Method Article
Hepatectomia anatômica laparoscópica usando abordagem de Takasaki e navegação de fluorescência verde de indocianina
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para hepatectomia anatômica laparoscópica usando a abordagem de Takasaki e navegação de fluorescência verde de indocianina na ressecção S4/5/7/8.
Resumo
A ressecção anatômica laparoscópica do fígado é um tratamento padrão para o câncer de fígado. A ressecção segmentar de S4/5/7/8 é complexa e carece de procedimentos padronizados, levando a complicações comuns. Técnicas inovadoras são essenciais para aumentar a segurança e os resultados. Um homem de 45 anos com história de hepatite B, função hepática Classe A de Child-Pugh, escore de status de desempenho (PS) 0 e nível de alfafetoproteína (AFP) de 198,3 ng/mL foi diagnosticado com uma massa de 4 cm × 5 cm × 5 cm em S4/7/8, indicando carcinoma hepatocelular primário (CHC), intimamente associado às veias hepáticas média e direita (BCLC A). A taxa de retenção de 15 minutos de indocianina verde (ICG) foi de 7,8%. O volume hepático padrão (SLV) foi de 1073 mL e o volume hepático real foi de 1345 mL. Realizamos ressecção laparoscópica dos segmentos S4/5/8 e S7 parcial, ressecando a veia hepática média (MHV) e preservando a veia hepática direita (RHV), pois a MHV estava muito fechada com o tumor. O futuro remanescente hepático (FLR) foi de 590 mL, com uma relação FLR/SLV de 55%. O procedimento cirúrgico utilizou a abordagem de Takasaki para bloquear o pedículo hepático anterior direito e coloração de fluorescência para identificar a linha de transecção. A operação durou 205 min com perda sanguínea estimada em 150 mL. O paciente não apresentou complicações pós-operatórias e recebeu alta hospitalar no sexto dia. A histopatologia confirmou carcinoma hepatocelular com margens de ressecção claras. A abordagem de Takasaki, combinada com a navegação de fluorescência ICG, melhora significativamente a hepatectomia anatômica laparoscópica. Essa técnica melhora a visualização, reduz as complicações e oferece um novo padrão para ressecções hepáticas complexas.
Introdução
A hepatectomia anatômica laparoscópica transformou o manejo de doenças hepáticas, fornecendo uma alternativa minimamente invasiva às técnicas cirúrgicas abertas tradicionais. A evolução contínua da cirurgia hepatobiliar enfatiza a necessidade de reduzir a morbidade pós-operatória, garantindo resultados oncológicos e funcionais adequados. Dentre as várias técnicas cirúrgicas, a abordagem de Takasaki se destaca como uma estratégia promissora para a ressecção anatômica do fígado. Ao contrário dos métodos convencionais, que podem ignorar estruturas vasculares críticas, a técnica de Takasaki se concentra em uma compreensão detalhada da anatomia hepática, essencial para preservar o parênquima hepático e otimizar o campo cirúrgico durante as ressecções segmentares1.
A anatomia complexa do fígado, caracterizada por um sistema vascular e biliar densamente ramificado, apresenta desafios significativos durante os procedimentos cirúrgicos. A ressecção dos segmentos 4, 5, 7 e 8 - áreas críticas para a manutenção da função hepática e associadas a maiores riscos de complicações - requer planejamento cuidadoso e precisão. A abordagem de Takasaki permite que os cirurgiões avaliem e preservem sistematicamente o suprimento vascular e a drenagem dos segmentos hepáticos adjacentes, minimizando assim o risco de isquemia e insuficiência hepática pós-operatória2.
Além disso, a incorporação da tecnologia de navegação por fluorescência verde de indocianina (ICG) aprimora esse paradigma cirúrgico. O ICG, administrado por via intravenosa, liga-se às proteínas plasmáticas, permitindo a visualização do fluxo sanguíneo hepático e das estruturas do ducto biliar por meio de imagens no infravermelho próximo3. Esse feedback em tempo real fornece aos cirurgiões uma visão dinâmica da perfusão hepática e ajuda a identificar marcos anatômicos críticos. Em particular, a navegação de fluorescência ICG é inestimável durante ressecções complexas, delineando efetivamente as margens do tumor e refinando a avaliação da anatomia vascular4.
Neste estudo, focamos na implementação da hepatectomia anatômica laparoscópica com abordagem de Takasaki, aprimorada pela navegação de fluorescência ICG, para a ressecção dos segmentos hepáticos S4, S5, S7 e S8. Apresentamos um caso que ilustra nossas técnicas cirúrgicas, destaca os benefícios da orientação por fluorescência e avalia os resultados dos pacientes. Por meio deste relato, pretendemos demonstrar a viabilidade e eficácia dessa abordagem cirúrgica integrada, contribuindo para o avanço de estratégias minimamente invasivas na cirurgia hepatobiliar 5,6,7. Os achados deste estudo ressaltam a importância do planejamento pré-operatório meticuloso, integração avançada de imagens e refinamento contínuo das técnicas cirúrgicas para aumentar a segurança do paciente e melhorar a recuperação pós-operatória8.
Protocolo
Este estudo foi aprovado pelo Comitê de Ética do Terceiro Hospital Afiliado da Universidade Sun Yat-Sen, que dispensou a exigência de consentimento informado devido ao desenho retrospectivo anônimo deste estudo.
1. Seleção de pacientes
- Confirme a indicação para cirurgia.
NOTA: Um homem de 45 anos que tem uma longa história de hepatite B e função hepática Child-Pugh Classe A, pontuação PS 0, nível AFP 198,3 ng/mL. A ressonância magnética e o CEUS mostraram um tumor de 4 cm 5 cm e 5 cm em S4/7/8, indicando CHC primário, intimamente associado ao MHV e RHV (o estágio do tumor é BCLC A). A taxa de retenção de 15 minutos do ICG é de 7,8%. O SLV foi de 1073 mL e o volume hepático real foi de 1345 mL. De acordo com as diretrizes da National Comprehensive Cancer Network (NCCN), optou-se por realizar ressecção laparoscópica dos segmentos hepáticos S4/5/8 e S7 parcial por ressecção do MHV, preservando o RHV. O remanescente hepático futuro (FLR) foi de 590 mL e o FLR/SLV foi de 55%.
2. Consentimento esclarecido
- Discuta o procedimento, riscos, benefícios e alternativas com o paciente. Obtenha consentimento informado.
3. Investigação pré-operatória
- Realize exames laboratoriais de rotina, incluindo hemograma completo, testes de função hepática e perfis de coagulação.
- Realize estudos de imagem para localizar tumores e avaliar a anatomia do fígado.
4. Configuração operacional
- Administre anestesia geral seguindo os protocolos padrão.
- Posicione o paciente em decúbito dorsal com o paciente ligeiramente girado para a esquerda.
- Coloque os trocartes.
- Estabeleça o pneumoperitônio usando uma agulha de Veress ou técnica aberta.
- Coloque 5 trocartes: Coloque um trocarte de câmera de 10 mm no umbigo. Coloque os trocartes de trabalho de 5 mm ou 10 mm nos quadrantes superiores esquerdo e direito e, possivelmente, na região epigástrica para a hepatotomia.
5. Técnica cirúrgica
- Exploração laparoscópica: Comece com uma exploração abdominal completa para avaliar qualquer doença metastática ou complicações abdominais.
- Colecistectomia: Exponha o triângulo de Calot, disseque o ducto cístico e a artéria cística e, em seguida, ligue duas vezes suas extremidades proximais. Tranecte os vasos e o ducto, disseque a vesícula biliar do leito hepático e obtenha hemostasia na superfície do leito hepático com eletrocautério.
- Dissecar o ligamento.
- Use um bisturi de ultrassom para dissecar o ligamento redondo do fígado, o ligamento falciforme e o ligamento coronário direito parcial.
- Exponha o segundo portal hepático e a raiz das veias hepáticas (RHV, MHV e veia hepática esquerda [PCI])
- Identifique a raiz do MHV e marque a linha de transecção hepática esquerda usando o gancho de eletrocoagulação (1 cm ao longo do ligamento falciforme).
- Preempt um cateter 12# como a primeira banda de bloqueio do portal hepático para o procedimento de pringle.
- Realize a ultrassonografia intraoperatória (IOUS).
- Examine todo o fígado para excluir quaisquer lesões não detectadas no pré-operatório. Selecione uma sonda laparoscópica de alta frequência (7.5-10 MHz), pré-aqueça o console de ultrassom e ajuste o ganho para 50-65 dB.
- Examine a localização, o tamanho e a borda do tumor, especialmente a relação com RHV e MHV.
- Escaneie o pedículo de glissão direito/esquerdo e a localização RHV/MHV.
- Usando uma varredura IOUS, marque a margem do tumor usando um gancho de eletrocoagulação, garantindo a margem de ressecção >1 cm.
- Realizar ressecção anatômica (abordagem de Takasaki)
- Execute a manobra de Pringle para ocluir o influxo do hilo hepático e, em seguida, disseque o pedículo hepático anterior direito por meio de uma abordagem extraperitoneal.
- Divida alguns pequenos ramos de G5 e libere moderadamente o pedículo hepático anterior direito para facilitar a oclusão (use bulldog laparoscópico). Isso facilitará o corte do pedículo hepático anterior direito após a divisão do parênquima hepático subsequente.
- Solte a oclusão e observe a linha de isquemia hepática.
- Administre ICG por via intravenosa (3-5 mL, 0,025 mg / mL) após o fechamento do pedículo glissoniano anterior direito. Use a coloração de fluorescência para observar a extensão do segmento anterior direito.
- Marque a linha de ressecção esquerda ao longo do lado direito do ligamento falciforme, inclinada em direção ao pedículo hepático anterior direito na superfície visceral. Marque a linha de ressecção direita de acordo com a coloração de fluorescência.
- Realize a transecção do parênquima hepático.
- Utilize bisturis ultrassônicos e dispositivos harmônicos para iniciar a transecção do parênquima ao longo da linha demarcada.
- Mantenha a hemostasia usando eletrocautério bipolar conforme necessário.
- No lado esquerdo, divida vários ramos do G4 e V4 até a raiz do MHV.
- Divida o parênquima hepático direito e divida o pedículo hepático anterior direito e MHV.
- Disseque cuidadosamente o tumor em S7 adjacente ao RHV.
NOTA: Como o tumor estava intimamente associado ao MHV e RHV, o RHV foi preservado sobre o MHV porque o procedimento FLR foi de 590 mL e FLR/SLV foi de 55%.
- Complete a ressecção.
- Separe o fígado ressecado dos tecidos circundantes.
- Ressecção cuidadosamente os segmentos alvo, garantindo que todos os principais vasos estejam protegidos.
- Recuperação de amostra: Recupere segmentos hepáticos usando uma bolsa de recuperação endoscópica através da porta maior ou uma incisão adicional, se necessário.
6. Cuidados pós-operatórios
- Monitoramento: Monitore os sinais vitais, o balanço hídrico e a função hepática no período pós-operatório.
- Controle da dor: Administre analgesia apropriada (considere bloqueios regionais, se indicado).
- Mobilização precoce: Incentive a deambulação precoce para melhorar a recuperação.
- Acompanhamentos: Realize visitas de acompanhamento para avaliar a função hepática e a cicatrização e abordar quaisquer complicações pós-operatórias.
7. Documentação e controle de qualidade
- Mantenha um relatório operatório detalhado, incluindo o diagnóstico pré-operatório, descobertas, técnicas utilizadas, bem como desafios e soluções intraoperatórias.
- Revise os resultados e complicações de maneira estruturada para melhoria futura da qualidade.
Resultados
Os resultados representativos da aplicação da fluorescência verde de indocianina (ICG) na ressecção hepática laparoscópica demonstram seu impacto significativo nos resultados cirúrgicos, particularmente no aumento da visibilidade das estruturas vasculares e biliares durante os procedimentos.
Uma das vantagens mais notáveis do uso da navegação ICG durante a ressecção hepática é sua capacidade de delinear claramente as margens de ressecção não apenas na superfície glissoniana, mas também profundamente no parênquima hepático. Ao diferenciar o parênquima vascularizado do não vascularizado, os cirurgiões podem identificar com mais precisão as linhas isquêmicas, o que é crucial para garantir planos de dissecção claros e remoção eficaz do tecido, preservando as estruturas vitais. Por exemplo, a Figura 1 ilustra a abordagem de Takasaki para bloquear o pedículo hepático anterior direito, mostrando a identificação precisa da linha isquêmica pela equipe cirúrgica.
A Figura 2 destaca o segmento anterior direito após a administração intravenosa de ICG, fornecendo feedback intraoperatório crucial sobre a anatomia hepática. Essa visualização aprimorada contribui para a redução relatada na perda sanguínea estimada para 150 mL (Tabela 1), sugerindo que a orientação de fluorescência promove práticas de dissecção mais cautelosas, ajudando os cirurgiões a evitar danos à vasculatura circundante.
A duração total do procedimento de 205 min é razoável para cirurgias hepáticas complexas. O paciente recebeu alta hospitalar no sexto dia sem eventos adversos maiores, como hemorragia ou vazamento biliar, reforçando a segurança dessa técnica (Tabela 1). A Figura 3 e a Figura 4 demonstram ainda mais a anatomia pós-ressecção, confirmando o sucesso da ressecção de estruturas vasculares críticas, incluindo VCL, VH, VCI e RHV, minimizando assim o risco de complicações.

Figura 1: Abordagem de Takasaki. Abordagem de Takasaki para bloquear o pedículo hepático anterior direito (usando bulldog laparoscópico para bloquear o pedículo hepático anterior direito e mostrar a linha isquêmica) Clique aqui para ver uma versão maior desta figura.

Figura 2: Coloração de fluorescência para identificar o segmento anterior direito. Administre ICG por via intravenosa 3-5 mL a uma concentração de 0,025 mg / mL. Clique aqui para ver uma versão maior desta figura.
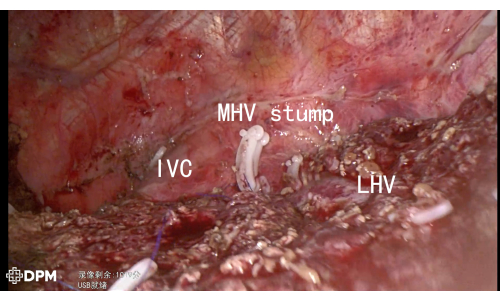
Figura 3: LHV/MHV/IVC demonstrada após ressecção hepática. Clique aqui para ver uma versão maior desta figura.
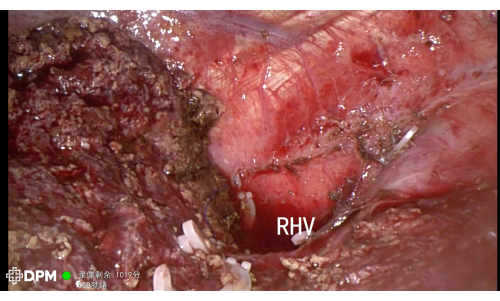
Figura 4: RHV demonstrado após ressecção hepática. Clique aqui para ver uma versão maior desta figura.
| Perda de sangue | 150 mL | |
| Duração | 205 minutos | |
| Internação hospitalar | 6 dias | |
| Drenagem | Dia 1 | 200 mL |
| Dia 4 | 50 mL | |
Tabela 1: Os detalhes da cirurgia
Discussão
A hepatectomia anatômica laparoscópica usando a abordagem de Takasaki e a navegação de fluorescência ICG envolve várias etapas críticas que são essenciais para garantir os melhores resultados. Um dos aspectos mais cruciais é a avaliação pré-operatória, que inclui estudos de imagem como ressonância magnética e ultrassom com contraste (CEUS) para localizar com precisão o tumor e avaliar a anatomia do fígado. Essa etapa é vital para o planejamento da abordagem cirúrgica, principalmente para ressecções segmentares complexas (S4/5/7/8)9.
Outro passo fundamental é a administração do ICG. A administração de ICG por via intravenosa (3-5 mL, 0.025 mg/mL) após o bloqueio do pedículo hepático anterior direito melhora a visualização do fluxo sanguíneo hepático durante a cirurgia. Essa orientação de fluorescência permite a avaliação em tempo real da perfusão hepática e auxilia na identificação de marcos anatômicos críticos10. Além disso, a abordagem de Takasaki enfatiza a dissecção sistemática e a preservação das estruturas vasculares, o que minimiza o risco de isquemia e insuficiência hepática pós-operatória11. A integração da ultrassonografia intraoperatória (USIO) para avaliação das margens tumorais e verificação da anatomia vascular também é crucial, pois permite a demarcação precisa das linhas de ressecção, garantindo margens claras e reduzindo complicações12.
Embora o protocolo seja projetado para ser abrangente, certas modificações podem aumentar sua eficácia. Por exemplo, o momento da administração de ICG pode ser ajustado com base na função hepática do paciente e na complexidade da ressecção. Nos casos em que a taxa de retenção de ICG é subótima, os cirurgiões podem considerar a administração de uma dose mais alta ou ajustar o momento da administração para melhorar a visualização13.
Além disso, estratégias de solução de problemas podem ser necessárias se a visualização de fluorescência for inadequada. Se a fluorescência não delinear claramente a anatomia hepática, os cirurgiões devem garantir que o ICG seja administrado corretamente e que o sistema de imagem esteja funcionando de maneira ideal. Ajustes intraoperatórios, como modificar as condições de iluminação ou ângulos de câmera, também podem melhorar a detecção de fluorescência. Além disso, se ocorrer sangramento inesperado, uma compreensão completa da anatomia vascular, conforme visualizada pelo ICG, permite a rápida identificação e manejo dos vasos sangrantes10.
Apesar de suas vantagens, o uso da navegação por fluorescência ICG na hepatectomia laparoscópica tem limitações. Uma preocupação significativa é a variabilidade nas taxas de retenção de ICG, que pode ser influenciada pela função hepática, integridade vascular e características do tumor14. Em pacientes com função hepática comprometida, como aqueles com cirrose, o sinal de fluorescência pode ser menos confiável, potencialmente levando à visualização inadequada de estruturas críticas.
Além disso, a dependência de imagens de fluorescência pode levar ao excesso de confiança na tomada de decisões intraoperatórias, principalmente se os cirurgiões negligenciarem os marcos anatômicos tradicionais e confiarem apenas na fluorescência para orientação12. Há também uma curva de aprendizado associada à técnica, pois os cirurgiões devem se tornar proficientes na interpretação de imagens de fluorescência e integrá-las ao seu fluxo de trabalho cirúrgico13.
A integração da navegação de fluorescência ICG na hepatectomia anatômica laparoscópica representa um avanço significativo em relação aos métodos tradicionais. As abordagens convencionais muitas vezes carecem do feedback em tempo real que a imagem de fluorescência fornece, o que pode levar a complicações aumentadas, como sangramento ou ressecções incompletas9. Ao melhorar a visualização, a fluorescência do ICG permite dissecções mais precisas e maior preservação do tecido saudável, o que é crucial para manter a função hepática no pós-operatório.
Além disso, a abordagem de Takasaki, combinada com o ICG, oferece um método sistemático para ressecções hepáticas segmentares que pode padronizar procedimentos e melhorar os resultados em várias equipes cirúrgicas11. Essa integração de tecnologia avançada de imagem não apenas aumenta a segurança cirúrgica, mas também se alinha com a tendência mais ampla de técnicas minimamente invasivas em cirurgia hepatobiliar, promovendo recuperação mais rápida e redução de internações hospitalares12.
Olhando para o futuro, a aplicação da navegação de fluorescência ICG na cirurgia hepática laparoscópica é promissora para novos avanços. Pesquisas futuras podem se concentrar na otimização dos protocolos de dosagem de ICG e no aprimoramento das tecnologias de imagem para melhorar a visualização em casos desafiadores, como aqueles envolvendo fígados cirróticos ou anatomia vascular complexa14.
Divulgações
Os autores declaram não ter conflito de interesses.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China (Grant No.82100692) e pelo Programa de Ciência e Tecnologia de Guangzhou (Grant No.202201011097).
Materiais
| Name | Company | Catalog Number | Comments |
| Indocyanine green for injection | Dandong Yichuang Pharmaceutical Co., Ltd. | H20055881 | |
| Harmonic devices | Affacare Medical (Beijing) Co., Ltd | AH-1200 | |
| Laparoscopic bulldog | B. Braun Aesculap Co.,Ltd | https://catalogs.bbraun.com/en-01/p/PRID00004560/bulldog-clips | |
| Surgical system | Deeper Network Technologies Co., Ltd | https://www.digipmc.com/Product/info/1071 | |
| Ultrasonic scalpels | Affacare Medical (Beijing) Co., Ltd | AH-600 | |
| Ultrasound | ALOKA Co., Ltd | ARIETTA 850 | |
| Veress needle | Hangzhou Kangji Medical Instrument Co.,Ltd. | https://www.kangjimed.com/laparoscopic-instruments-/surgical-needle-or-knife-/veress-needle-.html |
Referências
- Takasaki, K., Yokoyama, Y. Laparoscopic anatomical liver resection: Takasaki's approach and technique. Surg Endosc. 28 (8), 2205-2212 (2014).
- D'Hondt, M., Berrevoet, W. V. P. Indocyanine green fluorescenceguided liver surgery: a review of the literature with focus on liver resection. J Hepatobiliary Pancreat Sci. 26 (8), 317-327 (2019).
- D'Angelica, M. I., Allen, P. J. The evolution of laparoscopic liver resection: going from open surgery to minimally invasive techniques. Liver Cancer. 4 (3), 163-172 (2015).
- Dufour, M., Abou Ali, E. F., Kianmanesh, R. Laparoscopic anatomical liver resection: technical aspects and clinical outcomes. World J Gastroenterol. 27 (17), 2079-2092 (2021).
- Doku, M., Ferlay, N. M. C. F. Fluorescent imaging in liver surgery: is it the future of resection technique. Surg Oncol. 35, 120-126 (2020).
- Choi, S. H., Kim, J. H., Park, K. J. The role of indocyanine green (ICG) fluorescence in laparoscopic liver surgery. J Surg Res. 221, 64-70 (2017).
- Lang, H., Liu, H. Minimally invasive liver resection: current strategies and future directions. Hepat Surg. 12 (1), 1-8 (2018).
- Nguyen, K. T., Tsung, A., Zhang, J. Current approaches in laparoscopic liver resection: evidencebased strategies. J Gastrointest Surg. 20 (9), 1592-1601 (2016).
- Klein, A., Golling, M., Schmid, M. Laparoscopic liver surgery: current status and outlook. J Minim Invasive Surg. 22 (1), 19-25 (2019).
- Kumar, R., Wong, T., Cheong, C. Use of indocyanine green fluorescence for laparoscopic liver resections: a review of the literature. Surg Endosc. 34 (6), 2373-2383 (2020).
- Takasaki, K., Shimizu, H., Matsumoto, J. The Takasaki approach for anatomical liver resection: insights into its technique and benefits. Am J Surg. 215 (4), 796-801 (2018).
- Gonzalez, M., Morton, S., Keck, T. Advances in laparoscopic liver resection: contemporary techniques and emerging technologies. Eur J Surg Oncol. 47 (3), 541-549 (2021).
- Tzeng, C. W. D., Wang, M. L., Huang, J. Optimizing indocyanine green dosage for liver surgery: impacts and clinical applications. J Surg Res. 246, 181-189 (2020).
- Matsui, Y., Nomura, T., Takai, Y. The role of indocyanine green in liver surgery: current perspectives and future directions. World J Gastroenterol. 27 (8), 599-612 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados