Method Article
Multiparametrik Manyetik Rezonans Görüntüleme ve Transrektal Ultrason Kullanılarak Kognitif Füzyon Kılavuzluğunda Prostat Biyopsisi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Prostat biyopsisi, prostat kanseri için altın standart tanı yöntemidir. Transrektal ultrasonu önceden ölçülmüş MRG parametreleriyle birleştiren bilişsel füzyon kılavuzluğunda prostat biyopsisi, biyopsi doğruluğunu artırır ve klinik olarak anlamlı prostat kanserinin tespit oranını artırır.
Özet
Geleneksel transrektal ultrason (TRUS) kılavuzluğunda prostat biyopsisi, kesin lezyon hedeflemesinin olmaması nedeniyle özellikle erken evre prostat kanserini tespit etmek için sınırlı duyarlılığa ve özgüllüğe sahiptir. Prostat multiparametrik MR (mpMRI) görüntülerinin üç parametresini TRUS görüntülerine entegre ederek lezyon hedeflemesini geliştirmek için geliştirilmiş bir bilişsel füzyon kılavuzluğunda prostat biyopsi yöntemi geliştirilmiştir. Prostat mpMRG ölçümü başlangıçta üç temel parametre elde etmek için yapılır: dönme açısı (α), rektal duvara olan mesafe (X) ve prostat apeksinden uzaklık (Y). Bu parametreler daha sonra hedef lezyonları tespit etmek için gerçek zamanlı, TRUS kılavuzluğunda prostat iğne biyopsisinde bilişsel olarak uygulanır. Bu geliştirilmiş transperineal kognitif füzyon biyopsi yöntemi, tanısal doğruluğu artırır, tekrarlanabilirliği artırır ve operatör deneyimine olan bağımlılığı azaltır. 423 hastada klinik uygulamada prostat kanseri tespit oranı %73.5 olup, %62.9'u klinik olarak anlamlı kanser olarak sınıflandırılmıştır. MRG-ultrason füzyon biyopsisi gibi ekipman yoğun yöntemlerle karşılaştırıldığında, bu yaklaşım uygun maliyetli, pratiktir ve daha geniş klinik benimseme için çok uygundur. Ek olarak, yöntemin esnekliği, 68Ga-PSMA PET/CT gibi diğer görüntüleme teknikleriyle entegrasyonu destekleyerek yüksek riskli prostat kanseri olan hastalar için tespit oranlarını daha da iyileştirir.
Giriş
Prostat kanseri, 2022'de dünya çapında bildirilen tahmini 1.466.680 yeni vaka ve 396.792 ölümle önemli bir küresel sağlık sorunudur. Prostat kanseri, erkekler arasında en sık görülen ikinci kanser ve kanser ölümlerinin beşinci önde gelen nedenidir1. 2040 yılına kadar yeni prostat kanseri vakalarının sayısının 2,9 milyona yükseleceği ve ölümlerin 700.000'e ulaşacağı tahmin edilmektedir2. Prostat kanserli hastalarda erken tanı ve standardize tedavi sağkalım oranlarını iyileştirmek için çok önemlidir ve prostat biyopsisi erken tanı için altın standart olmaya devam etmektedir.
1968'den beri transrektal ultrason (TRUS) prostat biyopsilerini yönlendirmek için önemli bir araç olmuştur. Bununla birlikte, TRUS kılavuzluğunda prostat biyopsilerinin duyarlılığı ve özgüllüğü, özellikle erken evre veya küçük hacimli lezyonların saptanmasında sırasıyla %65-74 ve %40-573 ile sınırlıdır4. Bu sınırlamaların üstesinden gelmek için, multiparametrik MRG (mpMRG), prostat dokusunun daha ayrıntılı değerlendirilmesini ve klinik olarak anlamlı prostat kanserinin lokalizasyonunun iyileştirilmesini sağlayan üstün bir görüntüleme tekniği olarak ortaya çıkmıştır. Geleneksel TRUS kılavuzluğunda biyopsi ile karşılaştırıldığında, mpMRG prostat içindeki şüpheli lezyonları daha doğru bir şekilde tanımlayabilir ve hedeflenen biyopsilerin hassasiyetini artırabilir 5,6.
Prostat mpMRG'nin gelişmiş tanısal yeteneklerinden yararlanan çeşitli MRG kılavuzluğunda prostat biyopsi teknikleri geliştirilmiştir. Bu teknikler arasında MRG hedefli prostat biyopsisi, MRG-transrektal ultrason füzyon prostat biyopsisi ve bilişsel füzyon kılavuzluğunda prostat biyopsisiyer alır 7,8. MRG hedefli prostat biyopsisi, doğrudan MRI tarayıcısının içinde gerçekleştirilir ve biyopsi sırasında gerçek zamanlı görüntü rehberliğine olanak tanır. Bu teknik mükemmel lezyon lokalizasyonu sunar; ancak, uzun süreli görüntüleme ve prosedür gereksinimleri nedeniyle maliyetli ve zaman alıcıdır. MRG-transrektal ultrason füzyon prostat biyopsisi, MR görüntülerini ve gerçek zamanlı TRUS görüntülerini özel bir yazılım aracılığıyla birleştirerek karmaşık ve maliyetli hale getirir.
Buna karşılık, kognitif füzyon kılavuzluğunda prostat biyopsisi, klinisyenlerin MR görüntülerinden lezyon yerlerini ezberlemesini ve bu bilgileri biyopsi sırasında gerçek zamanlı TRUS ile zihinsel olarak bütünleştirmesini içerir. Bu teknik ek ekipman gerektirmez, bu da onu basit, uygun maliyetli ve klinik benimseme için son derece uygun hale getirir. Bununla birlikte, kognitif füzyon kılavuzluğunda prostat biyopsisi büyük ölçüde klinisyenin deneyimine bağlıdır ve lezyon lokalizasyonu süreci tamamen hafıza ve yargıya dayanır, bu da tekrarlanabilirliğin azalmasına neden olur ve daha geniş uygulamasını sınırlar. Bu zorlukların üstesinden gelmek için, prostat mpMR görüntülerinden elde edilen üç temel parametrenin TRUS ile entegre edilmesiyle geliştirilmiş bir transperineal kognitif füzyon biyopsi yöntemi geliştirilmiştir. Bu yöntem yüksek oranda tekrarlanabilir, gerçekleştirilmesi kolay ve yaygın klinik uygulama için çok uygundur ve prostat kanserinin doğru teşhisi için önemli destek sunar. Bu makale, bu standardize yaklaşımın protokolünü ve klinik faydasını detaylandırarak, rutin uygulamada prostat kanseri tespitini iyileştirme potansiyelini vurgulamaktadır.
Protokol
İnsan katılımcıları içeren bu çalışma, Helsinki Bildirgesi'nde belirtilen ilkelere uygun olarak yürütülmüştür. Çalışmaya dahil edilmeden önce tüm katılımcılardan yazılı bilgilendirilmiş onam alındı. Dahil etme ve çıkarma kriterleri, katılımcı güvenliğini ve prosedürün uygunluğunu sağlamak için dikkatlice tanımlanmıştır.
1. Hasta seçimi
- Hasta seçimi için aşağıdaki dahil etme kriterlerini ayarlayın: prostat spesifik antijen (PSA) > 10 ng/mL; PSA seviyesinden bağımsız olarak dijital rektal muayene (DRE) ile tespit edilen şüpheli bir prostat nodülünün varlığı; PSA seviyesinden bağımsız olarak transrektal ultrason (TRUS), MRI veya PSMA PET/BT ile tanımlanan şüpheli lezyonlar; 4 ile 10 ng/mL arasında PSA seviyeleri ve buna bağlı olarak f/tPSA < 0.16 ve/veya PSA yoğunluğu (PSAD) > 0.15 ng/mL2 ve/veya PSA hızı (PSAV) yıllık > 0.75 ng/ml; yüksek prostat sağlığı indeksi (PHI) veya pozitif idrar prostat kanseri antijen 3 (PCA3) sonuçları gibi prostatla ilgili diğer testlerden elde edilen anormal sonuçlar.
- Aşağıdaki kriterlere göre katılımcıları çalışmadan hariç tutun: çalışma süresi boyunca akut enfeksiyon veya ateş; hipertansif kriz; dekompanse kalp yetmezliği; şiddetli kanama bozuklukları; hipertansiyon veya diyabet gibi kötü kontrol edilen veya kararsız komorbiditeler; ileri iç/dış hemoroid veya önemli rektal/anal patoloji dahil olmak üzere ciddi anal veya rektal durumlar; şiddetli immünosüpresif durum; ciddi psikolojik bozukluklar veya prosedürle işbirliği yapmak istemeyen veya işbirliği yapamayan katılımcılar.
2. mpMRG'de lezyonun üç boyutlu koordinatlarının belirlenmesi
- Prostat lezyonlarını tanımlamak için multiparametrik MRG (mpMRI) taramalarının T2 ağırlıklı görüntüleme (T2WI, Şekil 1A), difüzyon ağırlıklı görüntüleme (DAG, Şekil 1B) ve görünür difüzyon katsayısı (ADC, Şekil 1C) haritalarını kapsamlı bir şekilde gözden geçirin.
NOT: Biyopsiden önce lezyonun yerini doğrulamak için bir radyologla konsültasyon gerekebilir. - Tepe noktası olarak anterior rektal duvardan yaklaşık 7 mm uzakta bir nokta kullanın. Vücudun orta hattından, kasık simfizi veya soğanlı üretra tarafından belirlenebilen bir çizgi çizin. Lezyonun ortasından başka bir çizgi çizin. Bu iki çizgi arasındaki açı, α olarak kaydedilen açısal yer değiştirmedir (Şekil 2A).
NOT: Bu açı α, biyopsi sırasında ultrason probunun lezyon ile hizalanacak şekilde ne kadar döndürüldüğünü belirlemek için kullanılır. - Lezyonun merkezinden rektal serozal yüzeye olan mesafeyi T2WI sekansında ölçün ve X olarak kaydedin (Şekil 2A).
NOT: X mesafesi, biyopsi sırasında iğne giriş noktasını yönlendirmek ve biyopsi iğnesinin rektuma göre yerleştirildiği yeri belirlemek için kullanılır. - Prostatın Tepesine Olan Mesafenin Ölçülmesi (Y) MPR (multiplanar rekonstrüksiyon) veya başka bir dilim fonksiyonu ile bir DICOM görüntüleyici aracılığıyla hem α açısının tepe noktasının merkezinden hem de lezyonun merkezinden geçen bir düzlem oluşturun. Bu düzlemde lezyondan prostatın tepesine kadar olan mesafeyi ölçün ve Y olarak kaydedin (Şekil 2B).
NOT: Y mesafesi, iğne penetrasyon derinliğini belirlemek için kritik öneme sahiptir; Biyopsi sırasında biyopsi iğnesinin ulaşması gereken derinliğe karşılık gelir.
3. Hasta hazırlığı ve görüntüleme
- Hastayı litotomi pozisyonuna getirin. Kalçaları muayene masasının tam orta kenarına yerleştirin. Bacak dayanaklarında her iki bacak simetrik olarak desteklenir.
- Skrotumu yukarı doğru çekin ve perineal bölgeyi tamamen ortaya çıkarın.
- Perineal bölgeyi povidon-iyot (iyodofor) ile dezenfekte edin ve alanı örtün, prosedür bölgesini erişilebilir bırakın.
- Prostatın perineal cilt üzerindeki en büyük enine düzleminin projeksiyonunda lokal anestezi için deri altından% 1 lidokain enjekte edin.
- Çift düzlemli transrektal ultrason (TRUS) probunu yavaşça rektuma yerleştirin. Probu anüse göre 45° yukarı açıyla konumlandırın.
NOT: Anestezi giriş noktası tipik olarak anüsten 1,5 cm uzaklıktadır (Şekil 3). - Biyopsi sırasında yeterli anesteziyi sağlamak için sagital düzlemde ultrason rehberliğinde levator ani kasına, prostat kapsülüne ve prostatın tepesine %1 lidokain enjekte edin.
4. TRUS ve bilişsel füzyon
- Transvers ultrason görüntüsünde, mpMRI'daki T2WI transvers görüntüsünden lezyonun konumuna yakından uyan bir düzlem yerleştirerek ultrason probunu orta hat ile hizalayın. Tanımlandıktan sonra, probu sabit tutun ve ultrason görüntüsünü bu kesit seviyesinde dondurun.
NOT: Ultrason probunun sagital düzleminin vücudun orta hattı ile aynı hizada olduğundan emin olun. Standart litotomi pozisyonunda, probun sagital düzlemi tipik olarak doğrudan baş üstü konumlandırılır. - Görüntüyü dondurun ve ultrasonda α açısını ölçmek için probun merkezini tepe noktası olarak kullanın. α açısının bir kenarını enine ultrason görüntüsündeki merkezi kılavuz çizgisiyle hizalayın (Şekil 4A).
NOT: Lezyonun ultrason görüntüsündeki konumuna karşılık gelen α açısının diğer kenarının konumu. - Görüntüyü çözün ve enine ultrason görüntüsünün merkezi kılavuz çizgisi MRG'de tanımlanan lezyonun konumu ile aynı hizaya gelene kadar probu döndürün. α açısına dönüş elde edildiğinde, probu daha fazla döndürmeden sabit tutun.
- Probu doğru α açısına döndürdükten sonra, doğrusal dizi ultrason probu prostat görüntüsünü gösterene kadar probu rektum boyunca yatay olarak ilerleterek ultrason probunu lezyon düzlemine yerleştirin.
NOT: Görüntülenen mevcut görüntü, önceki MRG ölçümleri tarafından belirlenen lezyonun düzlemine karşılık gelir (Şekil 4B). - Rektal serozal yüzeyden MRG'de daha önce ölçülen X değerine karşılık gelen konuma olan mesafeyi ölçün ve biyopsi iğnesinin yerleştirme noktasını onaylayın.
- Prostatın tepesinden MRG'de daha önce ölçülen Y değerine karşılık gelen konuma olan mesafeyi rektuma paralel yönde ölçün ve biyopsi iğnesi yerleştirilmesi için doğru derinliği sağlayın (Şekil 4B).
NOT: Bu X ve Y ölçümleri, probun ultrason görüntüsündeki lezyon ile doğru şekilde hizalandığını doğrular ve biyopsi sırasında hassas hedeflemeye izin verir.
5. Hedefe yönelik biyopsi
- Biyopsi iğnesini, doğrusal dizi probunu kullanarak sagital düzlem ultrason rehberliğinde rektumdan olan mesafeye (ultrason görüntüsünde X olarak ölçülür) karşılık gelen iğne kılavuz çizgisi boyunca yerleştirin.
- İğne derinliğini, prostatın tepesinden olan mesafeyi temsil eden önceden ölçülen Y değerine göre ayarlayın. Doğru derinliğe ulaşıldığında lezyon bölgesinde 2-3 hedefli biyopsi çekirdeği gerçekleştirin (Şekil 4B).
- Birden fazla lezyon tanımlanırsa, her hedef lezyon için yukarıdaki adımları tekrarlayın.
NOT: Ultrason probunun stabilitesini korumak çok önemlidir ve işlem boyunca her biyopsi bölgesi için X ve Y koordinatları doğru bir şekilde uygulanmalıdır. Hassasiyeti sağlamak ve el hareketini azaltmak için, yardım için bir ultrason probu destek kolu kullanılması önerilir.
6. Sistematik biyopsi
- Prostatın sol lobunun hem periferik hem de merkezi bölgelerinde apeks, orta hat ve tabandan bir biyopsi çekirdeği alın.
- Prob konumunu ayarlayın ve her iki bölgedeki tepe, orta hat ve tabandan birer çekirdek alın; Ardından, işlemi prostatın sağ lobunda tekrarlayın.
NOT: Sistematik biyopsi sırasında toplam 12 çekirdek alınması tavsiye edilir.
7. Tamamlama
- Biyopsiden sonra herhangi bir rahatsızlığı önlemek için TRUS probunu rektumdan nazikçe çıkarın.
- Kalan jel veya kanı temizlemek için perineal ve rektal bölgeleri steril mendillerle temizleyin.
- Her biyopsi çekirdeğini uygun koruyucularla önceden etiketlenmiş kaplara yerleştirin. Her kabı hastanın bilgileri ve biyopsi bölgesi ile işaretleyin.
- Biyopsi çekirdekleri ile etiketli kapları histopatolojik analiz için Patoloji Laboratuvarına taşıyın.
Sonuçlar
Bu durumda, bilişsel füzyon kılavuzluğunda prostat biyopsisi, klinik olarak anlamlı bir prostat kanseri lezyonunu doğru bir şekilde tanımladı. Bu lezyon, prostatın sol apeksinde MRG ile maksimum çapı yaklaşık 6 mm ve PI-RADS skoru 4 olarak gösterildi ve klinik olarak anlamlı prostat kanseri olasılığının yüksek olduğunu düşündürdü.
Bu biyopsi lezyonunun patolojik tanısı prostat asiner adenokarsinomu olup, aşağıdaki detaylar verilmiştir (Şekil 5):
Gleason puanı: 4 + 4 = 8, %60 majör Gleason deseni 4 ve %40 minör Gleason paterni 3 ile
WHO/ISUP Sınıf Grubu: Kanser ilerlemesi için orta derecede bir risk olduğunu gösteren Sınıf Grup 4 olarak sınıflandırılmıştır
Tümör yükü: Tümör biyopsi çekirdeklerinin %30'unu işgal etti.
Perinöral invazyon: Negatif (sinir tutulumu olduğuna dair kanıt yok)
Vasküler invazyon: Negatif (kan damarlarına yayılma kanıtı yok)
Prostatın diğer sistematik biyopsi çekirdekleri benign olarak rapor edildi.
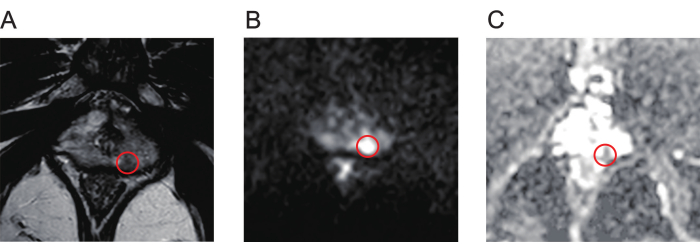
Şekil 1: Prostat kanseri lezyonlarının tipik mpMR görüntüleri. (A) Kırmızı daire, T2 ağırlıklı görüntüleme ile gösterildiği gibi düşük sinyal yoğunluğuna sahip lezyonu gösterir. (B) Kırmızı daire, difüzyon ağırlıklı görüntüleme ile gösterildiği gibi yüksek sinyal yoğunluğuna sahip lezyonu gösterir. (C) Kırmızı daire, görünür difüzyon katsayısı haritasında düşük sinyal yoğunluğunu gösteren lezyonu gösterir. Kısaltma: mpMR = multiparametrik manyetik rezonans. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
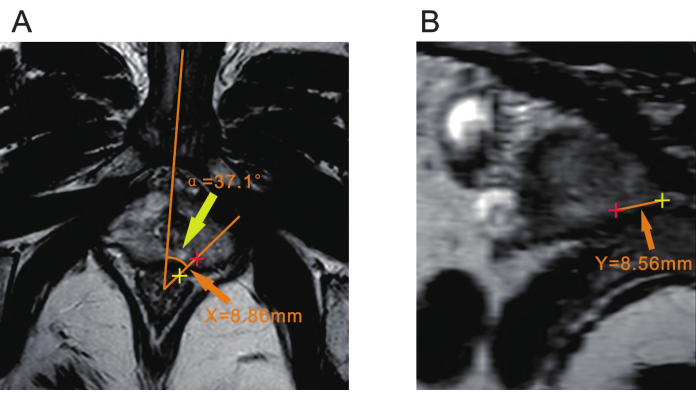
Şekil 2: Prostat mpMRG'nin üç parametresi. (A) Sarı ok ucu, lezyonun düzlemi ile vücudun orta hattı arasındaki açıyı (α) gösterir. Turuncu ok ucu, lezyonun merkezinden (kırmızı artı) rektal serozal yüzeye (sarı artı) olan mesafeyi (X) gösterir. (B) Turuncu ok ucu, lezyonun merkezinden (kırmızı artı) prostatın tepesine (sarı artı) olan mesafeyi (Y) gösterir. Kısaltma: mpMRI = multiparametrik manyetik rezonans görüntüleme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
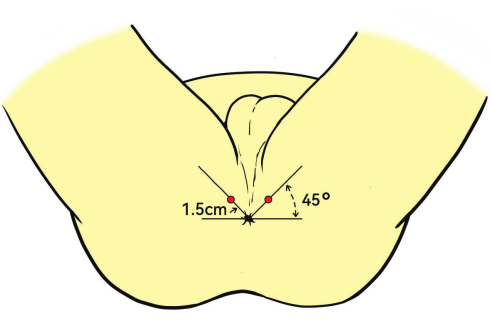
Şekil 3: Hasta pozisyonu ve anestezi bölgesi. Hastalar litotomi pozisyonuna getirilir. Derin infiltrasyon anestezisi için kırmızı noktalar olarak gösterilen enjeksiyon bölgesi anüsten 1,5 cm uzakta, 45° açılıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
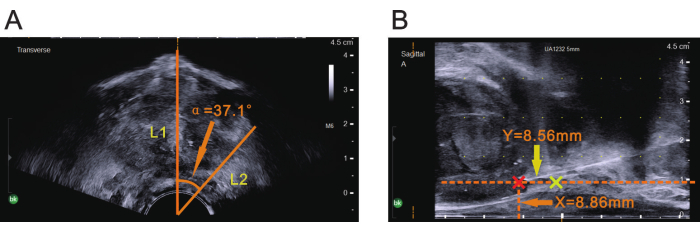
Şekil 4: Ultrasonda gösterilen üç prostat mpMRG parametresi. (A) Ultrason görüntüsü dondurulduğunda, probun merkezi tepe noktası olarak kullanıldı ve mpMRI'da gösterildiği gibi turuncu ok ucu ile gösterilen α açısını ölçmek için merkezi kılavuz çizgisi bir kenar (L1) olarak kullanıldı. Turuncu ok ucu ile gösterilen α açısı ölçüldükten sonra, açının diğer kenarı (L2) enine ultrason görüntüsünde belirlendi. (B) Turuncu ok ucu ile gösterilen mpMRG'deki X değeri, rektal serozal yüzey ile paralel bir çizgi çizmek için dikey mesafe olarak kullanıldı ve sarı ok ucu ile gösterilen mpMRG'deki Y değeri, prostatın tepesinden dikey bir çizgi çizmek için yatay mesafe olarak kullanıldı (sarı artı). Kesişme yerindeki kırmızı artı, lezyon alanını (biyopsi bölgesi) gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Prostattan biyopsi hedef lezyonunun patolojik boyanması. (A) Gleason skoru 4 + 4 = 8 (200x) olan prostat asiner adenokarsinomu gösteren HE boyama. Ölçek Çubuğu = 10 μm. (B) NKX3.1'in pozitif ekspresyonu için immünohistokimyasal boyama, prostat kanserinde zayıf diferansiyasyonu gösterir (200x). Ölçek Çubuğu=10 μm. Kısaltma: HE = Hematoksilen-eozin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
MRG kılavuzluğunda biyopsi (MRG-GB), hedefe yönelik prostat biyopsisinin temel taşıdır ve MRG hedefli biyopsi (MRI-TB), MRG-transrektal ultrason füzyon biyopsisi (FUS-TB) ve bilişsel füzyon biyopsisini (COG-TB) içerir. MRG-TB, %80'lik genel kanser tespit oranı ve %55'lik klinik olarak anlamlı kanser tespit oranı ile gerçek zamanlı MR görüntüleme yoluyla yüksek tanısal doğruluk sağlar9. Bununla birlikte, yüksek maliyeti ve operasyonel karmaşıklığı, yaygın kullanımını sınırlamaktadır. FUS-TB, özel yazılım kullanarak MRI hassasiyetini gerçek zamanlı ultrason rehberliği ile birleştirerek hassas lokalizasyon sunar; Ancak, ek ekipman ve karmaşık iş akışları gerektirir. Buna karşılık, COG-TB, yalnızca operatörün prosedür sırasında MR ve ultrason görüntülerini zihinsel olarak entegre etme yeteneğine dayanır ve özel ekipman ihtiyacını ortadan kaldırır. Bu yaklaşım uygun maliyetlidir, gerçekleştirilmesi kolaydır ve yaygın klinik uygulama için önemli bir potansiyele sahiptir.
Çalışmalar, klinik olarak anlamlı prostat kanserini (csPCa) tespit etmede COG-TB'nin tanısal doğruluğunun, MRG-TB ve FUS-TB gibi ileri MRG kılavuzluğunda biyopsi teknikleriyle karşılaştırılabilir olduğunu göstermiştir 7,10. Bu karşılaştırılabilir etkinlik, özellikle özel ekipmana sınırlı erişimi olan ortamlarda COG-TB'nin uygun bir alternatif olduğunun altını çizmektedir. Bununla birlikte, basitliğine rağmen, COG-TB operatörün deneyimine bağlı olmaya devam etmektedir. Geleneksel bilişsel füzyon yöntemleri, 8,11,12,13,14,15 lezyonlarını konumlandırmak için genellikle kistler, iyi huylu prostat hiperplazisi nodülleri veya kalsifikasyonlar gibi anatomik işaretlere dayanır. Bununla birlikte, araştırmalar, prostat kanseri lezyonlarının yaklaşık% 50'sinin TRUS'ta tipik hipoekoik özellikler göstermediğini ve bazı hastalarda belirgin anatomik belirteçlerin bulunmadığını göstermektedir16. Bu değişkenlik, operatörün uzamsal farkındalığa olan güveniyle birleştiğinde, COG-TB'nin tekrarlanabilirliğini ve ölçeklenebilirliğini sınırlar.
Bu geliştirilmiş transperineal kognitif füzyon biyopsi yönteminde, lezyon lokalizasyonu, mpMR görüntülerinin üç temel metriği kullanılarak parametrelendirilir: rotasyon açısı (α), rektal serozadan uzaklık (X) ve prostat apeksinden uzaklık (Y). MR görüntülerinden T2WI dizileri kullanılarak, α açısının tepe noktası dönme ekseni olarak tanımlanır ve lezyonun yerini belirlemek ve α, X ve Y değerlerini ölçmek için prostat düzlemlere ayrılır. Bu parametreler daha sonra kesin lezyon hedeflemesi için TRUS kılavuzluğunda uygulanır. Bu üç parametrenin uygulanması, TRUS probunun rektumda döndürülmesine benzer. T2WI kullanılarak prostat, lezyon düzleminin tanımlanmasına izin veren yelpaze şeklindeki sektörlere bölünür. Hem MRG hem de TRUS, α açısı için referans olarak vücudun orta hattını kullanır ve bu da iki görüntüleme yöntemi arasındaki herhangi bir konumsal tutarsızlığı düzeltir.
X ve Y parametreleri, iğne batırma yerini ve derinliğini belirlemek için çok önemlidir. T2WI düzleminde ölçülen X değeri, lezyon merkezinden rektal serozal yüzeye olan mesafeyi temsil eder. Lezyon merkezinden prostat tabanına olan mesafe ölçülmedi, çünkü ultrason ekranının kılavuzu biyopsi iğnesini etkili bir şekilde yönlendiriyor. Rektal serozal yüzey, X ve Y değerlerini belirlemek için kolay ve doğru bir referans sağlayan kılavuzdaki sıfır işaretine yakındır. Geleneksel bilişsel füzyondan farklı olarak, bu yaklaşım lezyonları prostatın iç anatomik işaretlerine göre konumlandırmaz. Çoğu durumda, bu ölçümleri gerçekleştirmek için ultrason görüntülerinin dondurulmasına gerek yoktur. Lezyonların mpMRI parametrelerine göre konumlandırılması, bu yöntemin yüksek tekrarlanabilirlik ve kısa öğrenme eğrisi ile geniş bir hasta yelpazesine uygulanabilmesini sağlar ve acemi operatörlerin yaklaşık 10 vaka üzerinde eğitim aldıktan sonra yüksek doğruluk elde etmelerini sağlar.
Yöntemin avantajlarına rağmen, MR ve ultrason görüntüleme modaliteleri arasındaki farklılıkların yanı sıra hasta konumlandırma ve doku kompresyonundaki farklılıklar hatalara neden olabilir. Temel optimizasyonlar şunları içerir:
X Değeri (Rektal Seroza Uzaklığı): X tipik olarak 2-3 mm'lik bir hata aralığı ile ölçülür. İnce kesitli MR görüntüleri çözünürlüğü ve kontrastı artırabilirken, radyologlar tarafından yapılan çoklu ölçümler doğruluğu artırabilir.
Y Değeri (Prostat Tepesinden Uzaklık): Y, sınırlı çözünürlüğe sahip olabilen yeniden yapılandırılmış T2WI düzlemlerine dayanır. Bununla birlikte, bir biyopsi iğnesi örneği 2 cm uzunluğunda olduğundan, lezyonun konumuna yaklaşmak genellikle yeterlidir. İnce dilimli tarama ve net sınır işaretleme, ölçüm hatalarını azaltabilir.
α Açısı (Dönme Açısı): MRG ve TRUS arasında tutarlı hasta konumlandırmasının sağlanması, vücut orta hattının referans olarak kullanılması ve ultrason probunun stabilize edilmesi, açıya bağlı sapmaları en aza indirebilir.
Bu geliştirilmiş yöntem yakın zamanda yaş ortalaması 70.8 yıl ve medyan PSA değeri 59.2 ng/mL olan 423 hastadan oluşan bir kohortta uygulanmıştır. 311 hastada (%73.5) prostat kanseri saptandı ve bunların %62.9'unda klinik olarak anlamlı kanser saptandı. Bu sonuçlar, bu yaklaşımın güvenilirliğini ve etkinliğini doğrulamaktadır. MRG-ultrason füzyonunu takiben prostat biyopsisi transrektal veya transperineal yaklaşım kullanılarak yapılabilir. Pepe ve ark. 8.500 transperineal prostat biyopsisi vakasından elde edilen klinik verileri analiz ederek prostat kanseri tespit oranı %37,1 ve komplikasyon oranı %35,9 olarak bildirmiştir17. Bu bulgular, transperineal yaklaşımın yüksek güvenlik profilini vurgulamaktadır. Ek olarak, transperineal yöntem, transrektal yaklaşıma göre daha yüksek bir kanser tespit oranı ve önemli ölçüde daha düşük enfeksiyon riski sunar. Bu avantajlara dayanarak, Avrupa Üroloji Derneği (EAU) kılavuzları prostat biyopsisi için tercih edilen yaklaşım olarak transperineal yolu önermektedir18.
Bu yöntem, yüksek riskli prostat kanserinin tespitini geliştirmek için 68Ga-PSMA PET/BT gibi diğer görüntüleme modaliteleri ile etkili bir şekilde entegre edilebilir. Çalışmalar, 8, 68Ga-PSMA PET/BT'nin standart alım değeri (SUVmax) kesme değeri ile ISUP derecesi ≥319 olan hastalarda klinik olarak anlamlı prostat kanseri (csPCa) için %100 tanısal doğruluk sağladığını göstermiştir. SUVmax ≥ 8 ile bölgelerin hedefe yönelik biyopsileri, csPCa'nın tespit oranını daha da artırabilir. Sonuç olarak, bu geliştirilmiş transperineal kognitif füzyon biyopsi yöntemi, geleneksel COG-TB'nin temel sınırlamalarını ele alır, gelişmiş tekrarlanabilirlik sunar, operatör bağımlılığını azaltır ve klinik uygulanabilirliğini genişletir.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Chongqing Sağlık Komisyonu ve Bilim ve Teknoloji Bürosu Ortak Projesi (2025MSXM046'dan JYD'ye) ve Çin Ulusal Doğa Bilimleri Vakfı (82470420'den JL'ye) ve Chongqing Üstün Tıbbi Akademik Lider Programı (JL'ye YXLJ202406).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5% Povidone-Iodine Solution | Chengdu Yong'an Pharmaceutical Co., Ltd. | H51022885 | For disinfection of the surgical area |
| 10% Neutral Buffered Formalin Fixative | Guangzhou Vigrass Biotechnology Co., Ltd. | 24010506 | For fixing biopsy tissue |
| AccuCARE Transperineal Solutions | CIVCO Medical Instruments Co., Inc | 620-119 | For supporting the probe |
| Injection syringe (20 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | For local anesthesia |
| Lidocaine | Hubei Tiansheng Pharmaceutical Co., Ltd. | H42021839 | Diluted with saline to 1% for local anesthesia |
| MRI 3.0T | Philips | Ingenia | For prostate examination |
| RadiAnt DICOM Viewer | Medixant | V2024.1 | For reading prostate MRI, outlining lesions, measuring distances, and angles |
| Single-use Biopsy Needle MC1820 | Bard Peripheral Vascular, Inc. | REHU3231 | For needle biopsy sampling |
| Single-use Sterile Needle 0.7 x 80 TWLB | Zhejiang Kangdeli Medical Devices Co., Ltd. | C20230923 | For local anesthesia |
| Sodium chloride injection | Southwest pharmaceutical Co., LTD | H50021610 | For diluting lidocaine |
| Ultrasound | BK Medical | bk3000-01 | For guiding prostate biopsy |
Referanslar
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- James, N. D., et al. The Lancet Commission on prostate cancer: planning for the surge in cases. Lancet. 403 (10437), 1683-1722 (2024).
- Jansen, H., Gallee, M. P., Schröder, F. H. Analysis of sonographic pattern in prostatic cancer: comparison of longitudinal and transversal transrectal ultrasound with subsequent radical prostatectomy specimens. Eur Urol. 18 (3), 174-178 (1990).
- Heijmink, S. W. T. P. J., et al. A comparison of the diagnostic performance of systematic versus ultrasound-guided biopsies of prostate cancer. Eur Radiol. 16 (4), 927-938 (2006).
- Verma, S., et al. The current state of MR imaging-targeted biopsy techniques for detection of prostate cancer. Radiology. 285 (2), 343-356 (2017).
- Moore, C. M., et al. Image-guided prostate biopsy using magnetic resonance imaging-derived targets: A systematic review. Eur Urol. 63 (1), 125-140 (2013).
- Wegelin, O., et al. The FUTURE trial: A multicenter randomised controlled trial on target biopsy techniques based on magnetic resonance imaging in the diagnosis of prostate cancer in patients with prior negative biopsies. Eur Urol. 75 (4), 582-590 (2019).
- Falagario, U. G., et al. Prostate cancer detection and complications of MRI-targeted prostate biopsy using cognitive registration, software-assisted image fusion or in-bore guidance: a systematic review and meta-analysis of comparative studies. Prostate Cancer Prostatic Dis. , (2024).
- Pokorny, M., et al. MRI-guided in-bore biopsy for prostate cancer: what does the evidence say? A case series of 554 patients and a review of the current literature. World J Urol. 37 (7), 1263-1279 (2019).
- Wegelin, O., et al. Comparing three different techniques for magnetic resonance imaging-targeted prostate biopsies: A systematic review of in-bore versus magnetic resonance imaging-transrectal ultrasound fusion versus cognitive registration. Is there a preferred technique. Eur Urol. 71 (4), 517-531 (2017).
- Puech, P., et al. Multiparametric MRI-targeted TRUS prostate biopsies using visual registration. BioMed Res Int. 2014, 819360 (2014).
- Ito, M., et al. Superior detection of significant prostate cancer by transperineal prostate biopsy using MRI-transrectal ultrasound fusion image guidance over cognitive registration. Int J Clin Oncol. 28 (11), 1545-1553 (2023).
- Oberlin, D. T., et al. Diagnostic value of guided biopsies: Fusion and cognitive-registration magnetic resonance imaging versus conventional ultrasound biopsy of the prostate. Urology. 92, 75-79 (2016).
- Khoo, C. C., et al. A comparison of prostate cancer detection between visual estimation (cognitive registration) and image fusion (software registration) targeted transperineal prostate biopsy. J Urol. 205 (4), 1075-1081 (2021).
- Fleville, S., et al. Diagnostic pathway outcomes for biparametric magnetic resonance imaging-targeted lesions using cognitive registration and freehand transperineal prostate biopsy in biopsy-naïve men (CRAFT single-center study). J Urol. 212 (6), 821-831 (2024).
- Won, S. Y., Cho, N. H., Choi, Y. D., Park, S. Y. Transrectal ultrasound-guided targeted biopsy of transition zone prostate cancer under cognitive registration with prebiopsy MRI and sonographic findings. Clin Radiol. 75 (2), 157.e21-157.e27 (2020).
- Pepe, P., Pennisi, M. Morbidity following transperineal prostate biopsy: Our experience in 8.500 men. Arch Ital Urol Androl. 94 (2), 155-159 (2022).
- Cornford, P., et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG guidelines on prostate cancer-2024 update. Part I: Screening, diagnosis, and local treatment with curative intent. Eur Urol. 86 (2), 148-163 (2024).
- Pepe, P., et al. 68Ga-PSMA PET/CT and prostate cancer diagnosis: Which SUVmax value. In Vivo. 37 (3), 1318-1322 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır