Method Article
マルチパラメトリック磁気共鳴画像法と経直腸超音波を使用した認知融合ガイド下前立腺生検
要約
前立腺生検は、前立腺がんのゴールドスタンダードの診断方法です。経直腸超音波と事前に測定されたMRIパラメータを組み合わせた認知融合ガイド下前立腺生検は、生検の精度を向上させ、臨床的に重要な前立腺がんの検出率を高めます。
要約
従来の経直腸超音波(TRUS)ガイド下前立腺生検は、正確な病変ターゲティングがないため、特に早期前立腺がんの検出において、感度と特異性が限られています。改良された認知融合ガイド下前立腺生検法は、前立腺マルチパラメトリックMR(mpMRI)画像の3つのパラメーターをTRUS画像に統合することにより、病変のターゲティングを強化するために開発されました。前立腺mpMRI測定は、最初に3つの主要なパラメータを取得するために実行されます:回転角度(α)、直腸壁からの距離(X)、および前立腺の頂点からの距離(Y)。次に、これらのパラメーターをリアルタイムの TRUS ガイド下前立腺針生検に認知的に適用して、標的病変を検出します。この改良された経会陰認知融合生検法は、診断精度を向上させ、再現性を向上させ、オペレーターの経験への依存を減らします。423人の患者に臨床適用された前立腺がんの検出率は73.5%であり、62.9%が臨床的に重要ながんに分類されました。MRI-超音波融合生検などの機器集約型の方法と比較して、このアプローチは費用対効果が高く、実用的であり、より広範な臨床採用に適しています。さらに、この手法の柔軟性は、 68Ga-PSMA PET/CT などの他のイメージング技術との統合をサポートし、高リスクの前立腺がん患者の検出率をさらに向上させます。
概要
前立腺がんは世界的な健康上の大きな懸念事項であり、2022年には世界中で推定1,466,680人の新規症例と396,792人の死亡が報告されています。前立腺がんは、男性の間で2番目に多いがんであり、がんによる死亡原因の第5位です1。2040年までに、新しい前立腺がんの症例数は290万人に増加し、死亡者数は70万人に達すると予測されています2。前立腺がん患者の生存率を向上させるためには、早期診断と標準化された治療が重要であり、前立腺生検は依然として早期診断のゴールドスタンダードです。
1968年以来、経直腸超音波(TRUS)は前立腺生検を導くための重要なツールでした。ただし、TRUSガイド下前立腺生検の感度と特異性は、特に初期段階または少量の病変を検出する場合、それぞれ65〜74%と40〜57%3に制限されています4。これらの制限を克服するために、マルチパラメトリックMRI(mpMRI)は優れたイメージング技術として浮上しており、前立腺組織のより詳細な評価と臨床的に重要な前立腺がんの局在化の改善を提供します。従来のTRUSガイド下生検と比較して、mpMRIは前立腺内の疑わしい病変をより正確に特定し、標的生検の精度を向上させることができる5,6。
前立腺mpMRIの強化された診断機能を活用して、いくつかのMRIガイド下前立腺生検技術が開発されています。これらの技術には、MRI標的前立腺生検、MRI経直腸超音波融合前立腺生検、および認知融合ガイド下前立腺生検7,8が含まれます。MRIを標的とした前立腺生検は、MRIスキャナー内で直接行われるため、生検中の画像ガイダンスをリアルタイムで行うことができます。この技術は、優れた病変の局在化を提供します。ただし、イメージングと手順の要件が長引くため、コストと時間がかかります。MRI-経直腸超音波融合前立腺生検は、MR画像とリアルタイムのTRUS画像を専用ソフトウェアで組み合わせるため、複雑でコストがかかります。
対照的に、認知融合ガイド下前立腺生検では、臨床医がMR画像から病変の位置を記憶し、生検中にこの情報をリアルタイムのTRASと精神的に統合します。この技術は追加の機器を必要としないため、シンプルで費用対効果が高く、臨床採用に非常に適しています。ただし、認知融合ガイド下前立腺生検は臨床医の経験に大きく依存しており、病変の局在化のプロセスは完全に記憶と判断に依存しているため、再現性が低下し、その広範な適用が制限されます。これらの課題に対処するために、前立腺 mpMR 画像からの 3 つの主要なパラメーターを TRUS と統合することにより、改良された経会陰認知融合生検法が開発されました。この方法は再現性が高く、実施が容易で、広範な臨床実装に適しており、前立腺がんの正確な診断を大きくサポートします。この論文では、この標準化されたアプローチのプロトコルと臨床的有用性を詳しく説明し、日常診療における前立腺がんの検出を改善する可能性を強調しています。
プロトコル
この研究は、ヘルシンキ宣言に概説されている原則に従って実施されました。書面によるインフォームドコンセントは、研究に含める前に、すべての参加者から得られました。包含基準と除外基準は、参加者の安全性と手順の適合性を確保するために慎重に定義されました。
1. 患者様の選択
- 患者選択のための次の選択基準を設定します: 前立腺特異抗原 (PSA) > 10 ng/mL;-PSAレベルに関係なく、直腸指診(DRE)によって検出された疑わしい前立腺結節の存在;-PSAレベルに関係なく、経直腸超音波(TRUS)、MRI、またはPSMA PET / CTによって特定された疑わしい病変。-f/tPSA<0.16、および/またはPSA密度(PSAD)>0.15 ng / mL2、および/またはPSA速度(PSAV)>年間0.75 ng / mlを伴う4〜10 ng / mLのPSAレベル。前立腺健康指数(PHI)の上昇や尿中前立腺がん抗原3(PCA3)の陽性結果など、他の前立腺関連検査からの異常な結果。
- 次の基準に基づいて、参加者を研究から除外します: 研究期間中の急性感染症または発熱;高血圧の危機;非代償性心不全;重度の出血性疾患;高血圧や糖尿病などの制御が不十分な、または不安定な併存疾患。-進行した内/外痔核または重大な直腸/肛門の病状を含む、重度の肛門または直腸の状態;重度の免疫抑制状態;-重度の精神障害または参加者が手順に協力したくない、または協力できない。
2. mpMRIによる病変の3次元座標の決定
- マルチパラメトリックMRI(mpMRI)スキャンのT2強調イメージング(T2WI、 図1A)、拡散強調イメージング(DWI、 図1B)、および見かけの拡散係数(ADC、 図1C)マップを徹底的にレビューして、前立腺病変を特定します。
注:生検の前に病変の位置を確認するために、放射線科医との相談が必要になる場合があります。 - 直腸前壁から約7mmの点を頂点として使用します。体の正中線を通る1本の線を引きます。これは、恥骨結合または球状尿道によって決定できます。病変の中心を通る別の線を引きます。これら 2 本の線の間の角度は角変位であり、α として記録されます (図 2A)。
注:この角度αは、生検中に超音波プローブが病変に合わせて回転する量を決定するために使用されます。 - 病変の中心から直腸漿膜表面までの距離をT2WIシーケンスで測定し、Xとして記録します(図2A)。
注:距離Xは、生検中に針の挿入点をガイドし、直腸に対して生検針が挿入される位置を決定するために使用されます。 - 前立腺の頂点からの距離の測定(Y) α角の頂点の中心と病変の中心の両方を通過する平面を、MPR(マルチプレーナー再構成)または別のスライス機能を備えたDICOMビューアを介して作成します。この平面で病変から前立腺の頂点までの距離を測定し、Yとして記録します(図2B)。
注:距離Yは、針の貫通の深さを決定するために重要です。これは、生検中に生検針が到達する必要がある深さに対応します。
3. 患者様の準備とイメージング
- 患者を結石切開の位置に置きます。臀部を診察台の正確な中央端に配置します。両脚はレッグレストで対称的に支えられています。
- 陰嚢を上方に引っ込め、会陰部を完全に露出させます。
- 会陰領域をポビドンヨード(ヨードフォア)で消毒し、その領域をドレープして、手続き部位にアクセスできるようにします。.
- 会陰皮膚上の前立腺最大の横面の投影で、局所麻酔のために1%リドカインを皮下注射します。.
- 複葉機経直腸超音波(TRUS)プローブを直腸にそっと挿入します。プローブを肛門に対して45°上向きの角度に配置します。
注:麻酔挿入点は通常、肛門から1.5cmです(図3)。 - 1% リドカインを矢状面の超音波ガイドを介して、肛門挙筋、前立腺嚢、および前立腺の頂点に注入して、生検中に適切な麻酔を確保します。
4. TRUSと認知融合
- mpMRI の T2WI 横方向画像からの病変の位置と密接に一致する平面を横方向の超音波画像上に配置することにより、超音波プローブを正中線に合わせます。同定したら、プローブをしっかりと保持し、この断面レベルで超音波画像をフリーズします。
注意: 超音波プローブの矢状面が体の正中線と位置合わせされていることを確認してください。標準的なリソトミー位置では、プローブの矢状面は通常、真上に配置されます。 - 画像をフリーズし、プローブの中心を頂点として使用して、超音波のα角を測定します。α角の一方の端を横方向の超音波画像の中央のガイドラインに合わせます(図4A)。
注:α角のもう一方のエッジの位置で、超音波画像上の病変の位置に対応します。 - 画像のフリーズを解除し、横行超音波画像の中央ガイドラインがMRIで特定された病変の位置と一致するまでプローブを回転させます。α角への回転が達成されたら、それ以上の回転をせずにプローブを安定させます。
- プローブを正しいα角度に回転させた後、リニアアレイ超音波プローブが前立腺画像を表示するまで、プローブを直腸に沿って水平に前進させることにより、超音波プローブを病変面に配置します。
注:現在表示されている画像は、以前のMRI測定(図4B)によって決定された病変の平面に対応しています。 - 直腸漿膜表面からMRIで以前に測定されたX値に対応する位置までの距離を測定し、生検針の挿入点を確認します。
- 前立腺の頂点から、MRIで以前に測定されたY値に対応する位置までの直腸に平行な方向の距離を測定し、生検針の挿入に正しい深さを確保します(図4B)。
注:これらのXおよびY測定は、プローブが超音波画像上の病変と正しく位置合わせされていることを確認し、生検中の正確なターゲティングを可能にします。
5. ターゲットバイオプシー
- 直腸からの距離 (超音波画像で X として測定) に対応する針ガイドラインに沿って生検針を、リニア アレイ プローブを使用した矢状面超音波ガイドの下に挿入します。
- 前立腺の頂点からの距離を表す以前に測定されたY値に従って針の深さを調整します。正しい深さに達したら、病変領域で2〜3個の標的生検コアを実行します(図4B)。
- 複数の病変が特定された場合は、各標的病変について上記の手順を繰り返します。
注:超音波プローブの安定性を維持することは非常に重要であり、X座標とY座標は、手順全体を通じて各生検部位に正確に適用する必要があります。精度を確保し、手の動きを減らすために、超音波プローブサポートアームを補助として使用することをお勧めします。
6. システマティック・バイオプシー
- 前立腺の左葉の末梢ゾーンと中央ゾーンの両方の頂点、正中線、および基部から 1 つの生検コアを採取します。
- プローブの位置を調整し、両方のゾーンの頂点、正中線、およびベースからそれぞれ1つのコアを取ります。次に、前立腺の右葉でこのプロセスを繰り返します。
注:系統的生検中に合計12個のコアを収集することをお勧めします。
7. 完成
- 生検後の不快感を避けるために、TRUSプローブを直腸からそっと取り外します。
- 滅菌ワイプで会陰部と直腸部を清掃し、残留したゲルや血液を取り除きます。
- 各生検コアを、適切な防腐剤を含むラベル済みの容器に入れます。各容器に患者の情報と生検部位をマークします。
- 生検コアの入った標識容器を病理組織学的分析のために病理学研究室に輸送します。
結果
この場合、認知融合ガイド下前立腺生検により、臨床的に重要な前立腺がん病変が正確に特定されました。この病変は、前立腺の左端のMRIで示され、最大直径は約6 mm、PI-RADSスコアは4であり、臨床的に重要な前立腺がんの可能性が高いことが示唆されました。
この生検病変の病理学的診断は前立腺癌であり、以下の詳細が認められました(図5)。
グリーソンスコア:4 + 4 = 8、60%が主要なグリーソンパターン4、40%がマイナーなグリーソンパターン3
WHO/ISUPグレードグループ:グレードグループ4に分類され、がん進行のリスクが中等度であることを示しています
腫瘍量:腫瘍は生検コアの30%を占めていました。
神経周囲浸潤:陰性(神経関与の証拠なし)
血管浸潤:陰性(血管への転移の証拠なし)
前立腺の他の系統的生検コアは良性であると報告されました。
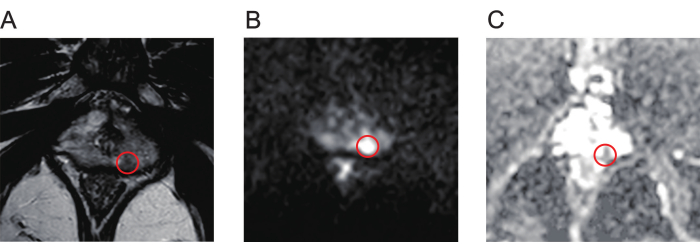
図1:前立腺がん病変の典型的なmpMR画像。(A) 赤丸は、T2強調画像で示されるように、信号強度が低い病変を示しています。 (B) 赤丸は、拡散強調画像で示されるように、 信号強度の高い病変を示しています。 (C) 赤丸は病変を示しており、見かけの拡散係数マップ上では信号強度が低いことを示しています。略語:mpMR =マルチパラメトリック磁気共鳴。 この図の拡大版を表示するには、ここをクリックしてください。
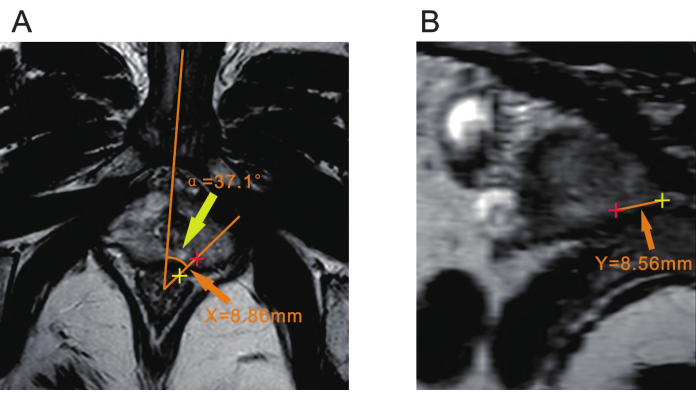
図2:前立腺mpMRIの3つのパラメータ。(A) 黄色の矢印は、病変の平面と体の正中線との間の角度(α)を示しています。オレンジ色の矢印は、病変の中心(赤色プラス)から直腸漿膜表面(黄色プラス)までの距離(X)を示しています。 (B) オレンジ色の矢印は、病変の中心(赤色のプラス)から前立腺の頂点(黄色のプラス)までの距離(Y)を示しています。略称:mpMRI =マルチパラメトリック磁気共鳴イメージング。 この図の拡大版を表示するには、ここをクリックしてください。
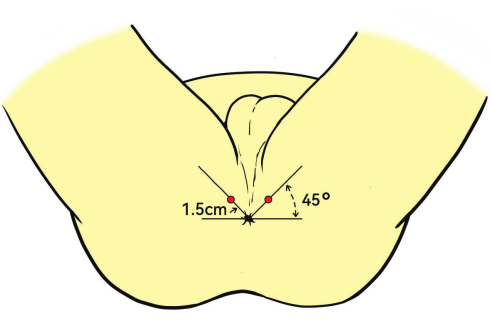
図3:患者の位置と麻酔部位。 患者は結石切開の位置に置かれます。深部浸潤麻酔の赤い点で示されている注射部位は、肛門から 1.5 cm で、角度は 45° です。 この図の拡大版を表示するには、ここをクリックしてください。
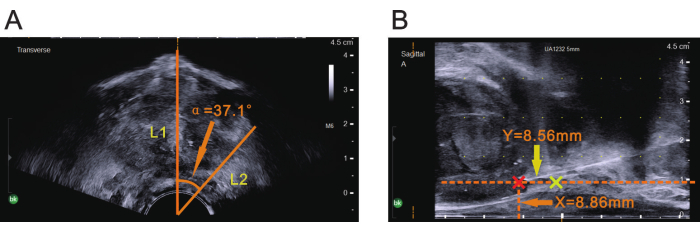
図4:超音波で示された前立腺mpMRIの3つのパラメータ。(A) 超音波画像を凍結した状態で、プローブの中心を頂点とし、中央のガイドラインを1つのエッジ(L1)として、mpMRIに示すようにオレンジ色の矢印で示すα角を測定しました。オレンジ色の矢印で示されたα角を測定すると、横方向の超音波画像上で角度のもう一方のエッジ(L2)が決定されました。 (B) オレンジ色の矢印で示したmpMRIのX値を直腸漿膜面と平行線を引くための垂直距離として、黄色の矢印で示したmpMRI上のY値を前立腺の頂点から垂直線を引くための水平距離(黄色のプラス)として使用した。交差部位の赤いプラスは、病変領域(生検部位)を示します。 この図の拡大版を表示するには、ここをクリックしてください。

図5:前立腺からの生検標的病変の病理学的染色。(A) 前立腺腺癌を示す HE 染色で、グリーソン スコアが 4 + 4 = 8 (200x)。スケール Bar=10 μm. (B) NKX3.1 の陽性発現に対する免疫組織化学染色は、前立腺がん (200x) の分化不良を示しています。スケールバー=10μm。略語:HE = ヘマトキシリン-エオシン。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
MRIガイド下生検(MRI-GB)は、標的前立腺生検の基礎であり、MRI標的生検(MRI-TB)、MRI-経直腸超音波融合生検(FUS-TB)、および認知融合生検(COG-TB)が含まれます。MRI-TBは、リアルタイムMRイメージングにより高い診断精度を達成し、全体のがん検出率は80%、臨床的に有意ながん検出率は55%9です。ただし、その高いコストと運用の複雑さにより、その広範な使用は制限されます。FUS-TBは、MRIの精度と専用ソフトウェアを使用したリアルタイムの超音波ガイダンスを組み合わせ、正確な位置特定を提供します。ただし、追加の機器と複雑なワークフローが必要です。対照的に、COG-TBは、手術中にMR画像と超音波画像を精神的に統合するオペレーターの能力のみに依存しているため、特殊な機器は必要ありません。このアプローチは、費用対効果が高く、実行が簡単で、広範な臨床応用に大きな可能性を秘めています。
研究によると、臨床的に重要な前立腺がん (csPCa) の検出における COG-TB の診断精度は、MRI-TB や FUS-TB 7,10 などの高度な MRI ガイド下生検技術に匹敵することが示されています。この同等の有効性は、COG-TBが、特に特殊な機器へのアクセスが限られている状況において、実行可能な代替手段であることを強調しています。しかし、そのシンプルさにもかかわらず、COG-TBは依然としてオペレーターの経験に依存しています。従来の認知融合法は、多くの場合、嚢胞、良性前立腺肥大症結節、石灰化などの解剖学的ランドマークに依存して、病変8、11、12、13、14、15を配置します。しかし、研究によると、前立腺がん病変の約50%はTRUSで典型的な低エコー特性を示さず、一部の患者には明確な解剖学的マーカーが欠けています16。このばらつきは、オペレーターの空間認識への依存と相まって、COG-TBの再現性とスケーラビリティを制限します。
この改良された経会陰認知融合生検法では、mpMR 画像の 3 つの主要な指標である回転角度 (α)、直腸漿膜からの距離 (X)、および前立腺頂点からの距離 (Y) を使用して、病変の局在化をパラメーター化します。MR画像からのT2WIシーケンスを使用して、α角の頂点を回転軸として定義し、前立腺を平面に分割して病変の位置を決定し、α、X、およびYの値を測定します。次に、これらのパラメーターは、正確な病変ターゲティングのために TRUS ガイダンスの下で適用されます。これら3つのパラメータの適用は、直腸内でTRUSプローブを回転させるのと似ています。T2WIを使用して、前立腺を扇形のセクターに分割し、病変の平面を識別できるようにします。MRIとTRUSはどちらも、身体の正中線をα角の基準として使用し、2つのイメージングモダリティ間の位置の不一致を補正します。
パラメータXとYは、針の挿入位置と深さを決定するために重要です。T2WI 平面で測定された X 値は、病変の中心から直腸の漿膜表面までの距離を表します。病変中心から前立腺基部までの距離は、超音波スクリーニングのガイドラインが生検針を効果的にガイドするため、測定されませんでした。直腸の漿膜表面はガイドラインのゼロマーカーに近く、X値とY値を決定するための簡単で正確な参照を提供します。従来の認知融合とは異なり、このアプローチは、前立腺の内部の解剖学的ランドマークに基づいて病変を配置しません。ほとんどの場合、これらの測定を実行するために超音波画像を凍結する必要はありません。mpMRIパラメータによる病変の位置決めにより、この手法は高い再現性と短い学習曲線で幅広い患者に適用でき、初心者のオペレーターは約10例のトレーニング後に高い精度を達成することができます。
この方法の利点にもかかわらず、MRと超音波イメージングモダリティの不一致、患者のポジショニングと組織の圧迫のばらつきにより、エラーが発生する可能性があります。主な最適化には、次のものが含まれます。
X値(直腸漿膜からの距離):Xは通常、2〜3mmの誤差範囲で測定されます。薄スライスMR画像は解像度とコントラストを向上させることができますが、放射線科医による複数の測定は精度を向上させることができます。
Y 値 (前立腺頂点からの距離): Y は再構築された T2WI 平面に依存しているため、解像度が限られている場合があります。ただし、生検針サンプルの長さは 2 cm であるため、多くの場合、病変の位置を概算するだけで十分です。薄スライススキャンと明確な境界マーキングにより、測定誤差を減らすことができます。
α角度(回転角度):MRIとTRUSの間で患者の一貫した位置を確保し、体の正中線を基準として使用し、超音波プローブを安定させることで、角度関連の偏差を最小限に抑えることができます。
この改良された方法は、最近、平均年齢が70.8歳、PSA値の中央値が59.2 ng/mLの423人の患者からなるコホートに適用されました。前立腺がんは311人の患者(73.5%)で検出され、そのうち62.9%が臨床的に重要ながんでした。これらの結果は、このアプローチの信頼性と有効性を実証しています。MRI-超音波融合後の前立腺生検は、経直腸的または経会陰的アプローチのいずれかを使用して行うことができます。Pepeらは、経会陰前立腺生検の8,500例の臨床データを分析し、前立腺がんの検出率が37.1%、合併症の発生率が35.9%であると報告しました17。これらの知見は、経会陰アプローチの高い安全性プロファイルを浮き彫りにしています。さらに、経会陰法は、経直腸的アプローチよりも癌の検出率が高く、感染のリスクが大幅に低くなります。これらの利点に基づいて、欧州泌尿器科学会 (EAU) のガイドラインでは、前立腺生検の好ましいアプローチとして経会陰ルートを推奨しています18.
この方法は、68Ga-PSMA PET/CTなどの他のイメージングモダリティと効果的に統合して、高リスクの前立腺がんの検出を強化することができます。研究によると、標準化取り込み値 (SUVmax) カットオフが 8, 68Ga-PSMA PET/CT は、ISUP グレード ≥319 の患者の臨床的に重要な前立腺がん (csPCa) に対して 100% の診断精度を達成することが示されています。SUVmax ≥ 8 を使用した領域の標的生検により、csPCa の検出率をさらに向上させることができます。結論として、この改良された経会陰認知融合生検法は、従来のCOG-TBの主要な制限に対処し、再現性を高め、オペレーターの依存を減らし、その臨床的適用性を広げます。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
本研究は、重慶市衛生委員会と科技局の共同プロジェクト(2025MSXM046からJY.D.)、中国国家自然科学基金会(82470420からJ.L.)、および重慶市の優れた医学学術リーダーのためのプログラム(YXLJ202406からJ.L.)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 5% Povidone-Iodine Solution | Chengdu Yong'an Pharmaceutical Co., Ltd. | H51022885 | For disinfection of the surgical area |
| 10% Neutral Buffered Formalin Fixative | Guangzhou Vigrass Biotechnology Co., Ltd. | 24010506 | For fixing biopsy tissue |
| AccuCARE Transperineal Solutions | CIVCO Medical Instruments Co., Inc | 620-119 | For supporting the probe |
| Injection syringe (20 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | For local anesthesia |
| Lidocaine | Hubei Tiansheng Pharmaceutical Co., Ltd. | H42021839 | Diluted with saline to 1% for local anesthesia |
| MRI 3.0T | Philips | Ingenia | For prostate examination |
| RadiAnt DICOM Viewer | Medixant | V2024.1 | For reading prostate MRI, outlining lesions, measuring distances, and angles |
| Single-use Biopsy Needle MC1820 | Bard Peripheral Vascular, Inc. | REHU3231 | For needle biopsy sampling |
| Single-use Sterile Needle 0.7 x 80 TWLB | Zhejiang Kangdeli Medical Devices Co., Ltd. | C20230923 | For local anesthesia |
| Sodium chloride injection | Southwest pharmaceutical Co., LTD | H50021610 | For diluting lidocaine |
| Ultrasound | BK Medical | bk3000-01 | For guiding prostate biopsy |
参考文献
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- James, N. D., et al. The Lancet Commission on prostate cancer: planning for the surge in cases. Lancet. 403 (10437), 1683-1722 (2024).
- Jansen, H., Gallee, M. P., Schröder, F. H. Analysis of sonographic pattern in prostatic cancer: comparison of longitudinal and transversal transrectal ultrasound with subsequent radical prostatectomy specimens. Eur Urol. 18 (3), 174-178 (1990).
- Heijmink, S. W. T. P. J., et al. A comparison of the diagnostic performance of systematic versus ultrasound-guided biopsies of prostate cancer. Eur Radiol. 16 (4), 927-938 (2006).
- Verma, S., et al. The current state of MR imaging-targeted biopsy techniques for detection of prostate cancer. Radiology. 285 (2), 343-356 (2017).
- Moore, C. M., et al. Image-guided prostate biopsy using magnetic resonance imaging-derived targets: A systematic review. Eur Urol. 63 (1), 125-140 (2013).
- Wegelin, O., et al. The FUTURE trial: A multicenter randomised controlled trial on target biopsy techniques based on magnetic resonance imaging in the diagnosis of prostate cancer in patients with prior negative biopsies. Eur Urol. 75 (4), 582-590 (2019).
- Falagario, U. G., et al. Prostate cancer detection and complications of MRI-targeted prostate biopsy using cognitive registration, software-assisted image fusion or in-bore guidance: a systematic review and meta-analysis of comparative studies. Prostate Cancer Prostatic Dis. , (2024).
- Pokorny, M., et al. MRI-guided in-bore biopsy for prostate cancer: what does the evidence say? A case series of 554 patients and a review of the current literature. World J Urol. 37 (7), 1263-1279 (2019).
- Wegelin, O., et al. Comparing three different techniques for magnetic resonance imaging-targeted prostate biopsies: A systematic review of in-bore versus magnetic resonance imaging-transrectal ultrasound fusion versus cognitive registration. Is there a preferred technique. Eur Urol. 71 (4), 517-531 (2017).
- Puech, P., et al. Multiparametric MRI-targeted TRUS prostate biopsies using visual registration. BioMed Res Int. 2014, 819360 (2014).
- Ito, M., et al. Superior detection of significant prostate cancer by transperineal prostate biopsy using MRI-transrectal ultrasound fusion image guidance over cognitive registration. Int J Clin Oncol. 28 (11), 1545-1553 (2023).
- Oberlin, D. T., et al. Diagnostic value of guided biopsies: Fusion and cognitive-registration magnetic resonance imaging versus conventional ultrasound biopsy of the prostate. Urology. 92, 75-79 (2016).
- Khoo, C. C., et al. A comparison of prostate cancer detection between visual estimation (cognitive registration) and image fusion (software registration) targeted transperineal prostate biopsy. J Urol. 205 (4), 1075-1081 (2021).
- Fleville, S., et al. Diagnostic pathway outcomes for biparametric magnetic resonance imaging-targeted lesions using cognitive registration and freehand transperineal prostate biopsy in biopsy-naïve men (CRAFT single-center study). J Urol. 212 (6), 821-831 (2024).
- Won, S. Y., Cho, N. H., Choi, Y. D., Park, S. Y. Transrectal ultrasound-guided targeted biopsy of transition zone prostate cancer under cognitive registration with prebiopsy MRI and sonographic findings. Clin Radiol. 75 (2), 157.e21-157.e27 (2020).
- Pepe, P., Pennisi, M. Morbidity following transperineal prostate biopsy: Our experience in 8.500 men. Arch Ital Urol Androl. 94 (2), 155-159 (2022).
- Cornford, P., et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG guidelines on prostate cancer-2024 update. Part I: Screening, diagnosis, and local treatment with curative intent. Eur Urol. 86 (2), 148-163 (2024).
- Pepe, P., et al. 68Ga-PSMA PET/CT and prostate cancer diagnosis: Which SUVmax value. In Vivo. 37 (3), 1318-1322 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved