Method Article
Eine kognitive Fusions-gesteuerte Prostatabiopsie mittels multiparametrischer Magnetresonanztomographie und transrektalem Ultraschall
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Prostatabiopsie ist die Goldstandard-Diagnosemethode für Prostatakrebs. Die kognitive fusionsgesteuerte Prostatabiopsie, bei der transrektaler Ultraschall mit vorab gemessenen MRT-Parametern kombiniert wird, verbessert die Genauigkeit der Biopsie und erhöht die Erkennungsrate von klinisch signifikantem Prostatakrebs.
Zusammenfassung
Die herkömmliche transrektale Ultraschall (TRUS)-gesteuerte Prostatabiopsie weist eine begrenzte Sensitivität und Spezifität auf, insbesondere bei der Erkennung von Prostatakrebs im Frühstadium, da es an einer präzisen Zielbestimmung der Läsionen mangelt. Eine verbesserte kognitive fusionsgesteuerte Prostatabiopsiemethode wurde entwickelt, um das Läsionstargeting zu verbessern, indem drei Parameter von multiparametrischen MRT-Bildern (mpMRT) der Prostata in TRUS-Bilder integriert werden. Die mpMRT-Messung der Prostata wird zunächst durchgeführt, um drei Schlüsselparameter zu erhalten: den Rotationswinkel (α), den Abstand zur Rektumwand (X) und den Abstand zur Prostataspitze (Y). Diese Parameter werden dann kognitiv in einer Echtzeit-TRUS-gesteuerten Prostatanadelbiopsie angewendet, um Zielläsionen zu erkennen. Diese verbesserte transperineale kognitive Fusionsbiopsiemethode erhöht die diagnostische Genauigkeit, verbessert die Reproduzierbarkeit und verringert die Abhängigkeit von der Erfahrung des Bedieners. Die klinische Anwendung bei 423 Patienten zeigte eine Prostatakrebs-Erkennungsrate von 73,5 %, wobei 62,9 % als klinisch signifikante Krebserkrankungen eingestuft wurden. Im Vergleich zu geräteintensiven Methoden wie der MRT-Ultraschall-Fusionsbiopsie ist dieser Ansatz kostengünstig, praktisch und eignet sich gut für eine breitere klinische Adoption. Darüber hinaus unterstützt die Flexibilität der Methode die Integration mit anderen bildgebenden Verfahren, wie z. B. 68Ga-PSMA PET/CT, wodurch die Erkennungsraten bei Patienten mit Prostatakrebs mit hohem Risiko weiter verbessert werden.
Einleitung
Prostatakrebs ist ein großes globales Gesundheitsproblem, mit schätzungsweise 1.466.680 neuen Fällen und 396.792 Todesfällen, die im Jahr 2022 weltweit gemeldet wurden. Prostatakrebs ist die zweithäufigste Krebserkrankung und die fünfthäufigste Krebstodesursache bei Männern1. Bis 2040 wird die Zahl der neuen Prostatakrebsfälle voraussichtlich auf 2,9 Millionen ansteigen, wobei die Zahl der Todesfälle voraussichtlich 700.000 erreichen wird2. Eine frühzeitige Diagnose und standardisierte Behandlung sind entscheidend für die Verbesserung der Überlebensraten bei Patienten mit Prostatakrebs, und die Prostatabiopsie bleibt der Goldstandard für die Früherkennung.
Seit 1968 ist der transrektale Ultraschall (TRUS) ein wichtiges Instrument zur Steuerung von Prostatabiopsien. Die Sensitivität und Spezifität von TRUS-gesteuerten Prostatabiopsien sind jedoch um 65-74 % bzw. 40-57 %3 begrenzt, insbesondere bei der Erkennung von Läsionen im Frühstadium oder bei kleinvolumigenLäsionen 4. Um diese Einschränkungen zu überwinden, hat sich die multiparametrische MRT (mpMRT) als überlegenes bildgebendes Verfahren herausgestellt, das detailliertere Untersuchungen des Prostatagewebes und eine verbesserte Lokalisierung von klinisch signifikantem Prostatakrebs ermöglicht. Im Vergleich zur herkömmlichen TRUS-gesteuerten Biopsie kann die mpMRT verdächtige Läsionen in der Prostata genauer identifizieren und die Präzision gezielter Biopsien verbessern 5,6.
Es wurden mehrere MRT-gesteuerte Prostatabiopsietechniken entwickelt, die die erweiterten diagnostischen Möglichkeiten der Prostata-mpMRT nutzen. Zu diesen Techniken gehören die MRT-gezielte Prostatabiopsie, die MRT-transrektale Ultraschall-Fusionsbiopsie der Prostata und die kognitive fusionsgesteuerte Prostatabiopsie 7,8. Die MRT-gezielte Prostatabiopsie wird direkt im MRT-Scanner durchgeführt und ermöglicht eine Echtzeit-Bildführung während der Biopsie. Diese Technik bietet eine hervorragende Lokalisierung von Läsionen; Es ist jedoch aufgrund der langwierigen Anforderungen an die Bildgebung und Verfahren kostspielig und zeitaufwändig. Die MRT-transrektale Ultraschall-Fusionsbiopsie der Prostata kombiniert MRT-Bilder und Echtzeit-TRUS-Bilder über eine spezielle Software, was sie komplex und kostspielig macht.
Im Gegensatz dazu müssen sich die Ärzte bei der kognitiven Fusionsbiopsie die Läsionsorte aus MRT-Bildern merken und diese Informationen während der Biopsie mental mit der Echtzeit-TRUS integrieren. Diese Technik erfordert keine zusätzliche Ausrüstung, was sie einfach, kostengünstig und sehr gut für die klinische Anwendung geeignet macht. Die kognitive fusionsgesteuerte Prostatabiopsie hängt jedoch stark von der Erfahrung des Arztes ab, und der Prozess der Läsionslokalisation beruht vollständig auf dem Gedächtnis und dem Urteilsvermögen, was zu einer verminderten Reproduzierbarkeit führt und ihre breitere Anwendung einschränkt. Um diesen Herausforderungen zu begegnen, wurde eine verbesserte transperineale kognitive Fusionsbiopsiemethode entwickelt, bei der drei Schlüsselparameter aus mpMRT-Bildern der Prostata mit TRUS integriert wurden. Diese Methode ist hochgradig reproduzierbar, einfach durchzuführen und eignet sich gut für die breite klinische Implementierung und bietet eine wichtige Unterstützung für die genaue Diagnose von Prostatakrebs. In diesem Artikel werden das Protokoll und der klinische Nutzen dieses standardisierten Ansatzes detailliert beschrieben und sein Potenzial zur Verbesserung der Prostatakrebserkennung in der Routinepraxis hervorgehoben.
Protokoll
Diese Studie mit menschlichen Teilnehmern wurde in Übereinstimmung mit den in der Deklaration von Helsinki dargelegten Grundsätzen durchgeführt. Vor ihrer Aufnahme in die Studie wurde von allen Teilnehmern eine schriftliche Einverständniserklärung eingeholt. Die Ein- und Ausschlusskriterien wurden sorgfältig definiert, um die Sicherheit der Teilnehmer und die Eignung des Verfahrens zu gewährleisten.
1. Auswahl des Patienten
- Legen Sie die folgenden Einschlusskriterien für die Patientenauswahl fest: prostataspezifisches Antigen (PSA) > 10 ng/ml; Vorhandensein eines verdächtigen Prostataknotens, der durch die digitale rektale Untersuchung (DRE) festgestellt wurde, unabhängig vom PSA-Wert; verdächtige Läsionen, die durch transrektalen Ultraschall (TRUS), MRT oder PSMA PET/CT identifiziert wurden, unabhängig vom PSA-Wert; PSA-Werte zwischen 4 und 10 ng/ml, begleitet von f/tPSA < 0,16 und/oder PSA-Dichte (PSAD) > 0,15 ng/ml2 und/oder PSA-Geschwindigkeit (PSAV) > 0,75 ng/ml jährlich; abnormale Ergebnisse aus anderen prostatabezogenen Tests, wie z. B. ein erhöhter Prostatagesundheitsindex (PHI) oder positive Ergebnisse des Prostatakrebsantigens 3 (PCA3) im Urin.
- Ausschluss von Teilnehmern aus der Studie auf der Grundlage der folgenden Kriterien: akute Infektion oder Fieber während des Studienzeitraums; hypertensive Krise; dekompensierte Herzinsuffizienz; schwere Blutungsstörungen; schlecht kontrollierte oder instabile Komorbiditäten wie Bluthochdruck oder Diabetes; schwere anale oder rektale Erkrankungen, einschließlich fortgeschrittener innerer/äußerer Hämorrhoiden oder signifikanter rektaler/analer Pathologie; schwerer immunsuppressiver Zustand; schwere psychische Störungen oder Teilnehmer, die nicht bereit oder nicht in der Lage sind, mit dem Verfahren zusammenzuarbeiten.
2. Bestimmung der dreidimensionalen Koordinaten der Läsion im mpMRT
- Überprüfen Sie die T2-gewichtete Bildgebung (T2WI, Abbildung 1A), die diffusionsgewichtete Bildgebung (DWI, Abbildung 1B) und den scheinbaren Diffusionskoeffizienten (ADC, Abbildung 1C) von multiparametrischen MRT-Scans (mpMRT) gründlich, um die Prostataläsionen zu identifizieren.
HINWEIS: Eine Rücksprache mit einem Radiologen kann erforderlich sein, um die Lokalisation der Läsion vor der Biopsie zu bestätigen. - Verwenden Sie als Eckpunkt einen Punkt, der etwa 7 mm von der vorderen Rektumwand entfernt ist. Ziehe eine Linie durch die Mittellinie des Körpers, die durch die Schambeinsymphyse oder die knollige Harnröhre bestimmt werden kann. Ziehe eine weitere Linie durch die Mitte der Läsion. Der Winkel zwischen diesen beiden Linien ist die Winkelverschiebung, die als α aufgezeichnet wird (Abbildung 2A).
HINWEIS: Dieser Winkel α wird verwendet, um zu bestimmen, wie stark die Ultraschallsonde gedreht wird, um sie während der Biopsie mit der Läsion auszurichten. - Messen Sie den Abstand vom Zentrum der Läsion zur rektalen serösen Oberfläche auf der T2WI-Sequenz und notieren Sie ihn als X (Abbildung 2A).
HINWEIS: Der Abstand X wird verwendet, um den Einführpunkt der Nadel während der Biopsie zu führen und die Stelle zu bestimmen, an der die Biopsienadel relativ zum Rektum eingeführt wird. - Messen des Abstands von der Spitze der Prostata (Y) Erstellen Sie mit einem DICOM-Viewer mit MPR (multiplanare Rekonstruktion) oder einer anderen Schichtfunktion eine Ebene, die sowohl durch die Mitte des Scheitelpunkts des α-Winkels als auch durch die Mitte der Läsion verläuft. Messen Sie den Abstand von der Läsion bis zur Spitze der Prostata in dieser Ebene und notieren Sie ihn als Y (Abbildung 2B).
HINWEIS: Der Abstand Y ist entscheidend für die Bestimmung der Einstichtiefe der Nadel; Sie entspricht der Tiefe, die die Biopsienadel während der Biopsie erreichen muss.
3. Patientenvorbereitung und Bildgebung
- Bringen Sie den Patienten in die Steinschnittposition. Positionieren Sie das Gesäß genau an der Mittelkante der Untersuchungsliege. Beide Beine sind symmetrisch in den Beinstützen abgestützt.
- Ziehen Sie den Hodensack nach oben zurück und legen Sie den Dammbereich vollständig frei.
- Desinfizieren Sie den Dammbereich mit Povidon-Jod (Iodophor) und bedecken Sie den Bereich, so dass die Eingriffsstelle zugänglich bleibt.
- Injizieren Sie subkutan 1% Lidocain zur Lokalanästhesie an der Projektion der größten Querebene der Prostata auf die Dammhaut.
- Führen Sie die biplane transrektale Ultraschallsonde (TRUS) vorsichtig in das Rektum ein. Positionieren Sie die Sonde in einem Winkel von 45° nach oben relativ zum Anus.
HINWEIS: Der Anästhesieeinführpunkt ist in der Regel 1,5 cm vom Anus entfernt (Abbildung 3). - Injizieren Sie 1% Lidocain in den Musculus levator ani, die Prostatakapsel und die Spitze der Prostata über Ultraschallführung in der Sagittalebene, um eine angemessene Anästhesie während der Biopsie zu gewährleisten.
4. TRUS und kognitive Fusion
- Richten Sie die Ultraschallsonde auf die Mittellinie aus, indem Sie eine Ebene auf dem transversalen Ultraschallbild lokalisieren, die der Position der Läsion aus dem T2WI-Querbild auf dem mpMRT genau entspricht. Halten Sie die Sonde nach der Identifizierung ruhig und frieren Sie das Ultraschallbild auf dieser Querschnittsebene ein.
HINWEIS: Stellen Sie sicher, dass die Sagittalebene der Ultraschallsonde mit der Mittellinie des Körpers ausgerichtet ist. In der Standard-Lithotomieposition wird die Sagittalebene der Sonde in der Regel direkt über dem Kopf positioniert. - Frieren Sie das Bild ein und verwenden Sie die Mitte der Sonde als Scheitelpunkt, um den α Winkel im Ultraschall zu messen. Richten Sie eine Kante des α Winkels an der zentralen Hilfslinie auf dem transversalen Ultraschallbild aus (Abbildung 4A).
HINWEIS: Die Position der anderen Kante des α Winkels, die der Position der Läsion auf dem Ultraschallbild entspricht. - Tauen Sie das Bild auf und drehen Sie die Sonde, bis die zentrale Hilfslinie des transversalen Ultraschallbildes mit der Position der im MRT identifizierten Läsion übereinstimmt. Halten Sie die Sonde ohne weitere Drehung ruhig, sobald die Drehung in den α Winkel erreicht ist.
- Positionieren Sie die Ultraschallsonde in der Läsionsebene, indem Sie die Sonde horizontal entlang des Rektums schieben, bis die Lineararray-Ultraschallsonde das Prostatabild anzeigt, nachdem Sie die Sonde in den richtigen α Winkel gedreht haben.
HINWEIS: Das aktuell angezeigte Bild entspricht der Ebene der Läsion, die durch die vorherigen MRT-Messungen bestimmt wurde (Abbildung 4B). - Messen Sie den Abstand von der rektalen serösen Oberfläche zu der Stelle, die dem zuvor gemessenen X-Wert im MRT entspricht, und bestätigen Sie den Einstichpunkt für die Biopsienadel.
- Messen Sie den Abstand von der Spitze der Prostata zu der Stelle, die dem zuvor gemessenen Y-Wert im MRT entspricht, in Richtung parallel zum Rektum, um die richtige Tiefe für das Einstechen der Biopsienadel sicherzustellen (Abbildung 4B).
HINWEIS: Diese X- und Y-Messungen bestätigen, dass die Sonde korrekt auf der Läsion auf dem Ultraschallbild ausgerichtet ist, was eine präzise Ausrichtung während der Biopsie ermöglicht.
5. Gezielte Biopsie
- Führen Sie die Biopsienadel entlang der Nadelführungslinie ein, die dem Abstand vom Rektum entspricht (gemessen als X auf dem Ultraschallbild) unter Ultraschallführung in der Sagittalebene mit der Lineararray-Sonde.
- Passen Sie die Nadeltiefe an den zuvor gemessenen Y-Wert an, der den Abstand von der Spitze der Prostata darstellt. Führen Sie 2-3 gezielte Biopsiekerne im Läsionsbereich durch, sobald die richtige Tiefe erreicht ist (Abbildung 4B).
- Wiederholen Sie die obigen Schritte für jede Zielläsion, wenn mehrere Läsionen identifiziert wurden.
HINWEIS: Es ist wichtig, die Stabilität der Ultraschallsonde zu erhalten, und die X- und Y-Koordinaten müssen während des gesamten Eingriffs für jede Biopsiestelle genau angewendet werden. Um die Präzision zu gewährleisten und die Handbewegung zu reduzieren, wird empfohlen, einen Stützarm mit Ultraschallsonde zur Unterstützung zu verwenden.
6. Systematische Biopsie
- Entnehmen Sie einen Biopsiekern aus der Spitze, der Mittellinie und der Basis sowohl in der peripheren als auch in der zentralen Zone des linken Lungenappens der Prostata.
- Passen Sie die Sondenposition an und entnehmen Sie jeweils einen Kern von der Spitze, der Mittellinie und der Basis in beiden Zonen. Wiederholen Sie dann den Vorgang am rechten Lappen der Prostata.
HINWEIS: Es wird empfohlen, während der systematischen Biopsie insgesamt 12 Kerne zu entnehmen.
7. Fertigstellung
- Entfernen Sie die TRUS-Sonde vorsichtig aus dem Rektum, um Beschwerden nach der Biopsie zu vermeiden.
- Reinigen Sie den perinealen und rektalen Bereich mit sterilen Tüchern, um Gel- oder Blutreste zu entfernen.
- Geben Sie jeden Biopsiekern in vorbeschriftete Behälter mit geeigneten Konservierungsmitteln. Markieren Sie jeden Behälter mit den Patienteninformationen und der Biopsiestelle.
- Transportieren Sie die beschrifteten Behälter mit den Biopsiekernen zur histopathologischen Analyse in das Pathologielabor.
Ergebnisse
In diesem Fall identifizierte die kognitive fusionsgesteuerte Prostatabiopsie eine klinisch signifikante Prostatakrebsläsion genau. Diese Läsion wurde mittels MRT in der linken Spitze der Prostata mit einem maximalen Durchmesser von etwa 6 mm und einem PI-RADS-Score von 4 angezeigt, was auf eine hohe Wahrscheinlichkeit für klinisch signifikanten Prostatakrebs hindeutet.
Die pathologische Diagnose dieser Biopsieläsion war ein prostatisches Azinus-Adenokarzinom mit folgenden Details (Abbildung 5):
Gleason-Punktzahl: 4 + 4 = 8, mit 60 % Dur-Gleason-Muster 4 und 40 % Moll-Gleason-Muster 3
WHO/ISUP-Grad-Gruppe: Einstufung als Gradgruppe 4, was auf ein moderates Risiko für das Fortschreiten der Krebserkrankung hinweist
Tumorlast: Der Tumor belegte 30% der Biopsiekerne.
Perineurale Invasion: Negativ (kein Hinweis auf eine Nervenbeteiligung)
Gefäßinvasion: Negativ (keine Hinweise auf eine Ausbreitung in Blutgefäße)
Die anderen systematischen Biopsiekerne der Prostata wurden als gutartig berichtet.
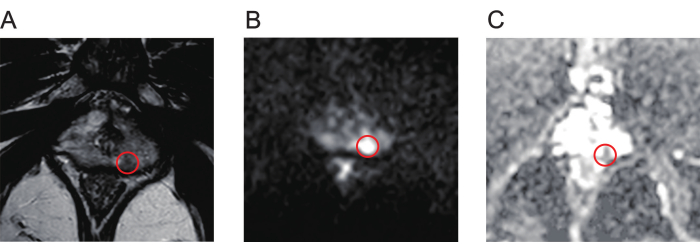
Abbildung 1: Typische mpMRT-Bilder von Prostatakrebsläsionen. (A) Der rote Kreis zeigt die Läsion mit geringer Signalintensität an, wie in der T2-gewichteten Bildgebung gezeigt. (B) Der rote Kreis zeigt die Läsion mit hoher Signalintensität an, wie sie durch diffusionsgewichtete Bildgebung gezeigt wird. (C) Der rote Kreis zeigt die Läsion an und zeigt eine geringe Signalintensität auf der Karte des scheinbaren Diffusionskoeffizienten. Abkürzung: mpMR = multiparametrische Magnetresonanz. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
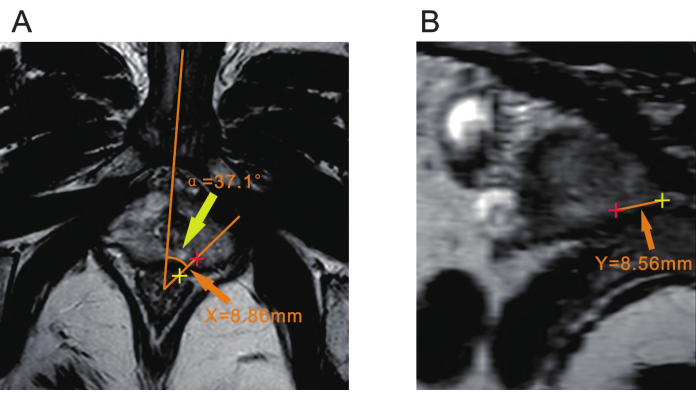
Abbildung 2: Drei Parameter der mpMRT der Prostata. (A) Die gelbe Pfeilspitze zeigt den Winkel (α) zwischen der Ebene der Läsion und der Mittellinie des Körpers an. Die orangefarbene Pfeilspitze zeigt den Abstand (X) von der Mitte der Läsion (rotes Plus) zur rektalen Serosaloberfläche (gelbes Plus) an. (B) Die orangefarbene Pfeilspitze zeigt den Abstand (Y) von der Mitte der Läsion (rot plus) bis zur Spitze der Prostata (gelb plus) an. Abkürzung: mpMRI = multiparametrische Magnetresonanztomographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
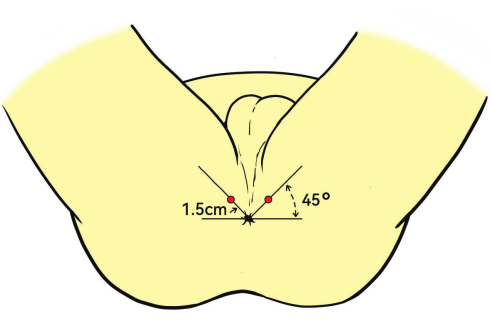
Abbildung 3: Patientenposition und Anästhesiestelle. Die Patienten werden in die Lithotomieposition gebracht. Die Injektionsstelle, die als rote Punkte für die tiefe Infiltrationsanästhesie dargestellt ist, ist 1,5 cm vom Anus entfernt und um 45° abgewinkelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
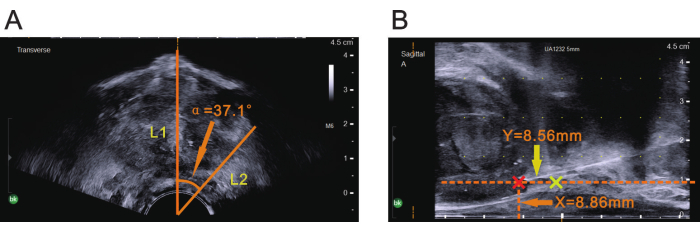
Abbildung 4: Drei Parameter der Prostata-mpMRT, die im Ultraschall dargestellt sind. (A) Nachdem das Ultraschallbild eingefroren war, wurde die Mitte der Sonde als Scheitelpunkt verwendet, und die zentrale Hilfslinie wurde als eine Kante (L1) verwendet, um den α Winkel zu messen, der durch die orangefarbene Pfeilspitze angezeigt wird, wie in der mpMRT gezeigt. Nachdem der durch die orangefarbene Pfeilspitze angezeigte α Winkel gemessen worden war, wurde die andere Kante (L2) des Winkels auf dem transversalen Ultraschallbild bestimmt. (B) Der X-Wert auf mpMRT, der durch die orangefarbene Pfeilspitze angezeigt wird, wurde als vertikaler Abstand zum Zeichnen einer parallelen Linie mit der rektalen serosalen Oberfläche verwendet, und der Y-Wert auf mpMRT, der durch die gelbe Pfeilspitze angezeigt wird, wurde als horizontaler Abstand zum Zeichnen einer vertikalen Linie von der Spitze der Prostata (das gelbe Plus) verwendet. Das rote Plus an der Kreuzungsstelle zeigt den Läsionsbereich (Biopsiestelle) an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Pathologische Färbung der Biopsiezielläsion aus der Prostata. (A) HE-Färbung mit azinärem Adenokarzinom der Prostata mit einem Gleason-Score von 4 + 4 = 8 (200x). Maßstabsbalken = 10 μm. (B) Die immunhistochemische Färbung für eine positive Expression von NKX3.1 deutet auf eine schlechte Differenzierung bei Prostatakrebs hin (200x). Maßstabsleiste = 10 μm. Abkürzung: HE = Hämatoxylin-Eosin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die MRT-gesteuerte Biopsie (MRT-GB) ist ein Eckpfeiler der gezielten Prostatabiopsie und umfasst die MRT-gezielte Biopsie (MRT-TB), die MRT-transrektale Ultraschall-Fusionsbiopsie (FUS-TB) und die kognitive Fusionsbiopsie (COG-TB). MRT-TB erreicht eine hohe diagnostische Genauigkeit durch Echtzeit-MRT-Bildgebung mit einer Gesamtkrebserkennungsrate von 80 % und einer klinisch signifikanten Krebserkennungsrate von 55 %9. Die hohen Kosten und die betriebliche Komplexität schränken jedoch die weite Verbreitung ein. FUS-TB kombiniert MRT-Präzision mit Echtzeit-Ultraschallführung unter Verwendung spezieller Software und bietet eine präzise Lokalisierung. Es erfordert jedoch zusätzliches Equipment und komplexe Arbeitsabläufe. Im Gegensatz dazu verlässt sich COG-TB ausschließlich auf die Fähigkeit des Bedieners, MRT- und Ultraschallbilder während des Eingriffs mental zu integrieren, wodurch spezielle Geräte überflüssig werden. Dieser Ansatz ist kostengünstig, einfach durchzuführen und birgt ein erhebliches Potenzial für eine breite klinische Anwendung.
Studien haben gezeigt, dass die diagnostische Genauigkeit von COG-TB bei der Erkennung von klinisch signifikantem Prostatakarzinom (csPCa) mit der von fortschrittlichen MRT-gesteuerten Biopsietechniken wie MRT-TB und FUS-TB vergleichbar ist 7,10. Diese vergleichbare Wirksamkeit unterstreicht, dass COG-TB eine praktikable Alternative ist, insbesondere in Umgebungen mit begrenztem Zugang zu Spezialgeräten. Trotz seiner Einfachheit bleibt COG-TB jedoch von der Erfahrung des Bedieners abhängig. Traditionelle kognitive Fusionsmethoden stützen sich häufig auf anatomische Orientierungspunkte wie Zysten, gutartige Prostatahyperplasieknoten oder Verkalkungen, um die Läsionen 8,11,12,13,14,15 zu positionieren. Untersuchungen deuten jedoch darauf hin, dass etwa 50 % der Prostatakrebsläsionen bei TRUS keine typischen echoarmen Eigenschaften aufweisen, wobei einigen Patienten eindeutige anatomische Marker fehlen16. Diese Variabilität, gepaart mit der Abhängigkeit des Bedieners von der räumlichen Wahrnehmung, schränkt die Reproduzierbarkeit und Skalierbarkeit von COG-TB ein.
Bei dieser verbesserten transperinealen kognitiven Fusionsbiopsiemethode wird die Lokalisierung der Läsionen anhand von drei Schlüsselmetriken von mpMRT-Bildern parametrisiert: Rotationswinkel (α), Abstand von der rektalen Serosa (X) und Abstand von der Prostataspitze (Y). Unter Verwendung von T2WI-Sequenzen aus MRT-Bildern wird der Scheitelpunkt des α Winkels als Rotationsachse definiert, und die Prostata wird in Ebenen segmentiert, um die Position der Läsion zu bestimmen und die α-, X- und Y-Werte zu messen. Diese Parameter werden dann unter TRUS-Anleitung angewendet, um eine präzise Läsionszielbestimmung zu ermöglichen. Die Anwendung dieser drei Parameter ist ähnlich wie bei der Drehung der TRUS-Sonde im Rektum. Mit Hilfe von T2WI wird die Prostata in fächerförmige Sektoren unterteilt, was die Identifizierung der Läsionsebene ermöglicht. Sowohl MRT als auch TRUS verwenden die Mittellinie des Körpers als Referenz für den α Winkel, der etwaige Positionsdiskrepanzen zwischen den beiden Bildgebungsmodalitäten korrigiert.
Die Parameter X und Y sind entscheidend für die Bestimmung der Lage und Tiefe des Einstechens der Nadel. Der auf der T2WI-Ebene gemessene X-Wert stellt den Abstand vom Zentrum der Läsion zur rektalen serosalen Oberfläche dar. Der Abstand vom Läsionszentrum zur Prostatabasis wurde nicht gemessen, da die Leitlinie des Ultraschallscreenings die Biopsienadel effektiv führt. Die rektale seröse Oberfläche befindet sich nahe der Nullmarkierung auf der Hilfslinie, was eine einfache und genaue Referenz für die Bestimmung der X- und Y-Werte bietet. Im Gegensatz zur herkömmlichen kognitiven Fusion werden bei diesem Ansatz die Läsionen nicht auf der Grundlage der inneren anatomischen Orientierungspunkte der Prostata positioniert. In den meisten Fällen müssen die Ultraschallbilder nicht eingefroren werden, um diese Messungen durchzuführen. Die Positionierung von Läsionen durch mpMRT-Parameter stellt sicher, dass diese Methode bei einem breiten Spektrum von Patienten mit hoher Reproduzierbarkeit und einer kurzen Lernkurve angewendet werden kann, so dass Anfänger nach dem Training in etwa 10 Fällen eine hohe Genauigkeit erreichen können.
Trotz der Vorteile der Methode können Diskrepanzen zwischen MRT- und Ultraschallbildgebungsmodalitäten sowie Unterschiede in der Patientenpositionierung und Gewebekompression zu Fehlern führen. Zu den wichtigsten Optimierungen gehören die folgenden:
X-Wert (Abstand von der rektalen Serosa): X wird typischerweise mit einem Fehlerbereich von 2-3 mm gemessen. Dünnschicht-MRT-Bilder können die Auflösung und den Kontrast verbessern, während Mehrfachmessungen durch Radiologen die Genauigkeit verbessern können.
Y-Wert (Abstand vom Prostata-Apex): Y basiert auf rekonstruierten T2WI-Ebenen, die möglicherweise eine begrenzte Auflösung aufweisen. Da eine Biopsienadelprobe jedoch 2 cm lang ist, ist es oft ausreichend, die Lokalisation der Läsion zu nähern. Dünnschicht-Scannen und klare Grenzmarkierungen können Messfehler reduzieren.
α Winkel (Rotationswinkel): Durch die Sicherstellung einer konsistenten Patientenpositionierung zwischen MRT und TRUS, die Verwendung der Körpermittellinie als Referenz und die Stabilisierung der Ultraschallsonde können winkelbedingte Abweichungen minimiert werden.
Diese verbesserte Methode wurde kürzlich in einer Kohorte von 423 Patienten mit einem Durchschnittsalter von 70,8 Jahren und einem medianen PSA-Wert von 59,2 ng/ml angewendet. Prostatakrebs wurde bei 311 Patienten (73,5 %) festgestellt, von denen 62,9 % eine klinisch signifikante Krebserkrankung aufwiesen. Diese Ergebnisse bestätigen die Zuverlässigkeit und Wirksamkeit dieses Ansatzes. Die Prostatabiopsie nach MRT-Ultraschall-Fusion kann entweder im transrektalen oder transperinealen Ansatz durchgeführt werden. Pepe et al. analysierten klinische Daten von 8.500 Fällen von transperinealer Prostatabiopsie und berichteten von einer Prostatakrebs-Erkennungsrate von 37,1 % und einer Komplikationsrate von 35,9 %17. Diese Ergebnisse unterstreichen das hohe Sicherheitsprofil des transperinealen Zugangs. Darüber hinaus bietet die transperineale Methode eine höhere Krebserkennungsrate und ein deutlich geringeres Infektionsrisiko als der transrektale Ansatz. Aufgrund dieser Vorteile empfehlen die Leitlinien der European Association of Urology (EAU) den transperinealen Weg als bevorzugten Ansatz für die Prostatabiopsie18.
Diese Methode kann effektiv mit anderen Bildgebungsverfahren, wie z. B. 68Ga-PSMA PET/CT, integriert werden, um die Erkennung von Prostatakrebs mit hohem Risiko zu verbessern. Studien haben gezeigt, dass bei einem standardisierten Aufnahmewert (SUVmax) von 8,68Ga-PSMA PET/CT bei Patienten mit einem ISUP-Grad ≥319 eine diagnostische Genauigkeit von 100 % für klinisch signifikanten Prostatakrebs (csPCa) erreicht wird. Gezielte Biopsien von Regionen mit einem SUVmax ≥ 8 können die Nachweisrate von csPCa weiter verbessern. Zusammenfassend lässt sich sagen, dass diese verbesserte transperineale kognitive Fusionsbiopsiemethode die wichtigsten Einschränkungen der traditionellen COG-TB behebt, eine verbesserte Reproduzierbarkeit bietet, die Abhängigkeit vom Bediener reduziert und ihre klinische Anwendbarkeit erweitert.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Diese Arbeit wurde unterstützt durch das gemeinsame Projekt der Chongqing Health Commission und des Science and Technology Bureau (2025MSXM046 bis JY. D.) und der National Natural Science Foundation of China (82470420 bis J.L.) sowie das Program for Outstanding Medical Academic Leader of Chongqing (YXLJ202406 bis J.L.).
Materialien
| Name | Company | Catalog Number | Comments |
| 5% Povidone-Iodine Solution | Chengdu Yong'an Pharmaceutical Co., Ltd. | H51022885 | For disinfection of the surgical area |
| 10% Neutral Buffered Formalin Fixative | Guangzhou Vigrass Biotechnology Co., Ltd. | 24010506 | For fixing biopsy tissue |
| AccuCARE Transperineal Solutions | CIVCO Medical Instruments Co., Inc | 620-119 | For supporting the probe |
| Injection syringe (20 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | For local anesthesia |
| Lidocaine | Hubei Tiansheng Pharmaceutical Co., Ltd. | H42021839 | Diluted with saline to 1% for local anesthesia |
| MRI 3.0T | Philips | Ingenia | For prostate examination |
| RadiAnt DICOM Viewer | Medixant | V2024.1 | For reading prostate MRI, outlining lesions, measuring distances, and angles |
| Single-use Biopsy Needle MC1820 | Bard Peripheral Vascular, Inc. | REHU3231 | For needle biopsy sampling |
| Single-use Sterile Needle 0.7 x 80 TWLB | Zhejiang Kangdeli Medical Devices Co., Ltd. | C20230923 | For local anesthesia |
| Sodium chloride injection | Southwest pharmaceutical Co., LTD | H50021610 | For diluting lidocaine |
| Ultrasound | BK Medical | bk3000-01 | For guiding prostate biopsy |
Referenzen
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- James, N. D., et al. The Lancet Commission on prostate cancer: planning for the surge in cases. Lancet. 403 (10437), 1683-1722 (2024).
- Jansen, H., Gallee, M. P., Schröder, F. H. Analysis of sonographic pattern in prostatic cancer: comparison of longitudinal and transversal transrectal ultrasound with subsequent radical prostatectomy specimens. Eur Urol. 18 (3), 174-178 (1990).
- Heijmink, S. W. T. P. J., et al. A comparison of the diagnostic performance of systematic versus ultrasound-guided biopsies of prostate cancer. Eur Radiol. 16 (4), 927-938 (2006).
- Verma, S., et al. The current state of MR imaging-targeted biopsy techniques for detection of prostate cancer. Radiology. 285 (2), 343-356 (2017).
- Moore, C. M., et al. Image-guided prostate biopsy using magnetic resonance imaging-derived targets: A systematic review. Eur Urol. 63 (1), 125-140 (2013).
- Wegelin, O., et al. The FUTURE trial: A multicenter randomised controlled trial on target biopsy techniques based on magnetic resonance imaging in the diagnosis of prostate cancer in patients with prior negative biopsies. Eur Urol. 75 (4), 582-590 (2019).
- Falagario, U. G., et al. Prostate cancer detection and complications of MRI-targeted prostate biopsy using cognitive registration, software-assisted image fusion or in-bore guidance: a systematic review and meta-analysis of comparative studies. Prostate Cancer Prostatic Dis. , (2024).
- Pokorny, M., et al. MRI-guided in-bore biopsy for prostate cancer: what does the evidence say? A case series of 554 patients and a review of the current literature. World J Urol. 37 (7), 1263-1279 (2019).
- Wegelin, O., et al. Comparing three different techniques for magnetic resonance imaging-targeted prostate biopsies: A systematic review of in-bore versus magnetic resonance imaging-transrectal ultrasound fusion versus cognitive registration. Is there a preferred technique. Eur Urol. 71 (4), 517-531 (2017).
- Puech, P., et al. Multiparametric MRI-targeted TRUS prostate biopsies using visual registration. BioMed Res Int. 2014, 819360 (2014).
- Ito, M., et al. Superior detection of significant prostate cancer by transperineal prostate biopsy using MRI-transrectal ultrasound fusion image guidance over cognitive registration. Int J Clin Oncol. 28 (11), 1545-1553 (2023).
- Oberlin, D. T., et al. Diagnostic value of guided biopsies: Fusion and cognitive-registration magnetic resonance imaging versus conventional ultrasound biopsy of the prostate. Urology. 92, 75-79 (2016).
- Khoo, C. C., et al. A comparison of prostate cancer detection between visual estimation (cognitive registration) and image fusion (software registration) targeted transperineal prostate biopsy. J Urol. 205 (4), 1075-1081 (2021).
- Fleville, S., et al. Diagnostic pathway outcomes for biparametric magnetic resonance imaging-targeted lesions using cognitive registration and freehand transperineal prostate biopsy in biopsy-naïve men (CRAFT single-center study). J Urol. 212 (6), 821-831 (2024).
- Won, S. Y., Cho, N. H., Choi, Y. D., Park, S. Y. Transrectal ultrasound-guided targeted biopsy of transition zone prostate cancer under cognitive registration with prebiopsy MRI and sonographic findings. Clin Radiol. 75 (2), 157.e21-157.e27 (2020).
- Pepe, P., Pennisi, M. Morbidity following transperineal prostate biopsy: Our experience in 8.500 men. Arch Ital Urol Androl. 94 (2), 155-159 (2022).
- Cornford, P., et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG guidelines on prostate cancer-2024 update. Part I: Screening, diagnosis, and local treatment with curative intent. Eur Urol. 86 (2), 148-163 (2024).
- Pepe, P., et al. 68Ga-PSMA PET/CT and prostate cancer diagnosis: Which SUVmax value. In Vivo. 37 (3), 1318-1322 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten