Method Article
İn Vivo Uygulamalar için İodiksanol Yoğunluk Gradyan Santrifüjü ile Adeno İlişkili Virüsün Süspansiyon Kültürü Üretimi ve Saflaştırılması
Bu Makalede
Özet
Adeno ilişkili virüs, süspansiyon hücre kültüründe üretilir ve çift iyodiksanol yoğunluk gradyan santrifüjlemesi ile saflaştırılır. Toplam virüs verimini artırmak, virüs çökelme riskini azaltmak ve nihai virüs ürününü daha da konsantre etmek için adımlar dahil edilmiştir. Beklenen nihai titreler 1012 viral partikül/mL'ye ulaşır ve klinik öncesi in vivo kullanım için uygundur.
Özet
Bu protokol, ilk olarak 1999'da tanımlanan AAV'yi saflaştırmak için serotipten bağımsız bir yöntem olan iyodiksanol yoğunluk gradyan santrifüjleme ile rekombinant adeno-ilişkili virüs (rAAV) üretimini ve saflaştırılmasını açıklar. rAAV vektörleri, transgenleri çeşitli insan hücre tiplerine iletmek için gen terapisi uygulamalarında yaygın olarak kullanılmaktadır. Bu çalışmada, rekombinant virüs, transgen, vektör kapsid ve adenoviral yardımcı genleri kodlayan plazmitlerle süspansiyon kültüründe Expi293 hücrelerinin transfeksiyonu ile üretilir. İodiksanol yoğunluk gradyan santrifüjü, partikül yoğunluğuna dayalı olarak tam AAV partiküllerini saflaştırır. Ek olarak, toplam virüs verimini artırmak, kontamine proteinler nedeniyle çökelme riskini azaltmak ve nihai virüs ürününü daha da yoğunlaştırmak için şu anda her yerde bulunan bu metodolojiye sırasıyla üç adım dahil edilmiştir: bir polietilen glikol (PEG) ve sodyum klorür çözeltisi kullanılarak hücre ortamından viral partiküllerin çökeltilmesi, ikinci bir iyodiksanol yoğunluk gradyan santrifüj turunun tanıtılması, ve santrifüj filtre ile tampon değişimi. Bu yöntemi kullanarak, in vivo kullanım için 1012 viral partikül / mL aralığında olağanüstü saflıkta titreleri tutarlı bir şekilde elde etmek mümkündür.
Giriş
Rekombinant adeno ilişkili viral (rAAV) vektörler, spinal müsküler atrofi, retina distrofisi ve hemofili Adahil olmak üzere genetik hastalıkların tedavisinde yaygın olarak kullanılan araçlardır 1,2,3. rAAV vektörleri, doğrusal tek sarmallı 4.7 kb DNA genomuna sahip küçük, zarfsız bir ikosahedral virüs olan vahşi tip AAV4'te bulunan viral genlerden yoksun olacak şekilde tasarlanmıştır. AAV ilk olarak 1960'larda adenovirüs preparatlarının bir kontaminantı olarak keşfedildi5. ITR'ler6 hariç maksimum 4.9 kb ile paketlenebilen transgenin boyutunu sınırlayan küçük kapsid boyutuna rağmen, AAV, insanlarda patojenik olmadığı, birçok bölünen ve bölünmeyen hücre tipinde transgen ekspresyonuna izin verdiği ve sınırlı immünojenik etkilere sahip olduğu için transgen iletimi için yararlıdır7.
Dependoparvovirus cinsinin üyeleri olarak, rAAV'lerin üretimi, adenovirüs veya herpes simpleks virüsünde bulunan yardımcı genlerin ekspresyonuna dayanır8. rAAV üretmek için çeşitli stratejiler geliştirilmiştir, ancak adenoviral E1A/E1B yardımcı genleri ile dönüştürülen HEK293 hücrelerinde üretim günümüzde kullanılan en yaygın yöntemdir9. rAAV üretiminin genel yaklaşımı, HEK293 hücrelerinin, sırasıyla ters terminal tekrarlar (ITR'ler), AAV rep ve cap genleri ve ek adenoviral yardımcı genler içinde transgeni içeren üç plazmid ile transfeksiyonu ile başlar. Transfeksiyondan yetmiş iki saat sonra, transgeni içeren rAAV'yi saflaştırmak için hücreler toplanır ve işlenir.
Terapötik amaçlar için yeni rAAV vektörlerinin geliştirilmesinde, ana hedef, artan transdüksiyon verimliliğine sahip vektörler üretmektir. Hedef hücrelerin transdüksiyon verimliliğindeki bir artış, gerekli klinik rAAV dozunda bir azalma anlamına gelir, böylece antikor aracılı nötralizasyondan akut toksisitelere kadar değişen olumsuz immünojenik etkilerin olasılığını azaltır10,11. rAAV vektörlerinin transdüksiyon etkinliğini arttırmak için, paketlenmiş genomda veya kapsidde değişiklikler yapılabilir. Paketlenmiş genom tasarımı yoluyla transdüksiyon etkinliğini ayarlamak için uygulanabilir yöntemler arasında güçlü ve dokuya özgü promotörlerin dahil edilmesi, mRNA işleme elemanlarının dikkatli seçimi ve çeviri verimliliğini artırmak için kodlama dizisi optimizasyonu yer alır12. Kapsidde yapılan değişiklikler, hedef insan hücre tipleri için tropizmi artırmak amacıyla yapılır. Yeni rAAV transgen iletim vektörü kapsidleri geliştirmeye yönelik çabalar, genellikle, belirli hücre reseptörlerini hedefleyen spesifik mutasyonlara sahip AAV kapsidlerinin rasyonel tasarımına veya belirli bir reseptörü hedeflemeden yüksek karmaşıklıktaki kombinatoryal kapsid kütüphanelerinden belirli hücre tipleri için tropizmli kapsidleri tanımlamak için yönlendirilmiş evrime odaklanarak karakterize edilir (bazı gruplar bu yaklaşımları birleştirse de)13, 14,15. Yönlendirilmiş evrim yaklaşımında, kombinatoryal kapsid kütüphaneleri, kapsid dış16 üzerinde mutasyona uğramış değişken bölgelere sahip belirli bir serotip omurgası kullanılarak oluşturulur. Kombinatoryal kapsid kütüphaneleri genellikle insanlardan kaynaklanmayan AAV serotiplerinden oluşturulur ve klinik kullanım sırasında önceden var olan bağışıklık riskini azaltır10. Bu nedenle, herhangi bir serotipe uygulanabilen saflaştırma yöntemleri, bu kütüphaneler için omurga görevi gören daha az kullanılan serotipler için serotipe özgü optimizasyon ihtiyacını ortadan kaldırmak için idealdir.
İodiksanol yoğunluk gradyan santrifüjü, yüksek enfektiviteye sahip yüksek rAAV titrelerini saflaştırmak için kullanılır17. Bu protokolde, büyük AAV titreleri üretmek için gereken emek miktarını azaltmak için süspansiyon hücre kültüründe rAAV üretilir. Kirletici proteinlerin varlığını azaltmak ve virüs çökelmesi riskini azaltmak için hücre lizatını temizlemek için bir santrifüjleme adımı da dahildir. Bu protokol, klinik öncesi kullanıma uygun yüksek saflıkta rAAV preparatları üretmek için uygun maliyetli bir yöntemdir.
Protokol
Bu protokolde kullanılan çözeltilerin ve tamponların bileşimi Tablo 1'de verilmiştir.
| Çözüm | Kompozisyon | |
| AAV lizis tamponu | 1.2 mL 5 M NaCl çözeltisi | |
| 2 mL 1 M Tris-HCl pH 8.5 çözeltisi | ||
| 80 uL 1 M MgCl2 çözeltisi | ||
| 40 mL'ye kadar mQ su | ||
| AAV çökeltme çözeltisi | 40 g PEG 8000 | |
| 50 mL 5 M NaCl çözeltisi | ||
| mQ su ila 100 mL | ||
| % 15 iyodiksanol fraksiyonu | 7,5 mL OptiPrep | |
| 3 mL 10X DPBS | ||
| 6 mL 5 M NaCl çözeltisi | ||
| 30 uL 1 M MgCl2 çözeltisi | ||
| mQ ila 30 mL | ||
| % 25 iyodiksanol fraksiyonu | 12. 5 mL OptiPrep | |
| 3 mL 10X DPBS | ||
| 30 uL 1 M MgCl2 çözeltisi | ||
| 60 uL fenol kırmızısı çözelti | ||
| mQ ila 30 mL | ||
| % 40 iyodiksanol fraksiyonu | 33.3 mL OptiPrep | |
| 5 mL 10X DPBS | ||
| 50 uL 1 M MgCl2 çözeltisi | ||
| mQ ila 50 mL | ||
| % 60 iyodiksanol fraksiyonu | 50 mL OptiPrep | |
| 100 uL fenol kırmızısı çözelti | ||
| AAV tampon çözeltisi | 8 mL 5 M NaCl | |
| 20 uL %10 Pluronic F-68 | ||
| PBS için 200 mL | ||
Tablo 1: Bu protokolde kullanılan çözeltiler için çözelti bileşimleri.
1. Expi293 hücrelerinin üçlü transfeksiyonu
- Tohum Expi293 hücreleri ( Malzeme Tablosuna bakınız) 5 x 105 canlı hücre (vc) / mL başlangıç yoğunluğunda.
- Hücrelerin 37 °C'de %8 CO2 ve 125 rpm çalkalayıcı hızı ile 3-5 x 106 vc/mL yoğunluğa ulaşana kadar inkübe etmesine izin verin. Otomatik bir hücre sayacı ile tripan mavisi dışlamasını kullanarak hücre yoğunluğunu ve canlılığını izleyin (bkz.
- Hücreler istenen hücre yoğunluğuna ulaştığında, toplam hacimleri orijinal hacminin on katı olacak şekilde yeni ortam ekleyerek bunları 1'den 10'a bölün. Gerekirse, hücreleri daha büyük bir şişeye aktarın. Kuluçkaya geri dönün.
- Hücreleri, 1 L'lik bir şişede 250 mL ortamda en az 2 x 106 vc/mL yoğunluğa ulaşana kadar 1.2-1.3 adımlarında açıklandığı gibi genişletmeye devam edin.
- Transfeksiyondan bir gün önce, hücreleri 250 mL ortamda 2 x 106 vc / mL'ye seyreltin ve gerektiğinde fazla hücreleri atın. Hücreleri gece boyunca inkübe edin.
- Transfeksiyon gününde, hücrelerin yarısını 18 ° C'de 5 dakika boyunca 58 x g'de santrifüjleyin. Hücre peletini aynı hacimde (125 mL) taze ortamda yeniden süspanse edin. Hücre canlılığı %98'e yakın olmalıdır.
- İki adet 50 mL konik tüp hazırlayın. Birini "PEI" ve diğerini "DNA" olarak etiketleyin.
- PEI etiketli konik tüpte, 1,2 mL PEI'yi (Polietilenimin, Malzeme Tablosuna bakınız) OptiMEM ortamında toplam 12,5 mL hacme kadar seyreltin.
- DNA etiketli konik tüpte, OptiMEM ortamında toplam 12,5 mL hacimde toplam 500 μg DNA'ya eşmolar bir plazmit DNA çözeltisi hazırlayın.
- DNA çözeltisini PEI çözeltisine ekleyin, iyice birleştirmek için birkaç kez ters çevirin ve oda sıcaklığında 10 dakika inkübe edin.
NOT: PEI'nin DNA ile yüklü kompleksler oluşturması için DNA-PEI çözeltisinin tam 10 dakika inkübe edilmesine izin verilmesi çok önemlidir. - DNA-PEI çözeltisi 10 dakika inkübe edildikten sonra, DNA-PEImax çözeltisini Expi293 hücrelerine yavaşça uygulamak için serolojik bir pipet kullanın. Transfekte edilmiş hücreleri inkübatöre geri koyun ve 72 saat inkübe etmelerine izin verin (Şekil 1).

Şekil 1: Transfeksiyondan iki gün sonra GFP eksprese eden Expi293 hücreleri. GFP için bir gen içeren bir plazmit ile transfeksiyondan sonra, Expi293 hücreleri geçici olarak eGFP'yi eksprese eder. Hücre morfolojisi yuvarlaktır. Görüntü 15 ms pozlama süresiyle çekildi. Mikroskop görüntüleri, epi-floresan aydınlatma ve 10x/0.30 objektif ile donatılmış ters çevrilmiş bir mikroskop kullanılarak elde edilir. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. rAAV vektör saflaştırma
- 72 saat sonra, süspansiyon halindeki hücreleri iki adet 250 mL'lik konik tüpe aktarın ve 4 ° C'de 10 dakika boyunca 415 x g'de döndürün.
- Süpernatan ortamı 500 mL'lik taze bir konik tüpe dökün ve daha sonra işlenmek üzere buz üzerinde 0 °C'de saklayın.
- Her hücre peletini 10 mL AAV lizis tamponunda yeniden süspanse edin (Tablo 1). İki lizatı tüplerden birinde bir araya getirin. Diğer tüpü ilave 5 mL AAV lizis tamponu ile durulayın, ardından havuzlanmış lizatlara ekleyin. -70 °C'de dondurun.
NOT: Deneme bu noktada duraklatılabilir. Süpernatan ortamı buz yerine -70 °C'de saklayın. - Adım 2.2'den süpernatan ortama 1:4 hacim AAV çökeltme çözeltisi ekleyin. İyice karıştırmak için birkaç kez ters çevirin ve buz üzerinde 0 °C'de en az 2 saat veya gece boyunca inkübe edin.
- İnkübe edilmiş çözeltiyi 4 ° C'de 1 saat boyunca 3000 x g'da santrifüjleyin.
- Süpernatanı atın ve viral çökelti içeren peleti 5 mL AAV lizis tamponunda yeniden süspanse edin.
- Hücre lizatını 37 °C'de bir su banyosunda çözdürün.
- Viral çökeltiyi hücre lizatı ile bir araya getirin. Bu ham lizattır. Viral çökeltiyi içeren santrifüj tüpünü ilave 5 mL AAV lizis tamponu ile durulayın ve ham lizat ile havuzlayın.
- Ham lizatı -70 °C'de dondurun, ardından 37 °C'de çözdürün. Bu döngüyü bir kez daha tekrarlayın.
NOT: Ham lizat, 37 °C'de çözülmesi gerekenden daha uzun süre bırakılmamalıdır. - Üçüncü kez çözüldükten sonra, ham lizata hemen 4 μL benzonaz ekleyin, karıştırmak için ters çevirin ve 37 °C'de 30 dakika inkübe edin.
- Ham lizatı 18 ° C'de 650 x g'de 10 dakika santrifüjleyin.
- Süpernatanı temiz bir 50 mL konik tüpe aktarın. Bu ham virüstür. Peleti atın.
- Kirletici proteinleri temizlemek için ham virüsü 18 ° C'de 3000 x g'de 30 dakika daha santrifüjleyin.
- Süpernatanı temiz bir 50 mL konik tüpe aktarın. Bu açıklığa kavuşturulmuş virüstür.
NOT: Deneme bu noktada duraklatılabilir. Arıtılmış virüsü -70 °C'ye kadar dondurun. - Çok kanallı peristaltik pompayı dört peristaltik tüple kurun (Malzeme Tablosuna bakın). Kılcal damarları her tüpün her iki ucuna takın.
- Kılcal damarları pompanın giriş tarafında, deiyonize suyla dolu bir behere yerleştirin. Pompanın çıkış tarafındaki kılcal damarları boş bir behere yerleştirin. Hortumu deiyonize (DI) suyla yıkamak için peristaltik pompayı 25.0 rpm'de çalıştırın.
- İyice yıkandığında, hortum sadece hava ile dolana kadar pompayı çalıştırarak peristaltik boruyu boşaltın. Tüm kılcal damarları temiz, tüy bırakmayan bir mendil üzerine koyun.
- Dört ultrasantrifüj tüpünü pompanın çıkış tarafındaki bir rafa yerleştirin.
- Her bir ultrasantrifüj tüpüne 10 mL arıtılmış virüsü dikkatlice dağıtmak için 10 mL'lik bir serolojik pipet kullanın. Hava kabarcıkları girmemesine dikkat edin.
NOT: Her tüpteki arıtılmış virüs hacmi, gerekirse tüp başına 12 mL'ye kadar uzatılabilir. Aşağıdaki 2.25 adımında% 60 iyodiksanol miktarını uygun şekilde azaltın. - Arıtılmış virüs, peristaltik pompa kullanılarak en düşük yoğunluktan en yüksek yoğunluğa kadar iyodiksanol fraksiyonları (Tablo 1) ile kaplanmıştır. Önce %15 kesir, ardından %25 kesir, %40 kesir ve son olarak %60 kesir eklenir. % 15 iyodiksanol fraksiyonunun 22 mL'sini (ultrasantrifüj tüpü başına 5.5 mL) temiz bir 50 mL konik tüpe aktarın. Pompanın giriş tarafındaki kılcal damarları, tüm kılcal damarların borunun dibine temas etmesine dikkat ederek boruya yerleştirin.
- Pompayı çalıştırın ve borunun iyodiksanol fraksiyonu ile dolmasına izin verin. İodiksanol fraksiyonu, pompanın çıkış tarafındaki kılcal damarların uçlarına ulaştığında, pompayı durdurun.
- Kılcal damarların her bir ultrasantrifüj tüpünün dibine temas etmesine dikkat ederek, arıtılmış virüslü her bir ultrasantrifüj tüpüne bir çıkış kılcal yerleştirin.
NOT: Kılcal damarlarda hava kalmaması kritik öneme sahiptir. İodiksanol, peristaltik borudan biraz farklı oranlarda akabilir, bu nedenle her bir çıkış kılcalının arıtılmış virüse yerleştirmeden önce tamamen iyodiksanol ile doldurulduğundan emin olun. Pompayı birkaç kez durdurmak ve çalıştırmak gerekebilir. - Pompayı çalıştırın ve ultrasantrifüj tüplerinin dolmasına izin verin. %15'lik fraksiyonun sonuncusu giriş kılcal damarlarına alınmak üzereyken pompayı durdurun. Peristaltik boruya hava kabarcığı girmemesi çok önemlidir.
NOT: Giriş kılcal damarlarına hava kabarcıkları girerse, pompa bunları geri itmek için kısa bir süre ters yönde çalıştırılabilir. - % 25 iyodiksanol fraksiyonunun 22 mL'sini (ultrasantrifüj tüpü başına 5.5 mL) 50 mL konik tüpe aktarın. Tüm kılcal damarların borunun dibine temas etmesine dikkat edin ve pompayı çalıştırın. %25'lik fraksiyonun sonuncusu giriş kılcal damarlarına alınmak üzereyken pompayı durdurun.
- Adım 2.24'ü% 40 iyodiksanol fraksiyonunun 20 mL'si (ultrasantrifüj tüpü başına 5 mL) ve ardından% 60 fraksiyonunun 24 mL'si (ultrasantrifüj tüpü başına 6 mL) ile tekrarlayın.
- Ultrasantrifüj tüpünde hala doldurulmamış hacim varsa, ultrasantrifüj tüpleri tamamen sıvı ile dolana kadar% 60 fraksiyondan daha fazlasını eklemeye devam edin.
- Lizat üstte bir kubbe yapana kadar her tüpü doldurun, ancak tüpten taşmayın. Pompayı durdurun ve iyodiksanol gradyanını bozmamaya dikkat ederek her bir çıkış kılcal damarını dikkatlice çıkarın.
- Her ultrasantrifüj tüpünü bir ara parça ile kapatın ve Tip 70 Ti rotora yükleyin (Malzeme Tablosuna bakın).
NOT: Rotorun uygun şekilde dengelendiğinden emin olun. Uygun eğitim olmadan ultrasantrifüjü çalıştırmaya çalışmayın. - Tip 70 Ti rotoru ultrasantrifüje yükleyin ve 18 °C'de 1 saat boyunca 489.000 x g'da santrifüj edin.
- Santrifüjlemeden sonra rotoru ultrasantrifüjden boşaltın. İodiksanol gradyanını bozmamaya dikkat ederek her bir ultrasantrifüj tüpünü rotordan dikkatlice çıkarmak için iğne burunlu pense kullanın.
- Bir ultrasantrifüj tüpünü sabitlemek için kelepçeli bir destek halkası standı kullanın.
- 5 mL'lik bir şırıngaya 20 GA'lık bir iğne takın ve bir kenara koyun. Kapağı ultrasantrifüj tüpünden çıkarmak için tüy bırakmayan bir mendil kullanın.
- Ultrasantrifüj tüpünün duvarına iğne ile% 40 -% 60 iyodiksanol arayüzünün yaklaşık 3 mm altına nüfuz edin (Şekil 2).
- Arayüzü ve% 40 fraksiyonunun bir kısmını yavaşça aspire edin. Yaklaşık 4 mL'lik bir toplam çekiş için %40'lık fraksiyonun tepesini aspire etmekten kaçının.
- Bir parmağınızı ultrasantrifüj tüpünün açık üst kısmı üzerinde tutarak şırıngayı dışarı çekin ve aspire edilen AAV fraksiyonunu 50 mL'lik konik bir tüpe aktarın. Şırıngayı keskin bir kaba atın. Ultrasantrifüj tüpünü atın.
- Her ultrasantrifüj tüpü için 2.31-2.35 adımlarını tekrarlayın.
- Aspire edilen AAV fraksiyonunu AAV lizis tamponunda yaklaşık iki kat 40 mL'lik bir hacme seyreltin.
- Peristaltik boruyu 2.16-2.17 adımlarında açıklandığı gibi yıkayın.
NOT: Deneme bu noktada duraklatılabilir. Seyreltilmiş AAV fraksiyonunu gece boyunca 0 °C'de saklayın. - Seyreltilmiş AAV fraksiyonunun her birini 20 mL'yi iki yeni ultrasantrifüj tüpüne yükleyin.
- İodiksanol yoğunluk gradyan santrifüjlemesinin ikinci turu için, seyreltilmiş AAV fraksiyonu, %40 fraksiyonun sadece 10 mL'si (ultrasantrifüj tüpü başına 5 mL) ve %60 fraksiyonun 14 mL'si (ultrasantrifüj tüpü başına 7 mL) kullanılarak yukarıda tarif edildiği gibi altlanır. Ultrasantrifüj ve aspirasyon için 2.29-2.36 adımlarını tekrarlayın.
NOT: Peristaltik pompayı ve hortumu saklamadan önce, 2.16-2.17 adımlarında açıklandığı gibi hortumu DI suyla yıkayın.

Şekil 2: %40-60 iyodiksanol arayüzü etiketli iyodiksanol gradyanı. (A) İlk iyodiksanol gradyanı. Fenol kırmızısı, %40 iyodiksanol ve %60 iyodiksanol fraksiyonlarında kullanılır. İki fraksiyon arasındaki pH farkından dolayı farklı bir renk olarak görünür. Ok, %40-%60 iyodiksanol arayüzünün hemen altında, rAAV fraksiyonunu hasat etmek için şırınganın nereye yerleştirilmesi gerektiğini gösterir. (B) İkinci iyodiksanol gradyanı. Bu adımda sadece %40 ve %60 iyodiksanol fraksiyonları kullanılır. Ok, rAAV fraksiyonunu hasat etmek için şırınganın nereye yerleştirilmesi gerektiğini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Tampon değişimi ve virüs konsantrasyonu
- İodiksanol yoğunluk gradyan santrifüjlemesinin ikinci turundan AAV fraksiyonunu elde ettikten sonra, AAV tampon çözeltisi ile iki kat seyreltin.
- Filtrenin üstüne 20 mL AAV tampon çözeltisi ekleyerek santrifüj filtreyi dengeleyin. Aparatı 3000 x g'de 18 °C'de 5 dakika santrifüjleyin ve akışı atın.
- Seyreltilmiş AAV fraksiyonunu santrifüj filtreye ekleyin. Aparatı 3000 x g'de 18 °C'de 5 dakika santrifüjleyin ve akışı atın.
- Filtrenin üstüne 20 mL AAV tampon çözeltisi ekleyin. Aparatı 3000 x g'de 18 °C'de 5 dakika santrifüjleyin ve akışı atın.
NOT: Santrifüj filtre membranı tıkanır ve çözeltinin verimsiz bir şekilde akmasına neden olursa, çözeltiyi filtrenin üst kısmında yukarı ve aşağı çekmek için dikkatli bir şekilde bir P200 mikropipet kullanın. Mikropipet ucuyla filtreye dokunmamaya çok dikkat edin. - Adım 3.4'ü iki kez daha tekrarlayın.
NOT: Filtrenin üst kısmında en az 1 mL hacim bırakarak AAV'nin aşırı konsantre olmadığından emin olun. Aşırı konsantrasyonu önlemek için santrifüj sürelerini ayarlamak gerekebilir. AAV aşırı konsantre ise, yağış meydana gelebilir. - 1012 vg / mL aralığında son bir titre için, virüsü yaklaşık 1 mL'lik bir son hacme döndürün.
NOT: Kullanılan serotip omurgasına ve virüsün paketleme verimliliğine bağlı olarak, virüsü daha küçük bir hacimde konsantre etmeniz gerekebilir. - Konsantre AAV'yi santrifüj filtrenin üstünden bir mikrosantrifüj tüpüne aktarmak için bir p1000 mikropipet kullanın. Kalan virüsleri toplamak ve konsantre AAV'nin geri kalanıyla bir araya getirmek için santrifüj filtreyi 50 μL AAV tamponu ile yıkamak için bir p200 mikropipet kullanın.
- Titre için konsantre AAV'nin 2 μL'lik bir alikotunu bir kenara koyun. qPCR için kullanılabilecek ITR primerlerini görüntülemek için Ek Tablo 1'e bakın.
- Konsantre AAV'yi sterilize etmek için 0,2 μm'lik bir şırınga filtresinden geçirin.
NOT: Küçük bir hacmi sterilize ederken, virüs kaybını en aza indirmek için küçük çaplı bir şırınga filtresi seçmeye dikkat edin. Küçük çaplı düşük proteinli bağlayıcı bir filtrenin kullanılması, minimum viral kayba neden olacaktır (veriler gösterilmemiştir). - Sterilize edilmiş AAV, hücreleri dönüştürmek için hemen kullanılabilir veya dört hafta içinde kullanılmak üzere 4 ° C'de saklanabilir. Daha uzun süreli depolama için -70 °C'de saklanmalıdır.
Sonuçlar
Bu yöntem, mL başına en az 1012 viral partikül titresi elde etmek için kullanılabilir. Ek Tablo 1'de verilen ITR primerleri kullanılarak, ddPCR ile veya başka herhangi bir titre yöntemi ile qPCR ile bir titre elde edilebilir (Şekil 3). Yetersiz titreler, zayıf paketleme verimliliğine sahip bir kapsidi kodlayan bir kapak geninin kullanılmasından kaynaklanabilir.
Optimal olmayan sonuçların bir başka olası kaynağı, Expi293 hücrelerinin zayıf transdüksiyon verimliliğidir. Transfeksiyon gününde hücrelerin 3-4 x 106 vc/mL yoğunlukta olması ve hücre canlılığının %98'e yakın olması önerilir. Bu çalışmada, yazarlar bu protokolü izleyerek 1.07 x 1012 vg'lik bir titre elde etmişlerdir. Bu verim, AAVrh7418 ambalajından elde edilen önceki verimlerle uyumludur.
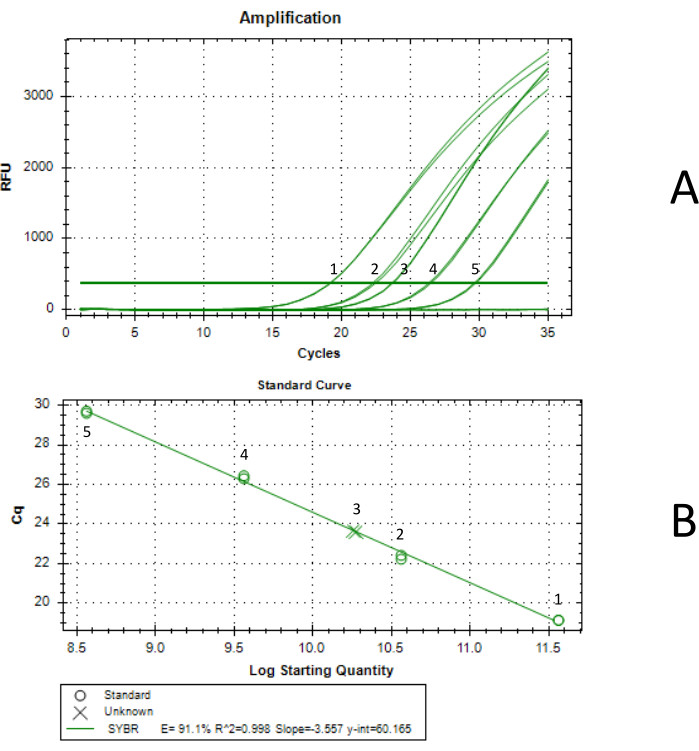
Şekil 3: qPCR ile titre tayini. Eğri 1, 3.66 x 1011 vg/mL standart konsantrasyonla, eğri 2, 3.66 x 1010 vg/mL standart konsantrasyonla, eğri 3, son konsantre AAV numunesiyle, eğri 4, 3.66 x 109 vg/mL standart konsantrasyonla ve eğri 5, 3.66 x 108 vg/mL standart konsantrasyonla üretildi. Her qPCR reaksiyonu iki kez gerçekleştirildi. (A) qPCR amplifikasyon eğrisi. Standartlar, ddPCR ile adlandırılan bir AAV standardının seri seyreltilmesiyle oluşturulmuştur. Seyreltilmemiş standardın konsantrasyonu 3.66 x 1012 vg / mL idi. (B) qPCR tarafından oluşturulan standart eğri. Üretilen AAV'nin 5.75 mL'de 1.85 x10 11 vg/mL konsantrasyona sahip olduğu ve toplam verimin 1.07 x 1012 vg olduğu belirlendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Tablo 1: AAV ters çevrilmiş terminal tekrarları (ITR'ler) için ileri ve geri primer dizileri. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Çift iyodiksanol yoğunluk gradyan saflaştırma protokolü evrensel yöntemdir, çünkü reseptör özgüllüklerine bakılmaksızın herhangi bir AAV mutant varyantına uygulanabilir. AAV saflaştırmanın erken yöntemleri, partikül yoğunluğuna dayanıyordu ve CsCl'de izopiknik santrifüjleme ve sürekli sükroz yoğunluk gradyan santrifüjünüiçeriyordu 19. Daha sonra, Sefaroz kolonlarına20 bağlı monoklonal antikorları kullanan serotipe özgü yaklaşımlar geliştirildi. 1999 yılında süreksiz bir iyodiksanol gradyanı kullanan yeni bir yoğunluk bazlı saflaştırma yöntemi geliştirildi ve CsCl gradyanlarından izole edilenlerden daha yüksek enfektiviteye sahip AAV izolatları verdi21. AAV'yi saflaştırma yöntemleri 2000'li yılların başına kadar geliştirilmeye devam etti, çünkü bazı gruplar rAAV'yi saflaştırmak için yüksek performanslı sıvı kromatografisi kullandı ve ham lizattan geri kazanım %70'i aştı22,23,24. Bu yöntemler hala büyük ölçekli üretim süreçlerinde kullanılmaktadır25. AAV'yi izole etmek için kromatografi yöntemlerinin geliştirilmesine rağmen, düşük maliyeti ve serotip agnostisizmi nedeniyle iyodiksanol yoğunluk gradyan santrifüjleme ile saflaştırma hala yaygın olarak kullanılmaktadır26,27.
Bu yöntem, rAAV'nin zaman açısından verimli klinik öncesi üretimi için çok uygun olsa da, ölçeklenebilirliği ve cGMP üretimine uyarlanma yeteneği açısından çok sınırlıdır25. Bu nedenle, yukarıda açıklandığı gibi, büyük ölçekli üretim için diğer saflaştırma yöntemleri tercih edilir. Ek olarak, rAAV vektörlerinin transgen kapasitesi sınırlıdır. Bozulmadan paketlenebilen bir AAV genomu için boyut sınırının, ITR'leri6'yı hesaba katan maksimum 4.9 kb'lik bir transgen boyutu için yaklaşık 5.2 kb olduğu bulunmuştur. Bu, cDNA'sı bu kapasiteyi aşan proteinlerin ekspresyonunu zorlaştırır. Bu proteinler, transgenin kendisinde modifikasyon yapılmadan veya bölünmüş bir vektör sistemi kullanılmadan burada açıklanan sistem tarafından ifade edilemez. Chamberlain ve ark. 4.9 kb28'den büyük transgenleri eksprese etmek için çeşitli yöntemler tanımlamaktadır.
Bu yöntem, kapsid yüzeyinde bulunan mutasyonlar nedeniyle çeşitli biyokimyasal özelliklere sahip AAV kapsidleri içeren yüksek karmaşıklıkta kombinatoryal kapsid kitaplıklarının üretimi için özellikle yararlıdır. rAAV preparatı hayvanlarda, özellikle insan olmayan primatlarda enjeksiyona yönelikse, endotoksin kontaminasyonunu sınırlamak çok önemlidir. Tüm adımlarda bakteriyel kontaminasyonu önlemek için bakteri kültürlerini büyütmek için kullanılan alanları rAAV üretiminden ayırmaya büyük özen gösterilmelidir. İnsan hücreleri ve ham AAV ile yapılan tüm çalışmaları, tek kullanımlık plastik eşyalar kullanarak bir biyogüvenlik kabininde gerçekleştirin. Bu, bakteriyel kontaminasyonu önler ve bir BSL1 ajanı olduğu için AAV ile çalışmak için bir gerekliliktir.
Bir laboratuvarın çalkalayıcılı bir CO2 inkübatörüne erişimi yoksa, Expi293 süspansiyon hücre kültürü yerine HEK293 hücreli yapışık hücre kültürü kullanılabilir. Alt kültürleme için üretici talimatlarını izleyin ve Crosson ve diğerleri, 201817'de açıklanan transfeksiyon protokolünü kullanın.
Bu protokoldeki kritik adımlar, Expi293 transfeksiyonu, iyodiksanol gradyanının hazırlanması ve AAV içeren iyodiksanol fraksiyonunun aspirasyonudur. Bu adımlardan herhangi biri sırasındaki hatalar, yetersiz rAAV verimlerine veya rAAV üretilememesine neden olabilir.
Expi293 hücrelerinin transfeksiyonu, bu protokolü kullanarak rAAV üretiminde kritik bir adımdır. Transfeksiyon gününde, hücreler, transfeksiyondan kurtulmak için gerekli besinleri sağlamak için yarım hacim taze ortamda yeniden süspanse edilir29; Transfeksiyon, hücreler için çok yorucu bir süreçtir. Bununla birlikte, şartlandırılmış ortam, hücre bakımı ve büyümesi için önemli olan büyüme faktörlerini ve diğer metabolitleri içerdiğinden tamamen atılmaz. PEI ve DNA'nın, yüklü bir kompleks oluşturmak için hücrelere uygulanmadan önce tam on dakika inkübe etmesiçok önemlidir 30. PEI ile bir kompleks oluşturmadan, DNA hücreler tarafından verimli bir şekilde alınmayacaktır.
rAAV üretilirken, ortamda bulunan virüsün oranı, belirli serotipin Expi293 hücre reseptörleri ile etkileşimlerine bağlıdır. Bazı serotipler, diğerlerinden daha yüksek oranlarda hücre ortamına salınır31, bu da mümkün olan en yüksek verimi elde etmek ve Expi293 hücre reseptörleri için afinite eksikliğine dayalı herhangi bir varyantın kaybını önlemek için viral partiküllerin hücre ortamından çökeltilmesini gerektirir. Buna karşılık, AAV2 serotipi, 293 hücrede bulunan heparan sülfat proteoglikanları ile güçlü reseptör etkileşimlerine sahiptir, bu nedenle ortamda çok az paketlenmiş virüs bulunur32. AAV2'nin bir türevini üretirken, PEG çökeltme adımını atlayın. Kombinatoryal kapsid kütüphanelerinin veya alternatif serotiplerin rAAV'sinin üretimi için, viral partiküllerin PEG ile çökeltilmesi uygundur.
Ultrasantrifüjleme sırasında toplanmış AAV partiküllerini ayırmak için %15 iyodiksanol fraksiyonunda 1 M sodyum klorürün bulunması çok önemlidir. Bu fraksiyonda NaCl'nin ihmal edilmesi, transdüksiyon etkinliğinde ve immünojenisitede azalma gibi istenmeyen sonuçlara yol açabilir33. Son olarak, AAV'yi iyodiksanol gradyanından aspire ederken çok dikkatli olun. İodiksanol fraksiyonunun çok fazla aspire edilmesi, nihai üründe boş kapsidlerinvarlığına neden olabilir 17.
Bu yöntem, belirli insan hücre tipleri için daha yüksek tropizme sahip kapsidleri tanımlamak için aşağı akışa yönelik evrim deneylerinde kullanılmak üzere rAAV kombinatoryal kapsid kitaplıklarını paketlemek için kullanılabilir. rAAV, kısa süreli kullanım için 4 °C'de ve uzun süreli depolama için -70 °C'de stabildir34. Şu anda, rekombinant AAV, Duchenne musküler distrofisi35,36,37 dahil olmak üzere FDA onaylı beş ilaçta kullanılmaktadır. Klinik ve klinik öncesi çalışmalarda birkaç ek rAAV tedavisi vardır 38,39,40. Bu vektör üzerinde daha fazla araştırma, ek gen terapilerinin geliştirilmesi için kritik öneme sahiptir.
Açıklamalar
Yazarların bildirecek herhangi bir açıklaması yoktur.
Teşekkürler
Hiç kimse.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5810 R benchtop centrifuge | Eppendorf | 22625501 | |
| 8-channel peristaltic pump | Watson-Marlow | 020.3708.00A | |
| Automated cell counter | NanoEntek | EVE-MC | |
| Avanti J-E high-speed centrifuge | Beckman Coulter | 369001 | |
| Benzonase | Thermo Scientific | 88701 | |
| Biological safety cabinet | Labconco | 322491101 | |
| CO2 incubator with shaker | Set at 8% CO2 and 37 °C | ||
| Conical centrifuge tubes | Thermo Scientific | 339652 | 50 mL |
| Conical centrifuge tubes | Thermo Scientific | 339650 | 15 mL |
| Disposable micro-pipets | Fisherbrand | 21-164-2G | Capillaries |
| Dulbecco's phosphate buffered saline without CaCl2 and MgCl2 (DPBS) (10x) | Sigma-Aldrich | D1408 | |
| ECLIPSE Ts2R-FL inverted microscope | Nikon | ||
| Expi293 Expression Medium | Gibco | A1435101 | |
| Expi293F cells | Gibco | A14527 | |
| Filter tips | USA Scientific | 1126-7810 | 1000 µL |
| Filter tips | USA Scientific | 1120-8810 | 200 µL |
| Filter tips | USA Scientific | 1120-1810 | 20 µL |
| Filter tips | USA Scientific | 1121-3810 | 10 µL |
| Hypodermic needles | Tyco Healthcare | 820112 | 20 GA x 1-1/2 A |
| Ice bucket with lid | VWR | 10146-184 | |
| JS-5.3 rotor | Beckman Coulter | 368690 | |
| Magnesium chloride solution (1 M) | Millipore Sigma | M1028-100ML | |
| Metal stand and clamp | Fisherbrand | 05-769-6Q | |
| Microcentrifuge tubes | Eppendorf | 22600028 | 1.5 mL |
| Needle nose pliers | |||
| Optima XE-90 ultracentrifuge | Beckman Coulter | A94471 | |
| Opti-MEM I Reduced-Serum Medium | Gibco | 31985062 | |
| OptiPrep density gradient media (iodixanol) | Serumwerk | AXS-1114542 | 60% iodixanol solution |
| P1000 Pipet | Gilson | F144059M | |
| P2 Pipet | Gilson | F144054M | |
| P20 Pipet | Gilson | F144056M | |
| P200 Pipet | Gilson | F144058M | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | P4474 | |
| Pipet-Aid XP pipette controller | Drummond Scientific | 4-000-101 | |
| Plasmid pCapsid | De novo or Addgene, etc. | N/A | We used pACGrh74. |
| Plasmid pHelper | Addgene | 112867 | |
| Plasmid pTransgene | De novo or Addgene, etc. | N/A | We used pdsAAV-GFP. |
| Pluronic F-68 polyol solution (10%) | Mp Biomedicals | 92750049 | |
| Polyethylene glycol 8000 | Research Products International | P48080-500.0 | |
| Polyethylenimine HCl Max (PEI-Max) | Polysciences | NC1038561 | Dilute in water to 40 μM |
| Polypropylene centrifuge tubes, sterile | Corning | 431123 | 500 mL |
| Polypropylene centrifuge tubes, sterile | Corning | 430776 | 250 mL |
| Polypropylene Optiseal tubes | Beckman Coulter | 361625 | |
| Serological pipettes | Alkali Scientific | SP250-B | 50 mL |
| Serological pipettes | Alkali Scientific | SP225-B | 25 mL |
| Serological pipettes | Alkali Scientific | SP210-B | 10 mL |
| Serological pipettes | Alkali Scientific | SP205-B | 5 mL |
| Shaker flasks | Fisherbrand | PBV1000 | 1 L |
| Shaker flasks | Fisherbrand | PBV50-0 | 500 mL |
| Shaker flasks | Fisherbrand | PBV250 | 250 mL |
| Shaker flasks | Fisherbrand | PBV12-5 | 125 mL |
| Sodium chloride solution (5 M) | Fisher Scientific | NC1752640 | |
| Sterile syringes | Fisherbrand | 14-955-458 | 5 mL |
| Syringe filter | Millipore | SLGV013SL | 0.22 micron |
| Tris-HCl pH 8.5 (1 M) | Kd Medical | RGE3363 | |
| Trypan blue solution | Gibco | 15250061 | |
| Tube rack assembly | Beckman Coulter | 361646 | |
| Tube spacers (x4) | Beckman Coulter | 361669 | |
| Tubing for peristaltic pump | Fisher Scientific | 14190516 | |
| Type 70 Ti fixed-angle titanium rotor | Beckman Coulter | 337922 | |
| Ultra low temperature freezer | Set at -70 °C | ||
| Vivaspin 20 centrifugal concentrator | Sartorius | VS2041 | |
| Water bath | Set at 37 °C |
Referanslar
- Strauss, K. A., et al. Onasemnogene abeparvovec for presymptomatic infants with three copies of SMN2 at risk for spinal muscular atrophy: the Phase III SPR1NT trial. Nat Med. 28 (7), 1390-1397 (2022).
- Fuller-Carter, P. I., Basiri, H., Harvey, A. R., Carvalho, L. S. Focused update on AAV-based gene therapy clinical trials for inherited retinal degeneration. BioDrugs. 34 (6), 763-781 (2020).
- George, L. A., et al. Multiyear factor VIII expression after AAV gene transfer for hemophilia A. N Engl J Med. 385 (21), 1961-1973 (2021).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a vector for gene therapy. Biodrugs. 31 (4), 317-334 (2017).
- Atchison, R. W., Casto, B. C., Hammon, W. M. c. D. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Wu, Z., Yang, H., Colosi, P. Effect of genome size on AAV vector packaging. Mol Ther. 18 (1), 80-86 (2010).
- Samulski, R. J., Muzyczka, N. AAV-mediated gene therapy for research and therapeutic purposes. Annu Rev Virol. 1 (1), 427-451 (2014).
- Zolotukhin, S. Production of recombinant adeno-associated virus vectors. Hum Gene Ther. 16 (5), 551-557 (2005).
- Penaud-Budloo, M., François, A., Clément, N., Ayuso, E. Pharmacology of recombinant adeno-associated virus production. Mol Ther - Methods Clin Dev. 8, 166-180 (2018).
- Costa-Verdera, H., et al. Understanding and Tackling immune responses to adeno-associated viral vectors. Hum Gene Ther. 34 (17-18), 836-852 (2023).
- Ertl, H. C. J. Mitigating serious adverse events in gene therapy with AAV Vectors: Vector dose and immunosuppression. Drugs. 83 (4), 287-298 (2023).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Marsic, D., et al. Vector design tour de force: Integrating combinatorial and rational approaches to derive novel adeno-associated virus variants. Mol Ther. 22 (11), 1900-1909 (2014).
- Grimm, D., Zolotukhin, S. E Pluribus Unum: 50 Years of research, millions of viruses, and one goal-tailored acceleration of AAV evolution. Mol Ther. 23 (12), 1819-1831 (2015).
- Biswas, M., et al. Engineering and in vitro selection of a novel AAV3B variant with high hepatocyte tropism and reduced seroreactivity. Mol Ther - Methods Clin Dev. 19, 347-361 (2020).
- Perabo, L., et al. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol Ther. 8 (1), 151-157 (2003).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free production of laboratory grade AAV and purification by iodixanol density gradient centrifugation. Mol Ther - Methods Clin Dev. 10, 1-7 (2018).
- Chan, C., Harris, K. K., Zolotukhin, S., Keeler, G. D. Rational design of AAV-rh74, AAV3B, and AAV8 with limited liver targeting. Viruses. 15 (11), 2168 (2023).
- Schmidt, O. W., Cooney, M. K., Foy, H. M. Adeno-associated virus in adenovirus type 3 conjunctivitis. Infect Immun. 11 (6), 1362-1370 (1975).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Clark, K. R., Liu, X., Mcgrath, J. P., Johnson, P. R. Highly purified recombinant adeno-associated virus vectors are biologically active and free of detectable helper and wild-type viruses. Hum Gene Ther. 10 (6), 1031-1039 (1999).
- Debelak, D., et al. Cation-exchange high-performance liquid chromatography of recombinant adeno-associated virus type 2. J Chromatogr B Biomed Sci App. 740 (2), 195-202 (2000).
- Burova, E., Ioffe, E. Chromatographic purification of recombinant adenoviral and adeno-associated viral vectors: methods and implications. Gene Ther. 12 (1), S5-S17 (2005).
- Adams, B., Bak, H., Tustian, A. D. Moving from the bench towards a large scale, industrial platform process for adeno-associated viral vector purification. Biotechnol Bioeng. 117 (10), 3199-3211 (2020).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2022).
- Chamberlain, K., Riyad, J. M., Weber, T. Expressing transgenes that exceed the packaging capacity of adeno-associated virus capsids. Hum Gene Ther Methods. 27 (1), 1-12 (2016).
- Green, E. A., Hamaker, N. K., Lee, K. H. Comparison of vector elements and process conditions in transient and stable suspension HEK293 platforms using SARS-CoV-2 receptor binding domain as a model protein. BMC Biotechnol. 23 (1), 7 (2023).
- Erbacher, P., Zou, S., Bettinger, T., Steffan, A. M., Remy, J. S. Chitosan-based vector/DNA complexes for gene delivery: Biophysical characteristics and transfection ability. Pharm Res. 15 (9), 1332-1339 (1998).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Hum Gene Ther. 21 (10), 1251-1257 (2010).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wright, J. F., et al. Identification of factors that contribute to recombinant AAV2 particle aggregation and methods to prevent its occurrence during vector purification and formulation. Mol Ther. 12 (1), 171-178 (2005).
- Gruntman, A. M., et al. Stability and compatibility of recombinant adeno-associated virus under conditions commonly encountered in human gene therapy trials. Hum Gene Ther Methods. 26 (2), 71-76 (2015).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized AAV vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mullard, A. FDA approves first gene therapy for Duchenne muscular dystrophy, despite internal objections. Nat Rev Drug Discov. 22 (8), 610-610 (2023).
- Center for Biologics Evaluation and Research. Approved Cellular and Gene Therapy Products. US Food Drug Adm. , (2023).
- Kang, L., et al. AAV vectors applied to the treatment of CNS disorders: Clinical status and challenges. J Control Release Off J Control Release Soc. 355, 458-473 (2023).
- De Wolf, D., Singh, K., Chuah, M. K., VandenDriessche, T. Hemophilia gene therapy: The end of the beginning. Hum Gene Ther. 34 (17-18), 782-792 (2023).
- Simons, E. J., Trapani, I. The opportunities and challenges of gene therapy for treatment of inherited forms of vision and hearing loss. Hum Gene Ther. 34 (17-18), 808-820 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır