Method Article
Производство суспензионных культур и очистка аденоассоциированного вируса с помощью градиентного центрифугирования с градиентом плотности йодиксанола для применения in vivo
В этой статье
Резюме
Аденоассоциированный вирус получают в культуре суспензионных клеток и очищают центрифугированием с двойным градиентом плотности йодиксанола. Включены шаги по увеличению общего выхода вируса, снижению риска выпадения вируса в осадок и дальнейшей концентрации конечного вирусного продукта. Ожидаемые конечные титры достигают10-12 вирусных частиц/мл и пригодны для доклинического применения in vivo .
Аннотация
Этот протокол описывает получение и очистку рекомбинантного аденоассоциированного вируса (rAAV) с помощью центрифугирования с градиентом плотности йодиксанола, серотип-независимого метода очистки AAV, впервые описанного в 1999 году. Векторы rAAV широко используются в генной терапии для доставки трансгенов к различным типам клеток человека. В данной работе рекомбинантный вирус получают путем трансфекции клеток Expi293 в суспензионной культуре с плазмидами, кодирующими трансген, векторный капсид и аденовирусные гены-хелперы. Центрифугирование с градиентом плотности йодиксанола очищает полные частицы AAV на основе плотности частиц. Кроме того, в эту повсеместную методологию включены три этапа для увеличения общего выхода вируса, снижения риска выпадения осадков из-за загрязнения белков и дальнейшей концентрации конечного вирусного продукта, соответственно: осаждение вирусных частиц из клеточных сред с использованием раствора полиэтиленгликоля (ПЭГ) и хлорида натрия, введение второго раунда центрифугирования с градиентом плотности йодиксанола, и замена буфера через центробежный фильтр. Используя этот метод, можно стабильно достигать титров в диапазоне10-12 вирусных частиц/мл исключительной чистоты для использования in vivo .
Введение
Рекомбинантные аденоассоциированные вирусные векторы (rAAV) являются широко используемыми инструментами для лечения генетических заболеваний, включая спинальную мышечную атрофию, дистрофию сетчатки и гемофилию А 1,2,3. Векторы rAAV спроектированы таким образом, чтобы не иметь вирусных генов, присутствующих в AAV4 дикого типа, небольшом икосаэдрическом вирусе без оболочки с линейным одноцепочечным геномом ДНК размером 4,7 kb. AAV был впервые обнаружен в 1960-х годах в качестве контаминанта аденовирусных препаратов5. Несмотря на небольшой размер капсида, который ограничивает размер трансгена, который может быть упакован максимум до 4,9 кб, исключая РМЭ6, AAV полезен для доставки трансгенов, поскольку он непатогенен для человека, позволяет экспрессировать трансген во многих делящихся и неделящихся типах клеток и имеет ограниченные иммуногенные эффекты7.
Как представители рода dependoparvovirus, продукция rAAV зависит от экспрессии генов-хелперов, присутствующих в аденовирусе или вирусе простого герпеса8. Было разработано несколько стратегий производства rAAV, но продукция в клетках HEK293, трансформированная с помощью аденовирусных генов-хелперов E1A/E1B, является наиболее устоявшимся методом, используемымна сегодняшний день. Общий подход к получению rAAV начинается с трансфекции клеток HEK293 тремя плазмидами, содержащими трансген внутри инвертированных концевых повторов (ITR), генами AAV rep и cap , а также дополнительными аденовирусными генами-хелперами, соответственно. Через семьдесят два часа после трансфекции клетки собирают и обрабатывают для очистки rAAV, содержащего трансген.
При разработке новых векторов rAAV для терапевтических целей основной целью является получение векторов с повышенной эффективностью трансдукции. Повышение эффективности трансдукции клеток-мишеней означало бы снижение необходимой клинической дозы rAAV, тем самым снижая вероятность неблагоприятных иммуногенных эффектов в диапазоне от нейтрализации, опосредованной антителами, до острой токсичности10,11. Для повышения эффективности трансдукции векторов rAAV могут быть внесены изменения в упакованный геном или капсид. Жизнеспособные методы настройки эффективности трансдукции с помощью пакетного дизайна генома включают включение сильных и тканеспецифичных промоторов, тщательный отбор обрабатывающих элементов мРНК и оптимизацию кодирующих последовательностей для повышения эффективности трансляции12. Изменения капсида вносятся с целью увеличения тропизма для целевых типов клеток человека. Усилия по разработке новых капсидов вектора доставки трансгена rAAV, как правило, характеризуются сосредоточением внимания либо на рациональном дизайне капсидов AAV со специфическими мутациями, нацеленными на конкретные клеточные рецепторы, либо на направленной эволюции для идентификации капсидов с тропизмом для конкретных типов клеток из библиотек комбинаторных капсидов высокой сложности без нацеливания на один конкретный рецептор (хотя некоторые группы комбинируют эти подходы)13, 14,15. В подходе направленной эволюции комбинаторные библиотеки капсидов строятся с использованием определенного серотипического остова с мутировавшими вариабельными областями на внешней стороне капсида16. Комбинаторные библиотеки капсидов часто создаются из серотипов AAV, не происходящих от человека, что снижает риск ранее существовавшего иммунитета во время клинического использования10. Таким образом, методы очистки, которые могут быть применены к любому серотипу, идеально подходят для устранения необходимости в серотип-специфичной оптимизации для менее часто используемых серотипов, служащих основой для этих библиотек.
Центрифугирование с градиентом плотности йодиксанола используется для очистки высоких титров rAAV с высокой инфекционностью17. В этом протоколе rAAV производится в культуре суспензионных клеток, чтобы уменьшить количество труда, необходимого для получения больших титров AAV. Этап центрифугирования также включен для очистки клеточного лизата, чтобы уменьшить присутствие загрязняющих белков и снизить риск осаждения вируса. Данный протокол является экономически эффективным методом получения препаратов rAAV высокой чистоты, пригодных для доклинического применения.
протокол
Состав растворов и буферов, используемых в данном протоколе, представлен в таблице 1.
| Решение | Состав | |
| Буфер для лизиса AAV | 1,2 мл 5 М раствора NaCl | |
| 2 мл 1 М раствора Tris-HCl pH 8,5 | ||
| 80 мкл 1 М раствора MgCl2 | ||
| мQ воды до 40 мл | ||
| Осадковый раствор AAV | 40 г ПЭГ 8000 | |
| 50 мл 5 М раствора NaCl | ||
| мQ воды до 100 мл | ||
| 15% йодиксаноловая фракция | 7,5 мл OptiPrep | |
| 3 мл 10X DPBS | ||
| 6 мл 5 М раствора NaCl | ||
| 30 мкл 1 М раствора MgCl2 | ||
| мQ до 30 мл | ||
| 25% йодиксаноловая фракция | 12. 5 мл OptiPrep | |
| 3 мл 10X DPBS | ||
| 30 мкл 1 М раствора MgCl2 | ||
| 60 мкл раствора фенолового красного | ||
| мQ до 30 мл | ||
| 40% йодиксаноловая фракция | 33,3 мл OptiPrep | |
| 5 мл 10X DPBS | ||
| 50 мкл 1 М раствора MgCl2 | ||
| мкQ до 50 мл | ||
| 60% йодиксаноловая фракция | 50 мл OptiPrep | |
| 100 мкл раствора фенолового красного | ||
| Буферный раствор AAV | 8 мл 5 М NaCl | |
| 20 мкл 10% Pluronic F-68 | ||
| PBS до 200 мл | ||
Таблица 1: Составы растворов для растворов, используемых в данном протоколе.
1. Тройная трансфекция клеток Expi293
- Семенные клетки Expi293 (см. Таблицу материалов) при начальной плотности 5 x 105 жизнеспособных клеток (vc)/мл.
- Дайте клеткам инкубироваться при 37 °C с 8%CO2 и скоростью шейкера 125 об/мин до тех пор, пока они не достигнут плотности 3-5 x 10,6 vc/мл. Контролируйте плотность и жизнеспособность клеток с помощью исключения трипанового синего с помощью автоматического счетчика клеток (см. таблицу материалов).
- Когда ячейки достигнут желаемой плотности, разделите их от 1 до 10, добавив свежую среду так, чтобы их общий объем в десять раз превышал исходный объем. При необходимости пересадите клетки в колбу большего размера. Вернитесь к инкубации.
- Продолжайте расширять клетки, как описано в шагах 1.2-1.3, пока они не достигнут плотности не менее 2 x 106 vc/мл в 250 мл среды в колбе объемом 1 л.
- За сутки до трансфекции развести клетки до 2 x 106 vc/мл в 250 мл среды, при необходимости отбрасывая излишки клеток. Инкубируют клетки в течение ночи.
- В день трансфекции центрифугируют половину клеток при 58 x g в течение 5 мин при 18 °C. Ресуспендируйте клеточную гранулу в том же объеме (125 мл) свежей среды. Жизнеспособность клеток должна быть близка к 98%.
- Подготовьте две конические пробирки по 50 мл. Обозначьте один «PEI», а другой «DNA».
- В конической пробирке с маркировкой PEI разбавьте 1,2 мл PEI (полиэтиленимин, см. Таблицу материалов) до общего объема 12,5 мл в среде OptiMEM.
- В конической пробирке, меченной ДНК, готовят эквимолярный раствор плазмидной ДНК с общим количеством 500 мкг ДНК в общем объеме 12,5 мл в среде OptiMEM.
- Добавьте раствор ДНК в раствор PEI, переверните несколько раз, чтобы тщательно перемешать, и дайте инкубироваться при комнатной температуре в течение 10 минут.
ПРИМЕЧАНИЕ: Очень важно, чтобы раствору ДНК-ПЭИ дали инкубироваться в течение полных 10 минут, чтобы ПЭИ сформировал заряженные комплексы с ДНК. - После того, как раствор ДНК-ПЭИ инкубируется в течение 10 мин, используйте серологический пипетку, чтобы медленно нанести раствор ДНК-PEImax на клетки Expi293. Верните трансфицированные клетки в инкубатор и дайте им инкубироваться в течение 72 ч (рисунок 1).

Рисунок 1: Клетки Expi293, экспрессирующие GFP через два дня после трансфекции. После трансфекции плазмидой, содержащей ген GFP, клетки Expi293 временно экспрессируют eGFP. Морфология клеток округлая. Снимок был сделан с выдержкой 15 мс. Изображения под микроскопом получают с помощью инвертированного микроскопа, оснащенного эпифлуоресцентной подсветкой и объективом 10x/0,30. Масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Векторная очистка rAAV
- Через 72 ч переложите клетки в суспензии в две конические пробирки по 250 мл и отжим их при 415 x g в течение 10 мин при 4 °C.
- Налейте надосадочную жидкость в свежую коническую пробирку объемом 500 мл и храните при температуре 0 °C на льду для последующей обработки.
- Ресуспендируйте каждую клеточную гранулу в 10 мл лизисного буфера AAV (Таблица 1). Соедините два лизата вместе в одной из пробирок. Промойте другую пробирку дополнительными 5 мл буфера для лизиса AAV, затем добавьте его к объединенным лизатам. Замораживать при -70 °C.
ПРИМЕЧАНИЕ: На этом эксперимент можно приостановить. Храните надосадочную жидкость при температуре -70 °C, а не на льду. - Добавьте 1:4 объема осадительного раствора AAV в надосадочную жидкость, начиная с шага 2.2. Переверните несколько раз, тщательно перемешайте и выдержите при 0 °C на льду не менее 2 ч или в течение ночи.
- Центрифуцируют инкубированный раствор при 3000 х г в течение 1 ч при 4 °С.
- Выбросьте надосадочную жидкость и повторно суспендируйте гранулу, содержащую вирусный осадок, в 5 мл лизисного буфера AAV.
- Разморозьте клеточный лизат при 37 °C на водяной бане.
- Объедините вирусный осадок с клеточным лизатом. Это сырой лизат. Промойте центрифугированную пробирку, содержащую вирусный осадок, дополнительным 5 мл буфера для лизиса AAV и пул с сырым лизатом.
- Заморозьте сырой лизат до -70 °C, затем разморозьте при 37 °C. Повторите этот цикл еще раз.
ПРИМЕЧАНИЕ: Сырой лизат не следует оставлять при температуре 37 °C дольше, чем необходимо для его оттаивания. - После размораживания в третий раз немедленно добавьте 4 мкл бензоназы к сырому лизату, перемешайте и инкубируйте в течение 30 минут при 37 °C.
- Центрифугают сырой лизат в течение 10 мин при 650 x g при 18 °C.
- Перелейте надосадочную жидкость в чистую коническую пробирку объемом 50 мл. Это сырой вирус. Выбросьте гранулу.
- Центрифугируйте сырой вирус еще в течение 30 минут при 3000 x g при 18 °C, чтобы очистить загрязняющие белки.
- Перелейте надосадочную жидкость в чистую коническую пробирку объемом 50 мл. Это осветленный вирус.
ПРИМЕЧАНИЕ: На этом эксперимент можно приостановить. Заморозьте осветленный вирус до -70 °C. - Установите многоканальный перистальтический насос с четырьмя перистальтическими трубками (см. Таблицу материалов). Прикрепите капилляры к обоим концам каждой трубки.
- Поместите капилляры на входной стороне насоса в стакан, наполненный деионизированной водой. Поместите капилляры на выходной стороне насоса в пустой стакан. Запустите перистальтический насос на 25,0 об/мин, чтобы промыть трубку деионизированной (DI) водой.
- После тщательной промывки опорожните перистальтическую трубку, запуская насос до тех пор, пока трубка не будет заполнена только воздухом. Выложите все капилляры на чистую безворсовую салфетку.
- Поместите четыре ультрацентрифужные пробирки в штатив на выходной стороне насоса.
- Используйте серологическую пипетку объемом 10 мл, чтобы осторожно дозировать 10 мл осветленного вируса в каждую ультрацентрифужную пробирку. Следите за тем, чтобы не появились пузырьки воздуха.
ПРИМЕЧАНИЕ: При необходимости объем осветленного вируса в каждой пробирке может быть увеличен до 12 мл на пробирку. Уменьшите количество йодиксанола на 60% соответствующим образом, выполнив шаг 2.25 ниже. - Осветленный вирус подстилают фракциями йодиксанола (табл. 1) от самой низкой до самой высокой плотности с помощью перистальтического насоса. Сначала добавляется фракция 15%, затем доля 25%, фракция 40% и, наконец, доля 60%. Перелейте 22 мл (5,5 мл на ультрацентрифужную пробирку) 15% йодиксаноловой фракции в чистую коническую пробирку объемом 50 мл. Поместите капилляры на входной стороне насоса в трубку, следя за тем, чтобы все капилляры касались дна трубки.
- Запустите насос и дайте трубке заполнить йодиксанольную фракцию. Когда йодиксанольная фракция достигнет концов капилляров на выходной стороне насоса, остановите насос.
- Вставьте по одному выходному капилляру в каждую пробирку ультрацентрифуги с осветленным вирусом, следя за тем, чтобы капилляры касались дна каждой пробирки ультрацентрифуги.
ПРИМЕЧАНИЕ: Очень важно, чтобы в капиллярах не оставалось воздуха. Йодиксанол может протекать через перистальтическую трубку с немного разной скоростью, поэтому убедитесь, что каждый отдельный выходной капилляр полностью заполнен йодиксанолом, прежде чем вводить его в осветленный вирус. Возможно, потребуется несколько раз останавливать и запускать насос. - Запустите насос и дайте пробиркам ультрацентрифуги заполниться. Когда последняя часть 15%-ной фракции вот-вот войдет во входные капилляры, остановите насос. Очень важно, чтобы пузырьки воздуха не попадали в перистальтическую трубку.
ПРИМЕЧАНИЕ: Если пузырьки воздуха попадают во входные капилляры, насос можно ненадолго запустить в обратном направлении, чтобы вытолкнуть их обратно. - Перелейте 22 мл (5,5 мл на ультрацентрифужную пробирку) 25% йодиксаноловой фракции в коническую пробирку объемом 50 мл. Следите за тем, чтобы все капилляры соприкасались с нижней частью трубки, и запустите насос. Когда последняя часть 25%-ной фракции вот-вот будет взята во входные капилляры, остановите насос.
- Повторите шаг 2.24 с 20 мл (5 мл на ультрацентрифужную пробирку) 40% йодиксаноловой фракции, а затем с 24 мл (6 мл на ультрацентрифужную пробирку) 60% фракции.
- Если в пробирке ультрацентрифуги все еще остается незаполненный объем, продолжайте добавлять еще 60% фракции, пока пробирки ультрацентрифуги не будут полностью заполнены жидкостью.
- Заполняйте каждую пробирку до тех пор, пока лизат не образует купол сверху, но не выльется из пробирки. Остановите насос и осторожно удалите каждый выходной капилляр, стараясь не нарушить градиент йодиксанола.
- Закройте каждую ультрацентрифужную пробирку проставкой и загрузите ее в ротор типа 70 Ti (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Убедитесь, что ротор правильно сбалансирован. Не пытайтесь эксплуатировать ультрацентрифугу без надлежащей подготовки. - Загрузите ротор Type 70 Ti в ультрацентрифугу и центрифугируйте при 489 000 x g в течение 1 ч при 18 °C.
- После центрифугирования выгрузите ротор из ультрацентрифуги. Используйте плоскогубцы с игольчатым наконечником, чтобы осторожно извлечь каждую ультрацентрифужную пробирку из ротора, стараясь не нарушить градиент йодиксанола.
- Используйте подставку с опорным кольцом и зажимом, чтобы закрепить одну ультрацентрифужную пробирку.
- Прикрепите иглу 20 GA к шприцу объемом 5 мл и отложите в сторону. Используйте безворсовую салфетку, чтобы снять колпачок с пробирки ультрацентрифуги.
- Проникните иглой в стенку ультрацентрифужной пробирки примерно на 3 мм ниже границы раздела 40%-60% йодиксанола (рисунок 2).
- Медленно аспирируйте границу раздела и часть 40%-ной фракции. Избегайте аспирации верхней части 40%-ной фракции, чтобы общее количество вытягивалось около 4 мл.
- Удерживая палец над открытой верхней частью пробирки ультрацентрифуги, вытащите шприц и перенесите аспирированную фракцию AAV в коническую пробирку объемом 50 мл. Выбросьте шприц в контейнер для острых предметов. Выбросьте ультрацентрифужную пробирку.
- Повторите шаги 2.31-2.35 для каждой ультрацентрифужной пробирки.
- Разбавьте отсасываемую фракцию AAV примерно в два раза в лизисном буфере AAV до объема 40 мл.
- Промойте перистальтическую трубку, как описано в шагах 2.16-2.17.
ПРИМЕЧАНИЕ: На этом эксперимент можно приостановить. Разбавленную фракцию AAV хранить при температуре 0 °C в течение ночи. - Загрузите по 20 мл разбавленной фракции AAV в две новые ультрацентрифужные пробирки.
- Для второго раунда центрифугирования с градиентом плотности йодиксанола разбавленная фракция AAV подкладывается, как описано выше, с использованием всего 10 мл (5 мл на ультрацентрифужную пробирку) 40%-ной фракции и 14 мл (7 мл на ультрацентрифужную пробирку) 60%-ной фракции. Повторите шаги 2.29-2.36 для ультрацентрифугирования и аспирации.
ПРИМЕЧАНИЕ: Перед хранением перистальтического насоса и трубок промойте трубки дедистрированной водой, как описано в шагах 2.16-2.17.

Рисунок 2: Градиент йодиксанола с меткой 40%-60% йодиксанола. (А) Первый градиент йодиксанола. Феноловый красный используется в 40% йодиксаноловой и 60% йодиксаноловой фракциях. Он выглядит как разный цвет из-за разницы в pH между двумя фракциями. Стрелка указывает, куда следует вставить шприц для сбора фракции rAAV, чуть ниже границы раздела 40%-60% йодиксанола. (Б) Второй градиент йодиксанола. На этом этапе используются только 40% и 60% фракции йодиксанола. Стрелка указывает, куда следует вставить шприц для сбора фракции rAAV. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Буферный обмен и концентрация вирусов
- После получения фракции AAV из второго раунда центрифугирования с градиентом плотности йодиксанола разбавляют ее в два раза буферным раствором AAV.
- Уравновесите центробежный фильтр, добавив 20 мл буферного раствора AAV в верхнюю часть фильтра. Центрифуйте аппарат при 3000 x g при 18 °C в течение 5 минут и выбросьте протекающий поток.
- Добавьте разбавленную фракцию AAV в центробежный фильтр. Центрифуйте аппарат при 3000 x g при 18 °C в течение 5 минут и выбросьте протекающий поток.
- Добавьте 20 мл буферного раствора AAV в верхнюю часть фильтра. Центрифуйте аппарат при 3000 x g при 18 °C в течение 5 минут и выбросьте протекающий поток.
ПРИМЕЧАНИЕ: Если мембрана центробежного фильтра засоряется, что приводит к неэффективному прохождению раствора, осторожно используйте микропипетку P200 для всасывания раствора вверх и вниз в верхней части фильтра. Будьте предельно осторожны, не прикасайтесь к фильтру наконечником микропипетки. - Повторите шаг 3.4 еще дважды.
ПРИМЕЧАНИЕ: Следите за тем, чтобы AAV не был чрезмерно концентрирован, поддерживая объем не менее 1 мл в верхней части фильтра. Возможно, потребуется отрегулировать время центрифугирования, чтобы предотвратить чрезмерную концентрацию. При чрезмерной концентрации AAV могут выпасть осадки. - Для получения конечного титра в диапазоне от 10до 12 vg/мл раскрутите вирус до конечного объема около 1 мл.
ПРИМЕЧАНИЕ: В зависимости от используемого серотипа и эффективности упаковки вируса вам, возможно, придется сконцентрировать вирус в меньшем объеме. - Используйте микропипетку p1000 для переноса концентрированного AAV из верхней части центробежного фильтра в микроцентрифужную пробирку. С помощью микропипетки p200 промойте центробежный фильтр 50 мкл буфера AAV, чтобы собрать оставшийся вирус и объединить его с остальной частью концентрированного AAV.
- Отложите 2 мкл аликвоты концентрированного AAV для титрования. В Дополнительной таблице 1 приведены праймеры ITR, которые можно использовать для кПЦР.
- Пропустите концентрированный AAV через шприцевой фильтр 0,2 мкм, чтобы стерилизовать его.
ПРИМЕЧАНИЕ: При стерилизации небольшого объема позаботьтесь о том, чтобы выбрать шприцевой фильтр небольшого диаметра, чтобы свести к минимуму потерю вируса. Использование фильтра с низким содержанием белка малого диаметра приведет к минимальной потере вируса (данные не показаны). - Стерилизованный AAV можно использовать сразу для трансдукции клеток или хранить при температуре 4 °C для использования в течение четырех недель. Его следует хранить при температуре -70 °C для более длительного хранения.
Результаты
Этот метод может быть использован для получения титров не менее10-12 вирусных частиц на мл. Титр может быть получен (Рисунок 3) методом кПЦР с использованием праймеров ITR, приведенных в Дополнительной таблице 1, методом ddPCR или любым другим методом титрования. Субоптимальные титры могут быть результатом использования гена cap , кодирующего капсид с низкой эффективностью упаковки.
Другим возможным источником неоптимальных результатов является низкая эффективность трансдукции клеток Expi293. Рекомендуется иметь клетки с плотностью 3-4 x 10,6 vc/мл в день трансфекции и чтобы жизнеспособность клеток была близка к 98%. В настоящем исследовании авторы получили титр 1,07 x 1012 vg по этому протоколу. Этот выход соответствует предыдущим показателям, полученным при упаковке AAVrh7418.
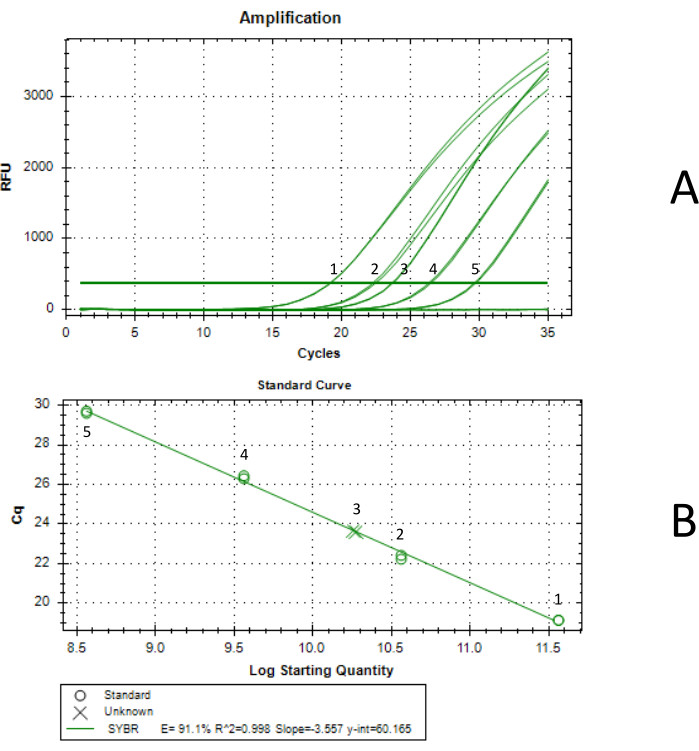
Рисунок 3: Определение титра методом кПЦР. Кривая 1 была сгенерирована со стандартной концентрацией 3,66 x 1011 vg/мл, кривая 2 была сгенерирована со стандартной концентрацией 3,66 x 1010 vg/мл, кривая 3 была окончательной концентрированной пробой AAV, кривая 4 была сгенерирована со стандартной концентрацией 3,66 x 109 vg/мл, а кривая 5 была сгенерирована со стандартной концентрацией 3,66 x 108 vg/мл. Каждую реакцию кПЦР проводили в двух экземплярах. (А) кривая амплификации кПЦР. Стандарты были получены путем последовательного разведения стандарта AAV, титрованного методом ddPCR. Концентрация неразбавленного стандарта составила 3,66 x 1012 vg/мл. (B) Стандартная кривая, полученная методом кПЦР. Было определено, что полученный AAV имеет концентрацию 1,85 x 1011 vg/мл в 5,75 мл, что дает общий выход 1,07 x 1012 vg. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Дополнительная таблица 1: Прямые и обратные последовательности праймеров для инвертированных концевых повторов (ITR) AAV. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Протокол очистки с двойным градиентом плотности йодиксанола является универсальным методом, поскольку он применим к любым мутантным вариантам AAV, независимо от их рецепторной специфичности. Ранние методы очистки AAV основывались на плотности частиц и включали изопикническое центрифугирование в CsCl и непрерывное центрифугирование с градиентом плотности сахарозы19. В дальнейшем были разработаны серотип-специфичные подходы, в которых использовались моноклональные антитела, связанные со столбиками сефарозы20. В 1999 г. был разработан новый метод очистки на основе плотности с использованием прерывистого градиента йодиксанола, в результате которого были получены изоляты AAV с более высокой инфекционностью, чем те, которые были выделены из градиентов CsCl21. Методы очистки AAV продолжали разрабатываться до начала 2000-х годов, поскольку некоторые группы использовали высокоэффективную жидкостную хроматографию для очистки rAAV с извлечением сырого лизата более 70%22,23,24. Эти методы до сих пор используются в крупномасштабных производственных процессах25. Несмотря на развитие хроматографических методов выделения AAV, очистка с помощью центрифугирования с градиентом плотности йодиксанола по-прежнему широко применяется из-за его более низкой стоимости и серотиповой агностицизма26,27.
Несмотря на то, что этот метод хорошо подходит для эффективного по времени доклинического производства rAAV, он очень ограничен в своей масштабируемости и возможности адаптации к производству в соответствии с требованиями надлежащей производственной практики (cGMP)25. Таким образом, как описано выше, для крупносерийного производства предпочтительны другие методы очистки. Кроме того, трансгенная емкость векторов rAAV ограничена. Было обнаружено, что предельный размер генома AAV, который может быть упакован в неповрежденном виде, составляет около 5,2 kb, при максимальном размере трансгена 4,9 kb, с учетом ITR6. Это усложняет экспрессию белков, кДНК которых превышает эту способность. Эти белки не могут экспрессироваться описанной здесь системой без модификации самого трансгена или использования системы расщепленных векторов. Чемберлен и др. описывают несколько методов экспрессии трансгенов размером более 4,9 kb28.
Этот метод особенно полезен для создания комбинаторных библиотек капсидов высокой сложности, содержащих капсиды AAV с различными биохимическими свойствами из-за мутаций, присутствующих на поверхности капсида. Если препарат rAAV предназначен для инъекций животным, особенно нечеловекообразным приматам, крайне важно ограничить контаминацию эндотоксинами. Необходимо уделять большое внимание отделению участков, используемых для выращивания бактериальных культур, от производства rAAV, чтобы предотвратить бактериальное загрязнение на всех этапах. Все работы с человеческими клетками и сырым AAV выполняйте в шкафу биобезопасности с использованием одноразовой пластиковой посуды. Это предотвращает бактериальное загрязнение и является необходимостью для работы с AAV, так как он является агентом BSL1.
Если лаборатория не имеет доступа к инкубаторуСО2 с шейкером, вместо культуры суспензии суспензии клеток Expi293 можно использовать адгезивную клеточную культуру с клетками HEK293. Следуйте инструкциям производителя по субкультуре и используйте протокол трансфекции, описанный в Crosson et al., 201817.
Важнейшими этапами в этом протоколе являются трансфекция Expi293, приготовление градиента йодиксанола и аспирация йодиксанольной фракции, содержащей AAV. Ошибки на любом из этих этапов могут привести к неоптимальному выходу rAAV или сбою в создании rAAV.
Трансфекция клеток Expi293 является критическим этапом в производстве rAAV с использованием этого протокола. В день трансфекции клетки ресуспендируют в половинном объеме свежей среды, чтобы обеспечить их питательными веществами, необходимыми для восстановления после трансфекции29; Трансфекция является очень трудоемким процессом для клеток. Тем не менее, кондиционированная среда не полностью отбрасывается, потому что она содержит факторы роста и другие метаболиты, важные для поддержания и роста клеток. Крайне важно, чтобы ПЭИ и ДНК инкубировались в течение полных десяти минут, прежде чем их наносили на клетки, чтобы сформировать заряженный комплекс30. Без образования комплекса с ПЭИ ДНК не будет эффективно поглощаться клетками.
При продуцировании rAAV доля вируса, обнаруженного в среде, зависит от взаимодействия конкретного серотипа с клеточными рецепторами Expi293. Некоторые серотипы высвобождаются в клеточную среду с большей скоростью, чемдругие31, что требует осаждения вирусных частиц из клеточной среды для захвата максимально возможного выхода и предотвращения потери любых вариантов, основанных на отсутствии сродства к клеточным рецепторам Expi293. Напротив, серотип AAV2 имеет сильное рецепторное взаимодействие с протеогликанами гепарансульфата, присутствующими в 293 клетках, поэтому в среде обнаруживается очень мало упакованного вируса32. При производстве производной AAV2 опустите стадию осаждения PEG. Для получения комбинаторных библиотек капсидов или rAAV альтернативных серотипов целесообразно осаждение вирусных частиц с помощью ПЭГ.
Крайне важно, чтобы 1 М хлорид натрия присутствовал в 15%-ной фракции йодиксанола для диссоциации агрегированных частиц AAV во время ультрацентрифугирования. Отсутствие NaCl в этой фракции может привести к нежелательным результатам, таким как снижение эффективности трансдукции и иммуногенности33. Наконец, будьте очень осторожны при аспирации AAV из градиента йодиксанола. Аспирация слишком большого количества йодиксаноловой фракции может привести к присутствию пустых капсидов в конечном продукте17.
Этот метод может быть использован для упаковки комбинаторных библиотек капсидов rAAV для использования в экспериментах по нисходящей эволюции для выявления капсидов с более высоким тропизмом для определенных типов клеток человека. rAAV стабилен при 4 °C при кратковременном использовании и при -70 °C при длительном хранении34. В настоящее время рекомбинантный AAV используется в пяти одобренных FDA препаратах для лечения заболеваний, включая мышечную дистрофию Дюшенна 35,36,37. В клинических и доклинических исследованиях есть несколько дополнительных методов лечения rAAV 38,39,40. Таким образом, дальнейшие исследования этого вектора имеют решающее значение для разработки дополнительных методов генной терапии.
Раскрытие информации
Авторы не раскрывают информацию, о которой они могли бы сообщить.
Благодарности
Никакой.
Материалы
| Name | Company | Catalog Number | Comments |
| 5810 R benchtop centrifuge | Eppendorf | 22625501 | |
| 8-channel peristaltic pump | Watson-Marlow | 020.3708.00A | |
| Automated cell counter | NanoEntek | EVE-MC | |
| Avanti J-E high-speed centrifuge | Beckman Coulter | 369001 | |
| Benzonase | Thermo Scientific | 88701 | |
| Biological safety cabinet | Labconco | 322491101 | |
| CO2 incubator with shaker | Set at 8% CO2 and 37 °C | ||
| Conical centrifuge tubes | Thermo Scientific | 339652 | 50 mL |
| Conical centrifuge tubes | Thermo Scientific | 339650 | 15 mL |
| Disposable micro-pipets | Fisherbrand | 21-164-2G | Capillaries |
| Dulbecco's phosphate buffered saline without CaCl2 and MgCl2 (DPBS) (10x) | Sigma-Aldrich | D1408 | |
| ECLIPSE Ts2R-FL inverted microscope | Nikon | ||
| Expi293 Expression Medium | Gibco | A1435101 | |
| Expi293F cells | Gibco | A14527 | |
| Filter tips | USA Scientific | 1126-7810 | 1000 µL |
| Filter tips | USA Scientific | 1120-8810 | 200 µL |
| Filter tips | USA Scientific | 1120-1810 | 20 µL |
| Filter tips | USA Scientific | 1121-3810 | 10 µL |
| Hypodermic needles | Tyco Healthcare | 820112 | 20 GA x 1-1/2 A |
| Ice bucket with lid | VWR | 10146-184 | |
| JS-5.3 rotor | Beckman Coulter | 368690 | |
| Magnesium chloride solution (1 M) | Millipore Sigma | M1028-100ML | |
| Metal stand and clamp | Fisherbrand | 05-769-6Q | |
| Microcentrifuge tubes | Eppendorf | 22600028 | 1.5 mL |
| Needle nose pliers | |||
| Optima XE-90 ultracentrifuge | Beckman Coulter | A94471 | |
| Opti-MEM I Reduced-Serum Medium | Gibco | 31985062 | |
| OptiPrep density gradient media (iodixanol) | Serumwerk | AXS-1114542 | 60% iodixanol solution |
| P1000 Pipet | Gilson | F144059M | |
| P2 Pipet | Gilson | F144054M | |
| P20 Pipet | Gilson | F144056M | |
| P200 Pipet | Gilson | F144058M | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich | P4474 | |
| Pipet-Aid XP pipette controller | Drummond Scientific | 4-000-101 | |
| Plasmid pCapsid | De novo or Addgene, etc. | N/A | We used pACGrh74. |
| Plasmid pHelper | Addgene | 112867 | |
| Plasmid pTransgene | De novo or Addgene, etc. | N/A | We used pdsAAV-GFP. |
| Pluronic F-68 polyol solution (10%) | Mp Biomedicals | 92750049 | |
| Polyethylene glycol 8000 | Research Products International | P48080-500.0 | |
| Polyethylenimine HCl Max (PEI-Max) | Polysciences | NC1038561 | Dilute in water to 40 μM |
| Polypropylene centrifuge tubes, sterile | Corning | 431123 | 500 mL |
| Polypropylene centrifuge tubes, sterile | Corning | 430776 | 250 mL |
| Polypropylene Optiseal tubes | Beckman Coulter | 361625 | |
| Serological pipettes | Alkali Scientific | SP250-B | 50 mL |
| Serological pipettes | Alkali Scientific | SP225-B | 25 mL |
| Serological pipettes | Alkali Scientific | SP210-B | 10 mL |
| Serological pipettes | Alkali Scientific | SP205-B | 5 mL |
| Shaker flasks | Fisherbrand | PBV1000 | 1 L |
| Shaker flasks | Fisherbrand | PBV50-0 | 500 mL |
| Shaker flasks | Fisherbrand | PBV250 | 250 mL |
| Shaker flasks | Fisherbrand | PBV12-5 | 125 mL |
| Sodium chloride solution (5 M) | Fisher Scientific | NC1752640 | |
| Sterile syringes | Fisherbrand | 14-955-458 | 5 mL |
| Syringe filter | Millipore | SLGV013SL | 0.22 micron |
| Tris-HCl pH 8.5 (1 M) | Kd Medical | RGE3363 | |
| Trypan blue solution | Gibco | 15250061 | |
| Tube rack assembly | Beckman Coulter | 361646 | |
| Tube spacers (x4) | Beckman Coulter | 361669 | |
| Tubing for peristaltic pump | Fisher Scientific | 14190516 | |
| Type 70 Ti fixed-angle titanium rotor | Beckman Coulter | 337922 | |
| Ultra low temperature freezer | Set at -70 °C | ||
| Vivaspin 20 centrifugal concentrator | Sartorius | VS2041 | |
| Water bath | Set at 37 °C |
Ссылки
- Strauss, K. A., et al. Onasemnogene abeparvovec for presymptomatic infants with three copies of SMN2 at risk for spinal muscular atrophy: the Phase III SPR1NT trial. Nat Med. 28 (7), 1390-1397 (2022).
- Fuller-Carter, P. I., Basiri, H., Harvey, A. R., Carvalho, L. S. Focused update on AAV-based gene therapy clinical trials for inherited retinal degeneration. BioDrugs. 34 (6), 763-781 (2020).
- George, L. A., et al. Multiyear factor VIII expression after AAV gene transfer for hemophilia A. N Engl J Med. 385 (21), 1961-1973 (2021).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-Associated Virus (AAV) as a vector for gene therapy. Biodrugs. 31 (4), 317-334 (2017).
- Atchison, R. W., Casto, B. C., Hammon, W. M. c. D. Adenovirus-associated defective virus particles. Science. 149 (3685), 754-756 (1965).
- Wu, Z., Yang, H., Colosi, P. Effect of genome size on AAV vector packaging. Mol Ther. 18 (1), 80-86 (2010).
- Samulski, R. J., Muzyczka, N. AAV-mediated gene therapy for research and therapeutic purposes. Annu Rev Virol. 1 (1), 427-451 (2014).
- Zolotukhin, S. Production of recombinant adeno-associated virus vectors. Hum Gene Ther. 16 (5), 551-557 (2005).
- Penaud-Budloo, M., François, A., Clément, N., Ayuso, E. Pharmacology of recombinant adeno-associated virus production. Mol Ther - Methods Clin Dev. 8, 166-180 (2018).
- Costa-Verdera, H., et al. Understanding and Tackling immune responses to adeno-associated viral vectors. Hum Gene Ther. 34 (17-18), 836-852 (2023).
- Ertl, H. C. J. Mitigating serious adverse events in gene therapy with AAV Vectors: Vector dose and immunosuppression. Drugs. 83 (4), 287-298 (2023).
- Pupo, A., et al. AAV vectors: The Rubik's cube of human gene therapy. Mol Ther. 30 (12), 3515-3541 (2022).
- Marsic, D., et al. Vector design tour de force: Integrating combinatorial and rational approaches to derive novel adeno-associated virus variants. Mol Ther. 22 (11), 1900-1909 (2014).
- Grimm, D., Zolotukhin, S. E Pluribus Unum: 50 Years of research, millions of viruses, and one goal-tailored acceleration of AAV evolution. Mol Ther. 23 (12), 1819-1831 (2015).
- Biswas, M., et al. Engineering and in vitro selection of a novel AAV3B variant with high hepatocyte tropism and reduced seroreactivity. Mol Ther - Methods Clin Dev. 19, 347-361 (2020).
- Perabo, L., et al. In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol Ther. 8 (1), 151-157 (2003).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free production of laboratory grade AAV and purification by iodixanol density gradient centrifugation. Mol Ther - Methods Clin Dev. 10, 1-7 (2018).
- Chan, C., Harris, K. K., Zolotukhin, S., Keeler, G. D. Rational design of AAV-rh74, AAV3B, and AAV8 with limited liver targeting. Viruses. 15 (11), 2168 (2023).
- Schmidt, O. W., Cooney, M. K., Foy, H. M. Adeno-associated virus in adenovirus type 3 conjunctivitis. Infect Immun. 11 (6), 1362-1370 (1975).
- Grimm, D., Kern, A., Rittner, K., Kleinschmidt, J. A. Novel tools for production and purification of recombinant adenoassociated virus vectors. Hum Gene Ther. 9 (18), 2745-2760 (1998).
- Zolotukhin, S., et al. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 6 (6), 973-985 (1999).
- Clark, K. R., Liu, X., Mcgrath, J. P., Johnson, P. R. Highly purified recombinant adeno-associated virus vectors are biologically active and free of detectable helper and wild-type viruses. Hum Gene Ther. 10 (6), 1031-1039 (1999).
- Debelak, D., et al. Cation-exchange high-performance liquid chromatography of recombinant adeno-associated virus type 2. J Chromatogr B Biomed Sci App. 740 (2), 195-202 (2000).
- Burova, E., Ioffe, E. Chromatographic purification of recombinant adenoviral and adeno-associated viral vectors: methods and implications. Gene Ther. 12 (1), S5-S17 (2005).
- Adams, B., Bak, H., Tustian, A. D. Moving from the bench towards a large scale, industrial platform process for adeno-associated viral vector purification. Biotechnol Bioeng. 117 (10), 3199-3211 (2020).
- Grieger, J. C., Choi, V. W., Samulski, R. J. Production and characterization of adeno-associated viral vectors. Nat Protoc. 1 (3), 1412-1428 (2006).
- Florea, M., et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 28, 146-159 (2022).
- Chamberlain, K., Riyad, J. M., Weber, T. Expressing transgenes that exceed the packaging capacity of adeno-associated virus capsids. Hum Gene Ther Methods. 27 (1), 1-12 (2016).
- Green, E. A., Hamaker, N. K., Lee, K. H. Comparison of vector elements and process conditions in transient and stable suspension HEK293 platforms using SARS-CoV-2 receptor binding domain as a model protein. BMC Biotechnol. 23 (1), 7 (2023).
- Erbacher, P., Zou, S., Bettinger, T., Steffan, A. M., Remy, J. S. Chitosan-based vector/DNA complexes for gene delivery: Biophysical characteristics and transfection ability. Pharm Res. 15 (9), 1332-1339 (1998).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Hum Gene Ther. 21 (10), 1251-1257 (2010).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol. 72 (2), 1438-1445 (1998).
- Wright, J. F., et al. Identification of factors that contribute to recombinant AAV2 particle aggregation and methods to prevent its occurrence during vector purification and formulation. Mol Ther. 12 (1), 171-178 (2005).
- Gruntman, A. M., et al. Stability and compatibility of recombinant adeno-associated virus under conditions commonly encountered in human gene therapy trials. Hum Gene Ther Methods. 26 (2), 71-76 (2015).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized AAV vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mullard, A. FDA approves first gene therapy for Duchenne muscular dystrophy, despite internal objections. Nat Rev Drug Discov. 22 (8), 610-610 (2023).
- Center for Biologics Evaluation and Research. Approved Cellular and Gene Therapy Products. US Food Drug Adm. , (2023).
- Kang, L., et al. AAV vectors applied to the treatment of CNS disorders: Clinical status and challenges. J Control Release Off J Control Release Soc. 355, 458-473 (2023).
- De Wolf, D., Singh, K., Chuah, M. K., VandenDriessche, T. Hemophilia gene therapy: The end of the beginning. Hum Gene Ther. 34 (17-18), 782-792 (2023).
- Simons, E. J., Trapani, I. The opportunities and challenges of gene therapy for treatment of inherited forms of vision and hearing loss. Hum Gene Ther. 34 (17-18), 808-820 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены