Method Article
İn Vitro Periferik Sinir Rejenerasyonu için Nanosaniye Darbeli Elektrik Alanı ile Schwann Hücre Büyümesinin Düzenlenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, Schwann hücrelerini in vitro olarak uyarmak için nanosaniye darbeli elektrik alanı (nsPEF) uygulamak için bir protokol sunuyoruz. İlgili faktörlerin ve hücre davranışı değişikliklerinin sentezi ve salgılanma yeteneği, nsPOF kullanılarak başarılı stimülasyonu doğruladı. Çalışma, periferik sinir rejenerasyon yönteminin olumlu bir görünümünü vermektedir.
Özet
Schwann hücreleri (SK'ler), periferik sinir sisteminin miyelinli hücreleridir ve periferik sinir rejenerasyonunda çok önemli bir rol oynarlar. Nanosaniye Darbe Elektrik Alanı (nsPEF), hücre proliferasyonunu ve diğer biyolojik süreçleri uyarmada etkili olduğu gösterilmiş, sinir elektriksel stimülasyonunda uygulanabilir yeni ortaya çıkan bir yöntemdir. SK'lerin nsPEF altında önemli değişikliklere uğrayıp uğramadığını değerlendirmek ve yeni periferik sinir rejenerasyon yöntemlerinin potansiyelini keşfetmeye yardımcı olmak amacıyla, kültürlenmiş RSC96 hücreleri 5 kV ve 10 kV'de nsPEF stimülasyonuna tabi tutuldu ve ardından 3-4 gün boyunca ekintiye devam edildi. Daha sonra, spesifik belirteç proteini, nörotrofik faktör, transkripsiyon faktörü ve miyelinasyon regülatörü dahil olmak üzere başarılı stimülasyonu göstermek için SK'ler tarafından ifade edilen bazı ilgili faktörler değerlendirildi. Temsili sonuçlar, nsPEF'in SK'lerin proliferasyonunu ve göçünü ve periferik sinirlerin rejenerasyonuna olumlu katkıda bulunan ilgili faktörleri sentezleme yeteneğini önemli ölçüde artırdığını gösterdi. Aynı zamanda, GFAP'ın daha düşük ekspresyonu periferik sinir yaralanmalarının benign prognozunu gösterdi. Tüm bu sonuçlar, nsPEF'in SK'leri uyararak periferik sinir yaralanmaları için etkili bir tedavi yöntemi olarak büyük bir potansiyele sahip olduğunu göstermektedir.
Giriş
Her yıl milyonlarca insan hem periferik sinir sistemini (PNS) hem de merkezi sinir sistemini (CNS) içeren sinir yaralanmalarından etkilenmektedir1. Çalışmalar, sinir yaralanmalarından sonra CNS'nin aksonal onarım kapasitesinin oldukça sınırlı olduğunu, PNS'nin ise SC'lerin2'nin önemli plastisitesi nedeniyle artmış kapasite gösterdiğini göstermiştir. Bununla birlikte, periferik sinir yaralanmalarından sonra tam rejenerasyonun sağlanması zorlu olmaya devam etmekte ve insan sağlığı için önemli bir zorluk teşkil etmeye devam etmektedir 3,4. Günümüzde, otogreftler, donör bölge morbiditesinin dezavantajlarına ve sınırlı kullanılabilirliğe rağmen yaygın bir tedavi olmaya devam etmektedir5. Bu durum, araştırmacıları malzeme6, moleküler faktörler7 ve elektriksel stimülasyon (ES) dahil olmak üzere alternatif tedavileri keşfetmeye sevk etti. Aksonal büyümeyi ve sinir rejenerasyonunuteşvik eden bir faktör olarak8, uygun bir ES yönteminin seçilmesi ve ES ile SK'ler arasındaki ilişkinin araştırılması zorunlu hale gelmektedir.
SK'ler, PNS'nin ana glial hücreleridir ve PNS 9,10'un rejenerasyonunda çok önemli bir rol oynar. Periferik sinir yaralanmalarını takiben, SK'ler hızlı aktivasyona, kapsamlı yeniden programlamaya2 ve sinirinrejenerasyonunu gerçekleştirmek için miyelin oluşturan bir durumdan büyümeyi destekleyici bir morfolojiye geçiş yapar 2. Yaralı sinirin distal ucunda önemli bir SK proliferasyonu meydana gelirken, distal güdük SK'leri, aksonların hedef organa doğru büyümesine rehberlik etmek için gerekli olan Bungner bandını oluşturmak için proliferasyon ve uzamaya uğrar11. Ayrıca, proksimal ve distal sinir güdüklerinden gelen SK'ler, akson rejenerasyonunu destekleyen SC kordonları oluşturmak için sinir köprüsüne göç eder12. Ayrıca, önceki çalışmalar, transkriptiyonel faktörler 13, nörotrofik faktörler14 ve miyelinasyon düzenleyicileri13 dahil olmak üzere periferik sinir rejenerasyonu vakalarında SK'lerle ilgili ilgili faktörlerin sentezi ve sekresyonunundeğiştiğini göstermiştir. Bu aynı zamanda SK'lerin aktivitesini değerlendirmek için göstergeler sağlar. Bunlara dayanarak, periferik sinir rejenerasyonunu iyileştirmek için SK proliferasyonunun, migrasyonunun, sentezinin ve ilgili faktörlerin salgılanmasının teşvik edilmesi kapsamlı bir şekilde araştırılmıştır15.
Önceki çalışmalar, sinir rejenerasyonu için ES'nin kullanılma olasılığını göstermiştir1. Yaygın olarak kabul edilen bir açıklama, ES'nin hücre zarlarının depolarizasyonunu indükleyebileceği, zar potansiyelini değiştirebileceği ve bu biyomoleküller üzerindeki yük dağılımlarını değiştirerek zar protein fonksiyonlarını etkileyebileceğidir1. Bununla birlikte, yaygın olarak uygulanan Yoğun PEF şiddetli ağrıya, istemsiz kas kasılmalarına ve kalp fibrilasyonuna neden olabilir8. Aynı zamanda kreatin kinaz (CK) aktivitesini arttırır, kas gücünü azaltır ve gecikmiş başlangıçlı kas ağrısı (DOMS) gelişimini indükler16. nsPEF, nanosaniye darbe süresi içinde yüksek voltajlı elektrik alanlarına sahip test deneklerini uyaran gelişmekte olan bir tekniktir ve hücresel düzeydeki araştırmalarda kademeli olarak kullanılmaktadır17,18. Önceki çalışmalar, hücre proliferasyonunu ve organel aktivitesini teşvik eden nsPEF'in olası mantığının, zar nanogözeneklerinin oluşumu ve iyonik kanalların aktivasyonu olduğunu ve bunun da sitoplazmikCa2+ konsantrasyonunda bir artışa yol açtığınıbildirmiştir 19. nsPEF, hücre zarını şarj etmek için darbe gücü teknolojisini kullanır ve kısa süre, hızlı yükselme süresi, yüksek güç ve düşük enerji yoğunluğu20 ile karakterize edilen darbeler üretir. Bu özellikler, nsPEF'in minimum stimülasyon yan etkileri ile tercih edilen bir mod olabileceğini düşündürmektedir8. Ayrıca nsPEF, cerrahi girişimlere göre minimal invaziv işlemler, geri dönüşümlülük, ayarlanabilirlik ve nöral dokulara tahribatsızlık gibi avantajlar sunmaktadır. nsPEF'in biyomedikal alandaki ana araştırma yönlerinden biri, yüksek enerjili elektrik alan stimülasyonu 21,22,23 kullanılarak tümör dokusu ablasyonu için uygulanmasıdır. Bazı araştırma sonuçları, 12-nsPEF'in periferik sinirleri hasara neden olmadan uyarabildiğini göstermektedir24. Bununla birlikte, şu anda, sinir rejenerasyonu alanında nsPEF'in uygulanmasına ilişkin sınırlı kanıt bulunmaktadır. Ayrıca, nsPEF kullanarak SK'leri uyarmak, in vivo ve klinik araştırmaların ilerlemesine katkıda bulunan öncü bir girişimdir. Bu çalışma, SK'lerin nsPEF stimülasyonunun sinir rejenerasyonunu teşvik edip edemeyeceğini ve sonraki derinlemesine ve sistematik araştırmalar için güvenilir bir temel sağlayıp sağlayamayacağını araştırmaktadır.
Protokol
1. Dondurularak saklanmış RSC96 hücrelerinin çözülmesi
- 1 mL hücre süspansiyonu içeren kriyoviyalı 37 °C'lik bir su banyosunda hızla çalkalayarak çözün ve ardından 4-6 mL tam kültür ortamı içeren bir santrifüj tüpüne ekleyin ve iyice karıştırın.
- 3-5 dakika boyunca 1000 x g'da santrifüjleyin, süpernatanı atın ve hücreleri 3 mL tam kültür ortamında yeniden süspanse edin.
- Hücre süspansiyonunu 6-8 mL tam kültür ortamı içeren bir kültür şişesine (veya kabına) ekleyin ve gece boyunca 37 ° C'de inkübe edin.
- Ertesi gün, mikroskop altında hücre büyümesini ve yoğunluğunu gözlemleyin.
2. Hücre geçişi:
NOT: Hücre yoğunluğu %80-%90'a ulaşırsa geçişe hazırdır.
- Kültür ortamını atın ve hücreleri kalsiyum ve magnezyum iyonları içermeyen fosfat tamponlu salin (PBS) ile 1-2 kez durulayın.
- Kültür şişesine% 0.25 (a / h) tripsin-0.53 mM EDTA ekleyin (bir T25 şişesi için 1-2 mL, bir T75 şişesi için 2-3 mL) ve 37 ° C'de 1-2 dakika inkübe edin.
- Mikroskop altında hücre ayrılmasını gözlemleyin. Hücrelerin çoğu yuvarlaklaşır ve ayrılırsa, şişeyi hızlı bir şekilde çalışma alanına geri koyun, şişeye hafifçe vurun ve sindirimi durdurmak için% 10 FBS içeren 3-4 mL kültür ortamı ekleyin.
- İçeriği karıştırın, çözeltiyi aspire edin ve 1000 x g'da 5 dakika santrifüjleyin. Ardından, süpernatanı atın ve 1-2 mL taze kültür ortamı ekleyerek ve hafifçe pipetleyerek hücreleri yeniden süspanse edin.
- Hücre süspansiyonunu 1: 2 oranında yeni bir T25 şişesine aktarın ve 7 mL kültür ortamı ekleyin.
3. nsPEF cihazının çalışması
- RSC96 hücrelerini 1 mL DMEM kültür ortamında yeniden süspanse edin ve her iki tarafta elektrotlar bulunan kolorimetrik çanaklara aktarın.
- Güç anahtarını açın.
- Elektrik alanının yoğunluğunu değiştirmek için cihaz üzerindeki düğmeyi çevirerek parametreleri ayarlayın. Bu çalışmada belirlenen şiddetler 5 kV/cm, 10 kV/cm, 20 kV/cm ve 40 kV/cm'dir.
- Elektrotları kıvılcımlar görünene kadar dikkatlice döndürün, böylece iki elektrotu hemen ayırmadan önce hücrelerin önceden ayarlanmış alan kuvveti yoğunluklarına göre 5 darbeli nsPEF almasına izin verin. Bu tedaviyi takiben, nsPEF ile muamele edilen deney grubu hücreleri ve tedavi edilmeyen kontrol grubu hücreleri, belirli bir hücre kültürü süresinden sonra (bu deneyde 1 gün) sırasıyla 4-6 bölümlerini gerçekleştirmek üzere alın.
4. Hücre sayma kiti-8 (CCK-8) testi
- Elektrik stimülasyonu ile uyarılan RSC96 hücrelerinden belirli bir konsantrasyonda bir hücre süspansiyonu hazırlayın. 96 oyuklu bir hücre kültürü plakasının her bir oyuğuna 100 μL hücre süspansiyonu ekleyin. CCK-8 testinin gereklilikleri göz önüne alındığında, reaktif kitindeki toplam hücre sayısını 1 x 103 ile 1 x 106 arasında kontrol edin.
- Kitten 10 μL CCK-8 çözeltisi alın ve 96 oyuklu hücre kültürü plakasına ekleyin. Bir CO2 inkübatöründe 37 ° C'de 30 dakika ila 4 saat daha inkübe edin.
- Emilimi ölçün. 430-490 nm algılama dalga boyu ve 600-650 nm referans dalga boyu ile çift dalga boyu ölçümü kullanın.
- Hücre proliferasyonunun deneysel sonuçlarına dayalı olarak sonraki deneyler için alan kuvveti yoğunluğunu belirleyin. Sonraki deneyler için iyi proliferasyona sahip hücreleri seçin.
5. Hücre çizik testi
- Altı oyuklu bir plakanın her bir oyuğunda, oyuk başına toplam hacmi 2 mL olan 3 x 105 hücre tohumlayın. Yaklaşık 72 saat sonra hücreler kuyuyu kaplayacaktır. Testi deney ve kontrol grupları üzerinde ayrı ayrı yapın.
- Kültür kuyusunun dibine yatay bir çizgi çizmek için bir pipet ucu kullanın. Pipet ucunun dikey olarak tutulduğundan emin olun ve eğilmesini önlemeye çalışın.
- Kültür ortamını aspire edin ve PBS ile 2-3 kez yıkayın.
- Her kuyucuğa 2 mL serumsuz ortam ekleyin.
- Plakayı 37 °C inkübatöre yerleştirin. Hücre göçündeki değişiklikleri gözlemlemek için ters çevrilmiş mikroskobun 0 saat ve 24 saatte dört kat büyütmesi altında fotoğraf çekin.
6. İmmünofloresan
- Hücre geçirgenliği:
- Hücre süspansiyonlarını kültür kaplarına nazikçe pipetledikten sonra, hücrelerin lamel üzerinde eşit olarak dağıldığı yerlere bir histoloji kalemiyle daireler çizin. Kontrol grubunu ve farklı deney gruplarını ayrı ayrı ele alın.
- 50-100 μL geçirgenlik çalışma solüsyonu (% 0.25-0.5 Triton X-100) ekleyin ve oda sıcaklığında (RT) 20 dakika inkübe edin. Her seferinde 5 dakika boyunca PBS ile üç kez yıkayın.
- Serum Blokajı: Dokuyu düzgün bir şekilde kaplamak için daireler içinde% 3 BSA ekleyin. RT'de 30 dakika inkübe edin.
- Birincil antikor inkübasyonu: Bloke edici çözeltiyi nazikçe çıkarın ve uygun şekilde seyreltilmiş birincil antikoru (fareden türetilmiş, 1:300'de seyreltilmiş) hücre kuyucuklarına ekleyin. Hücre kültürü plakasını nemli bir kutuya yerleştirin ve gece boyunca 4 °C'de inkübe edin.
- İkincil antikor inkübasyonu: Hücre plakasını bir çalkalayıcı üzerine yerleştirin ve her seferinde 5 dakika boyunca üç kez yıkayın. Karşılık gelen ikincil antikoru (CY3 işaretli keçi anti-fare IgG, 1:300'de seyreltilmiş) ekleyin ve RT'de 50 dakika inkübe edin.
- DAPI nükleer boyama:
- Lameli PBS'ye (pH 7.4) bir çalkalayıcıya yerleştirin ve her seferinde 5 dakika boyunca üç kez yıkayın.
- Slaytı nazikçe kuruttuktan sonra, dairelerin içine DAPI boyama solüsyonu (2 μg / mL, daire başına 0.5 mL) ekleyin ve karanlık bir odada 10 dakika RT'de inkübe edin.
- Montaj: Labeli PBS'ye (pH 7.4) bir çalkalayıcı üzerine yerleştirin ve her seferinde 5 dakika boyunca üç kez yıkayın. Sürgüyü nazikçe kuruttuktan sonra, lamel floresan için solmaya karşı dayanıklı bir montaj ortamıyla kapatın.
- Görüntü elde etme: DAPI'yi 330-380 nm dalga boyunda uyarın ve 420 nm'de emisyonu tespit edin; AF488 için 465-495 nm'de uyarılır ve 515-555 nm'de emisyonu tespit eder; 510-560 nm'de uyarılır ve CY3 için 590 nm'de emisyonu tespit eder; 608-648 nm'de uyarılır ve CY5 için 672-712 nm'de emisyonu tespit eder.
Sonuçlar
Düşük yoğunluklu darbeli elektrik alanları hücre proliferasyonunu uyarır
CCK-8 testine göre, 5 kV / cm grubundaki RSC96'nın proliferasyon hızı, kontrol grubu hücrelerinden önemli ölçüde daha hızlıydı. Bununla birlikte, parametreler arttıkça (20 kV/cm ve 40 kV/cm), proliferasyon hızı kararsızdı, hatta kontrol grubununkinden bile daha düşüktü. RSC96 hücrelerinin hücre proliferasyon hızı, 40 kV/cm grubunda, kontrol ve 5 kV/cm gruplarından anlamlı derecede düşüktü ve istatistiksel olarak anlamlı bir fark gösterdi (P < 0.05). Hücre proliferasyonunun deneysel gereksinimlerini karşılamaması nedeniyle, 20 kV/cm ve 40 kV/cm grupları sonraki deneylerde dışlandı (Şekil 1).
Düşük yoğunluklu darbeli elektrik alanları, S100β'nın ekspresyonunu teşvik eder
SC'lerin spesifik bir belirteç proteini olan S100β, nörit ekstansiyonu ve aksonal proliferasyon14 dahil olmak üzere çeşitli işlevlere katılır. Ek olarak, S100β proteininin gelişim sırasında nörotrofik bir faktör olarak hareket ettiği ve sinir yaralanmaları durumunda ekspresyonunun arttığı bulunmuştur. Önceki çalışmalar, S100β'nın farklı sinyal iletim kaskadlarını düzenlemek ve nöronal olgunlaşma akson büyümesine katkıda bulunmak için beyin kaynaklı nörotrofik faktör (BDNF) ile çalışabileceğini göstermiştir14,25. Mikroskop altında, tüm gruplarda hücre tarama deneylerinde kırmızı renkte dağılmış sitoplazmik S100β-pozitif hücreler gözlendi (Şekil 2A). Üç günlük ekimden sonra, RSC96 hücrelerinin 5 kV / cm grubundaki floresanın entegre optik yoğunluğu (IOD), kontrol grubu ve 10 kV / cm grubununkinden önemli ölçüde daha yüksekti ve önemli bir istatistiksel fark gösterdi (***P < 0.001; ****P < 0.0001) (Şekil 2B).
Düşük yoğunluklu darbeli elektrik alanları, NF-H'nin ekspresyonunu teşvik eder
NF-H, bir ağ oluşturmak için diğer ara filamentlerle etkileşime girer ve nöronal hücre iskeletinin önemli bir bileşenidir. Mikroskop altında, tüm gruplarda hücre tarama deneylerinde kırmızı renkte dağılmış sitoplazmik NF-H-pozitif hücreler gözlendi (Şekil 3A). Üç günlük ekimden sonra, RSC96 hücrelerinin 5 kV / cm grubundaki floresanın entegre optik yoğunluğu (IOD), kontrol grubu ve 10 kV / cm grubununkinden önemli ölçüde daha yüksekti ve önemli bir istatistiksel fark gösterdi (*P<0.05; **P < 0.01) (Şekil 3B).
Düşük yoğunluklu darbeli elektrik alanları, GFAP'ın ekspresyonunu düzenler
Glial fibriler asidik proteinin (GFAP) ekspresyonu, astrosit aktivitesinin göstergelerinden biridir. Astrositler başlangıçta sinir hasarını takiben reaktif proliferasyon gösterir ve bu da erken evrelerde koruyucu bir etkiye sahiptir. Bununla birlikte, glial hücrelerin aşırı çoğalması, nöronal liflerin bağlantısını engelleyerek glial skarların oluşumuna yol açabilir26. Önceki araştırmalar, GFAP27 gibi tipik olarak akson büyümesi sırasında ifade edilen genlerin yeniden ifade edildiğini göstermiştir. Mikroskop altında, tüm gruplarda hücre tarama deneylerinde kırmızı renkte dağılmış sitoplazmik GFAP pozitif hücreler gözlendi (Şekil 4A). Üç günlük ekivasyondan sonra, RSC96 hücrelerinin 5 kV/cm grubundaki floresanın entegre optik yoğunluğu (IOD), kontrol grubu ve 10 kV/cm grubununkinden önemli ölçüde daha düşüktü ve önemli bir istatistiksel fark gösterdi (****P < 0.0001; ***P < 0.001) (Şekil 4B).
Düşük yoğunluklu darbeli elektrik alanları, Sox10'un ifadesini destekler
Sox10, periferik sinir miyelinasyonu13 için önemli bir transkripsiyon faktörü olan SC'lerde sürekli olarak eksprese edilir. Mikroskop altında, tüm gruplarda hücre tarama deneylerinde yeşil renkte dağılmış sitoplazmik Sox10 pozitif hücreler gözlendi (Şekil 5A). 3 günlük ekivasyondan sonra, RSC96 hücrelerinin 5 kV/cm grubundaki ortalama gri değer, kontrol grubu ve 10 kV/cm grubundan anlamlı derecede yüksekti ve bu da anlamlı bir istatistiksel fark gösterdi (*P < 0.05; *P < 0.05) (Şekil 5B).
Düşük yoğunluklu darbeli elektrik alanları hücre göçünü teşvik eder
24 saatlik scratch testinden sonra RSC96 hücrelerinin migrasyon oranları karşılaştırıldığında, 5 kV/cm grubundaki RSC96 hücrelerinin migrasyonunun kontrol grubu ve 10 kV/cm grubuna göre önemli ölçüde hızlandığı gözlenmiştir (Şekil 6).

Şekil 1: 5 kV/cm, 10 kV/cm, 20 kV/cm ve 40 kV/cm'de uyarılan RSC96 hücrelerinin hücresel proliferasyonunun CCK8 testi ve kontroller. Sonuçlar, ≥3 kopyaya dayalı SD ± ortalamasını temsil eder. NS önemli değil; *P < 0.05; **P < 0.01; **P < 0.01 Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
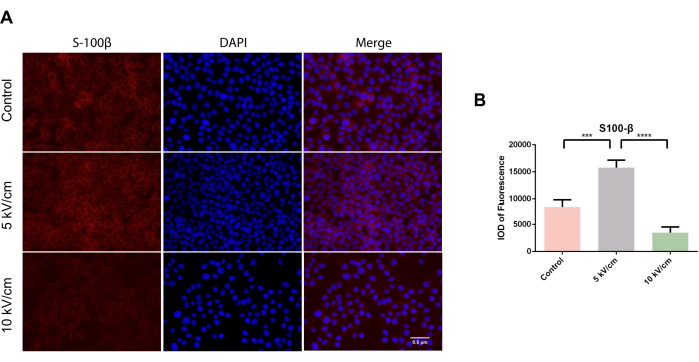
Şekil 2: 5 kV/cm, 10 kV/cm'de uyarılan RSC96 hücrelerinde S100β ekspresyonu ve kontroller. Sonuçlar, ≥3 kopyaya dayalı SD ± ortalamasını temsil eder. P < 0.001; P < 0.0001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
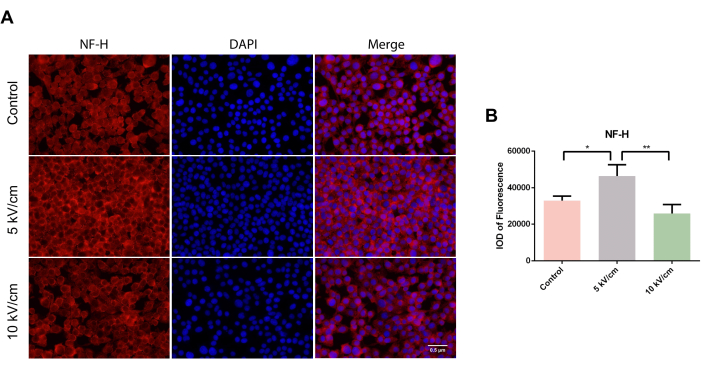
Şekil 3: 5 kV/cm, 10 kV/cm'de uyarılan RSC96 hücrelerinde NF-H ekspresyonu ve kontroller. Sonuçlar, ≥3 kopyaya dayalı SD ± ortalamasını temsil eder. *P < 0.05; **P < 0.01. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: 5 kV/cm, 10 kV/cm'de uyarılan RSC96 hücrelerinde GFAP ekspresyonu ve kontroller. Sonuçlar, ≥3 kopyaya dayalı SD ± ortalamasını temsil eder. P < 0.0001; P < 0.001'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
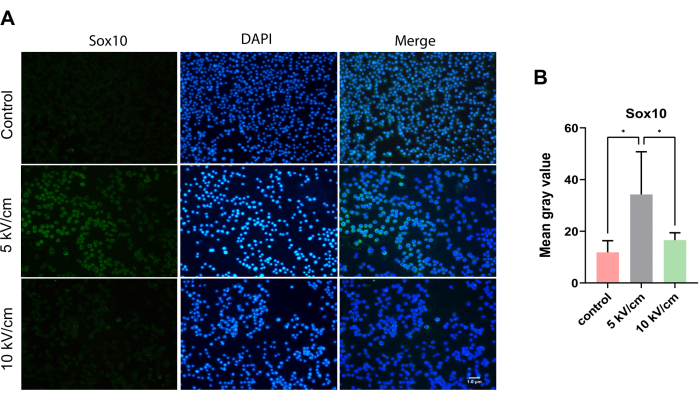
Şekil 5: 5 kV/cm, 10 kV/cm'de uyarılan RSC96 hücrelerinde Sox10 ekspresyonu ve kontroller. Sonuçlar, ≥3 kopyaya dayalı SD ± ortalamasını temsil eder. *P < 0.05; *P < 0.05. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
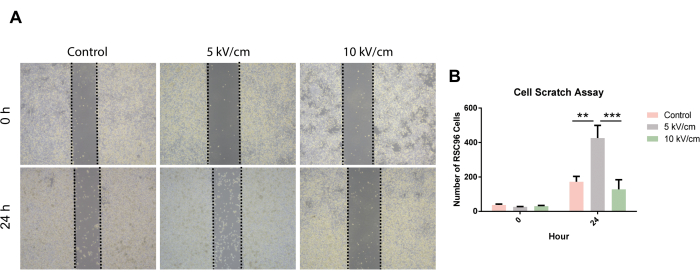
Şekil 6: 5 kV/cm, 10 kV/cm'de uyarılan RSC96 hücrelerinin hücre çizilme deneyi ve kontroller. Sonuçlar, ≥3 kopyaya dayalı SD ± ortalamasını temsil eder. **P < 0.01; P < 0.001'dir. İstatistiksel veriler sıradan tek yönlü ANOVA'ya dayanmaktadır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Son yıllarda, bildirildiği gibi, nsPEF uygulaması artan bir büyüme yaşadı. nsPEF, yalnızca istenen alan üzerinde yüksek oranda hedeflenmiş bir etkiye sahiptir, ek termal hasara neden olmadan tedavi etmek için yeterli enerji sağlar ve insan vücudu için daha güvenli hale getirir28. Bu özellikler, tümör tedavisinde ve sinir rejenerasyonunda umut verici translasyonel beklentiler sağlar. Bununla birlikte, bazı çalışmalar nsPEF'in bazı sınırlamalarını önermiştir. Malzeme araştırmaları ile karşılaştırıldığında, ES harici güç kaynakları ve teller29 tarafından kısıtlanır. Ayrıca, yakın zamanda yapılan bir çalışma, perioperatif lidokainin bir analjezik olarak uygulanmasının, sinir rejenerasyonunda ES ile ilişkili iyileşmeyi önemli ölçüde azalttığını kanıtlamıştır25. Bu endişeler, in vivo olarak gelecekteki çalışmalara zorluklar getirebilir.
RSC96 hücrelerini uyarmak için sadece nsPEF kullandık. Düşük yoğunluklu stimülasyona maruz kalan hücreler gözle görülür değişiklikler gösterdi. Bununla birlikte, nsPEF tarafından indüklenen stimülasyon etkisinin süresi, deneysel sonuçlara göre nispeten kısadır, yaklaşık 3 gündür. Gelecekte, darbeli elektrik alanlarının biyoelektrik etkilerini artırabilen altın nanoçubuklar ve nano hidrojel gibi malzemelerin birleştirilmesi, böylece darbeli elektrik alanlarının biyoelektrik etkilerinin artırılması ve daha hedefli ve verimli tedavi yaklaşımlarının geliştirilmesi düşünülebilir30,31.
Deneysel operasyonun birkaç hayati hususu aşağıdaki gibidir. İlk olarak CCK-8 deneyi gerçekleştirildi, bu sayede elektriksel stimülasyondan sonra uygun alan kuvveti ve hücre kültürü süresi, sonraki deneysel adımları ve uygulamaları kurtarmak için tarandı. Cihazımız ve deneysel koşullarımız altında, beş elektrik sinyali darbesi almak, hücresel değişiklikleri en üst düzeye çıkarmak için elverişlidir. Nabız frekansı çok düşükse, hücreler tarafından alınan elektriksel uyarım, proliferasyonu ve diğer tepkileri aktive etmek için yetersizdir. Öte yandan, aşırı frekans geri dönüşü olmayan hücresel hasara yol açabilir. Elektriksel stimülasyon sırasında, daha fazla elektrik çarpmasının deney sonuçlarını etkilemesini önlemek için önceden belirlenmiş sayıda elektrik çarpmasından sonra elektrotların hızlı bir şekilde ayrılabilmesini sağlamak için uygun bir konumu korumak için elektrotlar arasındaki mesafeye dikkat etmek gerekir. Elektrik çarpmasının tamamlanmasından sonra, cihaza zarar vermemek için cihaz zamanında topraklanmalıdır.
Bu çalışmada, düşük alan kuvvetine sahip nsPEF, SK'lerde ilgili faktörlerin proliferasyon, göç, sentez ve salgı yeteneğini etkili bir şekilde desteklemiştir. Altta yatan mekanizmanın hala açıklığa kavuşturulması gerekmesine rağmen, bu çalışma hücre proliferasyonunu ve göçünü uyarmak için nsPEF'in uygulanmasına olumlu bir bakış açısı sunmaktadır. nsPEF'in neden olduğu bu tür hücre çoğalması ve göçü, mevcut araştırma alanlarında azdır19 . Ayrıca, SK'lerin uyarılmasında birçok önemli faktör rol oynar. Bu çalışmada spesifik belirteç protein ve nörotrofik faktör S100β, transkripsiyon faktörleri Sox10, GFAP ve nöronal hücre iskeleti NF-H bileşenleri değerlendirildi. nsPEF stimülasyonunda geçirdikleri değişiklikler, SK'lerin aktivitesini, periferik sinirlerdeki onarım seviyesini ve prognozu çoklu boyutlarda değerlendirebilir. Tüm sonuçlar, SK'lerin nsPEF tarafından anlamlı olarak uyarıldığını ve benign prognozu gösterdi. Gelecekte, hayvan modelleri üzerinde daha fazla çalışma yürüteceğiz ve optimal pro-farklılaşma elektrik alan stimülasyonu modunu taramak için farklı yoğunluklarda nsPEF'in SC'ler üzerindeki etkilerini daha fazla araştıracağız.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Ulusal Anahtar Bilimsel Araç ve Ekipman Geliştirme Projesi (NO.82027803) tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Wuhan Xavier Biotechnology Co., LTD | G1401 | |
| Anti-GFAP Mouse mAb | Wuhan Xavier Biotechnology Co., LTD | GB12100-100 | |
| Anti-Neurofilament heavy polypeptide Mouse mAb | Wuhan Xavier Biotechnology Co., LTD | GB12144-100 | |
| Anti-S100 beta Mouse mAb | Wuhan Xavier Biotechnology Co., LTD | GB14146-100 | |
| BSA | Wuhan Xavier Biotechnology Co., LTD | GC305010 | |
| Coverslip | Jiangsu Shitai experimental equipment Co., LTD | 10212432C | |
| CY3-labeled goat anti-mouse IgG | Wuhan Xavier Biotechnology Co., LTD | GB21302 | |
| DAPI Staining Reagent | Wuhan Xavier Biotechnology Co., LTD | G1012 | |
| Decolorizing shaker | Wuhan Xavier Biotechnology Co., LTD | DS-2S100 | |
| High Voltage Power Supply for nsPEF | Matsusada Precision Inc. | AU-60P1.6-L | |
| Histochemical pen | Wuhan Xavier Biotechnology Co., LTD | G6100 | |
| Membrane breaking liquid | Wuhan Xavier Biotechnology Co., LTD | G1204 | |
| Microscope slide | Wuhan Xavier Biotechnology Co., LTD | G6012 | |
| Palm centrifuge | Wuhan Xavier Biotechnology Co., LTD | MS6000 | |
| PBS powdered | Wuhan Xavier Biotechnology Co., LTD | G0002 | |
| Pipette | Wuhan Xavier Biotechnology Co., LTD | ||
| Positive fluorescence microscope | Nikon, Japan | NIKON ECLIPSE C1 | |
| Rabbit Anti-SOX10/AF488 Conjugated antibody | Beijing Bioss Biotechnology Co., LTD | BS-20563R-AF488 | |
| RSC96 Schwann cells | Wuhan Xavier Biotechnology Co., LTD | STCC30007G-1 | |
| scanister | 3DHISTECH | Pannoramic MIDI | |
| Special cable for nsPEF | Times Microwave Systems | M17/78-RG217 | |
| Turbine mixer | Wuhan Xavier Biotechnology Co., LTD | MV-100 |
Referanslar
- Jing, W., et al. Study of electrical stimulation with different electric-field intensities in the regulation of the differentiation of PC12 cells. ACS Chem Neurosci. 10 (1), 348-357 (2018).
- Nocera, G., Jacob, C. Mechanisms of Schwann cell plasticity involved in peripheral nerve repair after injury. Cell Mol Life Sci. 77, 3977-3989 (2020).
- Aguilar, Z. . Nanomaterials for Medical Applications. , (2012).
- Xie, S., et al. Efficient generation of functional Schwann cells from adipose-derived stem cells in defined conditions. Cell Cycle. 16 (9), 841-851 (2017).
- Rosenbalm, T. N., Levi, N. H., Morykwas, M. J., Wagner, W. D. Electrical stimulation via repeated biphasic conducting materials for peripheral nerve regeneration. J Mater Sci Mater Med. 34 (11), 1-18 (2023).
- Daly, W. T., et al. Comparison and characterization of multiple biomaterial conduits for peripheral nerve repair. Biomaterials. 34 (34), 8630-8639 (2013).
- Lee, B. -. K., et al. End-to-side neurorrhaphy using an electrospun PCL/collagen nerve conduit for complex peripheral motor nerve regeneration. Biomaterials. 33 (35), 9027-9036 (2012).
- Kim, V., Gudvangen, E., Kondratiev, O., Redondo, L., Xiao, S., Pakhomov, A. G. Peculiarities of neurostimulation by intense nanosecond pulsed electric fields: how to avoid firing in peripheral nerve fibers. Int J Mol Sci. 22 (13), 7051 (2021).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Chen, Y. Y., McDonald, D., Cheng, C., Magnowski, B., Durand, J., Zochodne, D. W. Axon and Schwann cell partnership during nerve regrowth. J Neuropathol Exp Neurol. 64 (7), 613-622 (2005).
- Yi, S., et al. Tau modulates Schwann cell proliferation, migration and differentiation following peripheral nerve injury. J Cell Sci. 132 (6), (2019).
- Min, Q., Parkinson, D. B., Dun, X. Migrating Schwann cells direct axon regeneration within the peripheral nerve bridge. Glia. 69 (2), 235-254 (2021).
- Zhang, Y., Zhao, Q., Chen, Q., Xu, L., Yi, S. Transcriptional control of peripheral nerve regeneration. Mol Neurobiol. 60 (1), 329-341 (2023).
- Nishi, M., Kawata, M., Azmitia, E. C. Trophic interactions between brain-derived neurotrophic factor and S100β on cultured serotonergic neurons. Brain Res. 868 (1), 113-118 (2000).
- Gu, Y., et al. miR-sc8 inhibits Schwann cell proliferation and migration by targeting EGFR. PLoS One. 10 (12), e0145185 (2015).
- Dong, H. -. L., et al. AMPK regulates mitochondrial oxidative stress in C2C12 myotubes induced by electrical stimulations of different intensities. Nan Fang Yi Ke Da Xue Xue Bao. 38 (6), 742-747 (2018).
- Beebe, S. J., Blackmore, P. F., White, J., Joshi, R. P., Schoenbach, K. H. Nanosecond pulsed electric fields modulate cell function through intracellular signal transduction mechanisms. Physiol Meas. 25 (4), 1077 (2004).
- Haberkorn, I., Siegenthaler, L., Buchmann, L., Neutsch, L., Mathys, A. Enhancing single-cell bioconversion efficiency by harnessing nanosecond pulsed electric field processing. Biotechnol Adv. 53, 107780 (2021).
- Ruiz-Fernández, A. R., Campos, L., Gutierrez-Maldonado, S. E., Núñez, G., Villanelo, F., Perez-Acle, T. Nanosecond pulsed electric field (nsPEF): Opening the biotechnological Pandora's box. Int J Mol Sci. 23 (11), 6158 (2022).
- Nuccitelli, R., et al. First-in-human trial of nanoelectroablation therapy for basal cell carcinoma: proof of method. Exp Dermatol. 23 (2), 135-137 (2014).
- Nuccitelli, R., et al. Non-thermal nanoelectroablation of UV-induced murine melanomas stimulates an immune response. Pigment Cell Melanoma Res. 25 (5), 618-629 (2012).
- Carr, L., et al. A nanosecond pulsed electric field (nsPEF) can affect membrane permeabilization and cellular viability in a 3D spheroids tumor model. Bioelectrochemistry. 141, 107839 (2021).
- Hornef, J., Edelblute, C. M., Schoenbach, K. H., Heller, R., Guo, S., Jiang, C. Thermal analysis of infrared irradiation-assisted nanosecond-pulsed tumor ablation. Sci Rep. 10 (1), 5122 (2020).
- Zuo, K. J., Gordon, T., Chan, K. M., Borschel, G. H. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Exp Neurol. 332, 113397 (2020).
- Juckett, L., Saffari, T. M., Ormseth, B., Senger, J. -. L., Moore, A. M. The effect of electrical stimulation on nerve regeneration following peripheral nerve injury. Biomolecules. 12 (12), 1856 (2022).
- Jessen, K. R., Mirsky, R. Negative regulation of myelination: relevance for development, injury, and demyelinating disease. Glia. 56 (14), 1552-1565 (2008).
- Chen, Z. -. L., Yu, W. -. M., Strickland, S. Peripheral regeneration. Annu Rev Neurosci. 30, 209-233 (2007).
- Yin, D., et al. Cutaneous papilloma and squamous cell carcinoma therapy utilizing nanosecond pulsed electric fields (nsPEF). PloS One. 7 (8), e43891 (2012).
- Qi, F., et al. Photoexcited wireless electrical stimulation elevates nerve cell growth. Colloids Surf B Biointerfaces. 220, 112890 (2022).
- Mi, Y., Liu, Q., Li, P., Xu, J., Yang, Q., Tang, J. Targeted gold nanorods combined with low-intensity nsPEFs enhance antimelanoma efficacy in vitro. Nanotechnology. 31 (35), 355102 (2020).
- Ho, T. -. C., et al. Hydrogels: Properties and applications in biomedicine. Molecules. 27 (9), 2902 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır