Method Article
Regulierung des Schwann-Zellwachstums durch ein gepulstes elektrisches Feld im Nanosekundenbereich für die periphere Nervenregeneration in vitro
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll für die Anwendung eines elektrischen Nanosekunden-Pulsfeldes (nsPEF) zur Stimulation von Schwann-Zellen in vitro vor. Die Synthese- und Sekretionsfähigkeit relevanter Faktoren und Veränderungen des Zellverhaltens bestätigten die erfolgreiche Stimulation mit nsPEF. Die Studie gibt ein positives Bild von der Methode der peripheren Nervenregeneration.
Zusammenfassung
Schwann-Zellen (SCs) sind myelinisierende Zellen des peripheren Nervensystems und spielen eine entscheidende Rolle bei der Regeneration peripherer Nerven. Das Nanosekunden-Puls-Elektrofeld (nsPEF) ist eine aufstrebende Methode, die bei der elektrischen Nervenstimulation anwendbar ist und sich bei der Stimulierung der Zellproliferation und anderer biologischer Prozesse als wirksam erwiesen hat. Mit dem Ziel, zu beurteilen, ob SCs unter nsPEF signifikante Veränderungen erfahren, und um das Potenzial für neue periphere Nervenregenerationsmethoden zu erforschen, wurden kultivierte RSC96-Zellen einer nsPEF-Stimulation bei 5 kV und 10 kV unterzogen, gefolgt von einer fortgesetzten Kultivierung für 3-4 Tage. Anschließend wurden einige relevante Faktoren, die von SCs exprimiert wurden, bewertet, um die erfolgreiche Stimulation zu demonstrieren, einschließlich des spezifischen Markerproteins, des neurotrophen Faktors, des Transkriptionsfaktors und des Myelinisierungsregulators. Die repräsentativen Ergebnisse zeigten, dass nsPEF die Proliferation und Migration von SCs und die Fähigkeit zur Synthese relevanter Faktoren, die positiv zur Regeneration peripherer Nerven beitragen, signifikant verbessert. Gleichzeitig deutete eine geringere Expression von GFAP auf eine gutartige Prognose peripherer Nervenverletzungen hin. All diese Ergebnisse zeigen, dass nsPEF ein großes Potenzial als effiziente Behandlungsmethode für periphere Nervenverletzungen durch Stimulation von SCs hat.
Einleitung
Jedes Jahr sind Millionen von Menschen von Nervenverletzungen betroffen, die sowohl das periphere Nervensystem (PNS) als auch das zentrale Nervensystem (ZNS) betreffen1. Studien haben gezeigt, dass die axonale Reparaturkapazität des ZNS nach Nervenverletzungen recht begrenzt ist, während das PNS aufgrund der signifikanten Plastizität von SCs eine erhöhte Kapazität aufweist2. Dennoch ist die vollständige Regeneration nach Verletzungen peripherer Nerven nach wie vor schwierig und stellt nach wie vor eine erhebliche Herausforderung für die menschliche Gesundheitdar 3,4. Heutzutage sind Autotransplantate trotz der Nachteile der Morbidität an der Spenderstelle und der begrenzten Verfügbarkeit eine gängige Behandlung geblieben5. Diese Situation hat Forscher dazu veranlasst, alternative Therapien zu erforschen, darunter die Materialien6, die molekularen Faktoren7 und die elektrische Stimulation (ES). Als Faktor, der das axonale Wachstum und die Nervenregeneration fördert8, ist die Wahl einer geeigneten Methode der ES und die Erforschung der Beziehung zwischen ES und SC unerlässlich.
SCs sind die wichtigsten Gliazellen des PNS und spielen eine entscheidende Rolle bei der Regeneration des PNS 9,10. Nach peripheren Nervenverletzungen durchlaufen SCs eine schnelle Aktivierung, eine umfangreiche Reprogrammierung2 und einen Übergang von einem myelinbildenden Zustand zu einer wachstumsfördernden Morphologie, um die Regeneration des Nervsdurchzuführen 2. Eine substantielle Proliferation von SCs tritt am distalen Ende des verletzten Nervs auf, während SCs des distalen Stumpfes eine Proliferation und Dehnung erfahren, um das Bungner-Band zu bilden, das notwendig ist, um Axone zum Wachstum in Richtung des Zielorgans zu leiten11. Darüber hinaus wandern SCs aus den proximalen und distalen Nervenstümpfen in die Nervenbrücke, um SC-Stränge zu bilden, die die Axonregeneration fördern12. Darüber hinaus haben frühere Studien gezeigt, dass sich die Synthese und Sekretion relevanter Faktoren, die mit SCs zusammenhängen, bei der peripheren Nervenregeneration ändern, einschließlich der transkriptionellen Faktoren13, der neurotrophen Faktoren14 und der Myelinisierungsregulatoren13. Dies liefert auch Indikatoren für die Beurteilung der Aktivität von SCs. Basierend auf diesen wurde die Förderung der SC-Proliferation, Migration, Synthese und Sekretion relevanter Faktoren zur Verbesserung der peripheren Nervenregeneration umfassend untersucht15.
Frühere Studien haben die Möglichkeit des Einsatzes von ES zur Nervenregeneration gezeigt1. Eine weithin akzeptierte Erklärung ist, dass ES die Depolarisation von Zellmembranen induzieren, das Membranpotenzial verändern und die Funktionen von Membranproteinen beeinflussen kann, indem es die Ladungsverteilungen auf diesen Biomolekülen verändert1. Weit verbreitetes intensives PEF kann jedoch starke Schmerzen, unwillkürliche Muskelkontraktionen und Herzflimmern verursachen8. Es erhöht auch die Aktivität der Kreatinkinase (CK), verringert die Muskelkraft und induziert die Entwicklung von verzögert einsetzendem Muskelkater (DOMS)16. nsPEF ist eine aufstrebende Technik, die Probanden innerhalb einer Nanosekunden-Pulsdauer mit elektrischen Hochspannungsfeldern stimuliert und nach und nach in der Forschung auf zellulärer Ebene eingesetzt wird17,18. Frühere Studien haben berichtet, dass die mögliche Begründung dafür, dass nsPEF die Zellproliferation und Organellenaktivität fördert, die Bildung von Membran-Nanoporen und die Aktivierung von Ionenkanälen ist, was zu einem Anstieg der zytoplasmatischen Ca2+-Konzentration führt19. nsPEF nutzt die Pulsleistungstechnologie, um die Zellmembran aufzuladen und Pulse zu erzeugen, die sich durch kurze Dauer, schnelle Anstiegszeit, hohe Leistung und niedrige Energiedichteauszeichnen 20. Diese Eigenschaften deuten darauf hin, dass nsPEF ein bevorzugter Modus mit minimalen Stimulationsnebenwirkungen sein könnte8. Darüber hinaus bietet nsPEF im Vergleich zu chirurgischen Eingriffen Vorteile wie minimalinvasive Eingriffe, Reversibilität, Anpassbarkeit und Zerstörungsfreiheit des Nervengewebes. Eine Hauptforschungsrichtung von nsPEF im biomedizinischen Bereich ist seine Anwendung für die Ablation von Tumorgewebe unter Verwendung der Stimulation hochenergetischer elektrischer Felder 21,22,23. Einige Forschungsergebnisse deuten darauf hin, dass 12-nsPEF periphere Nerven stimulieren kann, ohne Schäden zu verursachen24. Derzeit gibt es jedoch nur begrenzte Evidenz für die Anwendung von nsPEF im Bereich der Nervenregeneration. Darüber hinaus ist die Stimulation von SCs mit nsPEF ein Pionierversuch, der zu weiterer In-vivo- und klinischer Forschung beiträgt. In dieser Studie wird untersucht, ob die nsPEF-Stimulation von SCs die Nervenregeneration fördern und eine verlässliche Grundlage für nachfolgende vertiefte und systematische Forschungen bieten kann.
Protokoll
1. Auftauen von kryokonservierten RSC96-Zellen
- Tauen Sie das Kryofläschchen mit 1 ml Zellsuspension auf, indem Sie es in einem 37 °C warmen Wasserbad schnell schütteln, und geben Sie es dann in ein Zentrifugenröhrchen mit 4-6 ml vollständigem Kulturmedium und mischen Sie es gut.
- Zentrifugieren Sie 3-5 Minuten lang bei 1000 x g , verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 3 mL vollständigem Kulturmedium.
- Die Zellsuspension wird in einen Kulturkolben (oder eine Schale) gegeben, der 6-8 ml vollständiges Kulturmedium enthält, und über Nacht bei 37 °C inkubiert.
- Beobachten Sie am nächsten Tag das Zellwachstum und die Zelldichte unter dem Mikroskop.
2. Zellpassage:
HINWEIS: Wenn die Zellendichte 80%-90% erreicht, ist es bereit für den Durchgang.
- Entsorgen Sie das Nährmedium und spülen Sie die Zellen 1-2 Mal mit phosphatgepufferter Kochsalzlösung (PBS) ohne Calcium- und Magnesiumionen.
- 0,25 % (w/v) Trypsin-0,53 mM EDTA in den Kulturkolben geben (1-2 mL für einen T25-Kolben, 2-3 mL für einen T75-Kolben) und 1-2 min bei 37 °C inkubieren.
- Beobachten Sie die Zellablösung unter dem Mikroskop. Wenn die meisten Zellen rund werden und sich ablösen, stellen Sie den Kolben schnell wieder in den Arbeitsbereich, klopfen Sie vorsichtig auf den Kolben und fügen Sie 3-4 ml Kulturmedium mit 10 % FBS hinzu, um den Verdau zu stoppen.
- Mischen Sie den Inhalt, aspirieren Sie die Lösung und zentrifugieren Sie sie bei 1000 x g für 5 min. Verwerfen Sie dann den Überstand und resuspendieren Sie die Zellen, indem Sie 1-2 ml frisches Kulturmedium hinzufügen und vorsichtig pipettieren.
- Die Zellsuspension wird im Verhältnis 1:2 in einen neuen T25-Kolben überführt und 7 ml Kulturmedium hinzugefügt.
3. Betrieb des nsPEF-Geräts
- Resuspendieren Sie die RSC96-Zellen in 1 mL DMEM-Kulturmedium und überführen Sie sie in kolorimetrische Schalen mit Elektroden auf beiden Seiten.
- Schalten Sie den Netzschalter ein.
- Passen Sie die Parameter an, indem Sie den Knopf am Instrument drehen, um die Intensität des elektrischen Feldes zu ändern. Die in dieser Studie festgelegten Intensitäten betragen 5 kV/cm, 10 kV/cm, 20 kV/cm und 40 kV/cm.
- Drehen Sie die Elektroden vorsichtig, bis Funken entstehen, so dass die Zellen 5 Impulse von nsPEF entsprechend den voreingestellten Feldstärkeintensitäten empfangen können, bevor Sie die beiden Elektroden sofort trennen. Nach dieser Behandlung werden die mit nsPEF behandelten Zellen der Versuchsgruppe und die unbehandelten Zellen der Kontrollgruppe nach einer bestimmten Zeit der Zellkultur (1 Tag in diesem Experiment) die Abschnitte 4 bis 6 durchgeführt.
4. Zellzählkit-8 (CCK-8) Assay
- Bereiten Sie eine Zellsuspension einer bestimmten Konzentration aus RSC96-Zellen vor, die durch elektrische Stimulation stimuliert wurden. Geben Sie 100 μl der Zellsuspension in jede Vertiefung einer 96-Well-Zellkulturplatte. Unter Berücksichtigung der Anforderungen des CCK-8-Assays ist die Gesamtzahl der Zellen im Reagenzkit zwischen 1 x 103 und 1 x 106 zu kontrollieren.
- Nehmen Sie 10 μl CCK-8-Lösung aus dem Kit und geben Sie sie auf die 96-Well-Zellkulturplatte. In einem CO2 -Inkubator bei 37 °C für weitere 30 min bis 4 h inkubieren.
- Messen Sie die Absorption. Verwenden Sie die Dual-Wellenlängen-Messung mit einer Detektionswellenlänge von 430-490 nm und einer Referenzwellenlänge von 600-650 nm.
- Bestimmen Sie die Feldstärkeintensität für nachfolgende Experimente auf der Grundlage der experimentellen Ergebnisse der Zellproliferation. Wählen Sie Zellen mit guter Proliferation für nachfolgende Experimente aus.
5. Zell-Scratch-Assay
- In jeder Vertiefung einer Sechs-Well-Platte werden 3 x 105 Zellen mit einem Gesamtvolumen von 2 ml pro Vertiefung ausgesät. Etwa 72 Stunden später werden die Zellen die Vertiefung abdecken. Führen Sie den Test an der Versuchsgruppe und der Kontrollgruppe getrennt durch.
- Zeichnen Sie mit einer Pipettenspitze eine horizontale Linie am Boden der Kulturvertiefung. Stellen Sie sicher, dass die Pipettenspitze senkrecht gehalten wird, und versuchen Sie, ein Verkanten zu vermeiden.
- Aspirieren Sie das Nährmedium und waschen Sie es 2-3 Mal mit PBS.
- Geben Sie 2 ml serumfreies Medium in jede Vertiefung.
- Stellen Sie die Platte in den 37 °C heißen Inkubator. Nehmen Sie Bilder unter einer vierfachen Vergrößerung des inversen Mikroskops bei 0 h und 24 h auf, um Veränderungen in der Zellmigration zu beobachten.
6. Immunfluoreszenz
- Permeabilisierung der Zellen:
- Nachdem Sie die Zellsuspensionen vorsichtig in Kulturschalen pipettiert haben, zeichnen Sie mit einem Histologiestift Kreise an den Stellen, an denen die Zellen gleichmäßig auf dem Deckglas verteilt sind. Behandeln Sie die Kontrollgruppe und die verschiedenen Versuchsgruppen getrennt.
- 50-100 μl Permeabilisierungs-Arbeitslösung (0,25-0,5 % Triton X-100) zugeben und 20 Minuten bei Raumtemperatur (RT) inkubieren. Dreimal mit PBS waschen für jeweils 5 Minuten.
- Serumblockierung: Fügen Sie 3% BSA innerhalb der Kreise hinzu, um das Gewebe gleichmäßig zu bedecken. 30 Minuten bei RT inkubieren.
- Inkubation des Primärantikörpers: Entfernen Sie vorsichtig die Blockierungslösung und geben Sie den entsprechend verdünnten Primärantikörper (aus der Maus, verdünnt bei 1:300) in die Zellvertiefungen. Stellen Sie die Zellkulturplatte in eine feuchte Box und inkubieren Sie sie über Nacht bei 4 °C.
- Inkubation von Sekundärantikörpern: Legen Sie die Zellplatte auf einen Schüttler und waschen Sie sie dreimal für jeweils 5 Minuten. Der entsprechende Sekundärantikörper (CY3-markiertes Ziegen-Anti-Maus-IgG, verdünnt bei 1:300) wird zugegeben und 50 Minuten lang bei RT inkubiert.
- DAPI-Kernfärbung:
- Legen Sie den Deckglas in PBS (pH 7,4) auf einen Shaker und waschen Sie ihn dreimal für jeweils 5 Minuten.
- Nach dem schonenden Trocknen des Objektträgers wird DAPI-Färbelösung (2 μg/ml, 0,5 mL pro Kreis) in die Kreise gegeben und 10 Minuten lang bei RT in einem dunklen Raum inkubiert.
- Montage: Legen Sie das Deckglas in PBS (pH 7,4) auf einen Shaker und waschen Sie es dreimal für jeweils 5 Minuten. Nach dem schonenden Trocknen des Objektträgers versiegeln Sie das Deckglas mit einem lichtbeständigen Eindeckmedium für die Fluoreszenz.
- Bildaufnahme: Anregung von DAPI bei einer Wellenlänge von 330-380 nm und Detektion von Emission bei 420 nm; Anregung bei 465-495 nm und Detektion der Emission bei 515-555 nm für AF488; Anregung bei 510-560 nm und Detektion von Emission bei 590 nm für CY3; Anregung bei 608-648 nm und Detektion von Emission bei 672-712 nm für CY5.
Ergebnisse
Gepulste elektrische Felder mit geringer Intensität stimulieren die Zellproliferation
Dem CCK-8-Assay zufolge war die Proliferationsrate von RSC96 in der 5 kV/cm-Gruppe signifikant schneller als die der Zellen der Kontrollgruppe. Mit zunehmenden Parametern (20 kV/cm und 40 kV/cm) war die Proliferationsrate jedoch instabil und sogar niedriger als die der Kontrollgruppe. Die Zellproliferationsrate von RSC96-Zellen in der 40 kV/cm-Gruppe war signifikant niedriger als in der Kontroll- und der 5 kV/cm-Gruppe, was einen signifikanten statistischen Unterschied darstellte (P < 0,05). Da die experimentellen Anforderungen an die Zellproliferation nicht erfüllt waren, wurden die 20 kV/cm- und 40 kV/cm-Gruppen in nachfolgenden Experimenten ausgeschlossen (Abbildung 1).
Gepulste elektrische Felder niedriger Intensität fördern die Expression von S100β
S100β ist als spezifisches Markerprotein von SCs an verschiedenen Funktionen beteiligt, darunter die Neuritenverlängerung und die axonale Proliferation14. Darüber hinaus wurde festgestellt, dass das S100β-Protein während der Entwicklung als neurotropher Faktor fungiert und seine Expression bei Nervenverletzungen zunimmt. Frühere Studien haben gezeigt, dass S100β mit dem vom Gehirn abgeleiteten neurotrophen Faktor (BDNF) zusammenarbeiten kann, um verschiedene Signaltransduktionskaskaden zu regulieren und zum Wachstum des neuronalen Reifungsaxons beizutragen14,25. Unter dem Mikroskop wurden verstreute zytoplasmatische S100β-positive Zellen in Rot in Zellkriechen in Zellkriechen in allen Gruppen beobachtet (Abbildung 2A). Nach dreitägiger Kultivierung war die integrierte optische Dichte (IOD) der Fluoreszenz in der 5 kV/cm-Gruppe von RSC96-Zellen signifikant höher als in der Kontrollgruppe und der 10 kV/cm-Gruppe, was einen signifikanten statistischen Unterschied darstellte (***P < 0,001; ****P < 0,0001) (Abbildung 2B).
Gepulste elektrische Felder niedriger Intensität fördern die Expression von NF-H
NF-H interagiert mit anderen intermediären Filamenten, um ein Netzwerk zu bilden, und ist ein Hauptbestandteil des neuronalen Zytoskeletts. Unter dem Mikroskop wurden verstreute zytoplasmatische NF-H-positive Zellen in roter Farbe in Zellkriechen-Assays in allen Gruppen beobachtet (Abbildung 3A). Nach dreitägiger Kultivierung war die integrierte optische Dichte (IOD) der Fluoreszenz in der 5 kV/cm-Gruppe von RSC96-Zellen signifikant höher als in der Kontrollgruppe und der 10 kV/cm-Gruppe, was einen signifikanten statistischen Unterschied darstellte (*P<0,05; **P < 0,01) (Abbildung 3B).
Gepulste elektrische Felder niedriger Intensität regulieren die Expression von GFAP
Die Expression des sauren Gliafaserproteins (GFAP) ist einer der Indikatoren für die Aktivität von Astrozyten. Astrozyten zeigen nach einer Nervenverletzung zunächst eine reaktive Proliferation, die im Frühstadium eine schützende Wirkung hat. Eine übermäßige Proliferation von Gliazellen kann jedoch zur Bildung von Glianarben führen, die die Konnektivität der neuronalen Fasern behindern26. Frühere Forschungen haben gezeigt, dass Gene, die typischerweise während des Axonwachstums exprimiert werden, wieder exprimiert werden, wie z. B. GFAP27. Unter dem Mikroskop wurden verstreute zytoplasmatische GFAP-positive Zellen in roter Farbe in Zellkriechen-Assays in allen Gruppen beobachtet (Abbildung 4A). Nach dreitägiger Kultivierung war die integrierte optische Dichte (IOD) der Fluoreszenz in der 5 kV/cm-Gruppe von RSC96-Zellen signifikant niedriger als in der Kontrollgruppe und der 10 kV/cm-Gruppe, was einen signifikanten statistischen Unterschied darstellte (****P < 0,0001; ***P < 0,001) (Abbildung 4B).
Gepulste elektrische Felder niedriger Intensität fördern die Expression von Sox10
Sox10 wird kontinuierlich in SCs exprimiert, ein wichtiger Transkriptionsfaktor für die Myelinisierung des peripheren Nerven13. Unter dem Mikroskop wurden verstreute zytoplasmatische Sox10-positive Zellen in grüner Farbe in Zellkriechen in Zellkriechen in allen Gruppen beobachtet (Abbildung 5A). Nach 3 Tagen Kultivierung war der mittlere Grauwert in der 5 kV/cm-Gruppe der RSC96-Zellen signifikant höher als der der Kontrollgruppe und der 10 kV/cm-Gruppe, was einen signifikanten statistischen Unterschied zeigte (*P < 0,05; *P < 0,05) (Abbildung 5B).
Gepulste elektrische Felder mit geringer Intensität fördern die Zellmigration
Beim Vergleich der Migrationsraten von RSC96-Zellen nach 24 h Scratch-Assay wurde beobachtet, dass die Migration von RSC96-Zellen in der 5 kV/cm-Gruppe im Vergleich zur Kontrollgruppe und der 10 kV/cm-Gruppe signifikant beschleunigt war (Abbildung 6).

Abbildung 1: CCK8-Assay der zellulären Proliferation von RSC96-Zellen, die bei 5 kV/cm, 10 kV/cm, 20 kV/cm und 40 kV/cm stimuliert wurden, und Kontrollen. Die Ergebnisse stellen den Mittelwert ± SD auf Basis von ≥3 Replikaten dar. NS nicht signifikant; *P < 0,05; **P < 0,01; **P < 0,01 Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
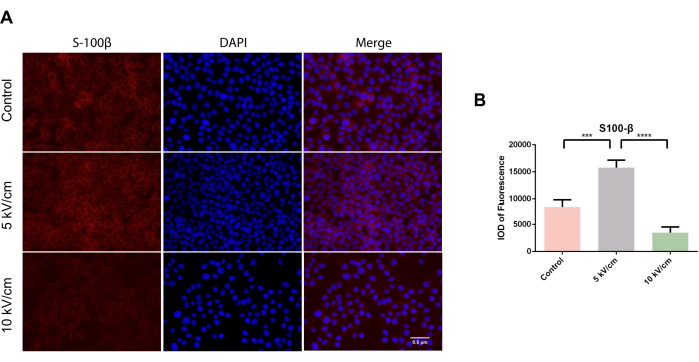
Abbildung 2: Expression von S100β in RSC96-Zellen, die bei 5 kV/cm, 10 kV/cm stimuliert wurden, und in Kontrollen. Die Ergebnisse stellen den Mittelwert ± SD auf Basis von ≥3 Replikaten dar. P < 0,001; P < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
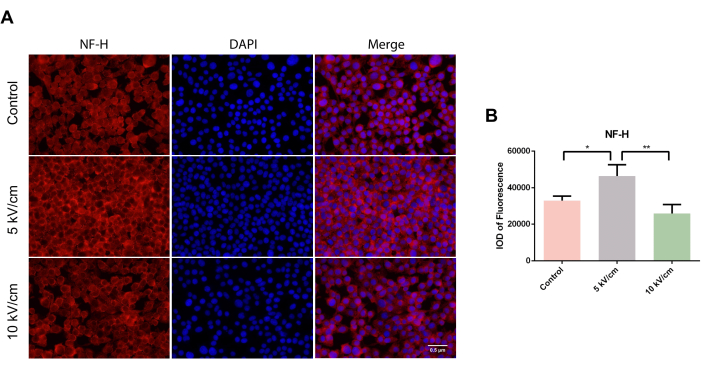
Abbildung 3: Expression von NF-H in RSC96-Zellen, die bei 5 kV/cm, 10 kV/cm stimuliert wurden, und Kontrollen. Die Ergebnisse stellen den Mittelwert ± SD auf Basis von ≥3 Replikaten dar. *P < 0,05; **P < 0,01. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Expression von GFAP in RSC96-Zellen, die bei 5 kV/cm, 10 kV/cm stimuliert wurden, und Kontrollen. Die Ergebnisse stellen den Mittelwert ± SD auf Basis von ≥3 Replikaten dar. P < 0,0001; P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
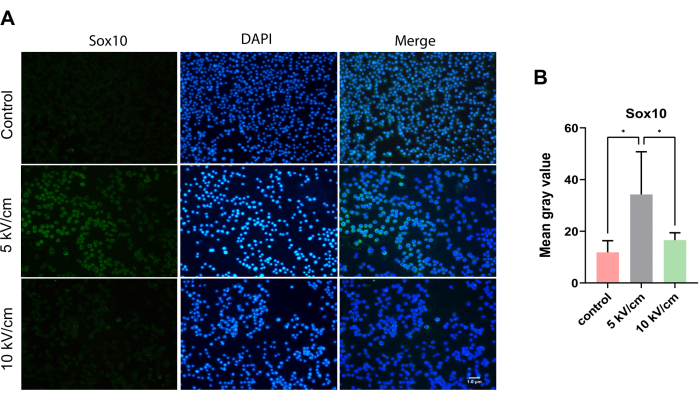
Abbildung 5: Expression von Sox10 in RSC96-Zellen, die bei 5 kV/cm, 10 kV/cm stimuliert wurden, und Kontrollen. Die Ergebnisse stellen den Mittelwert ± SD auf Basis von ≥3 Replikaten dar. *P < 0,05; *P < 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
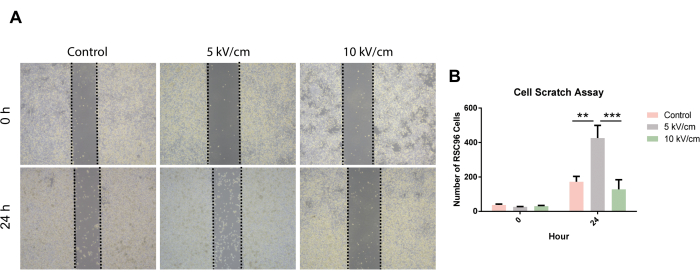
Abbildung 6: Zell-Scratching-Assay von RSC96-Zellen, die bei 5 kV/cm, 10 kV/cm stimuliert wurden, und Kontrollen. Die Ergebnisse stellen den Mittelwert ± SD auf Basis von ≥3 Replikaten dar. **P < 0,01; P < 0,001. Die statistischen Daten basieren auf der gewöhnlichen Einweg-ANOVA. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In den letzten Jahren hat die Anwendung von nsPEF, wie berichtet, ein Schub für das Wachstum erfahren. nsPEF hat eine sehr gezielte Wirkung nur auf den gewünschten Bereich und liefert genügend Energie für die Behandlung, ohne zusätzliche thermische Schäden zu verursachen, was es für den menschlichen Körper sicherer macht28. Diese Eigenschaften geben ihm vielversprechende translationale Aussichten in der Tumorbehandlung und Nervenregeneration. Einige Studien haben jedoch einige Einschränkungen von nsPEF vorgeschlagen. Im Vergleich zur Materialforschung ist ES durch externe Stromquellen und Drähte begrenzt29. Darüber hinaus hat eine aktuelle Studie gezeigt, dass die Gabe von perioperativem Lidocain als Analgetikum die ES-bedingte Verbesserung der Nervenregeneration signifikant verringert25. Diese Bedenken könnten zukünftige Studien in vivo vor Herausforderungen stellen.
Wir verwendeten nsPEF ausschließlich zur Stimulation von RSC96-Zellen. Die Zellen, die einer Stimulation mit geringer Intensität unterzogen wurden, zeigten auffällige Veränderungen. Die Dauer des durch nsPEF induzierten Stimulationseffekts ist jedoch nach experimentellen Ergebnissen mit etwa 3 Tagen relativ kurz. In Zukunft könnte erwogen werden, Materialien wie Gold-Nanostäbchen und Nano-Hydrogel zu kombinieren, die die bioelektrischen Wirkungen von pulsierenden elektrischen Feldern verstärken können, wodurch die bioelektrischen Wirkungen von pulsierenden elektrischen Feldern verstärkt und gezieltere und effizientere Behandlungsansätze entwickelt werden30,31.
Im Folgenden finden Sie einige wichtige Überlegungen zum experimentellen Betrieb. Zuerst wurde das CCK-8-Experiment durchgeführt, bei dem die geeignete Feldstärke und Zellkulturzeit nach der elektrischen Stimulation gescreent wurden, um die nachfolgenden experimentellen Schritte und Praktiken zu sparen. Unter unseren Instrumenten- und experimentellen Bedingungen ist der Empfang von fünf Impulsen elektrischer Signale förderlich, um zelluläre Veränderungen zu maximieren. Wenn die Pulsfrequenz zu niedrig ist, reicht die von den Zellen empfangene elektrische Stimulation nicht aus, um die Proliferation und andere Reaktionen zu aktivieren. Auf der anderen Seite kann eine übermäßige Frequenz zu irreversiblen Zellschäden führen. Während der elektrischen Stimulation ist es notwendig, auf den Abstand zwischen den Elektroden zu achten, um eine korrekte Position beizubehalten und sicherzustellen, dass die Elektroden nach einer vorgegebenen Anzahl von Elektroschocks schnell getrennt werden können, um zu verhindern, dass weitere Elektroschocks die Ergebnisse des Experiments beeinträchtigen. Nach Beendigung des Stromschlags sollte das Instrument rechtzeitig geerdet werden, um Schäden am Instrument zu vermeiden.
In dieser Studie förderte nsPEF mit geringer Feldstärke effektiv die Proliferation, Migration, Synthese und Sekretionsfähigkeit relevanter Faktoren in SCs. Obwohl der zugrundeliegende Mechanismus noch geklärt werden muss, bietet diese Studie eine positive Sicht auf die Anwendung von nsPEF zur Stimulierung der Zellproliferation und -migration. Solche Zellproliferationen und -migrationen, die durch nsPEF induziert werden, sind in den aktuellen Forschungsbereichen selten19 . Darüber hinaus sind viele entscheidende Faktoren an der Stimulation von SCs beteiligt. In dieser Studie wurden das spezifische Markerprotein und der neurotrophe Faktor S100β, die Transkriptionsfaktoren Sox10, GFAP und die neuronalen Zytoskelettkomponenten NF-H untersucht. Die Veränderungen, die sie bei der nsPEF-Stimulation erfahren, können die Aktivität von SCs, den Grad der Reparatur in peripheren Nerven und die Prognose in mehreren Dimensionen beurteilen. Alle Ergebnisse zeigten eine signifikante Stimulation von SCs und eine gutartige Prognose durch nsPEF. In Zukunft werden wir weitere Studien an Tiermodellen durchführen und die Auswirkungen unterschiedlicher Intensitäten von nsPEF auf SCs weiter untersuchen, um den optimalen Modus der Pro-Differenzierungs-Stimulation des elektrischen Feldes herauszufiltern.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch das National Key Scientific Instrument and Equipment Development Project (Nr. 82027803) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Wuhan Xavier Biotechnology Co., LTD | G1401 | |
| Anti-GFAP Mouse mAb | Wuhan Xavier Biotechnology Co., LTD | GB12100-100 | |
| Anti-Neurofilament heavy polypeptide Mouse mAb | Wuhan Xavier Biotechnology Co., LTD | GB12144-100 | |
| Anti-S100 beta Mouse mAb | Wuhan Xavier Biotechnology Co., LTD | GB14146-100 | |
| BSA | Wuhan Xavier Biotechnology Co., LTD | GC305010 | |
| Coverslip | Jiangsu Shitai experimental equipment Co., LTD | 10212432C | |
| CY3-labeled goat anti-mouse IgG | Wuhan Xavier Biotechnology Co., LTD | GB21302 | |
| DAPI Staining Reagent | Wuhan Xavier Biotechnology Co., LTD | G1012 | |
| Decolorizing shaker | Wuhan Xavier Biotechnology Co., LTD | DS-2S100 | |
| High Voltage Power Supply for nsPEF | Matsusada Precision Inc. | AU-60P1.6-L | |
| Histochemical pen | Wuhan Xavier Biotechnology Co., LTD | G6100 | |
| Membrane breaking liquid | Wuhan Xavier Biotechnology Co., LTD | G1204 | |
| Microscope slide | Wuhan Xavier Biotechnology Co., LTD | G6012 | |
| Palm centrifuge | Wuhan Xavier Biotechnology Co., LTD | MS6000 | |
| PBS powdered | Wuhan Xavier Biotechnology Co., LTD | G0002 | |
| Pipette | Wuhan Xavier Biotechnology Co., LTD | ||
| Positive fluorescence microscope | Nikon, Japan | NIKON ECLIPSE C1 | |
| Rabbit Anti-SOX10/AF488 Conjugated antibody | Beijing Bioss Biotechnology Co., LTD | BS-20563R-AF488 | |
| RSC96 Schwann cells | Wuhan Xavier Biotechnology Co., LTD | STCC30007G-1 | |
| scanister | 3DHISTECH | Pannoramic MIDI | |
| Special cable for nsPEF | Times Microwave Systems | M17/78-RG217 | |
| Turbine mixer | Wuhan Xavier Biotechnology Co., LTD | MV-100 |
Referenzen
- Jing, W., et al. Study of electrical stimulation with different electric-field intensities in the regulation of the differentiation of PC12 cells. ACS Chem Neurosci. 10 (1), 348-357 (2018).
- Nocera, G., Jacob, C. Mechanisms of Schwann cell plasticity involved in peripheral nerve repair after injury. Cell Mol Life Sci. 77, 3977-3989 (2020).
- Aguilar, Z. . Nanomaterials for Medical Applications. , (2012).
- Xie, S., et al. Efficient generation of functional Schwann cells from adipose-derived stem cells in defined conditions. Cell Cycle. 16 (9), 841-851 (2017).
- Rosenbalm, T. N., Levi, N. H., Morykwas, M. J., Wagner, W. D. Electrical stimulation via repeated biphasic conducting materials for peripheral nerve regeneration. J Mater Sci Mater Med. 34 (11), 1-18 (2023).
- Daly, W. T., et al. Comparison and characterization of multiple biomaterial conduits for peripheral nerve repair. Biomaterials. 34 (34), 8630-8639 (2013).
- Lee, B. -. K., et al. End-to-side neurorrhaphy using an electrospun PCL/collagen nerve conduit for complex peripheral motor nerve regeneration. Biomaterials. 33 (35), 9027-9036 (2012).
- Kim, V., Gudvangen, E., Kondratiev, O., Redondo, L., Xiao, S., Pakhomov, A. G. Peculiarities of neurostimulation by intense nanosecond pulsed electric fields: how to avoid firing in peripheral nerve fibers. Int J Mol Sci. 22 (13), 7051 (2021).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Chen, Y. Y., McDonald, D., Cheng, C., Magnowski, B., Durand, J., Zochodne, D. W. Axon and Schwann cell partnership during nerve regrowth. J Neuropathol Exp Neurol. 64 (7), 613-622 (2005).
- Yi, S., et al. Tau modulates Schwann cell proliferation, migration and differentiation following peripheral nerve injury. J Cell Sci. 132 (6), (2019).
- Min, Q., Parkinson, D. B., Dun, X. Migrating Schwann cells direct axon regeneration within the peripheral nerve bridge. Glia. 69 (2), 235-254 (2021).
- Zhang, Y., Zhao, Q., Chen, Q., Xu, L., Yi, S. Transcriptional control of peripheral nerve regeneration. Mol Neurobiol. 60 (1), 329-341 (2023).
- Nishi, M., Kawata, M., Azmitia, E. C. Trophic interactions between brain-derived neurotrophic factor and S100β on cultured serotonergic neurons. Brain Res. 868 (1), 113-118 (2000).
- Gu, Y., et al. miR-sc8 inhibits Schwann cell proliferation and migration by targeting EGFR. PLoS One. 10 (12), e0145185 (2015).
- Dong, H. -. L., et al. AMPK regulates mitochondrial oxidative stress in C2C12 myotubes induced by electrical stimulations of different intensities. Nan Fang Yi Ke Da Xue Xue Bao. 38 (6), 742-747 (2018).
- Beebe, S. J., Blackmore, P. F., White, J., Joshi, R. P., Schoenbach, K. H. Nanosecond pulsed electric fields modulate cell function through intracellular signal transduction mechanisms. Physiol Meas. 25 (4), 1077 (2004).
- Haberkorn, I., Siegenthaler, L., Buchmann, L., Neutsch, L., Mathys, A. Enhancing single-cell bioconversion efficiency by harnessing nanosecond pulsed electric field processing. Biotechnol Adv. 53, 107780 (2021).
- Ruiz-Fernández, A. R., Campos, L., Gutierrez-Maldonado, S. E., Núñez, G., Villanelo, F., Perez-Acle, T. Nanosecond pulsed electric field (nsPEF): Opening the biotechnological Pandora's box. Int J Mol Sci. 23 (11), 6158 (2022).
- Nuccitelli, R., et al. First-in-human trial of nanoelectroablation therapy for basal cell carcinoma: proof of method. Exp Dermatol. 23 (2), 135-137 (2014).
- Nuccitelli, R., et al. Non-thermal nanoelectroablation of UV-induced murine melanomas stimulates an immune response. Pigment Cell Melanoma Res. 25 (5), 618-629 (2012).
- Carr, L., et al. A nanosecond pulsed electric field (nsPEF) can affect membrane permeabilization and cellular viability in a 3D spheroids tumor model. Bioelectrochemistry. 141, 107839 (2021).
- Hornef, J., Edelblute, C. M., Schoenbach, K. H., Heller, R., Guo, S., Jiang, C. Thermal analysis of infrared irradiation-assisted nanosecond-pulsed tumor ablation. Sci Rep. 10 (1), 5122 (2020).
- Zuo, K. J., Gordon, T., Chan, K. M., Borschel, G. H. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Exp Neurol. 332, 113397 (2020).
- Juckett, L., Saffari, T. M., Ormseth, B., Senger, J. -. L., Moore, A. M. The effect of electrical stimulation on nerve regeneration following peripheral nerve injury. Biomolecules. 12 (12), 1856 (2022).
- Jessen, K. R., Mirsky, R. Negative regulation of myelination: relevance for development, injury, and demyelinating disease. Glia. 56 (14), 1552-1565 (2008).
- Chen, Z. -. L., Yu, W. -. M., Strickland, S. Peripheral regeneration. Annu Rev Neurosci. 30, 209-233 (2007).
- Yin, D., et al. Cutaneous papilloma and squamous cell carcinoma therapy utilizing nanosecond pulsed electric fields (nsPEF). PloS One. 7 (8), e43891 (2012).
- Qi, F., et al. Photoexcited wireless electrical stimulation elevates nerve cell growth. Colloids Surf B Biointerfaces. 220, 112890 (2022).
- Mi, Y., Liu, Q., Li, P., Xu, J., Yang, Q., Tang, J. Targeted gold nanorods combined with low-intensity nsPEFs enhance antimelanoma efficacy in vitro. Nanotechnology. 31 (35), 355102 (2020).
- Ho, T. -. C., et al. Hydrogels: Properties and applications in biomedicine. Molecules. 27 (9), 2902 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten