Method Article
Régulation de la croissance des cellules de Schwann par un champ électrique pulsé nanoseconde pour la régénération des nerfs périphériques in vitro
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons un protocole d’application d’un champ électrique à impulsions nanosecondes (nsPEF) pour stimuler les cellules de Schwann in vitro. La capacité de synthèse et de sécrétion des facteurs pertinents et les changements de comportement cellulaire ont validé la stimulation réussie à l’aide de nsPEF. L’étude donne une vision positive de la méthode de régénération des nerfs périphériques.
Résumé
Les cellules de Schwann (SC) sont des cellules myélinisantes du système nerveux périphérique, jouant un rôle crucial dans la régénération des nerfs périphériques. Le champ électrique pulsé nanoseconde (nsPEF) est une méthode émergente applicable à la stimulation électrique nerveuse qui s’est avérée efficace pour stimuler la prolifération cellulaire et d’autres processus biologiques. Dans le but d’évaluer si les CS subissent des changements significatifs sous nsPEF et d’aider à explorer le potentiel de nouvelles méthodes de régénération des nerfs périphériques, les cellules RSC96 cultivées ont été soumises à une stimulation nsPEF à 5 kV et 10 kV, suivie d’une culture continue pendant 3 à 4 jours. Par la suite, certains facteurs pertinents exprimés par les CS ont été évalués pour démontrer le succès de la stimulation, notamment la protéine marqueur spécifique, le facteur neurotrophique, le facteur de transcription et le régulateur de myélinisation. Les résultats représentatifs ont montré que nsPEF améliorait significativement la prolifération et la migration des CS et la capacité à synthétiser les facteurs pertinents qui contribuent positivement à la régénération des nerfs périphériques. Simultanément, une expression plus faible de GFAP indiquait le pronostic bénin des lésions nerveuses périphériques. Tous ces résultats montrent que nsPEF a un grand potentiel en tant que méthode de traitement efficace des lésions nerveuses périphériques en stimulant les CS.
Introduction
Chaque année, des millions de personnes sont touchées par des lésions nerveuses impliquant à la fois le système nerveux périphérique (SNP) et le système nerveux central (SNC)1. Des études ont démontré que la capacité de réparation axonale du SNC est assez limitée après des lésions nerveuses, tandis que le SNP présente une capacité accrue en raison de la plasticité significative des SC2. Néanmoins, la régénération complète après des lésions des nerfs périphériques reste ardue et continue de poser un défi important à la santé humaine 3,4. De nos jours, les autogreffes sont restées un traitement courant malgré les inconvénients de la morbidité du site donneur et de la disponibilité limitée5. Cette situation a incité les chercheurs à explorer des thérapies alternatives, notamment les matériaux6, les facteurs moléculaires7 et la stimulation électrique (ES). En tant que facteur favorisant la croissance axonale et la régénération nerveuse8, le choix d’une méthode appropriée de SE et l’exploration de la relation entre ES et SC deviennent essentiels.
Les SC sont les principales cellules gliales du SNP, jouant un rôle crucial dans la régénération du SNP 9,10. À la suite de lésions nerveuses périphériques, les CS subissent une activation rapide, une reprogrammation extensive2 et une transition d’un état formant de la myéline à une morphologie favorable à la croissance pour conduire la régénération du nerf2. Une prolifération substantielle de CS se produit à l’extrémité distale du nerf blessé, tandis que les SC du moignon distal subissent une prolifération et un allongement pour former la bande de Bungner, qui est nécessaire pour guider les axones à se développer vers l’organe cible11. De plus, les CS des moignons nerveux proximaux et distaux migrent dans le pont nerveux pour former des cordons SC favorisant la régénération axonale12. De plus, des études antérieures ont démontré que la synthèse et la sécrétion de facteurs pertinents liés aux CS changent dans les cas de régénération nerveuse périphérique, y compris les facteurs de transcription13, les facteurs neurotrophiques14 et les régulateurs de myélinisation13. Sur cette base, la promotion de la prolifération, de la migration, de la synthèse et de la sécrétion de facteurs pertinents a été largement étudiée pour améliorer la régénération des nerfs périphériques15.
Des études antérieures ont démontré la possibilité d’utiliser l’ES pour la régénération nerveuse1. Une explication largement acceptée est que la SEA peut induire une dépolarisation des membranes cellulaires, modifier le potentiel membranaire et affecter les fonctions des protéines membranaires en modifiant les distributions de charge sur ces biomolécules1. Cependant, l’EEP intense largement appliqué peut provoquer des douleurs intenses, des contractions musculaires involontaires et une fibrillation cardiaque8. Il augmente également l’activité de la créatine kinase (CK), diminue la force musculaire et induit le développement de douleurs musculaires d’apparition retardée (DOMS)16. nsPEF est une technique émergente qui stimule les sujets testés avec des champs électriques à haute tension dans une durée d’impulsion de l’ordre de la nanoseconde, et elle est progressivement utilisée dans la recherche au niveau cellulaire17,18. Des études antérieures ont rapporté que la raison possible de la prolifération cellulaire et de l’activité des organites est la formation de nanopores membranaires et l’activation des canaux ioniques, ce qui conduit à une augmentation de la concentration cytoplasmique de Ca2+ 19. nsPEF utilise la technologie de puissance d’impulsion pour charger la membrane de la cellule, produisant des impulsions caractérisées par une courte durée, un temps de montée rapide, une puissance élevée et une faible densité d’énergie20. Ces caractéristiques suggèrent que la nsPEF peut être un mode privilégié avec des effets secondaires de stimulation minimes8. De plus, le nsPEF offre des avantages tels que des procédures peu invasives, la réversibilité, l’adaptabilité et la non-destructivité des tissus neuraux par rapport aux interventions chirurgicales. L’une des principales orientations de recherche de nsPEF dans le domaine biomédical est son application pour l’ablation des tissus tumoraux à l’aide d’une stimulation de champ électrique à haute énergie 21,22,23. Certains résultats de recherche indiquent que le 12-nsPEF peut stimuler les nerfs périphériques sans causer de dommages24. Cependant, à l’heure actuelle, il existe peu de preuves concernant l’application de la nsPEF dans le domaine de la régénération nerveuse. De plus, la stimulation des CS à l’aide de nsPEF est une tentative pionnière, contribuant à faire avancer la recherche in vivo et clinique. Cette étude vise à déterminer si la stimulation nsPEF des SC peut favoriser la régénération nerveuse et fournir une base fiable pour des recherches ultérieures approfondies et systématiques.
Protocole
1. Décongélation de cellules RSC96 cryoconservées
- Décongelez le flacon cryogénique contenant 1 mL de suspension cellulaire en l’agitant rapidement dans un bain-marie à 37 °C, puis ajoutez-le dans un tube à centrifuger contenant 4 à 6 mL de milieu de culture complet et mélangez bien.
- Centrifuger à 1000 x g pendant 3 à 5 min, jeter le surnageant et remettre les cellules en suspension dans 3 mL de milieu de culture complet.
- Ajouter la suspension cellulaire dans une fiole (ou une boîte) contenant de 6 à 8 mL de milieu de culture complet et incuber à 37 °C pendant la nuit.
- Le lendemain, observez la croissance et la densité des cellules au microscope.
2. Passage cellulaire :
REMARQUE : Si la densité cellulaire atteint 80% -90%, il est prêt pour le passage.
- Jetez le milieu de culture et rincez les cellules 1 à 2 fois avec une solution saline tamponnée au phosphate (PBS) sans ions calcium et magnésium.
- Ajouter 0,25 % (p/v) de trypsine-0,53 mM d’EDTA dans le ballon de culture (1 à 2 ml pour un ballon T25, 2 à 3 ml pour un ballon T75) et incuber à 37 °C pendant 1 à 2 minutes.
- Observez le décollement cellulaire au microscope. Si la plupart des cellules deviennent rondes et se détachent, remettez rapidement le ballon dans la zone de travail, tapotez doucement le ballon et ajoutez 3 à 4 ml de milieu de culture contenant 10 % de FBS pour arrêter la digestion.
- Mélanger le contenu, aspirer la solution et centrifuger à 1000 x g pendant 5 min. Ensuite, jetez le surnageant et remettez les cellules en suspension en ajoutant 1 à 2 ml de milieu de culture frais et en pipetant doucement.
- Transvaser la suspension cellulaire dans une nouvelle fiole T25 dans un rapport de 1:2 et ajouter 7 mL de milieu de culture.
3. Fonctionnement du dispositif nsPEF
- Remettre les cellules RSC96 en suspension dans 1 mL de milieu de culture DMEM et les transférer dans des boîtes colorimétriques avec des électrodes des deux côtés.
- Allumez l’interrupteur d’alimentation.
- Ajustez les paramètres en tournant le bouton de l’instrument pour modifier l’intensité du champ électrique. Les intensités définies dans cette étude sont de 5 kV/cm, 10 kV/cm, 20 kV/cm et 40 kV/cm.
- Faites pivoter soigneusement les électrodes jusqu’à ce que des étincelles apparaissent, ce qui permet aux cellules de recevoir 5 impulsions de nsPEF selon les intensités de champ prédéfinies avant de séparer immédiatement les deux électrodes. Après ce traitement, prélever les cellules du groupe expérimental traitées avec nsPEF et les cellules du groupe témoin non traitées pour effectuer les sections 4 à 6, respectivement, après une certaine période de culture cellulaire (1 jour dans cette expérience).
4. Test du kit de comptage cellulaire-8 (CCK-8)
- Préparez une suspension cellulaire d’une concentration particulière à partir de cellules RSC96 stimulées par stimulation électrique. Ajouter 100 μL de suspension cellulaire dans chaque puits d’une plaque de culture cellulaire de 96 puits. Compte tenu des exigences du test CCK-8, contrôlez le nombre total de cellules dans le kit de réactifs entre 1 x 103 et 1 x 106.
- Prélever 10 μL de solution de CCK-8 dans le kit et l’ajouter à la plaque de culture cellulaire à 96 puits. Incuber dans un incubateur de CO2 à 37 °C pendant 30 min à 4 h supplémentaires.
- Mesurez l’absorbance. Utilisez la mesure à double longueur d’onde avec une longueur d’onde de détection de 430-490 nm et une longueur d’onde de référence de 600-650 nm.
- Déterminer l’intensité du champ pour les expériences ultérieures en fonction des résultats expérimentaux de la prolifération cellulaire. Sélectionnez des cellules avec une bonne prolifération pour les expériences ultérieures.
5. Essai de rayure cellulaire
- Dans chaque puits d’une plaque à six puits, ensemencer 3 x 105 cellules d’un volume total de 2 mL par puits. Environ 72 h plus tard, les cellules couvriront le puits. Effectuez le test sur le groupe expérimental et le groupe témoin séparément.
- À l’aide d’une pointe de pipette, tracez une ligne horizontale au fond du puits de culture. Assurez-vous que la pointe de la pipette est maintenue verticalement et essayez d’éviter de l’incliner.
- Aspirez le milieu de culture et lavez-le avec du PBS 2 à 3 fois.
- Ajouter 2 ml de milieu sans sérum dans chaque puits.
- Placez la plaque dans l’incubateur à 37 °C. Prenez des photos sous un grossissement quadruple du microscope inversé à 0 h et 24 h pour observer les changements dans la migration cellulaire.
6. Immunofluorescence
- Perméabilisation cellulaire :
- Après avoir doucement pipeté des suspensions cellulaires dans des boîtes de culture, tracez des cercles avec un stylo d’histologie aux endroits où les cellules sont uniformément réparties sur la lamelle. Traitez séparément le groupe témoin et les différents groupes expérimentaux.
- Ajouter 50 à 100 μL de solution de travail de perméabilisation (0,25 à 0,5 % Triton X-100) et incuber à température ambiante (RT) pendant 20 min. Lavez trois fois avec du PBS pendant 5 minutes à chaque fois.
- Blocage sérique : Ajouter 3 % de BSA dans les cercles pour couvrir uniformément les tissus. Incuber à RT pendant 30 min.
- Incubation de l’anticorps primaire : Retirer délicatement la solution bloquante et ajouter l’anticorps primaire correctement dilué (dérivé de la souris, dilué à 1:300) dans les puits cellulaires. Placez la plaque de culture cellulaire dans une boîte humide et incubez toute la nuit à 4 °C.
- Incubation secondaire des anticorps : Placez la plaque cellulaire sur un agitateur et lavez-la trois fois pendant 5 minutes à chaque fois. Ajouter l’anticorps secondaire correspondant (IgG anti-souris de chèvre marquées au CY3, diluées à 1:300) et incuber à RT pendant 50 min.
- Coloration nucléaire DAPI :
- Placez la lamelle dans du PBS (pH 7,4) sur un shaker et lavez-la trois fois pendant 5 minutes à chaque fois.
- Après avoir séché doucement la lame, ajoutez la solution de coloration DAPI (2 μg/mL, 0,5 mL par cercle) à l’intérieur des cercles et incubez à RT pendant 10 min dans une pièce sombre.
- Montage : Placez la lamelle dans du PBS (pH 7,4) sur un shaker et lavez-la trois fois pendant 5 minutes à chaque fois. Après avoir séché doucement la lame, scellez la lamelle avec un agent de montage anti-décoloration pour la fluorescence.
- Acquisition d’images : Exciter le DAPI à une longueur d’onde de 330-380 nm et détecter l’émission à 420 nm ; exciter à 465-495 nm et détecter l’émission à 515-555 nm pour AF488 ; exciter à 510-560 nm et détecter l’émission à 590 nm pour CY3 ; exciter à 608-648 nm et détecter l’émission à 672-712 nm pour CY5.
Résultats
Les champs électriques pulsés de faible intensité stimulent la prolifération cellulaire
Selon le test CCK-8, le taux de prolifération de RSC96 dans le groupe 5 kV/cm était significativement plus rapide que celui des cellules du groupe témoin. Cependant, à mesure que les paramètres augmentaient (20 kV/cm et 40 kV/cm), le taux de prolifération était instable, même inférieur à celui du groupe témoin. Le taux de prolifération cellulaire des cellules RSC96 dans le groupe 40 kV/cm était significativement inférieur à celui des groupes témoins et 5 kV/cm, montrant une différence statistique significative (P < 0,05). En raison de l’absence de respect des exigences expérimentales de prolifération cellulaire, les groupes de 20 kV/cm et de 40 kV/cm ont été exclus des expériences ultérieures (figure 1).
Les champs électriques pulsés de faible intensité favorisent l’expression de S100β
S100β, en tant que protéine marqueur spécifique des CS, participe à diverses fonctions, notamment l’extension des neurites et la prolifération axonale14. De plus, il a été constaté que la protéine S100β agit comme un facteur neurotrophique au cours du développement, et son expression augmente en cas de lésions nerveuses. Des études antérieures ont démontré que S100β peut travailler avec le facteur neurotrophique dérivé du cerveau (BDNF) pour réguler différentes cascades de transduction de signal et contribuer à la maturation neuronale de la croissance axonale14,25. Au microscope, des cellules cytoplasmiques S100β positives dispersées en rouge ont été observées dans des tests de crawling cellulaire dans tous les groupes (Figure 2A). Après trois jours de culture, la densité optique intégrée (IOD) de la fluorescence dans le groupe 5 kV/cm des cellules RSC96 était significativement plus élevée que celle du groupe témoin et du groupe 10 kV/cm, montrant une différence statistique significative (***P < 0,001 ; ****P < 0,0001) (Figure 2B).
Les champs électriques pulsés de faible intensité favorisent l’expression de NF-H
NF-H interagit avec d’autres filaments intermédiaires pour former un réseau et est un composant majeur du cytosquelette neuronal. Au microscope, des cellules cytoplasmiques NF-H positives dispersées en rouge ont été observées dans des tests de crawling cellulaire dans tous les groupes (Figure 3A). Après trois jours de culture, la densité optique intégrée (IOD) de fluorescence dans le groupe 5 kV/cm des cellules RSC96 était significativement plus élevée que celle du groupe témoin et du groupe 10 kV/cm, montrant une différence statistique significative (*P<0,05 ; **P < 0,01) (Figure 3B).
Les champs électriques pulsés de faible intensité régulent l’expression de la GFAP
L’expression de la protéine acide fibrillaire gliale (GFAP) est l’un des indicateurs de l’activité astrocytaire. Les astrocytes présentent d’abord une prolifération réactive à la suite d’une lésion nerveuse, ce qui a un effet protecteur dans les premiers stades. Cependant, une prolifération excessive de cellules gliales peut entraîner la formation de cicatrices gliales, entravant la connectivité des fibres neuronales26. Des recherches antérieures ont démontré que les gènes généralement exprimés pendant la croissance axonale sont réexprimés, tels que GFAP27. Au microscope, des cellules cytoplasmiques positives à la GFAP dispersées en rouge ont été observées dans des tests de crawling cellulaire dans tous les groupes (Figure 4A). Après trois jours de culture, la densité optique intégrée (IOD) de la fluorescence dans le groupe 5 kV/cm des cellules RSC96 était significativement inférieure à celle du groupe témoin et du groupe 10 kV/cm, montrant une différence statistique significative (****P < 0,0001 ; ***P < 0,001) (Figure 4B).
Les champs électriques pulsés de faible intensité favorisent l’expression de Sox10
Sox10 est exprimé en continu dans les SC, un facteur de transcription clé pour la myélinisation des nerfs périphériques13. Au microscope, des cellules cytoplasmiques positives à Sox10 dispersées en vert ont été observées dans des tests de crawling cellulaire dans tous les groupes (Figure 5A). Après 3 jours de culture, la valeur grise moyenne dans le groupe 5 kV/cm des cellules RSC96 était significativement plus élevée que celle du groupe témoin et du groupe 10 kV/cm, montrant une différence statistique significative (*P < 0,05 ; *P < 0,05) (Figure 5B).
Les champs électriques pulsés de faible intensité favorisent la migration cellulaire
En comparant les taux de migration des cellules RSC96 après 24 h d’essai de grattage, il a été observé que la migration des cellules RSC96 dans le groupe 5 kV/cm était significativement accélérée par rapport au groupe témoin et au groupe 10 kV/cm (Figure 6).

Figure 1 : Essai CCK8 de la prolifération cellulaire de cellules RSC96 stimulées à 5 kV/cm, 10 kV/cm, 20 kV/cm et 40 kV/cm, et témoins. Les résultats représentent la moyenne ± écart-type sur la base de ≥3 répétitions. NS non significatif ; *P < 0,05 ; **P < 0,01 ; **P < 0,01 Veuillez cliquer ici pour voir une version agrandie de cette figure.
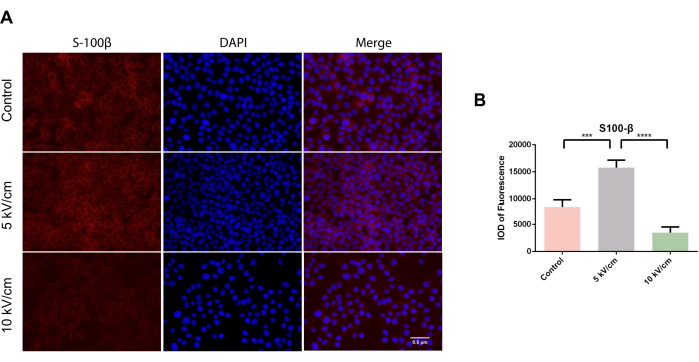
Figure 2 : Expression de S100β dans les cellules RSC96 stimulées à 5 kV/cm, 10 kV/cm, et les témoins. Les résultats représentent la moyenne ± écart-type sur la base de ≥3 répétitions. P < 0,001 ; P < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
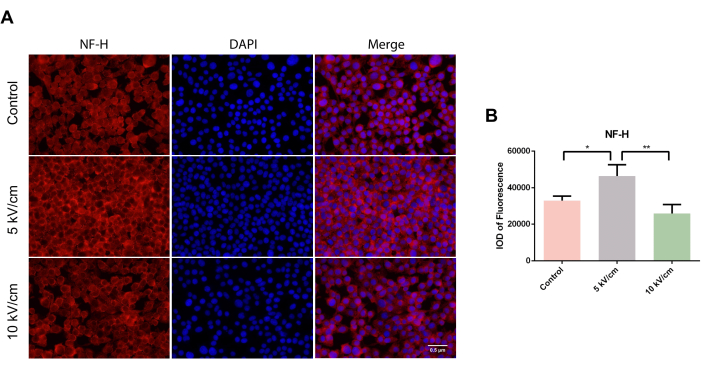
Figure 3 : Expression de NF-H dans les cellules RSC96 stimulées à 5 kV/cm, 10 kV/cm, et contrôles. Les résultats représentent la moyenne ± écart-type sur la base de ≥3 répétitions. *P < 0,05 ; **P < 0,01. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Expression de GFAP dans les cellules RSC96 stimulées à 5 kV/cm, 10 kV/cm, et contrôles. Les résultats représentent la moyenne ± écart-type sur la base de ≥3 répétitions. P < 0,0001 ; P < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
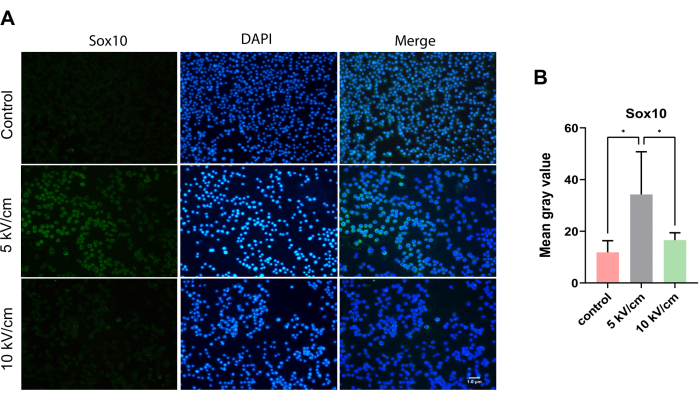
Figure 5 : Expression de Sox10 dans les cellules RSC96 stimulées à 5 kV/cm, 10 kV/cm, et les contrôles. Les résultats représentent la moyenne ± écart-type sur la base de ≥3 répétitions. *P < 0,05 ; *P < 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
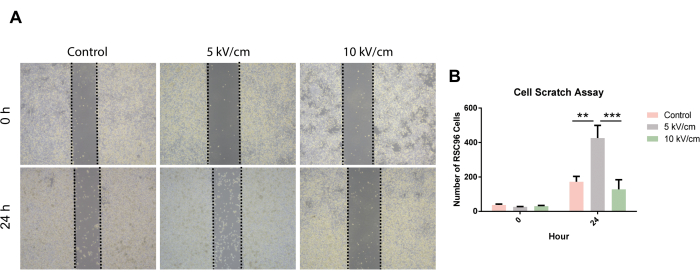
Figure 6 : Essai de grattage cellulaire de cellules RSC96 stimulées à 5 kV/cm, 10 kV/cm, et contrôles. Les résultats représentent la moyenne ± écart-type sur la base de ≥3 répétitions. **P < 0,01 ; P < 0,001. Les données statistiques sont basées sur l’ANOVA unidirectionnelle ordinaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ces dernières années, l’application de nsPEF a connu une croissance stimulée, comme indiqué. nsPEF a un effet très ciblé uniquement sur la zone souhaitée, fournissant suffisamment d’énergie pour traiter sans causer de dommages thermiques supplémentaires, ce qui le rend plus sûr pour le corps humain28. Ces caractéristiques lui confèrent des perspectives translationnelles prometteuses dans le traitement des tumeurs et la régénération nerveuse. Cependant, certaines études ont proposé certaines limites de la nsPEF. Par rapport à la recherche sur les matériaux, l’ES est limitée par des sources d’alimentation externes et des fils29. De plus, une étude récente a prouvé que l’administration de lidocaïne périopératoire en tant qu’analgésique diminue significativement l’amélioration de la régénération nerveuse liée à l’ES25. Ces préoccupations pourraient poser des défis pour les études futures in vivo.
Nous avons uniquement utilisé nsPEF pour stimuler les cellules RSC96. Les cellules soumises à une stimulation de faible intensité ont montré des changements notables. Cependant, la durée de l’effet de stimulation induit par nsPEF est relativement courte, environ 3 jours, selon les résultats expérimentaux. À l’avenir, on pourrait envisager de combiner des matériaux tels que des nanotiges d’or et du nanohydrogel qui peuvent améliorer les effets bioélectriques des champs électriques pulsés, augmentant ainsi les effets bioélectriques des champs électriques pulsés et développant des approches de traitement plus ciblées et plus efficaces30,31.
Voici quelques considérations essentielles à l’opération expérimentale. L’expérience CCK-8 a été réalisée en premier, au cours de laquelle l’intensité de champ appropriée et le temps de culture cellulaire après stimulation électrique ont été criblés pour sauvegarder les étapes et les pratiques expérimentales ultérieures. Dans nos instruments et dans les conditions expérimentales, la réception de cinq impulsions de signaux électriques est propice à l’optimisation des changements cellulaires. Si la fréquence d’impulsion est trop faible, la stimulation électrique reçue par les cellules est insuffisante pour activer la prolifération et d’autres réponses. D’autre part, une fréquence excessive peut entraîner des dommages cellulaires irréversibles. Pendant la stimulation électrique, il est nécessaire de faire attention à la distance entre les électrodes pour maintenir une position correcte afin de s’assurer que les électrodes peuvent être rapidement séparées après un nombre prédéterminé de chocs électriques afin d’éviter que d’autres chocs électriques n’affectent les résultats de l’expérience. Une fois le choc électrique terminé, l’instrument doit être mis à la terre à temps pour éviter d’endommager l’instrument.
Dans cette étude, la nsPEF à faible intensité de champ a efficacement favorisé la prolifération, la migration, la synthèse et la capacité de sécrétion des facteurs pertinents dans les CS. Bien que le mécanisme sous-jacent doive encore être clarifié, cette étude fournit une vision positive de l’application de nsPEF pour stimuler la prolifération et la migration cellulaires. Une telle prolifération cellulaire et une telle migration induites par nsPEF sont rares19 dans les domaines de recherche actuels. De plus, de nombreux facteurs cruciaux sont impliqués dans la stimulation des SC. Cette étude a évalué la protéine marqueur spécifique et le facteur neurotrophique S100β, les facteurs de transcription Sox10, GFAP et les composants du cytosquelette neuronal NF-H. Les altérations qu’ils subissent dans la stimulation nsPEF peuvent évaluer l’activité des SC, le niveau de réparation dans les nerfs périphériques et le pronostic dans plusieurs dimensions. Tous les résultats ont démontré la stimulation significative des CS et le pronostic bénin par nsPEF. À l’avenir, nous mènerons d’autres études sur des modèles animaux et étudierons davantage les effets de différentes intensités de nsPEF sur les SC afin d’éliminer le mode optimal de stimulation du champ électrique pro-différenciation.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par le National Key Scientific Instrument and Equipment Development Project (NO.82027803).
matériels
| Name | Company | Catalog Number | Comments |
| Antifade mounting medium | Wuhan Xavier Biotechnology Co., LTD | G1401 | |
| Anti-GFAP Mouse mAb | Wuhan Xavier Biotechnology Co., LTD | GB12100-100 | |
| Anti-Neurofilament heavy polypeptide Mouse mAb | Wuhan Xavier Biotechnology Co., LTD | GB12144-100 | |
| Anti-S100 beta Mouse mAb | Wuhan Xavier Biotechnology Co., LTD | GB14146-100 | |
| BSA | Wuhan Xavier Biotechnology Co., LTD | GC305010 | |
| Coverslip | Jiangsu Shitai experimental equipment Co., LTD | 10212432C | |
| CY3-labeled goat anti-mouse IgG | Wuhan Xavier Biotechnology Co., LTD | GB21302 | |
| DAPI Staining Reagent | Wuhan Xavier Biotechnology Co., LTD | G1012 | |
| Decolorizing shaker | Wuhan Xavier Biotechnology Co., LTD | DS-2S100 | |
| High Voltage Power Supply for nsPEF | Matsusada Precision Inc. | AU-60P1.6-L | |
| Histochemical pen | Wuhan Xavier Biotechnology Co., LTD | G6100 | |
| Membrane breaking liquid | Wuhan Xavier Biotechnology Co., LTD | G1204 | |
| Microscope slide | Wuhan Xavier Biotechnology Co., LTD | G6012 | |
| Palm centrifuge | Wuhan Xavier Biotechnology Co., LTD | MS6000 | |
| PBS powdered | Wuhan Xavier Biotechnology Co., LTD | G0002 | |
| Pipette | Wuhan Xavier Biotechnology Co., LTD | ||
| Positive fluorescence microscope | Nikon, Japan | NIKON ECLIPSE C1 | |
| Rabbit Anti-SOX10/AF488 Conjugated antibody | Beijing Bioss Biotechnology Co., LTD | BS-20563R-AF488 | |
| RSC96 Schwann cells | Wuhan Xavier Biotechnology Co., LTD | STCC30007G-1 | |
| scanister | 3DHISTECH | Pannoramic MIDI | |
| Special cable for nsPEF | Times Microwave Systems | M17/78-RG217 | |
| Turbine mixer | Wuhan Xavier Biotechnology Co., LTD | MV-100 |
Références
- Jing, W., et al. Study of electrical stimulation with different electric-field intensities in the regulation of the differentiation of PC12 cells. ACS Chem Neurosci. 10 (1), 348-357 (2018).
- Nocera, G., Jacob, C. Mechanisms of Schwann cell plasticity involved in peripheral nerve repair after injury. Cell Mol Life Sci. 77, 3977-3989 (2020).
- Aguilar, Z. . Nanomaterials for Medical Applications. , (2012).
- Xie, S., et al. Efficient generation of functional Schwann cells from adipose-derived stem cells in defined conditions. Cell Cycle. 16 (9), 841-851 (2017).
- Rosenbalm, T. N., Levi, N. H., Morykwas, M. J., Wagner, W. D. Electrical stimulation via repeated biphasic conducting materials for peripheral nerve regeneration. J Mater Sci Mater Med. 34 (11), 1-18 (2023).
- Daly, W. T., et al. Comparison and characterization of multiple biomaterial conduits for peripheral nerve repair. Biomaterials. 34 (34), 8630-8639 (2013).
- Lee, B. -. K., et al. End-to-side neurorrhaphy using an electrospun PCL/collagen nerve conduit for complex peripheral motor nerve regeneration. Biomaterials. 33 (35), 9027-9036 (2012).
- Kim, V., Gudvangen, E., Kondratiev, O., Redondo, L., Xiao, S., Pakhomov, A. G. Peculiarities of neurostimulation by intense nanosecond pulsed electric fields: how to avoid firing in peripheral nerve fibers. Int J Mol Sci. 22 (13), 7051 (2021).
- Assinck, P., Duncan, G. J., Hilton, B. J., Plemel, J. R., Tetzlaff, W. Cell transplantation therapy for spinal cord injury. Nat Neurosci. 20 (5), 637-647 (2017).
- Chen, Y. Y., McDonald, D., Cheng, C., Magnowski, B., Durand, J., Zochodne, D. W. Axon and Schwann cell partnership during nerve regrowth. J Neuropathol Exp Neurol. 64 (7), 613-622 (2005).
- Yi, S., et al. Tau modulates Schwann cell proliferation, migration and differentiation following peripheral nerve injury. J Cell Sci. 132 (6), (2019).
- Min, Q., Parkinson, D. B., Dun, X. Migrating Schwann cells direct axon regeneration within the peripheral nerve bridge. Glia. 69 (2), 235-254 (2021).
- Zhang, Y., Zhao, Q., Chen, Q., Xu, L., Yi, S. Transcriptional control of peripheral nerve regeneration. Mol Neurobiol. 60 (1), 329-341 (2023).
- Nishi, M., Kawata, M., Azmitia, E. C. Trophic interactions between brain-derived neurotrophic factor and S100β on cultured serotonergic neurons. Brain Res. 868 (1), 113-118 (2000).
- Gu, Y., et al. miR-sc8 inhibits Schwann cell proliferation and migration by targeting EGFR. PLoS One. 10 (12), e0145185 (2015).
- Dong, H. -. L., et al. AMPK regulates mitochondrial oxidative stress in C2C12 myotubes induced by electrical stimulations of different intensities. Nan Fang Yi Ke Da Xue Xue Bao. 38 (6), 742-747 (2018).
- Beebe, S. J., Blackmore, P. F., White, J., Joshi, R. P., Schoenbach, K. H. Nanosecond pulsed electric fields modulate cell function through intracellular signal transduction mechanisms. Physiol Meas. 25 (4), 1077 (2004).
- Haberkorn, I., Siegenthaler, L., Buchmann, L., Neutsch, L., Mathys, A. Enhancing single-cell bioconversion efficiency by harnessing nanosecond pulsed electric field processing. Biotechnol Adv. 53, 107780 (2021).
- Ruiz-Fernández, A. R., Campos, L., Gutierrez-Maldonado, S. E., Núñez, G., Villanelo, F., Perez-Acle, T. Nanosecond pulsed electric field (nsPEF): Opening the biotechnological Pandora's box. Int J Mol Sci. 23 (11), 6158 (2022).
- Nuccitelli, R., et al. First-in-human trial of nanoelectroablation therapy for basal cell carcinoma: proof of method. Exp Dermatol. 23 (2), 135-137 (2014).
- Nuccitelli, R., et al. Non-thermal nanoelectroablation of UV-induced murine melanomas stimulates an immune response. Pigment Cell Melanoma Res. 25 (5), 618-629 (2012).
- Carr, L., et al. A nanosecond pulsed electric field (nsPEF) can affect membrane permeabilization and cellular viability in a 3D spheroids tumor model. Bioelectrochemistry. 141, 107839 (2021).
- Hornef, J., Edelblute, C. M., Schoenbach, K. H., Heller, R., Guo, S., Jiang, C. Thermal analysis of infrared irradiation-assisted nanosecond-pulsed tumor ablation. Sci Rep. 10 (1), 5122 (2020).
- Zuo, K. J., Gordon, T., Chan, K. M., Borschel, G. H. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Exp Neurol. 332, 113397 (2020).
- Juckett, L., Saffari, T. M., Ormseth, B., Senger, J. -. L., Moore, A. M. The effect of electrical stimulation on nerve regeneration following peripheral nerve injury. Biomolecules. 12 (12), 1856 (2022).
- Jessen, K. R., Mirsky, R. Negative regulation of myelination: relevance for development, injury, and demyelinating disease. Glia. 56 (14), 1552-1565 (2008).
- Chen, Z. -. L., Yu, W. -. M., Strickland, S. Peripheral regeneration. Annu Rev Neurosci. 30, 209-233 (2007).
- Yin, D., et al. Cutaneous papilloma and squamous cell carcinoma therapy utilizing nanosecond pulsed electric fields (nsPEF). PloS One. 7 (8), e43891 (2012).
- Qi, F., et al. Photoexcited wireless electrical stimulation elevates nerve cell growth. Colloids Surf B Biointerfaces. 220, 112890 (2022).
- Mi, Y., Liu, Q., Li, P., Xu, J., Yang, Q., Tang, J. Targeted gold nanorods combined with low-intensity nsPEFs enhance antimelanoma efficacy in vitro. Nanotechnology. 31 (35), 355102 (2020).
- Ho, T. -. C., et al. Hydrogels: Properties and applications in biomedicine. Molecules. 27 (9), 2902 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon