Method Article
Dehücreli Akciğer Ekstraselüler Matriks Hidrojellerinin Geliştirilmesi ve Karakterizasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Protokol, doğal sığır pulmoner dokularına uygulanan iki farklı hücre dışı bırakma metodolojisini açıklığa kavuşturur ve bunların ilgili karakterizasyonlarının kapsamlı bir açıklamasını sağlar.
Özet
Hücre dışı matriks (ECM) türevi hidrojellerin doku mühendisliğinde kullanımı, hücrelerin doğal ortamını in vitro olarak taklit edebildikleri için giderek daha popüler hale gelmiştir. Bununla birlikte, ECM'nin doğal biyokimyasal içeriğini korumak, mekanik stabiliteyi sağlamak ve hücreden arındırma işleminin ECM hidrojellerinin mekanik özellikleri üzerindeki etkisini anlamak zordur. Burada, iki farklı protokol kullanılarak sığır akciğer dokusunun hücreden arındırılması için bir boru hattı, hücreden arındırmanın etkinliğinin aşağı akış karakterizasyonu, sulandırılmış hücreden arındırılmış akciğer ECM hidrojellerinin üretimi ve mekanik ve sitouyumluluk özelliklerinin değerlendirilmesi anlatılmıştır. Sığır akciğerinin hücreden arındırılması, fiziksel (donma-çözülme döngüleri) veya kimyasal (deterjan bazlı) bir yöntem kullanılarak gerçekleştirildi. Hematoksilen ve Eozin boyama, ana ECM bileşenlerinin hücreden arındırılmasını ve tutulmasını doğrulamak için yapıldı. Decellularize örneklerde rezidüel kollajen ve sülfatlanmış glikozaminoglikan (sGAG) içeriğinin değerlendirilmesi için sırasıyla Sirius kırmızısı ve Alcian mavisi boyama teknikleri kullanıldı. Hücrelerden arındırılmış akciğer ECM hidrojellerinin mekanik özellikleri, salınımlı reoloji ile karakterize edildi. Sonuçlar, hücrelerden arındırılmış sığır akciğer hidrojellerinin, çoğu doğal ECM bileşenini koruyarak ticari ECM ürünlerine güvenilir bir organotipik alternatif sağlayabileceğini göstermektedir. Ayrıca, bu bulgular, tercih edilen hücre çözme yönteminin, jelleşme kinetiğinin yanı sıra elde edilen hidrojellerin sertlik ve viskoelastik özelliklerini önemli ölçüde etkilediğini ortaya koymaktadır.
Giriş
Konvansiyonel tek tabakalı kültür koşulları, doğal doku mikro ortamlarının sadık bir temsilini sunmaz ve hücre-matris ve hücre-hücre etkileşimlerini sağlayan öğretici ligandlarla üç boyutlu (3D) bir iskele sağlama yeteneğinden yoksundur1. Ekstraselüler matriks (ECM) bileşimi ve mekanik özellikleri oldukça dokuya özgüdür, zamana bağlıdır ve patolojik durumlarda değişikliklere uğrar. Bu nedenle, bu özelliklerin ayarlanabilirliğine, hücresel davranışın modülasyonuna ve istenen doku işlevselliğinin elde edilmesine izin veren biyomimetik 3D doku modellerine ihtiyaç vardır. Doğal ECM'den türetilen biyomalzemeler, dokuya özgü ECM 1,2,3,4,5'i doğrudan kullanabilme yeteneği ile doku mühendisliğinde büyük ilgi görmektedir. ECM tabanlı taşıyıcılar, doku rejenerasyonundan hastalık modeli geliştirmeye kadar birçok uygulamada kullanılmıştır. Enjekte edilebilir veya implante edilebilir biyomateryal iskeleleri 4,5, ilaç tarama uygulamalarında 6,7, hücre büyümesini indükleyen materyallerin geliştirilmesinde 8,9,10, biyo-mürekkepler 11,12,13, mikroakışkanlar14 ve kanser dokusu modellerinde 15,16,17,18,19.
Doku ve organların hücreden arındırılması, dokuya özgü ECM'yi taklit eden yapı iskeleleri oluşturmak için popüler bir yaklaşımdır. Hücrelerden arındırılmış doku ve organların hidrojeller halinde sulandırılması, hücrelerin biyomimetik 3D doku modellerine gömülmesine izin verir20. Hücre çözme teknikleri, esas olarak ECM bileşimini korurken hücresel bileşenleri ortadan kaldırmaya odaklanır. Dokuları hücreden arındırmak için donma-çözülme döngüleri gibi fiziksel yöntemler veya Triton-X-100 tedavisi gibi kimyasal işlemler yaygın olarak uygulanır. Ayrıca, hücre gömülmesi üzerine immünolojik yanıtları en aza indirmek için kalıntı DNA'nın uzaklaştırılması için DNaz tedavisi tercih edilir. Hücre giderme prosedürlerini optimize etmek için maksimum hücre giderimi ve minimum ECM bozulması elde etmek çok önemlidir21. Bu yönlerin yanı sıra, yeniden yapılandırılmış iskelelerin viskoelastisite ve sertlik dahil olmak üzere biyokimyasal ve mekanik özelliklerinin karakterizasyonu, doğal matrislerden türetilen tasarlanmış 3D doku modellerinin iyileştirilmesi için çok önemlidir20.
Akciğer doku mühendisliğinde organa özgü ECM, gelişimsel, homeostatik veya patolojik süreçleri in vitro modellemek ve terapötikleri fizyo-mimetik bir ortamda test etmek için pulmoner mikroçevrenin taklit edilmesine izin verir 20,22,23. Önceki çalışmalar, sıçanlar, domuz eti ve insanlar gibi çeşitli türlerden akciğer dokusunun hücreden arındırıldığını göstermiştir, ancak bu yöntemler henüz sığır gibi daha az kullanılan türlere uyarlanmamıştır. Hücreden arındırma sürecinin parametrelerinin ve bunların biyokimyasal bileşim ve mekanik özelliklerle ilgili olarak ortaya çıkan yeniden yapılandırılmış ECM iskelelerini nasıl etkilediğinin daha iyi anlaşılması, bu yönlerin daha iyi ayarlanmasına izin verecek ve sağlık ve hastalıkta daha güvenilir doku modellerinin önünü açacaktır. Bu çalışmada, donma-çözülme siklusları ve Triton-X-100 tedavisi olmak üzere iki farklı yöntemle sığır akciğeri hücreden arındırma açıkça tanımlanmış ve ardından hücrelerden arındırılmış akciğer ECM (dECM) hidrojellerinin biyokimyasal ve mekanik analizleri yapılmıştır. Bulgular, her iki yöntemin de ECM ligandlarının etkili bir şekilde hücreden arındırılmasını ve tutulmasını sağladığını ortaya koymaktadır. Özellikle, yöntem seçimi, sulandırılmış hidrojellerin ortaya çıkan sertliğini ve viskoelastisitesini önemli ölçüde değiştirir. Sığır dECM'sinden türetilen hidrojeller, insan akciğerinin hücre dışı matrisi ile dikkate değer biyokimyasal analojiler gösterir ve güvenilir termal jelleşme özellikleri sergilerler20. Daha önce açıklandığı gibi, her iki yöntem de akciğer kanseri hücrelerinin, sağlıklı bronşiyal epitel hücrelerinin ve hasta kaynaklı akciğer organoidlerinin 3D kültürü için uygundur20.
Protokol
Genç (1-2 yaş) sığır donörlerinden taze yerli akciğerler, yerel bir mezbahadan elde edildi ve buz üzerinde kapalı bir plastik kapta laboratuvara taşındı. Hayvan kurbanı, genel et tüketimi (atık olarak atılan akciğerler) için yapılır ve çalışma ile ilgili veya çalışma nedeniyle değildir. Kesimhanenin ulusal hayvan kurban etme yasalarına ve yönetmeliklerine uygun olduğunu onaylıyoruz. Ayrıca, sadece atık malzeme kullandığımızı ve araştırma projesinin kurban edilen hayvan sayısı üzerinde bir etkisi olmadığını teyit ediyoruz.
1. Organların toplanması ve doku hazırlığı
- Deneye kadar taze elde edilen sığır akciğer dokularını -80 °C'de saklayın.
- Deney günü, donmuş akciğer dokularının oda sıcaklığında çözülmesini bekleyin.
- Trakea ve kıkırdaklı hava yollarını çıkarmak için dokuları steril neşter ve makasla inceleyin ve küçük parçalara ayırın (5 mm3).
- En az 3x %2 penisilin / streptomisin (P / S) içeren ultra saf su ile iyice yıkayın.
2. Dokuların hücresizleştirilmesi
NOT: Doğal sığır akciğer dokuları iki farklı protokol kullanılarak hücreden arındırılmıştır.
- Donma-çözülme yöntemi
- Doku örneklerini 1. adıma göre hazırlayın. Kıyılmış dokuları steril damıtılmış suda (dH2O) 1 dakika boyunca% 2 iyot çözeltisine daldırın. Steril dH2O'da art arda iki yıkama gerçekleştirin.
- Kıyılmış doku parçalarını 15 mL seviyesine kadar 50 mL'lik bir tüpe aktarın ve taşınabilir bir sıvı nitrojen kabı kullanarak beş manuel donma-çözülme döngüsü uygulayın. Tüpleri steril dH2O ile doldurun ve tüpleri sıvı nitrojen içinde 2 dakika dondurun. 2 dakika sonra hemen 10 dakika boyunca 37 °C'lik bir su banyosuna aktarın. Bu, 1 döngü donma-çözülme oluşturur.
- Numuneleri 10 mL DNaz çözeltisi (10 U/mL) ile 10 mM MgCl2 tamponunda (pH 7.5) 100 rpm'de sabit çalkalama altında 37 °C'de 1 saat inkübe edin.
- Her 24 saatte bir çözelti ikmali ile 100 rpm'de sürekli çalkalayarak 3 gün boyunca steril dH2O ile kapsamlı bir yıkamaya devam edin.
- Liyofilizasyon ve kriyofrezelemeyi aşağıdaki gibi gerçekleştirin20: Islak dECM numunelerini -80 °C'de 24 saat dondurun. Dondurulmuş numuneleri bir liyofilizatöre aktarın ve tamamen kuruyana kadar 3 ila 4 gün vakum altında kurutma modunda çalıştırın. Dondurarak kurutmanın tamamlanmasının ardından, bir öğütme aparatı ve kuru buz kullanarak numunelerin ince bir toz formuna öğütülmesini gerçekleştirin.
NOT: Bu ince toz hali, sindirim işleminin sonraki aşamalarında gelişmiş çözünürlük özellikleri nedeniyle gerekli kabul edilir.
- Triton-X-100 yöntemi
- Doku örneklerini 1. adıma göre hazırlayın. Akciğer dokularını 4 ° C'de hafif rotasyon altında 3 gün boyunca% 1 Triton-X-100 ile tedavi edin. Her 24 saatte bir değişim çözümü.
- Numuneleri DNaz çözeltisi (10U/mL) ile 10 mM MgCl2 tamponunda (pH 7.5) 37 °C'de 1 saat sabit çalkalama altında inkübe edin.
- Her 24 saatte bir çözelti ikmali ile yumuşak rotasyon altında 3 gün boyunca steril dH2O ile kapsamlı bir yıkamaya devam edin.
- Liyofilizasyonu ve ardından adım 2.1'de açıklandığı gibi kriyo-frezelemeyi gerçekleştirin.
3. Pepsin sindirimi
- Toz haline getirilmiş dECM örneklerini pepsin çözeltisi içinde 15 mg/mL (a/h) konsantrasyonda sindirin (0.01 M HCl, pH 2 içinde 1 mg/mL pepsin). Etkili parçalama için numune parçalama işlemini oda sıcaklığında 48 saat boyunca sürekli karıştırarak gerçekleştirin ve çözeltinin pH'ını sık sık koruyun.
- Digestleri bir tüpe aktarın ve 5000 x g'da 10 dakika santrifüjleyin.
- Süpernatanı toplayın ve 5M NaOH ve 10x PBS ilavesiyle fizyolojik koşullara (pH 7, 1x fosfat tampon salin (PBS)) nötralize edin ve tamponlayın.
NOT: Asidik sindirimin pH ayarlaması için konsantre alkali çözeltilerin kullanılması önerilir, çünkü bu yaklaşım, sonraki adımlarda jelleşmeyi zararlı bir şekilde etkileyebilecek istenmeyen hacim genişlemesini önler. - Daha ileri çalışmalar için ön jel sindirimlerini −20 °C'de saklayın.
4. Histolojik boyama
- Gece boyunca 4 ° C'de 1 mL %3.7 formaldehit çözeltisi içinde hücreden arındırılmış doku örneğinin küçük bir kısmını (5 mm3) sabitleyin.
- PBS'de 1 ml% 30 sükroz çözeltisi içeren tüplerdeki dokuları sabit bir kaya üzerinde 4 ° C'de 12 saat inkübe edin.
- Dokuları optimum kesme sıcaklığı bileşiğine (OCT) gömmek için, bir kriyokalıba 1 mL OCT dökün, dokuyu kriyokalıbın ortasına yerleştirin, ardından dokunun üzerine 2 mL OCT dökün.
- Doku içeren kriyokalıpları kuru buz üzerine yerleştirin ve sıvı nitrojen kullanarak dondurun. OCT tamamen beyaza döndüğünde numuneler hazırdır, bu genellikle 3 dakika sürer. OCT gömülü dokuları kullanana kadar -20 °C'de saklayın.
- Poli-L-lizin kaplı bir cam slayt üzerinde -25 ° C'de kriyostatta 10 μm'lik kesitler elde edin ve doku bölümünün slayt üzerinde erimesini sağlamak için slaytı oda sıcaklığına aktarın. Slaytları kullanana kadar -20 °C'de saklayın.
- Hücreden arındırmadan sonra çekirdeğin yokluğunu doğrulamak için, aşağıda açıklandığı gibi bir Hematoksilen ve Eozin (H & E) boyaması gerçekleştirin.
- Slaytları oda sıcaklığında 10 dakika inkübe edin. Slaytları PBS'ye daldırın ve kullanıma hazır 50 mL hematoksilen çözeltisi ile bir boyama kavanozunda 3 dakika boyayın, ardından 3 dakika musluk suyuyla yıkayın.
- Slaytları %95 etanole batırın ve 50 mL %0.5 alkollü Eosin çözeltisi ile bir boyama kavanozunda 45 saniye boyayın.
- Hücreden arındırma işleminden sonra kollajen içeriğinin korunduğunu göstermek için Sirius kırmızı boyama yapın.
- Slaytları PBS ile nemlendirin ve 1 saat boyunca bir boyama kavanozunda doymuş sulu pikrik asit çözeltisinde 50 mL% 0.1 Sirius kırmızısına daldırın.
- Slaytları %0,5 asetik asit solüsyonunda 5 saniye durulayın ve tüm slaytları sırayla %70, %95 ve %100 etanole her biri 1 dakika bekleterek kurutun.
- Doku örneklerindeki sGAG içeriğini analiz etmek için, aşağıda açıklandığı gibi Alcian mavisi boyama yapın.
- Slaytları 50 mL %1 Alcian mavisi içinde %3 asetik asit çözeltisine (pH 2.5) 30 dakika boyama kavanozuna daldırın. Slaytları akan musluk suyuyla 2 dakika yıkayın.
- Tüm slaytları sırayla %70, %95 ve %100 etanole 1 dakika batırarak kurutun.
- Numunelerin üzerine 0,1 mL montaj ortamı ekleyin ve 10x büyütme kullanarak ışık mikroskobu kullanarak görselleştirin.
5. Mekanik karakterizasyon
- Paralel plaka geometrisine sahip bir reometre kullanarak salınımlı reoloji ölçümleri uygulayın.
- Hızlı jelleşmeyi önlemek için buz üzerinde tutulan 250 μL ön jel solüsyonunu önceden soğutulmuş (4 °C) bir alt plakaya dökün.
- Ön jel çözeltisi iki plaka arasında 1 mm boşluk genişliğine sahip bir disk oluşturana kadar 20 mm paralel plakayı indirin.
- Ölçümü hemen başlatın. Jelleşme kinetiğini gözlemlemek için alt plakayı 30 dakika boyunca 37 °C'ye ısıtırken sabit bir frekans ve gerinim ile zaman içindeki depolama ve kayıp modüllerini ölçün. 0,5 Hz sabit frekans ve %0,1 gerinim kullanın.
- Depolama modülü değerinin artması durduktan ve bir platoya ulaştıktan sonra bir sürünme-kurtarma testi gerçekleştirin.
- Hidrojele 15 dakika boyunca 1 Pa kesme gerilimi uygulayın, gerilimi ölçün, numuneyi gerilimden boşaltın ve gerinim değerindeki değişikliği 15 dakika boyunca kaydedin.
- Stresi gevşetme davranışını göstermek için bir gerilme-zaman grafiği çizin. Üç farklı dECM özeti için ölçümleri kopya olarak tekrarlayın.
Sonuçlar
Hücresizleştirme
Doğal akciğer mikroçevresini özetleyecek dECM hidrojelleri üretmek için sığır akciğer dokusunun hücreden arındırılması, hem fiziksel (donma-çözülme) hem de kimyasal (Triton-X-100) yöntemlerle sağlanmıştır. Diseksiyondan sonra, doku parçaları, daha sonra dECM hidrojellerinin sterilitesini etkileyebilecek patojenleri uzaklaştırmak içindH2Oiçeren antibiyotiklerde yıkandı. Hücresel yapıları bozmak için donma-çözülme yöntemi için sıvı nitrojen ile 37 °C su banyosu arasında değişen toplam beş döngü uygulandı. İkinci hücre giderme yönteminde, doğal akciğer doku parçaları sürekli karıştırılarak 3 gün boyunca %1'lik Triton-X-100 solüsyonu ile muamele edildi. Her iki yöntemde de, akciğer dokusunun küçük parçalara ayrılması, solüsyonların çekirdek bölgelere difüzyonunun yanı sıra nükleer içeriğin fiziksel olarak bozulmasına izin vermek için kritik öneme sahiptir. Decellularizasyonun ilk görsel göstergesi olarak her iki yöntemde de tekrarlanan döngülerle dokunun pembe rengi beyazımsı bir renge dönüşmüştür. Bu protokolde DNaz tedavisi ile elde edilen rezidüel DNA'nın uzaklaştırılması da çok önemlidir. Ayrıca, her iki yöntemle de hücrelerden arındırma işleminden sonra, dokuların sterilitesini korumak için antibiyotiklerle desteklenmişdH2O'dadokular 3 gün boyunca kapsamlı bir şekilde yıkandı. Dikkate alınması gereken bir diğer nokta da, dECM sindirimlerinin fizyolojik koşullara nötralizasyonu ve tamponlanması sırasında, tüm çözeltilerin yine sterilite amacıyla filtreyle sterilize edilmesi ve erken jel oluşumunu önlemek için buz üzerinde tutulmasıdır. Akciğer dECM hidrojel oluşumu daha sonra son adımda termal jelleşme ile elde edildi (Şekil 1).
Kriyo-kesit ve histolojik boyamalar
Doğal ve hücresizleştirilmiş akciğer dokularının fiksasyonu ve kriyo-kesiti, ardından hücrelerin giderilmesinden sonra çekirdeklerin eliminasyonunu ve ECM moleküllerinin tutulmasını değerlendirmek için belirtilen histolojik boyamalar yapıldı (Şekil 2A). H&E boyama, doğal dokuya kıyasla hem donma-çözülme hem de Triton-X-100 yöntemleriyle hücreden arındırılmış numunelerde çekirdek içeriğinde önemli bir azalma gösterdi, bu da hücresizleştirmenin hem fiziksel hem de kimyasal yöntemlerle sağlandığını ima etti (Şekil 2B). Sirius kırmızı boyaması, hücrelerden arındırılmış dokularda tutulan kollajenin doğal doku ile karşılaştırılabilir olduğunu gösterdi, bu da her iki decellularizasyon yönteminin de kollajen içeriği üzerinde minimum etkiye sahip olduğunu gösterdi (Şekil 2B). Ek olarak, Alcian mavisi boyama, hücreden arındırılmış dokulardaki sGAG içeriğinin doğal dokulara kıyasla verimli bir şekilde korunduğunu göstermiştir (Şekil 2B).
Mekanik karakterizasyon
Hücrelerden arındırılmış akciğer hidrojellerinin reoloji ölçümleri, 1 mm kalınlığında bir hidrojel disk elde etmek için 20 mm'lik bir paralel plaka seti ile gerçekleştirilmiştir (Şekil 3A). Ölçümlerde kullanılan gerinim değerlerini optimize etmek için frekans taraması kullanılmıştır. Donma-çözülme yöntemi ile elde edilen hidrojellerin ortalama depolama modülü (G'') ve kayıp modülü (G'') sırasıyla 204 Pa ve 28.4 Pa olup, Triton-X-100 yöntemi ile elde edilen hidrojellerden önemli ölçüde daha serttir (Şekil 3B-C). İlginç bir şekilde, sürünme-geri kazanım testleri, donma-çözülme ve Triton-X-100 yöntemleriyle elde edilen hidrojellerin strese karşı farklı tepkilere sahip olduğunu gösterdi ve bu da hidrojellerin farklı viskoelastik özelliklere sahip olduğunu ima etti (Şekil 3D).

Şekil 1: Hücresizleştirme sürecinin şematik gösterimi. Sığır akciğer dokusu küçük parçalara ayrıldı ve iyice yıkandı. Hücresel içeriğin giderilmesi iki farklı yöntemle sağlandı. Tekrarlayan donma-çözülme döngüleri ile fiziksel yöntem ve Triton-X-100 tedavisi ile kimyasal yöntem. Rezidüel DNA'nın uzaklaştırılması için her iki yöntemde de DNaz tedavisi uygulandı; Decellularize dokuların liyofilizasyonundan sonra kriyofrezeleme, pepsin sindirimi, nötralizasyon ve jelleşme aşamaları izlendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
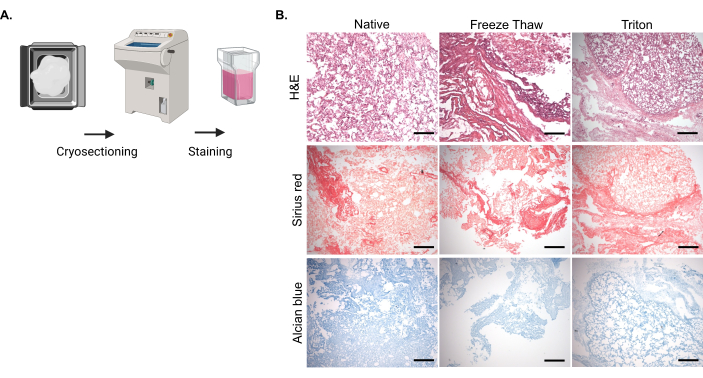
Şekil 2: Doğal ve hücresizleştirilmiş sığır akciğer dokularının kriyo-kesiti ve boyanması. (A) Doğal ve hücrelerden arındırılmış sığır akciğer dokusu parçaları% 3.7 formaldehit çözeltisi ile sabitlendi, PBS'de% 30 sükroz çözeltisine daldırıldı, daha sonra optimum kesme sıcaklığı (OCT) bileşiğine gömüldü ve donduruldu. Her numune için, boyamaya devam etmek için cam slaytlara 10 μm'lik kesitler monte edildi. (B) Donma-çözülme veya Triton-X-100 yöntemleriyle doğal ve hücresi kaldırılmış numunelerin temsili görüntüleri. Nükleuslar için Hematoksilen ve Eozin (H&E), kollajenler için Sirius kırmızısı ve sGAG'lar için Alcian mavisi boyaması yapıldı. Ölçek çubuğu: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Hücresi kaldırılmış akciğer ECM hidrojellerinin mekanik özelliklerinin ölçümü. (A) Mekanik karakterizasyondan sonra termal olarak çapraz bağlanmış hücreden arındırılmış akciğer hidrojelinin temsili görüntüsü. Salınım reolojisi, paralel plaka geometrisine sahip bir reometre kullanılarak gerçekleştirildi. Decellularize hidrojellerin reolojik özellikleri, (B) depolama modülü (G'), (C) kayıp modülü (G''), (D) hidrojellerin stres gevşeme davranışını değerlendirmek için sürünme-geri kazanım testi. Hata çubukları s.d. (*p < 0.05), n=3'ü temsil eder. İstatistiksel analiz için Welch düzeltmesi ile eşleştirilmemiş bir t-testi kullanıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Organ kaynaklı hidrojeller, doğal doku ECM'sini özetleyen ve organotipik hücresel fonksiyonu taklit eden umut verici modeller haline gelmiştir. Hücre dışı akciğer ECM'si doku mühendisliğinde sıklıkla kullanılmış olsa da, biyomateryal bileşiminin ve mekanik özelliklerin kapsamlı bir karakterizasyonu, homeostaz veya hastalık sırasında biyolojik süreçleri modellemek için hücre-ECM etkileşimlerinin nasıl modüle edilebileceğinin daha iyi anlaşılmasına fayda sağlayacaktır. Özellikle, sulandırılmış hidrojellerin sertlik ve viskoelastisite gibi mekanik özelliklerinin değerlendirilmesi ve kontrolü, çeşitli hücresel fenomenlerin düzenlenmesinde ima edildiği için büyük önem taşımaktadır. Bu nedenle, dECM hidrojellerinin üretimi için farklı hücre giderme yöntemlerinin biyokimyasal içerik ve mekanik yönler açısından karşılaştırılması ve değerlendirilmesi çok önemlidir20,23. Burada, sığır akciğeri hücresizleşmesi iki farklı yaklaşımla gösterilmiştir: Esas olarak DNA içeriğinin mekanik olarak parçalanması ve uzaklaştırılmasına dayanan donma-çözülme döngülerinin yanı sıra ortak bir deterjan olan Triton-X-100 kullanılarak nükleer içeriğin kimyasal olarak uzaklaştırılması (Şekil 1). Dondurarak çözdürme yöntemi için, tüm doku örneklerinin dondurulmasını ve sıvı nitrojen ile su banyosu arasında otomatik ve tekrarlayan bir yolda uygun şekilde çözülmesini sağlamakesastır 24. Bunu başarmak için, doku örnekleri birkaç tüpe bölünebilir ve dondurmak için nitrojen kabına ve ardından çözülmek için bir su banyosuna batırılabilir. Triton-X-100 çözeltisinin her 24 saatte bir değiştirilmesi, kimyasal yöntemin hücresel içeriği etkili bir şekilde bozması için kritik öneme sahiptir21. DNaz tedavisi, kapsüllenmiş hücrelerin canlılığını azaltabilecek kalan DNA'nın parçalanmasını daha da artırmak için her iki yöntemde de kullanıldı. Her iki yöntem de hücreden arındırma sırasında hücresel materyali başarılı bir şekilde ortadan kaldırdı ve her iki durumda da eser miktarda DNA kaldı20. Özellikle, ticari olarak temin edilebilen hücre dışı matris ürünlerinin, doku mühendisliği ve translasyonel çalışmalarda kullanımları için implantasyon üzerine konakçılarda sitouyumluluk veya bağışıklık tepkileri üzerinde olumsuz bir etkisi olmayan az miktarda kalıntı DNA içerdiği bildirilmiştir20,25.
ECM, hücresel sinyallemede kritik düzenleyici rollere sahip olan kollajenler, elastinler ve proteoglikanlar gibi birçok protein ve polisakkarit makromolekülü içerir26. Bu nedenle, doğal ECM'den türetilen yapı iskeleleri, bu tür hücre öğretici ECM ligandlarının tutulduğunu göstermelidir. Bu amaçla, hücreden arındırılmış matrislerin ECM bileşimini doğal dokularınkiyle karşılaştırmak için kollajen ve sGAG boyamaları yapıldı. Sonuçlar, kollajen ve sGAG içeriğinin, donma-çözülme ve Triton-X-100 hücre giderme yöntemleri yoluyla hücrelerden arındırılmış dokularda tutulduğunu göstermektedir, bu da sulandırılmış iskelelerde doğal benzeri bir ECM mikro ortamı sunduklarını düşündürmektedir20,26. ECM bileşenlerinin yapısal organizasyonu, ECM içeriğindeki küçük farklılıklara rağmen, hücreden arındırma yöntemine göre farklılıklar göstermiştir. Temsili görüntüler, akciğer dokusunun deterjan bazlı hücreden arındırılması ile doğal akciğer dokusu boyamaları arasında daha fazla benzerlik gösterse de, her iki protokol de genel olarak doğal ECM proteinlerini başarıyla korudu (Şekil 2).
3D doku modellerinin mekanik özellikleri, hücre kültürü çalışmalarında çok önemli bir rol oynar, çünkü hücrelerin hem büyümesi hem de davranışı, doğal ECM 27,28,29,30'un mekanik özellikleri tarafından yüksek oranda talimatlandırılır. Çeşitli hücre giderme yöntemleri, jelleşme süreci ve dECM hidrojellerinin nihai sertliği ve viskoelastisitesi üzerinde farklı etkiler gösterir. Bu bulgular, donma-çözülme yönteminin Triton-X-100 yönteminden daha sağlam ve daha sert hidrojeller ürettiğini göstermektedir. Ayrıca, önceki çalışmamızda, donma-çözülme dECM hidrojellerinin sertliğinin, ligand konsantrasyonu değiştirilerek ayarlanabileceğini ve Triton-X-100'den türetilen dECM hidrojellerinin20 sertliğine uyacak şekilde düşürülebileceğini gösterdik. Viskoelastisite, mekanik deformasyona yanıt olarak viskoz ve elastik davranışı gösteren doğal doku matrislerinin bir özelliğidir. Son çalışmalar, ECM viskoelastisitesinin hücre proliferasyonu, morfolojisi ve farklılaşmasındaki rolünü ortaya koymuştur29,30. Bu çalışma, akciğer dECM hidrojellerini doğal fibrin, kollajen veya sulandırılmış bazal membrana benzer stres giderici malzemeler olarak göstermektedir. Ayrıca bulgular, Triton-X-100 yönteminden türetilen dECM hidrojellerinin, donma-çözülme türevli hidrojellerden daha hızlı iyileştiğini göstermektedir. Bu nedenle, hücreden arındırma yönteminin seçimi, elde edilen dECM jellerinin sürünme tepkisini ve gevşeme kinetiğini büyük ölçüde etkiler.
Burada açıklanan hücre giderme yöntemleri, akciğer dokusu ECM'sinin biyokimyasal ve mekanik özelliklerini yeniden oluşturmak için sığır akciğerini kullanır. Hücreden arındırma işleminden sonra ECM'nin biyokimyasal ve fiziksel bileşimini hassas bir şekilde karakterize ettik. Hücreden arındırma yöntemlerindeki önemli bir zorluk, partiler arasında dECM hidrojellerinin jelleşme kapasitesini doğrudan etkileyen ECM bileşiminin tutulmasıdır. Aynı donörden alınan akciğer dokusunun kullanılması, partiden partiye değişkenliğin üstesinden gelmek için önemli bir parametredir. Sağlıklı doğal dokular kullanılmış olsa da, donörler arasında değişkenlik kaçınılmazdır. Genel olarak, hem donma-çözülme hem de Triton-X-100 yöntemleri, akciğerin hastalık modellemesinde doğal dECM hidrojellerinin kullanılması için umut verici bir potansiyel göstermektedir.
Açıklamalar
Tüm yazarlar hiçbir rakip mali çıkar beyan etmezler.
Teşekkürler
Bu çalışma Türkiye Bilimsel ve Teknolojik Araştırma Kurumu (TÜBİTAK) tarafından desteklenmiştir (Hibe No. 118C238). Yayının/bildirinin tüm sorumluluğu yayın sahibine aittir. TÜBİTAK'tan alınan maddi destek, yayının içeriğinin TÜBİTAK tarafından bilimsel anlamda onaylandığı anlamına gelmemektedir. Yazarlar, Koç Üniversitesi Translasyonel Tıp Araştırma Merkezi'nin (KUTTAM) hizmet ve olanaklarından yararlanmalarını minnetle kabul ederler. Şekil 1 ve Şekil 2a, Biorender.com kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | ISOLAB | 64-17-5 | |
| Acetic acid | ISOLAB | 64-19-7 | |
| Alcian blue solution | Sigma-Aldrich | B8438 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| Discovery HR-2 rheometer | TA Instruments | ||
| Entellan mounting medium | Merck | 107960 | |
| Eosin solution | Bright-slide | 2.BS01-105-1000 | |
| Formaldehyde | Electron Microscopy Sciences | 50-980-485 | |
| Hydrochloric acid | Merck | 100317 | |
| Iodine | Sigma-Aldrich | 3002 | |
| Magnesium chloride | Sigma-Aldrich | 7786-30-3 | |
| Mayer's haematoxylin staining solution | Merck | 2.BS01-103-1000 | |
| O.C.T compound | Tissue-Tek | 4583 | |
| Penicillin/Streptomycin | Biowest | L0018-100 | |
| Pepsin from porcine gastric mucosa | Sigma-Aldrich | P6887 | |
| Picric acid | Polysciences | 88-89-1 | |
| Sirius Red | Polysciences | 09400-25 | |
| Sodium hydroxide | Sigma-Aldrich | S5881 | |
| Sucrose | Sigma-Aldrich | S0389 | |
| Triton-X-100 | Merck | 112298 |
Referanslar
- Zhu, X., et al. Ordered micropattern arrays fabricated by lung-derived dECM hydrogels for chemotherapeutic drug screening. Mater Today Bio. 15, 100274(2022).
- Ulldemolins, A., et al. Lung extracellular matrix hydrogels-derived vesicles contribute to epithelial lung repair. Polymers. 14 (22), 4907(2022).
- Biehl, A., et al. Towards a standardized multi-tissue decellularization protocol for the derivation of extracellular matrix materials. Biomater Sci. 11 (2), 641-654 (2023).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of cartilage in human knee osteoarthritis with autologous adipose tissue-derived stem cells and autologous extracellular matrix. Biores Open Access. 5 (1), 192-200 (2016).
- Spang, M. T., Christman, K. L. Extracellular matrix hydrogel therapies. In vivo applications and development.Acta Biomater. 68, 1-14 (2018).
- Schwartz, A. D., et al. A biomaterial screening approach reveals microenvironmental mechanisms of drug resistance. Integr Biol. 9 (12), 912-924 (2017).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P., Mano, J. F. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
- Nakamura, R., Nakamura, F., Fukunaga, S. Changes in the composition of the extracellular matrix accumulated by mesenchymal stem cells during in vitro expansion. Anim Sci J. 85 (6), 706-713 (2014).
- Bual, R. P., Ijima, H. Intact extracellular matrix component promotes maintenance of liver-specific functions and larger aggregates formation of primary rat hepatocytes. Regen Ther. 11, 258-268 (2019).
- Jhala, D., Vasita, R. A review on extracellular matrix mimicking strategies for an artificial stem cell niche. Poly Rev. 55 (4), 561-595 (2015).
- Jeong, W., Kim, M. K., Kang, H. W. Effect of detergent type on the performance of liver decellularized extracellular matrix-based bio-inks. J Tissue Eng. 12, 2041731421997091(2021).
- Lee, S. J., Lee, J. H., Park, J., Kim, W. D., Park, S. A. Fabrication of 3D printing scaffold with porcine skin decellularized bio-ink for soft tissue engineering. Materials. 13 (16), 3522(2020).
- Won, J. Y., et al. A potential dermal substitute using decellularized dermis extracellular matrix derived bio-ink. Artif Cells Nanomed Biotechnol. 47 (1), 644-649 (2019).
- Lin, Z., et al. Bioactive decellularized extracellular matrix hydrogel microspheres fabricated using a temperature-controlling microfluidic system. ACS Biomater Sci Eng. 8 (4), 1644-1655 (2022).
- Kaushik, N., Kim, S., Suh, Y., Lee, S. J. Proinvasive extracellular matrix remodeling for tumor progression. Arch Pharm Res. 42 (1), 40-47 (2019).
- Lu, P., Weaver, V. M., Werb, Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol. 196 (4), 395-406 (2012).
- Poltavets, V., Kochetkova, M., Pitson, S. M., Samuel, M. S. The role of the extracellular matrix and its molecular and cellular regulators in cancer cell plasticity. Front Oncol. 8, 431(2018).
- Takeda, M., et al. Development of a drug screening system using three-dimensional cardiac tissues containing multiple cell types. Sci Rep. 11 (1), 5654(2021).
- Jensen, A. R. D., et al. Organ-specific, fibroblast-derived matrix as a tool for studying breast cancer metastasis. Cancers (Basel). 13 (13), 3331(2021).
- Kuşoğlu, A., et al. Different decellularization methods in bovine lung tissue reveals distinct biochemical composition, stiffness, and viscoelasticity in reconstituted hydrogels. ACS Appl Bio Mater. 6 (2), 793-805 (2023).
- Fernández-Pérez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Sci Rep. 9 (1), 14933(2019).
- Park, S., Kim, T. H., Kim, S. H., You, S., Jung, Y. Three-dimensional vascularized lung cancer-on-a-chip with lung extracellular matrix hydrogels for in vitro screening. Cancers (Basel). 13 (16), 3930(2021).
- Uriarte, J. J., Uhl, F. E., Rolandsson Enes, S. E., Pouliot, R. A., Weiss, D. J. Lung bioengineering: advances and challenges in lung decellularization and recellularization. Curr Opin Organ Transplant. 23 (6), 673-678 (2018).
- Roth, S. P., et al. Automated freeze-thaw cycles for decellularization of tendon tissue - a pilot study. BMC Biotechnol. 17 (1), 13(2017).
- Gilbert, T. W., Freund, J. M., Badylak, S. F. Quantification of DNA in biologic scaffold materials. J Surg Res. 152 (1), 135-139 (2009).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Cox, T. R. The matrix in cancer. Nat Rev Cancer. 21 (4), 217-238 (2021).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nat Rev Mol Cell Biol. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Chaudhuri, O., et al. Hydrogels with tunable stress relaxation regulate stem cell fate and activity. Nat Mater. 15 (3), 326-334 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır