Method Article
脱細胞化肺細胞外マトリックスハイドロゲルの開発と特性評価
* これらの著者は同等に貢献しました
要約
プロトコルは原産の牛のような肺のティッシュに加えられる2つの明瞭な脱cellularizationの方法を解明し、それぞれの性格描写の広範囲の記述を提供する。
要約
細胞外マトリックス(ECM)由来のハイドロゲルは、 in vitroで細胞の自然環境を模倣できるため、組織工学における使用がますます一般的になっています。しかし、ECMの天然生化学的含有量を維持し、機械的安定性を達成し、脱細胞化プロセスがECMハイドロゲルの機械的特性に与える影響を理解することは困難です。ここでは、2つの異なるプロトコルを使用したウシ肺組織の脱細胞化のパイプライン、脱細胞化の有効性の下流特性評価、再構成された脱細胞化肺ECMハイドロゲルの作製、およびそれらの機械的および細胞適合性の評価について説明しました。ウシ肺の脱細胞化は、物理的(凍結融解サイクル)または化学的(界面活性剤ベース)方法を用いて追求された。ヘマトキシリンおよびエオシン染色を実施して、主要なECM成分の脱細胞化および保持を検証しました。脱細胞化サンプル内の残留コラーゲンおよび硫酸化グリコサミノグリカン(sGAG)含有量の評価には、それぞれシリウスレッドおよびアルシアンブルー染色技術を採用しました。脱細胞化肺ECMハイドロゲルの機械的特性は、振動レオロジーによって特徴付けられました。この結果は、脱細胞化ウシ肺ハイドロゲルが、ほとんどの天然ECM成分を保持することにより、市販のECM製品に代わる信頼性の高い器官型 代替を提供できることを示唆しています。さらに、これらの知見は、選択した脱細胞化法がゲル化速度論だけでなく、得られるハイドロゲルの硬さや粘弾性特性にも大きく影響することを明らかにしています。
概要
従来の単層培養条件では、天然の組織微小環境を忠実に表現できず、細胞-マトリックスおよび細胞-細胞間相互作用を可能にする有益なリガンドを備えた3次元(3D)スキャフォールドを提供する能力が欠けています1。細胞外マトリックス(ECM)の組成と機械的特性は、組織特異性が高く、時間依存性があり、病理学的状態の変化を受けます。したがって、そのような特性の調整可能性、細胞挙動の調節、および所望の組織機能の達成を可能にする生体模倣的3D組織モデルが必要である。天然ECM由来の生体材料は、組織特異的なECM 1,2,3,4,5を直接使用できるため、組織工学において大きな注目を集めています。ECMベースのキャリアは、組織再生から疾患モデル開発まで、多くの用途で使用されています。これらは、注射用または埋め込み型の生体材料足場4,5、薬物スクリーニングアプリケーション6,7、細胞増殖を誘導する材料の開発8,9,10、バイオインク11,12,13、マイクロ流体工学14、および癌組織モデル15,16,17として使用されます、18,19。
組織や臓器の脱細胞化は、組織特異的なECMを模倣した足場を生成するための一般的なアプローチです。脱細胞化された組織および器官のハイドロゲルへの再構成は、細胞を生体模倣3D組織モデルに埋め込むことを可能にする20。脱細胞化技術は、主にECM組成を維持しながら細胞成分を除去することに重点を置いています。組織の脱細胞化には、凍結融解サイクルなどの物理的方法や、Triton-X-100処理などの化学プロセスが一般的に適用されます。さらに、DNase処理は、細胞包埋時の免疫学的反応を最小限に抑えるために、残留DNAを除去するために好まれます。脱細胞化手順を最適化するには、最大の細胞除去と最小限のECM障害を達成することが重要です21。 これらの側面に加えて、粘弾性や剛性など、再構成された足場の生化学的および機械的特性の特性評価は、ネイティブマトリックスから派生した工学的3D組織モデルを改善するために重要です20。
肺組織工学における臓器特異的ECMは、肺微小環境を模倣して、in vitroで発生、恒常性、または病理学的プロセスをモデル化し、生理学的模倣環境で治療薬をテストすることを可能にします20,22,23。これまでの研究では、ラット、ブタ、ヒトなど数種の肺組織の脱細胞化が実証されているが、これらの方法は、ウシなどあまり使用頻度の低い種にはまだ適応されていない。脱細胞化プロセスのパラメータと、それらが生化学的組成と機械的特性に関して結果として生じる再構成されたECM足場にどのように影響するかをよりよく理解することで、そのような側面のより良い調整が可能になり、健康と疾患におけるより信頼性の高い組織モデルへの道が開かれます。この研究では、凍結融解サイクルとTriton-X-100処理の2つの異なる方法によるウシ肺の脱細胞化について明示的に説明し、その後、脱細胞化肺ECM(dECM)ハイドロゲルの生化学的および機械的分析を行います。この知見は、どちらの方法もECMリガンドの効果的な脱細胞化と保持をもたらすことを明らかにしています。特に、方法の選択は、再構成されたハイドロゲルの結果として生じる剛性と粘弾性を有意に変化させます。ウシdECMに由来するハイドロゲルは、ヒト肺の細胞外マトリックスと顕著な生化学的類似性を示し、信頼性の高い熱ゲル化特性を示す20。前述したように、どちらの方法も、肺癌細胞、健康な気管支上皮細胞、および患者由来の肺オルガノイドの3D培養に適している20。
プロトコル
若い(1〜2歳)ウシドナーからの新鮮な天然肺を地元の食肉処理場から入手し、氷上で密封されたプラスチック容器に入れて実験室に輸送しました。動物の生贄は、一般的な肉の消費(肺は廃棄物として廃棄される)のために行われ、研究とは関係ありません。屠殺場が動物の犠牲に関する国の法律および規制に準拠していることを確認します。また、廃棄物のみを使用し、犠牲になった動物の数に影響がなかったことも確認しています。
1.臓器の採取と組織の準備
- 新たに採取したウシ肺組織は、実験まで-80°Cで保存してください。
- 実験当日は、凍結した肺組織が室温で融解するのを待ちます。
- 滅菌メスとハサミで組織を解剖して気管と軟骨気道を除去し、さらに細かく刻みます(5 mm3)。
- 2%ペニシリン/ストレプトマイシン(P / S)を含む超純水で少なくとも3回十分に洗浄します。
2. 組織の脱細胞化
注:天然のウシ肺組織は、2つの異なるプロトコルを使用して脱細胞化されました。
- 凍結融解法
- ステップ1に従って組織サンプルを調製します。ミンチした組織を滅菌蒸留水(dH2O)の2%ヨウ素溶液に1分間浸します。滅菌dH2Oで2回連続して洗浄します。
- みじん切りにした組織片を50 mLチューブに15 mLレベルまで移し、ポータブル液体窒素容器を使用して5回の手動凍結融解サイクルを実施します。チューブを上部に滅菌dH2Oで満たし、液体窒素でチューブを2分間凍結します。2分後、すぐに37°Cのウォーターバスに移し、10分間加熱します。これは凍結融解の1サイクルを構成します。
- サンプルを 30 mL の DNase 溶液(10 U/mL)と 10 mM MgCl2 バッファー(pH 7.5)中で、100 rpm で一定に振とうしながら 37 °C で 1 時間インキュベートします。
- 滅菌dH2Oで100rpmで一定に振とうしながら3日間、24時間ごとに溶液を補充しながら、広範囲に洗浄を続けます。
- 凍結乾燥とクライオミリングは、以下のように行います。20: 湿ったdECMサンプルを-80°Cで24時間凍結します。凍結したサンプルを凍結乾燥機に移し、完全に乾燥するまで真空下で3〜4日間乾燥モードで操作します。凍結乾燥が終了したら、粉砕装置とドライアイスを用いて試料を微粉末状に粉砕する。
注:この微粉末状態は、分解プロセスの次の段階で溶解性が向上するため、必要であると見なされます。
- Triton-X-100 メソッド
- ステップ1に従って組織サンプルを調製します。1% Triton-X-100 で肺組織を 4 °C で穏やかに回転させながら 3 日間処理します。 24時間ごとに溶液を交換します。
- サンプルをDNase溶液(10U/mL)と10 mM MgCl2バッファー(pH 7.5)中で、37°Cで1時間、一定に振とうしながらインキュベートします。
- 滅菌dH2Oで3日間、穏やかな回転で広範囲に洗浄し、24時間ごとに溶液を補充します。
- 凍結乾燥を行った後、ステップ2.1で説明したようにクライオミリングを行います。
3.ペプシン消化
- 粉末 dECM サンプルを 15 mg/mL(w/v)の濃度でペプシン溶液(0.01 M 塩酸、pH 2 中 1 mg/mL)で分解します。サンプル分解プロセスは、室温で48時間連続攪拌しながら行い、効果的な分解のために溶液のpHを頻繁に維持します。
- 消化物をチューブに移し、5000 x g で10分間遠心分離します。
- 上清を回収し、5M NaOHおよび10x PBSを添加して、生理学的条件(pH 7、1xリン酸緩衝生理食塩水(PBS))に中和および緩衝します。
注:酸性消化物のpH調整には濃アルカリ溶液を使用することが推奨されており、このアプローチにより、後続のステップでゲル化に悪影響を与える可能性のある望ましくない容量膨張を回避できます。 - プレゲル消化物は、さらなる研究のために-20°Cで保存してください。
4. 組織学的染色
- 脱細胞化組織サンプルのごく一部(5 mm3)を1 mLの3.7%ホルムアルデヒド溶液に4°Cで一晩固定します。
- PBSに1 mLの30%スクロース溶液を入れたチューブ内の組織を、安定した岩石の上で4°Cで12時間インキュベートします。
- 最適な切断温度のコンパウンド(OCT)に組織を包埋するには、1 mLのOCTをクライオモールドに注ぎ、クライオモールドの中央に組織を置き、組織の上に2 mLのOCTを注ぎます。
- 組織を含むクライオモールドをドライアイス上に置き、液体窒素を使用して急速凍結します。OCTが白一色に変わると、通常3分かかりますが、サンプルの準備が整います。OCT包埋組織は、使用するまで-20°Cで保管してください。
- ポリ-L-リジンでコーティングされたスライドガラス上のクライオスタットで-25°Cの10 μm切片を採取し、スライドを室温に移して、組織切片をスライド上で溶融させます。スライドは使用するまで-20°Cで保管してください。
- 脱細胞化後の核の不在を確認するために、以下に説明するようにヘマトキシリンおよびエオシン(H&E)染色を行います。
- スライドを室温で10分間インキュベートします。スライドをPBSに浸し、すぐに使用できる50 mLのヘマトキシリン溶液で染色ジャーに3分間染色した後、水道水で3分間洗浄します。
- スライドを95%エタノールに浸し、50 mLの0.5%アルコール性エオシン溶液で染色ジャーに45秒間染色します。
- シリウスレッド染色を行い、脱細胞化後のコラーゲン含有量の保持を示します。
- スライドをPBSで水和し、染色ジャーのピクリン酸飽和水溶液中の0.1%シリウスレッド50 mLに1時間浸します。
- スライドを0.5%酢酸溶液で5秒間すすぎ、すべてのスライドを70%、95%、100%エタノールにそれぞれ1分間順次浸して脱水します。
- 組織サンプル中のsGAG含量を分析するには、以下に説明するようにアルシアンブルー染色を行います。
- スライドを50 mLの1%アルシアンブルー、3%酢酸溶液(pH 2.5)に染色ジャーに30分間浸漬します。スライドを水道水で2分間洗浄します。
- すべてのスライドを70%、95%、100%エタノールにそれぞれ1分間連続して浸して脱水します。
- サンプルの上に0.1 mLの封入剤を加え、10倍の倍率で光学顕微鏡で可視化します。
5. 機械的特性評価
- 平行平板形状のレオメータを使用して振動レオロジー測定を実施します。
- 急速なゲル化を避けるために、氷上に保持した250 μLのプレゲル溶液を予冷(4°C)した下部プレートに注ぎます。
- プレゲル溶液が2つのプレート間に1mmのギャップ幅を持つディスクを形成するまで、20 mmの平行プレートを下げます。
- すぐに測定を開始してください。下部プレートを37°Cに30分間加熱しながら、固定周波数とひずみで経時的な貯蔵弾性率と損失弾性率を測定し、ゲル化速度を観察します。0.5Hzの固定周波数と0.1%のひずみを使用します。
- 貯蔵弾性率値の上昇が止まり、プラトーに達した後、クリープ回復試験を実行します。
- ハイドロゲルに1 Paのせん断応力を15分間加え、ひずみを測定し、応力からサンプルをアンロードし、ひずみ値の変化を15分間記録します。
- ひずみ対時間のグラフを描画して、応力緩和挙動を示します。3つの異なるdECM消化物について繰り返し測定を繰り返します。
結果
脱細胞化
ウシ肺組織の脱細胞化による天然の肺微小環境を再現するdECMハイドロゲルの作製は、物理的(凍結融解)と化学的(Triton-X-100)の両方の方法で達成されています。解剖後、組織片をdH2O含有抗生物質で洗浄し、後にdECMハイドロゲルの無菌性に影響を与える可能性のある病原体を除去しました。凍結融解法では、液体窒素と37°Cの水浴を交互に合計5サイクル行い、細胞構造を破壊しました。第2の脱細胞化法では、天然の肺組織片を1%Triton-X-100溶液で3日間、一定の攪拌下で処理した。どちらの方法でも、肺組織を細かく切断することは、核の内容物の物理的破壊だけでなく、コア領域への溶液の拡散を可能にするために重要です。脱細胞化の最初の視覚的指標として、組織のピンク色は、両方の方法でサイクルを繰り返すことで白っぽい色に変わりました。また、このプロトコルではDNase処理で達成された残留DNAを除去することも重要です。さらに、両方の方法による脱細胞化後、組織の無菌性を維持するために抗生物質を添加したdH2O中で組織を3日間広範囲に洗浄した。考慮すべきもう1つの点は、dECM消化物を生理学的条件に中和および緩衝する際に、すべての溶液をフィルター滅菌し、これも無菌目的で、早期のゲル形成を避けるために氷上に保持することです。その後、肺のdECMハイドロゲル形成は、最終ステップでの熱ゲル化によって達成されました(図1)。
凍結切片と組織学的染色
脱細胞化後の核の除去とECM分子の保持を評価するために、天然および脱細胞化肺組織の固定および凍結切片化、およびそれに続く組織学的染色を実施しました(図2A)。H&E染色では、凍結融解法とTriton-X-100法の両方で脱細胞化サンプルの核含有量が天然組織と比較して有意に減少することが示され、脱細胞化が物理的および化学的方法の両方で達成されたことが示唆されました(図2B)。シリウスレッド染色では、脱細胞化組織に保持されたコラーゲンは天然組織と同等であることが示され、どちらの脱細胞化法もコラーゲン含有量への影響が最小限であることが示されました(図2B)。さらに、アルシアンブルー染色により、脱細胞化組織中のsGAG含量が天然組織と比較して効率的に保存されることが実証されました(図2B)。
機械的特性評価
脱細胞化肺ハイドロゲルのレオロジー測定を20 mmの平行プレートセットアップで実施し、厚さ1 mmのヒドロゲルディスクを得ました(図3A)。周波数掃引を使用して、測定に使用するひずみ値を最適化しました。凍結融解法で得られたハイドロゲルの平均貯蔵弾性率(G')および損失弾性率(G'')は、それぞれ204 Paおよび28.4 Paであり、Triton-X-100法で得られたハイドロゲルよりも有意に硬かった(図3B-C)。興味深いことに、クリープ回復試験では、凍結融解法とTriton-X-100法で得られたハイドロゲルは応力に対して異なる応答を示しており、ハイドロゲルは異なる粘弾性特性を持っていることが示唆されました(図3D)。

図1:脱細胞化プロセスの概略図。 ウシの肺組織を細かく解剖し、徹底的に洗浄した。細胞内容物の除去は、2つの異なる方法で達成されました。凍結融解サイクルを繰り返す物理的方法と、Triton-X-100処理による化学的方法。DNase処理は、残留DNAを除去するために両方の方法で実施されました。脱細胞化組織を凍結乾燥した後、クライオミリング、ペプシン消化、中和、ゲル化のステップを進めました。 この図の拡大版をご覧になるには、ここをクリックしてください。
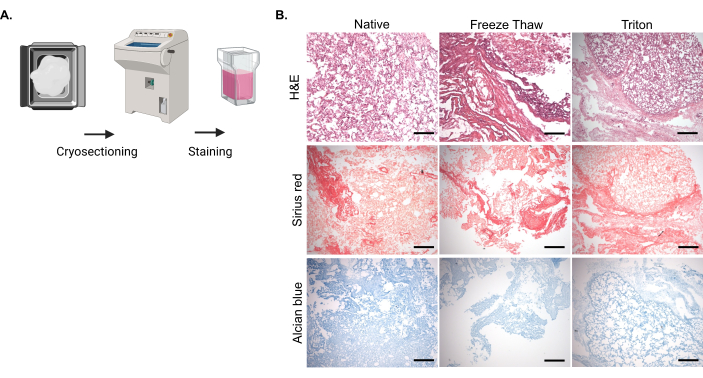
図2:天然および脱細胞化ウシ肺組織の凍結切片および染色。 (A)天然および脱細胞化ウシ肺組織片を3.7%ホルムアルデヒド溶液で固定し、PBS中の30%ショ糖溶液に浸漬した後、最適切削温度(OCT)化合物に包埋し、急速凍結した。各サンプルについて、10 μmの切片をスライドガラスに取り付けて染色を進めました。(B)凍結融解法またはTriton-X-100法による天然サンプルおよび脱細胞化サンプルの代表的な画像。核についてはヘマトキシリンおよびエオシン(H&E)染色、コラーゲンについてはシリウス赤色染色、sGAGについてはアルシアンブルー染色を実施した。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3:脱細胞化肺ECMハイドロゲルの機械的特性の測定。 (A)機械的特性評価後の熱架橋脱細胞化肺ハイドロゲルの代表画像。振動レオロジーは、平行平板形状のレオメーターを使用して行いました。脱細胞化ハイドロゲルのレオロジー特性、(B)貯蔵弾性率(G')、(C)損失弾性率(G'')、(D)ハイドロゲルの応力緩和挙動を評価するためのクリープ回復試験。エラーバーは s.d. (*p < 0.05)、n=3 を表します。ウェルチの補正を伴う対応のないt検定を統計分析に使用しました。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
臓器由来のハイドロゲルは、天然組織のECMを再現し、器官型の細胞機能を模倣する有望なモデルとなっています。脱細胞化肺ECMは組織工学でよく使用されてきましたが、生体材料の組成と機械的特性を徹底的に特性評価することで、ホメオスタシスや疾患中の生物学的プロセスをモデル化するために細胞-ECM相互作用がどのように調節されるかをよりよく理解することができます。特に、再構成されたハイドロゲルの硬さや粘弾性などの機械的特性の評価と制御は、いくつかの細胞現象の制御に暗示されているため、非常に重要です。したがって、dECMハイドロゲルを製造するためのさまざまな脱細胞化方法を、生化学的含有量と機械的側面の観点から比較および評価することが重要です20,23。ここでは、主に機械的破壊とDNA含有量の除去に基づく凍結融解サイクルと、一般的な界面活性剤であるTriton-X-100を使用した核含有量の化学的除去という2つの異なるアプローチで、ウシ肺の脱細胞化が実証されました(図1)。凍結融解法の場合、すべての組織試料が凍結され、自動化された反復経路24で液体窒素と水浴の間で適切に融解されることを確実にすることが不可欠である。これを達成するために、組織サンプルをいくつかのチューブに分割し、窒素容器に沈めて凍結し、次にウォーターバスに入れて解凍することができます。Triton-X-100溶液を24時間ごとに交換することは、化学的方法が細胞内容物を効果的に破壊するために重要です21。DNase処理は、カプセル化された細胞の生存率を低下させる可能性のある残存DNAの分解をさらに促進するために、両方の方法で使用されました。どちらの方法も、脱細胞化中に細胞物質を除去することに成功し、どちらの場合も微量のDNAが残った20。特に、市販の細胞外マトリックス製品も同様に、組織工学およびトランスレーショナル研究で使用するために移植された宿主の細胞適合性または免疫応答に悪影響を与えない少量の残留DNAを含むことが報告されています20,25。
ECMは、コラーゲン、エラスチン、プロテオグリカンなどの多くのタンパク質および多糖類高分子で構成されており、細胞シグナル伝達において重要な調節機能を持っています26。したがって、ネイティブECM由来のスキャフォールドは、このような細胞に有益なECMリガンドの保持を実証するはずです。この目的のために、コラーゲン染色およびsGAG染色を実施して、脱細胞化マトリックスのECM組成を天然組織のECM組成と比較しました。その結果、コラーゲンとsGAGの含有量が凍結融解法とTriton-X-100脱細胞化法によって脱細胞化組織に保持されたことが示され、再構成された足場に天然のようなECM微小環境が提供されることが示唆されました20,26。ECM成分の構造構造は、ECM含量にわずかな違いはあるものの、脱細胞化法によって違いが見られました。代表的な画像では、界面活性剤による肺組織の脱細胞化と天然肺組織染色の間により多くの類似性が示されましたが、どちらのプロトコルも全体的に天然ECMタンパク質を正常に保持していました(図2)。
細胞の増殖と挙動の両方がネイティブECMの機械的特性によって高度に指示されるため、3D組織モデルの機械的特性は細胞培養研究において重要な役割を果たします27、28、29、30。さまざまな脱細胞化法が、dECMハイドロゲルのゲル化プロセスと最終的な剛性および粘弾性に明確な影響を与えます。これらの知見は、凍結融解法がTriton-X-100法よりも頑健で硬いハイドロゲルを生成することを実証しています。さらに、これまでの研究で、凍結融解dECMハイドロゲルの剛性は、リガンド濃度を変更することで調整でき、Triton-X-100由来のdECMハイドロゲルの剛性に合わせて下げることができることを示しました20。粘弾性は、機械的変形に応答する粘性および弾性挙動を示す天然組織マトリックスの特徴です。最近の研究では、細胞の増殖、形態、および分化におけるECM粘弾性の役割が明らかになりました29,30。この研究は、肺のdECMハイドロゲルが、天然のフィブリン、コラーゲン、または再構成された基底膜に類似したストレス緩和材料であることを示しています。さらに、Triton-X-100 法由来の dECM ハイドロゲルは、凍結融解法由来のハイドロゲルよりも早く回収できることも示されました。したがって、脱細胞化法の選択は、得られるdECMゲルのクリープ応答と緩和速度に大きく影響します。
ここで説明する脱細胞化法は、ウシの肺を利用して、肺組織ECMの生化学的および機械的特性を再構成します。脱細胞化プロセス後のECMの生化学的および物理的組成を詳細に特徴付けました。脱細胞化法における主な課題は、バッチ間のdECMハイドロゲルのゲル化能に直接影響するECM組成の保持です。同じドナーからの肺組織の利用は、バッチ間のばらつきを克服するための重要なパラメータです。健康な天然組織が用いられたとしても、ドナー間のばらつきは避けられない。全体として、凍結融解法とTriton-X-100法はどちらも、肺の疾患モデリングにネイティブdECMハイドロゲルを使用する有望な可能性を示しています。
開示事項
すべての著者は、競合する金銭的利益がないことを宣言します。
謝辞
この研究は、トルコ科学技術研究評議会 (TÜBİTAK) (助成金番号 118C238) から資金提供を受けました。出版物/論文の全責任は、出版物の所有者に帰属します。TÜBİTAKから受けた財政的支援は、出版物の内容がTÜBİTAKによって科学的な意味で承認されていることを意味するものではありません。著者らは、コチ大学トランスレーショナルメディシン研究センター(KUTTAM)のサービスと施設の利用に感謝しています。図 1 と図 2a は、Biorender.com を使用して作成されました。
資料
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | ISOLAB | 64-17-5 | |
| Acetic acid | ISOLAB | 64-19-7 | |
| Alcian blue solution | Sigma-Aldrich | B8438 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| Discovery HR-2 rheometer | TA Instruments | ||
| Entellan mounting medium | Merck | 107960 | |
| Eosin solution | Bright-slide | 2.BS01-105-1000 | |
| Formaldehyde | Electron Microscopy Sciences | 50-980-485 | |
| Hydrochloric acid | Merck | 100317 | |
| Iodine | Sigma-Aldrich | 3002 | |
| Magnesium chloride | Sigma-Aldrich | 7786-30-3 | |
| Mayer's haematoxylin staining solution | Merck | 2.BS01-103-1000 | |
| O.C.T compound | Tissue-Tek | 4583 | |
| Penicillin/Streptomycin | Biowest | L0018-100 | |
| Pepsin from porcine gastric mucosa | Sigma-Aldrich | P6887 | |
| Picric acid | Polysciences | 88-89-1 | |
| Sirius Red | Polysciences | 09400-25 | |
| Sodium hydroxide | Sigma-Aldrich | S5881 | |
| Sucrose | Sigma-Aldrich | S0389 | |
| Triton-X-100 | Merck | 112298 |
参考文献
- Zhu, X., et al. Ordered micropattern arrays fabricated by lung-derived dECM hydrogels for chemotherapeutic drug screening. Mater Today Bio. 15, 100274(2022).
- Ulldemolins, A., et al. Lung extracellular matrix hydrogels-derived vesicles contribute to epithelial lung repair. Polymers. 14 (22), 4907(2022).
- Biehl, A., et al. Towards a standardized multi-tissue decellularization protocol for the derivation of extracellular matrix materials. Biomater Sci. 11 (2), 641-654 (2023).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of cartilage in human knee osteoarthritis with autologous adipose tissue-derived stem cells and autologous extracellular matrix. Biores Open Access. 5 (1), 192-200 (2016).
- Spang, M. T., Christman, K. L. Extracellular matrix hydrogel therapies. In vivo applications and development.Acta Biomater. 68, 1-14 (2018).
- Schwartz, A. D., et al. A biomaterial screening approach reveals microenvironmental mechanisms of drug resistance. Integr Biol. 9 (12), 912-924 (2017).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P., Mano, J. F. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
- Nakamura, R., Nakamura, F., Fukunaga, S. Changes in the composition of the extracellular matrix accumulated by mesenchymal stem cells during in vitro expansion. Anim Sci J. 85 (6), 706-713 (2014).
- Bual, R. P., Ijima, H. Intact extracellular matrix component promotes maintenance of liver-specific functions and larger aggregates formation of primary rat hepatocytes. Regen Ther. 11, 258-268 (2019).
- Jhala, D., Vasita, R. A review on extracellular matrix mimicking strategies for an artificial stem cell niche. Poly Rev. 55 (4), 561-595 (2015).
- Jeong, W., Kim, M. K., Kang, H. W. Effect of detergent type on the performance of liver decellularized extracellular matrix-based bio-inks. J Tissue Eng. 12, 2041731421997091(2021).
- Lee, S. J., Lee, J. H., Park, J., Kim, W. D., Park, S. A. Fabrication of 3D printing scaffold with porcine skin decellularized bio-ink for soft tissue engineering. Materials. 13 (16), 3522(2020).
- Won, J. Y., et al. A potential dermal substitute using decellularized dermis extracellular matrix derived bio-ink. Artif Cells Nanomed Biotechnol. 47 (1), 644-649 (2019).
- Lin, Z., et al. Bioactive decellularized extracellular matrix hydrogel microspheres fabricated using a temperature-controlling microfluidic system. ACS Biomater Sci Eng. 8 (4), 1644-1655 (2022).
- Kaushik, N., Kim, S., Suh, Y., Lee, S. J. Proinvasive extracellular matrix remodeling for tumor progression. Arch Pharm Res. 42 (1), 40-47 (2019).
- Lu, P., Weaver, V. M., Werb, Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol. 196 (4), 395-406 (2012).
- Poltavets, V., Kochetkova, M., Pitson, S. M., Samuel, M. S. The role of the extracellular matrix and its molecular and cellular regulators in cancer cell plasticity. Front Oncol. 8, 431(2018).
- Takeda, M., et al. Development of a drug screening system using three-dimensional cardiac tissues containing multiple cell types. Sci Rep. 11 (1), 5654(2021).
- Jensen, A. R. D., et al. Organ-specific, fibroblast-derived matrix as a tool for studying breast cancer metastasis. Cancers (Basel). 13 (13), 3331(2021).
- Kuşoğlu, A., et al. Different decellularization methods in bovine lung tissue reveals distinct biochemical composition, stiffness, and viscoelasticity in reconstituted hydrogels. ACS Appl Bio Mater. 6 (2), 793-805 (2023).
- Fernández-Pérez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Sci Rep. 9 (1), 14933(2019).
- Park, S., Kim, T. H., Kim, S. H., You, S., Jung, Y. Three-dimensional vascularized lung cancer-on-a-chip with lung extracellular matrix hydrogels for in vitro screening. Cancers (Basel). 13 (16), 3930(2021).
- Uriarte, J. J., Uhl, F. E., Rolandsson Enes, S. E., Pouliot, R. A., Weiss, D. J. Lung bioengineering: advances and challenges in lung decellularization and recellularization. Curr Opin Organ Transplant. 23 (6), 673-678 (2018).
- Roth, S. P., et al. Automated freeze-thaw cycles for decellularization of tendon tissue - a pilot study. BMC Biotechnol. 17 (1), 13(2017).
- Gilbert, T. W., Freund, J. M., Badylak, S. F. Quantification of DNA in biologic scaffold materials. J Surg Res. 152 (1), 135-139 (2009).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Cox, T. R. The matrix in cancer. Nat Rev Cancer. 21 (4), 217-238 (2021).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nat Rev Mol Cell Biol. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Chaudhuri, O., et al. Hydrogels with tunable stress relaxation regulate stem cell fate and activity. Nat Mater. 15 (3), 326-334 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。