Method Article
탈세포화된 폐 세포외 기질 하이드로겔의 개발 및 특성 분석
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 토착 소 폐 조직에 적용되는 두 가지 뚜렷한 탈세포화 방법론을 설명하여 각각의 특성화에 대한 포괄적인 설명을 제공합니다.
초록
조직 공학에서 세포외 기질(ECM) 유래 하이드로겔의 사용은 체외에서 세포의 자연 환경을 모방할 수 있기 때문에 점점 더 대중화되고 있습니다. 그러나 ECM의 기본 생화학적 함량을 유지하고, 기계적 안정성을 달성하고, 탈셀룰러화 공정이 ECM 하이드로겔의 기계적 특성에 미치는 영향을 이해하는 것은 어려운 일입니다. 여기에서는 두 가지 프로토콜을 사용한 소 폐 조직의 탈세포화를 위한 파이프라인, 탈세포화 효과의 다운스트림 특성 분석, 재구성된 탈세포화된 폐 ECM 하이드로겔의 제조 및 기계적 및 세포 적합성 특성 평가에 대해 설명했습니다. 소 폐의 탈세포화는 물리적(동결-해동 주기) 또는 화학적(세제 기반) 방법을 사용하여 수행되었습니다. 주요 ECM 성분의 탈세포화 및 머무름을 검증하기 위해 Hematoxylin 및 Eosin 염색을 수행했습니다. 탈세포화된 샘플 내의 잔류 콜라겐 및 황산염 글리코사미노글리칸(sGAG) 함량을 평가하기 위해 각각 Sirius red 및 Alcian blue 염색 기법을 사용했습니다. 탈세포화된 폐 ECM 하이드로겔의 기계적 특성은 진동 유변학에 의해 특성화되었습니다. 그 결과, 탈세포화된 소 폐 하이드로겔은 대부분의 천연 ECM 성분을 유지함으로써 상용 ECM 제품에 대한 신뢰할 수 있는 유기형 대안을 제공할 수 있음을 시사합니다. 또한, 이러한 발견은 선택한 탈세포화 방법이 겔화 역학뿐만 아니라 생성된 하이드로겔의 강성 및 점탄성 특성에 상당한 영향을 미친다는 것을 보여줍니다.
서문
기존의 단층 배양 조건은 천연 조직 미세환경을 충실하게 표현하지 못하며, 세포-매트릭스 및 세포-세포 상호작용을 가능하게 하는 교육적 리간드가 있는 3차원(3D) 스캐폴드를 제공할 수 있는 능력이 부족하다1. 세포외 기질(ECM) 조성 및 기계적 특성은 조직 특이적이고 시간 의존적이며 병리학적 조건에서 변화를 겪습니다. 따라서 이러한 특성의 조정 가능성, 세포 행동의 조절 및 원하는 조직 기능 달성을 허용하는 생체 모방 3D 조직 모델이 필요합니다. 네이티브 ECM 유래 생체 재료는 조직 특이적 ECM 1,2,3,4,5를 직접 사용할 수 있는 능력으로 조직 공학에서 많은 관심을 끌고 있습니다. ECM 기반 캐리어는 조직 재생에서 질병 모델 개발에 이르기까지 많은 응용 분야에서 사용되었습니다. 이들은 주사 또는 이식 가능한 생체 재료 스캐폴드(4,5), 약물 스크리닝 응용 분야(6,7), 세포 성장을 유도하는 물질 개발(8,9,10), 바이오 잉크(11,12,13), 미세유체역학(14) 및 암 조직 모델(15,16,17)로 사용됩니다 ,18,19.
조직과 장기의 탈세포화는 조직 특이적 ECM을 모방하는 스캐폴드를 생성하는 데 널리 사용되는 접근 방식입니다. 탈세포화된 조직 및 기관을 하이드로겔로 재구성하면 생체모방 3D 조직 모델(20)에 세포를 내장할 수 있다. 탈세포화 기술은 주로 ECM 조성을 유지하면서 세포 성분을 제거하는 데 중점을 둡니다. 동결-해동 주기와 같은 물리적 방법 또는 Triton-X-100 처리와 같은 화학적 공정은 일반적으로 조직을 탈세포화하는 데 적용됩니다. 또한, DNase 처리는 세포 임베딩 시 면역학적 반응을 최소화하기 위해 잔류 DNA를 제거하는 데 선호됩니다. 탈세포화 절차를 최적화하기 위해 최대한의 세포 제거와 최소한의 ECM 손상을 달성하는 것이 중요하다21. 이러한 측면 외에도, 점탄성 및 강성을 포함한 재구성된 지지체의 생화학적 및 기계적 특성의 특성화는 네이티브 매트릭스(20)로부터 유도된 공학적 3D 조직 모델을 개선하는 데 매우 중요하다.
폐 조직 공학에서 장기 특이적 ECM을 사용하면 폐 미세환경을 모방하여 체외에서 발달, 항상성 또는 병리학적 과정을 모델링하고 생리모방 환경에서 치료제를 테스트할 수 있습니다 20,22,23. 이전 연구에서는 쥐, 돼지 및 인간과 같은 여러 종의 폐 조직의 탈세포화를 입증했지만 이러한 방법은 소와 같이 덜 자주 사용되는 종에는 아직 적용되지 않았습니다. 탈세포화 공정의 매개변수와 생화학적 조성 및 기계적 특성과 관련하여 재구성된 ECM 스캐폴드에 미치는 영향을 더 잘 이해하면 이러한 측면을 더 잘 조정할 수 있고 건강 및 질병에서 보다 신뢰할 수 있는 조직 모델을 위한 길을 열 수 있습니다. 이 연구에서는 동결-해동 주기와 Triton-X-100 처리라는 두 가지 뚜렷한 방법을 사용한 소 폐 탈세포화를 명시적으로 설명한 후 탈세포화된 폐 ECM(dECM) 하이드로겔의 생화학적 및 기계적 분석을 수행합니다. 연구 결과에 따르면 두 방법 모두 ECM 리간드의 효과적인 탈세포화 및 유지를 제공합니다. 특히, 방법의 선택은 재구성된 하이드로겔의 결과 강성과 점탄성을 크게 변경합니다. 소 dECM에서 유래한 하이드로겔은 인간 폐의 세포외 기질과 주목할 만한 생화학적 유사성을 보여주며, 신뢰할 수 있는 열 겔화 특성을 나타낸다20. 앞서 설명한 바와 같이, 두 방법 모두 폐암 세포, 건강한 기관지 상피 세포 및 환자 유래 폐 오가노이드의 3D 배양에 적합하다20.
프로토콜
어린(1-2세) 소 기증자로부터 신선한 토종 폐를 지역 도축장에서 얻어 얼음 위에 밀봉된 플라스틱 용기에 담아 실험실로 운송했습니다. 동물 희생은 일반적인 육류 소비(폐는 폐기물로 버려짐)를 위해 수행되며 연구와 관련이 없거나 연구로 인한 것이 아닙니다. 우리는 도축장이 동물 희생에 관한 국가 법률 및 규정을 준수함을 확인합니다. 또한, 폐기물만 사용했으며, 연구 프로젝트는 희생된 동물의 수에 영향을 미치지 않았음을 확인합니다.
1. 장기 및 조직 적출 준비
- 갓 얻은 소의 폐 조직은 실험이 끝날 때까지 -80°C에서 보관합니다.
- 실험 당일에는 얼어붙은 폐 조직이 실온에서 해동될 때까지 기다립니다.
- 멸균 메스와 가위로 조직을 해부하여 기관과 연골기도를 제거하고 작은 조각으로 더 잘게 썬다.
- 2% 페니실린/스트렙토마이신(P/S)을 3배 이상 함유한 초순수로 철저히 씻으십시오.
2. 조직의 탈세포화
참고: 천연 소의 폐 조직은 두 가지 별개의 프로토콜을 사용하여 탈세포화되었습니다.
- 동결-해동 방법
- 1단계에 따라 조직 샘플을 준비합니다. 멸균 증류수(dH2O)에 다진 조직을 2% 요오드 용액에 1분 동안 담그십시오. 멸균 dH2O에서 2회 연속 세척을 수행합니다.
- 다진 조직 조각을 최대 15mL 수준까지 50mL 튜브에 옮기고 휴대용 액체 질소 용기를 사용하여 5번의 수동 동결-해동 주기를 구현합니다. 멸균 dH2O로 튜브를 상단까지 채우고 액체 질소에서 2분 동안 튜브를 동결합니다. 2분 후 즉시 37°C 수조로 옮겨 10분 동안 가열합니다. 이것은 동결-해동의 1주기를 구성합니다.
- 100 rpm에서 일정하게 흔들면서 37 °C에서 1 시간 동안 10 mM MgCl2 완충액 (pH 7.5)에 30 mL의 DNase 용액 (10 U / mL)을 넣고 샘플을 배양합니다.
- 멸균dH 2O로 3일 동안 100rpm에서 일정하게 흔들면서 24시간마다 용액을 보충하면서 광범위하게 세척합니다.
- 다음과 같이 동결건조 및 동결 밀링을 수행합니다20: 습식 dECM 샘플을 -80°C에서 24시간 동안 동결합니다. 냉동 샘플을 동결 건조기로 옮기고 완전히 건조될 때까지 3-4일 동안 진공 상태에서 건조 모드로 작동합니다. 동결 건조가 완료되면 분쇄 장치와 드라이 아이스를 사용하여 샘플을 미세한 분말 형태로 밀링합니다.
참고: 이 미세한 분말 상태는 분해 과정의 후속 단계에서 향상된 용해도 특성으로 인해 필요한 것으로 간주됩니다.
- Triton-X-100 분석법
- 1단계에 따라 조직 샘플을 준비합니다. 1% Triton-X-100으로 폐 조직을 4°C에서 부드럽게 회전시키면서 3일 동안 치료합니다. 24시간마다 용액을 교환합니다.
- DNase 용액(10U/mL)을 10mM MgCl2 완충액(pH 7.5)에 넣고 37°C에서 1시간 동안 지속적으로 흔들어 주면서 샘플을 배양합니다.
- 멸균dH 2O로 3일 동안 부드럽게 회전하면서 24시간마다 용액을 보충하면서 광범위하게 세척합니다.
- 2.1단계에서 설명한 대로 동결건조 후 극저온 밀링을 수행합니다.
3. 펩신 소화
- 펩신 용액(0.01M HCl, pH 2에서 1mg/mL 펩신)에서 15mg/mL(w/v) 농도로 분말 dECM 샘플을 분해합니다. 실온에서 48시간 동안 일정하게 교반하면서 시료 분해 공정을 수행하고 효과적인 분해를 위해 용액의 pH를 자주 유지합니다.
- 분해물을 튜브에 옮기고 5000 x g 에서 10분 동안 원심분리합니다.
- 상층액을 포집하고 5M NaOH 및 10x PBS를 첨가하여 생리학적 조건(pH 7, 1x 인산염 완충 식염수(PBS))으로 중화 및 완충합니다.
참고: 산성 분해물의 pH 조정을 위해 농축 알칼리성 용액을 사용하는 것이 좋습니다., 이 접근 방식은 후속 단계에서 겔화에 해로운 영향을 미칠 수 있는 원치 않는 부피 팽창을 피하기 때문입니다. - 추가 연구를 위해 프리겔 분해물을 -20°C에서 보관합니다.
4. 조직학적 염색
- 탈세포화된 조직 샘플의 소량(5mm3)을 4°C에서 밤새 3.7% 포름알데히드 용액 1mL에 고정합니다.
- PBS에서 30% 자당 용액 1ml를 함유한 튜브에 조직을 안정된 암석에서 4°C에서 12시간 동안 배양합니다.
- 최적의 절단 온도 화합물(OCT)에 조직을 포비하려면 크라이오몰드에 OCT 1mL를 붓고 크라이오몰드 중앙에 조직을 놓은 다음 조직 위에 OCT 2mL를 붓습니다.
- 조직이 들어 있는 크라이오몰드를 드라이아이스 위에 놓고 액체 질소를 사용하여 급속 냉동합니다. OCT가 모두 흰색으로 바뀌면 샘플이 준비되며, 보통 3분이 소요됩니다. OCT가 포매된 티슈는 사용할 때까지 -20°C에서 보관하십시오.
- -25°C의 cryostat에서 poly-L-lysine으로 코팅된 유리 슬라이드에서 10μm 절편을 얻고 슬라이드를 실온으로 옮겨 조직 절편이 슬라이드에서 녹을 수 있도록 합니다. 슬라이드를 사용할 때까지 -20°C에서 보관하십시오.
- 탈세포화 후 핵이 없음을 확인하기 위해 아래 설명된 대로 Hematoxylin 및 Eosin(H&E) 염색을 수행합니다.
- 슬라이드를 실온에서 10분 동안 배양합니다. 슬라이드를 PBS에 담그고 염색 용기에 바로 사용할 수 있는 50mL의 헤마톡실린 용액으로 3분 동안 염색한 다음 수돗물로 3분 동안 세척합니다.
- 슬라이드를 95% 에탄올에 담그고 염색 용기에 50mL의 0.5% 알코올 에오신 용액으로 45초 동안 염색합니다.
- 시리우스 레드 염색을 수행하여 탈세포화 후 콜라겐 함량의 유지를 보여줍니다.
- PBS로 슬라이드를 수화하고 염색 용기에 있는 피크르산 포화 수용액에 0.1% 시리우스 레드 50mL에 1시간 동안 담그십시오.
- 슬라이드를 0.5% 아세트산 용액에 5초 동안 헹구고 모든 슬라이드를 70%, 95% 및 100% 에탄올에 각각 1분 동안 순차적으로 담가 탈수합니다.
- 조직 샘플에서 sGAG 함량을 분석하려면 아래 설명된 대로 Alcian blue 염색을 수행합니다.
- 슬라이드를 염색 용기에 3% 아세트산 용액(pH 2.5)에 넣은 1% Alcian blue 50mL에 30분 동안 담급니다. 흐르는 수돗물로 2분 동안 슬라이드를 씻습니다.
- 모든 슬라이드를 70%, 95%, 100% 에탄올에 각각 1분 동안 순차적으로 담가 탈수합니다.
- 샘플 위에 0.1mL의 장착 배지를 추가하고 10배 배율로 광학 현미경을 사용하여 시각화합니다.
5. 기계적 특성화
- 평행 플레이트 형상의 레오미터를 사용하여 진동 유변학 측정을 구현합니다.
- 얼음 위에 보관된 250μL의 프리겔 용액을 사전 냉각된(4°C) 하부 플레이트에 부어 급격한 겔화를 방지합니다.
- 프리겔 용액이 두 플레이트 사이에 1mm 간격 너비의 디스크를 형성할 때까지 20mm 평행 플레이트를 내립니다.
- 즉시 측정을 시작하십시오. 고정 주파수와 변형률로 시간 경과에 따른 저장 및 손실 계수를 측정하고 하부 플레이트를 30분 동안 37°C로 가열하여 겔화 역학을 관찰합니다. 0.5Hz의 고정 주파수와 0.1% 변형률을 사용합니다.
- 저장 계수 값이 증가를 멈추고 안정기에 도달한 후 크리프 회복 테스트를 수행합니다.
- 15분 동안 하이드로겔에 1Pa 전단 응력을 가하고, 변형률을 측정하고, 응력에서 샘플을 언로드하고, 15분 동안 변형률 값의 변화를 기록합니다.
- 스트레스 이완 행동을 보여주기 위해 변형 대 시간 그래프를 그립니다. 세 개의 서로 다른 dECM 분해물에 대해 반복실험으로 측정을 반복합니다.
결과
탈셀룰라화(Decellularization)
본래 폐 미세환경을 재현하는 dECM 하이드로겔을 생산하기 위한 소 폐 조직의 탈세포화는 물리적(동결-해동) 및 화학적(Triton-X-100) 방법 모두에 의해 달성되었습니다. 해부 후, 조직 조각을dH2O 함유 항생제로 세척하여 나중에 dECM 하이드로겔의 무균성에 영향을 미칠 수 있는 병원균을 제거하였다. 세포 구조를 파괴하기 위해 동결-해동 방법에 액체 질소에서 37°C 수조를 번갈아 가며 총 5회 사이클을 적용했습니다. 두 번째 탈세포화 방법에서는 천연 폐 조직 조각을 1% Triton-X-100 용액으로 3일 동안 일정한 교반 하에 처리했습니다. 두 방법 모두 폐 조직을 작은 조각으로 자르는 것이 핵 내용물의 물리적 파괴뿐만 아니라 핵심 영역으로의 용액 확산을 허용하는 데 중요합니다. 탈세포화의 첫 번째 시각적 지표로서 조직의 분홍색은 두 가지 방법 모두에서 반복된 주기로 희끄무레한 색으로 변했습니다. 이 프로토콜에서 DNase 처리로 달성된 잔류 DNA를 제거하는 것도 중요합니다. 또한, 두 가지 방법으로 탈세포화 후, 조직의 무균성을 보존하기 위해 항생제가 보충된dH2O에서 조직을 3일 동안 광범위하게 세척하였다. 고려해야 할 또 다른 사항은 생리학적 조건으로 dECM 분해물을 중화 및 완충하는 동안 모든 용액을 다시 멸균 목적으로 필터 멸균하고 조기 겔 형성을 방지하기 위해 얼음 위에 보관했다는 것입니다. 그런 다음 폐 dECM 하이드로겔 형성은 최종 단계에서 열 겔화로 달성되었습니다(그림 1).
냉동 절편 및 조직학적 염색
탈세포화 후 핵의 제거 및 ECM 분자의 유지를 평가하기 위해 천연 및 탈세포화된 폐 조직의 고정 및 동결 절편에 이어 표시된 조직학적 염색을 수행했습니다(그림 2A). H&E 염색은 본래 조직에 비해 동결-해동 및 Triton-X-100 분석법을 모두 사용한 탈세포화된 시료에서 핵 함량이 현저히 감소하는 것으로 나타났으며, 이는 물리적 및 화학적 방법 모두에 의해 탈세포화가 달성되었음을 의미합니다(그림 2B). 시리우스 레드 염색은 탈세포화된 조직의 잔류 콜라겐이 천연 조직과 비슷하다는 것을 보여주었으며, 이는 두 탈세포화 방법 모두 콜라겐 함량에 미치는 영향이 최소화되었음을 나타냅니다(그림 2B). 또한 Alcian blue 염색은 탈세포화된 조직의 sGAG 함량이 자연 조직에 비해 효율적으로 보존됨을 보여주었습니다(그림 2B).
기계적 특성화
탈세포화된 폐 하이드로겔의 유변학 측정은 1mm 두께의 하이드로겔 디스크를 얻기 위해 20mm 평행 플레이트 셋업으로 수행되었습니다(그림 3A). 주파수 스윕은 측정에 사용된 변형률 값을 최적화하는 데 사용되었습니다. 동결-해동 방법으로 얻은 하이드로겔의 평균 저장 탄성률(G') 및 손실 탄성률(G'')은 각각 204Pa 및 28.4Pa였으며, 이는 Triton-X-100 방법으로 얻은 하이드로겔보다 훨씬 더 단단했습니다(그림 3B-C). 흥미롭게도, 크리프 회수 테스트에서 동결-해동 및 Triton-X-100 방법으로 얻은 하이드로겔은 응력에 대해 뚜렷한 반응을 보였으며, 이는 하이드로겔이 서로 다른 점탄성 특성을 갖는다는 것을 의미합니다(그림 3D).

그림 1: 탈세포화 공정의 개략도 . 소의 폐 조직을 작은 조각으로 절개하고 철저히 세척했습니다. 세포 내용물의 제거는 두 가지 다른 방법으로 달성되었습니다. 동결-해동 주기를 반복하는 물리적 방법과 Triton-X-100 처리를 사용한 화학적 방법. 잔류 DNA를 제거하기 위해 두 가지 방법 모두에서 DNase 처리를 수행했습니다. 탈세포화된 조직의 동결건조 후, 크라이오밀링, 펩신 분해, 중화 및 겔화 단계를 수행했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
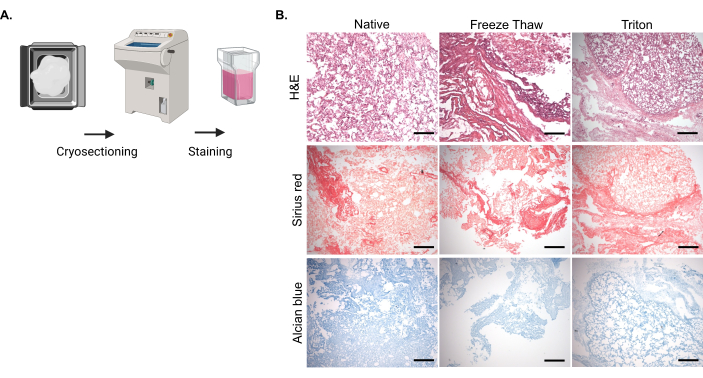
그림 2: 자연 및 탈세포화된 소 폐 조직의 냉동 절편 및 염색. (A) 천연 및 탈세포화된 소 폐 조직 조각을 3.7% 포름알데히드 용액으로 고정하고, PBS의 30% 슈크로스 용액에 담근 다음, 최적 절단 온도(OCT) 화합물에 매립하고 스냅 냉동했습니다. 각 샘플에 대해 10μm 섹션을 유리 슬라이드에 장착하여 염색을 진행했습니다. (B) 동결-해동 또는 Triton-X-100 방법에 의한 네이티브 및 탈세포화된 샘플의 대표 이미지. 핵에 대한 Hematoxylin & Eosin (H&E) 염색, 콜라겐에 대한 Sirius red 염색 및 sGAG에 대한 Alcian blue 염색을 수행했습니다. 척도 막대: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 탈세포화된 폐 ECM 하이드로겔의 기계적 특성 측정. (A) 기계적 특성 분석 후 열적으로 가교된 탈세포화된 폐 하이드로겔의 대표 이미지. 진동 유변학은 평행 플레이트 형상을 가진 레오미터를 사용하여 수행되었습니다. 탈셀룰라화된 하이드로겔의 유변학적 특성, (B) 저장 탄성률(G'), (C) 손실 탄성률(G''), (D) 하이드로겔의 응력 완화 거동을 평가하기 위한 크리프 회복 시험. 오차 막대는 s.d. (*p < 0.05), n=3을 나타냅니다. Welch의 수정이 있는 쌍을 이루지 않은 t-검정을 통계 분석에 사용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
장기 유래 하이드로겔은 자연 조직 ECM을 재현하고 기관형 세포 기능을 모방하는 유망한 모델이 되었습니다. 탈세포화된 폐 ECM은 조직 공학에 자주 사용되어 왔지만, 생체 재료 조성 및 기계적 특성의 철저한 특성 분석은 항상성 또는 질병 중 생물학적 과정을 모델링하기 위해 세포-ECM 상호 작용이 어떻게 조절될 수 있는지 더 잘 이해하는 데 도움이 됩니다. 특히, 강성 및 점탄성과 같은 재구성 하이드로겔의 기계적 특성에 대한 평가 및 제어는 여러 세포 현상을 조절하는 데 있어 매우 중요합니다. 따라서 생화학적 함량 및 기계적 측면 측면에서 dECM 하이드로겔을 생산하기 위한 다양한 탈세포화 방법을 비교하고 평가하는 것이 중요합니다20,23. 여기에서 소의 폐 탈세포화는 주로 DNA 함량의 기계적 파괴 및 제거를 기반으로 하는 동결-해동 주기와 일반 세제인 Triton-X-100을 사용한 핵 함량의 화학적 제거라는 두 가지 뚜렷한 접근 방식으로 입증되었습니다(그림 1). 동결-해동 방법의 경우, 모든 조직 샘플이 동결되고 자동화되고 반복적인 경로(24)에서 액체 질소와 수조 사이에서 적절하게 해동되도록 하는 것이 필수적이다. 이를 달성하기 위해 조직 샘플을 여러 개의 튜브로 나누고 질소 용기에 가라앉혀 얼린 다음 해동을 위해 수조를 만들 수 있습니다. 24시간마다 Triton-X-100 용액을 교체하는 것은 화학적 방법으로 세포 함량을 효과적으로 파괴하는 데 매우 중요합니다21. DNase 처리는 캡슐화된 세포의 생존력을 감소시킬 수 있는 남아 있는 DNA의 분해를 더욱 향상시키기 위해 두 방법 모두에 사용되었습니다. 두 방법 모두 탈세포화 동안 세포 물질을 성공적으로 제거했으며, 두 경우 모두 미량의 DNA가 남아 있었습니다20. 특히, 상업적으로 이용 가능한 세포외 기질 산물은 조직 공학 및 중개 연구에 사용하기 위해 이식 시 숙주의 세포 적합성 또는 면역 반응에 악영향을 미치지 않으면서 소량의 잔류 DNA를 포함하는 것으로 유사하게 보고되었습니다20,25.
ECM은 콜라겐, 엘라스틴, 프로테오글리칸과 같은 많은 단백질 및 다당류 거대분자로 구성되며, 이들은 세포 신호전달에 중요한 조절 역할을 한다26. 따라서 네이티브 ECM 유래 스캐폴드는 이러한 세포 유도 ECM 리간드의 보유를 입증해야 합니다. 이를 위해 콜라겐 및 sGAG 염색을 수행하여 탈세포화된 매트릭스의 ECM 조성을 본래 조직의 ECM 조성과 비교했습니다. 결과는 콜라겐 및 sGAG 함량이 동결-해동 및 Triton-X-100 탈세포화 방법을 통해 탈세포화된 조직에서 유지되었음을 보여주며, 이는 재구성 된 스캐폴드에서 네이티브와 유사한 ECM 미세 환경을 제공한다는 것을 시사합니다20,26. ECM 성분의 구조적 조직은 ECM 함량의 미세한 차이에도 불구하고 탈세포화 방법에 따른 차이를 보였다. 대표 이미지에서 폐 조직의 세제 기반 탈세포화와 천연 폐 조직 염색 간에 더 많은 유사성이 나타났지만, 두 프로토콜 모두 전반적으로 천연 ECM 단백질을 성공적으로 유지했습니다(그림 2).
3D 조직 모델의 기계적 특성은 세포의 성장과 거동이 모두 네이티브 ECM 27,28,29,30의 기계적 특성에 의해 고도로 지시되기 때문에 세포 배양 연구에서 중요한 역할을 합니다. 다양한 탈세포화 방법은 겔화 과정과 dECM 하이드로겔의 최종 강성 및 점탄성에 뚜렷한 영향을 미칩니다. 이러한 결과는 동결-해동 방법이 Triton-X-100 방법보다 더 견고하고 단단한 하이드로겔을 생성한다는 것을 보여줍니다. 또한, 이전 연구에서는 리간드 농도를 조절하여 동결-해동 dECM 하이드로겔의 강성을 조절할 수 있으며, 트리톤-X-100 유래 dECM 하이드로겔20의 강성에 맞게 낮출 수 있음을 밝혔다. 점탄성은 기계적 변형에 대한 반응으로 점성 및 탄성 거동을 나타내는 기본 조직 매트릭스의 특징입니다. 최근 연구에서는 세포 증식, 형태 및 분화에서 ECM 점탄성의 역할을 밝혔습니다29,30. 이 연구는 폐 dECM 하이드로겔이 천연 섬유소, 콜라겐 또는 재구성 기저막과 유사한 스트레스 완화 물질임을 보여줍니다. 또한, 연구 결과에 따르면 Triton-X-100 분석법에서 파생된 dECM 하이드로겔은 동결-해동 유래 하이드로겔보다 더 빨리 회복됩니다. 따라서 탈셀룰라화 방법의 선택은 생성된 dECM 겔의 크리프 반응 및 이완 역학에 큰 영향을 미칩니다.
여기에 설명된 탈세포화 방법은 폐 조직 ECM의 생화학적 및 기계적 특성을 재구성하기 위해 소의 폐를 이용합니다. 탈세포화 과정 후 ECM의 생화학적, 물리적 조성을 정교하게 특성화했습니다. 탈세포화 방법의 주요 과제는 배치 간 dECM 하이드로겔의 겔화 능력에 직접적인 영향을 미치는 ECM 조성물의 머무름입니다. 동일한 기증자의 폐 조직 활용은 배치 간 변동성을 극복하기 위한 중요한 매개변수입니다. 건강한 천연 조직이 사용되더라도 기증자 간의 차이는 불가피합니다. 전반적으로, 동결-해동 및 Triton-X-100 분석법 모두 폐의 질병 모델링에 천연 dECM 하이드로겔을 사용할 수 있는 유망한 잠재력을 보여줍니다.
공개
모든 저자는 재정적 이익 경쟁이 없음을 선언합니다.
감사의 말
이 연구는 터키 과학 기술 연구 위원회(TÜBİTAK)(보조금 번호 118C238)의 자금 지원을 받았습니다. 출판물/논문에 대한 모든 책임은 출판물의 소유자에게 있습니다. TÜBİTAK으로부터 받은 재정적 지원은 출판물의 내용이 TÜBİTAK에 의해 과학적 의미로 승인되었음을 의미하지 않습니다. 저자들은 Koç University Research Center for Translational Medicine (KUTTAM)의 서비스 및 시설 사용에 대해 감사의 뜻을 표합니다. 그림 1과 그림 2a는 Biorender.com 를 사용하여 작성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | ISOLAB | 64-17-5 | |
| Acetic acid | ISOLAB | 64-19-7 | |
| Alcian blue solution | Sigma-Aldrich | B8438 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| Discovery HR-2 rheometer | TA Instruments | ||
| Entellan mounting medium | Merck | 107960 | |
| Eosin solution | Bright-slide | 2.BS01-105-1000 | |
| Formaldehyde | Electron Microscopy Sciences | 50-980-485 | |
| Hydrochloric acid | Merck | 100317 | |
| Iodine | Sigma-Aldrich | 3002 | |
| Magnesium chloride | Sigma-Aldrich | 7786-30-3 | |
| Mayer's haematoxylin staining solution | Merck | 2.BS01-103-1000 | |
| O.C.T compound | Tissue-Tek | 4583 | |
| Penicillin/Streptomycin | Biowest | L0018-100 | |
| Pepsin from porcine gastric mucosa | Sigma-Aldrich | P6887 | |
| Picric acid | Polysciences | 88-89-1 | |
| Sirius Red | Polysciences | 09400-25 | |
| Sodium hydroxide | Sigma-Aldrich | S5881 | |
| Sucrose | Sigma-Aldrich | S0389 | |
| Triton-X-100 | Merck | 112298 |
참고문헌
- Zhu, X., et al. Ordered micropattern arrays fabricated by lung-derived dECM hydrogels for chemotherapeutic drug screening. Mater Today Bio. 15, 100274 (2022).
- Ulldemolins, A., et al. Lung extracellular matrix hydrogels-derived vesicles contribute to epithelial lung repair. Polymers. 14 (22), 4907 (2022).
- Biehl, A., et al. Towards a standardized multi-tissue decellularization protocol for the derivation of extracellular matrix materials. Biomater Sci. 11 (2), 641-654 (2023).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of cartilage in human knee osteoarthritis with autologous adipose tissue-derived stem cells and autologous extracellular matrix. Biores Open Access. 5 (1), 192-200 (2016).
- Spang, M. T., Christman, K. L. Extracellular matrix hydrogel therapies. In vivo applications and development.Acta Biomater. 68, 1-14 (2018).
- Schwartz, A. D., et al. A biomaterial screening approach reveals microenvironmental mechanisms of drug resistance. Integr Biol. 9 (12), 912-924 (2017).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P., Mano, J. F. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
- Nakamura, R., Nakamura, F., Fukunaga, S. Changes in the composition of the extracellular matrix accumulated by mesenchymal stem cells during in vitro expansion. Anim Sci J. 85 (6), 706-713 (2014).
- Bual, R. P., Ijima, H. Intact extracellular matrix component promotes maintenance of liver-specific functions and larger aggregates formation of primary rat hepatocytes. Regen Ther. 11, 258-268 (2019).
- Jhala, D., Vasita, R. A review on extracellular matrix mimicking strategies for an artificial stem cell niche. Poly Rev. 55 (4), 561-595 (2015).
- Jeong, W., Kim, M. K., Kang, H. W. Effect of detergent type on the performance of liver decellularized extracellular matrix-based bio-inks. J Tissue Eng. 12, 2041731421997091 (2021).
- Lee, S. J., Lee, J. H., Park, J., Kim, W. D., Park, S. A. Fabrication of 3D printing scaffold with porcine skin decellularized bio-ink for soft tissue engineering. Materials. 13 (16), 3522 (2020).
- Won, J. Y., et al. A potential dermal substitute using decellularized dermis extracellular matrix derived bio-ink. Artif Cells Nanomed Biotechnol. 47 (1), 644-649 (2019).
- Lin, Z., et al. Bioactive decellularized extracellular matrix hydrogel microspheres fabricated using a temperature-controlling microfluidic system. ACS Biomater Sci Eng. 8 (4), 1644-1655 (2022).
- Kaushik, N., Kim, S., Suh, Y., Lee, S. J. Proinvasive extracellular matrix remodeling for tumor progression. Arch Pharm Res. 42 (1), 40-47 (2019).
- Lu, P., Weaver, V. M., Werb, Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol. 196 (4), 395-406 (2012).
- Poltavets, V., Kochetkova, M., Pitson, S. M., Samuel, M. S. The role of the extracellular matrix and its molecular and cellular regulators in cancer cell plasticity. Front Oncol. 8, 431 (2018).
- Takeda, M., et al. Development of a drug screening system using three-dimensional cardiac tissues containing multiple cell types. Sci Rep. 11 (1), 5654 (2021).
- Jensen, A. R. D., et al. Organ-specific, fibroblast-derived matrix as a tool for studying breast cancer metastasis. Cancers (Basel). 13 (13), 3331 (2021).
- Kuşoğlu, A., et al. Different decellularization methods in bovine lung tissue reveals distinct biochemical composition, stiffness, and viscoelasticity in reconstituted hydrogels. ACS Appl Bio Mater. 6 (2), 793-805 (2023).
- Fernández-Pérez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Sci Rep. 9 (1), 14933 (2019).
- Park, S., Kim, T. H., Kim, S. H., You, S., Jung, Y. Three-dimensional vascularized lung cancer-on-a-chip with lung extracellular matrix hydrogels for in vitro screening. Cancers (Basel). 13 (16), 3930 (2021).
- Uriarte, J. J., Uhl, F. E., Rolandsson Enes, S. E., Pouliot, R. A., Weiss, D. J. Lung bioengineering: advances and challenges in lung decellularization and recellularization. Curr Opin Organ Transplant. 23 (6), 673-678 (2018).
- Roth, S. P., et al. Automated freeze-thaw cycles for decellularization of tendon tissue - a pilot study. BMC Biotechnol. 17 (1), 13 (2017).
- Gilbert, T. W., Freund, J. M., Badylak, S. F. Quantification of DNA in biologic scaffold materials. J Surg Res. 152 (1), 135-139 (2009).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Cox, T. R. The matrix in cancer. Nat Rev Cancer. 21 (4), 217-238 (2021).
- Vining, K. H., Mooney, D. J. Mechanical forces direct stem cell behaviour in development and regeneration. Nat Rev Mol Cell Biol. 18 (12), 728-742 (2017).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Chaudhuri, O., et al. Hydrogels with tunable stress relaxation regulate stem cell fate and activity. Nat Mater. 15 (3), 326-334 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유