Method Article
Caenorhabditis elegans ve Memeli Hücrelerinde Mitopajinin Organele Özgü Boyalar Kullanılarak Saptanması
Bu Makalede
Özet
Mitofaji'yi elektron mikroskobu, genetik sensörler ve immünofloresan yoluyla keşfetmek, pahalı ekipman, yetenekli personel ve önemli bir zaman yatırımı gerektirir. Burada, ticari bir floresan boya kitinin hem Caenorhabditis elegans hem de bir karaciğer kanseri hücre hattındaki mitopaji sürecini ölçmedeki etkinliğini gösteriyoruz.
Özet
Mitokondri, enerji üretimi, lipid metabolizması, kalsiyum homeostazı, heme biyosentezi, düzenlenmiş hücre ölümü ve reaktif oksijen türlerinin (ROS) üretimi dahil olmak üzere çeşitli biyolojik fonksiyonlar için gereklidir. ROS, anahtar biyolojik süreçler için hayati öneme sahiptir. Bununla birlikte, kontrolsüz olduklarında, mitokondriyal hasar da dahil olmak üzere oksidatif hasara yol açabilirler. Hasarlı mitokondri daha fazla ROS salgılar, böylece hücresel hasarı ve hastalık durumunu yoğunlaştırır. Mitokondriyal otofaji (mitopaji) adı verilen homeostatik bir süreç, hasarlı mitokondrileri seçici olarak ortadan kaldırır ve daha sonra yenileriyle değiştirilir. Birden fazla mitopaji yolu vardır, ortak son nokta lizozomlardaki hasarlı mitokondrinin parçalanmasıdır.
Genetik sensörler, antikor immünofloresansı ve elektron mikroskobu dahil olmak üzere çeşitli metodolojiler, mitopajiyi ölçmek için bu son noktayı kullanır. Mitopajiyi incelemek için kullanılan her yöntemin, spesifik doku / hücre hedefleme (genetik sensörlerle) ve büyük ayrıntı (elektron mikroskobu ile) gibi avantajları vardır. Bununla birlikte, bu yöntemler genellikle pahalı kaynaklar, eğitimli personel ve transgenik hayvanlar oluşturmak gibi gerçek deneyden önce uzun bir hazırlık süresi gerektirir. Burada, mitokondri ve lizozomları hedef alan ticari olarak temin edilebilen floresan boyaları kullanarak mitofajiyi ölçmek için uygun maliyetli bir alternatif sunuyoruz. Bu yöntem, nematod Caenorhabditis elegans ve insan karaciğer hücrelerindeki mitopajiyi etkili bir şekilde ölçer ve bu da diğer model sistemlerdeki potansiyel verimliliğini gösterir.
Giriş
Mitokondri, insanlar da dahil olmak üzere tüm aerobik hayvanlar için gereklidir. Biyomoleküllerin kimyasal enerjisini oksidatif fosforilasyon1 yoluyla adenozin trifosfata (ATP) dönüştürürler, heme2'yi sentezlerler, yağ asitlerini β oksidasyon3 yoluyla parçalarlar, kalsiyum4 ve demir5 homeostazını düzenlerler, apoptoz6 ile hücre ölümünü kontrol ederler ve redoks homeostazında hayati bir rol oynayan reaktif oksijen türleri (ROS) üretirler7. İki tamamlayıcı ve zıt süreç, mitokondrinin bütünlüğünü ve uygun işlevini korur: yeni mitokondriyal bileşenlerin sentezi (biyogenez) ve mitokondriyal otofaji (yani mitofaji) yoluyla hasarlı olanların seçici olarak uzaklaştırılması)8.
Çeşitli mitopaji yolaklarına PINK1 / Parkin gibi enzimler ve FUNDC1, FKBP8 ve BNIP / NIX 9,10 dahil olmak üzere reseptörler aracılık eder. Özellikle, mitokondriyal bileşenlerin seçici bozunması, otofagozom makinesinden bağımsız olarak (yani, mitokondriyal kaynaklı veziküller yoluyla) meydana gelebilir11. Bununla birlikte, farklı seçici mitopaji yolaklarının bitiş noktaları benzerdir (yani, lizozomal enzimler tarafından mitokondriyal bozunma)12,13. Bu nedenle, mitofajiyi tanımlamak ve ölçmek için çeşitli yöntemler, mitokondriyal ve lizozomal belirteçlerin 14,15,16,17 ve mitokondriyal proteinlerin / mitokondriyal DNA18 seviyelerinin azalmasına dayanır.
Aşağıda, ftolaysız mikroskopi kullanarak hayvan hücrelerinde mitopajiyi ölçmek için mevcut deneysel metodolojilerin kısa bir açıklaması bulunmaktadır ve mitopaji bitiş noktası fazını vurgulamaktadır.
Mitopaji biyosensörleri
Mitokondriyal bozunma, lizozom19'un asidik ortamında meydana gelir. Bu nedenle, proteinler de dahil olmak üzere mitokondriyal bileşenler, mitopaji işleminin son noktasında nötrden asidik bir pH'a geçiş yaşarlar. Bu model, mito-Rosella18 ve tandem mCherry-GFP-FIS114 dahil olmak üzere çeşitli mitopaji biyosensörlerinin etki mekanizmasını desteklemektedir. Bu sensörler pH'a duyarlı yeşil floresan proteini (GFP) ve pH'a duyarsız kırmızı floresan proteini (RFP) içerir. Bu nedenle, mitopajinin son noktasında, GFP floroforun söndürülmesi nedeniyle yeşil-kırmızı floresan oranı önemli ölçüde düşer. Bu sensörlerin başlıca sınırlamaları şunlardır: (1) floroforlar arasında olası Förster rezonans enerji transferi (FRET); (2) GFP ve RFP'nin diferansiyel olgunlaşma hızı; (3) GFP ve RFP arasında, onları birbirine bağlayan polipeptitin proteolitik bölünmesi nedeniyle ayrışma; (4) floresan-emisyon çakışması; ve (5) diferansiyel florofor parlaklığı ve söndürme15,16.
Bu sınırlamaların bazılarının üstesinden gelen bir sensör, Keima mitokondriyal sensör17'dir. mt-Keima sensörü (mercan proteini Keima'dan türetilmiştir) tek bir emisyon zirvesi (620 nm) gösterir. Bununla birlikte, uyarma zirveleri pH'a duyarlıdır. Sonuç olarak, yüksek bir pH'tan asidik bir pH 16,17'ye geçerken yeşil bir uyarmadan (440 nm) kırmızı olana (586 nm) bir geçiş vardır. Daha yeni bir mitopaji sensörü olan Mito-SRAI, sabit biyolojik örneklerde ölçümlere izin vererek alanı ilerletmiştir20. Bununla birlikte, genetik sensörlerin, onları belirli dokularda / hücrelerde ifade etme ve bunları farklı mitokondriyal bölmelere hedefleme yeteneği gibi birçok avantajına rağmen, sınırlamaları da vardır. Bir sınırlama, genetik sensörlerin hücrelerde veya hayvanlarda ifade edilmesi gerektiğidir, bu da zaman alıcı ve kaynak yoğun olabilir.
Ek olarak, sensörlerin mitokondri içindeki ekspresyonu, mitokondriyal fonksiyonu etkileyebilir. Örneğin, C. elegans solucanı vücut duvarı kaslarında mitokondriyal GFP'nin (mtGFP) eksprese edilmesi, mitokondriyal ağıgenişletir 21. Bu fenotip, mitokondride (UPRmt)21'de katlanmamış protein yanıtının aktivasyonunda önemli bir rol oynayan stresle aktive edilmiş transkripsiyon faktörü ATFS-1'in işlevine bağlıdır. Bu nedenle, genetik olarak kodlanmış mitokondri / mitopaji biyosensörleri, mitokondri homeostazını in vivo olarak izlemek için son derece yararlı olsa da, ölçmek için tasarlandıkları süreci etkileyebilirler.
Mitokondri/lizozom spesifik antikorlar ve boyalar
Mitokondriyal / lizozom kolokalizasyonunu test etmek için bir başka strateji, mitokondriyal dış membran proteini TOM20 ve lizozomal ilişkili membran proteini 1 (LAMP1) 22 gibi mitokondriyal / lizozomal proteinlere karşı antikorlar kullanmaktır. Çoğu durumda, bir florofora konjuge edilen ikincil antikorlar, floresan sinyalini mikroskopi yoluyla tespit etmek için kullanılır. Diğer bir strateji, genetik yapıları mitokondriyal/lizozomal boyalarla birleştirmektir, örneğin hücrelerde bir LAMP1::GFP füzyon yapısını eksprese ederken, kırmızı mitokondriyal boya (örneğin, Mitotracker Red) ile boyamaktır16. Bu metodolojiler, etkili olsa da, spesifik antikorlar gerektirir ve genellikle sabit örneklerle çalışmayı veya floresan olarak etiketlenmiş mitokondri / lizozomları ifade eden hücreler / transgenik hayvanlar üretmeyi içerir.
Burada, bundan böyle VL-85023 olarak anılacak olan sentetik diamin O,O (oktan-1,8-diil)bis'in (hidroksilamin) mitopaji aktive edici özelliklerini değerlendirmek için ticari bir lizozom / mitokondri / nükleer boyama kitinin kullanımını C . elegans solucanlarında ve insan kanser hücre hattı Hep-3B'de özetliyoruz (Şekil 1). Boyama kiti, özellikle bu organelleri boyayan lizozomal / mitokondriyal / nükleer hedefli boyaların bir karışımını içerir23. Bu kiti daha önce C. elegans23'te 1,8 diaminooktan (bundan böyle VL-004 olarak anılacaktır) mitopaji aktivitesini göstermek için kullandık. Daha da önemlisi, boyama kiti sonuçlarını mito-Rosella biyosensörü ve mitokondriyal: nükleer DNA içeriği23'ün qPCR ölçümleri ile doğruladık. Bu boyama kiti aşağıdaki avantajları sunar. İlk olarak, bir mitokondriyal biyosensörü ifade eden transgenik hayvanlar veya hücreler üretmeye gerek yoktur. Bu nedenle, değiştirilmemiş vahşi tip hayvanları veya hücreleri inceleyebilir ve böylece çok fazla zaman, para ve emek tasarrufu sağlayabiliriz. Ayrıca, belirtildiği gibi, mitokondriyal biyosensörlerin eksprese edilmesi mitokondriyal fonksiyonu değiştirebilir. İkincisi, kit uygun maliyetli, kullanımı kolay ve hızlıdır. Üçüncüsü, yöntemi C. elegans ve insan hücrelerinde göstermemize rağmen, diğer hücre tipleri ve organizmalar için değiştirilebilir.
Bununla birlikte, herhangi bir yöntem gibi, boyama kiti protokolünün de dezavantajları vardır. Örneğin, solucanların reaktif ile inkübasyonu, gıda yokluğunda gerçekleştirilir (ölü bakterilerin bile boyama verimliliğini önemli ölçüde azalttığını gördük). Kuluçka süresi nispeten kısa olmasına rağmen, bu zaman diliminde bile, mitopaji de dahil olmak üzere homeostatik tepkilerin değişmesi mümkündür. Ek olarak, boyaların ER / mitokondriyal / nükleer proteinlere ve diğer biyomoleküllere bağlanması bu organellerin aktivitelerini etkileyebilir. Dahası, genetik sensörlerle mitofaji ölçümünün aksine, kimyasal fiksasyona uğramış solucanlar ve hücrelerle çalışıyoruz. Bu nedenle, aynı solucanları / hücreleri farklı zamanlarda izlemeye devam etmek imkansızdır. Bu nedenle, belirli bir fizyolojik süreçte mitopajinin işlevini doğrulamak için farklı metodolojileri birleştirmenizi öneririz. Aşağıda, VL-850'nin C. elegans solucanlarında ve Hep-3B hücrelerinde sağlam mitofajiyi indüklediğini gösteren yeni veriler sunuyoruz. Bu nedenle, bu veriler VL-850'nin C. elegans'ın ömrünü uzattığı ve C. elegans'ı sağlıklı mitofajinin indüksiyonu yoluyla oksidatif hasardan koruduğu hipotezini daha da desteklemektedir. Proton iyonofor karbonil siyanür 4-(triflorometoksi) fenilhidrazon (FCCP), güçlü bir mitofaji indükleyicisi24 olan pozitif bir kontrol olarak kullandık.
Protokol
NOT: Okuyucuların rahatlığı için, protokolü iki bölüme ayırdık: biri C. elegans'ta mitofajiyi ölçmek için protokole odaklanırken, diğeri karaciğer hücrelerinde mitofajiyi ölçmek için protokole odaklanmaktadır. Malzemelerin listesi sağlanan Malzemeler Tablosunda bulunabilir.
1. C. elegans protokolü
- Nematod büyüme ortamı (NGM) plakalarının ve Escherichia coli OP50 bakteri stoğunun hazırlanması
NOT: Bir açıklama noktası olarak, NGM plakalarının ve OP50 bakteri stoğu25,26'nın hazırlanması için standart protokolleri takip ederken, bu protokollerde farklı laboratuvarlar arasında farklılıklar olabileceğinin farkındayız. Bu nedenle, deneyin doğru bir şekilde çoğaltılmasını sağlamak için tüm protokolleri dahil ettik.- pH 6'ya ulaşana kadar ~150 mL 1 M K 2 HPO 4 ila 500 mL 1 M KH2PO4 çözeltisi ekleyerek 1 M potasyum fosfat tamponu, pH 6 yapın. Tamponu 0,22 μm vakum filtresi/depolama sisteminden geçirerek sterilize edin.
- 0.1 M kalsiyum klorür (CaCl 2) ve magnezyum sülfat (MgSO4) yapın ve bunları0.2 μm şırınga filtresi ile sterilize edin.
- Mutlak etanol içinde 5 mg / mL kolesterol hazırlayın.
NOT: Kolesterol etanol içinde hazırlandığından, filtrelemeyin. - 1.5 g sodyum klorür (NaCl), 1.25 g pepton ve 8.5 g agar'ı 500 mL çift damıtılmış suda (DDW) çözerek NGM-agar'ı hazırlayın. Otoklavlayın ve ~ 55 ° C'ye soğumaya bırakın.
- Steril koşullar altında, 12.5 mL potasyum fosfat tamponu (pH 6), 0.5 mL 0.1 M CaCl2, 0.5 mL 0.1 M MgSO4 ve 1 mL 5 mg / mL kolesterol ekleyin. Her eklemeden sonra iyice karıştırın.
- Her 35 mm'lik plakaya erimiş NGM-agar'dan 4 mL ekleyin. Bulaşıkları oda sıcaklığında (RT, ~ 21 ° C) katılaşması için gece boyunca bırakın.
- Luria-Bertani (LB) agar plakaları yapmak için, 5 g NaCl, 5 g tripton, 2.5 g maya ekstraktı ve 7.5 g agar'ı 400 mL damıtılmış, deiyonize su (DDW) içinde çözün, çözeltinin pH'ını 7.0'a ayarlayın, hacmi DDW ile 500 mL'ye çıkarın ve otoklavlayın. Çözelti 55 ° C'ye soğutulduktan sonra, her 90 mm Petri kabına 25 mL karışım dökün ve plakaların oda sıcaklığında 2 gün kurumasını bekleyin. Daha sonra, gliserol stoğundan kurutulmuş LB plakaları üzerindeki OP50 bakterilerini çizin ve tek koloniler elde etmek için gece boyunca 37 ° C'de inkübe edin.
- 8 g tripton, 5 g maya ekstraktı ve 2.5 g sodyum klorürü (NaCl) 0.5 L DDW'de çözerek 2x maya tripton (YT) hazırlayın. PH'ı 7'ye ayarlayın ve otoklavlayın.
- Soğuduktan sonra, yeni çizgilenmiş LB plakasından bir OP50 bakteri kolonisini, 250 mL'lik bir Erlenmeyer şişesinde 50 mL 2x YT ortamına aşılayın. 37 °C ve 250 rpm'de yaklaşık 0,6 optik yoğunluğa (OD600) çalkalayın.
- Araç ve deney plakalarının hazırlanması
- Her 35 mm NGM-agar plakasının merkezine 100 μL OP50 bakterisi ekleyin. Gece boyunca RT'de kurutun (oda sıcaklığı, 21 °C).
- DMSO'da 0,5 M VL-850 hazırlayın ve M9 tamponu kullanarak 10 mM VL-850'ye seyreltin (22 mM KH 2 PO 4, 42 mM Na2HPO 4, 86 mM NaCl, pH 7ve 1 mM MgSO 4)26. PH'ın 7,0 olduğunu onaylayın (değilse, 0,1 M HCl ile titre edin) ve çözeltiyi 0,22 μm şırınga filtresiyle filtreleyin-sterilize edin. Aracı yukarıda açıklandığı gibi, ancak ilaç olmadan hazırlayın (bu durumda, VL-850). DMSO'da 50 mM FCCP yapın, M9 tamponu ile 1 mM FCCP'ye seyreltin ve çözeltiyi 0,22 μm şırınga filtresiyle filtreleyin-sterilize edin.
- Bakteri çimleri üzerinde ayrı ayrı tohumlanmış NGM plakalarına 25 μL araç (negatif kontrol), FCCP (pozitif kontrol; 5 μM) veya VL-850 (deneysel işlem; 62,5 μM) ekleyin.
- Plakaları alüminyum folyo ile örtün ve RT'de kurumaya bırakın (oda sıcaklığı, 21 °C). Plakaları ~ 16 saat sonra kullanın.
- Senkronize genç yetişkin C. elegans hermafroditlerinin elde edilmesi
- 22 mM KH 2 PO 4, 42 mM Na2HPO4 ve 86 mM NaCl ile 1 L M9 tampon yapın. Otoklavlayarak sterilize edin ve soğumaya bırakın. Soğutulduktan sonra, 1 mL 1 mM MgSO4 (0,22 μm filtre sterilize edilmiş) ekleyin.
- 4 mL'lik bir alkali hipoklorit çözeltisi (sodyum hidroksit için 0,5 N'lik nihai konsantrasyon ve sodyum hipoklorit için %1,25'lik nihai konsantrasyon) oluşturmak için 0,8 mL'lik 2,5 N sodyum hidroksit ve 1 mL% 5'lik bir sodyum hipoklorit çözeltisini 2,2 mL DDW ile karıştırın.
- Tüm annelerin tüpe toplandığından emin olmak için NGM plakalarını 1 mL M9 tampon 3x ile yıkayarak solucanları (gravid hermafroditler) 15 mL konik bir tüpe toplayın.
- Solucanları 1 dakika boyunca 500 × g'da santrifüjleme ile tortulayın ve süpernatantı 1 mL'lik bir hacim kalana kadar atın.
- 1 mL alkali hipoklorit çözeltisi ekleyin ve tüpü 5x ters çevirerek karıştırın. Yumurtaların salınmasına yardımcı olmak için tüpü 3 dakika boyunca hafifçe vorteksleyin ve disseke edici bir stereoskop altında solucanların durumunu gözlemleyin.
- Solucanların yaklaşık% 50'si kırıldığında, 5 mL M9 tamponu ekleyin ve 500 × g'da 1 dakika boyunca santrifüj yaparak yumurtaları hemen çökeltin.
- Peletleri rahatsız etmeden süpernatantı dikkatlice çıkarın. 5 mL M9 tampon ekleyin ve yıkama prosedürünü 2 kez tekrarlayın.
- Süpernatantı 2 mL kalana kadar çıkarın ve senkronize L1 larvaları elde etmek için tüpü ~ 16 saat (RT, 21 ° C) boyunca 20 rpm'de döndürün (360 ° rotasyon). Bu tüpten, bir cam slayt üzerine 5 μL'lik bir damla alın, bir stereoskop altında larva sayısını sayın, bu adımı 3x tekrarlayın, üç sayının ortalamasını alın ve mikrolitre başına solucan sayısını tahmin edin (μL). Bu hesaplamalara dayanarak, OP50 bakterileri ile tohumlanmış NGM plakası başına ~ 200 larva ekleyin.
- L1 larvalarını genç yetişkin aşamasına kadar ~ 48 saat boyunca 21 ° C'de büyütün.
- İlaç tedavisi ve mikroskopi prosedürü
- Deney veya kontrol plakalarının her birine 100 solucan koyun. Negatif, pozitif ve deneysel plakaların aracı, sırasıyla 5 μM FCCP ve 62,5 μM VL-850'yi içerdiğinden emin olun. 6 saat boyunca 21 ° C'de inkübe edin.
- Solucanları her plakadan 1,7 mL'lik bir mikrosantrifüj tüpüne yıkamak için 1 mL M9 tamponu kullanın. Tüpü bir mini santrifüjde kısaca (~ 3 s) döndürün. Ardından, solucan topağını rahatsız etmeden M9 tamponunu yavaşça pipetleyerek süpernatantı atın. Bu yıkama adımını 2x tekrarlayın ve ardından solucan topağını rahatsız etmeden süpernatantı yavaşça çıkarın.
- Solucan topağına %0,1 v/v Poloxamer 188, %0,1 v/v Pluronic F127 ve 2 μL boyama kiti reaktifi içeren 200 μL M9 tamponu ekleyin. Karışımın RT'de (oda sıcaklığı, 21 ° C) 1 saat boyunca 20 rpm'de (360 ° dönüş) dönmesine izin verin. Boyaları ışıktan korumak için, tüpleri alüminyum folyo ile örtün.
- Solucanları adım 1.3.4'te açıklandığı gibi yavaşça döndürün. Ardından, solucan topağını rahatsız etmeden boyama çözeltisini çıkarın. Daha sonra, solucanları adım 1.3.2'de açıklandığı gibi yıkayın ve uygun tedaviyi içeren tohumlu bir NGM-agar plakasına aktarın - örneğin, FCCP ile muamele edilmiş solucanlar FCCP içeren bir plakaya aktarılır. Plakaları alüminyum folyo ile örtün, çünkü boyama reaktifi ışığa duyarlıdır.
NOT: Aşırı boya nedeniyle arka plan gürültüsünü en aza indirmek için solucanları bakteri içeren kültür plakalarına ve ilgili arıtma maddesine aktardık. Örneğin, FCCP ile muamele edilen solucanlar, FCCP takviyeli plakalara vb. Aktarıldı. - Solucanları plakalardan 1 mL M9 tampon kullanarak taze mikrosantrifüj tüplerine yıkayın; Solucanları aynı şekilde 2x yıkayın. Daha sonra, solucanları 30 dakika boyunca buz üzerinde% 1 formaldehit ile sabitleyin ve artık formaldehiti gidermek için solucanları 1 mL M9 tampon 3x ile yıkayın. Yıkamalardan sonra, solucanları bir pelet haline getirin ve solucan peletini 10 μL M9'da bozulmadan tutarak maksimum miktarda süpernatan aspire edin.
- % 2.5 agaroz hazırlamak için, 10 mL'lik bir borosilikat cam test tüpüne 0.125 g agaroz ağırlığında, 5 mL M9 tamponu ekleyin ve tüpü bir Bunsen brülörü ile hafifçe ısıtarak agarozu çözün. Erimiş agarozu 75 ° C'de ayarlanmış kuru bir banyoya aktarın ve 1 mL'lik bir uç kullanarak, erimiş agarozun 100 μL'sini bir Deckgläser mikroskop kapak camına (24 mm x 60 mm) koyun. Hemen, agaroz damlasına dik olarak başka bir slayt koyun ve çapraz bir şekil oluşturun. ~ 2 dakika bekleyin ve üst kapak camını (nazikçe) iterek slaytları yavaşça ayırın, böylece agaroz pedini alt kapak slaytında bırakın.
NOT: Tüpteki agarozu ısıtırken dikkatli olun ve tüpün vücuttan uzak tutulduğundan emin olun. Agarozun pıhtılaşmasını en aza indirmek için 1 mL ucun kenarını kesin. - Solucanları bir Pasteur cam pipet ile agaroz pedine aktarın (yani, tüpteki tüm miktar, ~ 10 μL). Fazla sıvıyı laboratuarda mendilden yapılmış bir fitille çıkarın ve ardından solucanları daha küçük bir kapak sürgüsü (24 mm x 40 mm) ile örtün. Buharlaşmayı önlemek için küçük kapak sürgüsünün çevresine şeffaf oje sürün. Slaytı ışıktan korumak için karanlık bir kutuya koyun.
- 60x büyütme lensi kullanarak solucanları 24 saat içinde uygun dalga boylarında (aşağıya bakınız) görüntülemek için konfokal bir mikroskop kullanın.
- Slaytı mikroskop aşamasına yerleştirin.
- Görüntüleme yazılımını açın ve yazılımın gri alanına sağ tıklayın. Açık Satın Alma | Ti2 Tam Yüzey Takımı | ND Satın Alma | LUT'lar açılır penceredeki seçeneklere tıklayarak sağ tıklama sonucunda ortaya çıkar.
- Ti2 Full Pad altında 60x'i seçin.
- Edinme altında, Göz Merceği DIA'yı seçin ve mikroskop ince odaklı düğmeyi kullanarak solucanları odak noktasına getirin. Alma altında, Dönen disk'i seçin ve 16 bit - Bağlama yok seçeneğini belirleyin. Her floresan filtresi için Pozlama Süresi'ni 500 ms ve Brightfield için 20 ms olarak ayarlayın. Bu parametreler ayarlandıktan sonra Şimdi Çalıştır'ı seçin ve çıktı görüntüsünün ND2 dosyası olarak oluşturulmasını bekleyin.
NOT: Farklı görüntüleme kurulumları farklı özelliklere sahip olduğundan pozlama süresinin deneysel olarak belirlenmesi gerekir. Her dalga boyunun floresan yoğunluğunu incelemek için arama tablolarını (LUT) kullanın.
- Görüntü analizi
- Konfokal görüntüleri (burada, Nikon ND2 dosyaları) birlikte yerelleştirme eklentisiyle ImageJ27'de açın. Her ND dosyası üç dalga boyunda (DAPI, GFP/FITC [yeşil] ve Texas Red [kırmızı] filtreleri kullanılarak) ve görünür ışıkta çekilen görüntü düzlemlerini içerir. Bu görüntülere erişmek için, ND dosyasını ImageJ sunucusunda açın ve iletişim kutusunda Görüntüleri Böl'ü seçin. Parlak alan (BF), yeşil kanal ve kırmızı kanal görüntüleriyle çalışın.
- Resim | Shift + D klavye kısayolunu çoğaltın veya kullanın.
- Arka planı azaltmak için, yukarıda belirtildiği gibi görüntünün başka bir kopyasını oluşturun. Arka planı 100'lük bir Yuvarlanma Yarıçapı ile çıkarın ve verilen görüntünün arka planına sahip bir görüntü oluşturmak için Arka Plan Oluştur (çıkarmayın) seçeneğini belirleyin. Ardından, İşlem | Görüntü Hesaplayıcı'yı seçin ve çoğaltılan ilk görüntüyü ikinci çoğaltılan görüntüden çıkarın. Kolokalizasyon analizi için elde edilen görüntüleri kullanın.
- Birlikte yerelleştirme eklentisini kullanmak için yeşil kanal ve kırmızı kanal görüntülerini 8 bit'e dönüştürün. Bunu yapmak için, Resim | Türü | 8 bit.
- Eklentilere tıklayın | Eşlokalizasyon. Kolokalizasyon eklentisini kullanarak mitokondri ve lizozom sinyallerinin kolokalizasyonunu ölçmek için (yukarıya bakın), aşağıdaki parametreleri kullanın: Oran =% 75, Eşik kırmızı kanal = 80.0, Eşik yeşil kanal = 50.0. Çıktı, bir RGB görüntüsünde birlikte yerelleştirilmiş puncta ve üç 8 bit görüntünün (yeşil, kırmızı ve birlikte yerelleştirilmiş görüntü) birleşimini içeren 8 bitlik bir ikili görüntüdür.
- Solucanların kafa, vücut-duvar kasındaki punktaya odaklanarak bu alanı manuel olarak seçin ve Düzenle'ye tıklayarak bir maske oluşturun | Seçim | İlgilenilen bölgeyi seçen Maske oluşturun (Şekil 2A, B). Baş vücut duvarı kas bölgesini analiz etmek için diğer lekeli varlıkları (örneğin, faringeal kaslar) seçici olarak çıkarın.
- İlgilenilen bölgedeki (ROI) parçacıkları seçmek için, birlikte yerelleştirilmiş 8 bit'i seçin ve görüntü hesaplayıcısını kullanarak görüntüleri maskeleyin . Ardından, YG'deki puncta'yı seçmek için AND işlemini (Şekil 3A) kullanın. Bu, YG'de puncta içeren bir görüntü oluşturur (Şekil 3B).
- Kolokalize mitokondri ve lizozomların alanını analiz etmek için Analiz | Parçacıkları analiz edin ve punktanın toplamının 0.1625 μm 2 ile 4 μm2 arasındaki toplamını ölçün.
2. Hep-3B kanser hücresi protokolü
- İlaç stok çözeltisinin hazırlanması
- DMSO'da 100 mM VL-850 hazırlayın. 0,5 M HEPES tamponu, pH 7,3 ile 5 mM'ye kadar seyreltin ve 0,22 μm şırınga filtresi kullanarak çözeltiyi sterilize edin. Ardından, aracı daha önce açıklandığı gibi, ancak ilaç olmadan (bu durumda, VL-850) hazırlayın.
- Deney, ilaç tedavisi ve mikroskopi prosedürü için Hep-3B hücrelerinin kültürlenmesi
- %10 ısıyla inaktive edilmiş fetal sığır serumu (FBS), %2 L-glutamin ve %1 tetrasiklin (bundan böyle tam DMEM olarak anılacaktır) ile desteklenmiş Dulbecco'nun Modifiye Kartal Ortamını (DMEM) içeren 10 cm'lik doku kültürü plakalarında Hep-3B hücrelerini büyütün. Hücreleri 37 ° C'de ve% 5 CO2'de inkübe edin.
- % 70 -% 80 hücre akıcılığı (logaritmik büyüme fazı) gösteren bir Hep-3B hücresi plakası seçin, ortamı çıkarın ve plakayı 5 mL önceden ısıtılmış fosfat tamponlu salin (PBS) ile yıkayın. PBS'yi çıkarın ve hücreleri 37 ° C'de ~ 3 dakika boyunca 1 mL önceden ısıtılmış% 0.25 tripsin /% 0.02 EDTA ile inkübe edin; Hücreleri doku kültürü mikroskobu altında gözlemleyin (10x). Hücreler yuvarlandığında tripsin sindirimini durdurun ve 5 mL tam DMEM ekleyerek plakadan ayrılmaya başlayın. Hücreleri 5 dakika boyunca 1.000 × g'da santrifüjleyin, süpernatanı çıkarın ve hücreleri 5 mL tam DMEM'de yeniden askıya alın.
- Hücre konsantrasyonunu belirleyin. 50 μL hücre süspansiyonunu 50 μL tripan mavisi ile karıştırın. Otomatik bir hücre sayacı kullanarak veya bir hemositometre 5x kullanarak hücreleri sayın ve sayımların doğruluğunu sağlamak için bu sayımların ortalamasını alın.
- Her 8 kuyucuklu μ slaytta 42.000 Hep3G hücresini 400 μL tam DMEM içinde tohumlayın (yukarıda açıklandığı gibi). Hücreleri 37 ° C'de 24 saat ve% 5 CO2'de inkübe edin.
- ~% 80 -% 85 akıcılıkta 24 saat sonra, kuyucukların her birinden 250 μL ortamı çıkarın ve uygun işlem veya araçla 50 μL ortam ekleyin. Bu protokolü takip etmek için, hücrelere 100 μM VL-850, 5 μM FCCP ve bir kontrol aracı uygulayın.
- Bileşiklerle 6 saatlik inkübasyondan sonra, boyama reaktifini içeren her bir kuyucuğa 50 μL orta ekleyin (her bir kuyucukta 250 μL için 0.5 μL boya). Hücreleri boya ile 37 ° C'de 30 dakika ve% 5 CO2'de inkübe edin.
NOT: Boyama reaktifi ışığa duyarlı olduğundan, numuneleri alüminyum folyo ile kaplayarak ve loş ışıklı bir ortamda (mümkünse) çalışarak ışığa maruz kalmayı en aza indirin. - 200 μL'lik bir pipet kullanarak, her bir oyuktan tüm ortamı (250 μL) yavaşça çıkarın ve ardından hücreleri 200 μL önceden ısıtılmış PBS ile yıkayın.
- Hücreleri, PBS'de RT'de 15 dakika boyunca hazırlanan% 4 formaldehit ve% 2.5 glutaraldehit içeren 200 μL sabitleme çözeltisi ile sabitleyin.
- Fiksatif çözeltiyi boşaltın ve 200 μL PBS ile kısaca yıkayın.
- 200 μL PBS ekleyin, hücreleri 4 ° C'de kapalı ve ışıktan koruyun ve 24 saat içinde görüntü alın.
NOT: Dönen diskli konfokal mikroskobu, adım 1.4.8'de olduğu gibi DIC, TRITC, FITC ve DAPI dahil olmak üzere dört kanalda kullandık. Tedavi başına ~ 300 hücre görüntüledik.
- Görüntü analizi
- 1.5.1-1.5.5 adımlarını gerçekleştirin. Hücrelerin YG'sini elde etmek için, hücrelerin alanını vurgulayan bir görüntü oluşturun. Bunun için bir eş yerelleştirilmiş noktalar (RGB) görüntüsü seçin (Şekil 4A). Hücre alanının tamamını seçmek için İşlem | İkili | İkili görüntü elde etmek için Maske oluşturun (Şekil 4B). Hücrenin alanını analiz etmek için Analiz | Parçacıkları analiz edin ve görüntüdeki tüm parçacıkları Parçacıkları Analiz Et için varsayılan ayar olan 0'dan sonsuzluğa kadar ölçün.
- Kolokalize mitokondri ve lizozomların alanını analiz etmek için, kolokalize 8 bitlik bir görüntü seçin, İşlem Seç'i seçerek bunu ikiliye dönüştürün | İkili | İkili Yap, Analiz Et'i seçin | Parçacıkları analiz edin ve 0.1625 μm 2 ile 4 μm 2 arasındaki punkta toplamını ölçün. Kolokalize punktayı ölçmek için, kolokalize mitokondri ve lizozomların alanını toplam hücre alanına bölün.
Sonuçlar
VL-850 ile hem C. elegans solucanlarında hem de Hep-3B hücrelerinde sağlam bir mitopaji yanıtının indüklenmesi
VL-850, C. elegans solucanlarını ve insan keratinositlerini (HaCaT hücreleri) oksidatif stresten korur23. Etki mekanizmasını daha fazla araştırmak için, VL-850'nin C. elegans ve diğer insan hücrelerinde mitopajiye neden olup olmadığını inceledik. Bunu test etmek için, C. elegans solucanlarını (genç yetişkinler, L1'den 3 gün sonra) 6 saat boyunca 62.5 μM VL-850, 5 μM FCCP (pozitif kontrol) ve araca (negatif kontrol) maruz bıraktık. Yukarıda tarif edildiği gibi, boyama reaktifini kullanarak mitopajiyi ölçtük. VL-850 için 62.5 μM konsantrasyonunu kullanmayı seçtik, çünkü solucanları oksidatif stresten koruyor ve ömürlerini önemli ölçüde uzatıyor23. VL-850, solucanların baş vücut duvarı kaslarında sağlam mitopaji indükledi (Şekil 5), bunun güçlü bir mitopaji indükleyicisi olduğunu gösteriyor. VL850'nin mitopaji gücü FCCP'ninkine benzerdi (Şekil 5).
Dahası, Hep-3B hücreleri ile benzer bir deney yaptık; Bu hücre hattı, primer hepatosellüler karsinomu (HCC)28 olan 8 yaşında siyah bir erkekten kaynaklanmıştır. C. elegans deneyine benzer şekilde, hücreleri 6 saat boyunca 100 μM VL-850, 5 μM FCCP (pozitif kontrol) ve araca (negatif kontrol) maruz bıraktık ve mitofajiyi ölçmek için boyama reaktifini kullandık. VL-850 ve FCCP, Hep-3B hücrelerinde (benzer ölçüde) önemli bir mitopajiye (benzer ölçüde) neden oldu ve VL-850'nin hem C. elegans hem de insan hücrelerinde güçlü bir mitopaji indükleyicisi olduğu hipotezimizi daha da destekledi.
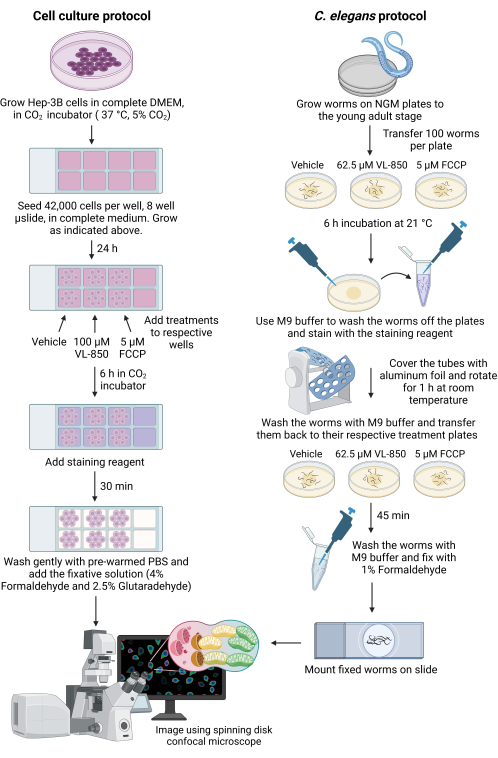
Resim 1: C. elegans ve Hep-3B hücrelerinde mitopaji ölçümü. Hem C. elegans solucanlarında hem de karaciğer kanseri hücrelerinde mitofajiyi ölçmek için boyama kitinin kullanımını gösteren şematik çizim. Kısaltmalar: VL-850 = O,O (oktan-1,8-diil)bis(hidroksilamin); FCCP = karbonil siyanür 4-(triflorometoksi)fenilhidrazon; PBS = fosfat tamponlu salin; NGM = nematod büyüme ortamı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: C. elegans'ta ilgilenilen baş vücut-duvar kası bölgesinin seçilmesi. (A) İlgilenilen bölge manuel olarak seçilir ve bir maske oluşturulur. (B) Ortaya çıkan maske görüntüsü, ilgilenilen ana bölgeyi gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
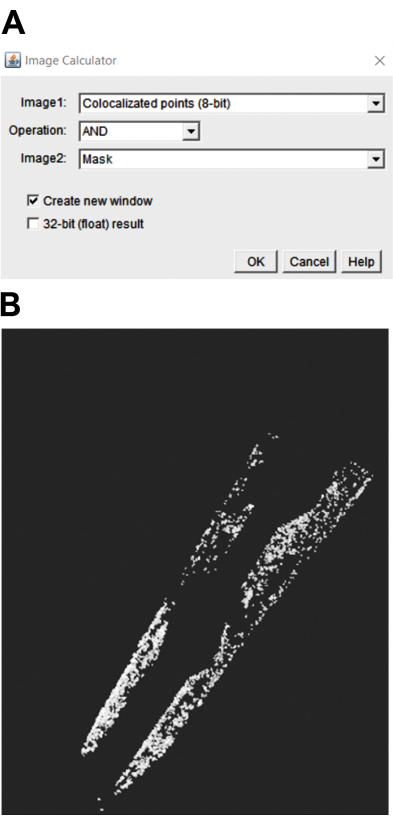
Şekil 3: C. elegans'ta ilgi duyulan bir bölgedeki kolokalize punktanın nicelleştirilmesi. (A) İlgili bölgedeki punktayı seçmek için, "VE" işlemi seçilmelidir. (B) Ortaya çıkan görüntü, ilgilenilen bölgedeki punktayı gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: İlgili bir bölgedeki hücreleri seçme . (A) Kolokalizasyon işlevinden sonra bir kolokalize noktalar (RGB) görüntüsü oluşturulur. (B) Punktanın çalışılacağı tüm hücre alanını temsil eden bir maske görüntüsü. Kısaltma: RGB = kırmızı, yeşil ve mavi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
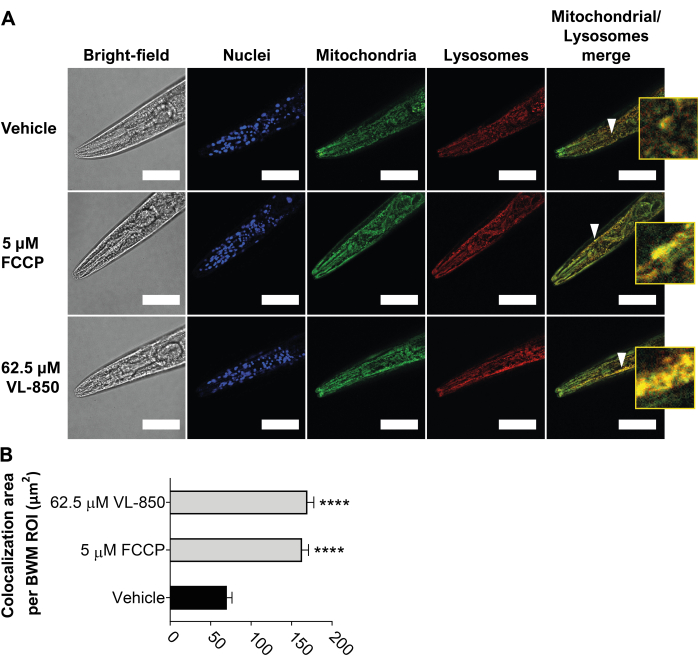
Şekil 5: C. elegans'ta VL-850 ile sağlam mitopajinin indüksiyonu. (A) Ok uçları, mitokondri ve lizozomların kolokalizasyonunu temsili kolokalizasyonun bir örneği olarak göstermektedir. Sekiz kat genişlemeye sahip olan iç kısım, daha iyi görselleştirme için sağlanmıştır. Ölçek çubukları = 100 μm. (B) Kolokalizasyon, üç biyolojik tekrar ve tedavi başına 30 solucan ile ölçüldü. Sonuçların önemi, araç kontrolleri ile karşılaştırılarak belirlendi ve yıldız işaretleri istatistiksel anlamlılığı gösteriyor. İstatistiksel analiz, eşlenmemiş tek yönlü ANOVA (Welch'in düzeltmesi ile Brown-Forsythe ve Welch ANOVA testleri) kullanılarak gerçekleştirildi ve 0.0001'den (****p < 0.0001) daha düşük bir p-değeri istatistiksel olarak anlamlı kabul edildi. Kısaltma: FCCP = karbonil siyanür 4-(triflorometoksi)fenilhidrazon. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 6: VL-850, Hep-3B hücrelerinde önemli mitopajiye neden olur. (A) Ok uçları, kolokalizasyonu temsil etmek için mitokondri ve lizozomların kolokalizasyonunu gösterir ve sekiz kat genişlemede kolokalizasyonu göstermek için bir iç kısım dahil edilir. Ölçek çubukları = 25 μm. (B) Kolokalizasyon, üç biyolojik tekrar ve tedavi başına N≥ 411 hücre ile ölçülmüştür (411, sonuçlarda istatistiksel anlamlılık ve güven sağlayan aralıkta yer almaktadır). Araç kontrollerine kıyasla istatistiksel olarak anlamlı farklılıklar değerlendirildi ve yıldız işaretleri anlamlılığı gösteriyor. Veriler eşlenmemiş tek yönlü ANOVA (Welch'in düzeltmesi ile Brown-Forsythe ve Welch ANOVA testleri) kullanılarak analiz edildi ve 0.0001'den küçük bir p değeri (****p < 0.0001) istatistiksel olarak anlamlı kabul edildi. Kısaltma: FCCP = karbonil siyanür 4-(triflorometoksi)fenilhidrazon. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Çoklu mitopaji yolları çeşitli proteinleri ve biyomolekülleri içerir (örneğin, kardiyolipin29). Bununla birlikte, bu yolakların bitiş noktası benzerdir - mitokondrinin lizozomal enzimler tarafından parçalanması12,13. Gerçekten de, birkaç yöntem mitofajiyi ölçmek için bu son noktayı kullanır. Bununla birlikte, elektron mikroskobu gibi bazı yöntemler, pahalı ekipmanlara, eğitimli uzmanlara ve numuneler ve analizler için daha uzun bir hazırlık süresine erişim gerektirir. Ayrıca, belirli dokularda/hücrelerde/hücre altı bölmelerde mitopajinin ölçülmesini içeren mitopaji biyosensörlerinin kullanılmasının avantajlarına rağmen, bu tür sensörlerin ekspresyonu hücre21'in fizyolojisini değiştirebilir. Bu nedenle, normal hücre fizyolojisine uzun süreli müdahaleye gerek kalmadan mitofajiyi ölçmek için güvenilir, uygun maliyetli ve hızlı bir yönteme ihtiyaç vardır.
Burada, mitokondri / lizozom / nükleer boya kokteylinin uygun fiyatlı bir ticari karışımının kullanılmasını içeren böyle bir yöntemi açıklıyoruz. Yakın zamanda C. elegans ve ölümsüzleştirilmiş insan keratinositlerinde (HaCaT hücreleri) mitofaji ölçümünde yararlılığını gösterdik23. Boyama kiti sonuçları, mito-Rosella ( C. elegans'ta) ve cox8-mCherry-EGFP (insan SH-SY5Y nöroblastoma hücrelerinde) dahil olmak üzere iki biyosensör ve mitokondriyal ve nükleer DNA içeriği ile birkaç mitopaji/otofaji geninin ekspresyonu arasındaki oranı ölçen qPCR deneyleri ile doğrulanmıştır23.
Bu çalışmada, C. elegans solucanlarında ve insan karaciğer adenokarsinomu Hep-3B hücrelerinde VL-850'nin mitopaji aktive edici gücünü keşfetmek için araştırmamızı genişlettik. Sonuçlar, VL-850'nin güçlü bir mitopaji indükleyicisi olduğunu göstermektedir (Şekil 5 ve Şekil 6). Bu sonuçlar, VL-850'nin C. elegans'ı oksidatif stresten koruduğu ve ömrünü uzattığı ve HaCat hücrelerinde mitofajiyi indüklediği önceki gözlemleri de desteklemektedir23.
Boyama kitinin kullanışlılığına rağmen, C. elegans çalışmaları ile ilgili bazı sınırlamaları vardır. İlk olarak, en azından incelenen koşullar altında, dendritlerin ve aksonların boyanmasını gözlemlemedik. Bu nedenle, mevcut protokol bu nöronal varlıklardaki mitopajiyi ölçmek için yararlı değildir. İkincisi, bağırsak otofloresansı, mitokondriyal boyanın yeşil floresan sinyaline müdahale edebilir. Bu nedenle, bağırsakta mitopaji ölçümleri için bu yöntemi uygularken dikkatli olunmalıdır. Son olarak, özellikle insan / kemirgen hücre hatları bağlamında, lizozom boyası çekirdek içindeki asidik varlıkları lekeleyebilir. Bu nedenle, her hücre hattı/ortam bileşimi için boyama reaktifi konsantrasyonunun/inkübasyon süresinin ampirik olarak titre edilmesi önerilir.
Ayrıca, yukarıda önerildiği gibi, mitofajiyi göstermek için tek bir yöntem yeterli değildir. Bu nedenle, boyama reaktifi sonuçlarının alternatif yöntemler (örneğin, mitopaji biyosensörleri, qPCR, immün boyama) kullanılarak doğrulanmasını öneririz ve her zaman pozitif bir mitopaji kontrolü (örneğin, FCCP) içerir. Sonuç olarak, boyama reaktifi boya kokteyli, C. elegans ve insan hücrelerinde mitopajiyi ölçmek için güvenilir ve uygun maliyetli bir yöntem sağlar. İnsan ve C. elegans hücreleri arasındaki önemli fark göz önüne alındığında, bu yöntemin diğer hayvan sistemlerine kolayca uyarlanabileceğini tahmin ediyoruz.
Açıklamalar
Yazarların beyan edecekleri çıkar çatışmaları yoktur.
Teşekkürler
Gross laboratuvarı üyelerine, makalenin eleştirel okuması ve yorum ve tavsiyeleri için teşekkür ederiz. Ulusal Sağlık Enstitüleri Araştırma Altyapısı Programları Ofisi (P40 OD010440) tarafından finanse edilen Caenorhabditis Genetik Merkezi'ne (CGC) bazı suşları sağladığı için teşekkür ederiz. Bu araştırma Vitalunga Ltd ve İsrail Bilim Vakfı'ndan (hibe No. 989/19) bir hibe ile desteklenmiştir. Grafiksel soyut şekil (Şekil 1) BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagent or resource | |||
| Analytical balance | Mettler-Toledo | ||
| Bacto Agar | BD-Difco | 214010 | |
| Bacto Peptone | BD-Difco | 211677 | |
| Bacto Tryptone | BD-Difco | 211705 | |
| Bacto Yeast extract | BD-Difco | 212750 | |
| Calcium chloride | Sigma | C1016 | |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone (FCCP) | Sigma | C2920 | |
| Chemicals | |||
| Cholestrol | Thermo Fisher | C/5360/48 | |
| DMEM high glucose | Biological Industries | 01-055-1A | |
| Double distilled water (DDW) | |||
| Dulbecco's Phosphate Buffered Saline (PBS) | Biological Industries | 02-023-1A | |
| FBS heat inactivated | Invitrogen | M7514 | |
| Gluteradehyde (25%) | Sigma | G5882 | |
| HEPES Buffer 1 M | Biological Industries | 03-025-1B | |
| L-gluatamine | Biological Industries | 03-020-1B | |
| Lysosome/Mitochondria/Nuclear Staining Cytopainter Reagent | Abcam | ab139487 | |
| Magnesium Sulfate | Sigma | M7506 | |
| Nonidet P 40 | Sigma | 74385 | |
| Paraformalydehyde (16%) | Electron Microscopy Sciences | 15720 | |
| Poloxamer 188 Solution | Sigma | P5556 | |
| Potassium dihydrogen phosphate | Millipore | 1.04873.1000 | |
| Potassium phosphate dibasic | Sigma | P3786 | |
| SeaKem LE Agarose | Lonza | 50004 | |
| Sodium Chloride | Bio-Lab | 1903059100 | |
| Sodium Hydroxide | Gadot | 1310732 | |
| Sodium phosphate dibasic dodecahydrate | Sigma | 4273 | |
| Tetracycline hydrochloride | Sigma | 87128-25G | |
| Trypsin-EDTA | Biological Industries | 03-052-1A | |
| VL-850: 1,8-diaminooxy-octane | Patented | ||
| Glass/Plastic Disposables | |||
| 0.22 μm syringe filter | Millex GV | SLGV033RS | |
| 1.7 mL Micro Centrifuge Tubes | Lifegene | LMCT1.7B-500 | |
| 10 cm Petri plates | Corning | 430167 | |
| 1,000 mL Erlenmeyer Flask | IsoLab, Germany | ||
| 15 mL Sterile Polypropylene tube | Lifegene | LTB15-500 | |
| 35 mm Petri dishes | Bar Naor | BN9015810 | |
| 500 mL vacuum filter/storage bottle system, 0.22 μm | Lifegene | LG-FPE205500S | |
| 50 mL Sterile Polypropylene tube | Lifegene | LTB50-500 | |
| Deckgläser Microscope cover glass 24 x 60 mm | Marienfeld | 101152 | |
| Glass test tubes (10 mL- 13 x 100 mm) Borosilicate glass | Pyrex | 99445-13 | |
| iBiDi 8 well μ-slides | iBiDi | 80826 | |
| Microscope cover glass 24 x 40 mm | Bar Naor | BN1052421ECALN | |
| Platinum iridium 0.25 mM wire | World Precision Instruments | PT1002 | |
| Instruments | |||
| Cell counter CellDrop BF | DeNovix | CellDrop BF-UNLTD | |
| Microspin FV-2400 | Biosan | BS-010201-AAA | |
| Nikon Yokogawa W1 Spinning Disk confocal microscope with DAPI, FITC, and TRITC filters and bright-field, with a 60x CFI Plan-Apochromat Lambda type lens (air lens) and NIS-Elements software | Nikon | CSU-W1 | |
| Olympus SZ61 stereo microscope | Olympus | SZ61 | |
| pH meter | Mettler-Toledo | MT30019032 | |
| Revolver Adjustable Lab Rotator | Labnet | H5600 |
Referanslar
- Westermann, B. Molecular machinery of mitochondrial fusion and fission. Journal of Biological Chemistry. 283 (20), 13501-13505 (2008).
- Piel, R. B., Dailey, H. A., Medlock, A. E. The mitochondrial heme metabolon: Insights into the complex(ity) of heme synthesis and distribution. Molecular Genetics and Metabolism. 128 (3), 198-203 (2019).
- Houten, S. M., Violante, S., Ventura, F. V., Wanders, R. J. A. The biochemistry and physiology of mitochondrial fatty acid β-oxidation and its genetic disorders. Annual Review of Physiology. 78, 23-44 (2016).
- Jung, S., et al. Mitofusin 2, a mitochondria-ER tethering protein, facilitates osteoclastogenesis by regulating the calcium-calcineurin-NFATc1 axis. Biochemical and Biophysical Research Communications. 516 (1), 202-208 (2019).
- Carraway, M. S., Suliman, H. B., Madden, M. C., Piantadosi, C. A., Ghio, A. J. Metabolic capacity regulates iron homeostasis in endothelial cells. Free Radical Biology and Medicine. 41 (11), 1662-1669 (2006).
- Armstrong, J. S. Mitochondrial medicine: Pharmacological targeting of mitochondria in disease. British Journal of Pharmacology. 151 (8), 1154-1165 (2007).
- Hamanaka, R. B., Chandel, N. S. Mitochondrial reactive oxygen species regulate cellular signaling and dictate biological outcomes. Trends in Biochemical Sciences. 35 (9), 505-513 (2010).
- Palikaras, K., Tavernarakis, N. Mitochondrial homeostasis: The interplay between mitophagy and mitochondrial biogenesis. Experimental Gerontology. 56, 182-188 (2014).
- Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death and Differentiation. 20, 31-42 (2013).
- Bhujabal, Z., et al. FKBP8 recruits LC3A to mediate Parkin-independent mitophagy. EMBO Reports. 18 (6), 947-961 (2017).
- Martinez-Vicente, M. Neuronal mitophagy in neurodegenerative diseases. Frontiers in Molecular Neuroscience. 10, 64(2017).
- Zimmermann, M., Reichert, A. S. How to get rid of mitochondria: Crosstalk and regulation of multiple mitophagy pathways. Biological Chemistry. 399 (1), 29-45 (2017).
- Almacellas, E., et al. Lysosomal degradation ensures accurate chromosomal segregation to prevent chromosomal instability. Autophagy. 17 (3), 796-813 (2021).
- Allen, G. F., Toth, R., James, J., Ganley, I. G. Loss of iron triggers PINK1/Parkin-independent mitophagy. EMBO Reports. 14 (12), 1127-1135 (2013).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chemistry & Biology. 18 (8), 1042-1052 (2011).
- Dolman, N. J., Chambers, K. M., Mandavilli, B., Batchelor, R. H., Janes, M. S. Tools and techniques to measure mitophagy using fluorescence microscopy. Autophagy. 9 (11), 1653-1662 (2013).
- Sun, N., et al. A fluorescence-based imaging method to measure in vitro and in vivo mitophagy using mt-Keima. Nature Protocols. 12, 1576-1587 (2017).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Coordination of mitophagy and mitochondrial biogenesis during ageing in C. elegans. Nature. 521 (7553), 525-528 (2015).
- Yim, W. W. -Y., Mizushima, N. Lysosome biology in autophagy. Cell Discovery. 6, 6(2020).
- Katayama, H., et al. Visualizing and modulating mitophagy for therapeutic studies of neurodegeneration. Cell. 181 (5), 1176-1187 (2020).
- Shpilka, T., et al. UPR(mt) scales mitochondrial network expansion with protein synthesis via mitochondrial import in Caenorhabditis elegans. Nature Communications. 12, 479(2021).
- Liao, Z., et al. The degradation of TMEM166 by autophagy promotes AMPK activation to protect SH-SY5Y cells exposed to MPP(). Cells. 11 (17), 2706(2022).
- Srivastava, V., et al. Distinct designer diamines promote mitophagy, and thereby enhance healthspan in C. elegans and protect human cells against oxidative damage. Autophagy. 19 (2), 474-504 (2022).
- Georgakopoulos, N. D., Wells, G., Campanella, M. The pharmacological regulation of cellular mitophagy. Nature Chemical Biology. 13 (2), 136-146 (2017).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: Synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Wood, W. B. The Nematode Caenorhabditis Elegans. , Cold Spring Harbor Laboratory Press. Long Island, NY. (1988).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Knowles, B. B., Howe, C. C., Aden, D. P. Human hepatocellular carcinoma cell lines secrete the major plasma proteins and hepatitis B surface antigen. Science. 209 (4455), 497-499 (1980).
- Antón, Z., et al. Human Atg8-cardiolipin interactions in mitophagy: Specific properties of LC3B, GABARAPL2 and GABARAP. Autophagy. 12 (12), 2386-2403 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır