Method Article
Обнаружение митофагии в клетках Caenorhabditis elegans и млекопитающих с использованием органеллоспецифических красителей
В этой статье
Резюме
Изучение митофагии с помощью электронной микроскопии, генетических датчиков и иммунофлуоресценции требует дорогостоящего оборудования, квалифицированного персонала и значительных затрат времени. Здесь мы демонстрируем эффективность коммерческого набора флуоресцентных красителей в количественной оценке процесса митофагии как у Caenorhabditis elegans, так и у клеточной линии рака печени.
Аннотация
Митохондрии необходимы для различных биологических функций, включая производство энергии, липидный обмен, гомеостаз кальция, биосинтез гема, регулируемую гибель клеток и образование активных форм кислорода (АФК). АФК жизненно важны для ключевых биологических процессов. Однако при отсутствии контроля они могут привести к окислительному повреждению, включая повреждение митохондрий. Поврежденные митохондрии высвобождают больше АФК, тем самым усиливая повреждение клеток и болезненное состояние. Гомеостатический процесс, называемый митохондриальной аутофагией (митофагией), избирательно удаляет поврежденные митохондрии, которые затем заменяются новыми. Существует несколько путей митофагии, общей конечной точкой которых является разрушение поврежденных митохондрий в лизосомах.
Несколько методологий, включая генетические датчики, иммунофлуоресценцию антител и электронную микроскопию, используют эту конечную точку для количественной оценки митофагии. Каждый метод исследования митофагии имеет свои преимущества, такие как специфическое нацеливание на ткани / клетки (с помощью генетических датчиков) и большая детализация (с помощью электронной микроскопии). Однако эти методы часто требуют дорогостоящих ресурсов, обученного персонала и длительного времени подготовки перед фактическим экспериментом, например, для создания трансгенных животных. Здесь мы представляем экономически эффективную альтернативу для измерения митофагии с использованием коммерчески доступных флуоресцентных красителей, нацеленных на митохондрии и лизосомы. Этот метод эффективно измеряет митофагию у нематоды Caenorhabditis elegans и клеток печени человека, что указывает на его потенциальную эффективность в других модельных системах.
Введение
Митохондрии необходимы для всех аэробных животных, включая человека. Они преобразуют химическую энергию биомолекул в аденозинтрифосфат (АТФ) посредством окислительного фосфорилирования1, синтезируют гем2, разлагают жирные кислоты β окисления3, регулируют гомеостаз кальция4 и железа5 , контролируют гибель клеток путем апоптоза6 и генерируют активные формы кислорода (АФК), которые играют жизненно важную роль в окислительно-восстановительном гомеостазе7. Два взаимодополняющих и противоположных процесса поддерживают целостность и правильное функционирование митохондрий: синтез новых митохондриальных компонентов (биогенез) и селективное удаление поврежденных посредством митохондриальной аутофагии (т.е. митофагии)8.
Несколько путей митофагии опосредованы ферментами, такими как PINK1 / Parkin, и рецепторами, включая FUNDC1, FKBP8 и BNIP / NIX 9,10. Примечательно, что селективная деградация митохондриальных компонентов может происходить независимо от аутофагосомного механизма (т.е. через везикулы митохондриального происхождения)11. Однако конечные точки различных селективных путей митофагии схожи (т.е. митохондриальная деградация лизосомальными ферментами)12,13. По этой причине различные методы идентификации и измерения митофагии основаны на колокализации митохондриальных и лизосомальных маркеров 14,15,16,17 и снижении уровней митохондриальных белков/митохондриальной ДНК 18.
Ниже приведено краткое описание существующих экспериментальных методологий измерения митофагии в клетках животных с использованием флуоресцентной микроскопии, подчеркивая конечную фазу митофагии.
Биосенсоры митофагии
Митохондриальная деградация происходит в кислой среде лизосомы19. Таким образом, митохондриальные компоненты, включая белки, испытывают сдвиг от нейтрального к кислому рН в конечной точке процесса митофагии. Эта закономерность лежит в основе механизма действия нескольких биосенсоров митофагии, включая мито-розеллу18 и тандем mCherry-GFP-FIS114. Эти датчики содержат pH-чувствительный зеленый флуоресцентный белок (GFP) и pH-нечувствительный красный флуоресцентный белок (RFP). Поэтому в конечной точке митофагии отношение флуоресценции зеленого к красному значительно падает из-за гашения флуорофора GFP. Основными ограничениями этих датчиков являются: (1) возможный резонансный перенос энергии Фёрстера (FRET) между флуорофорами; (2) дифференциальная скорость созревания GFP и RFP; (3) диссоциация между GFP и RFP из-за протеолитического расщепления полипептида, который их соединяет; (4) флуоресцентно-эмиссионное перекрытие; и (5) дифференциальная яркость флуорофора и гашение15,16.
Датчиком, который преодолевает некоторые из этих ограничений, является митохондриальный датчикKeima 17. Датчик mt-Keima (полученный из кораллового белка Keima) отображает один пик излучения (620 нм). Однако его пики возбуждения чувствительны к pH. В результате происходит переход от зеленого возбуждения (440 нм) к красному (586 нм) при переходе от высокого рН к кислому рН16,17. Более поздний датчик митофагии, Mito-SRAI, продвинулся вперед в этой области, позволив проводить измерения в фиксированных биологических образцах20. Однако, несмотря на многие преимущества генетических датчиков, такие как способность экспрессировать их в определенных тканях / клетках и нацеливать их на отдельные митохондриальные компартменты, они также имеют ограничения. Одним из ограничений является то, что генетические датчики должны экспрессироваться в клетках или животных, что может занять много времени и ресурсов.
Кроме того, экспрессия датчиков в самих митохондриях может влиять на функцию митохондрий. Например, экспрессия митохондриального GFP (mtGFP) в мышцах стенки тела червя C. elegans расширяет митохондриальную сеть21. Этот фенотип зависит от функции стресс-активируемого транскрипционного фактора ATFS-1, который играет существенную роль в активации развернутого белкового ответа в митохондриях (UPRmt)21. Поэтому, хотя генетически кодируемые биосенсоры митохондрий/митофагии чрезвычайно полезны для мониторинга гомеостаза митохондрий in vivo, они могут влиять на сам процесс, для измерения которого они предназначены.
Митохондрии/лизосомоспецифические антитела и красители
Другой стратегией тестирования колокализации митохондрий/лизосом является использование антител против митохондриальных/лизосомальных белков, таких как белок внешней мембраны митохондрий TOM20 и лизосомальный мембранный белок 1 (LAMP1)22. В большинстве случаев вторичные антитела, конъюгированные с флуорофором, используются для обнаружения сигнала флуоресценции с помощью микроскопии. Другая стратегия заключается в объединении генетических конструкций с митохондриальными/лизосомальными красителями, такими как экспрессия конструкции слияния LAMP1::GFP в клетках при окрашивании их красным митохондриальным красителем (например, Mitotracker Red)16. Эти методологии, хотя и эффективны, требуют специфических антител и часто включают работу с фиксированными образцами или генерацию клеток / трансгенных животных, экспрессирующих флуоресцентно меченные митохондрии / лизосомы.
Здесь мы описываем использование коммерческого набора для окрашивания лизосом / митохондрий / ядра для оценки митофагий-активирующих свойств синтетического диамина O, O (октан-1,8-диил) биса (гидроксиламина), далее именуемого VL-85023, у червей C. elegans и линии раковых клеток человека Hep-3B (рис. 1). Набор для окрашивания содержит смесь лизосомных/митохондриальных/ядерных красителей, которые специфически окрашивают эти органеллы23. Ранее мы использовали этот набор для демонстрации митофагической активности 1,8 диаминооктана (далее именуемого VL-004) у C. elegans23. Важно отметить, что мы проверили результаты набора для окрашивания с помощью биосенсора мито-розеллы и измерений кПЦР содержания митохондриальной: ядерной ДНК23. Этот набор для окрашивания обладает следующими преимуществами. Во-первых, нет необходимости генерировать трансгенных животных или клетки, экспрессирующие митохондриальный биосенсор. Таким образом, мы можем изучать немодифицированных животных или клетки дикого типа и, таким образом, сэкономить много времени, денег и труда. Более того, как уже упоминалось, экспрессия митохондриальных биосенсоров может изменить функцию митохондрий. Во-вторых, комплект экономичен, прост в использовании и быстр. В-третьих, хотя мы демонстрируем метод на клетках C. elegans и человека, он может быть модифицирован для других типов клеток и организмов.
С учетом сказанного, как и любой метод, протокол набора для окрашивания имеет недостатки. Например, инкубация червей с реагентом проводится в отсутствие пищи (мы видели, что даже мертвые бактерии значительно снижают эффективность окрашивания). Хотя инкубационное время относительно короткое, возможно, что даже в этот период гомеостатических реакций могут быть изменены, включая митофагию. Кроме того, связывание красителей с ER/митохондриальными/ядерными белками и другими биомолекулами может влиять на активность этих органелл. Более того, в отличие от измерения митофагии с помощью генетических датчиков, мы работаем с червями и клетками, прошедшими химическую фиксацию. Поэтому невозможно продолжать наблюдение за одними и теми же червями/клетками в разное время. Следовательно, мы рекомендуем комбинировать различные методологии для проверки функции митофагии в конкретном физиологическом процессе. Ниже мы представляем новые данные, демонстрирующие, что VL-850 индуцирует устойчивую митофагию у червей C. elegans и клеток Hep-3B. Таким образом, эти данные еще раз подтверждают гипотезу о том, что VL-850 продлевает продолжительность жизни C. elegans и защищает C. elegans от окислительного повреждения за счет индукции здоровой митофагии . В качестве положительного контроля мы использовали протонный ионофор карбонилцианид 4-(трифторметокси)фенилгидразон (FCCP), который является мощным индуктором митофагии24.
протокол
ПРИМЕЧАНИЕ: Для удобства читателей мы разделили протокол на две части: одна посвящена протоколу измерения митофагии у C. elegans, а другая - протоколу измерения митофагии в клетках печени. С перечнем материалов можно ознакомиться в Таблице предоставленных материалов .
1. Протокол C. elegans
- Подготовка пластин для среды для роста нематод (NGM) и бактериального сырья Escherichia coli OP50
ПРИМЕЧАНИЕ: В качестве пояснения, хотя мы следовали стандартным протоколам подготовки планшетов NGM и бактериального запаса OP5025,26, мы признаем, что в этих протоколах могут быть различия между различными лабораториями. Поэтому мы включили полные протоколы, чтобы обеспечить точное воспроизведение эксперимента.- Сделайте буфер из 1 М фосфата калия, pH 6, добавив ~ 150 мл 1 M K 2 HPO 4 до 500 мл раствора1 M KH2PO4 до достижения pH 6. Стерилизуйте буфер, пропустив его через вакуумный фильтр/систему хранения 0,22 мкм.
- Сделайте 0,1 М хлорида кальция (CaCl 2) и сульфата магния (MgSO4) и стерилизуйте их шприц-фильтром0,2 мкм.
- Приготовьте 5 мг/мл холестерина в абсолютном этаноле.
ПРИМЕЧАНИЕ: Поскольку холестерин готовится в этаноле, не фильтруйте его. - Приготовьте NGM-агар, растворив 1,5 г хлорида натрия (NaCl), 1,25 г пептона и 8,5 г агара в 500 мл двойной дистиллированной воды (DDW). Автоклав и дайте ему остыть до ~55 °C.
- В стерильных условиях добавляют 12,5 мл калий-фосфатного буфера (рН 6), 0,5 мл 0,1 М CaCl2, 0,5 мл 0,1 М MgSO4 и 1 мл 5 мг/мл холестерина. Хорошо перемешивайте после каждого добавления.
- Добавьте 4 мл расплавленного NGM-агара в каждую 35-миллиметровую пластину. Оставьте посуду на ночь для застывания при комнатной температуре (RT, ~ 21 °C).
- Для изготовления агаровых пластин Лурия-Бертани (LB) растворяют 5 г NaCl, 5 г триптона, 2,5 г дрожжевого экстракта и 7,5 г агара в 400 мл дистиллированной деионизированной воды (DDW), доводят рН раствора до 7,0, доводят объем до 500 мл с DDW и автоклавом. Как только раствор остынет до 55 °C, налейте 25 мл смеси в каждую чашку Петри диаметром 90 мм и дайте пластинам высохнуть в течение 2 дней при комнатной температуре. Затем удалите бактерии OP50 на высушенных пластинах LB из глицеринового сырья и инкубируйте при 37 ° C в течение ночи для получения единичных колоний.
- Приготовьте 2x дрожжевого триптона (YT), растворив 8 г триптона, 5 г дрожжевого экстракта и 2,5 г хлорида натрия (NaCl) в 0,5 л DDW. Отрегулируйте рН до 7 и автоклав.
- После охлаждения инокулируйте колонию бактерий OP50 из пластины LB со свежими прожилками в 50 мл среды 2x YT в колбе Эрленмейера объемом 250 мл. Встряхните при 37 °C и 250 об/мин до оптической плотности (OD600) приблизительно 0,6.
- Подготовка транспортного средства и экспериментальных пластин
- Добавьте 100 мкл бактерий OP50 в центр каждой 35-миллиметровой пластины NGM-агара. Сушить в течение ночи при температуре RT (комнатная температура, 21 °C).
- Приготовьте 0,5 М VL-850 в ДМСО и разбавьте до 10 мМ VL-850 с использованием буфера M9 (22 мМ KH 2 PO 4, 42 мМ Na2HPO 4, 86 мМ NaCl,pH 7 и 1 мМ MgSO 4)26. Убедитесь, что рН составляет 7,0 (если нет, титруйте 0,1 М HCl) и простерилизуйте раствор с помощью шприцевого фильтра 0,22 мкм. Готовят средство так, как описано выше, но без препарата (в данном случае ВЛ-850). Сделайте 50 мМ FCCP в ДМСО, разбавьте до 1 мМ FCCP буфером M9 и простерилизуйте раствор шприцевым фильтром 0,22 мкм.
- Добавьте 25 мкл носителя (отрицательный контроль), FCCP (положительный контроль; 5 мкМ) или VL-850 (экспериментальная обработка; 62,5 мкМ) к отдельно засеянным пластинам NGM на бактериальном газоне.
- Накройте тарелки алюминиевой фольгой и дайте им высохнуть при температуре 21 °C. Используйте пластины после ~16 ч.
- Получение синхронизированных молодых взрослых особей C. elegans hermaphrodites
- Сделайте 1 л буфера M9 с 22 мМ KH 2 PO 4, 42 мМ Na2HPO4 и 86 мМ NaCl. Стерилизуйте автоклавированием и дайте остыть. После охлаждения добавьте 1 мл 1 мМ MgSO4 (0,22 мкм, стерилизованного фильтром).
- Смешайте 0,8 мл 2,5 Н гидроксида натрия и 1 мл 5% раствора гипохлорита натрия с 2,2 мл DDW с образованием 4 мл щелочного раствора гипохлорита (конечная концентрация 0,5 Н для гидроксида натрия и 1,25% для гипохлорита натрия).
- Соберите червей (гравидных гермафродитов) в коническую пробирку объемом 15 мл, промыв пластины NGM 1 мл буфера M9 3 раза, чтобы убедиться, что все матери были собраны в пробирку.
- Осаждайте червей центрифугированием при 500 × г в течение 1 мин и выбросьте надосадочную жидкость до тех пор, пока не останется объем 1 мл.
- Добавьте 1 мл щелочного раствора гипохлорита и перемешайте, перевернув пробирку в 5 раз. Осторожно покрутите трубку в течение 3 минут, чтобы помочь выпустить яйца, и наблюдайте за состоянием червей под рассекающим стереоскопом.
- Когда примерно 50% червей будут сломаны, добавьте 5 мл буфера М9 и немедленно осаждайте яйца центрифугированием в течение 1 минуты при 500 × г.
- Удалите надосадочную жидкость осторожно, не нарушая гранулы. Добавьте 5 мл буфера M9 и повторите процедуру промывки 2 раза.
- Удалите надосадочную жидкость до тех пор, пока не останется 2 мл, и поверните пробирку (вращение на 360 °) при 20 об/мин в течение ~ 16 ч (RT, 21 °C) для получения синхронизированных личинок L1. Из этой пробирки возьмите каплю 5 мкл на предметное стекло, подсчитайте количество личинок под стереоскопом, повторите этот шаг 3 раза, возьмите среднее значение трех подсчетов и оцените количество червей на микролитр (мкл). Основываясь на этих расчетах, добавьте ~ 200 личинок на пластину NGM, засеянную бактериями OP50.
- Выращивайте личинок L1 при 21 ° C в течение ~ 48 часов до стадии молодой взрослой особи.
- Медикаментозное лечение и процедура микроскопии
- Положите по 100 червей на каждую из экспериментальных или контрольных пластин. Убедитесь, что отрицательная, положительная и экспериментальная пластины содержат носитель, 5 мкМ FCCP и 62.5 мкМ VL-850 соответственно. Инкубировать при 21 °C в течение 6 часов.
- Используйте 1 мл буфера M9, чтобы промыть червей из каждой пластины в микроцентрифужную пробирку объемом 1,7 мл. Ненадолго закрутите трубку (~3 с) в миницентрифуге. Затем выбросьте надосадочную жидкость, аккуратно пипетировав буфер M9, не нарушая гранулы червяка. Повторите этот шаг промывки 2 раза, а затем аккуратно удалите надосадочную жидкость, не нарушая гранулы червяка.
- Добавьте в гранулу червяка 200 мкл буфера M9, который содержит 0,1% об./об. полоксамера 188, 0,1% об./об. Pluronic F127 и 2 мкл реагента для окрашивания. Дайте смеси вращаться при 20 об/мин (вращение на 360°) в течение 1 ч при RT (комнатная температура 21 °C). Чтобы защитить красители от света, накройте тюбики алюминиевой фольгой.
- Аккуратно вращайте червей, как описано в шаге 1.3.4. Затем удалите окрашивающий раствор, не нарушая гранулы червяка. Затем промывают червей, как описано на шаге 1.3.2, и переносят их в засеянную пластину NGM-агара, содержащую соответствующую обработку - например, черви, обработанные FCCP, переносят в пластину, содержащую FCCP. Накройте пластины алюминиевой фольгой, потому что окрашивающий реагент чувствителен к свету.
ПРИМЕЧАНИЕ: Мы перенесли червей на культуральные пластины, содержащие бактерии и соответствующий обработочный агент, чтобы свести к минимуму фоновый шум из-за избытка красителя. Например, черви, обработанные FCCP, были перенесены на планшеты с добавлением FCCP и так далее. - Смойте червей с пластин в свежие микроцентрифужные пробирки, используя 1 мл буфера М9; Вымойте червей таким же образом 2 раза. Затем закрепите червей 1% формальдегидом на льду в течение 30 минут и промойте червей 1 мл буфера M9 3x, чтобы удалить остатки формальдегида. После промывки раскрутите червей до гранулы и аспирируйте максимальное количество надосадочной жидкости, сохраняя гранулу червя неповрежденной в 10 мкл M9.
- Чтобы приготовить 2,5% агарозы, взвесьте 0,125 г агарозы в пробирку из боросиликатного стекла объемом 10 мл, добавьте 5 мл буфера M9 и растворите агарозу, осторожно нагрев пробирку горелкой Бунзена. Перенесите расплавленную агарозу в сухую ванну, установленную при температуре 75 °C, и, используя наконечник объемом 1 мл, поместите 100 мкл расплавленной агарозы на покровное стекло микроскопа Deckgläser (24 мм x 60 мм). Сразу же положите еще одну горку перпендикулярно на каплю агарозы, образуя крестообразную форму. Подождите ~ 2 минуты и аккуратно отделите предметные стекла, (осторожно) нажав на верхнее стекло крышки, тем самым оставив агарозную подушку на нижней крышке.
ПРИМЕЧАНИЕ: Будьте осторожны при нагревании агарозы в трубке и убедитесь, что трубка держится подальше от тела. Обрежьте край кончика объемом 1 мл, чтобы свести к минимуму коагуляцию агарозы. - Перенесите червей на агарозную подушечку с помощью стеклянной пипетки Пастера (т.е. все количество в пробирке, ~ 10 мкл). Удалите излишки жидкости фитилем, сделанным из лабораторной салфетки, а затем накройте червей предметным стеклом меньшего размера (24 мм x 40 мм). Нанесите прозрачный лак для ногтей на периферию предметного стекла меньшего покрытия, чтобы предотвратить испарение. Поместите предметное стекло в темную коробку, чтобы защитить его от света.
- Используйте конфокальный микроскоп для визуализации червей в течение 24 часов на соответствующих длинах волн (см. Ниже) с использованием линзы с 60-кратным увеличением.
- Поместите предметное стекло на предметный столик микроскопа.
- Откройте программное обеспечение для обработки изображений и щелкните правой кнопкой мыши серую область программного обеспечения. Открытое приобретение | Ti2 Full Pad | Приобретение ND | LUT , щелкнув параметры во всплывающем окне, которое появляется в результате щелчка правой кнопкой мыши.
- В разделе Ti2 Full Pad выберите 60x.
- В разделе «Сбор» выберите «Окуляр DIA» и сфокусируйте червей с помощью ручки точной фокусировки микроскопа. В разделе "Приобретение" выберите "Вращающийся диск" и выберите параметр "16-разрядная версия - без биннинга". Для каждого флуоресцентного фильтра установите время экспозиции на 500 мс и 20 мс для яркого поля. После того, как эти параметры установлены, выберите «Запустить сейчас» и дождитесь создания выходного изображения в виде файла ND2.
ПРИМЕЧАНИЕ: Время экспозиции необходимо определить экспериментально, так как разные настройки визуализации имеют разные характеристики. Используйте таблицы поиска (LUT) для изучения интенсивности флуоресценции для каждой длины волны.
- Анализ изображений
- Откройте конфокальные изображения (в данном случае файлы Nikon ND2) в ImageJ27 с помощью плагина колокализации. Каждый файл ND содержит плоскости изображения, снятые на трех длинах волн (с использованием фильтров DAPI, GFP/FITC [зеленый] и Texas Red [красный]) и видимого света. Чтобы получить доступ к этим изображениям, откройте ND-файл на сервере ImageJ и выберите «Разделить изображения » в диалоговом окне. Работа с изображениями яркого поля (BF), зеленым и красным каналами.
- Создайте дубликаты этих изображений, чтобы сохранить исходное изображение нетронутым, нажав « Изображение» | Дублируйте или используйте сочетание клавиш Shift+D.
- Чтобы уменьшить фон, сгенерируйте еще один дубликат изображения, как упоминалось выше. Вычтите фон с радиусом прокрутки 100 и выберите параметр «Создать фон (не вычитать)», чтобы создать изображение с фоном данного изображения. Затем перейдите в раздел «Обработать» | Калькулятор изображений и вычтите первое дублированное изображение из второго дублированного изображения. Используйте полученные изображения для анализа колокализации.
- Чтобы использовать плагин колокализации, преобразуйте изображения зеленого и красного каналов в 8-битные. Для этого нажмите на Изображение | Тип | 8 бит.
- Нажмите на плагины | Колокализация. Для измерения колокализации сигналов митохондрий и лизосом с помощью плагина колокализации (см. выше) используйте следующие параметры: Ratio = 75%, Threshold red channel = 80.0, Threshold green channel = 50.0. На выходе получается 8-битное двоичное изображение, содержащее колокализованные точки и комбинацию трех 8-битных изображений (зеленого, красного и колокализованного изображения) в изображении RGB.
- Сфокусируйтесь на точке в мышце стенки головы червей, вручную выделив эту область и создав маску, нажав « Изменить» | Выбор | Создайте маску, которая выбирает интересующую область (рис. 2A, B). Выборочно удалите другие окрашенные объекты (например, мышцы глотки), чтобы проанализировать область мышц головы и стенки головы.
- Чтобы выбрать частицы в интересующей области (ROI), выберите колокализованные 8-битные и маскирующие изображения с помощью калькулятора изображений. Затем используйте операцию И (рис. 3A), чтобы выбрать пункту в ROI. При этом генерируется изображение с пунктами в ROI (рис. 3B).
- Чтобы проанализировать площадь колокализованных митохондрий и лизосом, выберите «Анализировать» | Проанализируйте частицы и измерьте сумму точек в диапазоне от 0,1625 мкм2 до 4мкм2.
2. Протокол раковых клеток Hep-3B
- Приготовление лекарственного раствора
- Подготовьте 100 мМ VL-850 в ДМСО. Разбавьте его до 5 мМ буфером HEPES 0,5 М, pH 7,3, и стерилизуйте раствор с помощью шприцевого фильтра 0,22 мкм. Затем приготовьте средство так, как описано ранее, но без препарата (в данном случае VL-850).
- Культивирование клеток Hep-3B для эксперимента, медикаментозного лечения и процедуры микроскопии
- Выращивайте клетки Hep-3B в 10-сантиметровых планшетах для культивирования тканей, содержащих модифицированную среду Dulbecco Eagle Medium (DMEM), дополненную 10% инактивированной теплом фетальной бычьей сыворотки (FBS), 2% L-глутамином и 1% тетрациклином (далее именуемым полным DMEM). Инкубируют клетки при 37 °C и 5%CO2.
- Выберите тарелку с клетками Hep-3B, демонстрирующими 70-80% слияния клеток (логарифмическая фаза роста), удалите среду и промойте тарелку 5 мл предварительно подогретого фосфатно-буферного физиологического раствора (PBS). Удалите PBS и инкубируйте клетки с 1 мл предварительно подогретого 0,25% трипсина / 0,02% ЭДТА в течение ~ 3 мин при 37 ° C; Наблюдайте за клетками под микроскопом тканевой культуры (10x). Остановите переваривание трипсина, когда клетки станут круглыми и начнут диссоциировать с пластиной, добавив 5 мл полного DMEM. Центрифугируют клетки при дозе 1000 × г в течение 5 мин, удаляют надосадочную жидкость и ресуспендируют клетки в 5 мл полного DMEM.
- Определите концентрацию клеток. Смешайте 50 мкл клеточной суспензии с 50 мкл трипанового синего. Подсчитайте клетки с помощью автоматического счетчика клеток или с помощью гемоцитометра 5x и возьмите среднее значение этих подсчетов, чтобы обеспечить точность подсчета.
- Засейте 42 000 клеток Hep3G в каждом 8-луночном μ-предметном стекле в 400 мкл полного DMEM (как описано выше). Инкубируют клетки в течение 24 ч при 37 °C и 5%CO2.
- Через 24 ч при ~80%-85% слиянии удалите 250 мкл среды из каждой из лунок и добавьте 50 мкл среды с соответствующей обработкой или носителем. Чтобы следовать этому протоколу, обработайте клетки 100 мкМ VL-850, 5 мкМ FCCP и носителем в качестве контроля.
- После 6-часовой инкубации с соединениями добавляют по 50 мкл среды в каждую лунку, содержащую окрашивающий реагент (0,5 мкл красителя на 250 мкл в каждую лунку). Инкубируют клетки с красителем в течение 30 мин при 37 °C и 5%CO2.
ПРИМЕЧАНИЕ: Поскольку окрашивающий реагент чувствителен к свету, сведите к минимуму воздействие света, накрыв образцы алюминиевой фольгой и работая в условиях тусклого света (если это возможно). - С помощью пипетки объемом 200 мкл аккуратно удалите всю среду (250 мкл) из каждой лунки, а затем промойте ячейки 200 мкл предварительно разогретого PBS.
- Зафиксируйте ячейки 200 мкл фиксирующего раствора, содержащего 4% формальдегида и 2,5% глутарового альдегида, приготовленного в PBS в течение 15 мин при RT.
- Сцедите фиксирующий раствор и ненадолго промойте 200 мкл PBS.
- Добавьте 200 мкл PBS, держите ячейки закрытыми и защищенными от света при 4 ° C и сделайте снимок в течение 24 часов.
ПРИМЕЧАНИЕ: Мы использовали конфокальный микроскоп с вращающимся диском в четырех каналах, включая DIC, TRITC, FITC и DAPI, как показано на шаге 1.4.8. Мы визуализировали ~ 300 клеток за процедуру.
- Анализ изображений
- Выполните шаги 1.5.1-1.5.5. Чтобы получить рентабельность инвестиций в ячейки, создайте изображение, которое выделяет область ячеек. Для этого выберите изображение с колокализованными точками (RGB) (рис. 4A). Чтобы выделить всю область ячейки, выберите «Обработать» | Двоичный | Создайте маску для получения двоичного изображения (рисунок 4B). Чтобы проанализировать площадь ячейки, выберите «Анализировать» | Анализ частиц и измерение всех частиц на изображении от 0 до бесконечности, что является настройкой по умолчанию для анализа частиц.
- Чтобы проанализировать площадь колокализованных митохондрий и лизосом, выберите колокализованное 8-битное изображение, преобразуйте его в двоичное , выбрав «Обработать» | Двоичный | Создайте двоичный файл, выберите «Анализировать» | Проанализируйте частицы и измерьте сумму точек в диапазоне от 0,1625 мкм 2 до 4мкм 2 . Чтобы измерить колокализованную пункту, разделите площадь колокализованных митохондрий и лизосом на общую площадь клеток.
Результаты
Индукция надежного ответа митофагии как у червей C. elegans, так и у клеток Hep-3B с VL-850
VL-850 защищает червей C. elegans и кератиноциты человека (клетки HaCaT) от окислительного стресса23. Для дальнейшего изучения механизма его действия мы изучили, индуцирует ли VL-850 митофагию в C. elegans и других клетках человека. Чтобы проверить это, мы подвергли червей C. elegans (молодые взрослые, через 3 дня после L1) воздействию 62,5 мкМ VL-850, 5 мкМ FCCP (положительный контроль) и носитель (отрицательный контроль) в течение 6 часов. Как описано выше, мы измерили митофагию с помощью окрашивающего реагента. Мы решили использовать концентрацию 62,5 мкМ для VL-850, потому что она защищает червей от окислительного стресса и значительно продлевает срок их жизни23. VL-850 индуцировал сильную митофагию в мышцах головы и стенки тела червей (рис. 5), что указывает на то, что он является мощным индуктором митофагии. Следует отметить, что эффективность митофагии VL850 была аналогична таковой FCCP (рис. 5).
Кроме того, мы провели аналогичный эксперимент с клетками Hep-3B; эта клеточная линия произошла от 8-летнего чернокожего мужчины с первичной гепатоцеллюлярной карциномой (ГЦК)28. Как и в эксперименте с C. elegans , мы подвергали клетки воздействию 100 мкМ VL-850, 5 мкМ FCCP (положительный контроль) и носителя (отрицательный контроль) в течение 6 часов и использовали окрашивающий реагент для количественного определения митофагии. VL-850 и FCCP индуцировали значительную митофагию (в одинаковой степени) в клетках Hep-3B (рис. 6), что еще раз подтверждает нашу гипотезу о том, что VL-850 является мощным индуктором митофагии как в клетках C. elegans, так и в клетках человека.
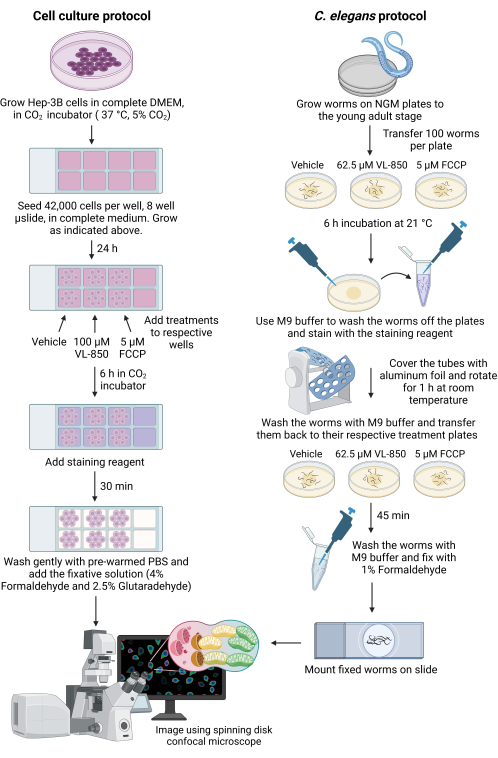
Рисунок 1: Измерение митофагии в клетках C. elegans и Hep-3B. Схематический рисунок, иллюстрирующий использование набора для окрашивания для измерения митофагии как у червей C. elegans, так и у клеток рака печени. Сокращения: VL-850 = O,O (октан-1,8-диил)бис (гидроксиламин); FCCP = карбонильный цианид 4- (трифторметокси) фенилгидразон; PBS = фосфатно-буферный физиологический раствор; NGM = среда для роста нематоды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Выбор интересующей области мышц головы и стенки головы у C. elegans. (A) Интересующая область выбирается вручную и создается маска. (B) Результирующее изображение маски отображает основную интересующую область. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
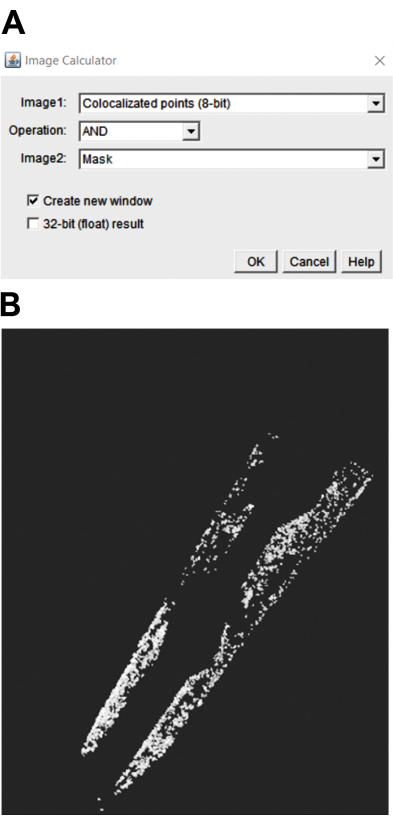
Рисунок 3: Количественная оценка колокализованной точки в области, представляющей интерес для C. elegans. (A) Чтобы выбрать пункту в интересующей области, необходимо выбрать операцию «И». (B) На результирующем изображении отображается точка в интересующей области. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Выделение ячеек в интересующей области . (A) Изображение колокализованных точек (RGB) генерируется после функции колокализации. (B) Изображение маски, представляющее всю область ячейки, в которой должны быть изучены пункты. Аббревиатура: RGB = красный, зеленый и синий. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
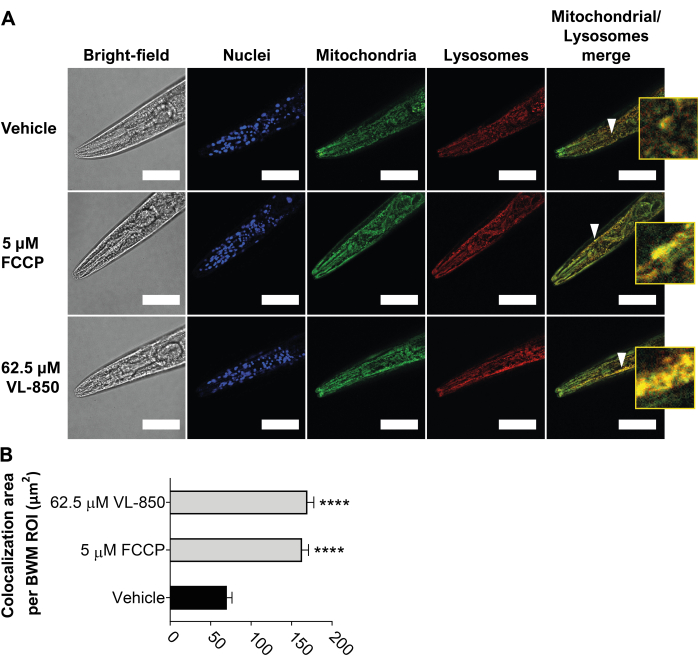
Рисунок 5: Индукция робастной митофагии у C. elegans с помощью VL-850. (A) Наконечники стрелок изображают колокализацию митохондрий и лизосом в качестве примера репрезентативной колокализации. Вставка, имеющая восьмикратное увеличение, предусмотрена для лучшей визуализации. Масштабные линейки = 100 мкм. (B) Колокализация была количественно определена с помощью трех биологических повторов и 30 червей на лечение. Значимость результатов определяли путем сравнения их с органами управления транспортным средством, а звездочки указывают на статистическую значимость. Статистический анализ проводился с использованием непарного одностороннего ANOVA (критерии ANOVA Брауна-Форсайта и Уэлча с поправкой Уэлча), и p-значение менее 0,0001 (****p < 0,0001) считалось статистически значимым. Аббревиатура: FCCP = карбонильцианид 4-(трифторметокси)фенилгидразон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: VL-850 индуцирует значительную митофагию в клетках Hep-3B . (A) Наконечники стрелок показывают колокализацию митохондрий и лизосом для представления колокализации, а вставка включена, чтобы продемонстрировать колокализацию при восьмикратном увеличении. Масштабные линейки = 25 мкм. (B) Колокализация была количественно определена с помощью трех биологических повторов и N ≥ 411 клеток на лечение (411 попадает в диапазон, который обеспечивает статистическую значимость и уверенность в результатах). Были оценены статистически значимые различия по сравнению с контрольными приборами транспортного средства, и звездочки указывают на значимость. Данные были проанализированы с использованием непарного одностороннего ANOVA (тесты Брауна-Форсайта и Уэлча ANOVA с поправкой Уэлча), и p-значение менее 0,0001 (****p < 0,0001) считалось статистически значимым. Аббревиатура: FCCP = карбонильцианид 4-(трифторметокси)фенилгидразон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Множественные пути митофагии включают различные белки и биомолекулы (например, кардиолипин29). Однако конечная точка этих путей аналогична — деградация митохондрий лизосомальными ферментами12,13. Действительно, несколько методов используют эту конечную точку для количественной оценки митофагии. Однако некоторые методы, такие как электронная микроскопия, требуют доступа к дорогостоящему оборудованию, обученным специалистам и длительному времени подготовки образцов и анализа. Кроме того, несмотря на преимущества использования биосенсоров митофагии, которые включают измерение митофагии в определенных тканях/клетках/субклеточных компартментах, экспрессия таких датчиков может изменить физиологию клетки21. Следовательно, существует потребность в надежном, экономичном и быстром методе количественной оценки митофагии без необходимости долгосрочного вмешательства в нормальную физиологию клеток.
Здесь мы описываем такой метод, который включает в себя использование доступной коммерческой смеси коктейля митохондрий/лизосом/ядерного красителя. Недавно мы продемонстрировали его полезность для измерения митофагии у C. elegans и иммортализированных кератиноцитов человека (клеток HaCaT)23. Результаты окрашивания были подтверждены с помощью двух биосенсоров, включая мито-розеллу (у C. elegans) и cox8-mCherry-EGFP (в клетках нейробластомы SH-SY5Y человека), а также экспериментов с кПЦР, которые количественно определяли соотношение между содержанием митохондриальной и ядерной ДНК и экспрессией нескольких генов митофагии / аутофагии23.
В этом исследовании мы расширили наши исследования, чтобы изучить активирующую митофагию активность VL-850 у червей C. elegans и клеток Hep-3B аденокарциномы печени человека. Результаты показывают, что VL-850 является мощным индуктором митофагии (рис. 5 и рис. 6). Эти результаты еще раз подтверждают предыдущие наблюдения о том, что VL-850 защищает C. elegans от окислительного стресса и продлевает их продолжительность жизни, а также индуцирует митофагию в клетках HaCat23.
Несмотря на полезность набора для окрашивания, он имеет некоторые ограничения в отношении исследований C. elegans. Во-первых, по крайней мере, в исследуемых условиях мы не наблюдали окрашивания дендритов и аксонов. Таким образом, текущий протокол не полезен для измерения митофагии в этих нейронных образованиях. Во-вторых, кишечная аутофлуоресценция может мешать зеленому сигналу флуоресценции митохондриального красителя. Поэтому следует соблюдать осторожность при применении этого метода для измерения митофагии в кишечнике. Наконец, и особенно в контексте клеточных линий человека / грызунов, лизосомный краситель может окрашивать кислотные образования в ядре. Поэтому рекомендуется эмпирически титровать концентрацию/время инкубации окрашивающего реагента для каждой клеточной линии/композиции среды.
Более того, как было сказано выше, ни один метод не является достаточным для демонстрации митофагии. Следовательно, мы рекомендуем проверять результаты окрашивания реагента с использованием альтернативных методов (например, биосенсоров митофагии, кПЦР, иммуноокрашивания) и всегда включать положительный контроль митофагии (например, FCCP). В заключение, коктейль красителя с окрашивающим реагентом обеспечивает надежный и экономичный метод количественной оценки митофагии в клетках C. elegans и человека. Учитывая значительную разницу между клетками человека и C. elegans , мы ожидаем, что этот метод может быть легко адаптирован к другим системам животных.
Раскрытие информации
У авторов нет конфликтов интересов, о которых можно было бы заявить.
Благодарности
Мы благодарим сотрудников лаборатории Гросса за критическое прочтение рукописи, а также за их комментарии и советы. Мы благодарим Центр генетики Caenorhabditis (CGC), который финансируется Управлением программ исследовательской инфраструктуры Национального института здравоохранения (P40 OD010440), за предоставление некоторых штаммов. Это исследование было поддержано грантом Vitalunga Ltd и Израильского научного фонда (грант No 989/19). Графический абстрактный рисунок (рис. 1) был сгенерирован с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagent or resource | |||
| Analytical balance | Mettler-Toledo | ||
| Bacto Agar | BD-Difco | 214010 | |
| Bacto Peptone | BD-Difco | 211677 | |
| Bacto Tryptone | BD-Difco | 211705 | |
| Bacto Yeast extract | BD-Difco | 212750 | |
| Calcium chloride | Sigma | C1016 | |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone (FCCP) | Sigma | C2920 | |
| Chemicals | |||
| Cholestrol | Thermo Fisher | C/5360/48 | |
| DMEM high glucose | Biological Industries | 01-055-1A | |
| Double distilled water (DDW) | |||
| Dulbecco's Phosphate Buffered Saline (PBS) | Biological Industries | 02-023-1A | |
| FBS heat inactivated | Invitrogen | M7514 | |
| Gluteradehyde (25%) | Sigma | G5882 | |
| HEPES Buffer 1 M | Biological Industries | 03-025-1B | |
| L-gluatamine | Biological Industries | 03-020-1B | |
| Lysosome/Mitochondria/Nuclear Staining Cytopainter Reagent | Abcam | ab139487 | |
| Magnesium Sulfate | Sigma | M7506 | |
| Nonidet P 40 | Sigma | 74385 | |
| Paraformalydehyde (16%) | Electron Microscopy Sciences | 15720 | |
| Poloxamer 188 Solution | Sigma | P5556 | |
| Potassium dihydrogen phosphate | Millipore | 1.04873.1000 | |
| Potassium phosphate dibasic | Sigma | P3786 | |
| SeaKem LE Agarose | Lonza | 50004 | |
| Sodium Chloride | Bio-Lab | 1903059100 | |
| Sodium Hydroxide | Gadot | 1310732 | |
| Sodium phosphate dibasic dodecahydrate | Sigma | 4273 | |
| Tetracycline hydrochloride | Sigma | 87128-25G | |
| Trypsin-EDTA | Biological Industries | 03-052-1A | |
| VL-850: 1,8-diaminooxy-octane | Patented | ||
| Glass/Plastic Disposables | |||
| 0.22 μm syringe filter | Millex GV | SLGV033RS | |
| 1.7 mL Micro Centrifuge Tubes | Lifegene | LMCT1.7B-500 | |
| 10 cm Petri plates | Corning | 430167 | |
| 1,000 mL Erlenmeyer Flask | IsoLab, Germany | ||
| 15 mL Sterile Polypropylene tube | Lifegene | LTB15-500 | |
| 35 mm Petri dishes | Bar Naor | BN9015810 | |
| 500 mL vacuum filter/storage bottle system, 0.22 μm | Lifegene | LG-FPE205500S | |
| 50 mL Sterile Polypropylene tube | Lifegene | LTB50-500 | |
| Deckgläser Microscope cover glass 24 x 60 mm | Marienfeld | 101152 | |
| Glass test tubes (10 mL- 13 x 100 mm) Borosilicate glass | Pyrex | 99445-13 | |
| iBiDi 8 well μ-slides | iBiDi | 80826 | |
| Microscope cover glass 24 x 40 mm | Bar Naor | BN1052421ECALN | |
| Platinum iridium 0.25 mM wire | World Precision Instruments | PT1002 | |
| Instruments | |||
| Cell counter CellDrop BF | DeNovix | CellDrop BF-UNLTD | |
| Microspin FV-2400 | Biosan | BS-010201-AAA | |
| Nikon Yokogawa W1 Spinning Disk confocal microscope with DAPI, FITC, and TRITC filters and bright-field, with a 60x CFI Plan-Apochromat Lambda type lens (air lens) and NIS-Elements software | Nikon | CSU-W1 | |
| Olympus SZ61 stereo microscope | Olympus | SZ61 | |
| pH meter | Mettler-Toledo | MT30019032 | |
| Revolver Adjustable Lab Rotator | Labnet | H5600 |
Ссылки
- Westermann, B. Molecular machinery of mitochondrial fusion and fission. Journal of Biological Chemistry. 283 (20), 13501-13505 (2008).
- Piel, R. B., Dailey, H. A., Medlock, A. E. The mitochondrial heme metabolon: Insights into the complex(ity) of heme synthesis and distribution. Molecular Genetics and Metabolism. 128 (3), 198-203 (2019).
- Houten, S. M., Violante, S., Ventura, F. V., Wanders, R. J. A. The biochemistry and physiology of mitochondrial fatty acid β-oxidation and its genetic disorders. Annual Review of Physiology. 78, 23-44 (2016).
- Jung, S., et al. Mitofusin 2, a mitochondria-ER tethering protein, facilitates osteoclastogenesis by regulating the calcium-calcineurin-NFATc1 axis. Biochemical and Biophysical Research Communications. 516 (1), 202-208 (2019).
- Carraway, M. S., Suliman, H. B., Madden, M. C., Piantadosi, C. A., Ghio, A. J. Metabolic capacity regulates iron homeostasis in endothelial cells. Free Radical Biology and Medicine. 41 (11), 1662-1669 (2006).
- Armstrong, J. S. Mitochondrial medicine: Pharmacological targeting of mitochondria in disease. British Journal of Pharmacology. 151 (8), 1154-1165 (2007).
- Hamanaka, R. B., Chandel, N. S. Mitochondrial reactive oxygen species regulate cellular signaling and dictate biological outcomes. Trends in Biochemical Sciences. 35 (9), 505-513 (2010).
- Palikaras, K., Tavernarakis, N. Mitochondrial homeostasis: The interplay between mitophagy and mitochondrial biogenesis. Experimental Gerontology. 56, 182-188 (2014).
- Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death and Differentiation. 20, 31-42 (2013).
- Bhujabal, Z., et al. FKBP8 recruits LC3A to mediate Parkin-independent mitophagy. EMBO Reports. 18 (6), 947-961 (2017).
- Martinez-Vicente, M. Neuronal mitophagy in neurodegenerative diseases. Frontiers in Molecular Neuroscience. 10, 64(2017).
- Zimmermann, M., Reichert, A. S. How to get rid of mitochondria: Crosstalk and regulation of multiple mitophagy pathways. Biological Chemistry. 399 (1), 29-45 (2017).
- Almacellas, E., et al. Lysosomal degradation ensures accurate chromosomal segregation to prevent chromosomal instability. Autophagy. 17 (3), 796-813 (2021).
- Allen, G. F., Toth, R., James, J., Ganley, I. G. Loss of iron triggers PINK1/Parkin-independent mitophagy. EMBO Reports. 14 (12), 1127-1135 (2013).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chemistry & Biology. 18 (8), 1042-1052 (2011).
- Dolman, N. J., Chambers, K. M., Mandavilli, B., Batchelor, R. H., Janes, M. S. Tools and techniques to measure mitophagy using fluorescence microscopy. Autophagy. 9 (11), 1653-1662 (2013).
- Sun, N., et al. A fluorescence-based imaging method to measure in vitro and in vivo mitophagy using mt-Keima. Nature Protocols. 12, 1576-1587 (2017).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Coordination of mitophagy and mitochondrial biogenesis during ageing in C. elegans. Nature. 521 (7553), 525-528 (2015).
- Yim, W. W. -Y., Mizushima, N. Lysosome biology in autophagy. Cell Discovery. 6, 6(2020).
- Katayama, H., et al. Visualizing and modulating mitophagy for therapeutic studies of neurodegeneration. Cell. 181 (5), 1176-1187 (2020).
- Shpilka, T., et al. UPR(mt) scales mitochondrial network expansion with protein synthesis via mitochondrial import in Caenorhabditis elegans. Nature Communications. 12, 479(2021).
- Liao, Z., et al. The degradation of TMEM166 by autophagy promotes AMPK activation to protect SH-SY5Y cells exposed to MPP(). Cells. 11 (17), 2706(2022).
- Srivastava, V., et al. Distinct designer diamines promote mitophagy, and thereby enhance healthspan in C. elegans and protect human cells against oxidative damage. Autophagy. 19 (2), 474-504 (2022).
- Georgakopoulos, N. D., Wells, G., Campanella, M. The pharmacological regulation of cellular mitophagy. Nature Chemical Biology. 13 (2), 136-146 (2017).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: Synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Wood, W. B. The Nematode Caenorhabditis Elegans. , Cold Spring Harbor Laboratory Press. Long Island, NY. (1988).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Knowles, B. B., Howe, C. C., Aden, D. P. Human hepatocellular carcinoma cell lines secrete the major plasma proteins and hepatitis B surface antigen. Science. 209 (4455), 497-499 (1980).
- Antón, Z., et al. Human Atg8-cardiolipin interactions in mitophagy: Specific properties of LC3B, GABARAPL2 and GABARAP. Autophagy. 12 (12), 2386-2403 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены