Method Article
Rilevazione della mitofagia in Caenorhabditis elegans e cellule di mammifero utilizzando coloranti organelli-specifici
In questo articolo
Riepilogo
Esplorare la mitofagia attraverso la microscopia elettronica, i sensori genetici e l'immunofluorescenza richiede attrezzature costose, personale qualificato e un investimento di tempo significativo. Qui, dimostriamo l'efficacia di un kit di coloranti a fluorescenza commerciale nel quantificare il processo mitofagico sia in Caenorhabditis elegans che in una linea cellulare di cancro al fegato.
Abstract
I mitocondri sono essenziali per varie funzioni biologiche, tra cui la produzione di energia, il metabolismo lipidico, l'omeostasi del calcio, la biosintesi dell'eme, la morte cellulare regolata e la generazione di specie reattive dell'ossigeno (ROS). I ROS sono vitali per i processi biologici chiave. Tuttavia, se incontrollati, possono portare a lesioni ossidative, incluso il danno mitocondriale. I mitocondri danneggiati rilasciano più ROS, intensificando così il danno cellulare e lo stato della malattia. Un processo omeostatico chiamato autofagia mitocondriale (mitofagia) rimuove selettivamente i mitocondri danneggiati, che vengono poi sostituiti da nuovi. Esistono molteplici percorsi mitofagici, con l'endpoint comune che è la rottura dei mitocondri danneggiati nei lisosomi.
Diverse metodologie, tra cui sensori genetici, immunofluorescenza anticorpale e microscopia elettronica, utilizzano questo endpoint per quantificare la mitofagia. Ogni metodo per esaminare la mitofagia ha i suoi vantaggi, come il targeting specifico di tessuti / cellule (con sensori genetici) e grande dettaglio (con microscopia elettronica). Tuttavia, questi metodi spesso richiedono risorse costose, personale addestrato e un lungo tempo di preparazione prima dell'esperimento vero e proprio, ad esempio per la creazione di animali transgenici. Qui, presentiamo un'alternativa economica per misurare la mitofagia utilizzando coloranti fluorescenti disponibili in commercio mirati ai mitocondri e ai lisosomi. Questo metodo misura efficacemente la mitofagia nel nematode Caenorhabditis elegans e nelle cellule epatiche umane, il che indica la sua potenziale efficienza in altri sistemi modello.
Introduzione
I mitocondri sono essenziali per tutti gli animali aerobici, compresi gli esseri umani. Convertono l'energia chimica delle biomolecole in adenosina trifosfato (ATP) tramite fosforilazione ossidativa1, sintetizzano l'eme2, degradano gli acidi grassi attraverso l'ossidazione β3, regolano l'omeostasi del calcio4 e del ferro5 , controllano la morte cellulare mediante apoptosi6 e generano specie reattive dell'ossigeno (ROS), che svolgono un ruolo vitale nell'omeostasi redox7. Due processi complementari e opposti mantengono l'integrità e il corretto funzionamento dei mitocondri: la sintesi di nuovi componenti mitocondriali (biogenesi) e la rimozione selettiva di quelli danneggiati attraverso l'autofagia mitocondriale (cioè la mitofagia)8.
Diverse vie mitofagiche sono mediate da enzimi, come PINK1 / Parkin, e recettori, tra cui FUNDC1, FKBP8 e BNIP / NIX 9,10. In particolare, la degradazione selettiva dei componenti mitocondriali può avvenire indipendentemente dal meccanismo autofagosomico (cioè attraverso vescicole derivate dai mitocondri)11. Tuttavia, gli endpoint delle diverse vie mitofagiche selettive sono simili (cioè degradazione mitocondriale da parte degli enzimi lisosomiali)12,13. Per questo motivo, vari metodi per identificare e misurare la mitofagia si basano sulla colocalizzazione dei marcatori mitocondriali e lisosomiali 14,15,16,17 e sulla diminuzione dei livelli di proteine mitocondriali/DNA mitocondriale 18.
Di seguito è riportata una breve descrizione delle metodologie sperimentali esistenti per misurare la mitofagia in cellule animali utilizzando la microscopia a fluorescenza, sottolineando la fase finale della mitofagia.
Biosensori mitofagici
La degradazione mitocondriale si verifica all'interno dell'ambiente acido del lisosoma19. Pertanto, i componenti mitocondriali, comprese le proteine, sperimentano un passaggio da un pH neutro a uno acido all'estremità del processo mitofagia. Questo modello è alla base del meccanismo d'azione di diversi biosensori mitofagici, tra cui mito-Rosella18 e tandem mCherry-GFP-FIS114. Questi sensori contengono una proteina di fluorescenza verde sensibile al pH (GFP) e una proteina di fluorescenza rossa (RFP) insensibile al pH. Pertanto, all'endpoint della mitofagia, il rapporto di fluorescenza verde-rosso diminuisce significativamente a causa dell'estinzione del fluoroforo GFP. I principali limiti di questi sensori sono (1) il possibile trasferimento di energia di risonanza di Förster (FRET) tra i fluorofori; (2) il tasso di maturazione differenziale di GFP e RFP; (3) dissociazione tra GFP e RFP dovuta alla scissione proteolitica del polipeptide che le collega; (4) sovrapposizione fluorescenza-emissione; e (5) luminosità differenziale del fluoroforo e tempra15,16.
Un sensore che supera alcune di queste limitazioni è il sensore mitocondriale Keima17. Il sensore mt-Keima (derivato dalla proteina corallina Keima) visualizza un singolo picco di emissione (620 nm). Tuttavia, i suoi picchi di eccitazione sono sensibili al pH. Di conseguenza, si passa da un'eccitazione verde (440 nm) a una rossa (586 nm) quando si passa da un pH elevato a un pH acido16,17. Un sensore di mitofagia più recente, Mito-SRAI, ha fatto progredire il campo consentendo misurazioni in campioni biologici fissi20. Tuttavia, nonostante i numerosi vantaggi dei sensori genetici, come la capacità di esprimerli in specifici tessuti / cellule e indirizzarli a compartimenti mitocondriali distinti, hanno anche dei limiti. Una limitazione è che i sensori genetici devono essere espressi nelle cellule o negli animali, il che può richiedere molto tempo e risorse.
Inoltre, l'espressione dei sensori all'interno dei mitocondri stessi può influenzare la funzione mitocondriale. Ad esempio, esprimere la GFP mitocondriale (mtGFP) nei muscoli della parete del corpo del verme C. elegans espande la rete mitocondriale21. Questo fenotipo dipende dalla funzione del fattore di trascrizione attivato dallo stress ATFS-1, che svolge un ruolo essenziale nell'attivazione della risposta proteica dispiegata nei mitocondri (UPRmt)21. Pertanto, sebbene i biosensori di mitocondri / mitofagia geneticamente codificati siano estremamente utili per monitorare l'omeostasi dei mitocondri in vivo, possono influenzare il processo stesso che sono progettati per misurare.
Mitocondri/anticorpi e coloranti specifici del lisosoma
Un'altra strategia per testare la colocalizzazione mitocondriale/lisosoma è quella di utilizzare anticorpi contro le proteine mitocondriali/lisosomiali, come la proteina della membrana esterna mitocondriale TOM20 e la proteina di membrana associata lisosomiale 1 (LAMP1)22. Nella maggior parte dei casi, gli anticorpi secondari coniugati a un fluoroforo vengono utilizzati per rilevare il segnale di fluorescenza tramite microscopia. Un'altra strategia è quella di combinare costrutti genetici con coloranti mitocondriali/lisosomiali, come esprimere un costrutto di fusione LAMP1::GFP nelle cellule mentre le colora con un colorante mitocondriale rosso (ad esempio, Mitotracker Red)16. Queste metodologie, sebbene efficaci, richiedono anticorpi specifici e spesso implicano il lavoro con campioni fissi o la generazione di cellule / animali transgenici che esprimono mitocondri / lisosomi marcati in modo fluorescente.
Qui, delineiamo l'utilizzo di un kit commerciale di colorazione lisosoma / mitocondri / nucleare per valutare le proprietà attivanti la mitofagia della diammina sintetica O,O (ottano-1,8-diil)bis (idrossilammina), di seguito denominata VL-85023, nei vermi C. elegans e nella linea cellulare tumorale umana Hep-3B (Figura 1). Il kit di colorazione contiene una miscela di coloranti lisosomiali/mitocondriali/a bersaglio nucleare che colorano specificamente questi organelli23. In precedenza abbiamo utilizzato questo kit per dimostrare l'attività mitofagica di 1,8 diaminoottano (di seguito denominato VL-004) in C. elegans23. È importante sottolineare che abbiamo convalidato i risultati del kit di colorazione con il biosensore mito-Rosella e le misurazioni qPCR del contenuto di DNA mitocondriale:nucleare23. Questo kit di colorazione offre i seguenti vantaggi. In primo luogo, non è necessario generare animali transgenici o cellule che esprimono un biosensore mitocondriale. Pertanto, possiamo studiare animali o cellule selvatiche non modificati e, quindi, risparmiare molto tempo, denaro e lavoro. Inoltre, come detto, l'espressione di biosensori mitocondriali può modificare la funzione mitocondriale. In secondo luogo, il kit è economico, facile da usare e veloce. In terzo luogo, sebbene dimostriamo il metodo in C. elegans e cellule umane, potrebbe essere modificato per altri tipi di cellule e organismi.
Detto questo, come ogni metodo, il protocollo del kit di colorazione presenta degli svantaggi. Ad esempio, l'incubazione dei vermi con il reagente viene effettuata in assenza di cibo (abbiamo visto che anche i batteri morti riducono significativamente l'efficienza di colorazione). Sebbene il tempo di incubazione sia relativamente breve, è possibile che anche in questo lasso di tempo, le risposte omeostatiche possano essere alterate, compresa la mitofagia. Inoltre, il legame dei coloranti alle proteine ER/mitocondriali/nucleari e ad altre biomolecole può influenzare le attività di questi organelli. Inoltre, a differenza della misurazione della mitofagia con sensori genetici, lavoriamo con vermi e cellule che hanno subito una fissazione chimica. Pertanto, è impossibile continuare a monitorare gli stessi worm / cellule in momenti diversi. Quindi, raccomandiamo di combinare diverse metodologie per convalidare la funzione della mitofagia in un particolare processo fisiologico. Di seguito, presentiamo nuovi dati che dimostrano che VL-850 induce una robusta mitofagia nei vermi C. elegans e nelle cellule Hep-3B. Pertanto, questi dati supportano ulteriormente l'ipotesi che VL-850 prolunghi la durata della vita di C. elegans e protegga C. elegans dal danno ossidativo attraverso l'induzione di una mitofagia sana . Abbiamo usato il protone ionoforo carbonil cianuro 4-(trifluorometossi)fenilidrazone (FCCP), che è un potente induttore della mitofagia24, come controllo positivo.
Protocollo
NOTA: Per comodità dei lettori, abbiamo diviso il protocollo in due parti: una si concentra sul protocollo per misurare la mitofagia in C. elegans e l'altra si concentra sul protocollo per misurare la mitofagia nelle cellule del fegato. L'elenco dei materiali può essere trovato nella tabella dei materiali fornita.
1. Il protocollo di C. elegans
- Preparazione delle piastre del terreno di crescita dei nematodi (NGM) e dello stock batterico di Escherichia coli OP50
NOTA: Come punto di chiarimento, mentre abbiamo seguito i protocolli standard per la preparazione delle piastre NGM e dello stock batterico OP5025,26, riconosciamo che potrebbero esserci variazioni in questi protocolli tra i diversi laboratori. Pertanto, abbiamo incluso i protocolli completi per garantire una replica accurata dell'esperimento.- Fare un tampone fosfato di potassio 1 M, pH 6, aggiungendo ~150 mL di 1 M K 2 HPO 4 a500 mL di soluzione 1 M KH2PO4 fino a raggiungere pH 6. Sterilizzare il tampone facendolo passare attraverso un sistema di filtraggio/stoccaggio sottovuoto da 0,22 μm.
- Produrre 0,1 M di cloruro di calcio (CaCl 2) e solfato di magnesio (MgSO4) e sterilizzarli con un filtro a siringa da0,2 μm.
- Preparare 5 mg / ml di colesterolo in etanolo assoluto.
NOTA: Poiché il colesterolo è preparato in etanolo, non filtrarlo. - Preparare NGM-agar sciogliendo 1,5 g di cloruro di sodio (NaCl), 1,25 g di peptone e 8,5 g di agar in 500 ml di acqua bidistillata (DDW). Autoclave e lasciare raffreddare a ~55 °C.
- In condizioni sterili, aggiungere 12,5 ml di tampone fosfato di potassio (pH 6), 0,5 ml di 0,1 M CaCl2, 0,5 ml di 0,1 M MgSO4 e 1 ml di 5 mg/ml di colesterolo. Mescolare bene dopo ogni aggiunta.
- Aggiungere 4 mL di NGM-agar fuso a ciascuna piastra da 35 mm. Lasciare i piatti per una notte a solidificare a temperatura ambiente (RT, ~21 °C).
- Per preparare le piastre di agar Luria-Bertani (LB), sciogliere 5 g di NaCl, 5 g di triptone, 2,5 g di estratto di lievito e 7,5 g di agar in 400 ml di acqua distillata deionizzata (DDW), regolare il pH della soluzione a 7,0, portare il volume fino a 500 ml con DDW e autoclave. Una volta raffreddata la soluzione a 55 °C, versare 25 ml della miscela in ciascuna capsula di Petri da 90 mm e lasciare asciugare le piastre per 2 giorni a temperatura ambiente. Quindi, striare i batteri OP50 sulle piastre LB essiccate dallo stock di glicerolo e incubare a 37 ° C durante la notte per ottenere singole colonie.
- Preparare 2x triptone di lievito (YT) sciogliendo 8 g di triptone, 5 g di estratto di lievito e 2,5 g di cloruro di sodio (NaCl) in 0,5 L di DDW. Regolare il pH a 7 e autoclave.
- Dopo il raffreddamento, inoculare una colonia di batteri OP50 dalla piastra LB appena striata in 50 ml di mezzo 2x YT in un matraccio di Erlenmeyer da 250 ml. Agitare a 37 °C e 250 giri/min fino a una densità ottica (OD600) di circa 0,6.
- Preparazione del veicolo e targhe sperimentali
- Aggiungere 100 μL di batteri OP50 al centro di ciascuna piastra NGM-agar da 35 mm. Asciugare per una notte a RT (temperatura ambiente, 21 °C).
- Preparare 0,5 M VL-850 in DMSO e diluire a 10 mM VL-850 utilizzando tampone M9 (22 mM KH 2 PO 4, 42 mM Na2HPO 4, 86 mM NaCl, pH 7 e 1mM MgSO 4)26. Confermare che il pH è 7,0 (in caso contrario, titolare con 0,1 M HCl) e filtrare la soluzione con un filtro a siringa da 0,22 μm. Preparare il veicolo come descritto sopra, ma senza il farmaco (in questo caso, VL-850). Produrre 50 mM FCCP in DMSO, diluire a 1 mM FCCP con tampone M9 e filtrare la soluzione con un filtro a siringa da 0,22 μm.
- Aggiungere 25 μL di veicolo (controllo negativo), FCCP (controllo positivo; 5 μM) o VL-850 (trattamento sperimentale; 62,5 μM) a piastre NGM seminate separatamente sul prato batterico.
- Coprire le piastre con un foglio di alluminio e lasciarle asciugare a RT (temperatura ambiente, 21 °C). Utilizzare le piastre dopo ~ 16 h.
- Ottenere giovani adulti sincronizzati C. elegans ermafroditi
- Produrre 1 L di tampone M9 con 22 mM KH 2 PO 4, 42 mM Na2HPO4 e 86 mM NaCl. Sterilizzare in autoclave e lasciare raffreddare. Una volta raffreddato, aggiungere 1 mL di 1 mM MgSO4 (0,22 μm filtrato sterilizzato).
- Mescolare 0,8 mL di idrossido di sodio 2,5 N e 1 mL di una soluzione al 5% di ipoclorito di sodio con 2,2 mL di DDW per ottenere una soluzione alcalina di ipoclorito da 4 mL (concentrazione finale di 0,5 N per idrossido di sodio e 1,25% per ipoclorito di sodio).
- Raccogliere i vermi (ermafroditi gravidi) in un tubo conico da 15 mL lavando le piastre NGM con 1 mL di tampone M9 3x per assicurarsi che tutte le madri siano state raccolte nel tubo.
- Sedimentare i vermi mediante centrifugazione a 500 × g per 1 minuto e scartare il surnatante fino a quando rimane un volume di 1 ml.
- Aggiungere 1 mL di soluzione alcalina di ipoclorito e mescolare capovolgendo il tubo 5x. Vortice delicatamente il tubo per 3 minuti per assistere il rilascio delle uova e osservare lo stato dei vermi sotto uno stereoscopio dissezionante.
- Quando circa il 50% dei vermi è rotto, aggiungere 5 ml di tampone M9 e sedimentare immediatamente le uova centrifugando per 1 minuto a 500 × g.
- Rimuovere con cura il surnatante senza disturbare il pellet. Aggiungere 5 ml di tampone M9 e ripetere la procedura di lavaggio 2x.
- Rimuovere il surnatante fino a quando rimangono 2 mL e ruotare il tubo (rotazione di 360°) a 20 giri / min per ~16 h (RT, 21 ° C) per ottenere larve L1 sincronizzate. Da questo tubo, prendi una goccia di 5 μL su un vetrino, conta il numero di larve sotto uno stereoscopio, ripeti questo passaggio 3x, fai una media dei tre conteggi e stima il numero di vermi per microlitro (μL). Sulla base di questi calcoli, aggiungere ~ 200 larve per piastra NGM seminata con batteri OP50.
- Coltivare le larve L1 a 21 °C per ~48 ore fino allo stadio di giovane adulto.
- Trattamento farmacologico e procedura di microscopia
- Metti 100 vermi su ciascuna delle piastre sperimentali o di controllo. Assicurarsi che le piastre negative, positive e sperimentali contengano rispettivamente il veicolo, 5 μM FCCP e 62,5 μM VL-850. Incubare a 21 °C per 6 ore.
- Utilizzare 1 mL di tampone M9 per lavare i vermi da ciascuna piastra in una provetta da microcentrifuga da 1,7 ml. Ruotare brevemente il tubo (~3 s) in una minicentrifuga. Quindi, scartare il surnatante pipettando delicatamente il tampone M9 senza disturbare il pellet di verme. Ripetere questo passaggio di lavaggio 2x, quindi rimuovere delicatamente il surnatante senza disturbare il pellet di verme.
- Aggiungere 200 μL di tampone M9, che contiene lo 0,1% v/v Poloxamer 188, 0,1% v/v Pluronic F127 e 2 μL del reagente del kit di colorazione, al pellet di verme. Lasciare ruotare la miscela a 20 giri/min (rotazione a 360°) per 1 h a RT (temperatura ambiente, 21 °C). Per proteggere i coloranti dalla luce, coprire i tubi con un foglio di alluminio.
- Ruotare delicatamente i vermi, come descritto al punto 1.3.4. Quindi, rimuovere la soluzione colorante senza disturbare il pellet di verme. Quindi, lavare i vermi come descritto al punto 1.3.2 e trasferirli in una piastra di agar-NGM seminata contenente il trattamento appropriato, ad esempio i vermi trattati con FCCP vengono trasferiti in una piastra contenente FCCP. Coprire le piastre con un foglio di alluminio perché il reagente colorante è sensibile alla luce.
NOTA: Abbiamo trasferito i vermi in piastre di coltura contenenti batteri e il corrispondente agente di trattamento per ridurre al minimo il rumore di fondo dovuto all'eccesso di colorante. Ad esempio, i vermi trattati con FCCP sono stati trasferiti in piastre integrate con FCCP e così via. - Lavare i vermi dalle piastre in provette di microcentrifuga fresca utilizzando 1 mL di tampone M9; Lavare i vermi allo stesso modo 2x. Quindi, fissare i vermi con l'1% di formaldeide sul ghiaccio per 30 minuti e lavare i vermi con 1 ml di tampone M9 3x per rimuovere la formaldeide residua. Dopo i lavaggi, ruotare i vermi fino a un pellet e aspirare la quantità massima di surnatante, mantenendo intatto il pellet di verme in 10 μL di M9.
- Per preparare il 2,5% di agarosio, pesare 0,125 g di agarosio in una provetta di vetro borosilicato da 10 ml, aggiungere 5 ml di tampone M9 e sciogliere l'agarosio riscaldando delicatamente il tubo con un bruciatore Bunsen. Trasferire l'agarosio fuso in un bagno asciutto a 75 °C e, utilizzando una punta da 1 ml, mettere 100 μL di agarosio fuso su un vetro di copertura del microscopio Deckgläser (24 mm x 60 mm). Immediatamente, metti un'altra diapositiva perpendicolarmente sulla goccia di agarosio, formando una forma a croce. Attendere ~ 2 minuti e separare delicatamente le diapositive spingendo (delicatamente) il vetro del coperchio superiore, lasciando così il tampone di agarosio sul vetrino del coperchio inferiore.
NOTA: Fare attenzione mentre si riscalda l'agarosio nel tubo e assicurarsi che il tubo sia tenuto lontano dal corpo. Tagliare il bordo della punta da 1 mL per ridurre al minimo la coagulazione dell'agarosio. - Trasferire i vermi sul tampone di agarosio con una pipetta di vetro Pasteur (cioè l'intera quantità nel tubo, ~10 μL). Rimuovere il liquido in eccesso con uno stoppino fatto di una salvietta da laboratorio, quindi coprire i vermi con un vetrino di copertura più piccolo (24 mm x 40 mm). Applicare uno smalto trasparente alla periferia del vetrino di copertura più piccolo per evitare l'evaporazione. Metti la diapositiva in una scatola scura per proteggerla dalla luce.
- Utilizzare un microscopio confocale per visualizzare i vermi entro 24 ore alle lunghezze d'onda appropriate (vedi sotto) utilizzando una lente con ingrandimento 60x.
- Posizionare il vetrino sul palco del microscopio.
- Aprire il software di imaging e fare clic con il pulsante destro del mouse sull'area grigia del software. Acquisizione aperta | Ti2 Full Pad Acquisizione ND | LUT cliccando sulle opzioni presenti sul pop-up che emerge come risultato del tasto destro.
- In Ti2 Full Pad, seleziona 60x.
- In Acquisizione, selezionare Oculare DIA e mettere a fuoco i vermi utilizzando la manopola di messa a fuoco fine del microscopio. In Acquisizione, selezionare Disco rotante e scegliere l'opzione 16 bit - Nessun binning . Per ciascun filtro a fluorescenza, impostare il Tempo di esposizione su 500 ms e 20 ms per Brightfield. Una volta impostati questi parametri, selezionare Esegui ora e attendere che l'immagine di output venga generata come file ND2.
NOTA: il tempo di esposizione deve essere determinato sperimentalmente, poiché diverse configurazioni di imaging hanno caratteristiche diverse. Utilizzare le tabelle di ricerca (LUT) per esaminare l'intensità della fluorescenza per ciascuna lunghezza d'onda.
- Analisi delle immagini
- Apri le immagini confocali (qui, i file Nikon ND2) in ImageJ27 con il plugin di colocalizzazione. Ogni file ND contiene piani di immagine ripresi a tre lunghezze d'onda (utilizzando filtri DAPI, GFP/FITC [verde] e Texas Red [rosso]) e luce visibile. Per accedere a queste immagini, aprire il file ND nel server ImageJ e selezionare Dividi immagini nella finestra di dialogo. Lavorare con immagini del canale luminoso (BF), del canale verde e del canale rosso.
- Genera duplicati di queste immagini per mantenere intatta l'immagine originale facendo clic su Immagine | Duplica o utilizza la scorciatoia da tastiera Maiusc + D.
- Per ridurre lo sfondo, genera un altro duplicato dell'immagine, come menzionato sopra. Sottrarre lo sfondo con un raggio di rotazione pari a 100 e selezionare l'opzione Crea sfondo (non sottrarre) per generare un'immagine con lo sfondo dell'immagine specificata. Quindi, vai a Processo | Image Calculator e sottrarre la prima immagine duplicata dalla seconda immagine duplicata. Utilizzare le immagini risultanti per l'analisi di colocalizzazione.
- Per utilizzare il plug-in di colocalizzazione, convertire le immagini del canale verde e del canale rosso in 8 bit. Per fare ciò, clicca su Immagine | Tipo | 8 bit.
- Clicca su Plugin | Colocalizzazione. Per misurare la colocalizzazione dei segnali mitocondriali e lisosomi utilizzando il plugin di colocalizzazione (vedi sopra), utilizzare i seguenti parametri: Rapporto = 75%, Soglia canale rosso = 80,0, Soglia canale verde = 50,0. L'output è un'immagine binaria a 8 bit contenente punteggiatura colocalizzata e una combinazione delle tre immagini a 8 bit (verde, rosso e immagine colocalizzata) in un'immagine RGB.
- Concentrati sul puncta nel muscolo testa-parete dei vermi selezionando manualmente quest'area e creando una maschera facendo clic su Modifica | Selezione | Crea maschera, che seleziona la regione di interesse (Figura 2A, B). Rimuovere selettivamente altre entità colorate (ad esempio, i muscoli faringei) per analizzare la regione muscolare della parete corporea della testa.
- Per selezionare le particelle nella regione di interesse (ROI), selezionare le immagini colocalizzate a 8 bit e mascherare utilizzando il calcolatore di immagini. Quindi, utilizzare l'operazione AND (Figura 3A) per selezionare il punto nel ROI. Questo genera un'immagine con punteggiatura nel ROI (Figura 3B).
- Per analizzare l'area dei mitocondri e dei lisosomi colocalizzati, selezionare Analizza | Analizza le particelle e misura la somma della puncta tra 0,1625 μm 2 e 4 μm2.
2. Il protocollo delle cellule tumorali Hep-3B
- Preparazione della soluzione stock di farmaci
- Preparare 100 mM VL-850 in DMSO. Diluirlo a 5 mM con tampone HEPES da 0,5 M, pH 7,3, e sterilizzare la soluzione utilizzando un filtro a siringa da 0,22 μm. Quindi, preparare il veicolo come descritto prima, ma senza il farmaco (in questo caso, VL-850).
- Coltura di cellule Hep-3B per l'esperimento, il trattamento farmacologico e la procedura di microscopia
- Coltivare cellule Hep-3B in piastre di coltura tissutale da 10 cm contenenti il Modified Eagle Medium (DMEM) di Dulbecco integrato con il 10% di siero fetale bovino (FBS) inattivato dal calore, il 2% di L-glutammina e l'1% di tetraciclina (di seguito denominata DMEM completo). Incubare le cellule a 37 °C e 5% di CO2.
- Scegli una piastra di cellule Hep-3B che mostri una confluenza cellulare del 70% -80% (fase di crescita logaritmica), rimuovi il mezzo e lavare la piastra con 5 ml di soluzione salina preriscaldata tamponata con fosfato (PBS). Rimuovere il PBS e incubare le cellule con 1 mL di tripsina preriscaldata allo 0,25% / EDTA allo 0,02% per ~ 3 minuti a 37 ° C; Osservare le cellule al microscopio per coltura tissutale (10x). Interrompere la digestione della tripsina quando le cellule diventano rotonde e iniziare a dissociarsi dalla piastra aggiungendo 5 ml di DMEM completo. Centrifugare le cellule a 1.000 × g per 5 minuti, rimuovere il surnatante e risospendere le cellule in 5 ml di DMEM completo.
- Determinare la concentrazione cellulare. Mescolare 50 μL della sospensione cellulare con 50 μL di blu tripano. Contare le cellule utilizzando un contatore automatico di cellule o utilizzando un emocitometro 5x e prendere una media di questi conteggi per garantire l'accuratezza dei conteggi.
- Seminare 42.000 cellule Hep3G in ogni 8 pozzetti μ-slide in 400 μL di DMEM completo (come descritto sopra). Incubare le cellule per 24 ore a 37 °C e 5% di CO2.
- Dopo 24 ore a ~80%-85% di confluenza, rimuovere 250 μL di mezzo da ciascuno dei pozzetti e aggiungere 50 μL di mezzo con il trattamento o il veicolo appropriato. Per seguire questo protocollo, trattare le cellule con 100 μM VL-850, 5 μM FCCP e un veicolo come controllo.
- Dopo le 6 ore di incubazione con i composti, aggiungere 50 μL di terreno a ciascun pozzetto contenente il reagente colorante (0,5 μL di colorante per 250 μL in ciascun pozzetto). Incubare le cellule con il colorante per 30 minuti a 37 °C e 5% CO2.
NOTA: Poiché il reagente colorante è sensibile alla luce, ridurre al minimo l'esposizione alla luce coprendo i campioni con un foglio di alluminio e lavorando in un ambiente in condizioni di scarsa illuminazione (se possibile). - Utilizzando una pipetta da 200 μL, rimuovere delicatamente tutto il mezzo (250 μL) da ciascun pozzetto, quindi lavare le celle con 200 μL di PBS preriscaldato.
- Fissare le cellule con 200 μL di soluzione di fissaggio contenente il 4% di formaldeide e il 2,5% di glutaraldeide preparata in PBS per 15 minuti a RT.
- Decantare la soluzione fissativa e lavare brevemente con 200 μL di PBS.
- Aggiungere 200 μL di PBS, mantenere le cellule coperte e protette dalla luce a 4 °C e visualizzare l'immagine entro 24 ore.
NOTA: Abbiamo usato il microscopio confocale a disco rotante in quattro canali, tra cui DIC, TRITC, FITC e DAPI, come nel passaggio 1.4.8. Abbiamo ripreso ~ 300 cellule per trattamento.
- Analisi delle immagini
- Eseguire i passaggi 1.5.1-1.5.5. Per ottenere il ROI delle celle, generare un'immagine che evidenzi l'area delle celle. A tale scopo, scegliere un'immagine di punti colocalizzati (RGB) (Figura 4A). Per selezionare l'intera area della cella, selezionare Elabora | Binario | Create maschera per ottenere un'immagine binaria (Figura 4B). Per analizzare l'area della cella, selezionare Analizza | Analizza particelle e misura tutte le particelle nell'immagine da 0 a infinito, che è l'impostazione predefinita per Analizza particelle.
- Per analizzare l'area dei mitocondri e dei lisosomi colocalizzati, selezionare un'immagine colocalizzata a 8 bit, convertirla in binario selezionando selezionare Processo | Binario | Crea binario, seleziona Analizza | Analizza le particelle e misura la somma di puncta tra 0,1625 μm 2 e 4 μm2. Per misurare la puncta colocalizzata, dividere l'area dei mitocondri colocalizzati e dei lisosomi per l'area totale della cellula.
Risultati
Induzione di una robusta risposta mitofagica sia nei vermi C. elegans che nelle cellule Hep-3B con VL-850
VL-850 protegge i vermi C. elegans e i cheratinociti umani (cellule HaCaT) dallo stress ossidativo23. Per esplorare ulteriormente il suo meccanismo d'azione, abbiamo esaminato se VL-850 induce mitofagia in C. elegans e altre cellule umane. Per testare questo, abbiamo esposto i vermi C. elegans (giovani adulti, 3 giorni dopo L1) a 62,5 μM VL-850, 5 μM FCCP (controllo positivo) e veicolo (controllo negativo) per 6 ore. Come descritto sopra, abbiamo misurato la mitofagia usando il reagente colorante. Abbiamo scelto di utilizzare la concentrazione di 62,5 μM per VL-850 perché protegge i vermi dallo stress ossidativo e allunga significativamente la loro durata23. VL-850 ha indotto una robusta mitofagia nei muscoli della parete corporea della testa dei vermi (Figura 5), indicando che si tratta di un potente induttore di mitofagia. Da notare che la potenza mitofagia di VL850 era simile a quella di FCCP (Figura 5).
Inoltre, abbiamo eseguito un esperimento simile con cellule Hep-3B; questa linea cellulare ha avuto origine da un maschio nero di 8 anni con carcinoma epatocellulare primario (HCC)28. Simile all'esperimento di C. elegans , abbiamo esposto le cellule a 100 μM VL-850, 5 μM FCCP (controllo positivo) e veicolo (controllo negativo) per 6 ore e abbiamo usato il reagente colorante per quantificare la mitofagia. VL-850 e FCCP hanno indotto mitofagia significativa (in misura simile) nelle cellule Hep-3B (Figura 6), supportando ulteriormente la nostra ipotesi che VL-850 sia un potente induttore della mitofagia sia in C. elegans che nelle cellule umane.
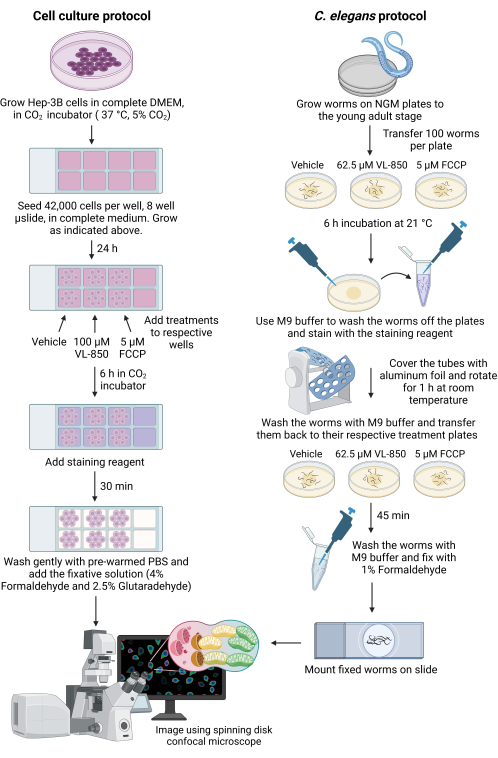
Figura 1: Misurazione della mitofagia nelle cellule di C. elegans e Hep-3B. Disegno schematico che illustra l'uso del kit di colorazione per misurare la mitofagia sia nei vermi di C. elegans che nelle cellule tumorali del fegato. Abbreviazioni: VL-850 = O,O (ottano-1,8-diil)bis(idrossilammina); FCCP = cianuro di carbonile 4-(trifluorometossi)fenilidrazone; PBS = soluzione salina tamponata fosfato; NGM = terreno di crescita dei nematodi. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Selezione della regione muscolare testa-parete corporea di interesse in C. elegans. (A) La regione di interesse viene selezionata manualmente e viene generata una maschera. (B) L'immagine della maschera risultante mostra la regione principale di interesse. Fare clic qui per visualizzare una versione ingrandita di questa figura.
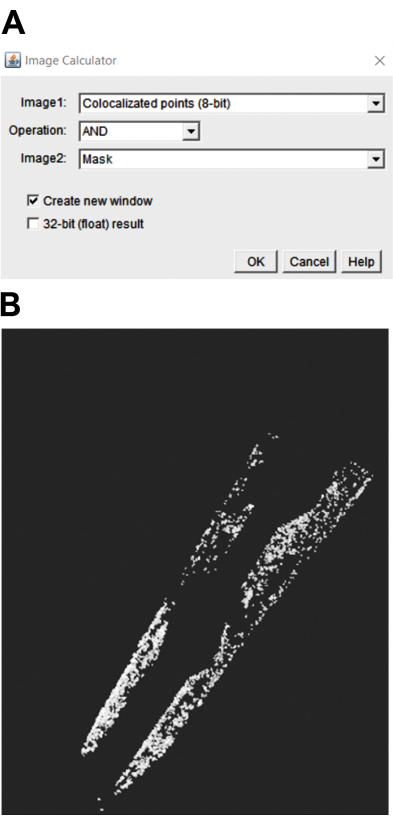
Figura 3: Quantificazione della puncta colocalizzata in una regione di interesse in C. elegans. (A) Per selezionare il punteggiato nella regione di interesse, è necessario selezionare l'operazione "E". (B) L'immagine risultante mostra il puncta nella regione di interesse. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Selezione delle celle in una regione di interesse . (A) Un'immagine di punti colocalizzati (RGB) viene generata dopo la funzione di colocalizzazione. (B) Un'immagine maschera che rappresenti l'intera area cellulare in cui devono essere studiati i puncta. Abbreviazione: RGB = rosso, verde e blu. Fare clic qui per visualizzare una versione ingrandita di questa figura.
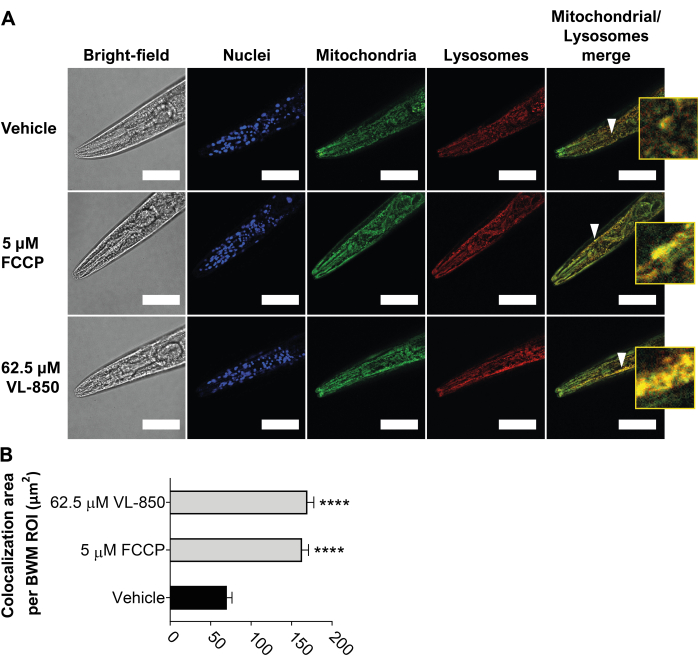
Figura 5: Induzione di mitofagia robusta in C. elegans da VL-850. (A) Le punte delle frecce raffigurano la colocalizzazione dei mitocondri e dei lisosomi come esempio di colocalizzazione rappresentativa. L'inserto, che ha un ingrandimento di otto volte, è fornito per una migliore visualizzazione. Barre di scala = 100 μm. (B) La colocalizzazione è stata quantificata con tre ripetizioni biologiche e 30 vermi per trattamento. La significatività dei risultati è stata determinata confrontandoli con i controlli del veicolo e gli asterischi indicano la significatività statistica. L'analisi statistica è stata effettuata utilizzando un ANOVA unidirezionale spaiato (test ANOVA di Brown-Forsythe e Welch con correzione di Welch) e un valore p inferiore a 0,0001 (****p < 0,0001) è stato considerato statisticamente significativo. Abbreviazione: FCCP = cianuro di carbonile 4-(trifluorometossi)fenilidrazone. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 6: VL-850 induce una significativa mitofagia nelle cellule Hep-3B. (A) Le punte delle frecce mostrano la colocalizzazione dei mitocondri e dei lisosomi per rappresentare la colocalizzazione, e un inserto è incluso per dimostrare la colocalizzazione con un ingrandimento di otto volte. Barre di scala = 25 μm. (B) La colocalizzazione è stata quantificata con tre ripetizioni biologiche e N ≥ 411 cellule per trattamento (411 rientrano nell'intervallo che consente la significatività statistica e la fiducia nei risultati). Sono state valutate differenze statisticamente significative rispetto ai controlli del veicolo e gli asterischi indicano la significatività. I dati sono stati analizzati utilizzando un ANOVA unidirezionale spaiato (test ANOVA di Brown-Forsythe e Welch con correzione di Welch) e un valore p inferiore a 0,0001 (****p < 0,0001) è stato considerato statisticamente significativo. Abbreviazione: FCCP = cianuro di carbonile 4-(trifluorometossi)fenilidrazone. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Molteplici vie mitofagiche coinvolgono varie proteine e biomolecole (ad esempio, cardiolipina29). Tuttavia, l'endpoint di queste vie è simile: la degradazione dei mitocondri da parte degli enzimi lisosomiali12,13. In effetti, diversi metodi utilizzano questo endpoint per quantificare la mitofagia. Tuttavia, alcuni metodi, come la microscopia elettronica, richiedono l'accesso ad attrezzature costose, esperti addestrati e un tempo di preparazione prolungato per i campioni e l'analisi. Inoltre, nonostante i vantaggi dell'uso di biosensori mitofagici, che includono la misurazione della mitofagia in specifici tessuti / cellule / compartimenti subcellulari, l'espressione di tali sensori può cambiare la fisiologia della cellula21. Pertanto, vi è la necessità di un metodo affidabile, economico e veloce per quantificare la mitofagia senza la necessità di interferenze a lungo termine con la normale fisiologia cellulare.
Qui, descriviamo un tale metodo, che prevede l'uso di una miscela commerciale economica di mitocondri / lisosoma / cocktail di coloranti nucleari. Abbiamo recentemente dimostrato la sua utilità nella misurazione della mitofagia in C. elegans e nei cheratinociti umani immortalizzati (cellule HaCaT)23. I risultati del kit di colorazione sono stati convalidati con due biosensori, tra cui mito-Rosella (in C. elegans) e cox8-mCherry-EGFP (in cellule umane di neuroblastoma SH-SY5Y), nonché esperimenti qPCR che hanno quantificato il rapporto tra il contenuto di DNA mitocondriale e nucleare e l'espressione di diversi geni mitofagici / autofagia23.
In questo studio, abbiamo ampliato la nostra ricerca per esplorare la potenza attivante della mitofagia di VL-850 nei vermi C. elegans e nelle cellule Hep-3B dell'adenocarcinoma epatico umano. I risultati mostrano che VL-850 è un potente induttore di mitofagia (Figura 5 e Figura 6). Questi risultati supportano ulteriormente le precedenti osservazioni secondo cui VL-850 protegge C. elegans dallo stress ossidativo e ne prolunga la durata della vita, oltre a indurre la mitofagia nelle cellule HaCat23.
Nonostante l'utilità del kit di colorazione, ha alcune limitazioni rispetto agli studi di C. elegans. In primo luogo, almeno nelle condizioni studiate, non abbiamo osservato la colorazione di dendriti e assoni. Pertanto, l'attuale protocollo non è utile per misurare la mitofagia in queste entità neuronali. In secondo luogo, l'autofluorescenza intestinale può interferire con il segnale di fluorescenza verde del colorante mitocondriale. Pertanto, è necessario prestare attenzione quando si applica questo metodo per le misurazioni della mitofagia nell'intestino. Infine, e specialmente nel contesto delle linee cellulari umane/roditori, il colorante lisosoma può macchiare entità acide all'interno del nucleo. Pertanto, si raccomanda di titolare empiricamente la concentrazione/tempo di incubazione del reagente colorante per ogni linea cellulare/composizione del mezzo.
Inoltre, come suggerito sopra, nessun singolo metodo è sufficiente per dimostrare la mitofagia. Pertanto, raccomandiamo la convalida dei risultati del reagente colorante utilizzando metodi alternativi (ad esempio, biosensori mitofagici, qPCR, immunocolorazione) e includiamo sempre un controllo mitofagia positivo (ad esempio, FCCP). In conclusione, il cocktail colorante di reagenti coloranti fornisce un metodo affidabile ed economico per quantificare la mitofagia in C. elegans e cellule umane. Data la differenza significativa tra le cellule umane e C. elegans , prevediamo che questo metodo potrebbe essere facilmente adattato ad altri sistemi animali.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Ringraziamo i membri del laboratorio Gross per la lettura critica del manoscritto e i loro commenti e consigli. Ringraziamo il Caenorhabditis Genetics Center (CGC), finanziato dal National Institutes of Health Office of Research Infrastructure Programs (P40 OD010440), per aver fornito alcuni dei ceppi. Questa ricerca è stata sostenuta da una sovvenzione di Vitalunga Ltd e della Israel Science Foundation (sovvenzione n. 989/19). La figura astratta grafica (Figura 1) è stata generata con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagent or resource | |||
| Analytical balance | Mettler-Toledo | ||
| Bacto Agar | BD-Difco | 214010 | |
| Bacto Peptone | BD-Difco | 211677 | |
| Bacto Tryptone | BD-Difco | 211705 | |
| Bacto Yeast extract | BD-Difco | 212750 | |
| Calcium chloride | Sigma | C1016 | |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone (FCCP) | Sigma | C2920 | |
| Chemicals | |||
| Cholestrol | Thermo Fisher | C/5360/48 | |
| DMEM high glucose | Biological Industries | 01-055-1A | |
| Double distilled water (DDW) | |||
| Dulbecco's Phosphate Buffered Saline (PBS) | Biological Industries | 02-023-1A | |
| FBS heat inactivated | Invitrogen | M7514 | |
| Gluteradehyde (25%) | Sigma | G5882 | |
| HEPES Buffer 1 M | Biological Industries | 03-025-1B | |
| L-gluatamine | Biological Industries | 03-020-1B | |
| Lysosome/Mitochondria/Nuclear Staining Cytopainter Reagent | Abcam | ab139487 | |
| Magnesium Sulfate | Sigma | M7506 | |
| Nonidet P 40 | Sigma | 74385 | |
| Paraformalydehyde (16%) | Electron Microscopy Sciences | 15720 | |
| Poloxamer 188 Solution | Sigma | P5556 | |
| Potassium dihydrogen phosphate | Millipore | 1.04873.1000 | |
| Potassium phosphate dibasic | Sigma | P3786 | |
| SeaKem LE Agarose | Lonza | 50004 | |
| Sodium Chloride | Bio-Lab | 1903059100 | |
| Sodium Hydroxide | Gadot | 1310732 | |
| Sodium phosphate dibasic dodecahydrate | Sigma | 4273 | |
| Tetracycline hydrochloride | Sigma | 87128-25G | |
| Trypsin-EDTA | Biological Industries | 03-052-1A | |
| VL-850: 1,8-diaminooxy-octane | Patented | ||
| Glass/Plastic Disposables | |||
| 0.22 μm syringe filter | Millex GV | SLGV033RS | |
| 1.7 mL Micro Centrifuge Tubes | Lifegene | LMCT1.7B-500 | |
| 10 cm Petri plates | Corning | 430167 | |
| 1,000 mL Erlenmeyer Flask | IsoLab, Germany | ||
| 15 mL Sterile Polypropylene tube | Lifegene | LTB15-500 | |
| 35 mm Petri dishes | Bar Naor | BN9015810 | |
| 500 mL vacuum filter/storage bottle system, 0.22 μm | Lifegene | LG-FPE205500S | |
| 50 mL Sterile Polypropylene tube | Lifegene | LTB50-500 | |
| Deckgläser Microscope cover glass 24 x 60 mm | Marienfeld | 101152 | |
| Glass test tubes (10 mL- 13 x 100 mm) Borosilicate glass | Pyrex | 99445-13 | |
| iBiDi 8 well μ-slides | iBiDi | 80826 | |
| Microscope cover glass 24 x 40 mm | Bar Naor | BN1052421ECALN | |
| Platinum iridium 0.25 mM wire | World Precision Instruments | PT1002 | |
| Instruments | |||
| Cell counter CellDrop BF | DeNovix | CellDrop BF-UNLTD | |
| Microspin FV-2400 | Biosan | BS-010201-AAA | |
| Nikon Yokogawa W1 Spinning Disk confocal microscope with DAPI, FITC, and TRITC filters and bright-field, with a 60x CFI Plan-Apochromat Lambda type lens (air lens) and NIS-Elements software | Nikon | CSU-W1 | |
| Olympus SZ61 stereo microscope | Olympus | SZ61 | |
| pH meter | Mettler-Toledo | MT30019032 | |
| Revolver Adjustable Lab Rotator | Labnet | H5600 |
Riferimenti
- Westermann, B. Molecular machinery of mitochondrial fusion and fission. Journal of Biological Chemistry. 283 (20), 13501-13505 (2008).
- Piel, R. B., Dailey, H. A., Medlock, A. E. The mitochondrial heme metabolon: Insights into the complex(ity) of heme synthesis and distribution. Molecular Genetics and Metabolism. 128 (3), 198-203 (2019).
- Houten, S. M., Violante, S., Ventura, F. V., Wanders, R. J. A. The biochemistry and physiology of mitochondrial fatty acid β-oxidation and its genetic disorders. Annual Review of Physiology. 78, 23-44 (2016).
- Jung, S., et al. Mitofusin 2, a mitochondria-ER tethering protein, facilitates osteoclastogenesis by regulating the calcium-calcineurin-NFATc1 axis. Biochemical and Biophysical Research Communications. 516 (1), 202-208 (2019).
- Carraway, M. S., Suliman, H. B., Madden, M. C., Piantadosi, C. A., Ghio, A. J. Metabolic capacity regulates iron homeostasis in endothelial cells. Free Radical Biology and Medicine. 41 (11), 1662-1669 (2006).
- Armstrong, J. S. Mitochondrial medicine: Pharmacological targeting of mitochondria in disease. British Journal of Pharmacology. 151 (8), 1154-1165 (2007).
- Hamanaka, R. B., Chandel, N. S. Mitochondrial reactive oxygen species regulate cellular signaling and dictate biological outcomes. Trends in Biochemical Sciences. 35 (9), 505-513 (2010).
- Palikaras, K., Tavernarakis, N. Mitochondrial homeostasis: The interplay between mitophagy and mitochondrial biogenesis. Experimental Gerontology. 56, 182-188 (2014).
- Ashrafi, G., Schwarz, T. L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death and Differentiation. 20, 31-42 (2013).
- Bhujabal, Z., et al. FKBP8 recruits LC3A to mediate Parkin-independent mitophagy. EMBO Reports. 18 (6), 947-961 (2017).
- Martinez-Vicente, M. Neuronal mitophagy in neurodegenerative diseases. Frontiers in Molecular Neuroscience. 10, 64(2017).
- Zimmermann, M., Reichert, A. S. How to get rid of mitochondria: Crosstalk and regulation of multiple mitophagy pathways. Biological Chemistry. 399 (1), 29-45 (2017).
- Almacellas, E., et al. Lysosomal degradation ensures accurate chromosomal segregation to prevent chromosomal instability. Autophagy. 17 (3), 796-813 (2021).
- Allen, G. F., Toth, R., James, J., Ganley, I. G. Loss of iron triggers PINK1/Parkin-independent mitophagy. EMBO Reports. 14 (12), 1127-1135 (2013).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chemistry & Biology. 18 (8), 1042-1052 (2011).
- Dolman, N. J., Chambers, K. M., Mandavilli, B., Batchelor, R. H., Janes, M. S. Tools and techniques to measure mitophagy using fluorescence microscopy. Autophagy. 9 (11), 1653-1662 (2013).
- Sun, N., et al. A fluorescence-based imaging method to measure in vitro and in vivo mitophagy using mt-Keima. Nature Protocols. 12, 1576-1587 (2017).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Coordination of mitophagy and mitochondrial biogenesis during ageing in C. elegans. Nature. 521 (7553), 525-528 (2015).
- Yim, W. W. -Y., Mizushima, N. Lysosome biology in autophagy. Cell Discovery. 6, 6(2020).
- Katayama, H., et al. Visualizing and modulating mitophagy for therapeutic studies of neurodegeneration. Cell. 181 (5), 1176-1187 (2020).
- Shpilka, T., et al. UPR(mt) scales mitochondrial network expansion with protein synthesis via mitochondrial import in Caenorhabditis elegans. Nature Communications. 12, 479(2021).
- Liao, Z., et al. The degradation of TMEM166 by autophagy promotes AMPK activation to protect SH-SY5Y cells exposed to MPP(). Cells. 11 (17), 2706(2022).
- Srivastava, V., et al. Distinct designer diamines promote mitophagy, and thereby enhance healthspan in C. elegans and protect human cells against oxidative damage. Autophagy. 19 (2), 474-504 (2022).
- Georgakopoulos, N. D., Wells, G., Campanella, M. The pharmacological regulation of cellular mitophagy. Nature Chemical Biology. 13 (2), 136-146 (2017).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: Synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Wood, W. B. The Nematode Caenorhabditis Elegans. , Cold Spring Harbor Laboratory Press. Long Island, NY. (1988).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Knowles, B. B., Howe, C. C., Aden, D. P. Human hepatocellular carcinoma cell lines secrete the major plasma proteins and hepatitis B surface antigen. Science. 209 (4455), 497-499 (1980).
- Antón, Z., et al. Human Atg8-cardiolipin interactions in mitophagy: Specific properties of LC3B, GABARAPL2 and GABARAP. Autophagy. 12 (12), 2386-2403 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon