Method Article
Arginin Metilomunun Nükleer Manyetik Rezonans Spektroskopisi ile Araştırılması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, serbest ve proteine bağlı arginin ve metil-argininlerin 1H-NMR spektroskopisi ile hazırlanmasını ve kantitatif ölçümünü açıklamaktadır.
Özet
Proteine bağlı arginin birçok proteinde yaygın olarak metillenir ve fizikokimyasal özellikleri, diğer proteinler veya nükleik asitler de dahil olmak üzere diğer moleküllerle etkileşimlerini değiştirerek işlevlerini düzenler. Bu çalışma, asimetrik ve simetrik dimetilarjinin (sırasıyla ADMA ve SDMA) ve monometil arginin (MMA) dahil olmak üzere arginin ve türevlerini ölçmek için kolayca uygulanabilir bir protokol sunmaktadır. Biyolojik vücut sıvılarından, dokulardan veya hücre lizatlarından protein izolasyonunu takiben, homojenizasyon, proteinlerin çökeltilmesi ve protein hidrolizi için basit bir yöntem açıklanmaktadır. Hidrolizatlar diğer amino asitler, lipitler ve nükleik asitler gibi birçok başka bileşen içerdiğinden, katı faz ekstraksiyonu (SPE) kullanan bir saflaştırma adımı esastır. SPE, santrifüjler veya pipetleme robotu kullanılarak manuel olarak gerçekleştirilebilir. Mevcut protokolü kullanan ADMA için duyarlılık yaklaşık 100 nmol / L'dir. Arjinin için üst tespit sınırı, SPE doygunluğu nedeniyle 3 mmol / L'dir. Özetle, bu protokol, biyolojik numune hazırlamadan NMR tabanlı tespitine kadar uzanan ve arginin metilomunu incelerken başarılı çalışmalar için değerli ipuçları ve tuzaklar sağlayan sağlam bir yöntemi tanımlamaktadır.
Giriş
Son yirmi yılda, arginin kalıntılarının metilasyonu, proteinlerin önemli bir posttranslasyonel modifikasyonu olarak kabul edilmiştir. Transkripsiyonun düzenlenmesi, sinyal iletimi ve daha birçok temel biyolojik süreci etkiler1. Arginin metilasyonunun düzenlenmesinde rol oynayan ana proteinler, protein arginin metiltransferazlarıdır (PRMT'ler)2. Arjininin ana türevleri ω-(N G,NG)-asimetrik dimetilarjinin (ADMA), ω-(N G,N'G)-simetrik dimetilarjinin (SDMA) ve ω-N G-monometilarginin (MMA)2'dir.
PRMT'ler, metil gruplarını proteine bağlı arginin1'in terminal guanidinos grubuna (iki eşdeğer amino grubuyla) aktarmak için S-adenosil-l-metiyonin kullanır. İki ana enzim ayırt edilebilir: Hem tip I hem de tip II enzimler, MMA'yı oluşturmak için ilk metilasyon adımını katalize eder (böylece simetrisini kaybeder). Bu adımı takiben, tip I enzimleri (örneğin, PRMT1, 2, 3, 4, 6, 8), ADMA'yı oluşturmak için substrat olarak MMA'yı kullanırken, tip II enzimleri (öncelikle PRMT5 ve PRMT9) SDMA üretir. PRMT1, memeli hücrelerinden izole edilen ilk protein arginin metiltransferazdır3. Yine de, PRMT'ler, memeli olmayan omurgalılar, omurgasız akordalar, ekinodermler, eklembacaklılar ve nematodlar cnidarians5, bitkiler6 ve maya7 gibi mantarlar da dahil olmak üzere protozoa gibi diğer hayvanlarda evrimsel olarakkorunmuştur. Birçok durumda, PRMT'lerden birinin nakavtı, düzenli olarak arginin bakımından zengin alanları içeren transkripsiyon, translasyon, sinyal iletimi, apoptoz ve sıvı-sıvı faz ayrımı (membransız organellerin oluşumu anlamına gelir, örneğin nükleol) gibi temel hücresel süreçlerde yer alan metillenmiş arginin türlerinin temel rolünü ortaya çıkararak, canlılık kaybına yol açar 8,9,10 . Buna karşılık, bu, kanser11,12,13, multipl miyelom 14, kardiyovasküler hastalıklar 15, viral patogenez, spinal müsküler atrofi 16, diabetes mellitus 17 ve yaşlanma1 dahil olmak üzere fizyolojiyi ve hastalık durumlarını etkiler. Kan dolaşımındaki artmış ADMA seviyelerinin, örneğin protein parçalanması nedeniyle akciğer18'den türetilen, endotel disfonksiyonu, kronik akciğer hastalığı19 ve diğer kardiyovasküler hastalık sendromları20 ile bağlantılı olduğu düşünülmektedir. PRMT'lerin aşırı ekspresyonunun tümörigenezi hızlandırdığı ve kötü prognoz ile ilişkili olduğu bulunmuştur21,22. Ayrıca, PRMT6 ve PRMT7'nin ablasyonu hücresel yaşlanma fenotipi23'ü tetikler. WI-38 fibroblastlarının yaşlanması sırasında ADMA ve PRMT1'de anlamlı azalma bulunmuştur24.
Buradaki zorluk, metilasyonun (pato) fizyolojik süreçlerde nasıl etki ettiğini anlamak, protein arginin metilasyonunu tanımlamak ve ölçmektir. Mevcut yaklaşımların çoğu, metillenmiş argininleri tespit etmek için antikorlar kullanmaktadır. Bununla birlikte, bu antikorlar hala bağlama özgüdür ve arginin metillenmiş proteinlerin farklı motiflerini tanımakta başarısız olabilirler25,26. Tarif edilen protokolde, yukarıda bahsedilen tüm arginin türevleri, nükleer manyetik rezonans (NMR) spektroskopisi ile, yani tek başına, kombinasyon halinde veya çoğu durumda olduğu gibi, ökaryotik hücreler (örneğin, maya, fare veya insan kökenli) ve dokular27 ve serum28 gibi karmaşık biyolojik matrisler içinde güvenilir bir şekilde ölçülebilir. Proteinler ve bu karmaşık matrisler için, protein hidrolizi29, arginin, MMA, SDMA ve ADMA gibi serbest (modifiye edilmiş) amino asitler üretmek için bir ön koşuldur. Katı faz ekstraksiyonu (SPE)30, ilgilenilen bileşiklerin zenginleştirilmesini sağlar. Son olarak, 1H-NMR spektroskopisi, arginin ve arginin'in tüm ana metil türevlerinin paralel olarak tespit edilmesini sağlar. NMR spektroskopisi, gerçekten kantitatif, yüksek oranda tekrarlanabilir ve sağlam bir teknik olması avantajıyla birlikte gelir31,32. Son NMR ölçümleri, daha sonra birçok örnek toplanıp hazırlandığında yapılabilir. Son olarak, bu protokol esas olarak numune hazırlamaya odaklanır, çünkü bu kendi NMR spektrometresini gerektirmez. Çoğu biyokimyasal laboratuvarında yapılabilir. Yine de, NMR spektroskopi ölçümlerinin yapılması gereken bazı ipuçları bu çalışmada verilmiştir.
Protokol
Maya proteini hidrolizatları, bu çalışmanın Temsili sonuçları için örnek olarak kullanılmıştır. Tüm protokol Şekil 1'de özetlenmiştir.
1. Malzemelerin ve reaktiflerin hazırlanması
- Metanol / su: MeOH / H 2 O olarak adlandırılan iki parça% 99 metanol (MeOH) ve bir parçaH2O karışımı hazırlayın. alkol buharlaşmasını enaza indirmek ve numune stabilitesini artırmak için saf MeOH ve MeOH / H2O'yu -20 ° C'de saklayın.
- Hidroklorik asit (HCl): 9 mol / L'yi konsantre HCl'den (12.0 mol / L veya% 37) ve ayrıca 0.1 mol / L HCl'den seyreltin. Daha yüksek konsantre (9 mol / L) çözelti protein hidrolizi için kullanılırken, daha düşük konsantre (0.1 mol / L) olan katı faz ekstraksiyonu için kullanılır.
DİKKAT: Davlumbazın içinde çalışın. - SPE için %10 oranında doymuş amonyak çözeltisi (stok: %30 w amonyak), %50 metanol ve %40 su (v/v) içeren bir Yedek çözelti hazırlayın.
- NMR Tamponu: 5.56 g disodyum hidrojen fosfat (Na 2 HPO 4, 0.08 mol / L), 0.4 g 3-(trimetilsilil) propiyonik asit-2,2,3,3-d4 sodyum tuzu (TSP, 5 mmol / L), % 0.04 (w / v) sodyum azid (NaN3) 500 mL döteryum dioksit (D2O) içinde çözün ve pH7.4'e ayarlayın (HCl veya NaOH kullanarak, sırasıyla) (bkz. Malzeme Tablosu). NMR spektroskopisi ile her yeni tampon partisinin saflığını kontrol edin.
NOT: Kirleticilerin (örneğin, etanol) miktarı mümkün olduğunca düşük olmalıdır. - Hamur tüplerini zirkonyum oksit boncuklarla doldurun (2 mL tüpler ve 1,4 mm boncuklar çoğu uygulama için uygundur, ancak farklı varyantlar mevcuttur) (bkz. Yaklaşık 10-20 boncuğu elle doldurun veya önceden doldurulmuş tüpleri satın alın.
- Pipetleri ve ilgili uçları 10-1.000 μL aralığında hazır tutun.
NOT: Çalışma boyunca ≥18.2MΩ·cm-1'lik yüksek dirençle tanımlanan H2 O olarak adlandırılan yüksek saf su kullanılmıştır. Çift damıtılmış suya karşılık gelir.
2. Örnek toplama ve depolama
- Sıvı numuneleri (serum/plazma, hücre kültürü süpernatan vb.) sıvı azotla flaşla dondurun ve kullanıma kadar -80 °C'de saklayın.
- Katı malzemeleri aşağıda belirtildiği gibi hazırlayın.
- Soğuk fosfat tamponlu salinle yıkadıktan sonra, kazıma ve santrifüjleme veya süspansiyonda yetiştirilen hücrelerin doğrudan santrifüjlenmesinden sonra, yapışkan hücreleri toplayarak hücreleri hücre kültürlerinden (3-5 milyon hücre) toplayın.
- Hücre süpernatantlarını çıkarın (ardışık doğrudan ölçüm ile daha fazla analiz için toplanabilir, adım 6'ya bakın veya çözünür proteinlerin çökeltilmesinden sonra, adım 3.1'e bakın) ve ardından peletleri sıvı azotla dondurun ve -80 ° C'de saklayın. Daha fazla işleme için adım 3.2'ye bakın.
- Dokuları çalışmanın amacına uygun olarak depolayın ve toplayın. Karaciğer veya kas gibi çok homojen dokular için, herhangi bir bölümünü analiz edin. Örneğin, bir fare beyni durumunda, tüm beynin veya beyin bölümlerinin küresel arginin metilasyonunu belirleyin.
NOT: İşlenecek dokuların ideal ağırlığı 30-60 mg'dır. Tüm beynin dondurulması ve toz haline getirilmesi ve bunların alikotlarının kullanılması tavsiye edilir. Alternatif olarak, belirli beyin parçaları (örneğin, frontal, beyincik, oksipital bölgeler veya ~ 250 mg ağırlığındaki bir yarımküre) kullanılabilir.
3. Ön numune hazırlama
NOT: MeOH'yi soğuk tutarak buz üzerinde çalışmayı gerçekleştirin. Protein bozulmasını önlemek için numuneler ayrıca buz üzerinde tutulmalıdır.
- Sıvı numuneler için, numunenin 200 μL'sine 400 μL buz gibi soğuk metanol ekleyin. 3.3. adımla devam edin.
NOT: Daha az numune varsa, hacimleri buna göre ayarlayın; NMR duyarlılığı genellikle daha küçük numune miktarları için yeterince yüksektir, ancak ayrı ayrı test edilmelidir. - Katı malzemeler söz konusu olduğunda, lizatlar için yeterli 1,5 mL tüp hazırlayın (homojenizasyondan sonra santrifüjleme için kullanın).
- Dikkatli ama kapsamlı bir şekilde, hücre peletlerini 600 μL MeOH / H2O içinde yeniden askıya alın ve tüm sıvı fazını hamur tüplerine aktarın.
- Dokuları pulpa tüplerine yerleştirin (doğrudan tüplere tartabilirsiniz) ve 600 μL MeOH / H2O ekleyin (30-60 mg için; ağırlık önemli ölçüde farklıysa ayarlayın).
- Tüpleri doku homojenizatörüne koyun ( Malzeme Tablosuna bakınız) ve ağır sallanma ile 20 sn için bir kez (hücre peletleri, yumuşak dokular için) veya her biri 20 s için iki kez (veya gerekirse daha uzun) 5 dakikalık bir aralıkla (sert dokular için) homojenize edin.
- Homojenizasyondan sonra, hemen numuneleri tekrar buzun üzerine koyun ve tüm lizatları yeni 1,5 mL tüplere aktarın.
- Daha fazla işlemden önce numuneleri -20 °C'de en az 30 dakika (birkaç güne kadar) saklayın.
- 4 °C'de 30 dakika boyunca 10.000 x g'de santrifüj. Bu arada, süpernatantları toplamak için yeterli 1,5 mL tüp hazırlayın.
NOT: Bu süpernatant (Şekil 1'de "( 1)" olarak adlandırılmıştır) atılabilir, liyofilize edilebilir ve doğrudan NMR için işlenebilir (adım 6) veya başka türlü analiz edilebilir. - Bu protokolde, MeOH çökeltisi (= sırasıyla adım 3.1 veya 3.2.2'den sonra elde edilen pelet), diğer şeylerin yanı sıra, nükleik asitler ve lipitler, arginin-metillenmiş proteinler gibi bileşenleri içeren daha ileri analizler için kullanılır. Protein hidrolizi ile devam edin veya peletleri birkaç gün boyunca -20 ° C'de saklayın.
4. Protein hidrolizi
- Her numuneye 500 μL 9 mol/L HCl ekleyin. Ardından, her tüpün kapaklarını makasla kesin ve cam kültür tüplerine yerleştirin (Şekil 2A). Dikkatlice, ancak sıkıca kırmızı kapakları kapatın (böylece sızdırmazlığı kontrol edin).
NOT: Kullanmadan önce, her bir sızdırmazlığı (kırmızı vidalı kapakların içindeki gri PTFE folyo) uygun sıkma için daima kontrol edin ve düzenli olarak suyla temizleyin. - İşiniz bittiğinde, tüpleri kısmen kumla dolu bir beherin içine yerleştirin (daha iyi ısı transferi için) ve numuneleri bir kurutma odasında 110 ° C'de yaklaşık 16 saat boyunca hidrolize edin.
- Hidrolizi takiben, numuneleri soğutun (~ 1 saat).
- Bundan sonra, yüksek vakumlu (100 Pa'nın altında) bir santrifüj kullanarak gece boyunca liyofilize edin.
- Peletleri çözün - tamamen kuruysa (değilse, liyofilizasyona devam edin) - 1 mL'lik 0.1 mol / L HCl'de çözün ve her tüpe 50 μL kloroform (CHCl3) ekleyin; Peleti 1.000 μL'lik bir pipetle iyice çözün, böylece sıvıları karıştırın ve ardından tüm hacmi yeni bir tüpe aktarın.
DİKKAT: Kapsamlı buharlaşmayı en aza indirmek için her zaman küçük miktarlarla çalışın - Ardından, oda sıcaklığında 10 dakika boyunca 8.000 x g'de santrifüj yapın.
- Suda çözünür fraksiyonu (Şekil 2B, düşük yoğunluklu fraksiyon) içeren bifazik sıvının üst fazını bir pipetle dikkatlice toplayın ve yeni tüplere doldurun. Manuel SPE için 1,5 mL tüpler (bölüm 5.2) veya robotik SPE için cam şişeler (bölüm 5.3 ve Şekil 2D) kullanın. CHCl3 ve içeriğinin üzerine dökülmekten kaçının (Şekil 2C).
5. Katı faz ekstraksiyonu (SPE)
- İlk kullanımdan önce, SPE kartuşlarını 1 mL değiştirme çözeltisi (adım 1.3) ile iki kez temizleyin, ardından oda sıcaklığında 1 dakika boyunca 800 x g'de santrifüjleme (15 mL tüplere yerleştirilir). Her biri 10-20 kez kullanılabilir.
- Manuel SPE
- Her çalıştırmada kartuşları ( Malzeme Tablosuna bakınız) 1 mL saf metanol ve 2 x 1 mL PBS ile ön koşullandırın, ardından her seferinde oda sıcaklığında 1 dakika boyunca 800 x g'de santrifüjleme (15 mL tüplere yerleştirilir).
- Bundan sonra, numuneleri (adım 4.7'den itibaren) SPE kartuşlarına yükleyin ve oda sıcaklığında 2 dakika boyunca 600 x g'de santrifüj yapın.
- Ardından, aşağıda belirtildiği gibi bir yıkama döngüsü uygulayın.
- Üç kez 1 mL H2O ekleyin (her biri oda sıcaklığında 800 x g'de 1 dakika santrifüjleme ile takip edilir).
- Beş kez 1 mL 0,1 mol/L HCl ekleyin (her biri oda sıcaklığında 800 x g'de 1 dakika santrifüjleme ile takip edilir).
- İki kez 1 mL MeOH ekleyin (her biri oda sıcaklığında 800 x g'da 1 dakika santrifüjleme ile takip edilir).
- Daha sonra, arginin ve türevlerini 3 x 1 mL yedek çözelti ile (ardından oda sıcaklığında 800 x g'de 1 dakika santrifüjleme) tek bir 15 mL tüpe boşaltın.
NOT: Değiştirme çözeltisi, arginin ve türevleri için elüent görevi görür ve ayrıca kartuşların temizlenmesi için de kullanılır (tüm maddeler elüsyondan önce veya yedek çözeltinin temel pH değerinde yıkanır). Yine de, zaman içinde kontaminasyonu önlemek için, yeniden kullanım sınırlandırılmalıdır (bkz. adım 5.1).
- Robotik SPE
NOT: Burada, bir pipetleme robotu (pipetleme iğnesi, iğne için bir yıkama istasyonu, bir reaktif beslemesi ve numuneler ve eluateler için konumlardan oluşan ana parça, bkz. Diğer enstrümanlar için, listelenen her şeyle tam donanımlı olduğunuzdan emin olun.- Süpernatantı (adım 4.7'den itibaren) doğrudan PTFE sızdırmazlığı olan cam şişelere doldurun (Şekil 2D), yeterli miktarda reaktif hazırlayın (her birinin 100 mL'si, yani yedek çözelti, MeOH, PBS, H 2 O ve mol / L HCl'nin% 99'u), elüsyon için 5 mL tüpler ve robotun iğnesi için yıkama çözeltisi (genellikle H2O).
- Robotun yazılımında, manuel SPE için tam olarak açıklanan adımlara dayanan bir uygulama veya yöntem kullanın (adım 5.2).
NOT: Detaylar cihaz tedarikçileri arasında çok farklı olabilir, bu nedenle programlama için ilgili robotun yazılım el kitabına bakın. Bir pipetleme robotu genellikle santrifüjleme yerine kartuşlara hava basıncı uygulayarak çalışır, bu da temel farktır. Protokol ilk kez kurulur ve çalıştırılırsa, optimum bir iş akışını doğrulamak için kontrolleri (örneğin, bilinen konsantrasyondaki L-arginin) dahil edin.
6. NMR için son hazırlık
- Amonyak veH2O'dan kurtulmak için kuruluğu tamamlamak için numuneleri gece boyunca liyofilize edin.
- Her numuneyi 500 μL NMR tamponunda (adım 1.4) çözün ve NMR tüplerine aktarın. Önemli olarak, hacim tüm tüplerde aynı olmalı ve numuneler homojen olmalıdır (agrega eğilimi gösteren kalıntı ve lipitler içermemelidir).
NOT: NMR spektroskopisinin ayrıntıları bu yöntem incelemesinin ötesine geçmiştir ve başka bir yerde daha ayrıntılı olarak açıklanmıştır27. Burada, yalnızca ana gereksinimler ve adımlar açıklanmaktadır. Arjinin ve metabolitlerinin miktarı, 600 MHz NMR spektrometresinde gerçekleştirilir (bkz. Prensip olarak, arginin ve metillenmiş argininlerin NMR sinyallerinin yeterli hassasiyetle ve sinyal çakışması olmadan tespit edilebilmesi koşuluyla, diğer herhangi bir NMR spektrometresi / NMR alan mukavemeti kullanılabilir. 1H-spektrumunu kaydedebilen z ekseni gradyanlarına sahip herhangi bir prob kafası, darbe dizilerinin buna göre ayarlanması koşuluyla kullanılabilir. - Ön doygunluk kullanarak su sinyali bastırma ile CPMG (Carr-Purcell-Meiboom-Gill) darbe dizisi 33,34 (cpmgpr1d, 512 taramalar, fid boyutu 73728, 11904,76 Hz spektral genişlik, 600 MHz NMR üzerinde geri dönüşüm gecikmesi 4 sn) kullanarak bir 1D spektrum kaydedin.
- Bu deneylerde, 1H skaler kaplinleri sanal dekuplaj ile çıkarın ve sinyal çakışmasını azaltın. Belirli sorular ve/veya karmaşık örnekler veya matrisler için ek kayıt yapın, örneğin, 1 H-13C-heteronükleer tek kuantum tutarlılık (HSQC) spektrumu27.
NOT: Metillenmiş argininlerin 1 H NMR sinyallerinin diğer metabolitlerin (örneğin, lizin) 1 H NMR sinyalleri ile kısmen örtüşebileceği daha karmaşık matrisler için, 1H homo-nükleer J-çözünmüş spektrum (JRES)35 gereklidir. - Bilinen bir konsantrasyondaki standartların ilgili pik yoğunluklarını, örneğin 100 μmol / arginin gibi entegre ederek mutlak niceleme gerçekleştirin.
NOT: Rutin olarak, ADMA, SDMA ve MMA (bakınız Malzeme Tablosu) arginin'e göre bir oran olarak bildirilmiştir. Bunun, ayrı bir normalleştirmenin (örneğin, hücre sayısı, doku kütlesi, protein konsantrasyonları) gerçekleştirilmesi gerekmediği konusunda önemli bir avantajı vardır. Bu durumda, arginin iç standart olarak hizmet eder ve biyolojik olarak ilgili bilgileri elde etmek için göreceli niceleme yeterlidir. - SDMA ve MMA'nın farklılaştırılması için, numuneleri tekrar liyofilize edin,D2O'dan kurtulmak için (daha önce NMR tamponunda yeniden askıya alınmışlarsa), daha sonra deuterated dimetil sülfoksit (d 6-DMSO) ile değiştirilir ve metil rezonanslarının çözünürlüğünü sağlar27. Bu nedenle, NMR tüplerinden alınan numuneleri Pasteur pipetlerle aspire edin, liyofilize edin ve 500 μL d 6-DMSO'da çözün.
Sonuçlar
Rutin olarak, 2D J-çözümlenmiş (JRES), neredeyse ayrıştırılmış NMR spektrumlarının 1H 1D projeksiyonları, laboratuvarımızda pik atamalar ve nicelemeler için kullanılır36. Şekil 3 , mevcut SPE protokolü kullanılarak saflaştırılan maya proteini hidrolizatlarının temsili JRES spektrumlarını göstermektedir. Çok farklı konsantrasyonlarda olmasına rağmen, her iki madde de hücresel bir matriste ayrılabilir ve ölçülebilir. İlgili kimyasal kaymada spesifik metil (-CH3) veya metilen (-CH2-) grubunun proton sayısına dayanarak, 1H-NMR spektroskopisi hassas nicelemeye izin verir. Protokolde (adım 0) belirtildiği gibi, bir metil-arginin türevinin arginin ile karşılaştırıldığında göreceli nicelleştirilmesi, biyolojik süreçleri, örneğin genlerin yıkılması / aşırı ekspresyonu, besinlerdeki değişiklikler veya inhibitörlerle tedavi gibi modülasyonlara yanıt olarak arginin metilasyonunun değişikliklerini gözlemlemek için esas olarak yeterlidir.
Daha önce 27 gösterildiği gibi, L-arginin ve ADMA, sırasıyla3.25 ve 3.02 ppm'deki farklı karakteristik kimyasal kaymaları ile iyi ayırt edilebilir. SDMA ve MMA metil protonları, 2.85 ppm'lik bir kimyasal kaymadaD2O'da (adım 1.4'te açıklanan NMR tamponu) örtüşen zirveleri ortaya çıkarır. İlgili konumda bir tepe noktası varsa, protokolün adım 6.6'sında açıklandığı gibi d 6-DMSO'daki örnekleri çözerek SDMA ve MMA'yı ayırabiliriz. Bu yaklaşımı kullanarak, SDMA ve MMA'nın 1H NMR kimyasal kaymaları, 2.76 ppm (SDMA) ve 2.74 ppm (MMA)27'deki karakteristik kimyasal kaymalarla ayrılabilir ve ölçülebilir. Şekil 3B, sırasıyla D2O ve d 6-DMSO'da SDMA ve MMA'nın (her ikisi de 100 μmol / L) temsili verilerini göstermektedir. Çeşitli hücre ve dokularda saptanan SMDA ve MMA'nın karşılık gelen verileri son zamanlarda bildirilmiştir27. Protokolün 6.4-6.5 numaralı adımlarında açıklandığı gibi, niceleme için bilinen konsantrasyonların referans standartları kullanılabilir. Metinde belirtilen tüm referans standartları ticari olarak temin edilebilir.

Şekil 1: Numune hazırlamaya genel bakış. Numune toplamadan NMR ölçümüne kadar önemli adımları ortaya koyan şema. Kara kutular, protokol bölümlerindeki numaralandırmayı ifade eder. Ek olarak, yaklaşık gün miktarı (numune sayısına göre değişir) gösterilir. Homojen olmayan sıvı numuneler, kalıntıları gidermek için MeOH (adım 3.1) eklenmeden önce santrifüj edilebilir (gösterilmemiştir). İlk santrifüjlemeden sonra süpernatant (1), örneğin hücre içi metabolitler veya proteine bağlı olmayan arginin metabolitleri içeren süpernatant, daha fazla analiz için -20 ° C'de depolanabilir. Rutin olarak, MeOH peletleri (2) daha fazla analiz edilir. Kısaltmalar: CHCl3, kloroform; HCl, hidroklorik asit; MeOH, metanol; NMR, nükleer manyetik rezonans; o/n, geceleme; SN, süpernatant; SPE, katı faz ekstraksiyonu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Protein hidrolizatlarının taşınması ve katı faz ekstraksiyonu için hazırlık. (A) Kumla doldurulmuş beher, cam tüpler, gri politetrafloroetilen (PTFE) sızdırmazlık folyosu ile vidalı kapaklar ve kapakları kestikten sonra 1,5 mL tüplerdeki numuneler. (B) Santrifüjlemeden sonra tüp (adım 4.6) ve (C) sulu süpernatantın çıkarılmasından sonra (adım 4.7): bir miktar artık su (~ 50 μL) kalabilir. Siyah kalıntı çözünmez, odun kömürü organik kalıntılar içerir. Yine de, bazı numuneler L-arginin ölçümüne müdahale etmeyen renkli maddeler (D) içerebilir. Bu kısmen, ardışık santrifüjleme adımları (E) veya bir pipetleme robotu (F) kullanılarak katı faz ekstraksiyonundan (SPE) kaynaklanmaktadır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
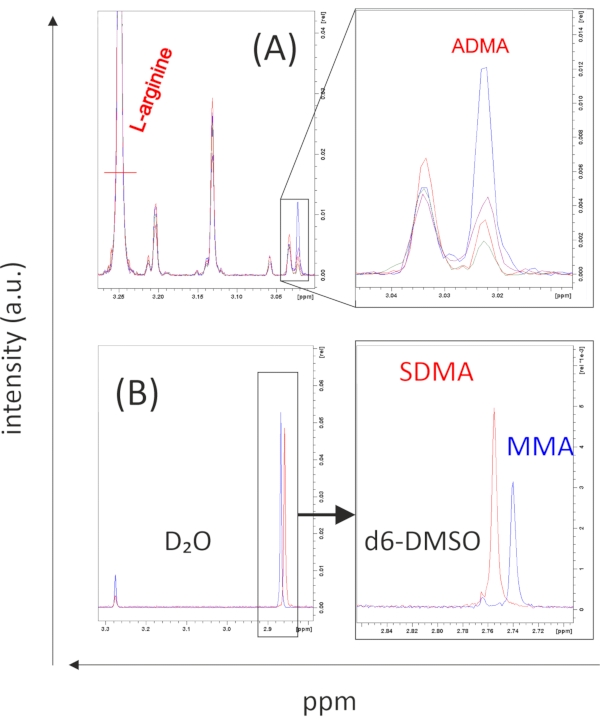
Şekil 3: L-Arginin ve metil türevlerinin tipik NMR spektrumları. 1 adet H 1D öngörülen J-çözümlenmiş NMR spektrumları, L-arginin'in δ-(CH2)-protonlarını (3.25 ppm) ve asimetrik dimetilarginin'in ω-N-CH 3-protonlarını (ADMA,3.02 ppm'de) kolayca ayırt edebilir. Maya peletlerinden (A) farklı miktarlarda ADMA ortaya çıkaran örnekler, yüksek miktarda arginin varlığında bile sinyal yoğunlukları entegre edilerek ölçülebilir (tam arginin zirvesinin gösterilmediğini unutmayın). (B) ω-(N G,N'G)-simetrik dimetilarginin (SDMA) ve ω-N G-monometil arginin (MMA) döteryum oksit tamponunda (D2O) neredeyse hiç ayırt edilemediğinden, numuneler deuterated dimetil sülfoksit (d6-DMSO) içinde çözülmelidir, burada pikler (bu durumda her maddenin 100 μmol / L'si) birbirinden kolayca ayırt edilebilir (2.75 ve 2.76 ppm'deki pikler, sırasıyla) ve nicelleştirilir. Tüm spektrogramlar doğrudan NMR spektrometresinin kontrol yazılımından ihraç edildi. Yazılım, birçok numunenin istatistikleri de dahil olmak üzere daha ayrıntılı bir analiz yapılmadan önce kontrol edilmesi gereken birincil sonuçları ortaya koymaktadır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Aşağıdaki bölümde, birincil odak noktası yöntemin kendisinde yatmaktadır; arginin metilasyonunun biyolojik etkileri Giriş bölümünde açıklanmıştır.
İlk olarak, farklı sertlikteki dokular numune lizisinin ayarlanmasına ihtiyaç duyabilir: hücre kültüründen hücreler (bakteri, maya vb. dahil) ve beyin, genç karaciğer, düz kas vb. gibi dokular hızla homojenize edilebilir. Yüksek sertlikteki dokular için (yaşlı deneklerin karaciğeri, arterler, kemikler vb. dahil), homojenizasyonun iki kez yapılması gerekir (bkz. adım 3.2.3). Bununla birlikte, bazı çözünmez kalıntılar kalsa bile, bu işlem daha sık devam ettirilmemelidir. Bunun yerine, numuneler 10.000 x g'de 10 dakika boyunca santrifüj edilmeli ve süpernatanlar daha fazla analiz için toplanmalıdır (numune bozulmasını en aza indirmek için).
Numunelerin dondurulduğu her adımda (başlangıçta, sırasıyla MeOH, adım 3.3, 3.4 veya 3.5 eklendikten sonra) veya liyofilizasyonu takiben (adım 4.4 ve 6.1), numuneler daha sonraki işlemlerden önce birkaç gün saklanabilir. Ek olarak, adım 3.4'teki süpernatant (homojenizasyonu takiben; Şekil 1'de "(1)" olarak tanımlanmıştır) daha ileri analizler için, örneğin metil-argininler36,37,38 dışındaki metabolitlerin ölçümü için de saklanabilir.
Bir yandan, kritik adımlar numune depolamayı içerir, çünkü proteinlerin bozulması sonucu değiştirebilir. MeOH çökelmesinden önce protein yıkımı meydana gelirse, arginin ve metil türevleri hafife alınabilir. Bu nedenle, numunelerin depolanması esastır, örneğin -20 ° C'de hücre veya doku lizisinden önce ve sonra veya mümkün olduğunda -80 ° C'de. Homojenizasyondan önce veya sonra (adım 3.2), numuneler buz üzerinde tutulmalıdır.
Öte yandan, proteinleri çökeltmek için numunelerin metanol ön işlemi, arginin'in metilasyon paternini değiştirmez. Bu, lizozim ve Escherichia coli protein ekstraktları (metillenmiş arginin içermeyen) ile test edilmiştir27. Bununla birlikte, daha önceki raporlar, MeOH'nin glutamat ve aspartat39'un terminal karboksil gruplarını metilleştirebileceğini göstermiştir.
Protein hidrolizi için, vidalı kapakların sızdırmazlıklarının sağlam olduğundan emin olun (adım 4.1). Aksi takdirde, HCl'nin buharlaştırılması kurutma odasını etkileyebilir. Analitlerin konsantrasyonu kritik olarak değiştirilmeyebilir, çünkü buharlaşmazlar ve artık HCl daha sonra liyofilizasyon ile buharlaştırılır. Daha düşük HCl konsantrasyonları, örneğin 6 mol / L, kullanılabilir, ancak daha uzun bir hidroliz süresi gerektirebilir. Hidrolizi takiben, numuneler oda sıcaklığında işlenebilir. Bununla birlikte, lipitlerin uygun şekilde çıkarılması esastır. Lipitler, daha sonra NMR ölçümü sırasında suda (veya sırasıyla D2O) bifazik karışımlar oluşturabilir. Bu homojensizlikler NMR tepe genişlemesine yol açar ve potansiyel olarak NMR deneylerinin kalitesini ve hassasiyetini etkiler.
SPE için pipetleme robotu yoksa, yatırıma değer (başka amaçlar için de kullanılabilir). SPE pipetleme robotundaki numuneler sırayla işlenir ve mevcut kurulumda, bir numune tam bir çalışma için ~ 40 dakika sürer. Reaktif kapasitelerinin sınırlamaları nedeniyle (yani, 100 mL), tek seferde sadece 19 numune işlenebilir (genel olarak ~ 13 saat sürer). Yine de, uygulamalı çalışma süresi manuel SPE prosedüründen çok daha azdır ve daha az malzeme gerektirir. Bu süre zarfında, numuneler liyofilizasyona kadar oda sıcaklığında robot içinde saklanabilir. Eşdeğer ürünler, kullanılan SPE matrislerinin ve kartuşlarının yerini alabilir. Bununla birlikte, SPE protokolünün değerlendirilmesi ve gerekirse ayarlanması önerilir.
ADMA için algılama sınırı, daha önce seri seyreltmelerle ve bildirilen NMR ölçüm süreleri kullanılarak değerlendirildiği gibi ~ 100 nmol / L'dir. Öte yandan, yüksek arginin konsantrasyonları ADMA'nın arginin'e oranını da abartabilir (genellikle% 5 -% 15 aralığındadır). Bunun nedeni, 3 mmol / L'nin üzerinde arginin; SPE sütun bağlama kapasitesi doygunluğa ulaşabilir27. Beklenmeyen sonuçlar durumunda tüm iş akışının hassasiyetini ve özgüllüğünü kontrol etmek için (örneğin, bildirilen kimyasal kaymalarda 1H-NMR spektrumunda pik veya örtüşen pikler yoktur), ADMA, SDMA ve MMA standartları ticari tedarikçilerden edinilebilir (bkz. Herhangi bir laboratuvarda NMR spektrometresi yoksa, nihai liyofilizasyon (adım 6.1) dahil olmak üzere tüm adımlar ilgili laboratuvarda gerçekleştirilebilir ve numuneler analiz için bir NMR tesisine gönderilebilir.
Kütle spektrometrisi gibi diğer yöntemlerle karşılaştırıldığında, analitlerin etiketlenmesine gerek yoktur ve niceleme için dahili standartlar olmadan gerçekleştirilebilir. Öte yandan, NMR'nin duyarlılığı biraz daha düşüktür, bu da çoğu biyolojik vakada, arginin ve metil türevleri gibi hiçbir rol oynamamasına rağmen, her türlü ökaryotik hücrede veya dokuda kolayca tespit edilebilir. Daha önce de belirtildiği gibi, proteine bağlı ADMA'yı ölçmek için 3 milyon hücre yeterlidir - çoğu hücre hattıyla kolayca elde edilebilecek birkaç hücre. Yetişkin kök hücreler40 gibi insan kökenli yavaş büyüyen, değiştirilmemiş birincil hücreler söz konusu olduğunda, hücreler daha uzun bir süre boyunca büyütülebilir veya ayrı deneylerden bir araya getirilebilir. Aynı şey doku örnekleri için de geçerlidir. Birçok organa, örneğin farelere (kısmen veya tamamen, örneğin küçük kaslar) veya biyopsi örneğine karşılık gelen ~ 30 mg doku, NMR ölçümü27 için yeterli lizat ve protein hidrolizatı hazırlamak için yeterlidir. Protein arginin metilasyonunu ölçmek için diğer yöntemler arasında enzim bağlantılı lüminesans testleri41 veya 3H etiketli S-adenosil-metiyonin (SAM)42 kullanılması yer almaktadır. Hassasiyet yüksektir ve 14C etiketli SAM kullanılarak ancak artan maliyetler pahasına artırılabilir. Ek olarak, radyoaktif maddelerin (sintilasyon sayımı için sıvılar dahil) kullanımı, mevcut protokolün kullanılması gerekmeyen özel atık yönetimine neden olur.
2D heteronükleer NMR spektroskopisi kullanan mevcut protokolün tamamlayıcı bir yöntemi, izole proteinler içinde bölgeye özgü metilasyon paternlerini ortaya çıkarabilir. Genel olarak NMR spektroskopisi ile metil-argininlerin tespitinin ayrıntılı bir tanımı da dahil olmak üzere yakın zamanda yayınlanmıştır43. Mevcut protokol, proteinler içinde bölgeye özgü arginin metilasyonu hakkında bilgi sağlamamaktadır. Yine de, küresel metilasyon, hücre büyümesi ve farklılaşması, yaşlanma, kanser 1,2,12, kardiyovasküler 20 ve nörodejeneratif hastalıklar 8,44 dahil olmak üzere hücresel ve fizyolojik düzeyde değişmektedir. İlgili mekanizmalarla ilgili kesin detaylar hala tam olarak anlaşılamamıştır ve protein-arginin metilasyonu11'e hem in vitro hem de in vivo olarak müdahale eden olası ilaç adaylarının daha fazla araştırılması gerekmektedir1. Metilasyonun kinetiğini incelemek (grubumuzun yakın zamanda gösterdiği)27, arginin modifikasyonu ve protein parçalanma mekanizmaları hakkında fikir edinmek için gereklidir. Tek proteinlerden tüm organizmalardan alınan örneklere kadar uzanan küresel arginin metilasyon ölçümleri ve kinetik deneyler (numuneler herhangi bir zamanda dondurulabilir), bu protokol kullanılarak doğrudan gerçekleştirilebilir. Bu nedenle, gelecekteki araştırmalar için kolayca uyarlanabilecek sağlam bir yöntem sağlar.
Açıklamalar
Yazarlar rakip çıkarlar olmadığını beyan ederler.
Teşekkürler
Çalışma, Avusturya Bilim Fonu (FWF) hibeleri P28854, I3792, doc.funds BioMolStruct DOC 130, DK-MCD W1226 BioTechMed-Graz (Amiral gemisi projesi DYNIMO), Avusturya Araştırma Tanıtım Ajansı (FFG) hibeleri 864690 ve 870454, Bütünleştirici Metabolizma Araştırma Merkezi Graz; Avusturya Altyapı Programı 2016/2017, Steiermark Hükümeti (Zukunftsfonds) ve Fujian Tıp Üniversitesi Üst Düzey Yetenekler için Başlangıç Fonu (XRCZX2021020). Hücre kültürü tesislerine erişim için Tıbbi Araştırma Merkezi'ne teşekkür ederiz. F.Z., Graz Tıp Üniversitesi, Moleküler Tıp doktora programı çerçevesinde eğitim almıştır. Q.Z., Graz Tıp Üniversitesi, Metabolik ve Kardiyovasküler Hastalıklar doktora programı çerçevesinde eğitildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL tubes | Greiner Bio One | 188271 | |
| 3-(trimethylsilyl) propionic acid-2,2,3,3-d4 sodium salt (TSP) | Alfa Aesar | A1448 | |
| 5 mL tubes, round bottom | Greiner Bio One | 115101 | |
| Ammonia Solution 32% | Roth | A990.1 | |
| Bruker 600 MHz NMR spectrometer, equipped with a TXI probe head | Bruker | - | |
| Centrifuge, refrigerated, e.g. 5430 R | Eppendorf | 5428000010 | |
| Chloroform ≥99% p.a. | Roth | 3313.1 | |
| Cryocool | Thermo Scientific | SCC1 | heat transfer fluid for SpeedVac System |
| Deuterium Oxide (D2O) | Cambridge Isotope Laboratories | DLM-10-PK | |
| Dimethyl sulfoxide-d6 (d6-DMSO) | Cambridge Isotope Laboratories | DLM-6-1000 | |
| Drying Chamber | Binder | 9090-0018 | |
| DURAN culture tubes, 13 x 100mm, GL 14, 9 mL | VWR International | 212-0375 | |
| Edwards Deep vacuum oil pump RV5 | Thermo Scientific | 16234611 | part of the SpeedVac System |
| Eppendorf 1.5 mL tubes | Greiner Bio One | 616201 | |
| Gilson pipetting robot GX-241 Aspec | Gilson Inc. | 26150008 | |
| L-arginine | AppliChem | A3675 | |
| Methanol ≥99% | Roth | 8388.4 | |
| Milli-Q water aparatus | Millipore | ZIQ7000T0 | |
| Oasis MCX 1cc/30 mg, 1 mL cartridges | Waters | 186000252 | https://www.waters.com/waters/en_US/Waters-Oasis-Sample-Extraction-SPE-Products/ |
| Phosphate Buffered Saline (PBS) | Lonza | LONBE17-512F | |
| Precellys 24 tissue homogenizer | Bertin Instruments | P000669-PR240-A | https://www.bertin-instruments.com/product/sample-preparation-homogenizers/precellys24-tissue-homogenizer/ |
| Precellys tubes (pulping tubes) | VWR International | 432-0351 | |
| Precellyse 1.4 mm zirconium oxide beads | VWR International | 432-0356 | |
| Reacti-Therm/ReactiVap Heating, Stirring, and Evaporation Modules | Thermo Scientific | TS-18820 | https://www.thermofisher.com/order/catalog/product/TS-18820 |
| Rotor for 1.5 mL tubes, FA-45-30-11 | Eppendorf | 5427753001 | |
| Savant Refrigerated Cooling Trap | Thermo Scientific | 15996161 | part of the SpeedVac System |
| Savant SpeedVac vacuum concentrator SPD210 | Thermo Scientific | 15906181 | part of the SpeedVac System; equipped with rotor for 1.5 ml tubes |
| Screw caps for glas vials with PTFE sealing, DN9 | Dr. R. Forche Chromatographie | CT11B3011 | |
| Seasand | Roth | 8441.3 | |
| Short thread glas vials 1.5 mL, ND9 | Dr. R. Forche Chromatographie | VT1100309 | |
| Sodium azide (NaN3) | Roth | K305.1 | |
| Sodium hydroxide (NaOH) | VWR | BDH7363-4 | |
| Sodium phosphate dibasic (Na2HPO4) | VWR | 80731-078 | |
| TopSpin 4.0 (Software) | Bruker | - | https://www.bruker.com |
| ω-NG-asymmetric dimethylarginine (ADMA) | Santa Cruz Biotechnology | sc-208093 | |
| ω-NG-monomethylarginine (MMA) | Santa Cruz Biotechnology | sc-200739A | |
| ω-NG-NG'-symmetric dimethylarginine (SDMA) | Santa Cruz Biotechnology | sc-202235A |
Referanslar
- Guccione, E., Richard, S. The regulation, functions and clinical relevance of arginine methylation. Nature Reviews Molecular Cell Biology. 20 (10), 642-657 (2019).
- Bedford, M. T., Clarke, S. G. Protein arginine methylation in mammals: who, what, and why. Molecular Cell. 33 (1), 1-13 (2009).
- Lin, W. J., Gary, J. D., Yang, M. C., Clarke, S., Herschman, H. R. The mammalian immediate-early TIS21 protein and the leukemia-associated BTG1 protein interact with a protein-arginine N-methyltransferase. Journal of Biological Chemistry. 271 (25), 15034-15044 (1996).
- Bachand, F. Protein arginine methyltransferases: from unicellular eukaryotes to humans. Eukaryotic Cell. 6 (6), 889-898 (2007).
- Wang, Y. C., Li, C. Evolutionarily conserved protein arginine methyltransferases in non-mammalian animal systems. FEBS Journal. 279 (6), 932-945 (2012).
- Ahmad, A., Cao, X. Plant PRMTs broaden the scope of arginine methylation. Journal of Genetics and Genomics. 39 (5), 195-208 (2012).
- Fisk, J. C., Read, L. K. Protein arginine methylation in parasitic protozoa. Eukaryotic Cell. 10 (8), 1013-1022 (2011).
- Hofweber, M., et al. Phase Separation of FUS Is Suppressed by Its Nuclear Import Receptor and Arginine Methylation. Cell. 173 (3), 706-719 (2018).
- Chong, P. A., Vernon, R. M., Forman-Kay, J. D. RGG/RG Motif Regions in RNA Binding and Phase Separation. Journal of Molecular Biology. 430 (23), 4650-4665 (2018).
- Nott, T. J., et al. Phase transition of a disordered nuage protein generates environmentally responsive membraneless organelles. Molecular Cell. 57 (5), 936-947 (2015).
- Fong, J. Y., et al. Therapeutic targeting of RNA splicing catalysis through inhibition of protein arginine methylation. Cancer Cell. 36 (2), 194-209 (2019).
- Yang, Y., Bedford, M. T. Protein arginine methyltransferases and cancer. Nature Reviews Cancer. 13 (1), 37-50 (2013).
- Wang, S. M., Dowhan, D. H., Muscat, G. E. O. Epigenetic arginine methylation in breast cancer: emerging therapeutic strategies. Journal of Molecular Endocrinology. 62 (3), 223-237 (2019).
- Gulla, A., et al. Protein arginine methyltransferase 5 has prognostic relevance and is a druggable target in multiple myeloma. Leukemia. 32 (4), 996-1002 (2018).
- Wang, Z., Tang, W. H., Cho, L., Brennan, D. M., Hazen, S. L. Targeted metabolomic evaluation of arginine methylation and cardiovascular risks: potential mechanisms beyond nitric oxide synthase inhibition. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (9), 1383-1391 (2009).
- Friesen, W. J., Massenet, S., Paushkin, S., Wyce, A., Dreyfuss, G. SMN, the product of the spinal muscular atrophy gene, binds preferentially to dimethylarginine-containing protein targets. Molecular Cell. 7 (5), 1111-1117 (2001).
- Lee, J. H., Park, G. H., Lee, Y. K., Park, J. H. Changes in the arginine methylation of organ proteins during the development of diabetes mellitus. Diabetes Research and Clinical Practice. 94 (1), 111-118 (2011).
- Bulau, P., et al. Analysis of methylarginine metabolism in the cardiovascular system identifies the lung as a major source of ADMA. American Journal of Physiology: Lung Cellular and Molecular Physiology. 292 (1), 18-24 (2007).
- Zakrzewicz, D., Eickelberg, O. From arginine methylation to ADMA: a novel mechanism with therapeutic potential in chronic lung diseases. BMC Pulmonary Medicine. 9, 5 (2009).
- Fulton, M. D., Brown, T., Zheng, Y. G. The biological axis of protein arginine methylation and asymmetric dimethylarginine. International Journal of Molecular Sciences. 20 (13), (2019).
- Aliferis, K. A., Chrysayi-Tokousbalides, M. Metabolomics in pesticide research and development: review and future perspectives. Metabolomics. 7 (1), 35-53 (2011).
- Chiang, K., et al. PRMT5 Is a Critical Regulator of Breast Cancer Stem Cell Function via Histone Methylation and FOXP1 Expression. Cell Reports. 21 (12), 3498-3513 (2017).
- Blanc, R. S., Vogel, G., Chen, T., Crist, C., Richard, S. PRMT7 preserves satellite cell regenerative capacity. Cell Reports. 14 (6), 1528-1539 (2016).
- Lim, Y., Lee, E., Lee, J., Oh, S., Kim, S. Down-regulation of asymmetric arginine methylation during replicative and H2O2-induced premature senescence in WI-38 human diploid fibroblasts. Journal of Biochemistry. 144 (4), 523-529 (2008).
- Bhatter, N., et al. Arginine methylation augments Sbp1 function in translation repression and decapping. FEBS Journal. 286 (23), 4693-4708 (2019).
- Lee, Y. H., Stallcup, M. R. Minireview: protein arginine methylation of nonhistone proteins in transcriptional regulation. Molecular Endocrinology. 23 (4), 425-433 (2009).
- Zhang, F., et al. Global analysis of protein arginine methylation. Cell Reports Methods. 1 (2), (2021).
- Zinellu, A., Sotgia, S., Scanu, B., Deiana, L., Carru, C. Determination of protein-incorporated methylated arginine reference values in healthy subjects whole blood and evaluation of factors affecting protein methylation. Clinical Biochemistry. 41 (14-15), 1218-1223 (2008).
- Weiss, M., Manneberg, M., Juranville, J. F., Lahm, H. W., Fountoulakis, M. Effect of the hydrolysis method on the determination of the amino acid composition of proteins. Journal of Chromatography A. 795 (2), 263-275 (1998).
- Davids, M., et al. Simultaneous determination of asymmetric and symmetric dimethylarginine, L-monomethylarginine, L-arginine, and L-homoarginine in biological samples using stable isotope dilution liquid chromatography tandem mass spectrometry. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences. 900, 38-47 (2012).
- Stryeck, S., Birner-Gruenberger, R., Madl, T. Integrative metabolomics as emerging tool to study autophagy regulation. Microbial Cell. 4 (8), 240-258 (2017).
- Vignoli, A., et al. High-throughput metabolomics by 1D NMR. Angewandte Chemie International Edition. 58 (4), 968-994 (2019).
- Carr, H. Y., Purcell, E. M. Effects of diffusion on free precession in nuclear magnetic resonance experiments. Physical Review. 94 (3), 630-638 (1954).
- Meiboom, S., Gill, D. Modified spin-echo method for measuring nuclear relaxation times. Review of Scientific Instruments. 29 (8), 688-691 (1958).
- Nagayama, K., Wuthrich, K., Bachmann, P., Ernst, R. R. Two-dimensional J-resolved 1H n.m.r. spectroscopy for studies of biological macromolecules. Biochemical and Biophysical Research Communications. 78 (1), 99-105 (1977).
- Stryeck, S., et al. Serum concentrations of Citrate, Tyrosine, 2- and 3- Hydroxybutyrate are associated with increased 3-month mortality in acute heart failure patients. Scientific Reports. 9 (1), 6743 (2019).
- Zhang, F., et al. Tissue-specific landscape of metabolic dysregulation during ageing. Biomolecules. 11 (2), (2021).
- Zhang, F., et al. Growing human hepatocellular tumors undergo a global metabolic reprogramming. Cancers. 13 (8), (2021).
- Pahlich, S., Zakaryan, R. P., Gehring, H. Protein arginine methylation: Cellular functions and methods of analysis. Biochimica et Biophysica Acta. 1764 (12), 1890-1903 (2006).
- Habisch, H. J., et al. Neuroectodermally converted human mesenchymal stromal cells provide cytoprotective effects on neural stem cells and inhibit their glial differentiation. Cytotherapy. 12 (4), 491-504 (2010).
- Ibanez, G., McBean, J. L., Astudillo, Y. M., Luo, M. An enzyme-coupled ultrasensitive luminescence assay for protein methyltransferases. Analytical Biochemistry. 401 (2), 203-210 (2010).
- Hevel, J. M., Price, O. M. Rapid and direct measurement of methyltransferase activity in about 30min. Methods. 175, 3-9 (2020).
- Altincekic, N., et al. Site-specific detection of arginine methylation in highly repetitive protein motifs of low sequence complexity by NMR. Journal of the American Chemical Society. 142 (16), 7647-7654 (2020).
- Kaneb, H. M., Dion, P. A., Rouleau, G. A. The FUS about arginine methylation in ALS and FTLD. The EMBO Journal. 31 (22), 4249-4251 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır