Method Article
DNA-Protein Etkileşimlerini İncelemek için CD Spektroskopisi
Bu Makalede
Özet
ATP'ye bağımlı kromatin remodeler'in DNA ligand ile etkileşimi CD spektroskopisi kullanılarak açıklanmaktadır. Üretilen zirveler tarafından analiz edilen bir gen promotöründeki indüklenen konformasyon değişiklikleri transkripsiyonal regülasyon mekanizmasını anlamak için kullanılabilir.
Özet
Dairesel dikroizm (CD) spektroskopisi, biyomoleküllerin ikincil yapısını ve etkileşimlerini araştırmak için basit ve kullanışlı bir yöntemdir. CD spektroskopislerindeki son gelişmeler, transkripsiyonel regülasyonun daha iyi anlaşılması için DNA-protein etkileşimlerinin ve DNA'nın konformasyonel dinamiklerinin farklı mikroçevrimlerde ayrıntılı olarak incelenmesini sağlamaktadır. Transkripsiyonun gerçekleşmesi için potansiyel bir transkripsiyon bölgesinin etrafındaki alanın çözilmesi gerekir. Bu, histon modifikasyonlarının koordinasyonunu, transkripsiyon faktörünün DNA'ya bağlanmasını ve diğer kromatin yeniden şekillendirme faaliyetlerini gerektiren karmaşık bir süreçtir. CD spektroskopisi kullanılarak, transkripsiyonu teşvik etmek için ATP'ye bağımlı kromatin remodelerleri gibi düzenleyici proteinlerin neden olduğu promotör bölgesindeki konformasyonsal değişiklikleri incelemek mümkündür. Proteinde meydana gelen konformasyon değişiklikleri de izlenebilir. Ek olarak, proteinin hedef DNA'sına ve dizi özgüllüğüne olan benzeşimi ile ilgili sorgular, hedef DNA'daki mutasyonlar dahil edilerek ele alınabilir. Kısacası, bu hassas ve ucuz yöntemin benzersiz anlayışı kromatin dinamiklerindeki değişiklikleri tahmin edebilir, böylece transkripsiyonel düzenleme anlayışını geliştirebilir.
Giriş
Dairesel dikroizm (CD), sağ elini kullanan ve solak dairesel polarize ışığın diferansiyel emilimine yol açan biyolojik makromoleküllerin doğal chiralitesine dayanan spektroskopik bir tekniktir. Bu diferansiyel emilim dairesel dikroizm olarak bilinir. Bu nedenle teknik, her ikisi de chiral merkezleri içeren proteinler ve DNA gibi biyolojik makromoleküllerin konformasyonunu tanımlamak için kullanılabilir1,2.
Elektromanyetik dalgalar hem elektrik hem de manyetik bileşenler içerir. Hem elektriksel hem de manyetik alanlar dalga yayılma yönüne dik olarak salınır. Kutuplaşmamış ışık durumunda, bu alanlar birçok yönde salınır. Işık dairesel olarak polarize edildiğinde, birbirine 90° faz farkıyla iki elektromanyetik alan elde edilir. Chiral molekülleri dairesel optik dönüş (birefringence) gösterir, böylece sağ elle dairesel polarize ışığı ve solak dairesel polarize ışığı farklı derecelerde emerler3. Elde edilen elektrik alanı, dalga boyunun bir işlevi olan elips olarak izlenecektir. CD spektrumu böylece eliptiklik (q) olarak kaydedilir ve veriler dalga boyunun bir işlevi olarak Ortalama Kalıntı Eliptikliği olarak sunulur.
Proteinler söz konusu olduğunda, amino asitlerin Cα'ları (glisine hariç) chiral'dır ve bu makromolekül4'ün ikincil yapısını belirlemek için CD spektroskopisi ile yararlanılmıştır. Protein moleküllerinin CD spektrumları tipik olarak Uzak UV aralığında kaydedilir. α-sarmal proteinler 222 nm ve 208 nm'de iki negatif bant ve 193 nm4'te bir pozitif zirveye sahiptir. Anti-paralel β yaprak ikincil yapıya sahip proteinler 218 nm'de negatif bir zirve ve 195 nm4'te pozitif bir zirve gösterir. Düzensiz yapılara sahip proteinler 210 nm'ye yakın düşük eliptiklik ve 195 nm4'te negatif bir zirve gösterir. Bu nedenle, farklı ikincil yapılar için iyi tanımlanmış tepe / bantlar, CD'yi denatürasyon ve ligand bağlama sırasında proteinlerin ikincil yapısında meydana gelen konformasyonel değişiklikleri aydınlatmak için uygun bir araç haline getirir.
Nükleik asitlerin üç tane chirality kaynağı vardır: şeker molekülü, ikincil yapının helitesi ve ortamdaKI DNA'nın uzun menzilli üçüncül sırası5,6. Nükleik asitlerin CD spektrumları tipik olarak 190 ila 300 nm aralığında kaydedilir5,6. DNA'nın her uyumu, tıpkı proteinler gibi karakteristik bir spektrum sağlar, ancak tepeler / bantlar çözücü koşullar ve DNA dizilerindeki farklılıklar nedeniyle bir dereceye kadar değişebilir7. En yaygın form olan B-DNA, 260-280 nm civarında pozitif bir zirve ve 245 nm6 civarında negatif bir tepe ile karakterizedir. B formu DNA'sının zirveleri/bantları genellikle küçüktür, çünkü baz çiftleri çift sarmala diktir ve moleküle zayıf bir chirality tanır. A-DNA 260 nm'de baskın pozitif zirve ve 210 nm6 civarında negatif bir zirve verir. Solak sarmal olan Z-DNA, 290 nm'de negatif bir bant ve 260 nm6 civarında pozitif bir zirve sağlar. Bu DNA aynı zamanda 205 nm6'da son derece negatif bir zirve verir.
Bu konformasyonlara ek olarak, DNA tripleksler, dört yönlüler ve saç tokaları da oluşturabilir ve bunların hepsi CD spektroskopisi ile ayırt edilebilir. Paralel G-quadruplex 260 nm'de baskın pozitif bant verirken, paralel karşıtı G-quadruplex 260 nm'de negatif bir bant ve 290 nm'de pozitif bir zirve vererek iki dört yönlü yapı biçimini ayırt etmeyi kolaylaştırır6. Tripleks karakteristik bir spektrum vermez8. Örneğin, Na+ varlığında G.G.C ve T.A.T baz çiftlerini içeren intramoleküler üçlü sarmal oluşturma potansiyeline sahip 36 nükleotid uzunluğundaki DNA'nın spektrumu 240 nm'de güçlü bir negatif bant ve geniş bir pozitif zirve göstermektedir. Geniş pozitif zirve 266, 273 ve 286 nm'de katkıları göstermektedir. Na+ ve Zn+'nın varlığında aynı oligonükleotid dört negatif bant (213, 238, 266 ve 282 nm) ve 258 nm'de pozitif bir zirve gösterir. Bu nedenle, tripleks DNA tayfı tuz koşullarına bağlı olarak değişebilir8.
Bu konformasyonlara ek olarak, CD spektrası X-DNA adı verilen başka bir DNA formunun tanımlanmasını sağlamış. DNA dizisi alternatif adenin ve timin kalıntıları içerdiğinde X-DNA oluşur. X-DNA'nın CD spektrumları 250 ve 280 nm'de iki negatif tepe içerir. X-DNA hakkında çok az bilgi mevcuttur, ancak pozitif supercoiling için bir lavabo işlevi görebilmiştir6,9. CD spektrumlarındaki değişiklikler ligand-protein etkileşimleri hakkında da ayrıntıları ortaya getirebilir ve bu nedenle, ilaç-protein etkileşimlerini tespit etmek için moleküler yöntemlerin cephaneliğine eklenmiştir10,11,12,13,14. CD spektrumları, katlama işlemi sırasında proteinlerin ikincil yapısındaki değişiklikleri izlemek için de kullanılmıştır15. Benzer şekilde, CD spektrumları ligand-DNA etkileşimlerini yoklamada da kullanılabilir16,17.
Cd spektroskopisi, bu nedenle, çok ucuz olmayan ekipman ve yazılımlara erişim olması koşuluyla, farklı DNA uyum biçimlerini ayırt etmek için kolay ve ucuz bir yöntemdir. Yöntem son derece hassas ve hızlıdır. Sadece az miktarda DNA gerektirir, bu da ona alternatif nükleer manyetik rezonans (NMR) spektroskopi tekniği üzerinde bir avantaj sağlar. Ligandlar ve substratlar ile titrasyonların yapılması da kolaydır. En büyük kısıtlama DNA'nın son derece saf olması gerektiğidir. Poliakrilamid jel elektroforez (PAGE) saflaştırılmış DNA kullanılması tavsiye edilir.
CD spektrası tarafından elde edilen bilgiler esas olarak protein yapısal özelliklerini çıkarmak ve farklı DNA uyumlularını tanımlamak için kullanılmıştır. Bu çalışmada CD spektrası, in vivo Chromatin Immunoprecipitation (ChIP) deneyinden elde edilen sonuçları entegre etmek için, ilgi proteininin /tahmin edilen transkripsiyon faktörünün efektör genlerinin promotör bölgesinde konformasyonsal bir değişiklik getirip getirmeyeceğini ortaya çıkarmak için kullanılmıştır. Bu işbirliği, bir organizatörün transkripsiyon başlangıç sitesi (TSS) üzerinde ve çevresinde öngörülen transkripsiyon faktörü tarafından transkripsiyon düzenleme mekanizmasını tahmin ederek geleneksel CD spektroskopik tekniklerinin ilerlemesine yardımcı olur.
Kromatin remodeling, sıkıca paketlenmiş kromatin transkripsiyon faktörleri, DNA replikasyonu bileşenleri veya hasar onarım proteinleri gibi çeşitli düzenleyici faktörler için erişilebilir hale getirerek DNA metabolik süreçlerini düzenlediği bilinen iyi tanımlanmış bir mekanizmadır. SWI/SNF protein ailesi olarak da bilinen ATP'ye bağımlı kromatin remodelerleri, ökaryotik hücrelerde bulunan anahtar remodeler proteinlerdir18,19. Filogenetik kümeleme, SWI/SNF protein ailesini 6 alt gruba ayırmıştır20: Snf2 benzeri, Swr1 benzeri, SSO1653 benzeri, Rad54 benzeri, Rad5/16 benzeri ve uzak. Bu çalışmada ilgi çekici protein olan SMARCAL1, uzak alt gruba aittir20. Bu protein, CD spektroskopisi kullanılarak transkripsiyonal regülasyon şeklini araştırmak için kullanılmıştır.
ATP'ye bağımlı kromatin remodeling proteinlerinin üyelerinin çoğunun nükleozomları yeniden konumlandırdığı veya tahliye ettiği veya histone varyant değişimine ATP'ye bağımlı bir şekilde aracılık ettiği gösterilmiştir21,22. Ancak, bu ailenin bazı üyelerinin nükleozomları yeniden şekillendirdiği gösterilmemiştir, örneğin SMARCAL1. Çalışmalar SMARCAL1'in politen kromozomlarla ilişkili olduğunu göstermiş olsa da, nükleozomları yeniden şekillendirme yeteneğine ilişkin deneysel kanıtlar eksiktir23. Bu nedenle, SMARCAL1'in DNA24 konformasyonunu değiştirerek transkripsiyon düzenleyebileceği ileri sürüldü. CD spektroskopisi, bu hipotezi doğrulamak için kolay ve erişilebilir bir yöntem sağladı.
SMARCAL1, öncelikle tavlama helicase25,26,27 olarak işlev gören atp bağımlı kromatin remodeling proteinidir. DNA konformasyonunu yeniden şekillendirerek transkripsiyonu modüle etmek için postülasyon edilmiştir24. Bu hipotezi test etmek için, doksrubisin kaynaklı DNA hasarı sırasında gen transkripsiyonunun düzenlenmesinde SMARCAL1'in rolü incelenmiştir. Bu çalışmalarda in vivo analiz için SMARCAL1, in vitro tahliller için ADAAD kullanılmıştır28,29. Önceki çalışmalar ADAAD'ın DNA'yı yapıya bağımlı ancak diziden bağımsız bir şekilde tanıyabileceğini göstermiştir30,31. Protein, kök döngü DNA'sına benzer şekilde tek iplikli geçiş bölgelerine çift iplikli dna moleküllerine en uygun şekilde bağlanır ve ATP 30,31'i hidroller.
In vivo deneyler, SMARCAL1'in organizatör bölgelerine bağlanarak MYC, DROSHA, DGCR8 ve DICER'ın ifadesini düzenlediğini gösterdi28,29. Etkileşim bölgesi ChIP deneyleri ile belirlendi28,29. ChIP tekniği, bir proteinin hücre içindeki konyak DNA'sı ile etkileşimini analiz etmek için kullanılır. Amacı, organizatörler veya diğer DNA bağlama bölgelerindeki transkripsiyon faktörleri gibi belirli proteinlerin belirli genomik alanlara bağlı olup olmadığını belirlemektir. DNA'ya bağlı protein ilk olarak formaldehit kullanılarak çapraz bağlanır. Bunu kromatin izolasyonu takip ediyor. İzole kromatin, sonikasyon veya nükleaz sindirimi ile 500 bp parçaya yamaçlanır ve DNA'ya bağlı protein, proteine özgü antikorlar kullanılarak bağışıklık sistemine bağlıdır. Çapraz bağlama tersine çevrilir ve DNA polimeraz zincir reaksiyonu (PCR) veya nicel gerçek zamanlı PCR kullanılarak analiz edilir.
ChIP sonuçları, SMARCAL1'in bu genlerin promotör bölgelerinde konformasyonel bir değişiklik yaratarak transkripsiyonel düzenlemeye aracılık ettiği hipotezine yol açtı. QGRS haritalayıcı ve Mfold yazılımı, bu organizatör bölgelerinin ikincil yapılar oluşturma potansiyelini belirlemek için kullanıldı28,29. QGRS eşleyici G-quadruplexes32'yi tahmin etmek için kullanılırken, Mfold33 bir sıranın kök döngüler gibi ikincil yapılar oluşturma yeteneğini analiz eder.
İkincil yapı analizinden sonra, Escherichia coli34'ten arındırılmış SMARCAL1'in sığır homologu olan rekombinant 6X His etiketli Aktif DNA'ya bağımlı ATPase A Domain (ADAAD) ile daha fazla in vitro deney yapıldı. ATPase tahlilleri ADAAD kullanılarak gerçekleştirildi ve tanımlanan DNA dizilerinin efektör olarak işlev görebileceğini belirledi28,29. Son olarak ADAAD28,29 tarafından DNA molekülünde indüklenen konformasyon değişikliklerinin izlenmesi için CD spektroskopisi yapıldı.
Proteinin ATPase aktivitesinin DNA molekülünde konformasyonel bir değişime neden olmak için gerekli olduğunu kanıtlamak için, şelat Mg +2'ye etilenediamin tetraasetik asit (EDTA) veya SWI/SNF proteininin spesifik bir inhibitörü olan Aktif DNA'ya bağımlı ATPase A Domain Inhibitörü Neomycin (ADAADiN) eklendi35.36 . Bu CD spektroskopik tekniği, chIP veya diğer ilgili testlerle bir organizatörün tahmin edilen genomik bölgesine bağlanmak için gösterilen herhangi bir saflaştırılmış proteinle kullanılabilir.
Protokol
1. Reaksiyon bileşenlerinin çalışma konsantrasyonu
- CD ve diğer reaksiyon bileşenleri için çalışan tampon konsantrasyonlarını yeni bir şekilde hazırlayın ( bkz. Tablo 1) ve reaksiyonları ayarlamadan önce 4 °C'de tutun.
NOT: Bu makalede açıklanan CD reaksiyonları için bileşenlerin çalışma konsantrasyonları aşağıdaki gibidir: Sodyum fosfat tamponu (pH 7.0) 1 mM, ATP 2 mM, DNA 500 nM, Protein 1 μM, MgCl2 10 mM, EDTA 50 mM, ADAADiN 5 μM.
2. ATPase etkinliği
- CD spektroskopisinden önce, CD spektroskopisinde kullanılan proteinin aktif olduğundan emin olmak ve ATP hidrolizini ortaya çıkarmakta en uygun şekilde etkili olan DNA moleküllerini tanımlamak için DNA moleküllerinin varlığında proteinin ATPase aktivitesini oluşturun.
- Aşağıdaki iki reaksiyondan oluşan NADH bağlantılı bir oksidasyon testi ile farklı DNA moleküllerinin varlığında proteinin ATPase aktivitesini ölçün.
- 0,1 μM ADAAD, 2 mM ATP, 10 nM DNA ve 1x REG tamponu 96 kuyulu bir plakada 250 μL'lik son hacme karıştırın.
NOT: Pyruvate kinaz enzimi, fosphoenolpyruvate'yi piruvata dönüştürmek için ADP ve Pi'yi kullanır, böylece ATP'yi yeniler. Bu, ATP'nin reaksiyonda her zaman doygun bir konsantrasyonda olmasını sağlar. İkinci reaksiyonda, piruvat kinazın etkisiyle oluşan piruvat, laktat dehidrogenaz tarafından laktata dönüştürülür. Bu reaksiyonda, bir NADH molekülü NAD+ ile oksitlendi. NADH tüketimi molekülün emiciliği 340 nm olarak ölçülerek ölçülür. - Bir inkübatörde 37 °C'de 30 dakika kuluçkaya yatır.
- Bir mikro plaka okuyucu kullanarak NAD+ miktarını 340 nm olarak ölçün.
- NAD+ miktarını ölçmek için mikro plaka okuyucu ile birlikte sağlanan yazılımı kullanın.
- Absorbansı 340 nm olarak ölçmek için NADH testine tıklayın.
- 96 kuyu plakasını aletteki plaka tutucusuna yerleştirin. Emiciliği kaydetmek için Plakayı Oku düğmesine tıklayın.
NOT: NAD+ konsantrasyonu, NADH'nin azı dişi yok olma katsayısı eq (1) kullanılarak 6,3 mM−1 olarak hesaplanır.
A = φcl (1)
Burada, A = Absorbans
ε = Molar yok olma katsayısı
c = Molar konsantrasyonu
l = Cm olarak optik yol uzunluğu
- 0,1 μM ADAAD, 2 mM ATP, 10 nM DNA ve 1x REG tamponu 96 kuyulu bir plakada 250 μL'lik son hacme karıştırın.
3. CD cuvettes seçimi ve hazırlanması
- Cd spektrumlarını yüksek saydamlıklı kuvars cuvettes'te toplayın. Dikdörtgen veya silindirik cuvettes kullanın.
NOT: Bu makalede açıklanan tüm reaksiyonlar için bir CD kuvars cuvette (nominal hacim 0,4 mL, yol uzunluğu 1 mm) kullanılmıştır. - Cuvette temizlemek için bir cuvette temizleme çözeltisi kullanın. Çözeltinin 400 μL'sini yapmak için suya% 1 cuvette temizleme çözeltisi ekleyin, cuvette dökün ve 1 saat boyunca 37 ° C'de kuluçkaya yatırın.
- Cuvette'i temizlemek için birkaç kez suyla yıkayın. Temiz olup olmadığını kontrol etmek için cuvetteki suyu veya tamponu tarayın.
NOT: Su veya tampon 0 ila 1 mdeg aralığında bir okuma vermelidir.
4. Proteinlerin ve DNA oligonükleotidlerinin hazırlanması
- Bazen belirsiz zirvelerin oluşumuna neden olan tampon bileşenlerinin miktarlarını en aza indirmek için reaksiyonda proteinin hacmini 50 μL'nin altında tutun. Herhangi bir bozulmayı önlemek için proteini deney boyunca buzun üzerinde tutun.
- Reaksiyonlarda PAGE saflaştırılmış DNA oligonükleotidleri kullanın.
NOT: Burada açıklanan reaksiyonlarda DNA hem doğal hem de ısı soğutmalı formlarda (hızlı soğutulmuş (FC) ve yavaş soğutulmuş (SC) olarak kullanılmıştır. Hızlı soğutma, DNA'da intramoleküler bağlanmayı teşvik ederek daha fazla ikincil yapı elde eder. Buna karşılık, yavaş soğutma DNA'da intermoleküler bağlanmayı teşvik eder ve daha az ikincil yapıya neden olarak ortaya çıkardı. - Hızlı soğutma için, ıSıTMA bloğunda 3 dakika boyunca 94 °C'de DNA ısıtın ve hemen buz üzerinde soğutun. Yavaş soğutma için DNA'yı 94 °C'de 3 dakika ısıtın ve dakikada 1 °C hızında oda sıcaklığına soğumasını bekleyin.
5. Temel spektrumları kaydetmek için kontrol deneyleri ayarlama
- Tüm reaksiyonlarda reaksiyon hacmini 300 μL'de tutun. 1,5 mL santrifüj tüplerinde tek tek toplam 5 temel reaksiyonun ayarını aşağıdaki gibi ayarlayın: i) Tampon + Su; ii) Tampon + MgCl2 + ATP + Su; iii) Tampon + MgCl2 + ATP + Protein + Su; iv) iii + EDTA veya ADAADiN; v) Tampon + Protein +Su.
6. Deneyleri CD spektrumunu kaydedecek şekilde ayarlama
- 1,5 mL santrifüj tüplerinde tek tek toplam 5 reaksiyonun aşağıdaki gibi kurulması: i) Tampon + DNA + Su; ii) Tampon + DNA + MgCl2 + ATP + Su; iii) Tampon + DNA + MgCl2 + ATP + Protein + Su; iv) iii + EDTA veya ADAADiN; v) Tampon + DNA + Protein +Su.
7. Kayıt taraması
- Gazı açın ve CD spektrometresini açın.
- 10-15 dk sonra lambayı aç. Su banyoyu aç ve tutucu sıcaklığını 37 °C'ye ayarla.
- CD spektrum yazılımını açın.
- Sıcaklığı 37 °C olarak ayarlayın.
- Dalga boyu aralığını 180 - 300 nm olarak ayarlayın.
- Nokta başına süreyi 0,5 sn olarak ayarlayın.
- Tarama numarasını 5 olarak ayarlayın.
- Pro-Data Viewer'a tıklayın, yeni bir dosya yapın ve deneme ve tarihle ilgili ayrıntılarla yeniden adlandırın.
- Herhangi bir bozulmayı önlemek için tüm reaksiyon bileşenlerini buzda tutun. Taban çizgilerini ve reaksiyonları tek tek santrifüj tüplerinde yapın ve pipetleme ile karıştırın. Reaksiyon karışımını cuvette'e dikkatlice aktarın, hava kabarcıkları olmadığından emin olun.
- Bir zaman kursu deneyi yapıyorsanız, reaksiyonları gerekli süre boyunca 37 °C'de kuluçkaya yatırın ve taramayı yapın. ATP hidrolizi durdurmak için DNA, ATP, Mg+2 ve protein içeren tampona EDTA ekleyin.
- ATPase aktivitesini tamamen inhibe etmek için EDTA konsantrasyonunu ve kuluçka süresini artırın.
- Yazılımdaki karşılık gelen reaksiyonlardan taban çizgilerini çıkarın (örneğin, reaksiyon 1'i temel 1'den çıkarın). CD spektrum yazılımındaki veya veri çizim yazılımındaki verileri yumuşatın. Veri çizim yazılımındaki verileri çizin.
NOT: Karşılık gelen reaksiyonlardan taban çizgilerinin çıkarılması, net CD'ye yalnızca DNA'nın spektrumunu verecektir.
8. Veri analizi ve yorumlanması
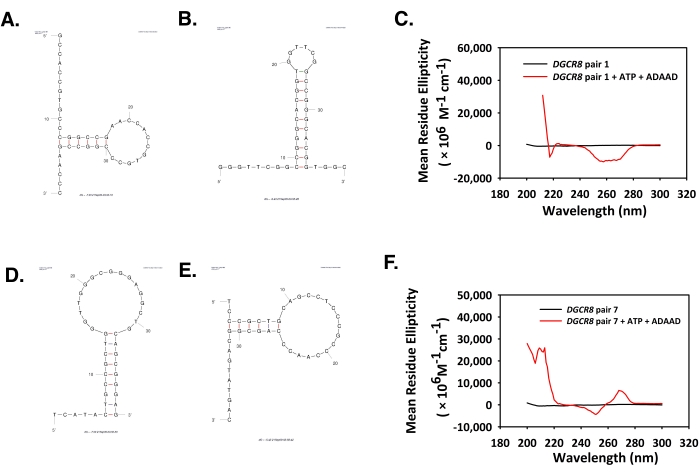
- Milidegrelerde elde edilen değerleri kalıntı eliptikliği anlamına getirmek için eq (2) tarafından verilen formülü kullanın.
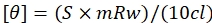 (2)
(2)
Burada, S milidegrelerde CD sinyali, c mg/mL'deki DNA konsantrasyonu, mRw ortalama kalıntı kütlesi ve l cm cinsinden yol uzunluğudur. - Veri çizim yazılımını kullanarak dalga boyu ve ortalama kalıntı eliptikliğine karşı bir grafik çizin ve zirveleri analiz edin.
- Grafiği çizmek için, Y eksenindeki ortalama kalıntı eliptikliğini ve X eksenindeki dalga boylarını seçin ve düz bir çizgi grafik çizin.
NOT: Bu grafik, farklı DNA formlarının karakteristik zirvelerini sağlayacaktır. Zirvelere karşılık gelen DNA formları mevcut literatür kullanılarak tanımlanabilir6.
Sonuçlar
ADAAD, MYC promotöründeki yapı gibi bir kök döngüyü stabilize eder
Önceki deneysel kanıtlar, SMARCAL1'in MYC29'un negatif bir düzenleyicisi olduğunu göstermiştir. MYC geninin 159 bp uzunluğundaki promotör bölgesinin QGRS haritacısı tarafından analizi, ileri telin bir G-quadruplex oluşturma potansiyeline sahip olduğunu göstermiştir (Tablo 2). Mfold, MYC DNA'sının her iki ipliğinin de kök döngü benzeri bir yapı oluşturabileceğini göstermiştir (Tablo 2). G-quadruplex (GECE) içeren 34 bp uzunluğunda bir DNA dizisi sentezlendi. GECE oligonükleotidinin ileri ve ters dizisinin Mfold yapıları Şekil 1A,B'de gösterilmiştir.
6X His-ADAAD kullanan ATPase tahlilleri, hızlı soğutulmuş GECE'nin yerli ve yavaş soğutulmuş formlardan daha iyi bir efektör olduğunu gösterdi. Bu nedenle, ATP ve ADAAD'ın yokluğunda ve varlığında CD spektrumunu kaydetmek için hızlı soğutulmuş GECE kullanılmıştır. CD spektrumu, ADAAD'ın 269 nm'de omuzlu 258 nm'de iki pozitif zirve-bir ve DNA'da 210 nm'de daha büyük bir tepeye neden olduğunu göstermiştir (Şekil 1C). 240 nm civarında negatife doğru bir düşüş de gözlendi. Bu spektrum, ADAAD'ın en uygun efektörü olan sentetik kök döngü DNA'sı protein ve ATP ile inkübe edildiğinde elde edilen spektruma benzerdi (Şekil 2A,B). Tripleks DNA benzer bir spektrum37 verebilir, bu da proteinin bu durumda böyle bir yapıya neden olabileceği hipotezine yol açabilir. ATP, Mg+2 ile bir koordinasyon kompleksi oluşturur ve bu katyon ATP hidrolizi için gereklidir. EDTA'nın eklenmesi Mg+2'yi chelates, ATP hidrolizinin inhibisyonunu yol açtı38. Bu nedenle, ADAAD tarafından ATP hidrolizinin konformasyonel değişim için önemli olup olmadığını anlamak için reaksiyon karışımına EDTA eklenmiştir. Reaksiyona EDTA'nın eklenmesi bu uyumu olumsuzlar. CD spektrumları artık negatif 210 nm tepe noktasına ve 230 ve 250 nm'de zirveleri olan geniş bir pozitif banda sahiptir (Şekil 1C).
ATPase etkinliğinin önemi, ADAAD'ın ATPase-dead mutant'ı kullanılarak da doğrulandı. K241A mutasyonu, I motifinin korunmuş GKT kutusunda meydana gelir ve bu mutantın daha önce DNA31 varlığında ATP'yi hidrol işleme yeteneğinden yoksun olduğu gösterilmiştir. Mutant protein GST etiketi ile ifade edildi ve glutatyon benzeşimi kromatografisi kullanılarak saflaştırılmıştır. Bu mutant tarafından MYC DNA'sında indüklenen konformasyonsal değişim, vahşi tip ADAAD'ın indüklediğinden farklıydı. Mutant proteinin varlığında MYC DNA'sının CD spektrumu pozitif 210 nm tepeye ve negatif 260 nm tepeye sahipdi (Şekil 1D).
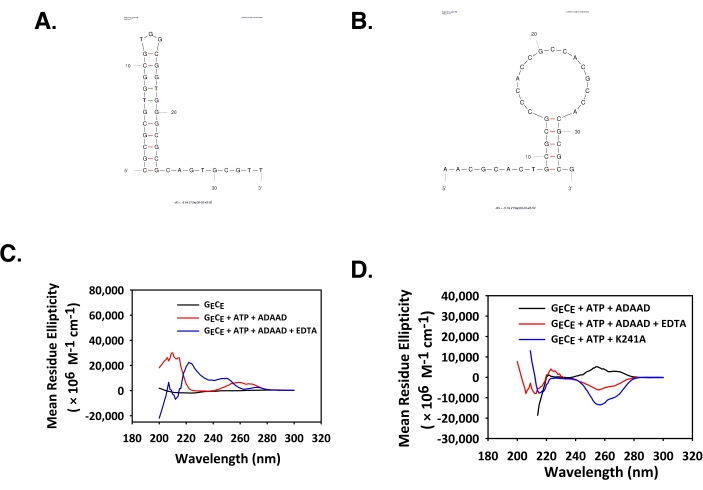
ADAAD, DROSHA organizatöründe A-form uyumunu teşvik eder
DROSHA, DGCR8 ve DICER'in organizatör bölgeleri de QGRS haritalayıcı ve Mfold yazılımı tarafından analiz edildi. Hem QGRS hem de MFold, organizatör bölgelerinin G-quadruplex ve stem benzeri yapılar oluşturma potansiyeline sahip olduğunu göstermiştir (Tablo 2). İleri ve ters oligonükleotidlerin Mfold yapıları Şekil 3A,B'de gösterilmiştir. ATPase aktivitesi, yerli ve ısı soğutmalı DNA'nın benzer şekilde davrandığını gösterdi. Bu nedenle, CD çalışmaları için bu DNA dizilerinin yavaş soğutulmuş formu kullanılmıştır. CD spektrumu, ADAAD'ın DROSHA promotöründe 210 nm'de negatif bir zirveye ve 260 nm'de pozitif bir zirveye neden olduğunu gösterdi (Şekil 3C). Bu spektrum A-DNA6'nın bir özelliğidir.
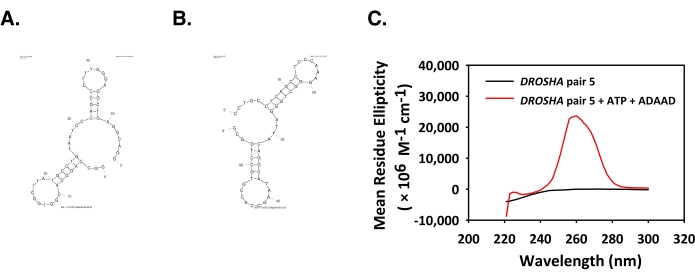
ADAAD, DGCR8 promotöründe B-X geçişine ve G-quadruplex oluşumuna neden olur
İlerinin Mfold yapıları ve kullanılan oligonükleotidlerin ters iplikçikleri Şekil 4A,B'de gösterilmiştir. DGCR8 çift 1 (Şekil 4C) için 210 nm'de pozitif bir zirve ve 260 nm'de geniş bir negatif zirve gözlenmiştir. Bu spektrum B-X geçişinin karakteristiğidir6. İlerinin Mfold yapıları ve kullanılan oligonükleotidlerin ters iplikçikleri Şekil 4D, E'de gösterilmiştir. DGCR8 çift 7'nin CD spektrumu 210 ve 270 nm'de güçlü bir pozitif zirve ve 250 nm'de negatif bir zirve gösterdi (Şekil 4F). Bu spektrum paralel G-dörtgen DNA yapılarının karakteristiğidir6.
ADAAD, DICER organizatöründe A-X geçişine neden oldu
İleri ve ters oligonükleotidlerin Mfold yapıları Şekil 5A,B'de gösterilmiştir. Dicer çifti 1 (Şekil 5C) için 210 nm'de pozitif bir zirve ve 230 nm'de iki negatif zirve-bir ve 260 nm zirvede diğeri gözlenmiştir. Bu zirveler A-X DNA geçişinin karakteristiğidir6,9. Transkripsiyon sürecinde belirli rollere sahip tüm CD spektrum zirveleri ve DNA formları Tablo 3'te özetlenmiştir.
Şekil 1: ADAAD, GECE DNA'sının konformasyonunu değiştirir. (A) ileri iplikçik ve (B) ters iplikçik için mfold yapılar tahmin edildi. (C) sadece GECE CD spektrumları (siyah), GECE ATP ve ADAAD ile kuluçkaya yatırıldı önce (kırmızı) ve EDTA (mavi) ekledikten sonra. (D) GECE CD spektrumu ATP ve GST etiketli ADAAD ile kuluçkaya yatırıldı (siyah) ve EDTA (kırmızı) ekledikten sonra, ATP ve GST etiketli K241A mutant (mavi) ile inkübe GECE CD spektrumu. Bu rakam 29'dan değiştirilmiştir. Kısaltmalar: ADAAD = Aktif DNA'ya bağımlı ATPase A Domain; CD = dairesel dikroizm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: ADAAD, slDNA'nın konformasyonunu değiştirir. (A) Kök döngü DNA'sı için öngörülen Mfold yapısı. (B) SADECE SLDNA CD spektrumları (siyah), ATP ve ADAAD (kırmızı) ile inkübe edilmiş slDNA. Bu rakam 29'dan değiştirilmiştir. Kısaltmalar: ADAAD = Aktif DNA'ya bağımlı ATPase A Domain; slDNA = kök döngü DNA'sı; CD = dairesel dikroizm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3: ADAAD, DROSHA çifti 5 DNA'nın konformasyonunu değiştirir. (A) ileri iplikçik ve (B) ters iplikçik için tahmin edilen mfold yapısı. (C) DROSHA çiftinin CD spektrumları sadece 5 DNA (siyah), DROSHA çifti 5 DNA ATP ve ADAAD (kırmızı) ile inkübe edildi. Bu rakam 28'den değiştirilmiştir. Kısaltmalar: ADAAD = Aktif DNA'ya bağımlı ATPase A Domain; CD = dairesel dikroizm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 4: ADAAD, DGCR8 çift 1 ve 7 DNA'nın konformasyonunu değiştirir. DGCR8 çift 1 oligonükleotid(A) ileri iplikçik ve (B) ters iplikçik için tahmin edilen mfold yapıları. (C) DGCR8 çift 1 tek başına (siyah), DGCR8 çift 1'in CD spektrumları ATP ve ADAAD (kırmızı) ile inkübe edilir. DGCR8 çift 7 oligonükleotid (D) ileri iplikçik ve (E) ters iplik için tahmin edilen Mfold yapıları. (F) CD spektrumları DGCR8 çift 7 tek başına (siyah), DGCR8 çift 7 ATP ve ADAAD (kırmızı) ile inkübe. Bu rakam 28'den değiştirilmiştir. Kısaltmalar: ADAAD = Aktif DNA'ya bağımlı ATPase A Domain; CD = dairesel dikroizm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
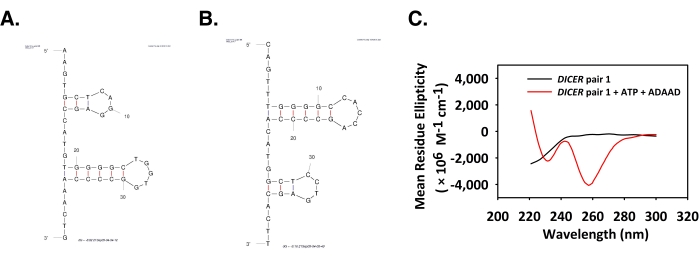
Şekil 5: ADAAD, Dicer çifti 1 DNA'nın konformasyonunu değiştirir. (A) ileri iplikçik ve (B) dicer çifti 1 oligonükleotid ters iplikçik için tahmin edilen mfold yapısı. (C) TEKER çiftinin CD spektrumları 1 tek başına (siyah), DİkER çifti 1 ATP ve ADAAD (kırmızı) ile inkübe edilmiş. Bu rakam 28'den değiştirilmiştir. Kısaltmalar: ADAAD = Aktif DNA'ya bağımlı ATPase A Domain; CD = dairesel dikroizm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| 5x REG arabelleği | |
| Parça | Çalışma konsantrasyonu |
| Laktat dehidrogenaz (LDH) | 50 birim/mL |
| Magnezyum asetat (Mg(OAc)2) | 30 mM |
| Fosephoenolpyruvat (PEP) | 6.8 mg/mL |
| Pottasium asetat (KOAc) | 300 mM |
| Pyruvate kinaz (PK) | 50 birim/mL |
| Tris asetat (Tris-OAc) | 125 mM |
| β-mercaptoethanol (β-ME) | 25 mM |
Tablo 1: Arabellek bileşenleri.
| Oligonükleotidler | İleri sıra | ΔG (m-Fold) Kcal/mol | G-skoru (QGRS eşleyici) | Ters sıra | ΔG kcal/mol (Mfold tahmini) | G-skoru (QGRS eşleyici) | |||
| slDNA | GCGCAATTGCGCTCGA CGATTTTTTAGCGCAA TTGCGC | -16.36 | - | - | - | - | |||
| MYC GECE | CGCGCGTGGCGTGG CGGTGGGCGCGCA GTGCGTT | -8.64 | 19 | AACGCACTGCGCGCC CACCGCCACGCCA CGCGCG | -5.74 | - | |||
| DROSHA Çifti 5 | GGCCAGGCACGGTG GCTTATGCCTGTAAT CCCAGCCCTTTGGGA GGCTGAGGCAGG | -10.18 | 19, 19 | CCTGCCTCAGCCTCC CAAAGGGCTGGGATT ACAGGCATAAGCCAC CGTGCCTGGCC | -10.95 | - | |||
| DGCR8 Çifti 1 | GCCACCGTGCCCGG CCGAACCACCGTGC CCGGCCGAACCC | -7.9 | - | GGGTTCGGCCGGG CACGGTGGTTCGG CCGGGCACGGTGGC | -9.4 | 21 | |||
| DGCR8 Çifti 7 | TCATACTGCCGCTG GGTTGGGCGGGAG GCTGCAGCGGGAG | -7.99 | 33 | TCCCGCTGCAGCCT CCCGCCCAACCCAG CGGCAGTATGAC | -5.43 | - | |||
| DİkER Çifti 1 | AAGTGCTCAGGAG CCATGTGGGGCTG GTGGCCCCAAACTG | -8.82 | 19 | CAGTTTGGGGCCAC CAGCCCCACATGGC TCCTGAGCACTT | -9.16 | - | |||
Tablo 2: Oligonükleotid dizileri. Tüm diziler 5'-3' yönünde. Kısaltmalar: slDNA = kök-döngü DNA'sı.
| Oligonükleotidler | CD Spectra Peaks in nm (ATP ve ADAAD ile kuluçkadan sonra) | DNA formu | Transkripsiyondaki Rolü |
| slDNA | +215, +250, +272 | Tripleks | Baskı |
| MYC GECE | +210, +258, +269 | Tripleks | Baskı |
| DROSHA Çifti 5 | -210, +260 | A-DNA | Başlatma/Etkinleştirme |
| DGCR8 Çifti 1 | +210,-260 | B-X Geçişi | Pozitif süpercoiling/Aktivasyon |
| DGCR8 Çifti 7 | +210, -250, +270 | G-dörtgen | Etkinleştirme |
| DİkER Çifti 1 | +210, -230, -257 | A-X Geçişi | Pozitif süpercoiling/Aktivasyon |
Tablo 3: Transkripsiyondaki rolleri ile farklı DNA formlarına karşılık gelen CD spektrum zirvesi. Kısaltmalar: ADAAD = Aktif DNA'ya bağımlı ATPase A Domain; CD = dairesel dikroizm.
Tartışmalar
Bu makalenin amacı, ATP'ye bağımlı kromatin remodeling proteinlerinin varlığında DNA'da meydana gelen konformasyonsal değişiklikleri incelemek ve bu konformasyonsal değişiklikleri gen ekspresyona bağlamak için bir yaklaşım olarak CD spektroskopi tekniğini tanıtmaktır. CD spektroskopisi, DNA'daki konformasyon değişikliklerini incelemek için hızlı ve kolay erişilebilir bir yöntem sağlar.
Bu teknik için dikkat edilmesi gereken önemli bir nokta DNA ve proteinin saflığıdır. Hem DNA hem de proteinin % 95 saf > emin olunması önerilir. PAGE-saflaştırılmış oligonükleotidler testte kullanılmalı ve protein tercihen% 95 saflık > benzeşim saflaştırılmalıdır. Diğer kritik parametre, cuvette'in temel okumanın 1 mdeg'i geçmeyecek şekilde temiz olması gerektiğidir. Tamponlar otomatik kapatılmış su kullanılarak yapılmalı ve arabelleğin taban çizgisi okuması 1 mdeg'i geçmemelidir. Organizatörün konformasyonunu incelemek için, proteinin bağlandığı bölgeleri belirlemek önemlidir. Bu nedenle, bu işlem protein tarafından bağlanan efektör geninin promotör bölgesinde bulunan DNA dizilerini tanımlamaya yardımcı olduğu için ilgi çekici proteini kullanarak ChIP deneyleri yapılması tavsiye edilir. Bölge tanımlandıktan sonra, dizinin belirli yapıları benimseme yeteneği mevcut biyoinformatik araçları kullanılarak analiz edilebilir. ChIP astarları genellikle 200 bp uzunluğunda olduğundan ve birden fazla uygunluk olabileceğinden bu önemlidir. Bu nedenle, yapıları tanımlamak için biyoinformatik aletlerin kullanılması, oligonükleotid uzunluğunu tek bir yapıya kısaltmaya yardımcı olacaktır.
Son olarak, ilgi proteini ATP'ye bağımlı bir kromatin remodeling proteini ise, oligonükleotidlerin efektör olarak hareket etme yeteneği ATPase tahlilleri kullanılarak kontrol edilmelidir. Hem CD spektroskopisi hem de ATPase tahlillerinde, reaksiyonda doygunluk konsantrasyonlarında ligandların kullanılmasına dikkat edilmelidir. Mümkünse, CD spektroskopisi ile devam etmeden önce protein-ligand etkileşimi için ayrışma sabiti (Kd) hesaplanmalıdır. Bağlama parametresini hesaplamak için çok sayıda yöntem mevcuttur. ATPase tahlilleri kullanılarak, Michaelis-Menten sabiti (KM) artan DNA konsantrasyonları titrating ile hesaplanabilir. KM, çoğu durumda, bağlama sabitine yaklaşık olarak tahmin edilebilir. Protein floresan ise, bağlama sabitleri floresan spektroskopisi kullanılarak hesaplanabilir. Bu tekniklerden her ikisi de mümkün değilse, elektroforezi hareket kabiliyeti kayması tahlil (EMSA) kullanılabilir.
CD spektroskopisi ile ilgili temel sorun, cuvettes temizlenmediğinde veya reaktifler saf olmadığında ortaya çıkar. Taban çizgisi çok yüksekse, cuvettes'in temizlenmesi tavsiye edilir. Çok sayıda cuvette temizleme soli mevcuttur. Cuvettes'i 16-24 saat boyunca seyreltilmiş bir asit çözeltisine yerleştirmek de cuvette'in temizlenmesine yardımcı olur. %95 saf > reaktif satın alınması ve çift damıtılmış ve otoklavlı su kullanılması tavsiye edilir. Temel sürüklenme başka bir olası sorundur. Uzun süreli bir deneme yapıyorsanız, taban çizgisini periyodik olarak kontrol etmeniz önerilir. Protein-DNA etkileşimlerini incelerken DNA'nın zirveleri, sadece DNA ile elde edilen zirvelere/bantlara tam olarak karşılık gelmeyebilir. Protein zirveleri genellikle 190 ila 230 nm arasındaki Uzak UV aralığında görülür. Bu nedenle, 250 nm'nin altındaki zirvelerde protein zirvesinden parazit olabilir ve güvenilir bilgi sağlamayabilir. DNA, diziye bağlı olarak B olmayan çeşitli konformasyonları benimseyebilir. DNA dizisi ne kadar uzun olursa, DNA oligonükleotid içinde birden fazla uyumun birlikte var olma olasılığı o kadar yüksektir. Bu, analizi zorlaştırabilir. Bu nedenle, biyoinformatik araçlar tarafından tahmin edilen potansiyel yapılara karşılık gelen daha kısa oligonükleotidlerin kullanılması tavsiye edilir.
CD spektroskopisinin diğer önemli dezavantajı, atomik düzeyde yapı analizine izin vermemesi ve elde edilen spektrumun tek uygulanabilir yapıyı tanımlamak için yetersiz olmasıdır. Örneğin, hem X-ışını kristalografisi hem de protein NMR spektroskopisi atomik çözünürlük verileri sağlarken, CD spektroskopisi daha az ayrıntılı yapısal bilgi sağlar. Bununla birlikte, CD spektroskopisi, büyük miktarlarda protein veya önemli miktarda veri işleme gerektirmeyen hızlı bir yaklaşımdır. Sonuç olarak, CD sıcaklık, pH, tuzluluk ve çeşitli kofaktörlerin varlığı gibi çok çeşitli çözücü değişkenlerini araştırmak için kullanılabilir. Dinamik sistemlerdeki yapısal değişiklikleri (karmaşık oluşum, katlanma/açılma, sıcaklığa bağlı denatürasyon, denatürantlar ve amino asit dizilme/mutasyonundaki değişiklikler nedeniyle) izlemek için de kullanılabilir. Stop-flow aparatına bağlayarak, protein/DNA-ligand etkileşimlerinin kinetiğini incelemek için de kullanılabilir.
İyi karakterize DNA uyumluları arasında A/B/Z DNA, tripleks, saç tokası ve G-kuadruplexler bulunur. Tüm bu DNA formları açık bir DNA uyumu ile ilişkilidir, yani negatif süper tepme için lavabo görevi gören unwound DNA. Transkripsiyon, açık bir kompleksin oluşumu RNA polimerazının hareketi için bir ön koşul olduğu için negatif süpercoiling ile ilişkilidir. Bu nedenle, çoğu genin transkripsiyon, organizatör bölgesinde artan negatif süpercoiling içerir. Çalışmalar, nükleozomların ortaya çıkmasının A-DNA uyumluluğuna yol açtığını göstermiştir, ancak kararsızdır39. Bir olasılık, örneğin SMARCAL1 gibi ilgi proteininin bu tür yapılara bağlanması ve stabilize edilmesidir, böylece DROSHA organizatörlerinde görüldüğü gibi transkripsiyon kolaylaştır. Guanin dörtlüks, Hoogsteen hidrojen bağları ile bağlanmış guanin tetradlarına dayanır. Siliko analizinde , G4 oluşturan dizilerin gen organizatörlerine ve transkripsiyon başlangıç bölgelerine proksimal olarak zenginleştirilmiş olduğunu doğrulamıştır. Bu G4 dizileri hem transkripsiyonunu etkinleştirebilir hem de baskılayabilir.
MYC promotörü40 durumunda, G-quadruplex oluşumu bir baskılayıcı görevi görürken, insan vasküler endotel büyüme faktörü (VEGF) durumunda, G-quadruplex yapısı transkripsiyon faktörleri için bir yerleştirme alanı olarak işlev görür41, böylece bu genin ekspresyonunu aktive eder. SMARCAL1 durumunda, ADAAD DGCR8 çifti 7 promotör dizileri ile etkileşime girdiğinde G-quadruplex yapısı gözlendi. Bu astar çiftinde SMARCAL1 ve RNAPII'nin doluluğu arttıkça, G-quadruplex oluşumunun bu durumda bu genin transkripsiyon aktivasyonu ile ilişkili olduğu varsayılmıştır. DNA da pozitif olarak süpercoiled olabilir ve RNA polimerazın ilerlemesinin önünde pozitif süpercoiling ürettiği bilinmektedir. Bu transkripsiyonla oluşturulan (+) süpercoiling, yol bloğu proteinlerini bozabilir veya ortadan kaldırabilir, DNA'yı RNA polimeraz için daha erişilebilir hale getirmek için nükleozom yapıları istikrarsızlaştırabilir. X-DNA'sı, pozitif süpercoiling için lavabo görevi görür DNA'nın bir uyumudur. Bir X-DNA'nın çarpıcı özelliği, bir genin organizatörü üzerinde sıraya özgü bir şekilde oluşabilmesidir. SMARCAL1 durumunda ADAAD, SıRASıYLA Dicer ve DGCR8 organizatörlerinde ATP'ye bağımlı bir şekilde A-X ve B-X geçişlerini indüklemiştir. Doksofobikin kaynaklı DNA hasarı varlığında bu organizatörlerde artan SMARCAL1 ve RNAPII doluluğunun bulunduğu in vivo verilerle birlikte, X-DNA oluşumunun engelleri/blokları kaldırarak transkripsiyonu kolaylaştırdığı varsayılabilir. Üçlü DNA helislerinin karakteristik bir spektrumu yok. MYC promotöründe ve sentetik kök döngü DNA'sında bulunan DNA dizilerinin CD spektrumu, 269 nm'de omuzlu 258 nm'de iki pozitif zirve-bir ve DNA'da 210 nm'de daha büyük bir zirve gösterdi. Bu spektrum türü tripleks37 durumunda elde edilebilir. Triplekslerin gevşemesi zordur ve bu nedenle transkripsiyonun engellenmesi bilinmektedir42. Bu nedenle, bu yapının SMARCAL1 tarafından c-MYC promotöründe oluşumunun transkripsiyonun baskılanmasına yol açtığı varsayılıyor.
ATP'nin aynı zamanda ATP'ye bağımlı kromatin remodeling proteinlerine bağlandığı belirtilmelidir. Bu proteinlerin helicaz etki alanının VI motifinde bulunan korunmuş arginin, proteinin γ-fosfat ile elektrostatik etkileşimler yoluyla etkileşime girer43. ADAAD durumunda, protein-ATP etkileşiminin Kd'si (1,5 ± 0,1) × 10-6 M38'dir. ATP'nin bağlanması, proteinde DNA'nın benzeşimi artacak şekilde konformasyonsal bir değişikliğe neden olan bir değişime neden olandır. DNA'nın bağlanması, proteinde bir uyum değişikliğine neden olarak ATP31 için 10 kat daha fazla benzeşime yol açtı. Örneğin ADAAD durumunda -212 nm ve -222 nm'de bantlar/zirveler gözlenir. ATP ayrıca 197 nm, +210 nm, -222 nm, -247 nm ve -270 nm'de bantlar verir. Bunlar, ligandların varlığında DNA'nın "net" uyumunu elde etmek için DNA + ADAAD + ATP spektrumundan çıkarılmalıdır.
Bu nedenle, bu makale ATP'ye bağımlı kromatin remodeling proteinlerinin varlığında DNA'da meydana gelen konformasyon değişikliklerinin incelenmesi için CD spektroskopisinin rahatlığını göstermektedir. DNA uyumluluğundaki değişiklikleri ChIP verileriyle ilişkilendirerek, araştırmacılara DNA uyumlularının transkripsiyonu nasıl etkinleştirdiklerine /baskılayacaklarına dair bilgi sağlayabilir.
Açıklamalar
Yazarların beyan edecekleri bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar CD spektrofotometresi için JNU İleri Enstrümantasyon Araştırma Tesisi'ne teşekkür eder. V.J. ve A.D. CSIR'den bir bursla desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Fisher scientific | O3446I-100 | |
| Adenosine 5′-triphosphate disodium salt hydrate | Sigmaaldrich | A2383 | |
| CD Quartz Cuvette | STARNA | 21-Q-1 | |
| Chirascan V100 CD spectrometer | Applied Photophysics | Not available | |
| EDTA Disodium Salt Dihydrate | SRL | 43272 | |
| Glutathione Sepharose 4B | GE Healthcare | 17-0756-01 | Glutathione affinity chromatography |
| Hellmanex III cleaning solution | Hellma | 9-307-011-4-507 | |
| L-Lactic Dehydrogenase | Sigmaaldrich | L2625 | |
| Magnesium Acetate Tetrahydrate | Fisher scientific | BP215-500 | |
| Magnesium Chloride Hexahydrate | Fisher scientific | M33-500 | |
| NADH disodium salt | Sigmaaldrich | 10107735001 | |
| Phosphoenolpyruvate Monocyclohexylammonium Salt | SRL | 40083 | |
| Potassium Acetate | Fisher scientific | P178-3 | |
| Pyruvate Kinase | Sigmaaldrich | P1506 | |
| Sodium Phosphate Dibasic Anhydrous | Fisher scientific | S374-500 | |
| Sodium Phosphate Monobasic Monohydrate | Fisher scientific | S369-500 | |
| Synergy HT microplate reader | BioTek | Not available | |
| Tris Base | Fisher scientific | BP152-500 |
Referanslar
- Woody, R. W. Circular dichroism. Methods in Enzymology. 246, 34-71 (1995).
- Kelly, S., Price, N. The Use of Circular Dichroism in the Investigation of Protein Structure and Function. Current Protein & Peptide Science. 1 (4), 349-384 (2000).
- Rodger, A., Marshall, D. Beginners guide to circular dichroism. The Biochemist. 43 (2), 58-64 (2021).
- Greenfield, N. J. Using circular dichroism spectra to estimate protein secondary structure. Nature Protocols. 1 (6), 2876-2890 (2006).
- Kypr, J., Kejnovská, I., Bednářová, K., Vorlíčková, M. Circular Dichroism Spectroscopy of Nucleic Acids. Comprehensive Chiroptical Spectroscopy. , 575-586 (2012).
- Kypr, J., Kejnovska, I., Renciuk, D., Vorlickova, M. Circular dichroism and conformational polymorphism of DNA. Nucleic Acids Research. 37 (6), 1713-1725 (2009).
- Miyahara, T., Nakatsuji, H., Sugiyama, H. Helical Structure and Circular Dichroism Spectra of DNA: A Theoretical Study. The Journal of Physical Chemistry A. 117 (1), 42-55 (2013).
- Khomyakova, E. B. Parallel intramolecular DNA triple helix with G and T bases in the third strand stabilized by Zn2+ ions. Nucleic Acids Research. 28 (18), 3511-3516 (2000).
- Kypr, J., et al. The unusual X-form DNA in oligodeoxynucleotides: dependence of stability on the base sequence and length. Journal of Biomolecular Structure & Dynamics. 13 (6), 999-1006 (1996).
- Zohoorian-Abootorabi, T., Sanee, H., Iranfar, H., Saberi, M. R., Chamani, J. Separate and simultaneous binding effects through a non-cooperative behavior between cyclophosphamide hydrochloride and fluoxymesterone upon interaction with human serum albumin: multi-spectroscopic and molecular modeling approaches. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 88, 177-191 (2012).
- Sharifi-Rad, A., Mehrzad, J., Darroudi, M., Saberi, M. R., Chamani, J. Oil-in-water nanoemulsions comprising Berberine in olive oil: biological activities, binding mechanisms to human serum albumin or holo-transferrin and QMMD simulations. Journal of Biomolecular Structure & Dynamics. 39 (3), 1029-1043 (2021).
- Mokaberi, P., Babayan-Mashhadi, F., Amiri Tehrani Zadeh, Z., Saberi, M. R., Chamani, J. Analysis of the interaction behavior between Nano-Curcumin and two human serum proteins: combining spectroscopy and molecular stimulation to understand protein-protein interaction. Journal of Biomolecular Structure & Dynamics. 39 (9), 3358-3377 (2021).
- Danesh, N., et al. Determining the binding site and binding affinity of estradiol to human serum albumin and holo-transferrin: fluorescence spectroscopic, isothermal titration calorimetry and molecular modeling approaches. Journal of Biomolecular Structure & Dynamics. 36 (7), 1747-1763 (2018).
- Sadeghzadeh, F., et al. Characterizing the binding of angiotensin converting enzyme I inhibitory peptide to human hemoglobin: influence of electromagnetic fields. Protein and Peptide Letters. 27 (10), 1007-1021 (2020).
- Chamani, J., et al. Cooperative alpha-helix formation of beta-lactoglobulin induced by sodium n-alkyl sulfates. Journal of Colloid and Interface Science. 293 (1), 52-60 (2006).
- Dareini, M., et al. A novel view of the separate and simultaneous binding effects of docetaxel and anastrozole with calf thymus DNA: Experimental and in silico approaches. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 228, 117528 (2020).
- Dehghani Sani, F., et al. Changes in binding affinity between ofloxacin and calf thymus DNA in the presence of histone H1: Spectroscopic and molecular modeling investigations. Journal of Luminescence. 203, 599-608 (2018).
- Hargreaves, D. C., Crabtree, G. R. ATP-dependent chromatin remodeling: genetics, genomics and mechanisms. Cell Research. 21 (3), 396-420 (2011).
- Morettini, S., Podhraski, V., Lusser, A. ATP-dependent chromatin remodeling enzymes and their various roles in cell cycle control. Frontiers in Bioscience: A Journal and Virtual Library. 13, 5522-5532 (2008).
- Flaus, A., Martin, D. M. A., Barton, G. J., Owen-Hughes, T. Identification of multiple distinct Snf2 subfamilies with conserved structural motifs. Nucleic Acids Research. 34 (10), 2887-2905 (2006).
- Flaus, A., Owen-Hughes, T. Mechanisms for ATP-dependent chromatin remodelling: the means to the end. The FEBS Journal. 278 (19), 3579-3595 (2011).
- Mizuguchi, G., et al. ATP-driven exchange of histone H2AZ variant catalyzed by SWR1 chromatin remodeling complex. Science. 303 (5656), 343-348 (2004).
- Elizondo, L. I., et al. Schimke immuno-osseous dysplasia: SMARCAL1 loss-of-function and phenotypic correlation. Journal of Medical Genetics. 46 (1), 49-59 (2009).
- Baradaran-Heravi, A., et al. SMARCAL1 deficiency predisposes to non-Hodgkin lymphoma and hypersensitivity to genotoxic agents in vivo. American Journal of Medical Genetics. Part A. 158 (9), 2204-2213 (2012).
- Bansal, R., et al. SMARCAL1, the annealing helicase and the transcriptional co-regulator. IUBMB life. 72 (10), 2080-2096 (2020).
- Yusufzai, T., Kadonaga, J. T. HARP is an ATP-driven annealing helicase. Science. 322 (5902), 748-750 (2008).
- Yusufzai, T., Kong, X., Yokomori, K., Kadonaga, J. T. The annealing helicase HARP is recruited to DNA repair sites via an interaction with RPA. Genes & Development. 23 (20), 2400-2404 (2009).
- Patne, K., et al. BRG1 and SMARCAL1 transcriptionally co-regulate DROSHA, DGCR8 and DICER in response to doxorubicin-induced DNA damage. Biochimica et Biophysica Acta. 1860 (9), 936-951 (2017).
- Sharma, T., Bansal, R., Haokip, D. T., Goel, I., Muthuswami, R. SMARCAL1 negatively regulates c-Myc transcription by altering the conformation of the promoter region. Scientific Reports. 5, 17910 (2015).
- Muthuswami, R., Truman, P. A., Mesner, L. D., Hockensmith, J. W. A eukaryotic SWI2/SNF2 domain, an exquisite detector of double-stranded to single-stranded DNA transition elements. The Journal of Biological Chemistry. 275 (11), 7648-7655 (2000).
- Nongkhlaw, M., Dutta, P., Hockensmith, J. W., Komath, S. S., Muthuswami, R. Elucidating the mechanism of DNA-dependent ATP hydrolysis mediated by DNA-dependent ATPase A, a member of the SWI2/SNF2 protein family. Nucleic Acids Research. 37 (10), 3332-3341 (2009).
- Kikin, O., D'Antonio, L., Bagga, P. S. QGRS Mapper: a web-based server for predicting G-quadruplexes in nucleotide sequences. Nucleic Acids Research. 34, 676-682 (2006).
- Zuker, M. Mfold web server for nucleic acid folding and hybridization prediction. Nucleic Acids Research. 31 (13), 3406-3415 (2003).
- Gupta, M., et al. Ligand-induced conformation changes drive ATP hydrolysis and function in SMARCAL1. The FEBS Journal. 282 (19), 3841-3859 (2015).
- Dutta, P., et al. Global epigenetic changes induced by SWI2/SNF2 inhibitors characterize neomycin-resistant mammalian cells. PloS One. 7 (11), 49822 (2012).
- Muthuswami, R., et al. Phosphoaminoglycosides inhibit SWI2/SNF2 family DNA-dependent molecular motor domains. Biochemistry. 39 (15), 4358-4365 (2000).
- Gondeau, C. Circular dichroism and UV melting studies on formation of an intramolecular triplex containing parallel T*A:T and G*G:C triplets: netropsin complexation with the triplex. Nucleic Acids Research. 26 (21), 4996-5003 (1998).
- Nongkhlaw, M., Gupta, M., Komath, S. S., Muthuswami, R. Motifs Q and I are required for ATP hydrolysis but not for ATP binding in SWI2/SNF2 proteins. Biochemistry. 51 (18), 3711-3722 (2012).
- Luchnik, A. N. DNA conformational transitions induced by supercoiling control transcription in chromatin. Gene Regulation and Systems Biology. 8, 89-96 (2014).
- Siddiqui-Jain, A., Grand, C. L., Bearss, D. J., Hurley, L. H. Direct evidence for a G-quadruplex in a promoter region and its targeting with a small molecule to repress c-MYC transcription. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11593-11598 (2002).
- Uribe, D. J., Guo, K., Shin, Y. -. J., Sun, D. Heterogeneous nuclear ribonucleoprotein K and nucleolin as transcriptional activators of the vascular endothelial growth factor promoter through interaction with secondary DNA structures. Biochemistry. 50 (18), 3796-3806 (2011).
- Young, S. L., Krawczyk, S. H., Matteucci, M. D., Toole, J. J. Triple helix formation inhibits transcription elongation in vitro. Proceedings of the National Academy of Sciences of the United States of America. 88 (22), 10023-10026 (1991).
- Dürr, H., Flaus, A., Owen-Hughes, T., Hopfner, K. -. P. Snf2 family ATPases and DExx box helicases: differences and unifying concepts from high-resolution crystal structures. Nucleic Acids Research. 34 (15), 4160-4167 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır