Method Article
CD-спектроскопия для изучения взаимодействий ДНК и белка
В этой статье
Резюме
Взаимодействие АТФ-зависимого ремоделятора хроматина с лигандом ДНК описано с помощью CD-спектроскопии. Индуцированные конформационные изменения на промоторе гена, проанализированные генерируемыми пиками, могут быть использованы для понимания механизма транскрипционной регуляции.
Аннотация
Круговая дихроизмная (CD) спектроскопия является простым и удобным методом исследования вторичной структуры и взаимодействий биомолекул. Последние достижения в области CD-спектроскопии позволили детально изучить днк-белковые взаимодействия и конформационную динамику ДНК в различных микросредах для лучшего понимания транскрипционной регуляции in vivo. Область вокруг потенциальной зоны транскрипции должна быть размотана для того, чтобы произошла транскрипция. Это сложный процесс, требующий координации модификаций гистонов, связывания транскрипционного фактора с ДНК и других действий по ремоделированию хроматина. Используя CD-спектроскопию, можно изучать конформационные изменения в промоторной области, вызванные регуляторными белками, такими как АТФ-зависимые ремоделирующие хроматины, для стимулирования транскрипции. Конформационные изменения, происходящие в белке, также можно контролировать. Кроме того, вопросы, касающиеся сродства белка к его целевой ДНК и специфичности последовательности, могут быть решены путем включения мутаций в целевую ДНК. Короче говоря, уникальное понимание этого чувствительного и недорогого метода может предсказать изменения в динамике хроматина, тем самым улучшая понимание транскрипционной регуляции.
Введение
Круговой дихроизм (CD) - это спектроскопическая техника, которая опирается на присущую биологическим макромолекулам хиральность, что приводит к дифференциальному поглощению правостороннего и левостороннего циркулярно поляризованного света. Это дифференциальное поглощение известно как круговой дихроизм. Таким образом, этот метод может быть использован для очерчивания конформации биологических макромолекул, таких как белки и ДНК, оба из которых содержат хиральные центры1,2.
Электромагнитные волны содержат как электрические, так и магнитные компоненты. Как электрическое, так и магнитное поля колеблются перпендикулярно направлению распространения волны. В случае неполяризованного света эти поля колеблются во многих направлениях. Когда свет циркулярно поляризован, два электромагнитных поля получаются при разности фаз 90° друг к другу. Хиральные молекулы демонстрируют круговое оптическое вращение (двулучепреломление) таким образом, что они будут поглощать правосторонний циркулярно поляризованный свет и левосторонний циркулярно поляризованный свет в разной степени3. Полученное электрическое поле будет прослежено в виде эллипса, функции длины волны. Таким образом, спектр CD регистрируется как эллиптичность (q), а данные представляются как средняя эллиптичность остатка как функция длины волны.
В случае белков Cα аминокислот (кроме глицина) является хиральным, и это используется CD-спектроскопией для определения вторичной структуры этой макромолекулы4. СПЕКТРЫ CD белковых молекул обычно регистрируются в дальнем УФ-диапазоне. α-спиральные белки имеют две отрицательные полосы при 222 нм и 208 нм и один положительный пик при 193 нм4. Белки с антипараллельной β листовой вторичной структурой показывают отрицательный пик при 218 нм и положительный пик при 195 нм4. Белки с неупорядоченной структурой показывают низкую эллиптичность около 210 нм и отрицательный пик в 195 нм4. Таким образом, четко определенные пики/полосы для различных вторичных структур делают CD удобным инструментом для выяснения конформационных изменений, происходящих во вторичной структуре белков во время денатурации, а также связывания лигандов.
Нуклеиновые кислоты имеют три источника хиральности: молекулу сахара, спиральность вторичной структуры и дальнодействующее третичное упорядочение ДНК в окружающей среде5,6. СПЕКТРЫ CD нуклеиновых кислот обычно регистрируются в диапазоне от 190 до 300 нм5,6. Каждая конформация ДНК, как и белки, дает характерный спектр, хотя пики/полосы могут варьироваться в некоторой степени из-за условий растворителя и различий в последовательностях ДНК7. B-ДНК, наиболее распространенная форма, характеризуется положительным пиком около 260-280 нм и отрицательным пиком около 245 нм6. Пики/полосы В-формы ДНК, как правило, малы, потому что пары оснований перпендикулярны двойной спирали, придавая молекуле слабую хиральность. A-ДНК дает доминирующий положительный пик при 260 нм и отрицательный пик около 210 нм6. Z-ДНК, левая спираль, дает отрицательную полосу при 290 нм и положительный пик около 260 нм6. Эта ДНК также дает крайне отрицательный пик в 205 нм6.
В дополнение к этим конформациям ДНК также может образовывать триплексы, квадруплексы и шпильки, все из которых можно отличить с помощью CD-спектроскопии. Параллельный G-квадруплекс дает доминирующую положительную полосу при 260 нм, в то время как антипараллельный G-квадруплекс дает отрицательную полосу при 260 нм и положительный пик при 290 нм, что позволяет легко различать две формы квадруплексных структур6. Триплексы не дают характеристического спектра8. Например, спектры 36-нуклеотидной ДНК с потенциалом формирования внутримолекулярной тройной спирали, содержащей пары оснований G.G.C и T.A.T. в присутствии Na+ показывают сильную отрицательную полосу при 240 нм и широкий положительный пик. Широкий положительный пик показывает вклад в 266, 273 и 286 нм. Тот же олигонуклеотид в присутствии Na+ и Zn+ показывает четыре отрицательные полосы (213, 238, 266 и 282 нм) и положительный пик на 258 нм. Таким образом, спектры триплексной ДНК могут варьироваться в зависимости от солевых условий8.
В дополнение к этим конформациям, спектры CD позволили идентифицировать другую форму ДНК, называемую X-ДНК. X-ДНК образуется, когда последовательность ДНК содержит альтернативные остатки аденина и тимина. CD-спектры X-ДНК содержат два отрицательных пика при 250 и 280 нм. Очень мало информации о X-ДНК, хотя было высказано предположение, что она функционирует как поглотитель для положительной суперспирали6,9. Изменения в спектрах CD также могут раскрывать подробности о лиганд-белковых взаимодействиях и, следовательно, были добавлены в арсенал молекулярных методов обнаружения лекарственно-белковых взаимодействий10,11,12,13,14. Спектры CD также использовались для мониторинга изменений вторичной структуры белков в процессе сворачивания15. Аналогичным образом, спектры CD также могут быть использованы для зондирования взаимодействия лиганд-ДНК16,17.
Таким образом, CD-спектроскопия является простым и недорогим методом различения различных форм конформации ДНК при условии доступа к не очень недорогому оборудованию и программному обеспечению. Метод чрезвычайно чувствителен и быстр. Он требует только небольшого количества ДНК, что дает ему преимущество перед альтернативным методом спектроскопии ядерного магнитного резонанса (ЯМР). Титрование лигандами и субстратами также легко выполнить. Основным ограничением является то, что ДНК должна быть очень чистой. Целесообразно использовать полиакриламидный гель электрофорез (PAGE) - очищенную ДНК.
Информация, полученная с помощью спектров CD, в основном использовалась для определения структурных особенностей белка и идентификации различных конформеров ДНК. В этом исследовании спектры CD были использованы для интеграции результатов, полученных в результате эксперимента in vivo с иммунопреципитацией хроматина (ChIP), чтобы определить, может ли интересующий белок / прогнозируемый фактор транскрипции вызвать конформационные изменения в промоторной области его эффекторных генов. Это сотрудничество помогает в прогрессе традиционных спектроскопических методов CD, предсказывая механизм регуляции транскрипции предсказанным фактором транскрипции на и вокруг сайта начала транскрипции (TSS) промотора.
Ремоделирование хроматина является четко определенным механизмом, который, как известно, регулирует метаболические процессы ДНК, делая плотно упакованный хроматин доступным для различных регуляторных факторов, таких как факторы транскрипции, компоненты репликации ДНК или белки восстановления повреждений. АТФ-зависимые ремоделирующие хроматины, также известные как семейство белков SWI/SNF, являются ключевыми белками-ремоделирующими, присутствующими в эукариотических клетках18,19. Филогенетическая кластеризация классифицировала семейство белков SWI/SNF на 6 подгрупп20: Snf2-подобные, Swr1-подобные, SSO1653-подобные, Rad54-подобные, Rad5/16-подобные и отдаленные. SMARCAL1, белок, представляющий интерес в данном исследовании, относится к отдаленной подгруппе20. Этот белок был использован для исследования его способа транскрипционной регуляции с использованием CD-спектроскопии.
Было показано, что большинство членов АТФ-зависимых белков ремоделирования хроматина либо репозиционируют, либо вытесняют нуклеосомы, либо опосредуют обмен вариантами гистонов АТФ-зависимым способом21,22. Тем не менее, некоторые члены этого семейства не были показаны для ремоделирования нуклеосом, например, SMARCAL1. Несмотря на то, что исследования показали, что SMARCAL1 ассоциируется с политеновыми хромосомами, экспериментальные данные относительно его способности ремоделировать нуклеосомы отсутствуют23. Поэтому было постулировано, что SMARCAL1 может регулировать транскрипцию, изменяя конформацию ДНК24. CD-спектроскопия обеспечила простой и доступный метод для подтверждения этой гипотезы.
SMARCAL1 является АТФ-зависимым хроматиновым ремоделирующим белком, который в основном функционирует как геликаза отжига25,26,27. Было постулировано модулировать транскрипцию путем ремоделирования конформации ДНК24. Чтобы проверить эту гипотезу, была изучена роль SMARCAL1 в регуляции транскрипции генов во время повреждения ДНК, индуцированного доксорубицином. В этих исследованиях SMARCAL1 использовался для анализа in vivo и ADAAD для анализов in vitro28,29. Предыдущие исследования показали, что ADAAD может распознавать ДНК структурно-зависимым, но независимым от последовательностей способом30,31. Белок оптимально связывается с молекулами ДНК, обладающими двухцепочечными к одноцепочечным переходным областям, похожим на стволовую петлю ДНК, и гидролизует АТФ 30,31.
Эксперименты in vivo показали, что SMARCAL1 регулирует экспрессию MYC, DROSHA, DGCR8 и DICER путем связывания с промоторными областями28,29. Область взаимодействия была идентифицирована экспериментами ChIP28,29. Метод ChIP используется для анализа взаимодействия белка с его родственной ДНК внутри клетки. Его цель состоит в том, чтобы определить, связаны ли специфические белки, такие как факторы транскрипции на промоторах или других сайтах связывания ДНК, с конкретными геномными областями. Белок, связанный с ДНК, сначала сшивается с использованием формальдегида. За этим следует выделение хроматина. Изолированный хроматин сдвигается до 500 фрагментов bp либо путем обработки ультразвуком, либо путем переваривания нуклеазы, а белок, связанный с ДНК, иммунопреципитируется с использованием антител, специфичных для белка. Сшивка обратная, и ДНК анализируется с использованием либо полимеразной цепной реакции (ПЦР), либо количественной ПЦР в реальном времени.
Результаты ChIP привели к гипотезе о том, что SMARCAL1, возможно, опосредует транскрипционную регуляцию, вызывая конформационные изменения в промоторных областях этих генов. Программное обеспечение QGRS mapper и Mfold использовались для определения потенциала этих промоторных регионов для формирования вторичных структур28,29. QGRS mapper используется для прогнозирования G-квадруплексов32, в то время как Mfold33 анализирует способность последовательности формировать вторичные структуры, такие как стволовые петли.
После вторичного структурного анализа дальнейшие эксперименты in vitro были проведены с рекомбинантным 6X His-меченым активным ДНК-зависимым доменом АТФазы А (ADAAD), бычьим гомологом SMARCAL1, очищенным от Escherichia coli34. Анализы АТФазы были выполнены с использованием ADAAD, чтобы установить, что идентифицированные последовательности ДНК могут действовать как эффекторы28,29. Наконец, CD-спектроскопия была выполнена для мониторинга конформационных изменений, индуцированных в молекуле ДНК ADAAD28,29.
Чтобы доказать, что атфазная активность белка была необходима для индуцирования конформационного изменения в молекуле ДНК, к хелату Mg+2 добавляли либо тетрауксусную кислоту этилендиамина (ЭДТА), либо добавляли активный ДНК-зависимый ингибитор домена АТФазы А Неомицин (ADAADiN), специфический ингибитор белка SWI/SNF35,36 . Этот метод CD-спектроскопии может быть использован с любым очищенным белком, который был продемонстрирован ChIP или любым другим соответствующим анализом для связывания с прогнозируемой геномной областью промотора.
протокол
1. Рабочая концентрация реакционных компонентов
- Подготовьте рабочие концентрации буферов для CD и других реакционных компонентов в свежем виде (см. Таблицу 1) и сохраните их при 4 °C перед началом реакций.
ПРИМЕЧАНИЕ: Для РЕАКЦИЙ CD, описанных в настоящей статье, рабочие концентрации компонентов являются следующими: буфер фосфата натрия (рН 7,0) 1 мМ, АТФ 2 мМ, ДНК 500 нМ, Белок 1 мкМ, MgCl2 10 мМ, ЭДТА 50 мМ, ADAADiN 5 мкМ.
2. Активность АТФазы
- Перед CD-спектроскопией установите АТФазную активность белка в присутствии молекул ДНК, чтобы убедиться, что белок, используемый в СПЕКТРОСКОПИИ CD, активен, и идентифицировать молекулы ДНК, которые оптимально эффективны в получении гидролиза АТФ.
- Измерьте активность АТФазы белка в присутствии различных молекул ДНК с помощью анализа окисления, связанного с NADH, состоящего из следующих двух реакций.
- Смешайте 0,1 мкМ ADAAD, 2 мМ АТФ, 10 нМ ДНК и 1x буфера REG в 96-луночной пластине с конечным объемом 250 мкл.
ПРИМЕЧАНИЕ: Фермент пируваткиназы использует АДФ и Пи для преобразования фосфоенолпирувата в пируват, тем самым регенерируя АТФ. Это гарантирует, что АТФ всегда находится в насыщенной концентрации в реакции. Во второй реакции пируват, образованный действием пируваткиназы, превращается лактатдегидрогеназой в лактат. В этой реакции одна молекула NADH окисляется до NAD+. Потребление NADH измеряется путем измерения поглощения молекулы при 340 нм. - Инкубировать в течение 30 мин при 37 °C в инкубаторе.
- Измерьте количество NAD+ при 340 нм с помощью микропластичного считывателя.
- Чтобы измерить количество NAD+, используйте программное обеспечение, поставляемое вместе со считывателем микропластин.
- Нажмите на анализ NADH, чтобы измерить поглощение при 340 нм.
- Поместите 96-луночную пластину на держатель пластины в инструменте. Нажмите кнопку Read Plate , чтобы записать поглощение.
ПРИМЕЧАНИЕ: Концентрация NAD+ рассчитывается с использованием коэффициента молярного вымирания NADH как 6,3 мМ−1 с использованием экв.(1).
A = εcl (1)
Здесь A = поглощение
ε = коэффициент молярного вымирания
c = молярная концентрация
l = длина оптического пути в см
- Смешайте 0,1 мкМ ADAAD, 2 мМ АТФ, 10 нМ ДНК и 1x буфера REG в 96-луночной пластине с конечным объемом 250 мкл.
3. Выбор и приготовление CD кювет
- Собирайте СПЕКТРЫ CD в высокопрозрачные кварцевые кюветы. Используйте прямоугольные или цилиндрические кюветы.
ПРИМЕЧАНИЕ: Для всех реакций, описанных в настоящем документе, использовалась кварцевая кювета CD (номинальный объем 0,4 мл, длина пути 1 мм). - Используйте чистящий раствор для кюветы, чтобы очистить кювету. Добавьте 1% раствор для очистки кюветы в воду, чтобы получить 400 мкл раствора, вылейте его в кювету и инкубируйте при 37 °C в течение 1 ч.
- Вымойте кювету водой несколько раз, чтобы очистить кювету. Сделайте сканирование воды или буфера в кювете, чтобы проверить, чиста ли она.
ПРИМЕЧАНИЕ: Вода или буфер должны давать показания в диапазоне от 0 до 1 mdeg.
4. Получение белков и олигонуклеотидов ДНК
- Держите объем белка ниже 50 мкл в реакции, чтобы минимизировать количество буферных компонентов, которые иногда вызывают образование неоднозначных пиков. Держите белок на льду на протяжении всего эксперимента, чтобы избежать деградации.
- Используйте ОЧИЩЕННЫЕ PAGE олигонуклеотиды ДНК в реакциях.
ПРИМЕЧАНИЕ: В описанных здесь реакциях ДНК использовалась как в нативной, так и в термоохлаждаемой формах (быстроохлаждаемая (FC) и медленно охлаждаемая (SC)). Быстрое охлаждение способствует внутримолекулярной связи в ДНК, создавая больше вторичных структур. Напротив, медленное охлаждение способствует межмолекулярной связи в ДНК, что приводит к меньшему количеству вторичных структур. - Для быстрого охлаждения нагрейте ДНК при 94 °C в течение 3 мин на нагревательном блоке и немедленно охладите его на льду. Для медленного охлаждения нагревают ДНК при 94 °C в течение 3 мин и дают ей остыть до комнатной температуры со скоростью 1 °C в минуту.
5. Настройка контрольных экспериментов для записи базовых спектров
- Держите реакционный объем на уровне 300 мкл во всех реакциях. Установить в общей сложности 5 базовых реакций в центрифужных трубках объемом 1,5 мл, одну за другой, следующим образом: i) буфер + вода; ii) буфер + MgCl2 + АТФ + вода; iii) буфер + MgCl2 + АТФ + белок + вода; iv) iii + ЭДТА или ADAADiN; v) Буфер + Белок + Вода.
6. Настройка экспериментов для записи спектров CD
- Наладить в общей сложности 5 реакций, одну за другой, в 1,5 мл центрифужных трубках следующим образом: i) Буфер + ДНК + Вода; ii) буфер + ДНК + MgCl2 + АТФ + вода; iii) буфер + ДНК + MgCl2 + АТФ + белок + вода; iv) iii + ЭДТА или ADAADiN; v) Буфер + ДНК + Белок + Вода.
7. Сканирование записи
- Включите газ и включите CD-спектрометр.
- Включите лампу через 10-15 мин. Включите водяную баню и установите температуру держателя на уровне 37 °C.
- Откройте программное обеспечение спектра компакт-дисков .
- Установите температуру на 37 °C.
- Установите диапазон длин волн на уровне 180 - 300 нм.
- Установите время на точку равным 0,5 с.
- Установите для параметра сканирования значение 5.
- Нажмите pro-Data Viewer, создайте новый файл и переименуйте его с подробными сведениями об эксперименте и дате.
- Держите все компоненты реакции на льду, чтобы избежать деградации. Сделайте исходные линии и реакции, одну за другой, в центрифужных трубках и перемешайте их путем пипетки. Осторожно перенесите реакционную смесь на кювету, следя за тем, чтобы не было пузырьков воздуха.
- Если вы проводите эксперимент с временным курсом, инкубируйте реакции при 37 °C в течение необходимого времени и пройдите сканирование. Добавьте ЭДТА в буфер, содержащий ДНК, АТФ, Mg+2 и белок, чтобы остановить гидролиз АТФ.
- Увеличивают концентрацию ЭДТА и время его инкубации для полного ингибирования активности АТФазы.
- Вычтите исходные линии из соответствующих реакций в программном обеспечении (например, вычтите реакцию 1 из исходного уровня 1). Сглаживайте данные либо в программном обеспечении спектра компакт-дисков, либо в программном обеспечении для построения данных. Построение данных в программном обеспечении для построения данных.
ПРИМЕЧАНИЕ: Вычитание исходных линий из соответствующих реакций даст чистые СПЕКТРЫ CD только ДНК.
8. Анализ и интерпретация данных
- Используйте формулу, заданную eq (2), для преобразования значений, полученных в миллидеграх, в среднюю остаточную эллиптичность.
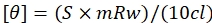 (2)
(2)
Здесь S — сигнал CD в миллидгреях, c — концентрация ДНК в мг/мл, mRw — средняя масса остатка, а l — длина пути в см. - Постройте график по длине волны и средней эллиптичности остатков с помощью программного обеспечения для построения данных и проанализируйте пики.
- Чтобы построить график, выберите среднюю остаточную эллиптичность по оси Y и длину волны по оси X и постройте график прямой линии.
ПРИМЕЧАНИЕ: Этот график предоставит пики характеристик различных форм ДНК. Формы ДНК, соответствующие пикам, могут быть идентифицированы с помощью существующей литературы6.
Результаты
ADAAD стабилизирует структуру, похожую на стволовую петлю, на промоутере MYC
Предыдущие экспериментальные данные показали, что SMARCAL1 является отрицательным регулятором MYC29. Анализ промоторной области гена MYC длиной 159 bp показал, что прямая нить обладает потенциалом для образования G-квадруплекса (таблица 2). Мфолд показал, что обе нити ДНК MYC могут образовывать стволовую петлеобразную структуру (таблица 2). Была синтезирована последовательность ДНК длиной 34 bp, содержащая G-квадруплекс (GECE). Структуры Mfold прямой и обратной последовательности олигонуклеотида GECE показаны на рисунке 1A,B.
Анализы АТФазы с использованием 6X His-ADAAD показали, что быстроохлаждаемый GECE является лучшим эффектором, чем нативная и медленно охлаждаемая формы. Поэтому для записи СПЕКТРОВ CD в отсутствие и присутствии АТФ и АДААД использовался быстроохлаждаемый GECE. Спектры CD показали, что ADAAD индуцирует два положительных пика - один на 258 нм с плечом на 269 нм и больший пик на 210 нм в ДНК (рисунок 1C). Также наблюдалось падение в сторону негатива около 240 нм. Этот спектр был аналогичен тому, который был получен при инкубации с белком и АТФ синтетической стволовой петли, оптимального эффектора ADAAD (рисунок 2A,B). Триплексная ДНК может давать аналогичный спектр37, что приводит к гипотезе о том, что белок может индуцировать такую структуру в этом случае. АТФ образует координационный комплекс с Mg+2, и этот катион необходим для гидролиза АТФ. Добавление хелатов ЭДТА Mg+2, приводящее к ингибированию гидролиза АТФ38. Поэтому ЭДТА добавляли в реакционную смесь, чтобы понять, важен ли гидролиз АТФ с помощью ADAAD для конформационных изменений. Добавление ЭДТА к реакции отменяет эту конформацию. Спектры CD теперь имеют отрицательный пик 210 нм и широкую положительную полосу с пиками на 230 и 250 нм (рисунок 1C).
Важность активности АТФазы также была подтверждена с помощью МЕРТВОГО АТФазы мутанта ADAAD. Мутация K241A происходит в законсервированной коробке GKT мотива I, и ранее было показано, что этот мутант не обладает способностью гидролизовать АТФ в присутствии ДНК31. Мутантный белок экспрессировали меткой GST и очищали с помощью глутатион-аффинной хроматографии. Конформационные изменения, индуцированные в ДНК MYC этим мутантом, отличались от изменений, индуцированных ADAAD дикого типа. СПЕКТР CD ДНК MYC в присутствии мутантного белка обладал положительным пиком 210 нм и отрицательным пиком 260 нм (рисунок 1D).
ADAAD индуцирует А-форму конформации в промоутере DROSHA
Промоторные регионы DROSHA, DGCR8 и DICER также были проанализированы программным обеспечением QGRS mapper и Mfold. Как QGRS, так и MFold показали, что промоторные области обладают потенциалом для формирования G-квадруплексных и стволовых структур (таблица 2). Структуры Mfold прямых и обратных олигонуклеотидов показаны на рисунке 3A,B. Активность АТФазы показала, что нативная и термоохлаждаемая ДНК ведут себя одинаково. Поэтому медленно охлаждаемая форма этих последовательностей ДНК использовалась для исследований БК. Спектры CD показали, что ADAAD индуцирует отрицательный пик при 210 нм и положительный пик при 260 нм в промоторе DROSHA (рисунок 3C). Этот спектр является характеристикой A-DNA6.
ADAAD индуцирует переход B-X и образование G-квадруплекса в промоутере DGCR8
Структуры Mfold передней и обратной нитей используемых олигонуклеотидов показаны на рисунке 4A,B. Положительный пик при 210 нм и широкий отрицательный пик при 260 нм наблюдались для пары DGCR8 1 (рисунок 4C). Этот спектр характерен для перехода B-X6. Структуры Mfold передней и обратной нитей используемых олигонуклеотидов показаны на рисунке 4D,E. Спектры CD пары DGCR8 7 показали сильный положительный пик при 210 и 270 нм и отрицательный пик при 250 нм (рисунок 4F). Этот спектр характерен для параллельных структур G-квадруплекса ДНК6.
ADAAD индуцирует переход A-X в промоутере DICER
Структуры Mfold прямых и обратных олигонуклеотидов показаны на рисунке 5A,B. Положительный пик при 210 нм и два отрицательных пика - один при 230 нм, а другой на пике 260 нм - наблюдались для пары DICER 1 (рисунок 5C). Эти пики характерны для перехода ДНК A-X6,9. Все пики спектров CD и формы ДНК, играющие определенные роли в процессе транскрипции, были обобщены в таблице 3.
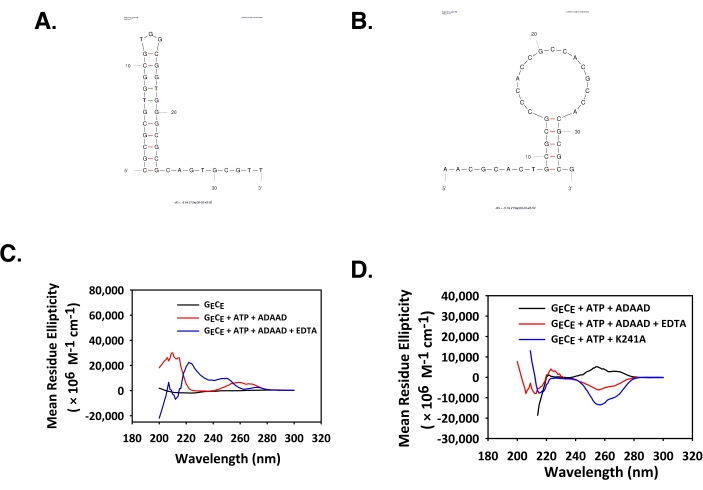
Рисунок 1: ADAAD изменяет конформацию ДНК GECE. Mfold структуры были предсказаны для (A) передней нити и (B) обратной нити. (C) CD-спектры только GECE (черный), GECE, инкубированные с АТФ и ADAAD до (красный) и после добавления ЭДТА (синий). (D) CD-спектры GECE, инкубированные с ATP и GST-мечеными ADAAD до (черный) и после добавления EDTA (красный), а также CD-спектры GECE, инкубированные с ATP и GST-меченым мутантом K241A (синий). Эта цифра была изменена с 29. Сокращения: ADAAD = активный ДНК-зависимый домен АТФазы А; CD = круговой дихроизм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: ADAAD изменяет конформацию slDNA. (A) Mfold structure, предсказанная для СТВОЛОВОЙ ПЕТЛИ ДНК. (B) CD-спектры только слдНК (черный), slDNA, инкубированной с АТФ и ADAAD (красный). Этот показатель был изменен с 29. Сокращения: ADAAD = активный ДНК-зависимый домен АТФазы А; slDNA = стволовая петлевая ДНК; CD = круговой дихроизм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
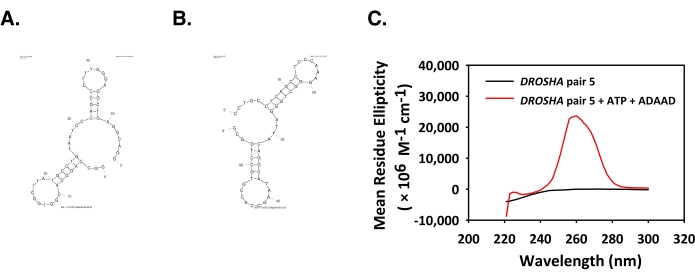
Рисунок 3: ADAAD изменяет конформацию ДНК пары DROSHA 5. Mfold структура предсказана для (A) передней нити и (B) обратной нити. (C) CD-спектры только ДНК пары DROSHA 5 (черная), ДНК пары DROSHA 5, инкубированной с АТФ и ADAAD (красный). Этот показатель был изменен с 28. Сокращения: ADAAD = активный ДНК-зависимый домен АТФазы А; CD = круговой дихроизм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
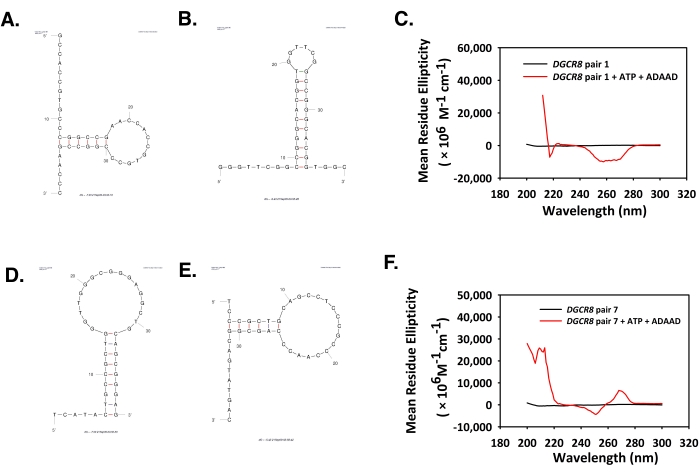
Рисунок 4: ADAAD изменяет конформацию DGCR8 пары 1 и 7 ДНК. Мфолдные структуры, предсказанные для (А) прямой цепи и (В) обратной цепи DGCR8 пары 1 олигонуклеотида. (C) CD-спектры только пары DGCR8 1 (черный), пары DGCR8 1 инкубированы с АТФ и ADAAD (красный). Mfold структуры, предсказанные для (D) прямой цепи и (E) обратной цепи DGCR8 пары 7 олигонуклеотида. (F) CD-спектры только пары DGCR8 7 (черный), пары DGCR8 7 инкубированы с АТФ и ADAAD (красный). Этот показатель был изменен с 28. Сокращения: ADAAD = активный ДНК-зависимый домен АТФазы А; CD = круговой дихроизм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
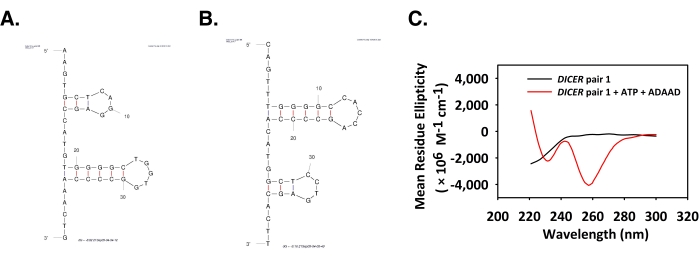
Рисунок 5: ADAAD изменяет конформацию ДНК пары DICER 1. Mfold структура предсказана для (A) прямой цепи и (B) обратной цепи DICER пары 1 олигонуклеотида. (C) CD-спектры только пары DICER 1 (черный), пары DICER 1, инкубированной с АТФ и ADAAD (красный). Этот показатель был изменен с 28. Сокращения: ADAAD = активный ДНК-зависимый домен АТФазы А; CD = круговой дихроизм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| 5x буфер REG | |
| Компонент | Рабочая концентрация |
| Лактатдегидрогеназа (ЛДГ) | 50 шт/мл |
| Ацетат магния (Mg(OAc)2) | 30 мМ |
| Фосфоэнолпируват (PEP) | 6,8 мг/мл |
| Поттазия ацетат (KOAc) | 300 мМ |
| Пируваткиназа (ПК) | 50 шт/мл |
| Трисацетат (Трис-ОАк) | 125 мМ |
| β-меркаптоэтанол (β-ME) | 25 мМ |
Таблица 1: Буферные компоненты.
| Олигонуклеотиды | Прямая последовательность | ΔG (м-в раз) Ккал/моль | G-балл (QGRS mapper) | Обратная последовательность | ΔG ккал/моль (Мфольное предсказание) | G-балл (QGRS mapper) | |||
| слДНК | GCGCAATTGCGCTCGA CGATTTTTTAGCGCAA ТТГКК | -16.36 | - | - | - | - | |||
| MYC GECE | CGCGCGTGGCGTGG CGGTGGGCGCGCA ГТГЦГТТ | -8.64 | 19 | AACGCACTGCGCGCC CACCGCCACGCCA CGCGCG | -5.74 | - | |||
| Пара ДРОША 5 | GGCCAGGCACGGTG GCTTATGCCTGTAAT CCCAGCCCTTTGGGA GGCTGAGGCAGG | -10.18 | 19, 19 | CCTGCCTCAGCCTCC CAAAGGGCTGGGATT ACAGGCATAAGCCAC CGTGCCTGGCC | -10.95 | - | |||
| Пара DGCR8 1 | GCCACCGTGCCCGG CCGAACCACCGTGC CCGGCCGAACCC | -7.9 | - | GGGTTCGGCCGGG CACGGTGGTTCGG CCGGGCACGGTGGC | -9.4 | 21 | |||
| DGCR8 Пара 7 | TCATACTGCCGCTG GGTTGGGCGGGAG GCTGCAGCGGGAG | -7.99 | 33 | TCCCGCTGCAGCCT CCCGCCCAACCCAG CGGCAGTATGAC | -5.43 | - | |||
| Пара DICER 1 | AAGTGCTCAGGAG CCATGTGGGGCTG GTGGCCCCAAACTG | -8.82 | 19 | CAGTTTGGGGCCAC CAGCCCCACATGGC TCCTGAGCACTT | -9.16 | - | |||
Таблица 2: Олигонуклеотидные последовательности. Все последовательности находятся в направлении 5'-3'. Сокращения: slDNA = стволовая петля ДНК.
| Олигонуклеотиды | CD Спектры пиков в нм (после инкубации с АТФ и АДААД) | Форма ДНК | Роль в транскрипции |
| слДНК | +215, +250, +272 | Тройной | Репрессия |
| MYC GECE | +210, +258, +269 | Тройной | Репрессия |
| Пара ДРОША 5 | -210, +260 | А-ДНК | Инициация/активация |
| Пара DGCR8 1 | +210,-260 | Переход B-X | Положительная суперкатушка/активация |
| DGCR8 Пара 7 | +210, -250, +270 | G-квадруплекс | Активация |
| Пара DICER 1 | +210, -230, -257 | Переход A-X | Положительная суперкатушка/активация |
Таблица 3: Пик спектров CD, соответствующий различным формам ДНК с их ролью в транскрипции. Сокращения: ADAAD = активный ДНК-зависимый домен АТФазы А; CD = круговой дихроизм.
Обсуждение
Целью данной статьи является внедрение метода CD-спектроскопии как подхода к изучению конформационных изменений, происходящих в ДНК в присутствии АТФ-зависимых хроматин-ремоделирующих белков, и связывание этих конформационных изменений с экспрессией генов. CD-спектроскопия обеспечивает быстрый и легкодоступный метод изучения конформационных изменений в ДНК.
Решающим моментом, который следует учитывать для этого метода, является чистота ДНК и белка. Желательно убедиться, что и ДНК, и белок >95% чисты. В анализе должны быть использованы очищенные PAGE олигонуклеотиды, и белок должен быть предпочтительно аффинно очищен до чистоты >95%. Другим критическим параметром является то, что кювета должна быть чистой, чтобы базовое значение не превышало 1 mdeg. Буферы должны быть изготовлены с использованием автоклавной воды, а базовое значение буфера не должно превышать 1 mdeg. Чтобы изучить конформацию промотора, важно определить области, где связывается белок. Поэтому целесообразно проводить эксперименты ChIP с использованием интересующего белка, поскольку этот процесс помогает идентифицировать последовательности ДНК, присутствующие в промоторной области эффекторного гена, связанного белком. Как только регион идентифицирован, способность последовательности принимать конкретные структуры может быть проанализирована с использованием доступных инструментов биоинформатики. Это важно, так как праймеры ChIP обычно имеют длину 200 bp и могут иметь несколько конформаций. Поэтому использование инструментов биоинформатики для идентификации структур поможет сократить длину олигонуклеотида до одной структуры.
Наконец, если интересующий белок является АТФ-зависимым хроматиновым ремоделирующим белком, способность олигонуклеотидов действовать как эффектор должна быть проверена с помощью анализов АТФазы. Как в CD-спектроскопии, так и в анализах АТФазы следует позаботиться о том, чтобы в реакции использовались насыщенные концентрации лигандов. Если возможно, константа диссоциации (Kd) для взаимодействия белка с лигандом должна быть рассчитана перед началом CD-спектроскопии. Для вычисления параметра привязки доступны многочисленные методы. Используя анализы АТФазы, постоянная Михаэлиса-Ментена (KM) может быть рассчитана путем титрования возрастающих концентраций ДНК. KM, во многих случаях, может быть аппроксимирован к константе связывания. Если белок флуоресцентный, константы связывания могут быть рассчитаны с помощью флуоресцентной спектроскопии. Если ни один из этих методов не осуществим, можно использовать анализ сдвига подвижности электрофореза (EMSA).
Основная проблема с CD-спектроскопией возникает, когда кюветы не очищаются или когда реагенты нечисты. Если базовый уровень слишком высок, желательно очистить кюветы. Доступны многочисленные решения для очистки кюветы. Помещение кювет в разбавленный раствор кислоты на 16-24 ч также помогает очистить кювету. Желательно приобретать реагенты, которые >95% чистоты и использовать двухдистиллированную и автоклавную воду. Дрейф базовой линии является еще одной потенциальной проблемой. Если проводится длительный эксперимент, желательно периодически проверять исходный уровень. Пики ДНК при изучении белково-ДНК-взаимодействий могут не точно соответствовать пикам/полосам, полученным только с помощью ДНК. Белковые пики обычно наблюдаются в дальнем УФ-диапазоне между 190 и 230 нм. Таким образом, пики ниже 250 нм могут иметь помехи от пика белка и могут не предоставлять достоверной информации. ДНК может принимать различные не-B конформации в зависимости от последовательности. Чем длиннее последовательность ДНК, тем выше вероятность того, что множественные конформации сосуществуют в олигонуклеотиде ДНК. Это может затруднить анализ. Следовательно, целесообразно использовать более короткие олигонуклеотиды, соответствующие потенциальным структурам, предсказанным биоинформационными инструментами.
Другим существенным недостатком CD-спектроскопии является то, что она не позволяет проводить анализ структуры на атомном уровне, а полученный спектр недостаточен для идентификации единственной жизнеспособной структуры. Например, как рентгеновская кристаллография, так и белковая ЯМР-спектроскопия предоставляют данные об атомном разрешении, тогда как CD-спектроскопия предоставляет менее подробную структурную информацию. Тем не менее, CD-спектроскопия является быстрым подходом, который не требует огромного количества белков или значительной обработки данных. В результате CD может быть использован для исследования широкого спектра переменных растворителей, таких как температура, рН, соленость и наличие различных кофакторов. Он также может быть использован для мониторинга структурных изменений (из-за сложного образования, складывания / разворачивания, денатурации из-за температуры, денатурантов и изменений в последовательности аминокислот / мутации) в динамических системах. Соединяя его с аппаратом остановки потока, он также может быть использован для изучения кинетики белково-ДНК-лигандных взаимодействий.
Хорошо охарактеризованные конформеры ДНК включают ДНК A / B / Z, триплекс, шпильку и G-квадруплексы. Все эти формы ДНК связаны с открытой конформацией ДНК, то есть раскрученной ДНК, которая служит раковиной для отрицательной суперспирали. Транскрипция связана с отрицательным суперспирали, так как образование открытого комплекса является предпосылкой для движения РНК-полимеразы. Поэтому транскрипция большинства генов включает в себя повышенную отрицательную суперспиральность в промоторной области. Исследования показали, что разворачивание нуклеосом приводит к конформации А-ДНК, которая, однако, нестабильна39. Одна из возможностей заключается в том, что интересующий белок, например, SMARCAL1, связывается с такими структурами и стабилизирует их, тем самым облегчая транскрипцию, как это видно в случае промоторов DROSHA . Гуаниновый квадруплекс основан на гуаниновых тетрадах, связанных водородными связями Hoogsteen. Анализ in silico подтвердил, что G4-образующие последовательности заметно обогащаются проксимально к промоторам генов и в местах начала транскрипции. Эти последовательности G4 могут как активировать, так и подавлять транскрипцию.
В случае промотора MYC40 образование G-квадруплекса действует как репрессор, в то время как в случае фактора роста эндотелия сосудов человека (VEGF) структура G-квадруплекса функционирует как стыковочный сайт для факторов транскрипции41, тем самым активируя экспрессию этого гена. В случае SMARCAL1 структура G-квадруплекса наблюдалась при взаимодействии ADAAD с промоторными последовательностями DGCR8 pair 7. Поскольку заполняемость SMARCAL1 и RNAPII увеличилась на этой паре праймеров, предполагается, что образование G-квадруплекса в этом случае коррелирует с активацией транскрипции этого гена. ДНК также может быть положительно перемотана, и прогресс РНК-полимеразы, как известно, генерирует положительную суперспираль перед ней. Эта транскрипционная (+) суперспираль может нарушить или устранить белки, блокирующие дорогу, дестабилизируя нуклеосомные структуры, чтобы сделать ДНК более доступной для РНК-полимеразы. X-ДНК — это конформация ДНК, которая действует как поглотители для положительной суперспирали. Поразительная особенность X-ДНК заключается в том, что она может формироваться последовательно-специфическим образом на промоторе гена. В случае SMARCAL1 ADAAD индуцировал переходы A-X и B-X в зависимости от АТФ в промоторах DICER и DGCR8, соответственно. В сочетании с данными in vivo, где повышенная занятость SMARCAL1 и RNAPII была обнаружена на этих промоторах в присутствии повреждения ДНК, вызванного доксорубицином, можно предположить, что образование X-ДНК облегчает транскрипцию, устраняя барьеры / блоки. Тройные спирали ДНК не имеют характерного спектра. Спектры CD последовательностей ДНК, присутствующих в промоторе MYC и синтетической стволовой петле ДНК, показали два положительных пика - один на 258 нм с плечом на 269 нм и больший пик на 210 нм в ДНК. Этот тип спектра может быть получен в случае триплексов37. Триплексы трудно раскрутить и, следовательно, как известно, блокируют транскрипцию42. Следовательно, предполагается, что формирование этой структуры в промоторе c-MYC SMARCAL1 приводит к подавлению транскрипции.
Следует отметить, что АТФ также связывается с АТФ-зависимыми белками ремоделирования хроматина. Консервированный аргинин, присутствующий в мотиве VI геликазного домена этих белков, взаимодействует посредством электростатических взаимодействий с γ-фосфатом белка43. В случае ADAAD Kd взаимодействия белка и АТФ составляет (1,5 ± 0,1) × 10-6 M38. Связывание АТФ вызывает конформационное изменение белка таким образом, что сродство ДНК увеличивается. Связывание ДНК также вызывает конформационное изменение белка, приводящее к увеличению 10-кратного сродства к АТФ31. Например, в случае ADAAD полосы/пики наблюдаются при -212 нм и -222 нм. АТФ также дает диапазоны при 197 нм, +210 нм, -222 нм, -247 нм и -270 нм. Они должны быть вычтены из спектров ДНК + ADAAD + ATP для получения «чистой» конформации ДНК в присутствии лигандов.
Таким образом, в данной работе показано удобство CD-спектроскопии для изучения конформационных изменений, происходящих в ДНК в присутствии АТФ-зависимых хроматин-ремоделирующих белков. Корреляция изменений в конформации ДНК с данными ChIP может предоставить исследователям информацию о том, как конформеры ДНК активируют / подавляют транскрипцию.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Авторы хотели бы поблагодарить Advanced Instrumentation Research Facility, JNU, за CD-спектрофотометр. V.J. и A.D. были поддержаны стипендией от CSIR.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Fisher scientific | O3446I-100 | |
| Adenosine 5′-triphosphate disodium salt hydrate | Sigmaaldrich | A2383 | |
| CD Quartz Cuvette | STARNA | 21-Q-1 | |
| Chirascan V100 CD spectrometer | Applied Photophysics | Not available | |
| EDTA Disodium Salt Dihydrate | SRL | 43272 | |
| Glutathione Sepharose 4B | GE Healthcare | 17-0756-01 | Glutathione affinity chromatography |
| Hellmanex III cleaning solution | Hellma | 9-307-011-4-507 | |
| L-Lactic Dehydrogenase | Sigmaaldrich | L2625 | |
| Magnesium Acetate Tetrahydrate | Fisher scientific | BP215-500 | |
| Magnesium Chloride Hexahydrate | Fisher scientific | M33-500 | |
| NADH disodium salt | Sigmaaldrich | 10107735001 | |
| Phosphoenolpyruvate Monocyclohexylammonium Salt | SRL | 40083 | |
| Potassium Acetate | Fisher scientific | P178-3 | |
| Pyruvate Kinase | Sigmaaldrich | P1506 | |
| Sodium Phosphate Dibasic Anhydrous | Fisher scientific | S374-500 | |
| Sodium Phosphate Monobasic Monohydrate | Fisher scientific | S369-500 | |
| Synergy HT microplate reader | BioTek | Not available | |
| Tris Base | Fisher scientific | BP152-500 |
Ссылки
- Woody, R. W. Circular dichroism. Methods in Enzymology. 246, 34-71 (1995).
- Kelly, S., Price, N. The Use of Circular Dichroism in the Investigation of Protein Structure and Function. Current Protein & Peptide Science. 1 (4), 349-384 (2000).
- Rodger, A., Marshall, D. Beginners guide to circular dichroism. The Biochemist. 43 (2), 58-64 (2021).
- Greenfield, N. J. Using circular dichroism spectra to estimate protein secondary structure. Nature Protocols. 1 (6), 2876-2890 (2006).
- Kypr, J., Kejnovská, I., Bednářová, K., Vorlíčková, M. Circular Dichroism Spectroscopy of Nucleic Acids. Comprehensive Chiroptical Spectroscopy. , 575-586 (2012).
- Kypr, J., Kejnovska, I., Renciuk, D., Vorlickova, M. Circular dichroism and conformational polymorphism of DNA. Nucleic Acids Research. 37 (6), 1713-1725 (2009).
- Miyahara, T., Nakatsuji, H., Sugiyama, H. Helical Structure and Circular Dichroism Spectra of DNA: A Theoretical Study. The Journal of Physical Chemistry A. 117 (1), 42-55 (2013).
- Khomyakova, E. B. Parallel intramolecular DNA triple helix with G and T bases in the third strand stabilized by Zn2+ ions. Nucleic Acids Research. 28 (18), 3511-3516 (2000).
- Kypr, J., et al. The unusual X-form DNA in oligodeoxynucleotides: dependence of stability on the base sequence and length. Journal of Biomolecular Structure & Dynamics. 13 (6), 999-1006 (1996).
- Zohoorian-Abootorabi, T., Sanee, H., Iranfar, H., Saberi, M. R., Chamani, J. Separate and simultaneous binding effects through a non-cooperative behavior between cyclophosphamide hydrochloride and fluoxymesterone upon interaction with human serum albumin: multi-spectroscopic and molecular modeling approaches. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 88, 177-191 (2012).
- Sharifi-Rad, A., Mehrzad, J., Darroudi, M., Saberi, M. R., Chamani, J. Oil-in-water nanoemulsions comprising Berberine in olive oil: biological activities, binding mechanisms to human serum albumin or holo-transferrin and QMMD simulations. Journal of Biomolecular Structure & Dynamics. 39 (3), 1029-1043 (2021).
- Mokaberi, P., Babayan-Mashhadi, F., Amiri Tehrani Zadeh, Z., Saberi, M. R., Chamani, J. Analysis of the interaction behavior between Nano-Curcumin and two human serum proteins: combining spectroscopy and molecular stimulation to understand protein-protein interaction. Journal of Biomolecular Structure & Dynamics. 39 (9), 3358-3377 (2021).
- Danesh, N., et al. Determining the binding site and binding affinity of estradiol to human serum albumin and holo-transferrin: fluorescence spectroscopic, isothermal titration calorimetry and molecular modeling approaches. Journal of Biomolecular Structure & Dynamics. 36 (7), 1747-1763 (2018).
- Sadeghzadeh, F., et al. Characterizing the binding of angiotensin converting enzyme I inhibitory peptide to human hemoglobin: influence of electromagnetic fields. Protein and Peptide Letters. 27 (10), 1007-1021 (2020).
- Chamani, J., et al. Cooperative alpha-helix formation of beta-lactoglobulin induced by sodium n-alkyl sulfates. Journal of Colloid and Interface Science. 293 (1), 52-60 (2006).
- Dareini, M., et al. A novel view of the separate and simultaneous binding effects of docetaxel and anastrozole with calf thymus DNA: Experimental and in silico approaches. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 228, 117528 (2020).
- Dehghani Sani, F., et al. Changes in binding affinity between ofloxacin and calf thymus DNA in the presence of histone H1: Spectroscopic and molecular modeling investigations. Journal of Luminescence. 203, 599-608 (2018).
- Hargreaves, D. C., Crabtree, G. R. ATP-dependent chromatin remodeling: genetics, genomics and mechanisms. Cell Research. 21 (3), 396-420 (2011).
- Morettini, S., Podhraski, V., Lusser, A. ATP-dependent chromatin remodeling enzymes and their various roles in cell cycle control. Frontiers in Bioscience: A Journal and Virtual Library. 13, 5522-5532 (2008).
- Flaus, A., Martin, D. M. A., Barton, G. J., Owen-Hughes, T. Identification of multiple distinct Snf2 subfamilies with conserved structural motifs. Nucleic Acids Research. 34 (10), 2887-2905 (2006).
- Flaus, A., Owen-Hughes, T. Mechanisms for ATP-dependent chromatin remodelling: the means to the end. The FEBS Journal. 278 (19), 3579-3595 (2011).
- Mizuguchi, G., et al. ATP-driven exchange of histone H2AZ variant catalyzed by SWR1 chromatin remodeling complex. Science. 303 (5656), 343-348 (2004).
- Elizondo, L. I., et al. Schimke immuno-osseous dysplasia: SMARCAL1 loss-of-function and phenotypic correlation. Journal of Medical Genetics. 46 (1), 49-59 (2009).
- Baradaran-Heravi, A., et al. SMARCAL1 deficiency predisposes to non-Hodgkin lymphoma and hypersensitivity to genotoxic agents in vivo. American Journal of Medical Genetics. Part A. 158 (9), 2204-2213 (2012).
- Bansal, R., et al. SMARCAL1, the annealing helicase and the transcriptional co-regulator. IUBMB life. 72 (10), 2080-2096 (2020).
- Yusufzai, T., Kadonaga, J. T. HARP is an ATP-driven annealing helicase. Science. 322 (5902), 748-750 (2008).
- Yusufzai, T., Kong, X., Yokomori, K., Kadonaga, J. T. The annealing helicase HARP is recruited to DNA repair sites via an interaction with RPA. Genes & Development. 23 (20), 2400-2404 (2009).
- Patne, K., et al. BRG1 and SMARCAL1 transcriptionally co-regulate DROSHA, DGCR8 and DICER in response to doxorubicin-induced DNA damage. Biochimica et Biophysica Acta. 1860 (9), 936-951 (2017).
- Sharma, T., Bansal, R., Haokip, D. T., Goel, I., Muthuswami, R. SMARCAL1 negatively regulates c-Myc transcription by altering the conformation of the promoter region. Scientific Reports. 5, 17910 (2015).
- Muthuswami, R., Truman, P. A., Mesner, L. D., Hockensmith, J. W. A eukaryotic SWI2/SNF2 domain, an exquisite detector of double-stranded to single-stranded DNA transition elements. The Journal of Biological Chemistry. 275 (11), 7648-7655 (2000).
- Nongkhlaw, M., Dutta, P., Hockensmith, J. W., Komath, S. S., Muthuswami, R. Elucidating the mechanism of DNA-dependent ATP hydrolysis mediated by DNA-dependent ATPase A, a member of the SWI2/SNF2 protein family. Nucleic Acids Research. 37 (10), 3332-3341 (2009).
- Kikin, O., D'Antonio, L., Bagga, P. S. QGRS Mapper: a web-based server for predicting G-quadruplexes in nucleotide sequences. Nucleic Acids Research. 34, 676-682 (2006).
- Zuker, M. Mfold web server for nucleic acid folding and hybridization prediction. Nucleic Acids Research. 31 (13), 3406-3415 (2003).
- Gupta, M., et al. Ligand-induced conformation changes drive ATP hydrolysis and function in SMARCAL1. The FEBS Journal. 282 (19), 3841-3859 (2015).
- Dutta, P., et al. Global epigenetic changes induced by SWI2/SNF2 inhibitors characterize neomycin-resistant mammalian cells. PloS One. 7 (11), 49822 (2012).
- Muthuswami, R., et al. Phosphoaminoglycosides inhibit SWI2/SNF2 family DNA-dependent molecular motor domains. Biochemistry. 39 (15), 4358-4365 (2000).
- Gondeau, C. Circular dichroism and UV melting studies on formation of an intramolecular triplex containing parallel T*A:T and G*G:C triplets: netropsin complexation with the triplex. Nucleic Acids Research. 26 (21), 4996-5003 (1998).
- Nongkhlaw, M., Gupta, M., Komath, S. S., Muthuswami, R. Motifs Q and I are required for ATP hydrolysis but not for ATP binding in SWI2/SNF2 proteins. Biochemistry. 51 (18), 3711-3722 (2012).
- Luchnik, A. N. DNA conformational transitions induced by supercoiling control transcription in chromatin. Gene Regulation and Systems Biology. 8, 89-96 (2014).
- Siddiqui-Jain, A., Grand, C. L., Bearss, D. J., Hurley, L. H. Direct evidence for a G-quadruplex in a promoter region and its targeting with a small molecule to repress c-MYC transcription. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11593-11598 (2002).
- Uribe, D. J., Guo, K., Shin, Y. -. J., Sun, D. Heterogeneous nuclear ribonucleoprotein K and nucleolin as transcriptional activators of the vascular endothelial growth factor promoter through interaction with secondary DNA structures. Biochemistry. 50 (18), 3796-3806 (2011).
- Young, S. L., Krawczyk, S. H., Matteucci, M. D., Toole, J. J. Triple helix formation inhibits transcription elongation in vitro. Proceedings of the National Academy of Sciences of the United States of America. 88 (22), 10023-10026 (1991).
- Dürr, H., Flaus, A., Owen-Hughes, T., Hopfner, K. -. P. Snf2 family ATPases and DExx box helicases: differences and unifying concepts from high-resolution crystal structures. Nucleic Acids Research. 34 (15), 4160-4167 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены