Method Article
Ex Vivo Retinal Doku Örneklerinde Mitokondriyal Solunum ve Glikoliz Tayini
Bu Makalede
Özet
Burada, ticari bir biyoanalizör kullanarak ex vivo retinal doku örneklerinde mitokondriyal stres tahlilini ve glikolitik oran tahlilini yapmak için ayrıntılı bir protokol açıklanmıştır.
Özet
Mitokondriyal solunum, tüm hücrelerde, özellikle de oldukça aktif bir metabolizmaya sahip retina fotoreceptörlerinde kritik bir enerji üreten yoldur. Ek olarak, fotoreceptörler de kanser hücreleri gibi yüksek aerobik glikoliz sergiler. Bu metabolik aktivitelerin hassas ölçümleri, fizyolojik koşullar altında ve hastalık durumlarında hücresel homeostaz hakkında değerli içgörüler sağlayabilir. Canlı hücrelerde mitokondriyal solunumu ve çeşitli metabolik aktiviteleri ölçmek için yüksek verim mikro plaka bazlı tahliller geliştirilmiştir. Bununla birlikte, bunların büyük bir çoğunluğu kültürlü hücreler için geliştirilmiştir ve bozulmamış doku örnekleri ve uygulama ex vivo için optimize edilmiştir. Burada açıklanan, mikro plaka tabanlı floresan teknolojisini kullanarak, mitokondriyal solunumun bir göstergesi olarak oksijen tüketim oranını (OCR) ve glikoliz göstergesi olarak hücre dışı asitleşme oranını (ECAR) doğrudan ölçmek için sağlam ex vivo retina dokusunda ayrıntılı bir adım adım protokoldür. Bu yöntem, yetişkin fare retinasında metabolik aktiviteleri başarılı bir şekilde değerlendirmek ve yaşlanma ve hastalığın hücresel mekanizmalarını araştırmadaki uygulamasını göstermek için kullanılmıştır.
Giriş
Mitokondriler, birden fazla önemli fizyolojik süreci koordine ederek hücresel metabolizmayı, sinyalizasyon, homeostaz ve apoptoz düzenleyen temel organeldir1. Mitokondri, oksidatif fosforilasyon (OKSOFS) yoluyla adenozin trifosfat (ATP) üretmek ve hemen hemen tüm hücresel olayları destekleyen enerji sağlamak için hücredeki güç merkezi olarak hizmet vermektedir. Hücresel oksijenin çoğunluğu, aerobik solunum sırasında elektron taşıma zincirinde (ETC) son elektron kabul edicisi olarak hizmet ettiği mitokondrilerde metabolize edilir. Düşük miktarda ATP, glikozun piruvata dönüştürüldüğü, laktata daha fazla dönüştürülebilen veya mitokondrilere taşınabilen ve trikarboksilik asit döngüsünde (TCA döngüsü) bir substrat olan asetil-CoA'ya oksitlenebilen sitozoldeki glikolizden de üretilebilir.
Retina, memelilerde metabolik olarak en aktif dokulardan biridir2, yüksek düzeyde mitokondriyal solunum ve son derece yüksek oksijen tüketimi gösterir3. Çubuk ve koni fotoreceptörleri yüksek yoğunlukta mitokondri4 içerir ve OXPHOS retinada çoğu ATP üretir5. Ek olarak, retina ayrıca glikozu laktatata dönüştürerek aerobik glikoliz6,7'ye de dayanır5. Mitokondriyal defektler çeşitli nörodejeneratif hastalıklarla ilişkilidir8,9; ve benzersiz yüksek enerji talepleri ile retina, mitokondriyal OKSPHOS4 ve glikoliz10'u etkileyenler de dahil olmak üzere metabolik kusurlara karşı özellikle savunmasızdır. Glikolizdeki mitokondriyal disfonksiyon ve defektler retina11,12 ve maküler13 dejeneratif hastalıklarda, yaşa bağlı makula dejenerasyonunda10,14,15,16 ve diyabetik retinopatide ilişkilidir17,18. Bu nedenle, mitokondriyal solunum ve glikolizin doğru ölçümleri retinanın bütünlüğünü ve sağlığını değerlendirmek için önemli parametreler sağlayabilir.
Mitokondriyal solunum, oksijen tüketim oranının (OCR) belirlenmesi ile ölçülebilir. Glikozun piruvata ve daha sonra laktata dönüştürülmesinin protonların hücre dışı ortama ekstrüzyonuna ve asitleşmesine neden olduğu göz önüne alındığında, hücre dışı asitleşme oranının (ECAR) ölçümleri glikoliz akısının bir göstergesini sağlar. Retina, substrat değişimi de dahil olmak üzere samimi ilişkilere ve aktif sinerjiye sahip birden fazla hücre tipinden oluştuğundan6, mitokondriyal fonksiyonu ve metabolizmayı tüm retina dokusu bağlamında bozulmamış laminasyon ve devre ile analiz etmek zorunludur. Son birkaç on yıldır, Clark tipi O2 elektrotları ve diğer oksijen mikroelektodları retinadaki oksijen tüketimini ölçmek için kullanılmıştır19,20,21. Bu oksijen elektrotları hassasiyette büyük sınırlamalara, büyük bir numune hacmine ve genellikle hücresel ve doku bağlamının bozulmasına yol açan askıda numunenin sürekli karıştırılması ihtiyacına sahiptir. Burada açıklanan protokol, yeni parçalanmış ex vivo fare retina dokusunda mitokondriyal enerji metabolizmasını ölçmek için mikro plaka bazlı, floresan tekniği kullanılarak geliştirilmiştir. Süspansiyon ve sürekli karıştırma ihtiyacını önlerken, ex vivo retina dokusunun küçük bir örneğini (1 mm punch) kullanarak hem OCR hem de ECAR'ın orta verimli gerçek zamanlı ölçümlerine izin verir.
Burada, yeni parçalanmış retinal zımba disklerinde mitokondriyal stres tahlili ve glikoliptik oran tahlil için deneysel prosedür gösterilmiştir. Bu protokol, mitokondri ile ilgili metabolik aktivitelerin eks vivo doku bağlamında ölçülenine izin verir. Kültürlü hücreler kullanılarak yapılan tahlillerden farklı olarak, burada elde edilen okumalar doku düzeyinde kombine enerji metabolizmasını yansıtır ve doku içindeki farklı hücre tipleri arasındaki etkileşimlerden etkilenir. Protokol, Islet Capture plakalı Agilent Seahorse hücre dışı akı 24 kuyulu (XFe24) çözümleyicisinin yeni nesline uyum sağlamak için daha önce yayımlanmış bir sürüm22,23'ten değiştirilir. Tahlil ortamı, enjeksiyon bileşik konsantrasyonları ve tahlil döngülerinin sayısı/süresi de retina dokusu için optimize edilmiştir. Retina zımba disklerinin hazırlanması için ayrıntılı bir adım adım protokol verilir. Program kurulumu ve veri analizi hakkında daha fazla bilgi üreticinin kullanım kılavuzundan alınabilir24,25,26.
Protokol
Tüm fare protokolleri Ulusal Göz Enstitüsü Hayvan Bakım ve Kullanım Komitesi (NEI ASP# 650) tarafından onaylandı. Fareler 12 saat açık-karanlık koşullarda barındırıldı ve Laboratuvar Hayvanlarının Bakımı ve Kullanımı Rehberi, Laboratuvar Hayvan Kaynakları Enstitüsü ve Laboratuvar Hayvanlarının İnsani Bakımı ve Kullanımına ilişkin Halk Sağlığı Hizmet Politikası'nın önerilerine uyularak bakımları yapıldı.
1. Sensör kartuşunun nemlendirilmesi ve test ortamının hazırlanması
- Deneyden bir gün önce, yardımcı plakanın her kuyusuna 1 mL kalibrasyon ortamı ekleyin. Hydro-Booster kapağını üste yerleştirin ve sensör kartuşunu kapak üzerindeki açıklıktan diriltin. Sensörün kalibrasyon ortamına batırıldığından emin olun. Floroforları etkinleştirmek için sensör kartuşunu 37 °C'de CO2 içermeyen bir inkübatörde bir gecede kuluçkaya yatırın.
NOT: Buharlaşmayı önlemek için, inkübatör içinde bir tepsi su tutularak nemlendirilir ve sensör kartuş kaseti şeffaf plastik sargı ile sarılır. - Seahorse DMEM ortamını istenen konsantrasyonlara glikoz, piruvat ve glutamin ilavesiyle yeniden inşa derek tahlil ortamını hazırlayın. Bu makalede bildirilen tahlillerde, tahlil ortamındaki son substrat konsantrasyonu şunlardır: 6 mM glikoz, 0.12 mM piruvat ve 0.5 mM glutamin. Her test plakası için, deney günü 40 mL test ortamı taze olarak hazırlanır.
- Üreticinin talimatını izleyerek analizörde tahlil programını ayarlayın26. Burada gösterilen testte protokol şu şekilde belirlenmiştir: Taban çizgisi için 5 döngü ölçüm, ardından A portunun enjektesi, ardından 4 ölçüm döngüsü, ardından B portunun enjektesi ve ardından 4 ölçüm döngüsü. Her döngü karışımdan (3 dk), bekleme (2 dk) ve ölçümden (3 dk) oluşur.
2. Adacık yakalama mikro plakasının kaplama örgü uçları
- Hücre ataşman ortamının 20 μL'lik kısmını (örneğin, Hücre Tak) 171 μL 0,1 M sodyum bikarbonat ve 9 μL 1 M NaOH ile birleştirerek kaplama karışımını hazırlayın.
- Kafes uçları içeren kasetin kapağını açın. Her örgü kesici uçlara kaplama karışımının pipeti 8 μL. Kaplama karışımını örgü kesici ucun her yerine eşit olarak dağıtmak için damlacığı hafifçe bulaştırmak / etrafa yaymak için bir pipet ucu kullanın.
- Kaseti kapatın ve ağ uçlarının adsorpsiyon için oda sıcaklığında en az 25 dakika kuluçkaya yatmasına izin verin.
- Tahlil ortamının 4 mL'lik kısmını doğrudan örgü kesici uçlara pipetleme yaparak ağ kesici uçlarını yıkayın. Tüm örgü uçlarının tahlil ortamıyla yıkanmasını sağlamak için kaseti hafifçe sallayın.
- Ağ kesici ucu bir kenara bırakın. Kullanıma hazırdır.
3. Enjeksiyon bileşiklerinin hazırlanması
- -80 °C dondurucudan Bam15 (10 mM), Rotenon (10 mM), Antimicin A (10 mM) ve 2-DG (500 mM) stok aliquots'u çıkar ve oda sıcaklığında çözün.
NOT: 2-DG stoku kullanıma hazırdır. Diğer ilaçların çalışma stoğuna seyreltilmesi gerekir. - 37 °C'lik su banyosunda 10 mL test ortamını ısıtın.
- İki aşamalı bir seyreltme prosedürü kullanarak 10 mM Bam15 stoğunu 50 μM çalışma stoğuna seyreltin: 5 mM ara stok elde etmek için 20 μL 10 mM stoku 20 μL DMSO ile karıştırın. Daha sonra yukarıdaki 5 mM ara stokun 10 μL'sini 990 μL önceden ısıtılmış test ortamı ile karıştırarak son 50 μM çalışma stoğunu elde edin.
- 10 mM Rotenone ve 10 mM Antimiycin A stoğunu iki adım seyreltme ile 10 μM Rotenone/Antimiycin A (Rot/AA) çalışma stoğuna seyreltin ve birleştirin: 10 mM Rotenone ve 10 mM Antimycin A stokunun her birini 10 μL DMSO ile karıştırarak 1 mM Rot/AA ara stok elde edin. Ardından, yukarıdaki 1 mM ara stokun 10 μL'sini 990 μL önceden ısıtılmış test ortamı ile karıştırarak son 10 μM Rot/AA çalışma stoğunu elde edin.
- Deney günü enjeksiyon bileşiklerinin yukarıda belirtilen çalışma stoklarını yeni hazırlayın ve sensör kartuşunun enjeksiyon portlarına yüklenene kadar oda sıcaklığında bir kenara koyun.
4. Retina diseksiyonu ve retina zımbası hazırlama
- Ötenazi ile ilgili AVMA Yönergeleri'ne uyarak bir fareyi CO2 boğulması ile ötenazi yapın27.
NOT: Hayvanı ötanazi için gereken süreden daha uzun bir CO2 odasında bırakmayın. - Gözleri enükle edin ve petri kabındaki buz gibi 1x PBS tamponuna yerleştirin ve ardından bir diseksiyon mikroskobu altına yerleştirin.
- Mikros makaslarla keserek, göz küresinin dışına takılan ekstra rektus kaslarını dikkatlice çıkarın ve optik siniri kesin.
- Korneanın (limbus) kenarındaki bir deliği delmek için 30 G'lik bir iğne kullanın; bu, mikroscisörler için ekleme alanı görevi görür. Daha sonra, korneanın kenarı boyunca dairesel bir kesim yapmak için ince bir diseksiyon mikrossörleri kullanın ve arka göz kabından ayırın.
- Korneayı, lensi ve vitreus mizahını göz kabından uzaklaştırmak için keskin diseksiyon tokmakları kullanın.
- Göz kabının kenarında skleral tabaka üzerinde birkaç küçük kesim yapmak için ince diseksiyon mikrossörleri kullanın. Retina tabakasını kesmekten kaçının. Kesimin her iki tarafındaki skleral dokuya tutunmak için iki keskin diseksiyon tokparlaması kullanın ve sinir retinasından çıkarmak için skleral tabakayı çok dikkatli bir şekilde çekin. Tüm sklera çıkarılana ve sağlam bir retina kabı elde edilene kadar bunu göz kabının etrafında tekrarlayın.
- Diseksiyon mikrossörleri kullanın ve düzleştirmek ve birkaç farklı bölüm oluşturmak için retina kabında radyal kesikler yapın.
NOT: Kişinin diseksiyon becerilerine ve taze retina dokusunu kullanmadaki deneyimine bağlı olarak, retina kabı 3 ila 5 farklı bölüm oluşturmak için kesilebilir. - Düzleştirilmiş retina kabının her bölümünden bir retina diski kesmek için 1 mm çapında biyopsi zımbalayıcı kullanın.
NOT: Retina disklerinin optik sinir başlığına eşit mesafede delmesine özen verilmelidir. - Önceden kaplanmış örgü uçlarını diseksiyon petri kabına aktarmak için önseçim kullanın. İki yüzeyli kirpik fırçası yardımıyla retina delme diskini ağ ucuna yerleştirin. Retina zımba diski, ganglion hücre katmanı tarafı aşağı bakacak şekilde mesh ve fotoreceptör tabakası yukarı bakacak şekilde mesh kesici ucun ortasına yerleştirilir.
NOT: Sık sık, bazı RPE hücreleri fotoreceptörlere bağlı kalır ve bu hücrelerin pigmentasyonu retina delikli disk yönünün bir göstergesi olarak kullanılabilir.
5. Sensör kartuşu enjeksiyon bağlantı noktalarının ve kalibrasyonunun yüklenmesi
- Hidratlı sensör kartuş plakası kasetini 37 °C inkübatörden çıkar. Hydro-Booster kapağını çıkarın ve sensör kartuşunu tekrar şebeke plakasına yerleştirin.
- İstediğiniz miktarda enjeksiyon bileşik çalışma stoku çözümlerini uygun bağlantı noktalarına yükleyin. Pipet ucunu 45 ° açıyla tutun. Pipet ucunu, ucun eğimi enjeksiyon bağlantı noktasının karşı duvarına olacak şekilde bir enjeksiyon bağlantı noktasına yarıya kadar yerleştirin ve bileşiği her bağlantı noktasına hafifçe yükleyin. Hava kabarcıklarını tanıtmaktan kaçının.
- Belirli bir test için her enjeksiyon bağlantı noktasına yüklenen bileşiğin hacmi için cihaz kullanım kılavuzuna bakın. Bu makalede sunulan deneylerde, 50 μM Bam15 çalışma stoğunun 68 μL'si (mitokondriyal stres tahlil için) veya 10 μM Rot/AA çalışma stoğunun 68 μL'si (glikolitik oran tahlil için) A limanına yüklenir; 75 μL 10 μM Rot/AA çalışma stoğu (mitokondriyal stres tahlil için) veya 75 μL 500 mM 2-DG çalışma stoğu (glikolitik oran tahlil için) B portuna yüklenir.
- Uygun enjeksiyonu sağlamak için arka plan düzeltme kuyuları ve boş kuyular da dahil olmak üzere plakanın tüm kuyularının yük enjeksiyon portları. Arka plan düzeltme kuyuları için ilgili bileşik çözeltiyi her bağlantı noktasına yükleyin. Banka kuyularının her bir limanında bileşik çözelti yerine tahlil ortamı ikame edilebilir.
- Test çalışmasından önce kalibrasyona başlamak için yüklü sensör kartuş plakasını kapağı kapalı olarak analizör makinesine yerleştirin. Kalibrasyon bittikten sonra, program otomatik olarak duraklatılır ve yardımcı plakanın retina zımbaları içeren adacık yakalama plakası ile değiştirilmesini bekler.
6. Adacık yakalama plakasını yüklemek ve test çalıştırmasını başlatmak
- Adacık yakalama plakasının her kuyusuna 607 μL test ortamı ekleyin
- Üstte retina zımba diskleri içeren ağ kesici ucunun kenarını kapmak ve Petri kabından çıkarmak için tokmak kullanın. Ekstra sıvıyı çıkarmak ve adacık yakalama plakasının kuyusuna koymak için emici bir silme dokusu üzerindeki ağ kesici ucunun altına hafifçe dokunun. Retina zımbalı tüm ağ uçları adacık yakalama plakasına yerleştirnine kadar bu adımı tekrarlayın. Arka plan düzeltme kuyularını ve boş kuyuları boş ağ uçlarıyla doldurun.
- Her kafes kesici ucun kenarına dikkatlice ve hafifçe basmak ve bunların adacık yakalama plakasının altına güvenli bir şekilde yerleştirildiğinden emin olmak için iki Graefe tokmak kullanın.
- Yüklenen adacık yakalama plakasını ısınmak için 5 dakika boyunca 37 °C'lik bir inkübatöre yerleştirin.
- Kalibrasyon tamamlandıktan sonra yardımcı plakayı çıkarın ve bir ile değiştirin ve retina zımbaları içeren kapak kapalı adacık yakalama plakası ile değiştirin.
- Test çalışmasına devam edin.
7. Sonlandırma ve veri depolamayı çalıştırın
- Çalıştırma tamamlandıktan sonra, retina zımbaları içeren sensör kartuşunu ve adacık yakalama plakasını dışarı dışarı çıkar. Veriler otomatik olarak .asyr dosyası olarak kaydedilir.
- Üreticinin kullanım kılavuzunun ardından verileri görüntülemek ve çözümlemek için ilişkili veri çözümleme yazılımını kullanın26.
- Elektronik tablo yazılımı kullanılarak görüntülenebilen ve çözümlenebilen verilerin .xslx dosyasını dışa vermek için Dışarı Aktar işlevini kullanın.
8. Retina zımba örneğinin kaydediliyor
- Testten sonra, plakayı makineden çıkarın, sensör kartuşunu çıkarın ve bir pipet kullanarak her kuyudan tahlil ortamını hafifçe çıkarın.
- Kapağı tekrar uygulayın ve plakanın kenarlarını parafilm şeridi ile kapatın.
- -80 °C'de saklayın.
- Normalleşme için, her kuyudaki yumruğun toplam DNA'sını veya protein içeriğini ölçün.
9. Veri analizi
- Mitokondriyal stres tahlili
NOT: Ölçülen OCR değeri (totalOCR) doku tarafından toplam oksijen tüketimini temsil eder. Bam15 (uncoupler) enjeksiyonundan sonra, OCR bazal seviyeden (totalOCRbasal) maksimum seviyeye (totalOCRmax) yükselir ve Rot / AA enjeksiyonundan sonra aşağı iner. Rot/AA enjeksiyonundan sonra kalan OCR değeri (totalOCRRot/AA) mitokondriyal olmayan oksijen tüketimini temsil eder.- Mitokondri ile ilgili oksijen tüketimini şu şekilde hesaplayın:
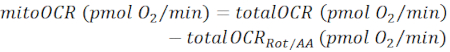 (Eş. 1) 28
(Eş. 1) 28
- Mitokondriyal rezerv kapasitesini (MRC) şu şekilde hesaplayın:
 (Eş. 2) 29
(Eş. 2) 29
NOT: Bam15 enjeksiyonundan önceki 5 ölçüm arasında son okuma "bazal" değer olarak alınır (totalOCRbasal ve mitoOCRbasal için). Bam15 enjeksiyonunu takip eden 4 ölçüm arasında en yüksek okuma "max" değeri olarak kullanılır (totalOCRmax ve mitoOCRmax için). Rot/AA enjeksiyonunu takip eden 4 ölçüm arasında en düşük okuma totalOCRRot/AA olarak kullanılır.
- Mitokondri ile ilgili oksijen tüketimini şu şekilde hesaplayın:
- Glikolitik oran tahlil
NOT: Ölçülen ECAR değeri (totalECAR), ortamın dokunun metabolik aktivitesi tarafından toplam asitlenmesini temsil eder. Genel olarak, hücre dışı mikro çevrenin asitlenmesi esas olarak glikolitik ürün olan laktatın ekstrüzyonu ile sonuçlanır. Mitokondriyal TCA döngüsündeki substratların katabolizması, hücre dışı ortamı bikarbonat için hidrasyon yoluyla asitleştiren CO2 üretimi ile sonuçlanır.- Substract mitokondriyal, glikoECAR'ı elde etmek için totalECAR'dan orta asitleşmeye (mitoECAR) katkıda bulundu.
 (Eş. 3) 28
(Eş. 3) 28
NOT: Mitokondriyal solunum ve TCA döngüsü güçlü bir şekilde bağlanmış süreçlerdir. Mitokondriden CO2 üretimi, mitoOCR ile ölçülebilen OKSFOS oranının bir işlevidir. - MitoECAR'ı şu şekilde hesaplayın:
 (Eş. 4) 28
(Eş. 4) 28
burada, CCF (CO2 Katkı Faktörü), CO2 aracılı asitleşmeden elde edilen H+ katkı miktarını ve OXPHOS'tan gelen her O2 tüketimini temsil eden ampirik olarak hesaplanan bir oran değeridir. Bu sistem için CCF önceden 0.6028 olarak belirlenmiştir. Orta asitleşmenin doğru ölçümü, ortamın tampon kapasitesi, alet pH sensörünün hassasiyeti ve etkili ölçüm odası kapasitesi ile belirlenir. Burada, BF (Tampon Faktörü), pH seviyesini 1 birim değiştirmek için etkili ölçüm odasına eklenen H+ veya OH miktarını temsil eden yerinde deneysel tampon kapasitesinin bir parametresidir. Özelleştirilmiş test ortamı kullanıldığında, BF, Tampon Faktör protokolü30'u takiben bilinen asit miktarlarını test ortamına titratlayarak belirlenebilir. Bu protokolde kullanılan Seahorse DMEM orta pH 7.4, önceden belirlenmiş 2.60 mmol H+/L/pH'lık bir BF'ye sahiptir. Bu protokolde kullanılan adacık yakalama plakası volmicrochamber = 16,6 μL31'e sahiptir. Hacim ölçekleme faktörü Kvol, ampirik olarak belirlenmiş bir sabittir. Kvol değeri adacık yakalama plakası için mevcut değildir, ancak mikrokaçamlarındaki hacim farkını oluşturan mikro plaka28'in değerinden 0,41 olarak hesaplanabilir.
NOT: Rot/AA enjeksiyonu mitokondriyal solunumu kapatır ve dokuyu ATP üretimi için glikolizise geçmeye zorlar, bu da daha yüksek laktat ekstrüzyonuna ve ECAR ölçümünde artışa yol açtı. Glikoliz 2-DG enjeksiyonu ile durdurulur ve artık ECAR ölçümü, ortanın glikolitik olmayan ve mitokondriyal olmayan asitleşmesini ortaya çıkarır. - Glikolitik rezerv kapasitesini (GRC) şu şekilde hesaplayın:
 (Eş. 5) 32
(Eş. 5) 32
burada Rot/AA enjeksiyonu öncesi 5 ölçüm arasında son okuma "bazal" değer (glikoECARbasal) olarak alınır. Rot/AA enjeksiyonunu takip eden 4 ölçüm arasında en yüksek okuma "max" değeri (glycoECARmax) olarak kullanılır. 2-DG enjeksiyonunu takip eden 4 ölçüm arasında en düşük okuma glikoECAR2-DG olarak kullanılır.
- Substract mitokondriyal, glikoECAR'ı elde etmek için totalECAR'dan orta asitleşmeye (mitoECAR) katkıda bulundu.
- Normal -leştirme
NOT: Farklı yaş gruplarındaki retina dokularından veya hücre sayılarında farklılık gösterebilecek vahşi tip ve patolojik/dejeneratif örnekler arasındaki okumalar karşılaştırıldığında normalleşme esastır.- Her retina delme diskinde DNA içeriğini değerlendirmek için uygun kitleri kullanın33,34.
- Alternatif olarak, retina deminden toplam proteini çıkarmak ve normalleşme için protein içeriğini kullanmak için radyoimmunoprecipitation test tamponu (RIPA tamponu) kullanın.
NOT: Yetişkin bir fare retinasının yüzey alanının daha önce 20 mm2 civarında olduğu belirlenmiştir ve her retina ~ 6,5 milyon hücre içerir35. Bu nedenle, her 1 mm çapında retina zımbası tek bir retinanın ~ 1/25'idir ve ~ 260K hücreler içerir. Retina yumruğundaki verileri diğer doku örneklerinden veya kültürlü hücrelerden gelenlerle karşılaştırırken bu sayılara başvurabilirsiniz,
Sonuçlar
Burada bildirilen veriler, 4 aylık transgenik Nrl-L-EGFP mice36'dan (C57B/L6 arka plan) taze parçalanmış 1 mm retinal zımba diskleri kullanılarak gerçekleştirilen OCR izini (Şekil 1) ve OCR izini ve ECAR izini gösteren glikoliptik oran testini gösteren temsili mitokondriyal stres tahlilidir (Şekil 2). Bu fareler GFP'yi normal retina gelişimini, histolojiyi ve fizyolojiyi değiştirmeden özellikle çubuk fotoreceptörlerde ifade etmişlerdir ve retina araştırmalarında vahşi tip kontroller olarak yaygın olarak kullanılmıştır. Burada sunulan tahlillerde iki adet Nrl-L-GFP çöp arkadaşı fare kullanılmıştır. Nrl-L-GFP farelerinde ifade edilen GFP, bu protokoldeki OCR ve ECAR ölçümlerini engellemez. Her retinadan beş retina yumruğu alındı. Retina yumruklarının 10'u mitokondriyal stres tahlili için, diğer 10'u ise glikolitik oran tahlilinde kullanıldı. Deneylerde Denizatı XF DMEM ortamı, pH 7.4 (6 mM glikoz, 0.12 mM piruvat ve 0.5 mM glutamin ile oluşturulmuş) ve Seahorse XFe24 Adacık Yakalama plakaları kullanılmıştır. Burada sunulan temsili veriler aynı 1 mm çapında delme kullanılarak elde edilmiş ancak DNA/protein içeriği açısından normalleştirilmedi.
Mitokondriyal stres testinde, uncoupler Bam1537, OCR taban çizgisini oluşturduktan sonra enjekte edildi ve bu da OCR'nin maksimum seviyeye çıkarılmasına yol açtı. Rotenon ve Antimisin A, sırasıyla kompleks I ve kompleks III'te mitokondri solunumunu inhibe etmek için enjekte edildi ve bu da OCR'nin minimum seviyeye düşmesine neden oldu (Şekil 1). OCR'nin maksimal düzeyi ile bazal OCR seviyesinin son ölçümü arasındaki fark mitokondriyal rezerv kapasitesini (MRC) yansıtır. MRC, önceki nesil Seahorse XF24 analizörü22,38 kullanılarak ~3 aylık Nrl-L-EGFP farelerinin retinalarında daha önce ölçülen MRC değerleriyle tutarlı olarak, Eq. 2 kullanılarak%19,2 ±3,4% olarak hesaplanır.
Glikolitik oran testinde, Rotenone ve Antimycin A, toplam ECAR için taban çizgisi belirlendikten sonra enjekte edildi. OXPHOS'tan ATP üretimi durdurulduğunda, doku enerji için glikolize güvenmek zorunda kalır ve laktatın hücre dışı salınımındaki artış ECAR'ı maksimum seviyeye çıkarır. Glikoliz, heksikinez bağlama için glikozla rekabet eden 2-DG enjeksiyonu ile durdurulur ve ECAR'ın minimum seviyeye düşmesine neden olur (Şekil 2). Mitokondri katkılı ECAR (mitoECAR) mitoOCR değerinden hesaplanabilir (Eq. 4). Glikoliz katkılı ECAR glikoECAR, mitoECAR'ın totalECAR'dan çıkarılmasıyla hesaplanır ve çizilir. GlikoECAR'ın maksimal seviyesi ile glikoECAR bazal seviyesinin son ölçümü arasındaki fark, glikoliz rezerv kapasitesini (GRC) yansıtır. Burada, GRC%35,7 ± %3,4 olarak hesaplanır.
Son derece glikolitik bir doku olarak, retinadan laktat üretimi, glikOECAR'ın totalECAR'dan küçük farkının ortaya çıkardığı gibi, önemli bir hücre dışı asitleşme kaynağını oluşturur. İlginçtir ki, ECAR ölçümü Rot/AA enjeksiyonundan hemen sonra plato yapmaz, ancak ikinci ölçümden sonra düşer. Retina zımba diski, fotoreceptörlerden salınan laktat (glikoliz son ürünü) aldığı bilinen Müller glia hücreleri de dahil olmak üzere farklı hücre tiplerinden oluşan sağlam bir ex vivo sistemidir6. Bu nedenle, Rot/AA enjeksiyonundan sonra ECAR ölçümündeki bir düşüş, muhtemelen laktatın hücreler arası alandan daha fazla çıkarılması ve ortama salınmasının yavaşlatılmış /önlenmesi ile açıklanmaktadır.

Şekil 1: Mitokondriyal stres tahlili. Çizilen grafik, Seahorse XF DMEM tamponunda 1 mm retinal zımba disklerinden 6 mM glikoz, 0,12 mM piruvat ve 0,5 mM glutamin ile desteklenmiş OCR izini göstermektedir. Her veri noktası, 10 kuyudan ölçümlerin ortalamasını temsil eder. Hata çubuğu = standart hata. MRC %19.2 ±3.4% olarak hesaplanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Glikolitik oran tahlil. Çizilen grafik, ölçülen OCR izini, ECAR izini (totalECAR) ve hesaplanan glikolizin Seahorse XF DMEM tamponunda 6 mM glikoz, 0,12 mM piruvat ve 0,5 mM glutamin ile desteklenen 1 mm retinal punch disklerden ECAR'a (glikoECAR) katkıda bulunduğunu göstermektedir. Her veri noktası, 10 kuyudan ölçümlerin ortalamasını temsil eder. Hata çubuğu = standart hata. GRC%35,7 ±3,4% olarak hesaplanmıştır Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada, ex vivo, taze parçalanmış retina zımba diskleri kullanarak mitokondriyal solunum ve glikoliz aktivitesinin mikro plaka bazlı testlerini gerçekleştirmek için ayrıntılı talimatlar verilmiştir. Protokol şu şekilde optimize edilmiştir: 1) ex vivo retina dokusu için uygun bir tahlil ortamının kullanılmasını sağlamak; 2) makinenin optimum algılama aralığına giren OCR ve ECAR okumalarını elde etmek için uygun boyutta retina delme diskleri kullanmak; 3) ölçüm döngüsü sırasında istikrarlı okuma için retina zımba yapışkanlığını artırmak için kaplama örgü ekler; 4) enjekte edilen her ilaç bileşiği optimal konsantrasyon kullanımı; ve 5) her adımda mitokondriyal durumların bir plato ulaşmak için değiştirilmiş döngü uzunluğu sağlamak. Reaktifler ve protokol, yeni nesil Seahorse XFe24 makinesine uyum sağlamak için daha önce yayımlanmış bir sürüm23'ten değiştirilmiştir. Ames'in önceki protokolde kullanılan tamponu yerine23, burada glikoz, glutamin ve piruvatı ayrı ayrı ekleyerek yakıt kaynağının özel yapısına izin vermek için temel bir Seahorse DMEM ortamı kullanılır. Bu, belirli bir yakıt substratın sağlandığı veya ortamdan yoksun bırakıldığı çeşitli tahlillerin gerçekleştirilmesini de mümkün kılar. Burada sunulan tahlillerde ortam, retina dokusuna uygun olduğu kanıtlanmış Ames tamponunda olduğu gibi aynı glikoz (6 mM), glutamin (0,5 mM) ve piruvat (0,12 mM) konsantrasyonunda oluşturulmuştu. Bu ortamın (5 mM HEPES ile) Ames'in tamponu üzerindeki bir diğer avantajı (22,6 mM NaHCO3 ile) ECAR28'in hassas ve doğru ölçümünü sağlayan düşük tampon kapasitesidir.
Hem mitokondriyal stres hem de glikolitik oran tahlilleri, çoğaltma kuyuları arasındaki sıkı standart hata değerlerinin kanıtlandığı gibi, burada açıklanan protokolün ardından yüksek hassasiyetle gerçekleştirilebilir. Ancak, veri değişkenliğine katkıda bulunabilecek faktörleri not etmek faydalı olacaktır. Retina dokusunda hücre ölümünden kaçının. Tüm diseksiyon işlemi buz gibi 1x PBS'de yapılmalı ve gözlerin enükleasyonundan retina demesini içeren adacık yakalama plakasının makineye konulmasına kadar olan süreç 2 saati geçmemelidir. Retina dokusunun zarar görmemesi için retina kabının diseksiyonu sırasında dikkatli olunmalı, diseksiyondan zarar gören bölgelerden yumruk alınmamalıdır. Her deneyde yeni, keskin biyopsi puncher kullanılmalıdır ve 1 mm çapında retina yumruklarının kesilmesinde tutarlılık ve doğruluk sağlamak için kenar donuk veya bükülmüş olduğunda zımbalayıcıyı değiştirilmelidir. Bölgesel varyasyonları önlemek için retina disklerini optik sinir kafasından eşitlikçiye deldirmeye çalışın (merkeze karşı periferik). Testten sonra, retina zımbasının ağ kesici uçtan koptuklarından herhangi bir işaret olup olmadığını her kuyuya kontrol edin. Bir retina yumruğu, ölçüm sırasında ağ kesici ucu veya ayırıcılar üzerinde zayıf yapışıklık olduğunda, duyu probundan dokuya olan mesafe değişecek ve okumaları etkileyecektir. Müstakil retina zımbası ile bu tür kuyulardan gelen verileri atla.
Bozulmamış retina dokusunda gerçek zamanlı mitokondriyal metabolizmanın ölçümü geniş uygulamalara sahiptir ve çeşitli çalışmalar için yararlı bilgiler sağlayabilir. Bu tahliller, farklı genetik geçmişlere sahip farelerden retina dokularındaki mitokondriyal solunumu ölçmek ve mitokondriyal aktivitedeki içsel farklarını ortaya çıkarmak için kullanılmıştır39,40. Ayrıca retinanın yaşlanması sırasında mitokondriyal enerji metabolizmasındaki değişiklikleri incelemek için de kullanılmıştır38. Farklı yakıt substratları sağlayarak ve farklı metabolik yolları hedefleyen çeşitli inhibitörler kullanarak, hücre/dokunun belirli yakıt kaynakları üzerinde tercihine dair içgörüler sağlar22,38. Ayrıca, kalıtsal retina dejenerasyonu vahşi tip fare ve fare modelleri arasında OCR ve MRC karşılaştırması, dejenere retinada mitokondriyal kusurların kanıtını sağlayabilir22.
Bu tekniğin sınırlamaları vardır. Bu tahlillerde kullanılan adacık yakalama plakası sadece 24 kuyu içerir; bu nedenle, yalnızca orta aktarım hızı analizi sağlayabilir. Bu yöntemden elde edilen veri kalitesi, retina zımba disklerinin kalitesine ve hücrelerin yaşayabilirliğine dayer. Ayrıca, retina diseksiyonu ve retina zımba diskleri hazırlama, 96 kuyu plakası mevcut olsa bile canlı ex vivo retinal dokularda yüksek verim analizine daha az uygulanabilir hale getiren zaman alıcı bir süreçtir. Kültürlü hücrelerin monolayer ile karşılaştırıldığında, ilaç bileşiği retina dokusuna nüfuz etmesi de veri okumasını etkiler. Ek olarak, ölçülen OCR ve ECAR değerleri, birçok farklı hücre tipi tarafından oluşturulan tüm dokunun toplam performansını temsil eder; bu nedenle, verileri yorumlarken retinadaki farklı nöronal ve glial hücreler arasındaki ilişkiyi ve etkileşimleri göz önünde bulundurmak gerekir. Her projeye özel deneysel tasarımlar uyarlanalarak uygulanmalıdır. Teknik olarak 3 ila 5 retina zımbası (aynı göz veya aynı fareden) içermesi ve biyolojik olarak 3 veya daha fazla fareden örnekler kullanması önerilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Ulusal Göz Enstitüsü Intramural Araştırma Programı (ZIAEY000450 ve ZIAEY000546) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1X PBS | Thermo Fisher | 14190-144 | |
| 2-Deoxy glucose (2-DG), 500 mM stock solution | Sigma | D6134 | Dissolve in Seahorse XF DMEM medium, prepare ahead of time |
| 30-gauge needle | BD Precision Glide | 305106 | |
| Antimycin A, 10 mM stock solution | Sigma | A8674 | Dissolve in DMSO, prepare ahead of time |
| Bam15, 10 mM stock solution | TimTec | ST056388 | Dissolve in DMSO, prepare ahead of time |
| Biopsy puncher, 1 mm | Integra Miltex | 33-31AA | |
| Cell-Tak | Corning Life Sciences | CB40240 | |
| CO2 asphyxiation chamber | |||
| Dissection forceps-Dumont #5 | Fine Science Tools | 11251-10 | Stright tip |
| Dissection forceps-Dumont #7 | Fine Science Tools | 11274-20 | Curved tip |
| Dissection microscope | |||
| DMSO | Sigma | D2438 | |
| Graefe forceps | Fine Science Tools | 11051-10 | Curved, Serrated tip |
| Microscissors | Fine Science Tools | 15004-08 | Curved tip |
| NaOH solution, 1 M | Sigma-Aldrich | S8263 | Aqueous solution, prepare ahead of time |
| Rotenone, 10 mM stock solution | Sigma | R8875 | Dissolve in DMSO, prepare ahead of time |
| Seahorse calibration medium | Agilent | 100840-000 | |
| Seahorse XF 1.0 M glucose | Agilent | 103577-100 | |
| Seahorse XF 100 mM pyruvate | Agilent | 103578-100 | |
| Seahorse XF 200 mM glutamine | Agilent | 103579-100 | |
| Seahorse XF DMEM medium | Agilent | 103575-100 | pH 7.4, with 5 mM HEPES |
| Seahorse XFe24 Islet Capture FluxPak | Agilent | 103518-100 | Containing Sensor Cartridge and Islet Capture microplate |
| Seahorse XFe24, Extra Cellular Flux Analyzer | Agilent | ||
| Sodium bicarbonate solution, 0.1 M | Sigma-Aldrich | S5761 | Aqueous solution, prepare ahead of time |
| Superfine eyelash brush | Ted Pella | 113 |
Referanslar
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wong-Riley, M. T. Energy metabolism of the visual system. Eye Brain. 2, 99-116 (2010).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retina and Eye Research. 20, 175-208 (2001).
- Barot, M., Gokulgandhi, M. R., Mitra, A. K. Mitochondrial dysfunction in retinal diseases. Current Eye Research. 36 (12), 1069-1077 (2011).
- Joyal, J. S., Gantner, M. L., Smith, L. E. H. Retinal energy demands control vascular supply of the retina in development and disease: The role of neuronal lipid and glucose metabolism. Progress in Retina and Eye Research. 64, 131-156 (2018).
- Hurley, J. B., Lindsay, K. J., Du, J. Glucose, lactate, and shuttling of metabolites in vertebrate retinas. Journal of Neuroscience Research. 93 (7), 1079-1092 (2015).
- Haydinger, C. D., Kittipassorn, T., Peet, D. J. Power to see-Drivers of aerobic glycolysis in the mammalian retina: A review. Clinical and Experimental Ophthalmology. 48 (8), 1057-1071 (2020).
- Wright, A. F., et al. Lifespan and mitochondrial control of neurodegeneration. Nature Genetics. 36, 1153-1158 (2004).
- Bossy-Wetzel, E., Schwarzenbacher, R., Lipton, S. A. Molecular pathways to neurodegeneration. Nature Medicine. 10, 2-9 (2004).
- Leveillard, T., Philp, N. J., Sennlaub, F. Is retinal metabolic dysfunction at the center of the pathogenesis of age-related macular degeneration. International Journal of Molecular Sciences. 20 (3), (2019).
- Vlachantoni, D., et al. Evidence of severe mitochondrial oxidative stress and a protective effect of low oxygen in mouse models of inherited photoreceptor degeneration. Human Molecular Genetics. 20 (2), 322-335 (2011).
- Grenell, A., et al. Loss of MPC1 reprograms retinal metabolism to impair visual function. Proceedings of the National Academy of Science U. S. A. 116 (9), 3530-3535 (2019).
- Wright, A. F., Chakarova, C. F., Abd El-Aziz, M. M., Bhattacharya, S. S. Photoreceptor degeneration: genetic and mechanistic dissection of a complex trait. Nature Reviews in Genetics. 11 (4), 273-284 (2010).
- Jarrett, S. G., Boulton, M. E. Consequences of oxidative stress in age-related macular degeneration. Molecular Aspects of Medicine. 33 (4), 399-417 (2012).
- Rozing, M., et al. Age-related macular degeneration: A two-level model hypothesis. Progress in Retina Eye Research. 76, 100825 (2020).
- Yokosako, K., et al. Glycolysis in patients with age-related macular degeneration. Open Ophthalmology Journal. 8, 39-47 (2014).
- Bek, T. Mitochondrial dysfunction and diabetic retinopathy. Mitochondrion. 36, 4-6 (2017).
- Yumnamcha, T., Guerra, M., Singh, L. P., Ibrahim, A. S. Metabolic dysregulation and neurovascular dysfunction in diabetic retinopathy. Antioxidants. 9 (12), (2020).
- Futterman, S., Kinoshita, J. H. Metabolism of the retina. I. Respiration of cattle retina. Journal of Biological Chemistry. 234 (4), 723-726 (1959).
- Linsenmeier, R. A. Effects of light and darkness on oxygen distribution and consumption in the cat retina. Journal of General Physiology. 88 (4), 521-542 (1986).
- Medrano, C. J., Fox, D. A. Oxygen consumption in the rat outer and inner retina: light- and pharmacologically-induced inhibition. Experiments in Eye Research. 61 (3), 273-284 (1995).
- Kooragayala, K. Quantification of oxygen consumption in retina ex vivo demonstrates limited reserve capacity of photoreceptor mitochondria. Investigative Ophthalmology and Visual Science. 56 (13), 8428-8436 (2015).
- Adlakha, Y. K., Swaroop, A. Determination of mitochondrial oxygen consumption in the retina ex vivo: applications for retinal disease. Methods in Molecular Biology. 1753, 167-177 (2018).
- . Agilent Mitocondrial stress test user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Cell_Mito_Stress_Test_Kit_User_Guide.pdf (2021)
- . Agilent Glycolytic rate assay user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . Agilent wave 2.6 user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . AVMA Guidelines for the Euthanasia of Animals Available from: https://www.avma.org/sites/default/files/2020-01/2020-Euthanasia-Final-1-17-20.pdf (2021)
- . Improving Quantification of Cellular Glycolytic Rate Using Agilent Seahorse XF Technology Available from: https://www.agilent.com/cs/library/whitepaper/public/whitepaper-improve-quantification-of-cellular-glycolytic-rate-cell-analysis-5991-7894en-agilent.pdf (2021)
- . Report Generator User Guide Agilent Seahorse XF Cell Mito Stress Test Available from: https://www.agilent.com/cs/library/usermanuals/public/Report_Generator_User_Guide_Seahorse_XF_Cell_Mito_Stress_Test_Single_File.pdf (2021)
- . Agilent Seahorse XF Buffer Factor Protocol Available from: https://www.agilent.com/cs/library/usermanuals/public/usermanual-xf-buffer-factor-protocol-cell-analysis-S7888-10010en-agilent.pdf (2021)
- . Agilent sensor cartridges and cell culture microplates Available from: https://www.agilent.com/cs/library/brochures/5991-8657EN_seahorse_plastics_brochure.pdf (2021)
- . Agilent Seahorse XF Glycolysis Stress Test Kit User Guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Glycolysis_Stress_Test_Kit_User_Guide.pdf (2021)
- Fan, Y. Y. A bioassay to measure energy metabolism in mouse colonic crypts, organoids, and sorted stem cells. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309, 1-9 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell- and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. Journal of Neuroscience. 18 (21), 8936-8946 (1998).
- Akimoto, M., et al. Targeting of GFP to newborn rods by Nrl promoter and temporal expression profiling of flow-sorted photoreceptors. Proceedings of the National Academy of Science U. S. A. 103 (10), 3890-3895 (2006).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Corso-Diaz, X., et al. Genome-wide profiling identifies DNA methylation signatures of aging in rod photoreceptors associated with alterations in energy metabolism. Cell Reports. 31 (3), 107525 (2020).
- Berkowitz, B. A., et al. Mitochondrial respiration in outer retina contributes to light-evoked increase in hydration in vivo. Investigative Ophthalmology and Visual Science. 59 (15), 5957-5964 (2018).
- Joyal, J. S., et al. Retinal lipid and glucose metabolism dictates angiogenesis through the lipid sensor Ffar1. Nature Medicine. 22 (4), 439-445 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır