Method Article
Определение митохондриального дыхания и гликолиза в образцах ткани сетчатки ex vivo
В этой статье
Резюме
Здесь описан подробный протокол для проведения анализа митохондриального стресса и анализа скорости гликолитизма в образцах ткани сетчатки ex vivo с использованием коммерческого биоанализатора.
Аннотация
Митохондриальное дыхание является критическим энергетическим путем во всех клетках, особенно в фоторецепторах сетчатки, которые обладают высокоактивным метаболизмом. Кроме того, фоторецепторы также демонстрируют высокий аэробный гликолиз, как раковые клетки. Точные измерения этих метаболических активностей могут дать ценную информацию о клеточном гомеостазе в физиологических условиях и в болезненных состояниях. Высокопроизводительные микропластинчатые анализы были разработаны для измерения митохондриального дыхания и различных метаболических активностей в живых клетках. Тем не менее, подавляющее большинство из них разработаны для культивируемых клеток и не были оптимизированы для интактных образцов тканей и для применения ex vivo. Здесь описан подробный пошаговый протокол, использующий технологию флуоресценции на основе микропластин, для непосредственного измерения скорости потребления кислорода (OCR) в качестве индикатора митохондриального дыхания, а также скорости внеклеточного подкисления (ECAR) в качестве индикатора гликолиза в неповрежденной ex vivo ткани сетчатки. Этот метод был использован для успешной оценки метаболической активности в сетчатке взрослой мыши и демонстрации его применения в исследовании клеточных механизмов старения и заболеваний.
Введение
Митохондрии являются важными органеллами, которые регулируют клеточный метаболизм, передачу сигналов, гомеостаз и апоптоз, координируя несколько важных физиологических процессов1. Митохондрии служат электростанцией в клетке для генерации аденозинтрифосфата (АТФ) путем окислительного фосфорилирования (OXPHOS) и обеспечивают энергию, которая поддерживает почти все клеточные события. Большая часть клеточного кислорода метаболизируется в митохондриях, где он служит конечным акцептором электронов в цепи переноса электронов (ETC) во время аэробного дыхания. Низкие количества АТФ также могут быть получены в результате гликолиза в цитозоле, где глюкоза превращается в пируват, который может быть дополнительно преобразован в лактат или транспортироваться в митохондрии и окисляться до ацетил-КоА, субстрата в цикле трикарбоновой кислоты (цикл ТЦА).
Сетчатка является одной из наиболее метаболически активных тканей у млекопитающих2, демонстрируя высокий уровень митохондриального дыхания и чрезвычайно высокое потребление кислорода3. Палочковые и конусные фоторецепторы содержат высокую плотность митохондрий4, а OXPHOS генерирует большую часть АТФ в сетчатке5. Кроме того, сетчатка также в значительной степени зависит от аэробного гликолиза6,7 путем преобразования глюкозы в лактат5. Митохондриальные дефекты связаны с различными нейродегенеративными заболеваниями8,9; и с его уникальными высокими энергетическими потребностями, сетчатка особенно уязвима к метаболическим дефектам, в том числе тем, которые влияют на митохондриальный OXPHOS4 и гликолиз10. Митохондриальная дисфункция и дефекты гликолиза связаны с дегенеративными заболеваниями сетчатки11,12 и макулярной13, возрастной макулярной дегенерацией10,14,15,16 и диабетической ретинопатией17,18. Поэтому точные измерения митохондриального дыхания и гликолиза могут обеспечить важные параметры для оценки целостности и здоровья сетчатки.
Митохондриальное дыхание может быть измерено путем определения скорости потребления кислорода (OCR). Учитывая, что превращение глюкозы в пируват, а затем в лактат приводит к экструзии протонов и подкислению внеклеточной среды, измерения скорости внеклеточного подкисления (ECAR) дают представление о потоке гликолиза. Поскольку сетчатка состоит из нескольких типов клеток с близкими отношениями и активной синергией, включая обмен субстратами6, крайне важно проанализировать митохондриальную функцию и метаболизм в контексте всей ткани сетчатки с неповрежденным ламинированием и схемой. В течение последних нескольких десятилетий электроды Кларка типа O2 и другие кислородные микроэлектроды использовались для измерения потребления кислорода в сетчатке19,20,21. Эти кислородные электроды имеют серьезные ограничения в чувствительности, требовании большого объема образца и необходимости непрерывного перемешивания суспендирующего образца, что обычно приводит к нарушению клеточного и тканевого контекста. Протокол, описанный здесь, был разработан с использованием флуоресцентного метода на основе микропластин для измерения митохондриального энергетического метаболизма в свежерассеченной ткани сетчатки мыши ex vivo. Он позволяет одновременно измерять OCR и ECAR со средней пропускной способностью в режиме реального времени с использованием небольшого образца (1 мм перфоратора) ткани сетчатки ex vivo, избегая при этом необходимости в суспензии и непрерывном перемешивании.
Здесь показана экспериментальная процедура анализа митохондриального стресса и анализа гликолитической скорости на свежерассеченных перфораторных дисках сетчатки. Этот протокол позволяет измерять метаболическую активность, связанную с митохондриями, в контексте ткани ex vivo. В отличие от анализов, выполняемых с использованием культивируемых клеток, показания, полученные здесь, отражают комбинированный энергетический метаболизм на тканевом уровне и зависят от взаимодействия между различными типами клеток в ткани. Протокол модифицирован по сравнению с ранее опубликованной версией 22,23 для адаптации к новому поколению внеклеточного анализатора 24-луночного потока Agilent Seahorse (XFe24) с пластиной Islet Capture. Среда для анализа, концентрации инъекционных соединений и количество/продолжительность циклов анализа также были оптимизированы для ткани сетчатки. Приведен подробный пошаговый протокол приготовления перфораторных дисков сетчатки. Более подробную информацию о настройке программы и анализе данных можно получить из руководства пользователя производителя24,25,26.
протокол
Все мышиные протоколы были одобрены Комитетом по уходу за животными и их использованию Национального института глаз (NEI ASP# 650). Мыши содержались в 12-часовых светло-темных условиях и ухаживали за ними, следуя рекомендациям Руководства по уходу и использованию лабораторных животных, Института ресурсов лабораторных животных и Политики службы общественного здравоохранения по гуманному уходу и использованию лабораторных животных.
1. Картридж датчика гидратации и подготовка пробирной среды
- За день до эксперимента добавьте 1 мл калибровочной среды в каждую лунку полезной пластины. Поместите крышку Hydro-Booster сверху и опустите картридж датчика через отверстие на крышке. Убедитесь, что датчик погружен в калибровочную среду. Инкубируйте картридж датчика в течение ночи в инкубаторе без CO2 при 37 °C для активации флуорофоров.
ПРИМЕЧАНИЕ: Для предотвращения испарения инкубатор увлажняют, держа внутри лоток с водой, а кассету с картриджем датчика оборачивают прозрачной полиэтиленовой пленкой. - Подготовьте пробирную среду путем восстановления среды DMEM Seahorse с добавлением глюкозы, пирувата и глутамина до желаемых концентраций. В анализах, представленных в этой статье, конечная концентрация субстратов в пробирной среде составляет: 6 мМ глюкозы, 0,12 мМ пирувата и 0,5 мМ глутамина. Для каждой пробирной пластины в день эксперимента готовится 40 мл пробирной среды в свежем виде.
- Настройте программу анализа в анализаторе в соответствии с инструкцией производителя26. В анализе, показанном здесь, протокол устанавливается следующим образом: 5 циклов измерений для исходного уровня, затем ввод порта A, затем 4 цикла измерений, затем ввод порта B и последующие 4 цикла измерений. Каждый цикл состоит из смеси (3 мин), ожидания (2 мин) и измерения (3 мин).
2. Покрытие сетчатых вставок микропластины островкового захвата
- Приготовьте смесь покрытия, объединив 20 мкл клеточной присоединения среды (например, Cell-Tak) со 171 мкл бикарбоната натрия 0,1 М и 9 мкл 1 М NaOH.
- Откройте крышку кассеты, содержащей сетчатые вставки. Пипетку 8 мкл покрытия смешивают с каждой сетчатой вставкой. Используйте наконечник пипетки, чтобы аккуратно намазать / распределить каплю вокруг, чтобы равномерно распределить смесь покрытия по всей сетчатой вставке.
- Закройте кассету и дайте сетчатым вставкам инкубироваться при комнатной температуре в течение не менее 25 мин для адсорбции.
- Промыть сетчатую вставку, пипеткой 4 мл пробирной среды непосредственно на сетчатые вставки. Аккуратно встряхните кассету, чтобы убедиться, что все сетчатые вставки промыты пробирной средой.
- Держите сетчатую вставку в стороне. Он готов к использованию.
3. Приготовление инъекционных соединений
- Вынимайте запасные аликвоты Бам15 (10 мМ), Ротенона (10 мМ), Антимицина А (10 мМ) и 2-ДГ (500 мМ) из морозильной камеры -80 °С и оттаивайте при комнатной температуре.
ПРИМЕЧАНИЕ: Запас 2-DG готов к использованию. Остальные препараты нужно разбавить до рабочего запаса. - Разогрейте 10 мл пробирной среды на водяной бане с температурой 37 °C.
- Разбавьте 10 мМ Bam15 до 50 мкМ рабочего материала с использованием двухэтапной процедуры разбавления: смешайте 20 мкл запаса 10 мМ с 20 мкл ДМСО для получения промежуточного запаса 5 мМ. Затем смешайте 10 мкл промежуточного материала выше 5 мМ с 990 мкл предварительно нагретой пробирной среды, чтобы получить конечный рабочий материал 50 мкМ.
- Разбавьте и смешайте 10 мМ ротенона и 10 мМ запаса антимицина А до 10 мкМ рабочего материала ротенона/антимицина А (Rot/AA) двумя этапами разведения: смешайте по 10 мкл из 10 мМ ротенона и 10 мМ запаса антимицина А с 80 мкл ДМСО для получения промежуточного запаса 1 мМ Рот/АА. Затем смешайте 10 мкл вышеуказанного промежуточного материала 1 мМ с 990 мкл предварительно нагретой пробирной среды, чтобы получить конечный рабочий материал Rot/AA 10 мкМ.
- Только что подготовьте вышеупомянутые рабочие запасы инъекционных соединений в день эксперимента и отложите их при комнатной температуре до загрузки в инжекционные отверстия картриджа датчика.
4. Рассечение сетчатки и подготовка перфоратора сетчатки
- Усыпление мыши путем удушья CO2 в соответствии с Руководящими принципами AVMA по эвтаназии27.
ПРИМЕЧАНИЕ: Не оставляйте животное в камере CO2 дольше, чем время, необходимое для эвтаназии. - Энуклеат глаз и поместите в ледяной старый 1x PBS буфер в чашке Петри, а затем поместите его под рассеченный микроскоп.
- Аккуратно удалите, разрезав микросубчиками, лишние прямые мышцы, прикрепленные снаружи глазного яблока, и отрежьте зрительный нерв.
- Используйте иглу весом 30 г, чтобы пробить отверстие на краю роговицы (лимбус); он служит местом вставки для микросублиц. Затем используйте тонкие рассечение микросубчиками, чтобы сделать круговой разрез по краю роговицы, отделив ее от задней глазной чашки.
- Используйте острые рассеченные щипцы, чтобы удалить роговицу, хрусталик и стекловидное тело подальше от глазной чашки.
- Используйте тонкие рассеченные микросубчики, чтобы сделать несколько небольших разрезов на склеральном слое на краю глазной чашки. Избегайте разрезания слоя сетчатки. Используйте два острых рассеченных щипца, чтобы удержать склеральную ткань с каждой стороны разреза и очень осторожно потяните за склеральный слой, чтобы удалить его из нервной сетчатки. Повторяйте это вокруг глазной чашки до тех пор, пока не будут удалены все склеры и не будет получена неповрежденная чашка сетчатки.
- Используйте рассечение микросублицоров и сделайте радиальные надрезы на чашке сетчатки, чтобы сплющить ее и создать несколько отдельных секций.
ПРИМЕЧАНИЕ: В зависимости от навыков рассечения и опыта человека в обращении со свежей тканью сетчатки, чашка сетчатки может быть разрезана для создания от 3 до 5 отдельных секций. - Используйте перфоратор для биопсии диаметром 1 мм, чтобы вырезать один диск сетчатки из каждого участка уплощенной чашки сетчатки.
ПРИМЕЧАНИЕ: Следует позаботиться о том, чтобы диски сетчатки были пробиты на равном расстоянии от головки зрительного нерва. - Используйте щипцы для переноса предварительно покрытых сетчатых вкладышей в рассекающую чашку Петри. С помощью двух сверхтонких ресниц поместите перфоратор сетчатки на сетчатую вставку. Перфорационный диск сетчатки помещается в центре сетчатой вставки с ганглиозным клеточным слоем стороной вниз, касаясь сетки и слоя фоторецептора лицом вверх.
ПРИМЕЧАНИЕ: Часто некоторые клетки RPE остаются прикрепленными к фоторецепторам, и пигментация этих клеток может быть использована в качестве индикатора ориентации диска перфоратора сетчатки.
5. Загрузка портов впрыска картриджа датчика и калибровка
- Достаньте гидратированную кассету с картриджной пластиной датчика из инкубатора с температурой 37 °C. Снимите крышку Hydro-Booster и поместите картридж датчика обратно на пластину утилиты.
- Загрузите желаемый объем растворов рабочего сырья инжекционных составов в соответствующие порты. Держите наконечник пипетки под углом 45°. Вставьте наконечник пипетки наполовину в инжекционный порт со скосом наконечника у противоположной стенки инжекционного отверстия и осторожно загрузите соединение в каждый порт. Избегайте введения пузырьков воздуха.
- Обратитесь к руководству пользователя прибора для получения объема соединения, загруженного в каждый инжекционный порт для конкретного анализа. В экспериментах, представленных в данной работе, 68 мкл рабочего материала Bam15 50 мкМ (для анализа митохондриального стресса) или 68 мкл рабочего материала Rot/AA 10 мкМ (для анализа скорости гликолита) загружается в порт А; 75 мкл рабочего материала Rot/AA 10 мкМ (для анализа митохондриального стресса) или 75 мкл рабочего материала 500 мМ 2-DG (для анализа скорости гликолитизма) загружается в порт B.
- Нагрузите нагнетательные отверстия всех скважин плиты, включая фоновые коррекционные скважины и заготовки скважин для обеспечения правильной закачки. Загрузите соответствующий составной раствор в каждый порт для фоновых коррекционных скважин. Пробирная среда может быть замещена, вместо сложного раствора, в каждом из портов береговых скважин.
- Поместите нагруженную пластину картриджа датчика со снятой крышкой в анализаторную машину, чтобы начать калибровку перед запуском анализа. После завершения калибровки программа автоматически приостановит работу, ожидая замены полезной пластины на пластину захвата островка, содержащую перфораторы сетчатки.
6. Загрузка пластины захвата островка и запуск прогона
- Добавьте 607 мкл пробирной среды в каждую лунку островковой улавливающей пластины
- Используйте щипцы, чтобы захватить ободок сетчатой вставки, содержащей перфораторные диски сетчатки сверху, и вынуть его из чашки Петри. Слегка постучите по нижней части сетчатой вставки по впитывающей салфетке, чтобы удалить лишнюю жидкость, и поместите ее в колодец пластины захвата островка. Повторяйте этот шаг до тех пор, пока все сетчатые вставки с перфораторами сетчатки не будут помещены в пластину захвата островка. Заполняйте фоновые корректирующие колодцы и пустые колодцы пустыми сетчатыми вставками.
- Используйте два щипца Graefe, чтобы осторожно и осторожно прижать обод каждой сетчатой вставки и убедиться, что они надежно вставлены в нижнюю часть пластины захвата островка.
- Поместите загруженную пластину захвата островка в инкубатор с температурой 37 °C на 5 минут для прогрева.
- Извлеките полезную пластину после завершения калибровки и замените ее пластиной захвата островка с отслойкой, содержащей перфораторы сетчатки.
- Возобновите прогон анализа.
7. Запуск терминации и хранения данных
- После завершения запуска извлеките картридж датчика и пластину захвата островка, содержащую перфораторы сетчатки. Данные автоматически сохраняются в виде файла .asyr.
- Используйте соответствующее программное обеспечение для анализа данных для просмотра и анализа данных в соответствии с руководством пользователя производителя26.
- Используйте функцию Export для экспорта .xslx файла данных, который можно просматривать и анализировать с помощью программного обеспечения для работы с электронными таблицами.
8. Сохранение образца перфоратора сетчатки
- После анализа выньте пластину из машины, извлеките картридж датчика и аккуратно извлеките пробирную среду из каждой лунки с помощью пипетки.
- Нанесите крышку обратно и запечатайте боковые стороны пластины полоской парапленки.
- Хранить при температуре -80 °C.
- Для нормализации количественно оцените общее содержание ДНК или белка в пунше в каждой лунке.
9. Анализ данных
- Анализ митохондриального стресса
ПРИМЕЧАНИЕ: Измеренное значение OCR (totalOCR) представляет общее потребление кислорода тканью. После инъекции Bam15 (разъединителя) OCR увеличивается с базального уровня (totalOCRbasal) до максимального уровня (totalOCRmax) и снижается после инъекции Rot/AA. Остаточное значение OCR после инъекции Rot/AA (totalOCRRot/AA) представляет собой немитохондриальное потребление кислорода.- Рассчитайте потребление кислорода, связанное с митохондриями, следующим образом:
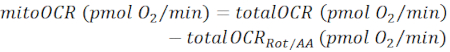 (Экв. 1) 28 См.
(Экв. 1) 28 См.
- Рассчитайте емкость митохондриального резерва (MRC) следующим образом:
 (Экв. 2) 29 См.
(Экв. 2) 29 См.
ПРИМЕЧАНИЕ: Последнее чтение среди 5 измерений перед инъекцией Bam15 принимается за «базальное» значение (для totalOCRbasal и mitoOCRbasal). Самое высокое значение среди 4 измерений после инъекции Bam15 используется в качестве «максимального» значения (для totalOCRmax и mitoOCRmax). Самое низкое значение среди 4 измерений после инъекции Rot/AA используется как totalOCRRot/AA.
- Рассчитайте потребление кислорода, связанное с митохондриями, следующим образом:
- Анализ гликолитической скорости
ПРИМЕЧАНИЕ: Измеренное значение ECAR (totalECAR) представляет собой полное подкисление среды метаболической активностью ткани. В целом, подкисление внеклеточной микросреды происходит в основном путем экструзии гликолитического продукта, лактата. Катаболизм субстратов в митохондриальном цикле ТЦА приводит к образованию CO2, который также подкисляет внеклеточную среду путем гидратации до бикарбоната.- Субстрактные митохондриальные вещества способствовали подкислению среды (mitoECAR) из totalECAR для получения гликоЭКАР.
 (Экв. 3) 28 См.
(Экв. 3) 28 См.
ПРИМЕЧАНИЕ: Митохондриальное дыхание и цикл ТЦА являются сильно связанными процессами. Производство CO2 из митохондрий является функцией скорости OXPHOS, которая измеряется с помощью mitoOCR. - Рассчитайте mitoECAR как:
 (Экв. 4) 28 См.
(Экв. 4) 28 См.
где CCF (коэффициент вклада CO2 ) представляет собой эмпирически рассчитанное значение соотношения, представляющее величину вклада H+ от ПОДКИСЛЕНИЯ, опосредованного CO2, по отношению к каждому потреблению O2 от OXPHOS. CCF для этой системы предварительно определен как 0,6028. Точное измерение подкисления среды определяется буферной емкостью среды, чувствительностью приборного датчика рН и эффективной емкостью измерительной камеры. Здесь BF (Buffer Factor) является параметром экспериментальной буферной емкости in situ , представляющим количество H+ или OH- , добавленное в эффективную измерительную камеру для изменения уровня pH на 1 единицу. Когда используется индивидуальная среда для анализа, BF может быть определен путем титрования известных количеств кислоты в пробирную среду в соответствии с протоколом Buffer Factor30. Средняя рН Seahorse DMEM 7,4, используемая в этом протоколе, имеет заранее определенный BF 2,60 ммоль H + / L / pH. Пластина захвата островков, используемая в этом протоколе, имеет Volmicrochamber = 16,6 μL31. Коэффициент масштабирования объема, Kvol, является эмпирически определенной константой. Значение Kvol недоступно для пластины захвата островков, но может быть рассчитано из значения микропластины28, учитывающего разницу объема в их микрошаблонах, равным 0,41.
ПРИМЕЧАНИЕ: Инъекция Rot/AA отключает митохондриальное дыхание и заставляет ткань переключаться на гликолиз для производства АТФ, что приводит к более высокой экструзии лактата и увеличению измерения ECAR. Гликолиз прекращается при инъекции 2-DG, а остаточное измерение ECAR выявляет негликолитическое и немитохондриальное подкисление среды. - Рассчитайте емкость запаса гликолитиков (GRC) следующим образом:
 (Экв. 5) 32 См.
(Экв. 5) 32 См.
где последнее показание среди 5 измерений перед инъекцией Rot/AA принимается за «базальное» значение (glycoECARbasal). Самое высокое значение среди 4 измерений после инъекции Rot/AA используется в качестве «максимального» значения (glycoECARmax). Самое низкое показание среди 4 измерений после инъекции 2-DG используется в качестве glycoECAR2-DG.
- Субстрактные митохондриальные вещества способствовали подкислению среды (mitoECAR) из totalECAR для получения гликоЭКАР.
- Нормализация
ПРИМЕЧАНИЕ: Нормализация необходима при сравнении показаний тканей сетчатки разных возрастных групп или между образцами дикого типа и патологическими/дегенеративными образцами, которые могут отличаться по количеству клеток.- Используйте коммерчески доступные наборы для оценки содержания ДНК в каждом перфораторном диске сетчатки33,34.
- Альтернативно, используйте буфер радиоиммунопреципитации (буфер RIPA) для извлечения общего белка из пунша сетчатки и используйте содержание белка для нормализации.
ПРИМЕЧАНИЕ: Ранее было определено, что площадь поверхности сетчатки взрослой мыши составляет около 20 мм2, и каждая сетчатка содержит ~ 6,5 миллиона клеток35. Следовательно, каждый перфоратор сетчатки диаметром 1 мм составляет ~ 1/25 одной сетчатки и содержит ~ 260K клеток. На эти цифры можно ссылаться при сравнении данных от пунша сетчатки с данными из других образцов тканей или культивируемых клеток;
Результаты
Данные, представленные здесь, представляют собой репрезентативный анализ митохондриального стресса, показывающий след OCR (рисунок 1), и анализ гликолитической скорости, показывающий след OCR и след ECAR (рисунок 2), которые были выполнены с использованием недавно рассеченных 1 мм перфорационных дисков сетчатки 4-месячной детей с трансгенной Nrl-L-EGFP36 (фон C57B / L6). Эти мыши экспрессируют GFP конкретно в палочковых фоторецепторах без изменения нормального развития сетчатки, гистологии и физиологии и широко используются в качестве контроля дикого типа в исследованиях сетчатки. В анализах, представленных здесь, использовались две мыши Nrl-L-GFP. GFP, экспрессируемый у мышей Nrl-L-GFP, не мешает измерениям OCR и ECAR в этом протоколе. Пять ударов сетчатки были взяты из каждой сетчатки. Десять ударов сетчатки были использованы для анализа митохондриального стресса, а остальные 10 были использованы для анализа гликолитической скорости. В экспериментах использовалась среда Seahorse XF DMEM, рН 7,4 (состоящая из 6 мМ глюкозы, пирувата 0,12 мМ и глутамина 0,5 мМ) и пластины захвата островков Seahorse XFe24. Репрезентативные данные, представленные здесь, были получены с использованием того же перфоратора диаметром 1 мм, но не были нормализованы в отношении содержания ДНК/белка.
В анализе митохондриального стресса разъединитель Bam1537 вводили после установления базового уровня OCR, что приводило к усилению OCR до максимального уровня. Ротенон и антимицин А вводили для ингибирования дыхания митохондрий в комплексе I и комплексе III соответственно, в результате чего OCR упал до минимального уровня (рисунок 1). Разница между максимальным уровнем OCR и последним измерением базального уровня OCR отражает емкость митохондриального резерва (MRC). MRC рассчитывается на 19,2% ±3,4% с использованием Eq. 2, что согласуется с ранее измеренными значениями MRC у сетчатки ~ 3-месячных мышей Nrl-L-EGFP с использованием анализатора Seahorse XF24 предыдущего поколения22,38.
В анализе гликолитической скорости ротенон и антимицин А вводили после установления исходного уровня для общего ECAR. Когда производство АТФ из OXPHOS остановлено, ткань вынуждена полагаться на гликолиз для получения энергии, а увеличение внеклеточного высвобождения лактата приводит ECAR к максимальному уровню. Гликолиз прекращается инъекцией 2-DG, который конкурирует с глюкозой за связывание гексокиназы, в результате чего ECAR падает до минимального уровня (рисунок 2). Митохондрии, внесенные ECAR (mitoECAR), могут быть рассчитаны по значению mitoOCR (Eq. 4). Гликолиз, внесенный ECAR glycoECAR рассчитывается и строится путем вычитания mitoECAR из totalECAR. Разница между максимальным уровнем гликоЭКАР и последним измерением базального уровня гликоЭКАР отражает емкость резерва гликолиза (GRC). Здесь GRC рассчитывается на 35,7% ± 3,4% с использованием Eq. 5.
Как высокогликолитическая ткань, производство лактата из сетчатки является основным источником внеклеточного закисления, о чем свидетельствует небольшая разница гликоЭКАР от тотальной ЭКАР. Интересно, что измерение ECAR не стабилизируется сразу после инъекции Rot/AA, а падает после второго измерения. Перфорационный диск сетчатки представляет собой неповрежденную систему ex vivo, состоящую из различных типов клеток, включая клетки глии Мюллера, которые, как известно, получают лактат (конечный продукт гликолиза), высвобождаемый из фоторецепторов6. Следовательно, снижение измерения ECAR после инъекции Rot/AA, вероятно, объясняется увеличением удаления лактата из межклеточного пространства, замедляя / предотвращая его высвобождение в среду.

Рисунок 1: Анализ митохондриального стресса. На графике показан след OCR от 1 мм перфораторных дисков сетчатки в буфере Seahorse XF DMEM, дополненный 6 мМ глюкозы, 0,12 мМ пирувата и 0,5 мМ глутамина. Каждая точка данных представляет собой среднее значение измерений из 10 скважин. Панель ошибок = стандартная ошибка. MRC оценивается в 19,2% ±3,4%. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Анализ гликолитической скорости. На построенном графике показан измеренный след OCR, след ECAR (totalECAR) и рассчитанный гликолиз, внесенный ECAR (glycoECAR) из 1 мм перфорационных дисков сетчатки в буфере Seahorse XF DMEM, дополненном 6 мМ глюкозы, 0,12 мМ пирувата и 0,5 мМ глутамина. Каждая точка данных представляет собой среднее значение измерений из 10 скважин. Панель ошибок = стандартная ошибка. GRC рассчитывается как 35,7% ±3,4% Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Здесь приведены подробные инструкции по проведению микропластинчатых анализов активности митохондриального дыхания и гликолиза с использованием ex vivo, свежерассеченных перфораторных дисков сетчатки. Протокол был оптимизирован для: 1) обеспечения использования подходящей среды для анализа ткани сетчатки ex vivo; 2) использовать надлежащий размер перфорационных дисков сетчатки для получения показаний OCR и ECAR, которые попадают в оптимальный диапазон обнаружения машины; 3) покрытие сетчатых вставок для повышения адгезивности перфоратора сетчатки для стабильного считывания показаний во время цикла измерения; 4) использование оптимальной концентрации каждого инъекционного лекарственного соединения; и 5) обеспечить изменение длины цикла для достижения плато митохондриальных состояний на каждом этапе. Реагенты и протокол были изменены по сравнению с ранее опубликованной версией23 для адаптации к машине Seahorse XFe24 нового поколения. Вместо буфера Эймса, используемого в предыдущем протоколе23, здесь используется базовая среда DMEM Seahorse, чтобы обеспечить пользовательскую конституцию источника топлива путем добавления глюкозы, глутамина и пирувата отдельно. Это также позволяет выполнять различные анализы, когда конкретный топливный субстрат подается или лишается среды. В анализах, представленных здесь, среда была составлена с той же концентрацией глюкозы (6 мМ), глутамина (0,5 мМ) и пирувата (0,12 мМ), что и в буфере Эймса, которые оказались пригодными для ткани сетчатки. Еще одним преимуществом этой среды (с 5 мМ HEPES) перед буфером Эймса (с 22,6 мМ NaHCO3) является ее низкая буферная емкость, которая обеспечивает чувствительное и точное измерение ECAR28.
Как митохондриальный стресс, так и анализы скорости гликолитических частот могут быть выполнены в соответствии с протоколом, описанным здесь, с высокой точностью, о чем свидетельствуют жесткие стандартные значения ошибок между реплицирующимися скважинами. Однако стоит отметить факторы, которые могут способствовать изменчивости данных. Избегайте гибели клеток в ткани сетчатки. Весь процесс рассечения должен выполняться в ледяном 1x PBS, а процесс от энуклеации глаз до помещения пластины захвата островка, содержащей перфоратор сетчатки, в машину не должен превышать 2 часов. Следует соблюдать осторожность во время рассечения чашки сетчатки, чтобы избежать любого повреждения ткани сетчатки, и удары не следует принимать из областей, поврежденных рассечением. В каждом эксперименте следует использовать новый, острый перфоратор для биопсии и менять перфоратор, когда край тусклый или изогнутый, чтобы обеспечить консистенцию и точность резки перфораторов сетчатки диаметром 1 мм. Попробуйте пробить диски сетчатки на равном расстоянии от головки зрительного нерва, чтобы избежать региональных вариаций (центр против периферических). После анализа проверьте каждую лунку на наличие признаков того, что перфоратор сетчатки отделяется от сетчатой вставки. Когда перфоратор сетчатки имеет плохую адгезию на сетчатой вставке или отсоединяется во время измерения, расстояние от зонда сенсера до ткани будет изменяться, влияя на показания. Опустите данные из таких скважин с отслоившимся перфоратором сетчатки.
Измерение метаболизма митохондрий в реальном времени в интактной ткани сетчатки имеет широкое применение и может предоставить полезную информацию для различных исследований. Эти анализы были использованы для измерения митохондриального дыхания в тканях сетчатки у мышей с различным генетическим фоном, чтобы выявить их внутреннюю разницу в активности митохондрий39,40. Он также использовался для изучения изменений в митохондриальном энергетическом обмене во время старения сетчатки38. Предоставляя различные топливные субстраты и используя различные ингибиторы, нацеленные на различные метаболические пути, он дает представление о предпочтении клетки / ткани определенным источникам топлива22,38. Кроме того, сравнение на OCR и MRC между мышиными и мышиными моделями наследственной дегенерации сетчатки дикого типа может предоставить доказательства митохондриальных дефектов в дегенерирующей сетчатке22.
Существуют ограничения этой техники. Островковая улавливающая пластина, используемая в этих анализах, содержит только 24 скважины; следовательно, он способен обеспечить только анализ средней пропускной способности. Качество данных этого метода зависит от качества перфорационных дисков сетчатки и жизнеспособности клеток. Кроме того, вскрытие сетчатки и подготовка перфорационных дисков сетчатки является трудоемким процессом, что делает его менее осуществимым для высокопроизводительного анализа на живых тканях сетчатки ex vivo даже при наличии пластин с 96 лунками. По сравнению с монослоем культивируемых клеток, проникновение лекарственного соединения в ткань сетчатки также влияет на считывание данных. Кроме того, измеренные значения OCR и ECAR представляют собой общую производительность всей ткани, которая состоит из множества различных типов клеток; следовательно, необходимо учитывать отношения и взаимодействия между различными нейронными и глиальными клетками в сетчатке при интерпретации данных. Конкретные экспериментальные проекты должны быть реализованы путем адаптации к каждому проекту. Рекомендуется, чтобы один включал от 3 до 5 ударов сетчаткой (от того же глаза или той же мыши) в качестве технических реплик и использовал образцы от 3 или более мышей в качестве биологических реплик.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа поддерживается Программой очных исследований Национального института глаз (ZIAEY000450 и ZIAEY000546).
Материалы
| Name | Company | Catalog Number | Comments |
| 1X PBS | Thermo Fisher | 14190-144 | |
| 2-Deoxy glucose (2-DG), 500 mM stock solution | Sigma | D6134 | Dissolve in Seahorse XF DMEM medium, prepare ahead of time |
| 30-gauge needle | BD Precision Glide | 305106 | |
| Antimycin A, 10 mM stock solution | Sigma | A8674 | Dissolve in DMSO, prepare ahead of time |
| Bam15, 10 mM stock solution | TimTec | ST056388 | Dissolve in DMSO, prepare ahead of time |
| Biopsy puncher, 1 mm | Integra Miltex | 33-31AA | |
| Cell-Tak | Corning Life Sciences | CB40240 | |
| CO2 asphyxiation chamber | |||
| Dissection forceps-Dumont #5 | Fine Science Tools | 11251-10 | Stright tip |
| Dissection forceps-Dumont #7 | Fine Science Tools | 11274-20 | Curved tip |
| Dissection microscope | |||
| DMSO | Sigma | D2438 | |
| Graefe forceps | Fine Science Tools | 11051-10 | Curved, Serrated tip |
| Microscissors | Fine Science Tools | 15004-08 | Curved tip |
| NaOH solution, 1 M | Sigma-Aldrich | S8263 | Aqueous solution, prepare ahead of time |
| Rotenone, 10 mM stock solution | Sigma | R8875 | Dissolve in DMSO, prepare ahead of time |
| Seahorse calibration medium | Agilent | 100840-000 | |
| Seahorse XF 1.0 M glucose | Agilent | 103577-100 | |
| Seahorse XF 100 mM pyruvate | Agilent | 103578-100 | |
| Seahorse XF 200 mM glutamine | Agilent | 103579-100 | |
| Seahorse XF DMEM medium | Agilent | 103575-100 | pH 7.4, with 5 mM HEPES |
| Seahorse XFe24 Islet Capture FluxPak | Agilent | 103518-100 | Containing Sensor Cartridge and Islet Capture microplate |
| Seahorse XFe24, Extra Cellular Flux Analyzer | Agilent | ||
| Sodium bicarbonate solution, 0.1 M | Sigma-Aldrich | S5761 | Aqueous solution, prepare ahead of time |
| Superfine eyelash brush | Ted Pella | 113 |
Ссылки
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wong-Riley, M. T. Energy metabolism of the visual system. Eye Brain. 2, 99-116 (2010).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retina and Eye Research. 20, 175-208 (2001).
- Barot, M., Gokulgandhi, M. R., Mitra, A. K. Mitochondrial dysfunction in retinal diseases. Current Eye Research. 36 (12), 1069-1077 (2011).
- Joyal, J. S., Gantner, M. L., Smith, L. E. H. Retinal energy demands control vascular supply of the retina in development and disease: The role of neuronal lipid and glucose metabolism. Progress in Retina and Eye Research. 64, 131-156 (2018).
- Hurley, J. B., Lindsay, K. J., Du, J. Glucose, lactate, and shuttling of metabolites in vertebrate retinas. Journal of Neuroscience Research. 93 (7), 1079-1092 (2015).
- Haydinger, C. D., Kittipassorn, T., Peet, D. J. Power to see-Drivers of aerobic glycolysis in the mammalian retina: A review. Clinical and Experimental Ophthalmology. 48 (8), 1057-1071 (2020).
- Wright, A. F., et al. Lifespan and mitochondrial control of neurodegeneration. Nature Genetics. 36, 1153-1158 (2004).
- Bossy-Wetzel, E., Schwarzenbacher, R., Lipton, S. A. Molecular pathways to neurodegeneration. Nature Medicine. 10, 2-9 (2004).
- Leveillard, T., Philp, N. J., Sennlaub, F. Is retinal metabolic dysfunction at the center of the pathogenesis of age-related macular degeneration. International Journal of Molecular Sciences. 20 (3), (2019).
- Vlachantoni, D., et al. Evidence of severe mitochondrial oxidative stress and a protective effect of low oxygen in mouse models of inherited photoreceptor degeneration. Human Molecular Genetics. 20 (2), 322-335 (2011).
- Grenell, A., et al. Loss of MPC1 reprograms retinal metabolism to impair visual function. Proceedings of the National Academy of Science U. S. A. 116 (9), 3530-3535 (2019).
- Wright, A. F., Chakarova, C. F., Abd El-Aziz, M. M., Bhattacharya, S. S. Photoreceptor degeneration: genetic and mechanistic dissection of a complex trait. Nature Reviews in Genetics. 11 (4), 273-284 (2010).
- Jarrett, S. G., Boulton, M. E. Consequences of oxidative stress in age-related macular degeneration. Molecular Aspects of Medicine. 33 (4), 399-417 (2012).
- Rozing, M., et al. Age-related macular degeneration: A two-level model hypothesis. Progress in Retina Eye Research. 76, 100825 (2020).
- Yokosako, K., et al. Glycolysis in patients with age-related macular degeneration. Open Ophthalmology Journal. 8, 39-47 (2014).
- Bek, T. Mitochondrial dysfunction and diabetic retinopathy. Mitochondrion. 36, 4-6 (2017).
- Yumnamcha, T., Guerra, M., Singh, L. P., Ibrahim, A. S. Metabolic dysregulation and neurovascular dysfunction in diabetic retinopathy. Antioxidants. 9 (12), (2020).
- Futterman, S., Kinoshita, J. H. Metabolism of the retina. I. Respiration of cattle retina. Journal of Biological Chemistry. 234 (4), 723-726 (1959).
- Linsenmeier, R. A. Effects of light and darkness on oxygen distribution and consumption in the cat retina. Journal of General Physiology. 88 (4), 521-542 (1986).
- Medrano, C. J., Fox, D. A. Oxygen consumption in the rat outer and inner retina: light- and pharmacologically-induced inhibition. Experiments in Eye Research. 61 (3), 273-284 (1995).
- Kooragayala, K. Quantification of oxygen consumption in retina ex vivo demonstrates limited reserve capacity of photoreceptor mitochondria. Investigative Ophthalmology and Visual Science. 56 (13), 8428-8436 (2015).
- Adlakha, Y. K., Swaroop, A. Determination of mitochondrial oxygen consumption in the retina ex vivo: applications for retinal disease. Methods in Molecular Biology. 1753, 167-177 (2018).
- . Agilent Mitocondrial stress test user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Cell_Mito_Stress_Test_Kit_User_Guide.pdf (2021)
- . Agilent Glycolytic rate assay user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . Agilent wave 2.6 user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . AVMA Guidelines for the Euthanasia of Animals Available from: https://www.avma.org/sites/default/files/2020-01/2020-Euthanasia-Final-1-17-20.pdf (2021)
- . Improving Quantification of Cellular Glycolytic Rate Using Agilent Seahorse XF Technology Available from: https://www.agilent.com/cs/library/whitepaper/public/whitepaper-improve-quantification-of-cellular-glycolytic-rate-cell-analysis-5991-7894en-agilent.pdf (2021)
- . Report Generator User Guide Agilent Seahorse XF Cell Mito Stress Test Available from: https://www.agilent.com/cs/library/usermanuals/public/Report_Generator_User_Guide_Seahorse_XF_Cell_Mito_Stress_Test_Single_File.pdf (2021)
- . Agilent Seahorse XF Buffer Factor Protocol Available from: https://www.agilent.com/cs/library/usermanuals/public/usermanual-xf-buffer-factor-protocol-cell-analysis-S7888-10010en-agilent.pdf (2021)
- . Agilent sensor cartridges and cell culture microplates Available from: https://www.agilent.com/cs/library/brochures/5991-8657EN_seahorse_plastics_brochure.pdf (2021)
- . Agilent Seahorse XF Glycolysis Stress Test Kit User Guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Glycolysis_Stress_Test_Kit_User_Guide.pdf (2021)
- Fan, Y. Y. A bioassay to measure energy metabolism in mouse colonic crypts, organoids, and sorted stem cells. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309, 1-9 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell- and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. Journal of Neuroscience. 18 (21), 8936-8946 (1998).
- Akimoto, M., et al. Targeting of GFP to newborn rods by Nrl promoter and temporal expression profiling of flow-sorted photoreceptors. Proceedings of the National Academy of Science U. S. A. 103 (10), 3890-3895 (2006).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Corso-Diaz, X., et al. Genome-wide profiling identifies DNA methylation signatures of aging in rod photoreceptors associated with alterations in energy metabolism. Cell Reports. 31 (3), 107525 (2020).
- Berkowitz, B. A., et al. Mitochondrial respiration in outer retina contributes to light-evoked increase in hydration in vivo. Investigative Ophthalmology and Visual Science. 59 (15), 5957-5964 (2018).
- Joyal, J. S., et al. Retinal lipid and glucose metabolism dictates angiogenesis through the lipid sensor Ffar1. Nature Medicine. 22 (4), 439-445 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены