Method Article
Ex Vivoのレティナル組織サンプルにおけるミトコンドリア呼吸と解糖の測定
要約
ここで説明する、商業バイオアナライザを用いた ex vivo のレチナル組織サンプルにおけるミトコンドリアストレスアッセイおよび解糖率アッセイを行うための詳細なプロトコルを説明する。
要約
ミトコンドリア呼吸は、全ての細胞、特に高活性代謝を有するレチン系感光体の重要なエネルギー生成経路である。また、光受容体は癌細胞のような高い好気性解糖を呈する。これらの代謝活動の正確な測定は、生理学的状態および疾患状態における細胞恒常性に関する貴重な洞察を提供することができる。高スループットマイクロプレートベースのアッセイは、生細胞におけるミトコンドリア呼吸および様々な代謝活動を測定するために開発されています。しかし、これらの大部分は培養細胞用に開発されており、インタクトな組織サンプルやアプリケーション ex vivo用に最適化されていません。ここでは、マイクロプレートベースの蛍光技術を用いて、酸素消費速度(OCR)をミトコンドリア呼吸の指標として直接測定する詳細なステップバイステッププロトコル、ならびに細胞外酸性化率(ECAR)を解糖の指標として、無傷の ex vivo レチン組織で説明する。この方法は、正常に成人マウスのレティナの代謝活動を評価し、老化や病気の細胞機構を調査する際にそのアプリケーションを実証するために使用されています。.
概要
ミトコンドリアは、細胞代謝、シグナル伝達、ホメオスタシス、アポトーシスを複数の重要な生理学的プロセスを調整することによって調節する必須のオルガネラである1。ミトコンドリアは、酸化リン酸化(OXPHOS)を介してアデノシン三リン酸(ATP)を生成し、ほぼすべての細胞イベントをサポートするエネルギーを提供する細胞内の大国として機能します。細胞酸素の大部分はミトコンドリアで代謝され、好気呼吸中の電子輸送鎖(ETC)の最終的な電子アクセクサとして機能する。低量のATPは、グルコースをピルビン酸に変換するサイトゾルの解糖からも製造することができ、さらに乳酸に変換したり、ミトコンドリアに輸送したり、三カルボン酸サイクル(TCAサイクル)の基質であるアセチルCoAに酸化することができます。
このレティナは哺乳動物2において最も代謝活性の高い組織の1つで、高レベルのミトコンドリア呼吸と非常に高い酸素消費量を示す3。ロッドおよびコーン光受容体は、ミトコンドリア4の高密度を含み、OXPHOSは、retina5で最もATPを生成します。さらに、このレチナは、グルコースを乳酸5に変換することにより、好気性解糖6,7にも大きく依存しています。ミトコンドリア欠損症は、様々な神経変性疾患に関連しています8,9;そして、その独特の高エネルギー需要と, retinaは、特に代謝欠陥に対して脆弱です, ミトコンドリアOXPHOS4および解糖症10に影響を与えるものを含む.ミトコンドリア機能障害と解糖の欠損は、網膜11,12及び黄斑13変性疾患、加齢黄斑変性症10、14、15、16、および糖尿病網膜症17,18に関与している。したがって、ミトコンドリア呼吸および解糖の正確な測定は、レティナの完全性および健康を評価するための重要なパラメータを提供することができる。
ミトコンドリア呼吸は酸素消費率(OCR)の測定によって測定することができる。グルコースからピルビン酸への変換、そしてその後の乳酸塩への変換は、細胞外環境への陽子の押出および酸性化をもたらすことを考えると、細胞外酸性化率(ECAR)の測定は、グリコリシスフラックスの指標を提供する。このレティナは、基質の交換を含む、親密な関係と活発な相乗効果を持つ複数の細胞タイプで構成されるため、無傷のラミネーションと回路を持つ全レチン組織のコンテキストでミトコンドリアの機能と代謝を分析することが不可欠です。過去数十年にわたり、クラーク型O2電極および他の酸素マイクロ電極は、retina19,20,21における酸素消費量を測定するために使用されてきました。これらの酸素電極は、感度、大きなサンプル体積の要件、および通常、細胞および組織の文脈の破壊につながる懸濁試料の連続攪拌の必要性に大きな制限を有する。ここで説明するプロトコルは、ミトコンドリアのエネルギー代謝を解剖したばかりのex vivoマウスの残膜組織におけるミトコンドリアのエネルギー代謝を測定するマイクロプレートベースの蛍光技術を用いて開発された。それは懸濁および連続的なかき混ぜのための必要性を避けながら、ex vivoのレチナル組織の小さいサンプル(1mmのパンチ)を同時に使用してOCRとECARの両方の中間の実時間測定を可能にする。
ここで示されているのが、解剖したばかりのレチナルパンチディスク上のミトコンドリア応力アッセイおよび解糖率アッセイの実験手順です。このプロトコルは、ミトコンドリア関連代謝活動を、エキビボ組織のコンテキストで測定することを可能にする。培養細胞を用いて行うアッセイとは異なり、ここで得られた測定値は組織レベルでの結合されたエネルギー代謝を反映し、組織内の異なる細胞タイプ間の相互作用の影響を受ける。このプロトコルは、アイレットキャプチャプレートを備えたアジレントシーホース細胞外フラックス24ウェル(XFe24)アナライザの新世代に適応するために、以前に公開されたバージョン22,23から変更されます。アッセイ培地、注入化合物濃度、およびアッセイサイクルの数/持続時間も、レチン組織に対して最適化されています。レチナルパンチディスクの準備のために詳細なステップバイステッププロトコルが与えられています。プログラムのセットアップとデータ分析の詳細については、製造元のユーザーガイド24,25,26から入手できます。
プロトコル
すべてのマウスプロトコルは、国立眼科研究所(NEI ASP#650)の動物のケアと使用委員会によって承認されました。マウスは12時間の明暗条件で収容され、実験動物のケアと使用のためのガイド、実験動物資源研究所、およびヒトケアと実験動物の使用に関する公衆衛生サービスポリシーの勧告に従って世話をしました。
1. センサカートリッジのハイドレートとアッセイ媒体の準備
- 実験前日に、1 mLのキャリブレーション媒体をユーティリティプレートの各ウェルに加えます。ハイドロブースターカバーを上部に置き、カバーの開口部からセンサーカートリッジを下げます。センサーがキャリブレーションメディアに沈み込みになっていることを確認します。センサーカートリッジを37°CのCO2フリーインキュベーターに一晩インキュベートし、フルオロフォアを活性化します。
注:蒸発を防ぐために、インキュベーターは内部の水のトレイを保つことによって加湿され、センサーカートリッジカセットは透明なラップで包まれます。 - シーホースDMEM培地をグルコース、ピルビン酸、グルタミンを所望の濃度に添加して再構成してアッセイ培地を調製します。本稿で報告されたアッセイでは、アッセイ媒体中の基質の最終濃度は、グルコースの6mM、ピルビン酸の0.12mM、および0.5mMのグルタミンである。各アッセイプレートについて、実験当日にアッセイ培地の40mLが新鮮に調製される。
- 製造者の指示26に従って、分析装置にアッセイプログラムをセットアップします。ここで示すアッセイでは、プロトコルは、ベースラインの測定の5サイクル、次にポートAを注入し、その後4サイクルの測定を注入し、次いでポートBを注入し、続いて4サイクルの測定を行う。各サイクルは、ミックス(3分)、待つ(2分)と測定(3分)で構成されています。
2. アイレットキャプチャマイクロプレートのコーティングメッシュインサート
- 20 μLの細胞取り付け培地(例えば、Cell-Tak)に0.1 M重炭酸ナトリウム、9 μLの1 M NaOHを組み合わせてコーティングミックスを準備します。
- メッシュインサートを含むカセットの蓋を開きます。各メッシュ挿入物にコーティングミックスのピペット8 μL。ピペットチップを使用して、液滴を穏やかに塗りつぶしたり広げたりして、メッシュインサート全体にコーティングミックスを均等に分配します。
- カセットを閉じ、メッシュインサートが吸着のために少なくとも25分間室温でインキュベートできるようにします。
- アッセイ媒体の4 mLをメッシュインサートに直接ピペットしてメッシュインサートを洗浄します。カセットを軽く振って、すべてのメッシュインサートがアッセイ媒体で洗浄されるようにします。
- メッシュ挿入物は脇に置きます。使用する準備ができました。
3. 注入化合物の準備
- Bam15(10 mM)、ロテノン(10mM)、アンチマイシンA(10mM)、2-DG(500mM)の在庫アリコートを-80°C冷凍庫から取り出し、室温で解凍します。
注:2DG在庫は使用する準備ができています。他の薬剤は、作業ストックに希釈する必要があります. - アッセイ媒体の10mLを37°Cの水浴で温めます。
- 2段階希釈手順を使用して10 mM Bam15ストックを50 μMの作業在庫に希釈:20 mMストックの20 μLとDMSOの20 μLを混合して5 mM中間在庫を得ます。その後、上記の5 mM中間ストックの10 μLを、990 μLの予温アッセイ媒体と混合して、最終的な50 μMの作業ストックを得ます。
- 希釈して10 mMロテノーンと10 mMアンチマイシンAストックを10 μMロテノーン/アンチマイシンA(Rot/AA)作業ストックに10 μM Rotenone/Antimycin AAの2ステップずつ組み合わせます:10 mMロテノーネのそれぞれ10 μLと10 mM Antimycin Aストックを80 μLのDMSOを持つAストックを1mM/AAの中間在庫にします。その後、上記の1mM中間ストックの10 μLを990 μLの予温アッセイ媒体と混合して、最終的な10 μM Rot/AA作業ストックを得ます。
- 実験当日に上記の注入化合物の作業ストックを新たに準備し、センサーカートリッジの注入ポートにロードするまで室温で確保します。
4. レチナル解剖とレチナルパンチ調製
- 安楽死27に関するAVMAガイドラインに従って、CO2窒息によりマウスを安楽死させる。
注:安楽死に必要な時間よりも長いCO2 チャンバーに動物を残してはなりません。 - 目を引き起せ、ペトリ皿の氷古の1x PBSバッファーに入れ、解剖顕微鏡の下に置きます。
- 慎重に除去, マイクロシザーで切断することにより, 眼球の外側に取り付けられた余分な直腸筋と視神経を切断.
- 角膜(四肢)の端に穴を開けるために30 G針を使用してください。これはマイクロシザーの挿入部位として機能する。次に、細かい解剖マイクロシザーを使用して角膜の端に沿って円形のカットを行い、後部アイカップから分離します。
- 鋭い解剖鉗子を使用して、角膜、レンズ、そして眼球から離れた膜膜のユーモアを取り除きます。
- 細かい解剖マイクロシザーを使用して、アイカップの縁部の硬化層にいくつかの小さなカットを行います。レティナ層を切断しないでください。カットの両側の強膜組織にしがみつくには、2つの鋭い解剖鉗子を使用し、非常に慎重に神経の残線からそれを取り除くために強膜層を引っ張ります。すべてのクリンラが取り除かれ、無傷のレチンカップが得られるまで、アイカップの周りでこれを繰り返します。
- 解剖マイクロシザーを使用し、それを平らにし、いくつかの異なるセクションを生成するために、レチンカップの放射状のカットを行います。
注:人の解剖スキルと新鮮なレチン組織を扱う経験に応じて、レチンカップをカットして3〜5つの異なるセクションを生成することができます。 - 平らなレチナルカップの各セクションから1つのレチナルディスクをカットするために1ミリメートルの直径生検パンチャーを使用してください。
注:視神経の頭部から等しい距離で、眼のディスクを打ち抜くように注意してください。 - 鉗子を使用して、事前にコーティングされたメッシュインサートを解剖シャーレに移します。2つの超微細なまつげブラシの助けを借りて、メッシュインサートにレチナルパンチディスクを置きます。このレチナルパンチディスクは、メッシュの中央に配置され、神経節細胞層側がメッシュと感光体層を上に向けて下に置かれます。
注:多くの場合、一部のRPE細胞は感光体に付着したままであり、これらの細胞の色素沈着は網膜パンチディスクの向きの指標として使用することができます。
5. センサーカートリッジの注入ポートとキャリブレーションのロード
- 37°Cインキュベーターから、水和されたセンサーカートリッジプレートカセットを取り出します。ハイドロブースターカバーを取り外し、センサーカートリッジをユーティリティプレートに戻します。
- 適切なポートに注入複合作業ストックソリューションの所望の容積をロードします。ピペットの先端を45°の角度で持ちます。ピペットチップを注入口の反対側の壁に対して先端のベベルを持つ注入口に途中で挿入し、各ポートにコンパウンドを静かにロードします。気泡の導入は避けてください。
- 特定のアッセイについては、各注入口にロードされる化合物の容積については、装置使用ガイドを参照してください。本論文で示した実験では、50μM Bam15作業ストック(ミトコンドリア応力アッセイ用)の68 μLまたは10μM Rot/AA作業ストック(解糖率アッセイ用)の68 μLがポートAに積み込まれています。75 μLの10 μM Rot/AA 作業ストック(ミトコンドリア応力アッセイ用)または500 mM 2-DG作業ストックの75 μL(解糖率アッセイ用)をポートBに積み込みます。
- 適切な注入を確実にするために、背景補正井戸とブランクウェルを含むプレートのすべての井戸の注入ポートをロードします。背景補正ウェル用に各ポートに各複合溶液をロードします。アッセイ媒体は、複合溶液の代わりに、バンクウェルの各ポートに置換することができる。
- ロードされたセンサーカートリッジプレートを蓋を外してアナライザマシンに取り付け、アッセイ実行前にキャリブレーションを開始します。キャリブレーションが終了すると、プログラムは自動的に一時停止し、レチンのパンチを含むアイレットキャプチャプレートとユーティリティプレートの交換を待つ。
6. 小地捕獲プレートをロードし、アッセイの実行を開始
- 小地捕獲プレートの各ウェルにアッセイ媒体の607 μLを加える
- 鉗子を使用して、レチナルパンチディスクを含むメッシュインサートのリムを上に持ち、ペトリ皿から取り出します。吸収ワイプティッシュのメッシュインサートの底を軽くタップして余分な液体を取り除き、小子捕獲プレートのウェルに入れます。レティナルパンチを含むすべてのメッシュ挿入物が、小子捕獲プレートに配置されるまで、このステップを繰り返します。背景補正ウェルと空白のウェルを空のメッシュインサートで塗りつぶします。
- 2つのGraefe鉗子を使用して、各メッシュインサートのリムを慎重かつ軽く押し、それらが小地捕獲プレートの下部にしっかりと挿入されていることを確認します。
- 37°Cインキュベーターに装填した小地捕獲プレートを5分間温める。
- キャリブレーションが完了した後にユーティリティプレートを取り出し、それを取り替えて、レティナルパンチを含む蓋をオフにして、アイレットキャプチャプレートに置き換えます。
- アッセイ実行を再開します。
7. 実行終了とデータストレージ
- 実行が完了したら、センサーカートリッジとレティナルパンチを含む小口取り取りプレートを取り出します。データは自動的に .asyr ファイルとして保存されます。
- 関連するデータ分析ソフトウェアを使用して、製造元のユーザーガイド26に従ってデータを表示および分析します。
- エクスポート機能を使用して、データの .xslx ファイルをエクスポートします。
8. レチナルパンチサンプルの保存
- アッセイ後、機械からプレートを取り出し、センサーカートリッジを取り外し、ピペットを使用して各ウェルからアッセイ媒体をそっと取り出します。
- カバーを貼り付け直し、パラフィルムストリップでプレートの側面を密封します。
- -80°Cで保管してください。
- 正規化のために、各ウェル内のパンチの総DNAまたはタンパク質含有量を定量化します。
9. データ分析
- ミトコンドリアストレスアッセイ
注:測定されたOCR値(totalOCR)は、組織による全酸素消費量を表します。Bam15(アンカプラー)注射後、OCRは基底レベル(totalOCRbasal)から最大レベル(totalOCRmax)に増加し、Rot/AA注入に続いてダウンします。腐敗/AA注入後の残留OCR値(totalOCRRot/AA)は、非ミトコンドリア酸素消費量を表します。- ミトコンドリア関連酸素消費量を次のように計算します。
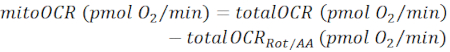 (Eq. 1)28
(Eq. 1)28
- ミトコンドリアリザーブ容量(MRC)を次のように計算します。
 (Eq. 2)29
(Eq. 2)29
注: Bam15 注入前の 5 つの測定値の最後の読み取り値は、「基底」値として取られます (totalOCRBASAL および mitoOCRbasal)。Bam15注入に続く4つの測定値の中で最も高い測定値は、「最大」値(totalOCRmaxおよびmitoOCRmaxの場合)として使用されます。ロート/AA注入後の4つの測定の中で最も低い読書はtotalOCRRot/AAとして使用される。
- ミトコンドリア関連酸素消費量を次のように計算します。
- 解糖率アッセイ
注:測定されたECAR値(totalECAR)は、組織の代謝活性による培地の総酸性化を表します。一般に、細胞外微環境の酸性化は、主に糖分解物、乳酸塩の押出によって生じる。ミトコンドリアTCAサイクルにおける基質の塞栓症はCO2の産生をもたらし、また、重炭酸塩への水和を通じて細胞外媒体を酸性化する。- サブストラクトミトコンドリアは、グルエカーから培地酸性化(ミトECAR)を寄与し、グリコECARを得た。
 (Eq. 3)28
(Eq. 3)28
注:ミトコンドリア呼吸とTCAサイクルは、強く結合されたプロセスです。ミトコンドリアからのCO2 の生産は、MItoOCRで測定可能なOXPHOSの割合の関数です。 - 次のように mitoECAR を計算します。
 (Eq. 4)28
(Eq. 4)28
ここで、CCF(CO2寄与係数)は経験的に計算された比率値であり、OXPHOSからのCO2媒介酸性化と各O2消費量からのH+寄与量を表します。このシステムの CCF は、事前に 0.6028 と判定されています。媒体酸性化の正確な測定は、媒体の緩衝能、計器装置pHセンサーの感度、及び有効な測定室容量によって決定される。ここで、BF(バッファファクター)とは、実験バッファ容量をインザシトゥのパラメータとし、有効測定チャンバに添加したH+またはOH-の量を1単位でpHレベルに変更することを表す。カスタマイズされたアッセイ媒体が使用される場合、BFは、緩衝因子プロトコル30に従ってアッセイ媒体に既知の量の酸を入れ、測定することができる。このプロトコルで使用されるシートホース DMEM 培地 pH 7.4 は、2.60 ミリモル H+/L/pH の事前に決定された BF を有する。このプロトコルで使用される小地捕獲板はVolmicrochamber= 16.6 μL31を有する。体積スケーリング係数Kvolは経験的に定められた定数です。Kvol値は、小子捕獲プレートには利用できないが、マイクロプレート28の値から計算することができ、マイクロチャンバの体積差を考慮して、0.41となる。
注:Rot/AAの注入はミトコンドリア呼吸を遮断し、ATP産生のために組織を解糖に切り替え、より高い乳酸塩押出およびECAR測定の増加に至る。解糖は2-DG注入で停止し、残りのECAR測定は、培地の非解糖および非ミトコンドリア酸性化を明らかにする。 - 次のように解糖予備容量 (GRC) を計算します。
 (Eq. 5)32
(Eq. 5)32
ここで、Rot/AA注入前の5つの測定値の中で最後の読み取り値は、「基底」値(グリコECARBASAL)として取られる。Rot/AA注入後の4つの測定値の中で最も高い測定値は、「最大」値(glycoECARmax)として使用されます。2-DG注入後の4つの測定の中で最も低い読書は、glycoECAR2-DGとして使用される。
- サブストラクトミトコンドリアは、グルエカーから培地酸性化(ミトECAR)を寄与し、グリコECARを得た。
- 正常化
注:正規化は、異なる年齢層のレチン組織からの測定値を比較する場合、または細胞数が異なる可能性のある野生型および病理学的/変性サンプル間での測定値を比較する際に不可欠です。- 各レチナルパンチディスク33,34のDNA含有量を評価するために、商業的に入手可能なキットを使用してください。
- あるいは、放射性免疫沈降アッセイバッファー(RIPAバッファー)を使用して、レチナルパンチから全タンパク質を抽出し、そのタンパク質含有量を正規化に使用します。
注:成人マウスのレチナの表面積は、以前は約20mm2であると判断されており、各レチナには約650万個のCells35が含まれています。したがって、各1mmの直径のレチナルパンチは、単一のレチナの〜1/25であり、〜260K細胞を含む。レチナルパンチのデータを他の組織サンプルまたは培養細胞のデータと比較する場合、これらの数値を参照することができます。
結果
ここで報告されるデータは、OCRトレースを示す代表的なミトコンドリア応力アッセイ(図1)およびOCRトレースおよびECARトレースを示す解糖率アッセイ(図2)であり、4ヶ月前のトランスジェニック Nrl-L-EGFP mice36 (C57B/L6バックグラウンド)から解剖したばかりの1mmのレチナルパンチディスクを使用して行った。これらのマウスは、正常なレチナルの発達、病変、生理学を変えることなく、特にロッド感光体でGFPを発現し、肛門の研究で広く使用されている。ここで提示したアッセイでは2つの Nrl-L-GFP リッターメートマウスが使用された。 Nrl-L-GFP マウスで発現されたGFPは、このプロトコルにおけるOCRおよびECARの測定を妨げない。各レチナから5つのレチナルパンチが採取された。10個のレチナルパンチをミトコンドリアストレスアッセイに使用し、残りの10を解糖率アッセイに使用した。シーホースXF DMEM培地、pH 7.4(6 mMグルコース、0.12 mMピルビン酸、および0.5 mMグルタミンで構成)およびシーホースXFe24アイレット捕獲プレートを実験に使用した。ここで提示した代表的なデータは、同じ直径1mmのパンチャーを用いて得られたが、DNA/タンパク質含有量に関して正規化されなかった。
ミトコンドリアストレスアッセイでは、アンカプラーBam1537をOCRベースラインを確立した後に注入し、OCRを最大レベルに増強した。ロテノーンとアンチマイシンAは、それぞれ、複合体Iおよび複合体IIIでミトコンドリア呼吸を阻害するために注射され、OCRは最小限のレベルに低下する結果となった(図1)。OCRの最大レベルと基底OCRレベルの最後の測定との差は、ミトコンドリア予備容量(MRC)を反映しています。MRCは、Eq.2を用いて19.2%±3.4%と計算され、前世代のシーツノオトシゴXF24アナライザ22,38を用いて、〜3ヶ月齢のNrl-L-EGFPマウスのレチナにおける以前に測定されたMRC値と一致する。
解糖率アッセイでは、ロテノーネとアンチマイシンAを全ECARのベースラインを確立した後に注入した。OXPHOSからのATPの産生が停止すると、組織はエネルギーに対する解糖に依存することを余儀なくされ、乳酸の細胞外放出の増加はECARを最大レベルに駆動する。解糖は、ヘキソキナーゼ結合のためにグルコースと競合する2-DGの注入によって停止され、ECARは最小限のレベルに低下する(図2)。ミトコンドリア寄与ECAR(mitoECAR)は、ミトオCR値(Eq. 4)から計算することができる。配糖化寄与ECARグリコエカーは、totalECARからmitoECARを差し引くことによって計算され、プロットされる。グリコECARの最大レベルとグリコECAR基底レベルの最後の測定との差は、グリコ分解リザーブ容量(GRC)を反映しています。ここで、GRCはEq.5を用いて3.4%±35.7%と計算されます。
高解糖組織として、retinaからの乳酸生産は、totalECARとのグリコECARの小さな差によって明らかにされるように、細胞外酸性化の主要な供給源を占める。興味深いことに、ECAR測定は、Rot/AA注入直後にプラトーを起ずに、2回目の測定後に低下します。このレチナルパンチディスクは、異なる細胞タイプで構成される無傷の ex vivo システムであり、この感光体から放出される乳酸(グリコ分解末産物)を受け取ることが知られているミュラーグリア細胞を含む。したがって、Rot/AA注入後のECAR測定の低下は、細胞間空間からの乳酸塩の除去の増加によって説明され、培地への放出を遅く/防止する。

図1:ミトコンドリアストレスアッセイ。 プロットされたグラフは、6 mMのグルコース、0.12mMのピルビン酸および0.5 mMのグルタミンを補充する、シーホースXF DMEMバッファーの1mmのレチナルパンチディスクからのOCRトレースを示す。各データポイントは、10ウェルからの測定値の平均を表します。エラー バー = 標準エラーです。MRCは19.2%±3.4%と計算されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:解糖率アッセイ。 プロットされたグラフは、測定されたOCRトレース、ECARトレース(totalECAR)、および計算された解糖分解が、6mMのグルコース、0.12mMのピルビン酸、および0.5mMのグルタミンを補ったシーホースXF DMEMバッファーの1mmのレチナルパンチディスクからECAR(glycoECAR)に寄与した。各データポイントは、10ウェルからの測定値の平均を表します。エラー バー = 標準エラーです。GRCは35.7%±3.4% と計算され、この図のより大きなバージョンを表示するにはここをクリックしてください。
ディスカッション
ここでは、ex vivo、新たに解剖されたレチナルパンチディスクを使用してミトコンドリア呼吸および解糖活性のマイクロプレートベースのアッセイを実行するための詳細な手順を提供します。プロトコルは、次のように最適化されています: 1) ex vivoのレチン組織に適したアッセイ媒体の使用を保証します。2)は、マシンの最適な検出範囲内にあるOCRとECARの測定値を得るために、レチナルパンチディスクの適切なサイズを採用します。3)コーティングメッシュ挿入物は、測定サイクル中に安定した読み取りのためのレチナルパンチの粘着性を高めるために挿入します。4)各注射薬物化合物の最適濃度の使用;5)各ステップでミトコンドリア状態の高原に到達するために変更されたサイクル長さを確認する。試薬とプロトコルは、新世代のシーホースXFe24マシンに適応するために、以前に公開されたバージョン23から変更されました。前のプロトコル23で使用されたAmesのバッファの代わりに、グルコース、グルタミン、ピルビン酸を別々に添加することによって燃料源のカスタム体質を可能にするために、基本的なシーツノオトシゴDMEM培地が使用されています。これにより、特定の燃料基質が媒体から供給されたり、奪われたりする様々なアッセイを行うことも可能になる。ここで提示したアッセイでは、この培地は、同じ濃度のグルコース(6mM)、グルタミン(0.5mM)、ピルビン酸(0.12mM)をエイムズの緩衝液と同じ濃度で構成した。この媒体(5 mM HEPES)の別の利点は、エイムズのバッファ(22.6 mM NaHCO3)に対するバッファ容量が低く、ECAR28の精密で正確な測定を保証します。
ミトコンドリア応力および解糖率アッセイはいずれも、複製ウェル間の厳しい標準誤差値によって証明されるように、ここで説明するプロトコルに従って高精度に行うことができる。ただし、データの変動に影響する要因をメモする価値があります。細胞死は、皮膜組織で避ける。全体の解剖プロセスは、氷冷1x PBSで行われるべきであり、眼の核球から、レチナルパンチを含むイレット捕捉プレートを機械に入れるまでのプロセスは2時間を超えてはならない。レティナ・カップの解剖の間、眼下組織への損傷を避けるため注意が必要であり、解剖によって損傷を受けた部分からパンチを取るべきではない。新しい、鋭い生検のパンチャーは、各実験で使用する必要があり、エッジが鈍いか曲がっているときにパンチャーを変更して、1mmの直径でレチナルパンチを切断する際の一貫性と正確性を確保する必要があります。局所的な変動(中心と周辺)を避けるために、視神経頭部から等距離で打ち抜かれて視神経の円盤を得るようにしてください。アッセイ後、網膜パンチがメッシュインサートから切り離されている兆候がないか、各井戸をチェックします。網膜パンチが測定中にメッシュインサートまたは剥離に密着性が悪いとき、Senserプローブから組織までの距離が変化し、測定値に影響を与えます。網膜パンチを切り離した井戸からのデータを省略します。
無傷の残膜組織におけるリアルタイムミトコンドリア代謝の測定は幅広い用途を有し、様々な研究に有用な情報を提供することができる。これらのアッセイは、異なる遺伝的背景を持つマウスからのレチン組織におけるミトコンドリア呼吸を測定し、ミトコンドリア活性の本質的な違いを明らかにするために使用されてきた39,40。また、retina38の老化時にミトコンドリアのエネルギー代謝の変化を研究するために使用されました。異なる燃料基質を提供し、異なる代謝経路を標的とする様々な阻害剤を利用することにより、特定の燃料源に対する細胞/組織の好みに関する洞察を提供する22,38。さらに、遺伝性のレチン系変性の野生型マウスとマウスモデル間のOCRとMRCの比較は、退化retina22におけるミトコンドリア欠陥の証拠を提供することができる。
この手法には制限があります。これらのアッセイで使用される小地捕獲プレートには24の井戸しか含まれなかった。したがって、ミッドスループット分析のみを提供できます。この方法によるデータ品質は、レチナルパンチディスクの品質と細胞の生存率に依存します。また、レチナル解剖とレチナルパンチディスクの準備は時間のかかるプロセスであり、96ウェルプレートが利用可能であっても、生きた vivo のレチナル組織に対するハイスループット分析を実現することは不可能です。培養細胞の単層と比較して、薬物化合物のレチン組織への浸透もデータ読み出しに影響を与える。さらに、測定されたOCRおよびECAR値は、多くの異なる細胞タイプで構成される組織全体の総性能を表します。したがって、データを解釈しながら、異なる神経細胞とグリア細胞間の関係と相互作用を考慮する必要があります。特定の実験計画は、各プロジェクトに合わせて調整することによって実装する必要があります。1つは、技術的な複製として(同じ目または同じマウスから)3〜5個のレチンガルパンチを含み、生物学的複製として3つ以上のマウスからのサンプルを使用することをお勧めします。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、国立眼科研究所(ZIAEY000450およびZIAEY000446)の壁内研究プログラムによって支援されています。
資料
| Name | Company | Catalog Number | Comments |
| 1X PBS | Thermo Fisher | 14190-144 | |
| 2-Deoxy glucose (2-DG), 500 mM stock solution | Sigma | D6134 | Dissolve in Seahorse XF DMEM medium, prepare ahead of time |
| 30-gauge needle | BD Precision Glide | 305106 | |
| Antimycin A, 10 mM stock solution | Sigma | A8674 | Dissolve in DMSO, prepare ahead of time |
| Bam15, 10 mM stock solution | TimTec | ST056388 | Dissolve in DMSO, prepare ahead of time |
| Biopsy puncher, 1 mm | Integra Miltex | 33-31AA | |
| Cell-Tak | Corning Life Sciences | CB40240 | |
| CO2 asphyxiation chamber | |||
| Dissection forceps-Dumont #5 | Fine Science Tools | 11251-10 | Stright tip |
| Dissection forceps-Dumont #7 | Fine Science Tools | 11274-20 | Curved tip |
| Dissection microscope | |||
| DMSO | Sigma | D2438 | |
| Graefe forceps | Fine Science Tools | 11051-10 | Curved, Serrated tip |
| Microscissors | Fine Science Tools | 15004-08 | Curved tip |
| NaOH solution, 1 M | Sigma-Aldrich | S8263 | Aqueous solution, prepare ahead of time |
| Rotenone, 10 mM stock solution | Sigma | R8875 | Dissolve in DMSO, prepare ahead of time |
| Seahorse calibration medium | Agilent | 100840-000 | |
| Seahorse XF 1.0 M glucose | Agilent | 103577-100 | |
| Seahorse XF 100 mM pyruvate | Agilent | 103578-100 | |
| Seahorse XF 200 mM glutamine | Agilent | 103579-100 | |
| Seahorse XF DMEM medium | Agilent | 103575-100 | pH 7.4, with 5 mM HEPES |
| Seahorse XFe24 Islet Capture FluxPak | Agilent | 103518-100 | Containing Sensor Cartridge and Islet Capture microplate |
| Seahorse XFe24, Extra Cellular Flux Analyzer | Agilent | ||
| Sodium bicarbonate solution, 0.1 M | Sigma-Aldrich | S5761 | Aqueous solution, prepare ahead of time |
| Superfine eyelash brush | Ted Pella | 113 |
参考文献
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wong-Riley, M. T. Energy metabolism of the visual system. Eye Brain. 2, 99-116 (2010).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retina and Eye Research. 20, 175-208 (2001).
- Barot, M., Gokulgandhi, M. R., Mitra, A. K. Mitochondrial dysfunction in retinal diseases. Current Eye Research. 36 (12), 1069-1077 (2011).
- Joyal, J. S., Gantner, M. L., Smith, L. E. H. Retinal energy demands control vascular supply of the retina in development and disease: The role of neuronal lipid and glucose metabolism. Progress in Retina and Eye Research. 64, 131-156 (2018).
- Hurley, J. B., Lindsay, K. J., Du, J. Glucose, lactate, and shuttling of metabolites in vertebrate retinas. Journal of Neuroscience Research. 93 (7), 1079-1092 (2015).
- Haydinger, C. D., Kittipassorn, T., Peet, D. J. Power to see-Drivers of aerobic glycolysis in the mammalian retina: A review. Clinical and Experimental Ophthalmology. 48 (8), 1057-1071 (2020).
- Wright, A. F., et al. Lifespan and mitochondrial control of neurodegeneration. Nature Genetics. 36, 1153-1158 (2004).
- Bossy-Wetzel, E., Schwarzenbacher, R., Lipton, S. A. Molecular pathways to neurodegeneration. Nature Medicine. 10, 2-9 (2004).
- Leveillard, T., Philp, N. J., Sennlaub, F. Is retinal metabolic dysfunction at the center of the pathogenesis of age-related macular degeneration. International Journal of Molecular Sciences. 20 (3), (2019).
- Vlachantoni, D., et al. Evidence of severe mitochondrial oxidative stress and a protective effect of low oxygen in mouse models of inherited photoreceptor degeneration. Human Molecular Genetics. 20 (2), 322-335 (2011).
- Grenell, A., et al. Loss of MPC1 reprograms retinal metabolism to impair visual function. Proceedings of the National Academy of Science U. S. A. 116 (9), 3530-3535 (2019).
- Wright, A. F., Chakarova, C. F., Abd El-Aziz, M. M., Bhattacharya, S. S. Photoreceptor degeneration: genetic and mechanistic dissection of a complex trait. Nature Reviews in Genetics. 11 (4), 273-284 (2010).
- Jarrett, S. G., Boulton, M. E. Consequences of oxidative stress in age-related macular degeneration. Molecular Aspects of Medicine. 33 (4), 399-417 (2012).
- Rozing, M., et al. Age-related macular degeneration: A two-level model hypothesis. Progress in Retina Eye Research. 76, 100825 (2020).
- Yokosako, K., et al. Glycolysis in patients with age-related macular degeneration. Open Ophthalmology Journal. 8, 39-47 (2014).
- Bek, T. Mitochondrial dysfunction and diabetic retinopathy. Mitochondrion. 36, 4-6 (2017).
- Yumnamcha, T., Guerra, M., Singh, L. P., Ibrahim, A. S. Metabolic dysregulation and neurovascular dysfunction in diabetic retinopathy. Antioxidants. 9 (12), (2020).
- Futterman, S., Kinoshita, J. H. Metabolism of the retina. I. Respiration of cattle retina. Journal of Biological Chemistry. 234 (4), 723-726 (1959).
- Linsenmeier, R. A. Effects of light and darkness on oxygen distribution and consumption in the cat retina. Journal of General Physiology. 88 (4), 521-542 (1986).
- Medrano, C. J., Fox, D. A. Oxygen consumption in the rat outer and inner retina: light- and pharmacologically-induced inhibition. Experiments in Eye Research. 61 (3), 273-284 (1995).
- Kooragayala, K. Quantification of oxygen consumption in retina ex vivo demonstrates limited reserve capacity of photoreceptor mitochondria. Investigative Ophthalmology and Visual Science. 56 (13), 8428-8436 (2015).
- Adlakha, Y. K., Swaroop, A. Determination of mitochondrial oxygen consumption in the retina ex vivo: applications for retinal disease. Methods in Molecular Biology. 1753, 167-177 (2018).
- . Agilent Mitocondrial stress test user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Cell_Mito_Stress_Test_Kit_User_Guide.pdf (2021)
- . Agilent Glycolytic rate assay user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . Agilent wave 2.6 user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . AVMA Guidelines for the Euthanasia of Animals Available from: https://www.avma.org/sites/default/files/2020-01/2020-Euthanasia-Final-1-17-20.pdf (2021)
- . Improving Quantification of Cellular Glycolytic Rate Using Agilent Seahorse XF Technology Available from: https://www.agilent.com/cs/library/whitepaper/public/whitepaper-improve-quantification-of-cellular-glycolytic-rate-cell-analysis-5991-7894en-agilent.pdf (2021)
- . Report Generator User Guide Agilent Seahorse XF Cell Mito Stress Test Available from: https://www.agilent.com/cs/library/usermanuals/public/Report_Generator_User_Guide_Seahorse_XF_Cell_Mito_Stress_Test_Single_File.pdf (2021)
- . Agilent Seahorse XF Buffer Factor Protocol Available from: https://www.agilent.com/cs/library/usermanuals/public/usermanual-xf-buffer-factor-protocol-cell-analysis-S7888-10010en-agilent.pdf (2021)
- . Agilent sensor cartridges and cell culture microplates Available from: https://www.agilent.com/cs/library/brochures/5991-8657EN_seahorse_plastics_brochure.pdf (2021)
- . Agilent Seahorse XF Glycolysis Stress Test Kit User Guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Glycolysis_Stress_Test_Kit_User_Guide.pdf (2021)
- Fan, Y. Y. A bioassay to measure energy metabolism in mouse colonic crypts, organoids, and sorted stem cells. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309, 1-9 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell- and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. Journal of Neuroscience. 18 (21), 8936-8946 (1998).
- Akimoto, M., et al. Targeting of GFP to newborn rods by Nrl promoter and temporal expression profiling of flow-sorted photoreceptors. Proceedings of the National Academy of Science U. S. A. 103 (10), 3890-3895 (2006).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Corso-Diaz, X., et al. Genome-wide profiling identifies DNA methylation signatures of aging in rod photoreceptors associated with alterations in energy metabolism. Cell Reports. 31 (3), 107525 (2020).
- Berkowitz, B. A., et al. Mitochondrial respiration in outer retina contributes to light-evoked increase in hydration in vivo. Investigative Ophthalmology and Visual Science. 59 (15), 5957-5964 (2018).
- Joyal, J. S., et al. Retinal lipid and glucose metabolism dictates angiogenesis through the lipid sensor Ffar1. Nature Medicine. 22 (4), 439-445 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved