Method Article
Proteotoksik Stresör ile Escherichia coli Tedavisinden Sonra Protein Agregalarının Ekstraksiyonu ve Görselleştirilmesi
Bu Makalede
Özet
Bu protokol, proteotoksik antimikrobiyal ile tedaviden sonra Escherichia coli'den agrega ve çözünür proteinlerin çıkarılmasını ve görselleştirilmesini açıklar. Bu prosedürün ardından, farklı bakteri suşlarında ve/veya tedaviler arasında in vivo protein agrega oluşumunun nitel bir karşılaştırmasına izin verir.
Özet
Canlı organizmaların çevresel ve hücresel streslere maruz kalması genellikle protein homeostazında bozulmalara neden olur ve protein toplanmasına neden olabilir. Bakteri hücrelerinde protein agregalarının birikmesi, hücresel fenotipik davranışta büyüme oranlarında azalma, stres direnci ve virülans da dahil olmak üzere önemli değişikliklere yol açabilir. Bu stresör aracılı fenotiplerin incelenmesi için çeşitli deneysel prosedürler mevcuttur. Bu makalede, gümüş ruthenium içeren bir antimikrobiyal ile tedavi edildikten sonra farklı Escherichia coli suşlarından agrega ve çözünür proteinlerin çıkarılması ve görselleştirilmesi için optimize edilmiş bir test açıklanmaktadır. Bu bileşiğin reaktif oksijen türleri ürettiği ve yaygın protein toplamasına neden olduğu bilinmektedir.
Yöntem, protein agregalarının ve çözünür proteinlerin işlenmiş ve işlenmemiş hücrelerden santrifüj bazlı ayrıştırılmasını, sodyum dodecyl sülfat-poliakrilamid jel elektroforezi (SDS-PAGE) ve Coomassie boyama ile daha sonra ayırma ve görselleştirme ile birleştirir. Bu yaklaşım basit, hızlıdır ve farklı E. coli suşlarında protein agrega oluşumunun nitel bir karşılaştırmasına izin verir. Metodoloji, diğer proteotoksik antimikrobiyallerin çok çeşitli bakterilerde in vivo protein toplama üzerindeki etkisini araştırma imkanı da dahil olmak üzere çok çeşitli uygulamalara sahiptir. Ayrıca, protokol proteotoksik maddelere karşı direncin artmasına katkıda bulunan genleri tanımlamak için kullanılabilir. Jel bantlar, özellikle toplanmaya eğilimli proteinlerin daha sonra tanımlanması için kullanılabilir.
Giriş
Bakteriler kaçınılmaz olarak düşük pH da dahil olmak üzere sayısız çevresel strese maruz kalır (örneğin,memelimidesinde) 1,2, reaktif oksijen ve klor türleri (ROS/RCS) (örneğin, fagositlerde oksidatif patlama sırasında)3,4,5,yüksek sıcaklıklar (örneğin, kaplıcalarda veya ısı şoku sırasında)6,7ve birkaç güçlü antimikrobiyal (örneğin, bu protokolde kullanılan AGXX)8. Proteinler bu stresörlerden herhangi birine karşı özellikle savunmasızdır ve maruz kalma, proteinin toplanmasına neden olabilir. Tüm organizmalar protein yanlış katlama ile başa çıkmalarını sağlayan koruyucu sistemler kullanmaktadır9. Bununla birlikte, şiddetli stres protein kalite kontrol makinelerini bunaltabilir ve proteinlerin ikincil ve/veya üçüncül yapısını bozabilir ve sonuçta proteinleri devre dışı bırakabilir. Sonuç olarak, protein agregaları bakteri üreme ve hayatta kalma, stres direnci ve virülans için gerekli kritik hücresel fonksiyonları ciddi şekilde bozabilir10. Bu nedenle, protein toplama ve bakterilerdeki sonuçlarına odaklanan araştırmalar, bulaşıcı hastalık kontrolü üzerindeki potansiyel etkisi nedeniyle ilgili bir konudur.
Isı kaynaklı protein açma ve toplama genellikle geridönüşümlüdür 7. Buna karşılık, oksidatif stres gibi diğer proteotoksik gerilmeler, spesifik amino asit yan zincirlerinin oksidasyonu yoluyla geri dönüşü olmayan protein değişikliklerine neden olabilir ve bu da proteinin yanlış/ yanlış katlanmasına ve sonunda protein toplama4. Çözünmeyen protein agregalarının stres kaynaklı oluşumu, moleküler refakatçiler ve maya ve bakterilerdeki koruyucu işlevleri bağlamında kapsamlı bir şekilde incelenmiştir11,12,13. Çözünmeyen protein agregalarının izolasyonu ve analizi için çeşitli biyokimyasal teknikler kullanan çeşitli protokoller yayınlanmıştır14,15,16,17. Mevcut protokoller esas olarak ısı şoku ve/veya moleküler refakatçilerin tanımlanması üzerine bakteriyel protein toplamayı incelemek için kullanılmıştır. Bu protokoller kesinlikle sahaya ilerlemekle birlikte, deneysel prosedürlerde bazı büyük rahatsızlıklar vardır, çünkü (i) hücre bozucuların, Fransız basınının ve/veya sonication14 , 15,17veya (iii) zaman alıcı tekrarlanan kullanımı da dahil olmak üzere 10 L 14,17, (ii) karmaşık fiziksel bozulma süreçlerine kadar büyük bir bakteri kültürü hacmi gerektirirler. yıkama ve kuluçka adımları15,16,17.
Bu makale, önceki yaklaşımların sınırlamalarını ele almayı amaçlayan ve proteotoksik antimikrobiyal yüzey kaplaması ile tedaviden sonra iki farklı Escherichia coli suşunda oluşan protein agregalarının miktarının analiz edilmesine izin veren değiştirilmiş bir protokolü açıklar. Kaplama, askorbik asit ile şartlandırılmış metal-gümüş (Ag) ve ruthenium (Ru) oluşur ve antimikrobiyal aktivitesi reaktif oksijen türlerinin üretilmesi ile elde edilir8,18. Burada, antimikrobiyal bileşik ile tedaviden sonra bakteri kültürünün hazırlanmasının ayrıntılı bir açıklaması ve antimikrobiyal konsantrasyonun artmasına karşı belirgin duyarlılık profillerine sahip iki E. coli suşunun maruz kalması üzerine protein toplama durumunun karşılaştırılması yer alıyor. Açıklanan yöntem ucuz, hızlı ve tekrarlanabilir ve diğer proteotoksik bileşiklerin varlığında protein toplamayı incelemek için kullanılabilir. Ek olarak, protokol, belirli gen silmelerinin çeşitli farklı bakterilerde protein toplama üzerindeki etkisini analiz etmek için değiştirilebilir.
Protokol
1. E. coli suşlarının stres tedavisi MG1655 ve CFT073
- Sırasıyla tek bir kommensal E. coli suşu MG1655 ve üropatojen E. coli (UPEC) suşu CFT073 kolonisi ile 5 mL lysojeny et suyu (LB) ortamını aşıleyin ve 37 °C ve 300 rpm'de 14-16 saat (bir gecede) kuluçkaya yatırın.
NOT: Escherichia coli CFT073 bir insan patojenidir. CFT073'ün kullanımı Biyogüvenlik Seviye-2 sertifikalı bir laboratuvarda uygun biyogüvenlik önlemleri ile yapılmalıdır. - Her suş, 70 mL 3-(N-morfolino)propansülfonic asit (MOPS)-glikoz (MOPS-g) ( Tablo1) içeren 500 mL'lik bir şişeye seyreltin ve 0,1 600 nm (OD600)değerinde optik yoğunluğa kadar orta. Orta kütük aşamasına ulaşılana kadar 37 °C ve 300 rpm'de kuluçkaya yaslanın (OD600 = 0.5-0.55).
- Her kültürün 20 mL'lik kısmını önceden ısıtılmış üç 125 mL şişeye aktarın ve 37 °C ve 300 rpm'de 2 dakika kuluçkaya yatırın.
NOT: Örneklerin zamanında işlenmesi gerektiğinden, aynı anda en fazla 6 kültürü işleyin. - MOPS-g ortamında 2 mg/mL konsantrasyonda bir antimikrobiyal bileşik çözelti hazırlayın. Belirtilen konsantrasyonlara ulaşmak için her kültüre antimikrobiyal ekleyin. İşlenmemiş kontrol için gerekli MOPS-g orta hacmini ekleyin.
NOT: Bileşik parçacıkların eşit bir şekilde dağıtılmasına izin vermek ve sedimansasyonu önlemek için 2 mg/mL antimikrobiyal çözeltiyi girdap. - Kültürleri 37 °C ve 300 rpm'de 45 dakika kuluçkaya yatırın.

Şekil 1: Escherichia coli stres tedavisi. Bakteri kültürleri MOPS-g'de yetiştirilir ve orta kütük fazı ulaştığında gümüş-ruthenium içeren antimikrobiyalin belirtilen konsantrasyonları ile tedavi edilir. Kısaltmalar: LB = lysogeny et suyu; Ag-Ru = gümüş-ruthenium; MOPS-g = 3-(N-morpholino)propansülofik asit (MOPS)-glikoz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Bakteri hücresi örneklerinin toplanması
- 45 dakikalık stres tedavisinden sonra, her kültürünOD 600'ü belirleyin. Her örnek için, 4 mL OD600 = 15 mL santrifüj tüplerinde 3.000 × g ve 4 °C'de 15 dakika santrifüjleme ile eşdeğer hücreler hasat edin.
- Süpernatant'ı tamamen çıkarın ve hücre peletlerini 50 μL buz gibi lizis tamponunda yeniden depolar (Tablo 1). Örnekleri buzda 30 dakika kuluçkaya yatır.
NOT: Bu lizis adımı peptidoglikan tabakasını bozayır. Her zaman yeni hazırlanmış lizis tamponu kullanın. - Numuneleri 1,7 mL mikrosantrifüj tüplerine aktarın. Bir sonraki kullanıma kadar -80 °C'de dondurun.

Şekil 2: Bakteriyel numune toplama. Hücre örnekleri santrifüjleme ile toplanır ve lizis tamponunda yeniden depolanır ve ardından -80 °C'de depolanır.
3. Çözünmeyen protein agregalarının çıkarılması
- Buzdaki örnekleri eritin.
NOT: Donma-çözülme döngüsü hücre lizizine katkıda bulunur. - 360 μL buz gibi tampon A (Tablo 1) ekleyin ve pipetleme ile hafifçe karıştırın.
NOT: Ozmotik şok hücre lizizine de katkıda bulunacaktır. - Numuneyi ~ 200 μL 0,5 mm cam boncuk içeren 2 mL mikrosantrifüj tüpüne aktarın. 1.400 rpm'de sallanan bir termokserde 8 °C'de 30 dakika kuluçkaya yaslanın.
NOT: Bu adım hücrenin fiziksel bozulmasına neden olur. Protein bozulmasını en aza indirmek için bir proteaz inhibitörü kullanılabilir. Kesinti 4 °C'de yapılabilir. Cam boncuk kullanımının maya19'daküçük bir protein alt kümesinin toplanmasına neden olduğu bildirilmiştir. - Cam boncukları yerleştirmek için titremeden buz üzerinde 5 dakika kuluçkaya yatın. Hücre lisatının 200 μL'lik kısmını 1,7 mL mikrosantrifüj tüplere aktarın.
NOT: Cam boncukların aktarılmasından kaçının. - 16.000 × g ve 4 °C'de 20 dakika santrifüj. Çözünür proteinler içeren süpernatantı toplayın ve bölüm 4'e geçin.
- Pipet kullanarak peletin 200 μL buz gibi tampon A(Tablo 1)ile yeniden depolansın. 16.000 × g ve 4 °C'de 20 dakika santrifüj. Üst kuruluşu dikkatlice çıkarın.
- 200 μL buz gibi tampon B ekleyin (bkz. Tablo 1 ve Malzeme Tablosu)ve peletin pipetlenerek dikkatlice yeniden depolanarak yeniden depolanır.
NOT: İyonik olmayan deterjan membran proteinini çözünür. - Santrifüjü 16.000 g × ve 4 °C'de 20 dakika boyunca tekrarlayın. Üst saltanayı dikkatlice çıkarın.
- Peletin boru ile 200 μL soğuk tampon A(Tablo 1)olarak yeniden depolansın. 16.000 × g ve 4 °C'de 20 dakika santrifüj. Üst saltanayı tamamen çıkarın.
- Peleti 100 μL 1x azaltıcı SDS numune tamponunda (Tablo 1) yeniden sakla ve bir termokserde 95 °C'de 5 dakika kaynatın.
- Daha sonra devam etmek için numuneyi -20 °C'de saklayın veya ayırma için hemen bir SDS poliakrilamid jeline yükleyin.

Şekil 3: Çözünmeyen protein agregalarının ekstraksiyonu. Protein agregalarının çıkarılması, hücre bozulması, protein agregalarının çözünür proteinlerden ayrılması, membran proteinlerinin çözünmesi ve yıkanması dahil olmak üzere bir dizi adımı içerir. Kısaltma: SDS = sodyum dodecyl sülfat. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Çözünür protein numunesi hazırlama
- 3.6. adımdan 4 hacim çözünür protein örneği ile 1 hacim %100 trikloroasetik asit (TCA) karıştırın.
NOT: TCA'nın taşınması için duman davlumbaz ve kişisel koruyucu ekipman ve onaylanmış atık bertaraf prosedürü gerekir. - Protein çökeltme için 4 °C'de 10 dakika kuluçkaya yaslanın.
NOT: Beyaz çökeltici çok yakında görünecektir. - Santrifüj, 5 dakika boyunca 21.000 × g ve 4 °C'de çökeltmek ve süpernatantı çıkarmak için. Hücresel kalıntıları gidermek için peleti 200 μL buz gibi asetonla yıkayın. 21.000 × g ve 4 °C'de 5 dakika santrifüj ve süpernatantı çıkarın. Bu eylemleri adım 4.3'te toplam üç kez yineleyin.
- Açık kapaklı mikrosantrifüj tüplerini, kalan asetonları peletten çıkarmak için 37 °C'de bir termomikser içine yerleştirin.
NOT: 5 dakikadan fazla inkübasyon protein peletinin çözünürlüğü azaltabilir. - 100 μL 1x azaltıcı SDS tamponu ekleyin (Tablo 1) ve peletin tamamen çözün. Numuneyi 95 °C'de 5 dakika kaynatın.
- Numuneyi daha sonra devam etmek için -20 °C'de saklayın veya ayırma için hemen bir SDS poliakrilamid jeline yükleyin.

Şekil 4: Çözünür proteinlerin hazırlanması. Çözünür proteinin hazırlanması, trikloroasetik asit ile bir çökeltme adımı ve buz gibi aseton ile tekrarlanan yıkamayı içerir. Kısaltmalar: TCA = trikloroasetik asit; SDS = sodyum dodecyl sülfat. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. SDS-PAGE kullanılarak çıkarılan protein agregalarının ayrılması ve görselleştirilmesi
- % 12 SDS-poliakrilamid jel hazırlayın.
- İki ayırma jeli için pipet 5,1 mL çift damıtılmış su (ddH2O), 3,75 mL Tris-HCl (pH 8,8), %20 (w/v) SDS'nin 7,5 mL'si, %30 akrilamid/bisacrylamide (29:1) çözeltisinin 6 mL'si, %10 w/v amonyum persülfatın 75 mL'si ve 10 mL tetrametrinediamin (TEMED) 15 mL santrifüj tüpüne karışır ve hava kabarcıkları sokmadan hafifçe karıştırın. Jelin cam plakalar içinde 1 mL pipet kullanarak dökün ve üst 2 cm'yi karışımdan arındırın. Ayırma jelinin üstüne% 70 etanol ekleyin ve iki katman arasında eşit bir arayüze izin verin.
- Ayırma jelinin polimerizasyonundan sonra, istifleme jelini 1.535 mL ddH2O, 625 mL Tris-HCl (pH 6.8), 12.5 mL% 20 (w/ v) SDS pipetleyerek hazırlayın, %30 akrilamid/bisacrylamide (29:1) çözeltisinin 335 mL'si, %10 w/v amonyum persülfatın 12,5 mL'si ve 2,5 mL TEMED. Etanol ayırma jellerinden çıkarın ve istifleme jeli çözeltisini ekleyin. Hava kabarcıkları tanıtmadan istediğiniz sayıda cepli bir tarak takın. Polimerizasyona 20-30 dakika izin verin.
- Her numune ve protein merdiveninin 4 μL'sini ayrı kuyulara yükleyin ve jelleri Tris-Glisine çalışan tamponda(Tablo 1)oda sıcaklığında 45 dakika boyunca 144 V'ta çalıştırın.
NOT: Bromophenol bandı jelden çıkmak üzereyken jeli durdurun. - Jelleri önceden ısıtilmiş bir Fairbanks çözeltisi A(Tablo 1)içinde bir rocker üzerinde 30 dakika lekelendir.
- Jelleri önceden ısıtilmiş bir Fairbanks çözümü D'de(Tablo 1)bir rocker üzerinde istenen arka plana (örneğin, bir gecede) kadar renksizleştirilmiştir.
Şekil 5: Protein ayırma ve görselleştirme. Örnekler SDS-PAGE ile ayrılır ve Coomassie boyama ile görselleştirilir. Kısaltma: SDS-PAGE = sodyum dodecyl sülfat-poliakrilamid jel elektroforezi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
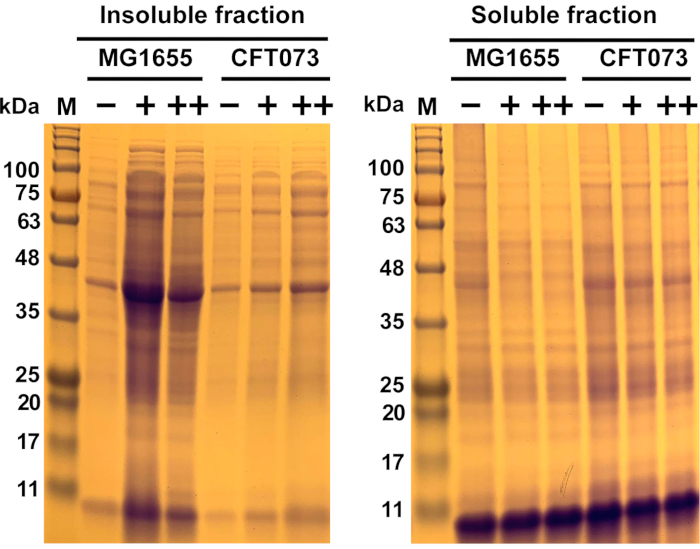
Şekil 6: Kommensal Escherichia coli suşu MG1655 ve UPEC suşu CFT073'te antimikrobiyal kaynaklı protein toplamanın temsili sonuçları. E. coli suşları MG1655 ve CFT073 belirtilen konsantrasyonlarla tedaviden önce MOPS-g ortamlarında 37 °C ve 300 rpm'de OD600= 0.5-0.55 arasında yetiştirildi (-, 0 mg/mL; +, 175 mg/mL; ++, 200 mg/mL) antimikrobiyal 45 dk. Çözünür ve çözünmeyen protein örnekleri protokolde açıklandığı gibi hazırlanmış ve Şekil 1, Şekil 2, Şekil 3ve Şekil 4'te görselleştirilmiş ve %12 SDS poliakrilamid jel üzerinde görselleştirilmiştir (Şekil 5). Antimikrobiyal varlığında her iki suşta protein agrega oluşumu (çözünmeyen fraksiyon) artarken çözünür protein miktarları azaldı. Genel olarak, antimikrobiyal MG1655 üzerinde CFT073'ten çok daha güçlü bir etkiye sahipti. Kısaltmalar: M= Protein belirteci; UPEC = üropatojenik E. coli; MOPS-g = 3-(N-morpholino)propansülofik asit (MOPS)-glikoz; SDS = sodyum dodecyl sülfat. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Burada, bu protokolü göstermek için proteotoksik gümüş-ruthenium içeren bir antimikrobiyal duyarlılığa karşı farklılık gösteren iki E. coli suşu kullanılmıştır. Ön sağkalım verileri, KOMMENSAL E. coli suşu MG1655'in ROS üreten antimikrobiyal için UPEC strain CFT073'ten (veriler gösterilmez) önemli ölçüde daha hassas olduğunu ortaya koydu. Her iki suş da MOPS-g ortamlarında 37 °C ve 300 rpm'de yetiştirildi. Orta kütük aşamasında, hücreler ya tedavi edilmez ya da antimikrobiyalin sırasıyla 175 μg/mL ve 200 μg/mL ile tedavi edilir ve 45 dakika inkübe edilir. Daha sonra, hücreler lised edildi ve hücresel protein agregaları çözünür proteinlerden ayrıldı. Her iki fraksiyondaki proteinler daha sonra SDS-PAGE ile ayrıldı ve Coomassie boyama ile görselleştirildi. Şekil 6'da gösterilen çözünmeyen fraksiyon, antimikrobiyal varlığında hücreler tedavi edilmemiş hücrelere kıyasla inkübe edildiğinde artan protein agregalarının miktarını temsil eder. Protein agrega oluşumundaki artış, daha hassas olan MG1655 suşunda agrega oluşumunda çok daha belirgin bir artış tespit edilse de, gerinim arka planından bağımsızdı. Tersine, tedavi edilmeyen muadili ile karşılaştırıldığında hücrelerin antimikrobiyal tedavisinden sonra daha düşük miktarlarda çözünür protein (çözünür fraksiyon) gözlenmiştir. CFT073'te antimikrobiyal toleransın MG1655'ten önemli ölçüde daha yüksek olduğunu gösteren ön veriler göz önüne alındığında bu sonuç bekleniyordu.
| Çözümleri | Tarifler |
| Arabellek A | 10 mM potasyum fosfat (pH 6.5), 1 mM EDTA |
| Arabellek B | %2 Nonidet P-40 içeren A tamponu. Daha sonra kullanmak üzere oda sıcaklığında saklanabilir. |
| Fairbanks A (Boyama çözümü) | %25 izopropanol, %10 Buzul Asetik asit, 1,4 g Coommassie R-250 |
| Fairbanks D (Destaining çözümü) | %10 Buzul asetik asit çözeltisi |
| Lizis arabelleği | 10 mM potasyum fosfat (pH 6.5), 1 mM EDTA, %20 sakkaroz hazırlanabilir ve uzun süreli kullanım için oda sıcaklığında saklanabilir. Kullanmadan önce 1 mg/mL lysozyme ve 50 u/mL Benzonase taze ekleyin. |
| MOPS-g medya | 100 mL 10x MOPS, 10 mL 0.132 M K2HPO4, 10 mL% glikoz, 0.5 mL 20 mM tiamin. DDH 2 O ve steril filtre ile1L'ye kadar doldurun |
| 1x SDS örnek arabelleği | 6.5 mM Tris-HCl (pH 7), %10 gliserol, %2 SDS, %0.05 bromofenol mavisi ve %2.5 β-mercaptoethanol. -20 °C'de saklanır. |
| %12 SDS poliakrilamid jel hazırlama (2 jel için) | Ayırma jeli: 5.1 mL ddH2O, 3,75 mL Tris-HCl (pH 8,8), 75 mL %20 w/v SDS, 6 mL %30 Akrilamid/Bisacrylamide çözeltisi 29:1 çözelti, 75 mL %10 w/v amonyum persülfate, 10 mL TEMED |
| İstifleme jeli: 1.535 mL ddH2O, 625 mL Tris-HCl (pH 6.8), 12.5 mL %20 w/v SDS, 335 mL %30 Akrilamid/Bisacrylamide çözeltisi 29:1 çözelti, 12.5 mL %10 w/v amonyum persülfat, 2.5 mL TEMED | |
| Arabellek çalıştıran SDS | 25 mM Tris, 192 mM Glisinin% 0.1 SDS DDH2O.'da oda sıcaklığında depolayın. |
Tablo 1: Arabellek, Ortam ve Çözümler. Bu protokolde kullanılan arabellek, ortam ve çözüm tarifleri.
Tartışmalar
Bu protokol, farklı E. coli suşlarının proteotoksik bir antimikrobiyal ile tedavisinden sonra protein agrega oluşumunun analizi için optimize edilmiş bir metodolojiyi açıklar. Protokol, tedavi edilen ve işlenmemiş E. coli hücrelerinden çözünmeyen ve çözünür protein fraksiyonlarının aynı anda çıkarılmasını sağlar. 14 , 15 , 16,20hücrelerinden protein agrega yalıtımı için mevcut protokollerle karşılaştırıldığında, bu yöntemin birkaç avantajı vardır: (i) sadece küçük kültür hacimlerine (4-8 mL) ihtiyaç vardır; (ii) hücre bozulması işlemi Fransız basını, hücre bozucu veya sonicator gibi özel ekipmanlara dayanmaz; ve (iii) protokolün, alanında nispeten erken kariyerli bilim adamları için bile takip etmesi kolaydır.
Bakteriler doğal ortamlarında sayısız stresle karşılaşırlar ve birçoğu, özellikle hücredeki en bol makromolekül olan proteinler için bir tehdit oluşturur21. Açıklanan metodoloji birçok olası uygulama sunar. Bunlardan biri, çok çeşitli streslerin (örneğin, yüksek sıcaklıklar, reaktif oksijen türleri, reaktif klor türleri) ve kimyasal bileşiklerin bakterilerde, arkealarda ve hatta ökaryotik hücrelerde protein homeostazını etkilediği etkinliği araştırma imkanıdır5,12,22,23. Ekstraksiyonumuz, uzaktan ilişkili iki E. coli suşu, MG1655 ve CFT073 ile gerçekleştirildi. Bununla birlikte, vahşi tip ve mutant suşlarında protein agrega oluşumunu karşılaştırarak protein homeostazı için spesifik gen ürünlerinin rolünü incelemek için de başarıyla uygulanmıştır11,12.
Büyüme koşullarının ve stresör konsantrasyonlarının uygun modifikasyonları ve sorun gidermeleri göz önünde bulundurulduktan sonra, bu protokol diğer Gram-negatif5 ve Gram-pozitif bakterilerde protein agrega oluşumunu belirlemek için de kullanılabilir8. Özellikle, SDS-PAGE'den sonra ayrılan jel bantları densitometrik olarak analiz edilebilir (yani ImageJ kullanılarak). Bu yaklaşım, moleküler refakatçilerin inhibitörleri gibi ek terapötik bileşiklerin etkisini analiz etmek için de kullanılabilir24. En ilgi çekici olanı, sadece çözünmeyen protein fraksiyonu 5,15'tekivarlıklarını veya yokluklarını belirleyerek, belirli bir stres koşulu altında toplamaduyarlı protein türlerinin türü hakkında bilgi sağlamak için kütle spektrometrik yaklaşımları ile birleştirilebilir.
Bu protokolün başarısı, hücrelerin maruz kaldığı stresör konsantrasyonlarının ve maruziyetin dikkatli bir şekilde değerlendirilmesini gerektirir. Bu nedenle, proteotoksik konsantrasyonu belirlemek için artan stresör konsantrasyonları ile bir ön sağkalım testi yapmanızı öneririz. Ayrıca, stresör çözümleri her deneyden önce taze olarak hazırlanmalı ve numune toplama süreleri tutarlı tutulmalıdır. Bu yöntemin bir sınırlaması, aynı anda işlenebilen düşük sayıda örnektir. Bunun başlıca nedeni, sedimentasyonu önlemek için bileşiğin kültürlere eklenmesi arasında antimikrobiyal çözeltinin önemli girdap adımlarını içeren bölüm 1'deki örneklerin zamana duyarlı işlenmesidir. Ancak, farklı çözünür stresörler uygulandığında bu böyle bir sorun olmayabilir. Ayrıca, açıklanan prosedür protein toplam konumu ve yörüngesi hakkında zaman aşımına neden olan herhangi bir bilgi sağlamaz, bu da zaman atlamalı mikroskopi25ile birlikte floresan mikroskopisi gibi daha ileri teknikler gerektirir. Özetle, geliştirilmiş metodoloji basit, takip edilmesi kolay, ucuzdur ve proteotoksik bileşikleri veya bakteriyel stres tepki genlerini tanımlamak için özel bir yaklaşım sağlayan ek modifikasyon potansiyeli sunar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Illinois State University School of Biological Sciences başlangıç fonları, Illinois State University New Faculty Initiative Grant ve NIAID hibesi R15AI164585 (J.-U.'ya) tarafından desteklendi. D.). G.M.A., Illinois State Üniversitesi Lisans Araştırma Destek Programı (G.M.A.'ya) tarafından desteklendi. K. P. H., Alman Akademik Değişim Servisi (DAAD) tarafından sağlanan rise bursu ile desteklendi. Yazarlar, AGXX tozunu sağladıkları için Largentech Vertriebs GmbH'den Dr. Uwe Landau ve Dr. Carsten Meyer'e teşekkür ediyor. Şekil 1, Şekil 2, Şekil 3, Şekil 4ve Şekil 5 Biorender ile oluşturulmuştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chemicals/Reagents | |||
| Acetone | Fisher Scientific | 67-64-1 | |
| 30% Acrylamide/Bisacrylamide solution 29:1 | Bio-Rad | 1610156 | |
| Ammonium persulfate | Millipore Sigma | A3678-100G | |
| Benzonase nuclease | Sigma | E1014-5KU | |
| Bluestain 2 Protein ladder, 5-245 kDa | GoldBio | P008-500 | |
| β-mercaptoethanol | Millipore Sigma | M6250-100ML | |
| Bromophenol blue | GoldBio | B-092-25 | |
| Coomassie Brilliant Blue R-250 | MP Biomedicals LLC | 821616 | |
| D-Glucose | Millipore Sigma | G8270-1KG | |
| D-Sucrose | Acros Organics | 57-50-1 | |
| Ethylenediamine tetra acetic acid (EDTA) | Sigma-Aldrich | SLBT9686 | |
| Glacial Acetic acid | Millipore Sigma | ARK2183-1L | |
| Glycerol, 99% | Sigma-Aldrich | G5516-1L | |
| Glycine | GoldBio | G-630-1 | |
| Hydrochloric acid, ACS reagent | Sigma-Aldrich | 320331-2.5L | |
| Isopropanol (2-Propanol) | Sigma | 402893-2.5L | |
| LB broth (Miller) | Millipore Sigma | L3522-1KG | |
| LB broth with agar (Miller) | Millipore Sigma | L2897-1KG | |
| Lysozyme | GoldBio | L-040-25 | |
| 10x MOPS Buffer | Teknova | M2101 | |
| Nonidet P-40 | Thomas Scientific | 9036-19-5 | |
| Potassium phosphate, dibasic | Sigma-Aldrich | P3786-1KG | |
| Potassium phosphate, monobasic | Acros Organics | 7778-77-0 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771-500G | |
| Tetramethylethylenediamine (TEMED) | Millipore Sigma | T9281-50ML | |
| Thiamine | Sigma-Aldrich | T4625-100G | |
| 100% Trichloroacetic acid | Millipore Sigma | T6399-100G | |
| Tris base | GoldBio | T-400-1 | |
| Material/Equipment | |||
| Centrifuge tubes (15 mL) | Alkali Scientific | JABG-1019 | |
| Erlenmeyer flask (125 mL) | Carolina | 726686 | |
| Erlenmeyer flask (500 mL) | Carolina | 726694 | |
| Freezer: -80 °C | Fisher Scientific | ||
| Glass beads (0.5 mm) | BioSpec Products | 1107-9105 | |
| Microcentrifuge | Hermle | Z216MK | |
| Microcentriguge tubes (1.7 mL) | VWR International | 87003-294 | |
| Microcentriguge tubes (2.0 mL) | Axygen Maxiclear Microtubes | MCT-200-C | |
| Plastic cuvettes | Fischer Scientific | 14-377-012 | |
| Power supply | ThermoFisher Scientific | EC105 | |
| Rocker | Alkali Scientific | RS7235 | |
| Shaking incubator (37 °C) | Benchmark Scientific | ||
| Small glass plate | Bio-Rad | 1653311 | |
| Spacer plates (1 mm) | Bio-Rad | 1653308 | |
| Spectrophotometer | Thermoscientific | 3339053 | |
| Tabletop centrifuge for 15 mL centrifuge tubes | Beckman-Coulter | ||
| Vertical gel electrophoresis chamber | Bio-Rad | 1658004 | |
| Vortexer | Fisher Vortex Genie 2 | 12-812 | |
| Thermomixer | Benchmark Scientific | H5000-HC | |
| 10 well comb | Bio-Rad | 1653359 |
Referanslar
- Dahl, J. -U., et al. HdeB functions as an acid-protective chaperone in bacteria. Journal of Biological Chemistry. 290 (1), 65-75 (2015).
- Foit, L., George, J. S., Zhang, B. W., Brooks, C. L., Bardwell, J. C. A. Chaperone activation by unfolding. Proceedings of the National Academy of Sciences of the United States of America. 110 (14), 1254-1262 (2013).
- Sultana, S., Foti, A., Dahl, J. -U. Bacterial defense systems against the neutrophilic oxidant hypochlorous acid. Infection and Immunity. 88 (7), 00964(2020).
- Dahl, J. -U., Gray, M. J., Jakob, U. Protein quality control under oxidative stress conditions. Journal of Molecular Biology. 427 (7), 1549-1563 (2015).
- Groitl, B., Dahl, J. -U., Schroeder, J. W., Jakob, U. Pseudomonas aeruginosa defense systems against microbicidal oxidants. Molecular Microbiology. 106 (3), 335-350 (2017).
- Casadevall, A. Thermal restriction as an antimicrobial function of fever. PLoS Pathogens. 12 (5), 1005577(2016).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Van Loi, V., Busche, T., Preuß, T., Kalinowski, J., Bernhardt, J. The AGXX ® antimicrobial coating causes a thiol-specific oxidative stress response and protein S-bacillithiolation in Staphylococcus aureus. Frontiers in Microbiology. 9, 3037(2018).
- Anfinsen, C. B., Scheraga, H. A. Experimental and theoretical aspects of protein folding. Advances in Protein Chemistry. 29, 205-300 (1975).
- Schramm, F. D., Schroeder, K., Jonas, K. Protein aggregation in bacteria. FEMS Microbiology Reviews. 44 (1), 54-72 (2020).
- Tomoyasu, T., Mogk, A., Langen, H., Goloubinoff, P., Bukau, B. Genetic dissection of the roles of chaperones and proteases in protein folding and degradation in the Escherichia coli cytosol. Molecular Microbiology. 40 (2), 397-413 (2001).
- Gray, M. J., et al. Polyphosphate is a primordial chaperone. Molecular Cell. 53 (5), 689-699 (2014).
- Weids, A. J., Ibstedt, S., Tamás, M. J., Grant, C. M. Distinct stress conditions result in aggregation of proteins with similar properties. Scientific Reports. 6, 24554(2016).
- Mogk, A., et al. Identification of thermolabile Escherichia coli proteins: prevention and reversion of aggregation by DnaK and ClpB. EMBO Journal. 18 (24), 6934-6949 (1999).
- Fay, A., Glickman, M. S. An essential nonredundant role for mycobacterial DnaK in native protein folding. PLoS Genetics. 10 (7), 1004516(2014).
- Schramm, F. D., Heinrich, K., Thüring, M., Bernhardt, J., Jonas, K. An essential regulatory function of the DnaK chaperone dictates the decision between proliferation and maintenance in Caulobacter crescentus. PLoS Genetics. 13 (12), 1007148(2017).
- Maisonneuve, E., Fraysse, L., Moinier, D., Dukan, S. Existence of abnormal protein aggregates in healthy Escherichia coli cells. Journal of Bacteriology. 190 (3), 887-893 (2008).
- Heiss, A., Freisinger, B., Held-Föhn, E. Enhanced antibacterial activity of silver-ruthenium coated hollow microparticles. Biointerphases. 12 (5), (2017).
- Papnayotou, I., Sun, B., Roth, A. F., Davis, N. G. Protein aggregation induced during glass bead lysis of yeast. Yeast. 27 (10), 801-816 (2010).
- Chuang, S. E., Blattner, F. R. Characterization of twenty-six new heat shock genes of Escherichia coli. Journal of Bacteriology. 175 (16), 5242-5252 (1993).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: Lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Mühlhofer, M., et al. The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins. Cell Reports. 29 (13), 4593-4607 (2019).
- Chandrangsu, P., Rensing, C., Helmann, J. D. Metal homeostasis and resistance in bacteria. Nature Reviews Microbiology. 15, 338-350 (2017).
- Stevens, M., et al. HSP60/10 chaperonin systems are inhibited by a variety of approved drugs, natural products, and known bioactive molecules. Bioorganic and Medicinal Chemistry Letters. 29 (9), 1106-1112 (2019).
- Schramm, F. D., Schroeder, K., Alvelid, J., Testa, I., Jonas, K. Growth-driven displacement of protein aggregates along the cell length ensures partitioning to both daughter cells in Caulobacter crescentus. Molecular Microbiology. 111 (6), 1430-1448 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır