Method Article
Экстракция и визуализация белковых агрегатов после лечения кишечной палочки протеотоксическим стрессором
В этой статье
Резюме
Этот протокол описывает экстракцию и визуализацию агрегированных и растворимых белков из кишечной палочки после лечения протеотоксическим противомикробным средством. Следование этой процедуре позволяет качественно сравнивать образование белковой агрегированности in vivo в различных бактериальных штаммах и/или между обработками.
Аннотация
Воздействие на живые организмы экологических и клеточных стрессов часто вызывает нарушения гомеостаза белка и может привести к агрегации белка. Накопление белковых агрегатов в бактериальных клетках может привести к значительным изменениям в клеточном фенотипической поведения, включая снижение темпов роста, стрессоустойчивости и вирулентности. Существует несколько экспериментальных процедур для изучения этих фенотипов, опосредованных стрессорами. В данной работе описан оптимизированный анализ для экстракции и визуализации агрегированных и растворимых белков из различных штаммов кишечной палочки после обработки серебристо-рутениемсодержащим антимикробным средством. Известно, что это соединение генерирует активные формы кислорода и вызывает широко распространенную агрегацию белка.
Метод сочетает в себе центрифугирование на основе разделения белковых агрегатов и растворимых белков из обработанных и необработанных клеток с последующим разделением и визуализацией путем электрофореза додецилсульфат-полиакриламидного геля натрия (SDS-PAGE) и окрашивания Coomassie. Такой подход прост, быстр и позволяет качественно сравнить образование белкового агрегата у разных штаммов E. coli. Методика имеет широкий спектр применения, включая возможность исследования влияния других протеотоксических противомикробных препаратов на агрегацию белка in vivo в широком спектре бактерий. Более того, протокол может быть использован для выявления генов, способствующих повышению устойчивости к протеотоксическим веществам. Гелевые полосы могут быть использованы для последующей идентификации белков, которые особенно склонны к агрегации.
Введение
Бактерии неизбежно подвергаются воздействию множества экологических стрессов, включая низкий рН (например, в желудке млекопитающих)1,2,активные формы кислорода и хлора (ROS / RCS) (например, во время окислительного всплеска в фагоцитах)3,4,5, повышенные температуры (например, в горячих источниках или во время теплового шока)6,7и несколько мощных противомикробных препаратов (например, AGXX, используемый в этом протоколе)8. Белки особенно уязвимы к любому из этих стрессоров, и воздействие может спровоцировать несложение белка, которое затем сеет агрегацию. Все организмы используют защитные системы, которые позволяют им справляться с неправильным свораскиванием белка9. Однако сильный стресс может перегрузить механизм контроля качества белка и нарушить вторичную и /или третичную структуру белков, что в конечном итоге инактивирует белки. Как следствие, белковые агрегаты могут серьезно ухудшить критические клеточные функции, необходимые для роста и выживания бактерий, стрессоустойчивости и вирулентности10. Поэтому исследования, посвященные агрегации белка и ее последствиям у бактерий, является актуальной темой из-за ее потенциального влияния на борьбу с инфекционными заболеваниями.
Тепловое развертывание и агрегация белка часто обратимы7. Напротив, другие протеотоксические стрессы, такие как окислительный стресс, могут вызывать необратимые модификации белка путем окисления определенных аминокислотных боковых цепей, что приводит к разложению белка и, в конечном итоге, агрегации белка4. Стресс-индуцированное образование нерастворимых белковых агрегатов широко изучено в контексте молекулярных шаперонов и их защитных функций у дрожжей и бактерий11,12,13. Было опубликовано несколько протоколов, которые используют различные биохимические методы для выделения и анализа нерастворимых белковых агрегатов14,15,16,17. Существующие протоколы в основном использовались для изучения агрегации бактериального белка при тепловом шоке и/или идентификации молекулярных шаперонов. Хотя эти протоколы, безусловно, были продвижением в этой области, в экспериментальных процедурах есть некоторые серьезные неудобства, поскольку они требуют (i) большого объема бактериальной культуры до 10 л14,17, (ii) сложных процессов физического разрушения, включая использование разрушителей клеток, френч-пресса и / или ультразвуковойобработка 14,15,17или (iii) трудоемкие повторяющиеся этапы промывки и инкубации15,16,17.
В данной работе описывается модифицированный протокол, направленный на устранение ограничений предыдущих подходов и позволяющий анализировать количество белковых агрегатов, образующихся в двух различных штаммах кишечной палочки после обработки протеотоксичным антимикробным поверхностным покрытием. Покрытие состоит из металл-серебра (Ag) и рутения (Ru)-кондиционированного аскорбиновой кислотой, а его антимикробная активность достигается за счет генерации активных форм кислорода8,18. Приведено подробное описание получения бактериальной культуры после обработки антимикробным соединением и сравнение состояния агрегации белка при воздействии двух штаммов E. coli с различными профилями восприимчивости к повышению концентрации противомикробного препарата. Описанный способ является недорогим, быстрым и воспроизводимым и может быть использован для изучения агрегации белка в присутствии других протеотоксических соединений. Кроме того, протокол может быть модифицирован для анализа влияния, которое конкретные делеции генов оказывают на агрегацию белка у множества различных бактерий.
протокол
1. Стресс-лечение штаммов E. coli MG1655 и CFT073
- Инокулируют 5 мл среды лизогенезного бульона (ЛБ) одной колонией комменсального штамма E. coli MG1655 и уропатогенного штамма E. coli (УПЭК) CFT073 соответственно и инкубируют в течение 14-16 ч (ночью) при 37 °C и 300 об/мин.
ПРИМЕЧАНИЕ: Escherichia coli CFT073 является патогеном человека. Обработка CFT073 должна осуществляться с соответствующими мерами биобезопасности в лаборатории, сертифицированной уровнем биобезопасности 2. - Разбавляют каждый штамм в колбу 500 мл, содержащую70 мл 3-(N-морфолино)пропансульфоновой кислоты (MOPS)-глюкозы (MOPS-g)(таблица 1)среды до оптической плотности при значении 600 нм (OD600)0,1. Инкубировать при 37 °C и 300 об/мин до достижения средней фазы (OD600 = 0,5-0,55).
- Переложить 20 мл каждой культуры в три предварительно высушенные колбы по 125 мл и инкубировать при 37 °C и 300 об/мин в течение 2 мин.
ПРИМЕЧАНИЕ: Поскольку требуется своевременная обработка образцов, обрабатывайте не более 6 культур одновременно. - Готовят раствор антимикробного соединения в среде MOPS-g в концентрации 2 мг/мл. Добавляют противомикробное противомикробное средстве в каждую культуру для достижения указанных концентраций. Для необработанных элементов управления добавьте необходимый объем среды MOPS-g.
ПРИМЕЧАНИЕ: Вихрь антимикробного раствора 2 мг/мл, чтобы обеспечить равномерное распределение частиц соединения и избежать осаждения. - Инкубировать культуры в течение 45 мин при 37 °C и 300 об/мин.

Рисунок 1:Лечение стресса Escherichia coli. Бактериальные культуры выращивают в МОПС-г и обрабатывают указанными концентрациями серебро-рутений-содержащего противомикробного препарата при достижении средней фазы. Сокращения: LB = лизогенный бульон; Ag-Ru = серебро-рутениевый; MOPS-g = 3-(N-морфолино)пропансульфоновая кислота (MOPS)-глюкоза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Сбор образцов бактериальных клеток
- После 45 мин лечения стрессом определяют ОД600 каждой культуры. Для каждого образца собирают клетки, эквивалентные 4 мл ОД600 = 1 в 15 мл центрифужных трубок путем центрифугирования в течение 15 мин при 3000 × г и 4 °C.
- Полностью удалить супернатант и повторно суспендируют клеточные гранулы в 50 мкл ледяного лизисного буфера(таблица 1). Инкубировать образцы в течение 30 мин на льду.
ПРИМЕЧАНИЕ: Этот этап лизиса ухудшает слой пептидо сликана. Всегда используйте свежеприготовленный буфер лизиса. - Перенесите образцы в микроцентрифужные трубки по 1,7 мл. Заморозить при -80 °C до дальнейшего использования.

Рисунок 2:Забор образцов бактерий. Образцы клеток собираются путем центрифугирования и повторно суспендируются в буфере лизиса с последующим хранением при -80 °C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Извлечение нерастворимых белковых агрегатов
- Оттаивать образцы на льду.
ПРИМЕЧАНИЕ: Цикл замораживания-оттаивания способствует лизису клеток. - Добавьте 360 мкл ледяного буфера А(таблица 1)и аккуратно перемешайте путем пипетки.
ПРИМЕЧАНИЕ: Осмотический шок также будет способствовать лизису клеток. - Перенесите образец в микроцентрифужную трубку размером 2 мл, содержащую ~200 мкл стеклянных шариков толщиной 0,5 мм. Инкубировать в течение 30 мин при 8 °C в термомиксаторе с встряхиванием при 1 400 об/мин.
ПРИМЕЧАНИЕ: Этот шаг приводит к физическому нарушению работы клетки. Ингибитор протеазы может быть использован для минимизации деградации белка. Разрушение может быть выполнено при 4 °C. Обратите внимание, что использование стеклянных шариков, как сообщается, вызывает агрегацию небольшого подмножества белков в дрожжах19. - Инкубировать в течение 5 мин на льду без встряхивания, чтобы осесть стеклянные шарики. Перенесите 200 мкл клеточного лизата в микроцентрифужные трубки 1,7 мл.
ПРИМЕЧАНИЕ: Избегайте переноса стеклянных бусин. - Центрифуга при 16 000 × г и 4 °C в течение 20 мин. Соберите супернатант, который содержит растворимые белки, и переходите к разделу 4.
- Повторно суспендируют гранулу в 200 мкл ледяного буфера А(таблица 1)с помощью пипетки. Центрифуга при 16 000 × г и 4 °C в течение 20 мин. Осторожно удалите супернатант вообще.
- Добавьте 200 мкл ледяного буфера B (см. Таблицу 1 и Таблицу материалов)и осторожно повторно суспендирование гранул путем пипетки.
ПРИМЕЧАНИЕ: Неионное моющее средство солюбилизирует мембранный белок. - Центрифугирование повторяют при 16 000 × г и 4 °C в течение 20 мин. Осторожно удалите супернатант.
- Повторно суспендируют гранулу в 200 мкл холодного буфера А(таблица 1)путем пипетирования. Центрифуга при 16 000 × г и 4 °C в течение 20 мин. Полностью удалить супернатант.
- Повторно суспендируют гранулу в 100 мкл 1x восстанавливающего буфера образца SDS(таблица 1)и кипятят в течение 5 мин при 95 °C в термомиксаторе.
- Храните образец при -20 °C, чтобы продолжить позже или немедленно загрузить полиакриламидный гель SDS для разделения.

Рисунок 3:Экстракция нерастворимых белковых агрегатов. Экстракция белковых агрегатов включает в себя ряд этапов, включая разрушение клеток, отделение белковых агрегатов от растворимых белков, солюбилизацию мембранных белков и промывку. Аббревиатура: SDS = додецилсульфат натрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Пробоподготовка растворимого белка
- Смешайте 1 объем 100% трихлоруксусной кислоты (ТЦА) с 4 объемами образца растворимого белка из шага 3.6.
ПРИМЕЧАНИЕ: Для обработки TCA требуется вытяжной капюшон и средства индивидуальной защиты, а также утвержденная процедура удаления отходов. - Инкубировать в течение 10 мин при 4 °C, чтобы обеспечить осаждение белка.
ПРИМЕЧАНИЕ: Белый осадок появится очень скоро. - Центрифуга выпадает в осадок при 21 000 × г и 4 °C в течение 5 мин и удаляет супернатант. Промыть гранулу 200 мкл ледяного ацетона для удаления клеточного мусора. Центрифуга при 21 000 × г и 4 °C в течение 5 мин и удаление супернатанта. Повторите эти действия на шаге 4.3 в общей сложности три раза.
- Поместите микроцентрифужные трубки с открытыми крышками в термомикшер при 37 °C, чтобы удалить оставшийся ацетон из гранулы.
ПРИМЕЧАНИЕ: Инкубация более 5 мин может снизить растворимость белковой гранулы. - Добавьте 100 мкл 1x восстанавливающего буфера SDS(таблица 1)и полностью растворите гранулу. Вскипятите образец в течение 5 мин при 95 °C.
- Храните образец при -20 °C, чтобы продолжить позже или немедленно загрузить полиакриламидный гель SDS для разделения.

Рисунок 4:Получение растворимых белков. Приготовление растворимого белка включает стадию осаждения трихлоруксусной кислотой и многократное промывание ледяным ацетоном. Сокращения: TCA = трихлоруксусная кислота; SDS = додецилсульфат натрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Разделение и визуализация экстрагированных белковых агрегатов с помощью SDS-PAGE
- Приготовьте 12% SDS-полиакриламидный гель.
- Для двух разделяющих гелей пипетка 5,1 мл двойной дистиллированной воды (ddH2O), 3,75 мл Tris-HCl (рН 8,8), 7,5 мл 20% (мас./об.) SDS, 6 мл 30% раствора акриламида/бисакриламида (29:1), 75 мл 10% мас./v персульфата аммония и 10 мл тетраметилэтилендиамина (TEMED) в 15 мл центрифужной трубки и аккуратно перемешайте без введения пузырьков воздуха. Залейте гель, используя пипетку 1 мл, в стеклянные пластины, оставив верхние 2 см свободными от смеси. Добавьте 70% этанола в верхнюю часть разделяющего геля и обеспечьте равномерное сопряжение между двумя слоями.
- После полимеризации сепарационного геля готовят укладочный гель путем пипетирования 1,535 мл ddH2O, 625 мл Tris-HCl (pH 6,8), 12,5 мл 20% (мас./об.) SDS, 335 мл 30% раствора акриламида/бисакриламида (29:1), 12,5 мл 10% мас./об.персульфата аммония и 2,5 мл TEMED. Удалите этанол из разделительных гелей и добавьте раствор геля для укладки. Вставьте расческу с нужным количеством карманов без введения пузырьков воздуха. Опустить полимеризацию в течение 20-30 мин.
- Загрузите 4 мкл каждого образца и белковую лестницу в отдельные скважины и запустите гель (гели) в буфере работы Трис-Глицина(Таблица 1)при 144 В в течение 45 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Остановите гель, когда бромфенольный бандаж собирается мигрировать из геля. - Окрашивают гель(ы) в предварительно выплавленный раствор Фэрбенкса А(таблица 1)в течение 30 мин на коромысле.
- Отклейте гель(ы) в предварительно распаленном растворе Фэрбенкса D(таблица 1)до желаемого фона (например, на ночь) на коромысле.
Рисунок 5:Разделение и визуализация белков. Образцы разделены SDS-PAGE и визуализируются окрашиванием Coomassie. Аббревиатура: SDS-PAGE = электрофорез додецилсульфат-полиакриламидного геля натрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
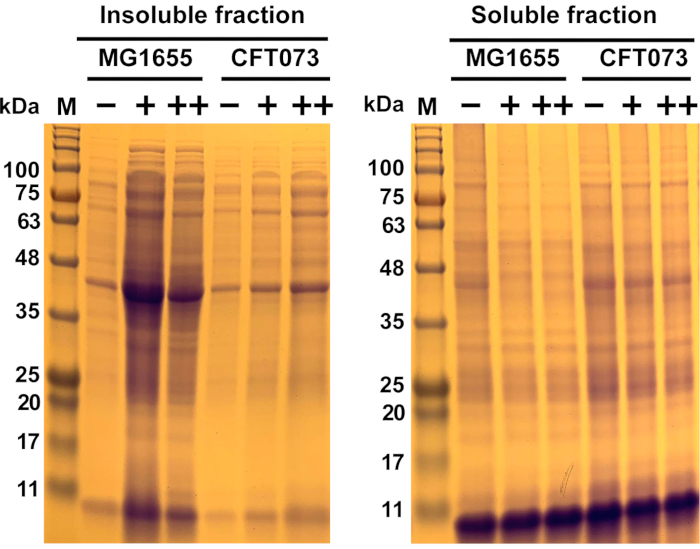
Рисунок 6:Репрезентативные результаты антимикробной агрегации белка в комменсальном штамме Escherichia coli MG1655 и штамме UPEC CFT073. Штаммы E. coli MG1655 и CFT073 выращивали при 37 °C и 300 об/мин до OD600= 0,5-0,55 в среде MOPS-g перед их обработкой указанными концентрациями (-, 0 мг/мл; +, 175 мг/мл; ++, 200 мг/мл) противомикробного средства в течение 45 мин. Образцы растворимых и нерастворимых белков были получены, как описано в протоколе и на фиг.1, фиг.2, фиг.3 и фиг.4 и визуализированы на 12% полиакриламидном геле SDS(фиг.5). Образование белкового агрегата (нерастворимая фракция) было увеличено в обоих штаммах в присутствии противомикробного препарата, в то время как количество растворимых белков было уменьшено. В целом, противомикробный эффект оказал гораздо более мощное влияние на MG1655, чем на CFT073. Сокращения: M= белковый маркер; ЮПЭК = уропатропогенная кишечная палочка; MOPS-g = 3-(N-морфолино)пропансульфоновая кислота (MOPS)-глюкоза; SDS = додецилсульфат натрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Здесь были использованы два штамма E. coli, которые отличаются по своей восприимчивости к протеотоксичному серебро-рутением-содержащему противомикробным препаратам, чтобы продемонстрировать этот протокол. Предварительные данные о выживаемости показали, что комменсальный штамм E. coli MG1655 значительно более чувствителен к АФК-генерирующим противомикробным препаратам, чем штамм UPEC CFT073 (данные не показаны). Оба штамма выращивали в среде MOPS-g при 37 °C и 300 об/мин. В середине фазы клетки либо оставляли без лечения, либо обрабатывали 175 мкг/мл и 200 мкг/мл противомикробного препарата соответственно и инкубировали в течение 45 мин. Впоследствии клетки были лизированы, а клеточные белковые агрегаты отделены от растворимых белков. Белки в обеих фракциях затем разделялись SDS-PAGE и визуализировались окрашиванием Кумасси. Нерастворимая фракция, показанная на фиг.6, представляет собой количество образующихся белковых агрегатов, которое было увеличено при инкубации клеток в присутствии противомикробного препарата по сравнению с необработанными клетками. Увеличение образования белковой агрегации не было связано с фоном штамма, хотя гораздо более выраженное увеличение образования агрегатов было обнаружено у более чувствительного штамма MG1655. И наоборот, более низкие количества растворимых белков (растворимая фракция) наблюдались после антимикробной обработки клеток по сравнению с необработанным аналогом. Такой результат был ожидаемым с учетом предварительных данных, которые показали значительно более высокую толерантность антимикробного препарата в CFT073, чем MG1655.
| Решения | Рецепты |
| Буфер A | 10 мМ калия фосфата (рН 6,5), 1 мМ ЭДТА |
| Буфер B | Буфер А, содержащий 2% нонидет Р-40. Может храниться при комнатной температуре для последующего использования. |
| Фэрбенкс А (Окрашивающее раствор) | 25% изопропанол, 10% ледниковая уксусная кислота, 1,4 г Coommassie R-250 |
| Фэрбенкс D (Решение для защиты) | 10% раствор уксусной кислоты ледникового |
| Буфер лизиса | 10 мМ калияфосфата (рН 6,5), 1 мМ ЭДТА, 20% сахарозы могут быть приготовлены и сохранены при комнатной температуре для длительного использования. Перед употреблением добавьте 1 мг/мл лизоцима и 50 мд/мл бензоназы в свежем виде. |
| MOPS-g носители | 100 мл 10x MOPS, 10 мл 0,132 M K2HPO4, 10 мл 20% глюкозы, 0,5 мл 20 мМ тиамина. Наполните до 1 л ddH2O и стерильным фильтром |
| 1 буфер образцов SDS | 6,5 мМ Tris-HCl (рН 7), 10% глицерина, 2% SDS, 0,05% бромфенола синего и 2,5% β-меркаптоэтанола. Хранить при -20 °C. |
| 12% SDS полиакриламидный гель препарат (на 2 геля) | Сепараторный гель: 5,1 мл ddH2O, 3,75 мл Tris-HCl (рН 8,8), 75 мл 20% мас./об.SDS, 6 мл 30% раствор акриламида/бисакриламида 29:1, 75 мл 10% мас./v персульфата аммония, 10 мл TEMED |
| Гель для укладки: 1,535 мл ddH2O, 625 мл Tris-HCl (pH 6,8), 12,5 мл 20% мас./об.SDS, 335 мл 30% раствор акриламида/бисакриламида 29:1, 12,5 мл 10% мас./об.персульфата аммония, 2,5 мл TEMED | |
| SDS работающий буфер | 25 мМ Tris, 192 мМ Глицин, 0,1% SDS в ddH2O. Хранить при комнатной температуре. |
Таблица 1: Буфер, носители и решения. Рецепты для буфера, носителей и решений, используемых в этом протоколе.
Обсуждение
Данный протокол описывает оптимизированную методологию анализа образования белковых агрегатов после обработки различных штаммов E. coli протеотоксическим противомикробным средством. Протокол допускает одновременную экстракцию нерастворимых и растворимых белковых фракций из обработанных и необработанных клеток E. coli. По сравнению с существующими протоколами выделения белковых агрегатов из клеток14,15,16,20,этот метод имеет ряд преимуществ: (i) необходимы только небольшие объемы культуры (4-8 мл); (ii) процесс разрушения клеток не зависит от специального оборудования, такого как френч-пресс, разрушитель ячеек или ультразвуковой аппарат; и iii) протокол легко соблюдать даже для относительно ранних ученых в этой области.
Бактерии сталкиваются с множеством стрессов в своей естественной среде, и многие из них представляют угрозу, особенно для белков, наиболее распространенных макромолекул в клетке21. Описанная методология предлагает множество потенциальных применений. Одним из них является возможность исследовать эффективность, с помощью которой широкий спектр стрессов (например, повышенные температуры, активные формы кислорода, активные виды хлора) и химических соединений влияет на гомеостаз белка у бактерий, архей и даже эукариотических клеток5,12,22,23. Наша экстракция была выполнена с двумя отдаленно связанными штаммами E. coli, MG1655 и CFT073. Тем не менее, он также был успешно применен для изучения роли специфических генных продуктов для белкового гомеостаза путем сравнения образования белковых агрегатов в диких и мутантных штаммах11,12.
После рассмотрения соответствующих модификаций и устранения неполадок в условиях роста и концентрациях стрессоров этот протокол также может быть использован для определения образования белкового агрегата у других грамотрицательных5 и грамположительных бактерий8. Примечательно, что гелевые полосы, разделенные после SDS-PAGE, могут быть денситометрически проанализированы (т. Е. С помощью ImageJ). Этот подход также может быть использован для анализа воздействия дополнительных терапевтических соединений, таких как ингибиторы молекулярных шаперонов24. Наиболее интригующим является то, что он может быть объединен с масс-спектрометрическими подходами для предоставления информации о типе белковых видов, которые чувствительны к агрегации при определенном стрессовом состоянии, просто путем определения их присутствия или отсутствия в нерастворимой белковой фракции5,15.
Успех этого протокола требует тщательного рассмотрения концентраций стрессоров, которым подвергаются клетки, и воздействия. Поэтому мы рекомендуем провести предварительный анализ выживаемости с увеличением концентрации стрессоров для определения протеотоксической концентрации. Кроме того, растворы стрессоров должны быть приготовлены заново перед каждым экспериментом, а время сбора образцов должно быть стабильным. Одним из ограничений этого метода является небольшое количество образцов, которые могут быть обработаны одновременно. Это в основном связано с чувствительной ко времени обработкой образцов в разделе 1, которая включает в себя значительные вихревые этапы антимикробного раствора между добавлением соединения в культуры, чтобы избежать осаждения. Однако это может быть не такой проблемой, когда применяются различные растворимые стрессоры. Кроме того, описанная процедура не дает какой-либо информации с временным разрешением о местоположении и траектории агрегата белка, что потребовало бы более продвинутых методов, таких как флуоресцентная микроскопия в сочетании с покадровой микроскопией25. Таким образом, улучшенная методология проста, удобна для использования, недорога и предлагает потенциал для дополнительной модификации, которая позволяет использовать индивидуальный подход к идентификации протеотоксических соединений или генов бактериального ответа на стресс.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана стартовыми фондами Школы биологических наук Университета штата Иллинойс, грантом Инициативы нового факультета Университета штата Иллинойс и грантом NIAID R15AI164585 (для J.-U. D.). G.M.A. был поддержан Программой поддержки исследований бакалавриата Университета штата Иллинойс (G.M.A.). K.P.H. была поддержана стипендией RISE, предоставленной Германской службой академических обменов (DAAD). Авторы благодарят д-ра Уве Ландау и д-ра Карстена Мейера из Largentech Vertriebs GmbH за предоставление порошка AGXX. Рисунки 1, Рисунок 2, Рисунок 3, Рисунок 4и Рисунок 5 были сгенерированы с помощью Biorender.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals/Reagents | |||
| Acetone | Fisher Scientific | 67-64-1 | |
| 30% Acrylamide/Bisacrylamide solution 29:1 | Bio-Rad | 1610156 | |
| Ammonium persulfate | Millipore Sigma | A3678-100G | |
| Benzonase nuclease | Sigma | E1014-5KU | |
| Bluestain 2 Protein ladder, 5-245 kDa | GoldBio | P008-500 | |
| β-mercaptoethanol | Millipore Sigma | M6250-100ML | |
| Bromophenol blue | GoldBio | B-092-25 | |
| Coomassie Brilliant Blue R-250 | MP Biomedicals LLC | 821616 | |
| D-Glucose | Millipore Sigma | G8270-1KG | |
| D-Sucrose | Acros Organics | 57-50-1 | |
| Ethylenediamine tetra acetic acid (EDTA) | Sigma-Aldrich | SLBT9686 | |
| Glacial Acetic acid | Millipore Sigma | ARK2183-1L | |
| Glycerol, 99% | Sigma-Aldrich | G5516-1L | |
| Glycine | GoldBio | G-630-1 | |
| Hydrochloric acid, ACS reagent | Sigma-Aldrich | 320331-2.5L | |
| Isopropanol (2-Propanol) | Sigma | 402893-2.5L | |
| LB broth (Miller) | Millipore Sigma | L3522-1KG | |
| LB broth with agar (Miller) | Millipore Sigma | L2897-1KG | |
| Lysozyme | GoldBio | L-040-25 | |
| 10x MOPS Buffer | Teknova | M2101 | |
| Nonidet P-40 | Thomas Scientific | 9036-19-5 | |
| Potassium phosphate, dibasic | Sigma-Aldrich | P3786-1KG | |
| Potassium phosphate, monobasic | Acros Organics | 7778-77-0 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771-500G | |
| Tetramethylethylenediamine (TEMED) | Millipore Sigma | T9281-50ML | |
| Thiamine | Sigma-Aldrich | T4625-100G | |
| 100% Trichloroacetic acid | Millipore Sigma | T6399-100G | |
| Tris base | GoldBio | T-400-1 | |
| Material/Equipment | |||
| Centrifuge tubes (15 mL) | Alkali Scientific | JABG-1019 | |
| Erlenmeyer flask (125 mL) | Carolina | 726686 | |
| Erlenmeyer flask (500 mL) | Carolina | 726694 | |
| Freezer: -80 °C | Fisher Scientific | ||
| Glass beads (0.5 mm) | BioSpec Products | 1107-9105 | |
| Microcentrifuge | Hermle | Z216MK | |
| Microcentriguge tubes (1.7 mL) | VWR International | 87003-294 | |
| Microcentriguge tubes (2.0 mL) | Axygen Maxiclear Microtubes | MCT-200-C | |
| Plastic cuvettes | Fischer Scientific | 14-377-012 | |
| Power supply | ThermoFisher Scientific | EC105 | |
| Rocker | Alkali Scientific | RS7235 | |
| Shaking incubator (37 °C) | Benchmark Scientific | ||
| Small glass plate | Bio-Rad | 1653311 | |
| Spacer plates (1 mm) | Bio-Rad | 1653308 | |
| Spectrophotometer | Thermoscientific | 3339053 | |
| Tabletop centrifuge for 15 mL centrifuge tubes | Beckman-Coulter | ||
| Vertical gel electrophoresis chamber | Bio-Rad | 1658004 | |
| Vortexer | Fisher Vortex Genie 2 | 12-812 | |
| Thermomixer | Benchmark Scientific | H5000-HC | |
| 10 well comb | Bio-Rad | 1653359 |
Ссылки
- Dahl, J. -U., et al. HdeB functions as an acid-protective chaperone in bacteria. Journal of Biological Chemistry. 290 (1), 65-75 (2015).
- Foit, L., George, J. S., Zhang, B. W., Brooks, C. L., Bardwell, J. C. A. Chaperone activation by unfolding. Proceedings of the National Academy of Sciences of the United States of America. 110 (14), 1254-1262 (2013).
- Sultana, S., Foti, A., Dahl, J. -U. Bacterial defense systems against the neutrophilic oxidant hypochlorous acid. Infection and Immunity. 88 (7), 00964(2020).
- Dahl, J. -U., Gray, M. J., Jakob, U. Protein quality control under oxidative stress conditions. Journal of Molecular Biology. 427 (7), 1549-1563 (2015).
- Groitl, B., Dahl, J. -U., Schroeder, J. W., Jakob, U. Pseudomonas aeruginosa defense systems against microbicidal oxidants. Molecular Microbiology. 106 (3), 335-350 (2017).
- Casadevall, A. Thermal restriction as an antimicrobial function of fever. PLoS Pathogens. 12 (5), 1005577(2016).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Van Loi, V., Busche, T., Preuß, T., Kalinowski, J., Bernhardt, J. The AGXX ® antimicrobial coating causes a thiol-specific oxidative stress response and protein S-bacillithiolation in Staphylococcus aureus. Frontiers in Microbiology. 9, 3037(2018).
- Anfinsen, C. B., Scheraga, H. A. Experimental and theoretical aspects of protein folding. Advances in Protein Chemistry. 29, 205-300 (1975).
- Schramm, F. D., Schroeder, K., Jonas, K. Protein aggregation in bacteria. FEMS Microbiology Reviews. 44 (1), 54-72 (2020).
- Tomoyasu, T., Mogk, A., Langen, H., Goloubinoff, P., Bukau, B. Genetic dissection of the roles of chaperones and proteases in protein folding and degradation in the Escherichia coli cytosol. Molecular Microbiology. 40 (2), 397-413 (2001).
- Gray, M. J., et al. Polyphosphate is a primordial chaperone. Molecular Cell. 53 (5), 689-699 (2014).
- Weids, A. J., Ibstedt, S., Tamás, M. J., Grant, C. M. Distinct stress conditions result in aggregation of proteins with similar properties. Scientific Reports. 6, 24554(2016).
- Mogk, A., et al. Identification of thermolabile Escherichia coli proteins: prevention and reversion of aggregation by DnaK and ClpB. EMBO Journal. 18 (24), 6934-6949 (1999).
- Fay, A., Glickman, M. S. An essential nonredundant role for mycobacterial DnaK in native protein folding. PLoS Genetics. 10 (7), 1004516(2014).
- Schramm, F. D., Heinrich, K., Thüring, M., Bernhardt, J., Jonas, K. An essential regulatory function of the DnaK chaperone dictates the decision between proliferation and maintenance in Caulobacter crescentus. PLoS Genetics. 13 (12), 1007148(2017).
- Maisonneuve, E., Fraysse, L., Moinier, D., Dukan, S. Existence of abnormal protein aggregates in healthy Escherichia coli cells. Journal of Bacteriology. 190 (3), 887-893 (2008).
- Heiss, A., Freisinger, B., Held-Föhn, E. Enhanced antibacterial activity of silver-ruthenium coated hollow microparticles. Biointerphases. 12 (5), (2017).
- Papnayotou, I., Sun, B., Roth, A. F., Davis, N. G. Protein aggregation induced during glass bead lysis of yeast. Yeast. 27 (10), 801-816 (2010).
- Chuang, S. E., Blattner, F. R. Characterization of twenty-six new heat shock genes of Escherichia coli. Journal of Bacteriology. 175 (16), 5242-5252 (1993).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: Lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Mühlhofer, M., et al. The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins. Cell Reports. 29 (13), 4593-4607 (2019).
- Chandrangsu, P., Rensing, C., Helmann, J. D. Metal homeostasis and resistance in bacteria. Nature Reviews Microbiology. 15, 338-350 (2017).
- Stevens, M., et al. HSP60/10 chaperonin systems are inhibited by a variety of approved drugs, natural products, and known bioactive molecules. Bioorganic and Medicinal Chemistry Letters. 29 (9), 1106-1112 (2019).
- Schramm, F. D., Schroeder, K., Alvelid, J., Testa, I., Jonas, K. Growth-driven displacement of protein aggregates along the cell length ensures partitioning to both daughter cells in Caulobacter crescentus. Molecular Microbiology. 111 (6), 1430-1448 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены