Method Article
タンパク質毒性ストストレスマによる 大腸菌 治療後のタンパク質凝集体の抽出と可視化
要約
このプロトコルは、タンパク質毒性抗菌剤による処理後の 大腸菌 からの凝集および可溶性タンパク質の抽出と可視化を記述する。この手順に従うと、異なる細菌株および/または治療間 のインビボで のタンパク質凝集形成の定性的比較が可能となる。
要約
環境や細胞のストレスに生物を曝露すると、しばしばタンパク質の恒常性の混乱を引き起こし、タンパク質凝集を引き起こす可能性があります。細菌細胞のタンパク質凝集体の蓄積は、増殖速度の低下、耐ストレス性、および毒性を含む細胞の現象行動の有意な変化につながる可能性があります。これらのストレータ媒介性型の検討にはいくつかの実験手順が存在する。この論文では、銀ルテニウム含有抗菌剤による処理後の、異なる 大腸菌 株からの凝集および可溶性タンパク質の抽出と可視化に対する最適化アッセイについて述べている。この化合物は、活性酸素種を生成することが知られており、広範囲にわたるタンパク質凝集を引き起こす。
この方法は、処理細胞および未処理細胞からのタンパク質凝集体と可溶性タンパク質の遠心分離と、その後の分離および可視化を、ドデシル硫酸-ポリアクリルアミドゲル電気泳動(SDS-PAGE)およびクママシー染色と組み合わせたものです。このアプローチは、単純で高速であり、異なる 大腸菌 株におけるタンパク質凝集体形成の定性的比較を可能にする。この方法論は、幅広い細菌における 生体内 タンパク質凝集に対する他のタンパク質毒性抗菌薬の影響を調べる可能性を含む、幅広い用途を有する。さらに、プロトコールは、タンパク質毒性物質に対する耐性の増大に寄与する遺伝子を同定するために使用することができる。ゲルバンドは、特に凝集しやすいタンパク質のその後の同定に使用できます。
概要
細菌は必然的に無数の環境ストレスにさらされ、 低pH(例えば哺乳類の胃の中)1、2、活性酸素および塩素種(ROS/RCS)(例えば、食細胞中の酸化バースト中)3、4、5、高温(例えば、温泉または熱ショック中)6、7、およびいくつかの強力な抗菌剤(例えば、このプロトコルで使用されるAGXX)タンパク質はこれらのストレッサーのいずれかに対して特に脆弱であり、暴露はタンパク質を引き起こす可能性があります。すべての生物は、タンパク質の誤折9に対処できる保護システムを採用しています。しかし、重度のストレスはタンパク質の品質管理機械を圧倒し、タンパク質の二次および/または三次構造を破壊し、最終的にタンパク質を不活性化させる可能性があります。その結果、タンパク質凝集体は、細菌の増殖および生存、ストレス耐性、および毒性10に必要な重要な細胞機能を著しく損なう可能性がある。したがって、タンパク質の凝集と細菌の影響に焦点を当てた研究は、感染症のコントロールに及ぼす潜在的な影響のために関連するトピックです。
熱誘起タンパク質の展開と凝集は、しばしば可逆的である7.対照的に、酸化ストレスなどの他のタンパク質毒性ストレスは、特定のアミノ酸側鎖の酸化によって不可逆的なタンパク質修飾を引き起こし、タンパク質の非改ざんを生じ、最終的にはタンパク質凝集4を引き起こす可能性がある。ストレス誘発不溶性タンパク質凝集体の形成は、酵母および細菌11、12、13におけるシャペロン分子およびその保護機能のコンテキストにおいて広く研究されている。不溶性タンパク質凝集体14、15、16、17の分離および分析のために様々な生化学的技術を利用するいくつかのプロトコルが発表されている。既存のプロトコルは、主に熱ショックや分子シャペロンの同定時に細菌タンパク質凝集を研究するために使用されてきました。これらのプロトコルは確かにこの分野への進歩でしたが、(i)細胞破壊器、フランスのプレス、および/または超音波処理14、15、17、または(iii)時間を消費する反復を含む複雑な物理的破壊プロセスの大きな細菌培養量を必要とするため、実験的手順には大きな不便があります。 洗浄およびインキュベーションステップ15、16、17。
本論文では、これまでのアプローチの限界に対処し、タンパク質毒性抗菌表面コーティングによる処理後に2種類のエシェリヒア・コリ株で形成されるタンパク質凝集体の量を分析することを目的とした改変プロトコルについて述べている。コーティングは、アスコルビン酸で金属銀(Ag)とルテニウム(Ru)を条件とし、その抗菌活性は活性酸素種8、18の生成によって達成される。本明細書において、抗菌性化合物による処理後の細菌培養物の調製の詳細な説明と、抗菌性の濃度を増加させるに対して明確な感受性プロファイルを有する2つの大腸菌株の曝露時のタンパク質凝集状態の比較である。記載された方法は、安価で、速く、かつ再現性が高く、他のタンパク質毒性化合物の存在下でタンパク質凝集を研究するために使用することができる。さらに、プロトコルを変更して、特定の遺伝子欠失がさまざまな異なる細菌のタンパク質凝集に与える影響を分析することができます。
プロトコル
1. 大腸菌 株MG1655およびCFT073のストレス治療
- 5 mLのリソジニーブロス(LB)培地を、それぞれ1コロニーの終部大 腸菌 株MG1655および泌尿病原性 大腸菌 (UPEC)株CFT073株で、37°Cおよび300rpmで14〜16時間(一晩)にインキュベートした。
注: 大腸菌 CFT073は、ヒトの病原体です。CFT073の取り扱いは、バイオセーフティレベル2認定ラボで適切なバイオセーフティ対策を講じる必要があります。 - 3-(N-モルフォリノ)プロパンサルホン酸(MOPS)-グルコース(MOPS-g)の70mLを含む500mLフラスコに各株を希釈し、600nm(OD600)値0.1の光学密度にします。37°Cおよび300 rpmでインキュベートして、中間段階に達するまで(OD600 = 0.5-0.55)。
- 各培養物20mLを3つのプリウォーム125mLフラスコに移し、37°Cでインキュベートし、300rpmで2分間インキュベートします。
注: サンプルのタイムリーな処理が必要なため、一度に 6 個以下のカルチャを処理してください。 - 2 mg/mLの濃度でMOPS-g培地に抗菌化合物溶液を調製する。各培養物に抗菌剤を加え、示された濃度に達する。未処理のコントロールの場合は、必要な MOPS-g メディアのボリュームを追加します。
注:2 mg/mL抗菌溶液をボルテックスして、化合物粒子の均一な分布を可能にし、沈下を避けます。 - 培養物を37°Cおよび300rpmで45分間培養します。

図1: 大腸菌 ストレス治療 細菌培養物は、MOPS-gで増殖し、中対数相に達すると、銀−ルテニウム含有抗菌剤の示された濃度で処理される。略語: LB = リソゲニースープ;Ag-Ru = 銀-ルテニウム;MOPS-g =3-(N-モルフォリノ)プロパンスルホン酸(MOPS)-グルコース。 この図の大きなバージョンを表示するには、ここをクリックしてください。
2. 細菌細胞サンプルの収集
- 45分のストレス処理の後、各培養物のOD600を決定する。各サンプルについて、3,000×gおよび4°Cで15分間の遠心分離によりOD600=15mL遠心管の4mL=1に相当する細胞を収穫する。
- 上清を完全に除去し、50μLの氷冷リシスバッファーで細胞ペレットを再懸濁する(表1)。氷の上で30分間サンプルをインキュベートします。
注:このリシスステップは、ペプチドグリカン層を劣化させます。常に作りたてのライシスバッファーを使用してください。 - サンプルを1.7 mLマイクロ遠心チューブに移します。さらに使用するまで-80°Cで凍結します。

図2:細菌サンプルコレクション 細胞サンプルは遠心分離によって採取され、リシスバッファーに再懸濁され、その後-80°Cで保存 されます。
3. 不溶性タンパク質凝集体の抽出
- 氷の上のサンプルを解凍します。
注:凍結融解サイクルは、細胞の融解に寄与します。 - 360 μLの氷冷バッファー A (表 1) を加え、ピペットで軽く混ぜます。
注:浸透性ショックは細胞のリシスにも寄与します。 - 0.5 mmガラスビーズの200 μLを含む2mLマイクロ遠心分離チューブにサンプルを移します。1,400 rpmで振るサーモミキサーで8°Cで30分間インキュベートします。
注: この手順により、セルの物理的な中断が生じます。プロテアーゼ阻害剤は、タンパク質の分解を最小限に抑えるために使用することができます。破壊は4°Cで行うことができる。 なお、ガラスビーズの使用は、酵母19におけるタンパク質の小さなサブセットの凝集を誘導すると報告されている。 - ガラスビーズを落ち着かせずに氷の上で5分間インキュベートします。200 μLの細胞ライセートを1.7 mLマイクロ遠心分離チューブに移します。
注:ガラスビーズの移動は避けてください。 - 16,000×gで遠心分離機、20分間4°C。可溶性タンパク質を含む上清を回収し、セクション4に進みます。
- ピペットを使用して、ペレットを200μLの氷冷バッファーA(表1)に再懸濁します。16,000×gで遠心分離機、20分間4°C。上清を慎重に取り除きます。
- 200 μLの氷冷バッファーB( 表1 および 材料表を参照)を加え、ピペット処理でペレットを慎重に再懸濁します。
注:非イオン性洗剤は膜タンパク質を可溶化します。 - 16,000×g、4°Cで20分間遠心分離を繰り返します。上清を慎重に取り除いてください。
- ペレットを200μLのコールドバッファーA(表1)にピペット処理して再懸濁する。16,000×gで遠心分離機、20分間4°C。上清を完全に取り除く。
- ペレットを1x減度SDSサンプルバッファー(表1)の100 μLで再懸濁し、サーモミキサーで95°Cで5分間沸騰させます。
- サンプルを-20°Cで保管し、後で進行するか、または分離のためにSDSポリアクリルアミドゲルに直ちに負荷を入れます。

図3:不溶性タンパク質凝集体の抽出 タンパク質凝集体の抽出には、細胞破壊、可溶性タンパク質からのタンパク質凝集体の分離、膜タンパク質の可溶化、および洗浄を含む一連のステップが含まれます。略語: SDS = ドデシル硫酸ナトリウム この図の大きなバージョンを表示するには、ここをクリックしてください。
4. 可溶性タンパク質サンプル調製
- ステップ3.6から100%トリクロロ酢酸(TCA)と4容量の可溶性タンパク質サンプルを混合します。
注:TCAの取り扱いには、ヒュームフードと個人用保護具と承認された廃棄物処理手順が必要です。 - 4°Cで10分間インキュベートし、タンパク質沈殿を可能にします。
注:白い沈殿物は非常にすぐに表示されます。 - 遠心分離機は21,000×g、4°Cで5分間沈殿し、上清を取り除く。200 μLの氷冷アセトンでペレットを洗浄し、細胞の破片を除去します。21,000×g、4°Cで5分間遠心分離し、上清を取り除く。ステップ 4.3 でこれらのアクションを合計 3 回繰り返します。
- 37°Cのサーモミキサーに開いた蓋を入れたマイクロ遠心分離管を入れ、ペレットから残りのアセトンを取り除きます。
注:5分以上のインキュベーションは、タンパク質ペレットの溶解度を低下させる可能性があります。 - 1x低減SDSバッファ(表1)100μLを加え、ペレットを完全に溶解します。サンプルを95°Cで5分間ゆでる。
- サンプルを-20 °Cで保存し、後で進行するか、または分離のためにSDSポリアクリルアミドゲルに直ちに負荷を入れます。

図4:可溶性タンパク質の調製 可溶性タンパク質の調製には、トリクロロ酢酸による沈殿ステップと氷冷アセトンによる繰り返し洗浄が含まれます。略語: TCA = トリクロロ酢酸;SDS = ドデシル硫酸ナトリウム。 この図の大きなバージョンを表示するには、ここをクリックしてください。
5. SDS-PAGEを用いた抽出タンパク質凝集体の分離と可視化
- 12%SDS-ポリアクリルアミドゲルを調製します。
- 2つの分離ゲルの場合、ピペット5.1mLの二重蒸留水(ddH2O)、3.75 mLのトリスHCl(pH 8.8)、7.5 mLの20%(w/v)SDS、 6 mLの30%アクリルアミド(29:1)溶液、75 mL w/v過硫酸アンモニウム、10mLのテトラメチルエチレンジアミン(TEMED)を15mL遠心分離チューブに入れ、空気気泡を入れずに軽く混ぜます。ガラス板内に1mLピペットを使用してゲルを注ぎ、上の2cmを混合物から自由に残します。分離ゲルの上部に70%エタノールを加え、2つの層の間に均一な界面を可能にする。
- 分離ゲルの重合後、ddH2Oの1.535 mLをピペット処理して積層ゲルを調製し、 トリス-HCl(pH 6.8)の625 mL、20%の12.5 mL(w/v)SDS、30%アクリルアミド/ビサクリアミド(29:1)溶液の335 mL、12.5mLの10%w/vアモニウムペルサルフェート、および2.5mL分離ゲルからエタノールを取り出し、積層ゲル溶液を添加します。気泡を導入することなく、ポケットの所望の数で櫛を挿入します。20〜30分間重合を可能にする。
- 各サンプルとプロテインラダーの4μLを別々のウェルにロードし、トリスグリシンランニングバッファ(表1)のゲルを室温で45分間144 Vで実行します。
注:ブロモフェノールバンドがゲルから移行しようとしているときにゲルを停止します。 - プリウォームドフェアバンクス溶液A(表1)にゲルをロッカーに30分間染色します。
- プリウォームドフェアバンクス溶液D(表1)でゲルをロッカー上で所望の背景(例えば、一晩)まで脱色する。
図5:タンパク質の分離と可視化 サンプルはSDS-PAGEによって分離され、クーマッシー染色によって視覚化される。略語: SDS-PAGE = ドデシル硫酸ポリアクリルアミドゲル電気泳動 この図の大きなバージョンを表示するには、ここをクリックしてください。
結果
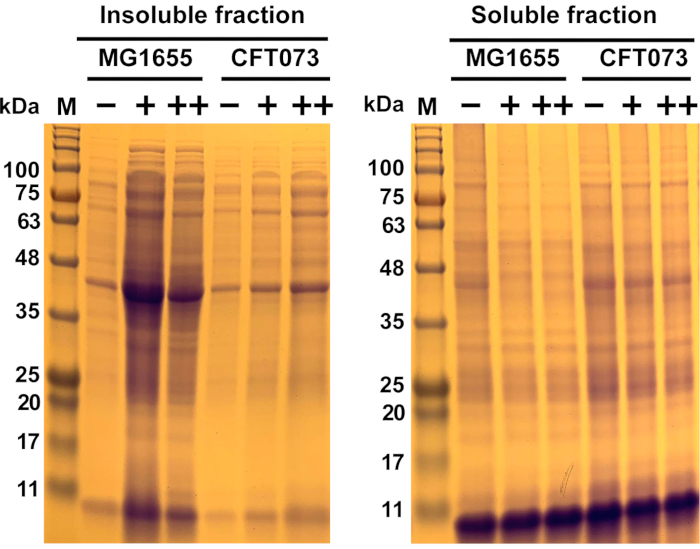
図6:コメンショナル大腸菌株MG1655およびUPEC株CFT073における抗菌誘発タンパク質凝集の代表的な結果大腸菌株MG1655およびCFT073は、示された濃度(-,0 mg/mL;+,175 mg/mL;++, 200 mg/mL)の抗菌薬で処理される前に、MOPS-g培地で37°Cおよび300rpmでOD600=0.0.55に成長した。可溶性および不溶性タンパク質サンプルは、プロトコルおよび図1に記載されているように調製し、図2、図3、および図4を12%SDSポリアクリルアミドゲル上で視覚化した(図5)。タンパク質凝集体形成(不溶性分画)は、可溶性タンパク質の量が減少した一方で、抗菌性の存在下で両方の株において増加した。全体として、抗菌薬はCFT073よりもMG1655にはるかに強力な効果を有した。略語: M= タンパク質マーカー;UPEC =泌尿器病性大腸菌;MOPS-g =3-(N-モルフォリノ)プロパンスルホン酸(MOPS)-グルコース;SDS = ドデシル硫酸ナトリウム。この図の大きなバージョンを表示するには、ここをクリックしてください。
ここでは、このプロトコルを実証するために、タンパク質毒性の銀−ルテニウム含有抗菌剤に対する感受性が異なる2つの 大腸菌 株を使用した。予備的生存データは、CMA株MG1655がUPEC 株 CFT073よりもROS生成抗菌性に対して有意に敏感であることを明らかにした(データは示さない)。両方の株は、37°Cおよび300rpmでMOPS-g培地で増殖した。中対数相では、細胞を175μg/mLおよび200μg/mLの抗菌剤でそれぞれ処理せずに、45分間インキュベートした。続いて、細胞を溶解し、細胞タンパク質凝集体を可溶性タンパク質から分離した。両画分のタンパク質をSDS-PAGEで分離し、クマシー染色によって可視化した。 図6 に示す不溶性分率は、形成されたタンパク質凝集体の量を表し、これは、未処理細胞と比較して抗菌性の存在下で細胞をインキュベートした際に増加した。タンパク質凝集体形成の増加は、株のバックグラウンドとは無関係であったが、より感受性株MG1655では凝集形成のはるかに顕著な増加が検出された。逆に、可溶性タンパク質の量が少ない(可溶性の分画)は、未処理の対応物と比較して細胞の抗菌処理後に観察された。この結果は、MG1655よりもCFT073において抗菌性の実質的に高い耐性を示した予備データを与えられたと予想された。
| ソリューション | レシピ |
| バッファ A | 10 mM リン酸カリウム (pH 6.5), 1 mM EDTA |
| バッファB | 2%のノニデトP-40を含む緩衝剤A。後で使用するために室温で保存することができます。 |
| フェアバンクスA(染色ソリューション) | 25%イソプロパノール、10%氷酢酸、1.4 g クーマシー R-250 |
| フェアバンクスD(デステインソリューション) | 10%氷酢酸溶液 |
| リシスバッファー | 10 mM リン酸カリウム (pH 6.5),1 mM EDTA, 20% スクロースを調製し、長期使用のために室温で保存することができます。使用前に1mg / mLリソザイムと50 u / mLベンゾナスを加えます。 |
| MOPS-g メディア | 100 mL 10x MOPS,10 mL 0.132 M K2HPO4, 10 mL 20% グルコース, 0.5 mL 20 mM チアミン.ddH2O および滅菌フィルターで最大 1 L を充填 |
| 1x SDS サンプルバッファー | 6.5 mM Tris-HCl(pH 7)、10%グリセロール、2%SDS、0.05%ブロモフェノールブルー、2.5%βメルカプトエタノール。-20°Cで保管。 |
| 12% SDSポリアクリルアミドゲル製剤(2ゲル用) | 分離ゲル:5.1 mL ddH2O、3.75 mL Tris-HCl(pH 8.8)、75 mL 20%w/v SDS、6 mL 30%アクリルアミド/ビサクリアミド溶液29:1溶液、75 mL 10%w/vアンモンニウムペルサルフェート、10 mL TEM |
| スタッキングジェル :1.535 mL ddH2O、625 mL Tris-HCl(pH 6.8)、12.5 mL 20%w/v SDS、335 mL 30%アクリルアミド溶液29:1溶液、12.5 mL 10 w/v ammonmon | |
| SDS 実行バッファー | 25 mM トリス、192 mM グリシン、0.1% DdH2O. ストアの室温で SDS。 |
表 1: バッファー、メディア、およびソリューション このプロトコルで使用されるバッファ、メディア、およびソリューションのレシピ。
ディスカッション
このプロトコルは、タンパク質毒性抗菌性を有する異なる大腸菌株の処理後のタンパク質凝集体形成の分析のための最適化された方法論を記述する。このプロトコルは、処理された未処理の大腸菌細胞からの不溶性および可溶性タンパク質画分の同時抽出を可能にする。細胞14、15、16、20からのタンパク質凝集分離のための既存のプロトコルと比較して、この方法はいくつかの利点を有する:(i)少量培養量(4-8 mL)のみが必要である。(ii)細胞破壊プロセスは、フランスのプレス、セルディスラプター、または超音波処理器などの特別な機器に依存しません。(iii)このプロトコルは、この分野の比較的初期の科学者にとっても従いやすい。
細菌は自然環境において無数のストレスに遭遇し、その多くは、特に細胞21の中で最も豊富な高分子であるタンパク質に対する脅威を表している。説明された方法論は、多くの潜在的なアプリケーションを提供します。そのうちの一つは、幅広いストレス(例えば、高温、活性酸素種、反応性塩素種)および化学化合物が細菌、古細菌、さらには真核細胞5、12、22、23のタンパク質ホメオスタシスに影響を及ぼす有効性を調査する可能性である。我々の抽出は、2つの遠縁関連大腸菌株、MG1655およびCFT073で行われた。しかし、野生型株と変異株11,12におけるタンパク質凝集体形成を比較することにより、タンパク質恒常性に対する特異的遺伝子産物の役割の研究にも成功している。
増殖条件およびストレータ濃度の適切な修正およびトラブルシューティングを検討した後、このプロトコルは、他のグラム陰性5およびグラム陽性菌8におけるタンパク質凝集形成を決定するためにも使用することができる。特に、SDS-PAGE後に分離されたゲルバンドは、密度的に分析することができる(すなわち、ImageJを用いて)。このアプローチはまた、分子シャペロン24の阻害剤のような追加の治療化合物の影響を分析するために使用することができる。最も興味深いことに、質量分析手法と組み合わせることで、不溶性タンパク質分画5,15における存在または不在を判定するだけで、特定のストレス状態下で凝集感受性であるタンパク質種の種類に関する情報を提供することができる。
このプロトコルの成功は、細胞が曝露されるストレッサー濃度と暴露を慎重に検討する必要があります。したがって、我々は、プロポ毒性濃度を決定するために、ストレータ濃度を増加させて予備生存アッセイを行うことを推奨する。さらに、ストレッサー溶液は各実験の前に新たに準備し、サンプル採取時間は一貫して保たれるべきである。この方法の制限の 1 つは、同時に処理できるサンプルの数が少ないことです。これは主に、沈み込みを避けるために化合物を培養物に添加する間に抗菌液の有意なボルテックスステップを伴うセクション1のサンプルの時間感受性処理によるものである。しかし、異なる可溶性ストレッサーが適用される場合、これはそのような問題ではないかもしれません。さらに、記載された手順は、タンパク質集合体の位置および軌跡に関する時間分解情報を提供するものではなく、これは、時間経過顕微鏡25と組み合わせて蛍光顕微鏡法などのより高度な技術を必要とするであろう。要約すると、改善された方法論は、簡単で、従いやすく、安価であり、タンパク質毒性化合物または細菌ストレス応答遺伝子を同定するためのカスタマイズされたアプローチを可能にする追加の改変の可能性を提供する。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、イリノイ州立大学生物科学部のスタートアップ資金、イリノイ州立大学新学部イニシアチブ助成金、NIAID助成金R15AI164585(J.-Uに対して支援されました。D.).G.M A.はイリノイ州立大学学部研究支援プログラム(G.M.A.)の支援を受けています。K. P. H. は、ドイツ学術交流サービス (DAAD) が提供する RISE フェローシップによって支援されました。著者らは、AGXX粉末を提供してくれたラージテック・ヴェルトリエブス社のウーヴェ・ランダウ博士とカーステン・マイヤー博士に感謝している。図1、図2、図3、図4、図5は、Biorenderで生成された。
資料
| Name | Company | Catalog Number | Comments |
| Chemicals/Reagents | |||
| Acetone | Fisher Scientific | 67-64-1 | |
| 30% Acrylamide/Bisacrylamide solution 29:1 | Bio-Rad | 1610156 | |
| Ammonium persulfate | Millipore Sigma | A3678-100G | |
| Benzonase nuclease | Sigma | E1014-5KU | |
| Bluestain 2 Protein ladder, 5-245 kDa | GoldBio | P008-500 | |
| β-mercaptoethanol | Millipore Sigma | M6250-100ML | |
| Bromophenol blue | GoldBio | B-092-25 | |
| Coomassie Brilliant Blue R-250 | MP Biomedicals LLC | 821616 | |
| D-Glucose | Millipore Sigma | G8270-1KG | |
| D-Sucrose | Acros Organics | 57-50-1 | |
| Ethylenediamine tetra acetic acid (EDTA) | Sigma-Aldrich | SLBT9686 | |
| Glacial Acetic acid | Millipore Sigma | ARK2183-1L | |
| Glycerol, 99% | Sigma-Aldrich | G5516-1L | |
| Glycine | GoldBio | G-630-1 | |
| Hydrochloric acid, ACS reagent | Sigma-Aldrich | 320331-2.5L | |
| Isopropanol (2-Propanol) | Sigma | 402893-2.5L | |
| LB broth (Miller) | Millipore Sigma | L3522-1KG | |
| LB broth with agar (Miller) | Millipore Sigma | L2897-1KG | |
| Lysozyme | GoldBio | L-040-25 | |
| 10x MOPS Buffer | Teknova | M2101 | |
| Nonidet P-40 | Thomas Scientific | 9036-19-5 | |
| Potassium phosphate, dibasic | Sigma-Aldrich | P3786-1KG | |
| Potassium phosphate, monobasic | Acros Organics | 7778-77-0 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771-500G | |
| Tetramethylethylenediamine (TEMED) | Millipore Sigma | T9281-50ML | |
| Thiamine | Sigma-Aldrich | T4625-100G | |
| 100% Trichloroacetic acid | Millipore Sigma | T6399-100G | |
| Tris base | GoldBio | T-400-1 | |
| Material/Equipment | |||
| Centrifuge tubes (15 mL) | Alkali Scientific | JABG-1019 | |
| Erlenmeyer flask (125 mL) | Carolina | 726686 | |
| Erlenmeyer flask (500 mL) | Carolina | 726694 | |
| Freezer: -80 °C | Fisher Scientific | ||
| Glass beads (0.5 mm) | BioSpec Products | 1107-9105 | |
| Microcentrifuge | Hermle | Z216MK | |
| Microcentriguge tubes (1.7 mL) | VWR International | 87003-294 | |
| Microcentriguge tubes (2.0 mL) | Axygen Maxiclear Microtubes | MCT-200-C | |
| Plastic cuvettes | Fischer Scientific | 14-377-012 | |
| Power supply | ThermoFisher Scientific | EC105 | |
| Rocker | Alkali Scientific | RS7235 | |
| Shaking incubator (37 °C) | Benchmark Scientific | ||
| Small glass plate | Bio-Rad | 1653311 | |
| Spacer plates (1 mm) | Bio-Rad | 1653308 | |
| Spectrophotometer | Thermoscientific | 3339053 | |
| Tabletop centrifuge for 15 mL centrifuge tubes | Beckman-Coulter | ||
| Vertical gel electrophoresis chamber | Bio-Rad | 1658004 | |
| Vortexer | Fisher Vortex Genie 2 | 12-812 | |
| Thermomixer | Benchmark Scientific | H5000-HC | |
| 10 well comb | Bio-Rad | 1653359 |
参考文献
- Dahl, J. -U., et al. HdeB functions as an acid-protective chaperone in bacteria. Journal of Biological Chemistry. 290 (1), 65-75 (2015).
- Foit, L., George, J. S., Zhang, B. W., Brooks, C. L., Bardwell, J. C. A. Chaperone activation by unfolding. Proceedings of the National Academy of Sciences of the United States of America. 110 (14), 1254-1262 (2013).
- Sultana, S., Foti, A., Dahl, J. -U. Bacterial defense systems against the neutrophilic oxidant hypochlorous acid. Infection and Immunity. 88 (7), 00964(2020).
- Dahl, J. -U., Gray, M. J., Jakob, U. Protein quality control under oxidative stress conditions. Journal of Molecular Biology. 427 (7), 1549-1563 (2015).
- Groitl, B., Dahl, J. -U., Schroeder, J. W., Jakob, U. Pseudomonas aeruginosa defense systems against microbicidal oxidants. Molecular Microbiology. 106 (3), 335-350 (2017).
- Casadevall, A. Thermal restriction as an antimicrobial function of fever. PLoS Pathogens. 12 (5), 1005577(2016).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Van Loi, V., Busche, T., Preuß, T., Kalinowski, J., Bernhardt, J. The AGXX ® antimicrobial coating causes a thiol-specific oxidative stress response and protein S-bacillithiolation in Staphylococcus aureus. Frontiers in Microbiology. 9, 3037(2018).
- Anfinsen, C. B., Scheraga, H. A. Experimental and theoretical aspects of protein folding. Advances in Protein Chemistry. 29, 205-300 (1975).
- Schramm, F. D., Schroeder, K., Jonas, K. Protein aggregation in bacteria. FEMS Microbiology Reviews. 44 (1), 54-72 (2020).
- Tomoyasu, T., Mogk, A., Langen, H., Goloubinoff, P., Bukau, B. Genetic dissection of the roles of chaperones and proteases in protein folding and degradation in the Escherichia coli cytosol. Molecular Microbiology. 40 (2), 397-413 (2001).
- Gray, M. J., et al. Polyphosphate is a primordial chaperone. Molecular Cell. 53 (5), 689-699 (2014).
- Weids, A. J., Ibstedt, S., Tamás, M. J., Grant, C. M. Distinct stress conditions result in aggregation of proteins with similar properties. Scientific Reports. 6, 24554(2016).
- Mogk, A., et al. Identification of thermolabile Escherichia coli proteins: prevention and reversion of aggregation by DnaK and ClpB. EMBO Journal. 18 (24), 6934-6949 (1999).
- Fay, A., Glickman, M. S. An essential nonredundant role for mycobacterial DnaK in native protein folding. PLoS Genetics. 10 (7), 1004516(2014).
- Schramm, F. D., Heinrich, K., Thüring, M., Bernhardt, J., Jonas, K. An essential regulatory function of the DnaK chaperone dictates the decision between proliferation and maintenance in Caulobacter crescentus. PLoS Genetics. 13 (12), 1007148(2017).
- Maisonneuve, E., Fraysse, L., Moinier, D., Dukan, S. Existence of abnormal protein aggregates in healthy Escherichia coli cells. Journal of Bacteriology. 190 (3), 887-893 (2008).
- Heiss, A., Freisinger, B., Held-Föhn, E. Enhanced antibacterial activity of silver-ruthenium coated hollow microparticles. Biointerphases. 12 (5), (2017).
- Papnayotou, I., Sun, B., Roth, A. F., Davis, N. G. Protein aggregation induced during glass bead lysis of yeast. Yeast. 27 (10), 801-816 (2010).
- Chuang, S. E., Blattner, F. R. Characterization of twenty-six new heat shock genes of Escherichia coli. Journal of Bacteriology. 175 (16), 5242-5252 (1993).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: Lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Mühlhofer, M., et al. The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins. Cell Reports. 29 (13), 4593-4607 (2019).
- Chandrangsu, P., Rensing, C., Helmann, J. D. Metal homeostasis and resistance in bacteria. Nature Reviews Microbiology. 15, 338-350 (2017).
- Stevens, M., et al. HSP60/10 chaperonin systems are inhibited by a variety of approved drugs, natural products, and known bioactive molecules. Bioorganic and Medicinal Chemistry Letters. 29 (9), 1106-1112 (2019).
- Schramm, F. D., Schroeder, K., Alvelid, J., Testa, I., Jonas, K. Growth-driven displacement of protein aggregates along the cell length ensures partitioning to both daughter cells in Caulobacter crescentus. Molecular Microbiology. 111 (6), 1430-1448 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved