Method Article
CRISPR/Cas9 Mutagenesis için Kum Sineği (Phlebotomus papatasi) Embriyo Mikroenjeksiyonu
Bu Makalede
Özet
Bu protokol, CRISPR/Cas9 hedefli mutajenizin kum sineklerindeki adımlarını detaylandırıyor: embriyo toplama, enjeksiyon, böcek yetiştirme ve tanımlamanın yanı sıra ilgi çekici mutasyonların seçimi.
Özet
Kum sinekleri, leishmania türleri için doğal vektörlerdir, protozoan parazitler, fetüs lezyonlarından viseral patolojiye kadar geniş bir semptom spektrumu üretir. Vektör / parazit etkileşimlerinin doğasının deşifre edilmesi, leishmania iletiminin konaklarına daha iyi anlaşılması için birincil öneme sahiptir. Kum sineği vektör yeterliliğini kontrol eden parametreler arasında (yani patojenleri taşıma ve iletme yetenekleri), bu böceklere içsel parametrelerin kilit rol oynadığı gösterilmiştir. Örneğin, böcek immün yanıtı, Leishmania'yakum sineği vektör yeterliliğini etkiler. Bu tür parametrelerin incelenmesi, bu model olmayan organizmalarda kullanılmak üzere uyarlanmış gen ekspresyon modifikasyon yöntemlerinin eksikliği ile sınırlanmıştır. Küçük müdahale RNA 'sı (siRNA) ile gen küçültme mümkündür, ancak teknik olarak zorlayıcı olmasının yanı sıra, susturma, nesilden nesile bulaşamayan sadece kısmi bir işlev kaybına yol açar. CRISPR/Cas9 teknolojisi ile hedeflenen mutagenesis yakın zamanda Phlebotomus papatasi kum sineğine uyarlandı. Bu teknik, özellikle seçilmiş bir lokusta aktarılabilir mutasyonların üretilmesine yol açarak ilgi genlerinin incelenmesine izin verir. CRISPR/Cas9 sistemi, daha sonra Homolog Olmayan Sonlandırma Birleştirme (NHEJ) veya Homology Driven Repair (HDR) tarafından onarılan hedeflenen çift iplikli DNA molalarının indüksiyonuna dayanır. NHEJ, kesmenin basit bir şekilde kapatılmasından oluşur ve sık sık küçük ekleme/silme olaylarına yol açar. Buna karşılık HDR, homolojiyi hedef DNA ile paylaşan bir donör DNA molekülünün varlığını onarım için bir şablon olarak kullanır. Burada, bugüne kadar kum sineği vektörlerine uyarlanmış tek genom modifikasyon tekniği olan NHEJ kullanılarak CRISPR/Cas9 tarafından hedeflenen mutajensis için bir kum sineği embriyo mikroenjeksiyon yöntemi sunuyoruz.
Giriş
Vektör kaynaklı hastalıklar sürekli evrimde önemli bir halk sağlığı tehdididir. Dünya Sağlık Örgütü'ne göre, çok farklı filojenik ailelere yayılmış yüzlerce vektör türü (örneğin sivrisinekler, keneler, pireler) yılda 700.000'den fazla insan ölümüyle sonuçlanan çok sayıda mikrobiyal patojenin bulaşmasından sorumludur. Vektör böcekler arasında, fenbotomik kum sinekleri (Diptera, Psychodidae), farklı coğrafi bölgelerde bulunan farklı fenotipik özellikler ve vektörel kapasiteler sergileyen kanıtlanmış 80 vektör türü ile geniş bir grup oluşturur. Leishmaniacinsinin protozoan parazitleri için vektörlerdir Yaklaşık 1.3 milyon yeni Leishmaniases vakasına ve yılda 20.000 ila 30.000 ölüme neden olan. Leishmaniases klinik sonuçları, kendi kendini sınırlayan keseli lezyonlardan tedavinin yokluğunda ölümcül olan viseral yayılıma kadar çeşitli semptomlarla çeşitlidir.
Kum sinekleri kesinlikle karasal böceklerdir. Diğer Diptera'lara kıyasla nispeten uzun olan yaşam döngüleri, sıcaklık, nem ve beslenme gibi farklı parametrelere bağlı olarak üç aya kadar sürer. Bir embriyonik evre (6 ila 11 gün), dört larva evresi (toplam 23 ila 25 gün sürer) ve bir pupal evreden (9 ila 10 gün) ve ardından metamorfoz ve daha sonra yetişkinlikten oluşur. Kum sinekleri yetiştirme için nemli ve sıcak bir ortam gerektirir. Hem erkekler hem de dişiler, çiçek nektarlarından vahşi doğada elde edilen şekerlerle beslenir. Sadece dişiler kan besleyicidir, çünkü yumurta üretimi için kan yemeğinden elde edilen proteinlere ihtiyaç duyarlar1.
Araştırmanın önemli bir odağı, aktarılabilir enfeksiyonların gelişmesine yol açan vektör / parazit etkileşimlerinin doğasını belirlemektir. Diğer vektör böceklerde olduğu gibi, kum sineklerine içsel parametrelerin, patojenleri konaklarına taşıma ve iletme yetenekleri olarak tanımlanan vektör yeterliliklerini etkilediği gösterilmiştir. Örneğin, parazit yüzey bileşenlerini tanıyan reseptörler olarak hareket eden Phlebotomus papatasi kum sineği midgut hücreleri tarafından galektinlerin ifadesi, Leishmania majör2,3için vektör yetkinliklerini doğrudan etkileyebilir. Böcek immün yanıt yolu, İmmün Yetmeme (IMD), Leishmania major4için Phlebotomus papatasi kum sineği vektör yeterliliği için de çok önemlidir. Vektör böcek immün yanıt yolları için enfeksiyöz patojenlerin iletimini kontrol etmede kritik bir rol benzer şekilde Aedes aegypti sivrisineklerinde5,6,7, tsetse fly Glossina morsitans8ve Anopheles gambiya sivrisineklerinde 9,10.
Kum sineği/Leishmania etkileşimleri çalışmaları, bu böceklerde kullanılmak üzere uyarlanmış gen ekspresyon modifikasyon yöntemlerinin eksikliği ile sınırlı olmuştur. Yakın zamana kadar sadece küçük müdahale RNA'sı (siRNA) ile gen küçültme11,12,13,14 olarak gerçekleşmiştir. Yetişkin kadınların mikroenjeksiyonu ile ilişkili mortalite ile sınırlı olan teknik, sadece nesilden nesile bulaşamayan kısmi bir işlev kaybına yol açar.
CRISPR/Cas9 teknolojisi, kum sinekleri gibi model olmayan organizmalarda fonksiyonel genomik araştırmalarda devrim yaratmamıştır. Bakteriyofajlara karşı savunma için prokaryotlardaki adaptif bağışıklık sisteminden modifiye edilmiş15,16, CRISPR Cas9 sistemi, böcekler de dahil olmak üzere üstün ökaryotik organizmalar için bir genom düzenleme aracı olarak hızla uyarlanmıştır. CRISPR/Cas9 hedefli genom düzenleme prensibi, tek bir kılavuz RNA'nın (sgRNA) belirli bir genomik lokusa tamamlayıcılığına dayanmaktadır. Cas9 çekirdeği sgRNA'ya bağlanır ve sgRNA'nın tamamlayıcı dizisiyle ilişkilendirildiği genomik DNA'da çift iplikli DNA (dsDNA) kırılması oluşturur. Cas9-sgRNA kompleksi, sgRNA'daki 17 ila 20 tamamlayıcı taban tarafından seçilen çekirgeye yönlendirilir, dsDNA kırılması daha sonra iki bağımsız yol ile onarılabilir: nonhomologous end joining (NHEJ) veya homology-directed repair (HDR)17. NHEJ onarımı, kesmenin basit bir şekilde kapatılmasını içerir, ancak genellikle küçük ekleme/silme olaylarına yol açar. HDR aracılığıyla DNA onarımı, onarım için bir şablon olarak hedef DNA ile homolojiyi paylaşan bir donör DNA molekülü kullanır. Böcekler her iki makineye de sahiptir.
CRISPR/Cas9 teknolojisi, NHEJ onarım yolundan seçilen bir çekirgede mutasyonlar oluşturabilir; veya uygun bir donör şablonuna sahip HDR yolundan darbeler veya ifade muhabirleri gibi daha karmaşık genom düzenleme stratejileri için. Kum sineklerinde, phlebotomus papatasi4'teNHEJ aracılı CRISPR aracılığıyla immün yanıt faktörü Relish'in boş mutant alelleri üretildi. Kum sineği embriyoları da başka bir çalışmada Sarı kodlayan geni hedefleyen crispr/cas9 karışımı ile enjekte edildi. Yine de, mutasyonu taşıyan hiçbir yetişkin üretilmedi18. Burada, protokolün kritik bir adımı olan embriyo mikroenjeksiyonuna odaklanarak NHEJ aracılı CRISPR/Cas9 tarafından hedeflenen ayrıntılı bir kum sineği hedefli mutagenezi yöntemini açıklıyoruz.
Protokol
Farelerin kum sineği beslemesi için kan kaynağı olarak kullanılması, Ulusal Sağlık Enstitüleri (NIH) Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'ndaki önerilere uygun olarak gerçekleştirildi. Protokol, NIAID, NIH Hayvan Bakım ve Kullanım Komitesi (protokol numarası LPD 68E) tarafından onaylandı. Omurgasızlar NIH yönergeleri kapsamında değildir.
1. İğne hazırlama (Şekil 1)
- Meuti ve Harrell19'daaçıklandığı gibi iğneleri ve eğimi çekin. Kısaca, borosilikat cam kılcal damarları kullanarak çift aşamalı bir cam mikropipette çekme üzerine iğneler çekin.
- Ekstra ince bir taş kullanarak mikropipette eğimli ıslak eğimli iğneleri keskinleştirin.
2. Embriyo toplanması ve mikromanipülasyonu (Şekil 2)
- Enjeksiyon gününden beş gün önce, koloni bakımı için rutin olarak gerçekleştirilen kan besleme kumu dişileri siner. Kum sineği kolonilerinin yetiştirme prosedürleri ve gerekli malzeme hakkında ayrıntılı bilgi için lütfen Avukat ve ark.1 Böcekleri tüm gelişimleri sırasında% 70 nemde ve 26 ° C'de inkübatörlerde saklayın.
- Bir gün kan besleme sonrası, kanla beslenen dişileri yan portlu alçı kaplarda 100-150 kişilik gruplar halinde yakalayın. Dişileri, koloni bakımı için olağan olan şeker çözeltisi (% 30 sakkaroz - küçük bir pamuk toplarını ıslatmak için yeterli hacim) ile besleyerek koruyun.
- Kan besleme sonrası 2-3 gün, alçı kapları nemlendirmeyin. Dişileri kuru bir substrat üzerinde tutmak erken yumurtlamayı önleyecektir, çünkü dişiler nemli bir ortama yumurta bırakmayı tercih eder.
- Kan besleme sonrası 5. günde embriyo toplama, mikromanipülasyon ve mikroenjeksiyonu gerçekleştirin. Yumurtlama odasına nemli bir filtre kağıdı sokun. Yeni döşenmiş embriyolar tam olarak gelişmiş bir korona sahip değildir ve beyaz görünür. Beyaz embriyoların görselleştirilmesini kolaylaştırmak için işlem sırasında siyah filtre kağıdı kullanın.
- Küçük bir grup dişiyi alçı tencereden bir ağız aspiratörü kullanarak yan bağlantı noktalarından yumurtlama odasına aktarın. Nemli bir substratın (filtre kağıdı) varlığı dişileri oviposit'e teşvik eder.
- 30-60 dakika sonra, filtre kağıdını odadan yeni döşenen embriyolarla dikkatlice alın. Filtre kağıdını ve embriyoları petri kabında 3 saate kadar saklayın. Bu süre zarfında, nemli kalmasını sağlamak için filtre kağıdının nem seviyesini düzenli olarak değerlendirin. Bu süre zarfında, yeni kadın gruplarıyla 2.4 ila 2.6 adımlarını tekrarlayın ve mümkün olduğunca çok embriyo toplayın.
- Enjeksiyon için mikroskop slaytları hazırlayın: yumurtaları çok ince bir boya fırçasıyla tek tek manuel olarak toplayın ve cam kapaklı bir mikroskop kaydırağı üzerine yerleştirilmiş başka bir nemli siyah filtre kağıdına dikkatlice aktarın.
- Filtre kağıdına su ekleyin, embriyoları nemli tutmaya yetecek kadar, ancak kapak kapağından uzaklaşmalarına veya örtünün altına çekilmelerine neden olmaz. Embriyoları kapak çizgisine göre hizala. Kapak, enjeksiyon sırasında yumurtaların yuvarlanmasını önleyen bir backstop görevi görür.
3. Embriyo Enjeksiyonları (Şekil 3)
- Enjeksiyonları yumurta toplamanın başlamasından 2,5 ila 3 saat sonra başlatın. Enjeksiyonları oda sıcaklığında ve ortam laboratuvarı nemsinde gerçekleştirin.
- Hizalanmış embriyoların yeterli suya sahip olduğundan emin olun, böylece nemli tutulurlar.
NOT: Enjeksiyonlar sırasında embriyoların nemli tutulması kritik öneme sahiptir. Enjeksiyon işlemi sırasında nemli değillerse, iğne embriyoyu delmede sorun yaşadığı için enjeksiyonlar zorlaşır. Doğru miktarda su, embriyoların etraflarında bir menisküs su olduğu noktadır, ancak kapak kapağı suyun üzerinde yüzerek embriyoların örtünün altına itmesine neden olmaz. Enjeksiyonlar sırasında embriyoların etrafındaki su miktarını izlemek önemlidir. Embriyoları nemli tutmak için gerektiği kadar su ekleyin. - Bir fırçayı suyla ıslatarak ve suyu filtre kağıdının arka ucuna aktararak dikkatlice su ekleyin. Bu şekilde su eklemek, suyun yavaş ve kontrollü bir şekilde eklenmesini sağlar, böylece embriyoları nemli tutacak kadar eklenir. Çok fazla su embriyoların hizadan çıkmasına neden olabilir ve bu da embriyoların enjekte edilmesine neden olabilir.
- Mikroenjeksiyon iğnesine geri yük enjeksiyonu karışımı. Elle çizilmiş bir borosilikat iğne dolgusu kullanarak iğneye yaklaşık 0,5 ila 1 μL enjeksiyon karışımı ekleyin, jel yükleme pipet uçları da kullanılabilir. Enjeksiyon karışımı, ticari rekombinant Cas9 proteini (300 ng/μL) ile karıştırılmış belirli bir lokusu hedeflemek için tasarlanmış bir veya birkaç kılavuz RNA'dan (her biri 80 ng/μL) oluşur.
- 30 psi'deki enjeksiyon basıncından başlayarak, iğnenin ucundaki havayı dışarı çıkarmak için enjeksiyon tetiğine basın. Bu, enjeksiyon karışımını iğnenin ucuna zorlayacak ve enjeksiyon karışımının akmasını sağlayacaktır. Bu noktada, enjeksiyon malzemesi akmaya başlayana kadar tutma/sabit basıncı yavaşça artırın, ardından iğneden akan enjeksiyon karışımının noktasının hemen altında olacak şekilde tutma/sabit basıncı geri çekilin. Kapılı ayar, embriyoya girmek için az miktarda malzeme görülebilmesi için yeterli enjeksiyon malzemesi sağlamalıdır.
NOT: Drosophila ve sivrisinekler için kullanılan diğer protokollere benzer şekilde halokarbon yağı altında kum sineği embriyolarının enjeksiyonu başlangıçta test edildi, ancak bu enjeksiyonların hayatta kalma yüzdesi çok düşüktü. Sağkalım, yukarıda açıklandığı gibi nemli filtre kağıdına enjeksiyonlara geçilerek iyileştirildi. - İğneyi embriyonun yanına yerleştirin. Embriyonun arkasındaki kapak kapağını, iğnenin embriyoyu delmesine yardımcı olacak bir backstop olarak kullanın. İğneyi hafifçe çıkarmadan önce embriyoya az miktarda enjeksiyon karışımı sunun.
- İğne çıkarıldıktan hemen sonra, iğne ucundan doldurulan herhangi bir malzemeyi çıkarmak için enjektöre basın. Bu, iğnenin tıkanmasını önlemeye yardımcı olacaktır.
- Bir sonraki embriyoya geçin. Her enjeksiyon arasında filtre kağıdının nemli olduğundan ve iğnenin tıkanmamasını sağlayın.
- Tüm embriyolar enjekte edildikten sonra, bir çetele tutmak için enjekte edilen embriyo sayısını sayın.
- Kapak kapağının yüzmesi için filtre kağıdına su ekleyerek kapak kapağını çıkarın. Bu noktada, kapak sapını enjekte edilen embriyolardan uzaklaştırmak için bir parmak kullanılırken filtre kağıdını yerinde tutmak için bir prob (ucuna yapışmış böcek pimli ahşap aplikatör çubuğu) kullanın.
- Kapak kapağı çıkarıldıktan sonra fazla suyu filtre kağıdından silin.
4. Enjeksiyon sonrası yetiştirme (G0) (Şekil 4)
- Filtre kağıdını, nemi korumak için bir Petri kabına yerleştirilmiş birkaç nemli filtre kağıdı katmanının üzerine embriyolarla birlikte aktarın. Diğer embriyoları enjekte etmek için gereken süre boyunca embriyoları burada tutun. Embriyolar bunun gibi en fazla 3 saat tutulabilir. Enjeksiyondan sonra yavaşça kahverengiye dönerler.
- Tüm embriyolar enjekte edildikten sonra, manuel olarak daha önce nemlendirilmiş küçük boyutlu alçı kaplara aktarın. Bireyler arasında olası mantar kirlenmesini önlemek için her tencereye çok fazla embriyo koymayın ve aralarındaki mesafeyi koruyun. Saksıları bir ekranla örtün ve tüm gelişimleri sırasında% 70 nemde ve 26 ° C'de inkübatörlerde tutulan kum sineği koloni yumurtaları için tipik olarak yapılacağı gibi saklayın.
- Enjeksiyondan sonraki 1. günde, tüm hasarlı ve ölü embriyoları bir boya fırçasıyla çıkarın. Mantar kontaminasyonunu sınırlamak için enjekte edilen embriyoları içeren alçı kaplara damla damla 100 μL% 0,5 propiyonik asit ekleyin. Enjeksiyon işlemi sırasında hasar gören embriyolardan sitoplazm salınımı özellikle mantar büyümesi için elverişlidir.
- Alçı kapları her gün kontrol edin ve kötü veya ölü embriyoları çıkarın. Mantar varsa, tüm enfekte embriyoları çıkarın ve birkaç damla% 0.5 propiyonik asit ekleyin.
- Larvalar enjeksiyon sonrası 8 ila 12 gün arasında yumurtadan çıkar. Günde iki kez, yeni ortaya çıkan larvaları maksimum 5-10 kişilik gruplar halinde yeni alçı kaplara aktarın. Az miktarda yiyecek ekleyin ve yiyecekleri haftada 2-3 kez kontrol edin.
- Mantar kontaminasyonu riskini çok fazla artırdığı için larva yiyeceklerinin miktarını dikkatlice izleyin. Kum sineği larvaları gruplar halinde daha iyi hayatta kalırlar, ancak yeterli yiyecek yoksa yamyam olabilirler.
- Larvalar yavruladığında, dişileri bakire olarak korumak için onları cinsiyete göre ayırın. Hayatta kalan çok kişi varsa, erkekleri atın ve sadece dişileri tutun.
NOT: Hem erkekler hem de dişiler mutasyon taşıyabilir ve iletebilir. Bununla birlikte, dişiler geçilmeden önce bakire tutulmaları gerektiği için, wt böceklerini cinsiyete göre ayırmak zorunda kalmamak için sadece G0 enjekte edilen kadınları kullanmak daha kolaydır. G0 erkekleri, yetişkin hayatta kalanların sayısı düşükse yedek olarak tutulabilir ve bu durumda sıralanmış wt bakire dişilerle çiftleştirilecektir.
5. Mutant alellerin seçimi ve taranır (Şekil 5)
- G0 dişilerini bir kafeste wt erkeklerle topluca geçin. Normal koloni bakımı için yapılacağı gibi onları tamamen kanla besleyin.
- Kan beslemeden bir gün sonra,2-3 wt erkekli her G 0 dişisini bir ağız aspiratörü kullanarak ayrı alçı tüplere aktarın. Sinekleri her gün değiştirilen küçük bir pamuk topu üzerinde şekerle besleyin ve alçı neminin yumurtlama için uygun olduğundan emin olmak için bir şırınna su kullanın.
- G0 dişileri yumurta bıraktıktan sonra (G1'ekarşılık gelen), vücutlarını daha sonra genotipleme için bireysel, açıklamalı Eppendorf tüplerinde toplayın. Embriyoları genellikle wt kolonileri için yapıldığı gibi koruyun.
- DNA'yı G0 dişilerinden seçim yöntemiyle çıkarın.
- Dna'yı mutasyonların varlığı için tarayın, örneğin beklenen CRISPR kesimlerinin bölgesini çevreleyen astarları kullanarak bir PCR testi tasarlayarak.
- Sadece G0 dişileri tarafından serilen G1 embriyolarını dönüşüm kanıtı göstererek saklayın. Bu G1 embriyoları pupa haline geldiğinde, onları cinsiyete göre ayırın ve sadece dişileri tutun. G1 dişilerini aynı G0 dişiden wt erkeklere geçin, kanla besleyin, ardından 2-3 kadın ve 4-5 erkekten oluşan küçük gruplar halinde küçük boyutlu kaplara aktarın.
NOT: Tüm G1 bireyleri benzersiz bir mutasyon taşıma şansına sahiptir, bu nedenle hayatta kalan bireylerin sayısı çok yüksek değilse, G1 dişilerini wt erkeklerle ayrı ayrı geçmek daha iyidir. Aynı tüpte bulunan farklı bir mutasyon taşıyan birkaç dişinin durumu nadirdir, ancak ortaya çıkabilir. Genotiplemeden sonra böyle bir durum görülürse, G2 soy dişileri daha sonra erkeklere ayrı ayrı çiftilmelidir. Bu çiftleşme şeması, soyda birden fazla mutasyon olasılığını önler. - Yumurtlamadan sonra, G1 kadın vücutlarını toplayın ve mutasyonlar için tarayın. Sadece en az bir dişinin mutasyon kanıtı gösterdiği tüpleri saklayın.
- Sonraki nesiller için tek çift çapraz yapar. Yumurtlamadan sonra, ebeveynleri mutasyon varlığı için tarayın. Her iki ebeveyn de aynı mutasyon için homozigous olana kadar her nesilde tekrarlayın. Tespit edildikten sonra, homozigous mutant stoğunun kurucuları olacak.
Sonuçlar
Kum sineği mutantları üretmek için burada açıklanan CRISPR/Cas9 mikroenjeksiyon protokolü önceki bir yayında oluşturulmuştur4. Bu yaklaşım, 540 kişiden 11'i prosedürden sağ çıktığı ve 9'unun mutant olduğu için yüksek verimli mutajensis üretti. CRISPR/Cas9 mutasyonu için kılavuzlar tasarlarken, kritik bir ilk adım, hedeflenecek alanın etrafındaki bölgeyi sıralamaktır. Sıralama şablonu, enjeksiyon için embriyo kaynağı olarak kullanılacak suştan olmalıdır. Kılavuz tasarlamak için yalnızca yayınlanan genom dizilerine güvenmek risklidir. Yayınlanan genom ve ön kılavuz tasarım dizileri arasında farklılıklar olması olağandışı değildir. Bazı durumlarda, yayınlanan genom dizisinden tasarlanan kılavuzlar, hedef genin etrafındaki bölge sıralandığında mevcut değildir (Harrell, kişisel gözlem). Buna ek olarak, dizi genotipleme sırasında gerçek CRISPR düzenlemeleri olarak yanılabilecek Tek Nükleotid Polimorfizmleri (SNP'ler) içerebilir. Bu nedenle, hedef bölgenin sırasını onaylamak, protokolün geri kalanının başarılı olması için kritik öneme sahiptir.
Böceklerin mikroenjeksiyon ile başarılı genetik modifikasyonu esas olarak iki kritik hususa bağlıdır: embriyolara mümkün olduğunca az hasar vererek gelişimin uygun zamanda malzemelerin (protein, plazmid veya mRNA) verilmesi; ve prosedürden sağ çıkacak ve yavru üretecek sağlam, sağlıklı böceklerin yetiştirimesi. Şekil 2'deaçıklanan bu prosedürün ilk aşaması, dişilerin wt kolonisinden kan beslemesi ile başlar ve beş gün sonra embriyo toplanmasına ve mikroenjeksiyonuna ilerler. İkinci aşama, enjekte edilen embriyoların yetişkinliğe kadar yetiştirilmelerinden, uygun haçların yapılmasından ve ilgi çekici mutasyonların tanımlanmasından ve izole edilmesinden oluşur.
Enjeksiyon için embriyolar 30 - 60 dakika boyunca toplanır, böylece yumurtlama sonrası saatler içinde göreceli yaş belirlenebilir. Embriyoların enjeksiyonlar başlamadan önce 3 saat boyunca gelişmesine izin verilir. Böcek gelişiminin bu zaman penceresi, embriyoların enjeksiyonlardan kurtulmasını sağlar. Bu yaşlanma döneminden sonra embriyolar hazırlanmış bir enjeksiyon kaydırağı üzerine toplanır ve embriyolar ince bir fırça kullanılarak kapak kenarına doğru yuvarlanır. Son yapılandırma Şekil 3A'da gösterilmiştir. Filtre kağıdını yeterince ıslatmak önemlidir, böylece embriyoların oturduğu kapak kenarında bir menisküs oluşur. Çok fazla su ve embriyolar kapak kenarından uzaklaştırılacaktır. Çok az embriyonun örtünün altına çekilmesine neden olur. Embriyoların nemli tutulması gerekir, aksi takdirde embriyo zarlarının enjekte edilmesi zorlaşır. Kapak kenarı bir geri durma görevi görür ve iğnenin kenara bastırıldığında embriyolara nüfuz etmesini sağlar. İğnenin sorunsuz bir şekilde nüfuz etmesini sağlayan keskin bir iğne ve bir backstop kombinasyonudur.
En başarılı mikroenjeksiyon protokollerinde olduğu gibi, enjekte edilen embriyolara uygun iyi bir mikroenjeksiyon iğnesi önemlidir. İyi, keskin iğneler, malzemenin enjeksiyon sonrası kaçmasına izin vermeden embriyoya kolayca nüfuz eden iğneler olarak tanımlanır. İyi penetrasyon, iğne embriyoya kaydığında belirgindir, penetrasyon sırasında embriyo zarının çok az veya hiç girintilenmesine neden olmaz ve iğne çekildikten sonra embriyodan malzeme sızıntısı olmaz. İyi keskin iğneler, ince bir noktaya gelen bir iğne üreten iğne çekme ayarları kullanılarak üretilir (Şekil 1A). Çekilen iğnenin çok uzun bir konik olmamalıdır. Aksi takdirde, iğnenin lümeni konikin büyük bir kısmı için çok dar hale gelir (Şekil 1B) ve enjeksiyon basıncını malzemeyi iğneden zorlayacak kadar yüksek hale getirmek zorlaşır. Bu protokolde eğimli iğneler kullanılmıştır. İğne çekme ve eğimlendirme işlemi Meuti ve Harrell19'daaçıklanmıştır. Uzun bir süre boyunca gelişen kum sineği embriyolarında, embriyonun hasar görmesini en aza indiren keskin iğnelere sahip olmak, böylece enjeksiyon bölgesinde malzeme sızmasını önlemek özellikle önemlidir. Embriyoplazma enjeksiyon sonrası bir embriyodan sızdığında, bu malzeme küf ve mantar büyümesi için zengin bir ortamdır. Daha kısa sürede gelişen embriyolarda embriyo, küf sorun olmadan önce gelişebilir ve yumurtadan çıkabilir. Enjeksiyondan sonra gözle görülür şekilde embriyoplazma sızdıran embriyolar çıkarılmalıdır.
Enjeksiyonlar sırasında, ince bir boya fırçasını ıslatarak ve filtre kağıdına dokunarak, suyun menisküsleri embriyoların hemen tabanına gelene kadar gerektiği gibi tekrarlayarak gerektiği gibi su eklemek önemlidir. Enjeksiyon gününde bağıl neme dikkat edilmesi gerekir. Düşük nem günlerinde, daha fazla su eklenmesi gerekecektir. Enjeksiyonlar tamamlandıktan sonra, filtre kağıdına biraz ekstra su eklenir, böylece kapak kapağı hafifçe yüzer ve çıkarılmasını kolaylaştırır. Kapak kapağı çıkarıldıktan sonra, enjekte edilen embriyoların olduğu filtre kağıdı şişebilir, böylece filtre kağıdı zar zor nemlidir. Embriyolar daha sonra ince bir boya fırçası kullanılarak kuluçka için nemli bir alçı tencereye aktarılabilir. Bu aşamada embriyolar çok kırılgandır, bu nedenle sürecin çok dikkatli bir şekilde üstlenilmesi gerekir. Küflü embriyoları çıkarabilmek ve mantar kontaminasyonunun yayılmasını sınırlayabilmek için embriyoların birbirine dokunmasını önlemek de önemlidir.
Enjeksiyon sonrası, G0 enjekte edilen embriyolar normal yetiştirme prosedürlerine göre alçı kaplarda tutulur. Yumurtadan çıkana kadar, enjekte edilen embriyo saksıları sağlıksız embriyoları çıkarmak için günde bir kez kontrol edilmelidir. Şekil 4A, yumurtlama ve enjeksiyon gününden yetişkinliğe kadar G0 bireysel yetiştirmenin beklenen zaman çizelgesini sunar. Şekil 4B, sağlıklı ve tutulması gereken G0 embriyolarının örneklerini göstermektedir; veya hasarlı, mantar tarafından kontamine, kurumuş veya deforme olmuş ve atılmalıdır. G0 enjekte edilen bireyler sözde mutant alelleri için mozaiktir. Potansiyel mutant alellerini tanımlamak için, beklenen kesme bölgelerini çevreleyen bölgenin PCR tahlili gibi bir yöntem tasarlanmalıdır. Şekil 4C, bir mutant alelesini temsil eden, beklenen wt ürününe ek bir PCR ürünü sergileyen bir mozaik G0 kişisini gösteren bir PCR tahlili örneği sunun.
Yetişkinler ortaya çıktıktan sonra, G0 enjekte edilen embriyolardan gelişen G0 dişileri wt erkeklerle geçilir, yumurta bırakmasına izin verilir ve daha sonra genotiplenir. Sadece genotipleme yönteminden kaynaklanan mutasyon kanıtlarını gösteren bir G0 sineği içeren tüpler korunur. Sonraki nesillerden gelen sinekler (G1 dişiler) wt erkeklerle veya kardeşler arasında (G2'den)bireysel olarak geçilir. Bu haçların yumurta bırakmasına izin verilir ve daha sonra seçim yöntemiyle genotiplenir. Homozigöz mutant erkekler ve dişiler elde edilene kadar son adım tekrarlanır ve homozigöz bir mutant hattı oluşturur. Bir mutant hattı oluşturmak için uygun haçların şematik bir gösterimi Şekil 5A'daverilmiştir. Şekil 5B, homozigous mutant kardeş haçının tanımlanmasına izin eden bir genotipleme PCR örneği göstermektedir.

Şekil 1: Mikroenjeksiyon iğneleri. A. İyi iğne. B. Enjeksiyonlar için iyi olmayan aşırı konik iğne. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Embriyo toplama ve mikromanipülasyona genel bakış (Bu rakam4'tenuyarlanmıştır). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Mikroenjeksiyon kurulumu. A. Mikroenjeksiyon kurulumunun şematik gösterimi. B. Mikroenjeksiyon için hizalanmış embriyonun yakın çekimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
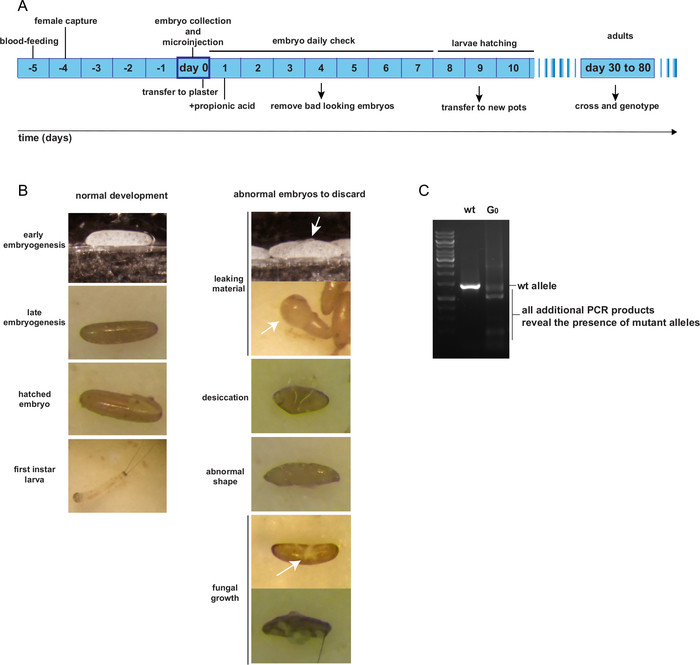
Şekil 4: Mozaik G0 yetişkin bireylerin yetiştiri ve tanımlanması. A. Embriyo mikroenjeksiyonundan G0 yetişkinliğine kadar beklenen zaman çizelgesi. B. Enjeksiyon sonrası iyi ve kötü görünümlü embriyo örnekleri. C. Dönüştürülmüş bir G0 mozaik bireyin PCR genotipleme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: İlgi çekici mutasyonların tanımlanması ve izolasyonu. A. Mutant alellerini izole etmek ve homozigous mutant stokları oluşturmak için deneysel stratejinin şematik gösterimi (şekil 4'ten). Renk, mutant alelleri taşıyan hücrelerin heterozygous (pembe) veya homozigous (kırmızı) durumda varlığını temsil eder. B. Kum sineklerinin çaprazlarını kemotipleyen bir PCR tarama stratejisi örneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada Phlebotomus papatasi kum sineklerinde CRISPR/Cas9 tarafından hedeflenen mutajensis için yakın zamanda geliştirilmiş bir embriyo mikroenjeksiyon yöntemini sunuyoruz. Böcek genetik modifikasyonu için embriyo mikroenjeksiyon 1980'lerin ortalarında Drosophila'da geliştirilmiştir21 ve şimdi rutin olarak çok çeşitli böceklerde kullanılmaktadır. ReMOT 20 , 21 , 22,23 ve elektroporasyon23gibi böceklerdekullanılmak üzere genetik modifikasyon malzemelerinin teslimi için diğer yöntemler geliştirilmiştir. Bununla birlikte, embriyo mikroenjeksiyon şu anda bu malzemelerin teslimi için en çok yönlü ve verimli yöntemdir. ReMOT bir doğum yöntemi olarak son derece umut vericidir ve embriyo mikroenjeksiyonlarına kıyasla yetişkin enjeksiyonlarının göreceli kolaylığı nedeniyle kum sineklerinde kullanılmak üzere araştırılmalıdır. Ancak, şimdiye kadar ReMot CRISPR / Cas9 HDR veya transposon transgenez için başarıyla kullanılmadı. Böceklerde embriyo mikroenjections tekniği temelde başlangıçta geliştirilenle aynı olsa da, tekniklerin her yeni tür iyileştirmesi için gerekli olabilir. Bu tür farklılıkları embriyo gelişiminin desenini ve süresini, embriyo yapısını ve embriyonun normalde geliştiği ortamı içerir. Kum sineği embriyoları özellikle küçüktür (0.3-0.5 mm uzunluğunda ve 0.1- 0.15 mm genişliğinde, Drosophila yumurtası 1 boyutunun yaklaşık 1/3'lerini temsil eder). Bu azaltılmış boyut, yumurtalara zarar vermeden elleçleme zorliğini arttırır. Kum sineği embriyoları özellikle kurumaya karşı hassas olduğundan, protokolün her adımındaki nem seviyesi çok dikkatli bir şekilde izlenmelidir. Bununla birlikte, sucul değildirler ve uzun bir süre tamamen suya batırılırlarsa öleceklerdir. Drosophila embriyo mikroenjeksiyonu embriyonun arka ucunda enjeksiyon gerektirir. Kum sineği embriyolarının neredeyse simetrik şekli nedeniyle embriyo polaritesinin belirlenmesi zordur. Son olarak, kum sineği embriyo gelişimi Drosophila'ya benzer şekilde ilerlerken, bunu çok daha yavaş bir hızda yapar. Sadece embriyogenez, kum sineği türlerine bağlı olarak 6 ila 11 gün arasında sürerken, Drosophila yumurtaları yumurtlamadan sadece bir gün sonra yumurtadan çıkar. Drosophila yumurta hücreselleştirme yumurtlamadan yaklaşık 2 saat sonra gerçekleşirken, kum sineği embriyoları bu aşamaya yaklaşık 9 saat sonra ulaşır. Gelişimsel zamanlamadaki bu farklılık göz önüne alındığında, senksiyal embriyoda gelişmekte olan çekirdeklerin gelişimin bu erken aşamasında gelişmekte olan embriyonun merkezine yakın bir yerde bulunduğu varsayımıyla gelişmekte olan kum sineği embriyosunun merkezine enjeksiyonlar hedeflenir, böylece embriyo polaritesini ayırt etme ihtiyacı ortadan kalkmaktadır.
CRISPR/Cas9, seçilen bir genomik lokusta dsDNA kırılmaları oluşturur. Bu çift iplikçik kopmaları hücrede NHEJ veya HDR tarafından onarılır. Burada sunduğumuz yöntem daha önce sadece NHEJ tabanlı mutajensis için kullanıldı, bu da küçük ekleme / silme olayları, indels üretti, gen dizilerinde bir frameshift'e yol açtı, erken durdurma kodonları ve tüm fonksiyonel etki alanlarından yoksun bir protein ile sonuçlandı4. Böcekler ayrıca dsDNA'nın HDR aracılığıyla onarımını kırmak için hücresel makineye sahiptir, bu da daha karmaşık genom düzenleme stratejileri tasarlamak için yeniden yönlendirilebilir. HDR tabanlı CRISPR/Cas9 genom düzenlemenin hala kum sineklerinde kullanılmak üzere kurulması gerekir ve diğer yapıların yanı sıra ifade ve koşullu ifade mutantlarının muhabirlerinin gelişmesine izin vermelidir.
Bu mikroenjeksiyon protokolünün geliştirilmesi şimdi CRISPR / Cas9 HDR, transposon transgenez, UAS / Gal4 gibi ikili ifade sistemleri ve phiC31 veya Cre /loxile bölgeye özgü rekombinasyon gibi diğer genom modifikasyon yöntemlerini kullanma kapısını açıyor. Bu diğer yöntemlerin geliştirilmesi, daha karmaşık genomik manipülasyona izin vererek kum sineği gen ekspresyon modifikasyonu için araç kutusunu daha da genişletecektir. Bununla birlikte, bu diğer yöntemler kullanılamadan önce, kum sineklerine eklenen genlerin ekspresyonunu yönlendirmek için düzenleyici elemanların belirlenmesi ve izole edilmesinin yanı sıra, transposazların ve rekombinozların ekspresyonunu yönlendirmek için promotörler gibi ekleme işaretlerine ve bu yöntemlerin diğer bileşenlerine ihtiyaç duyulacaktır.
Son olarak, model olmayan böceklerde genom düzenleme, özellikle CRISPR / Cas9 keşfi ve adaptasyonu devrimi sayesinde artık bir olasılık haline geldi15,16. Böceklerde, yeni geliştirilen ReMOT tekniğinin önemli istisnası için çoğu genom düzenleme tekniği, hem çok önemli hem de teknik olarak zorlu bir adım olan embriyo mikroenjeksiyon gerektirir. Bu yayının kum sineklerine uyarlanmış gen ekspresyon modifikasyon teknikleri yelpazesini genişletmeye yardımcı olacağını ve biyolojileri üzerinde yeni keşiflere ve Leishmania parazitlerine vektör yeterliliğine yol açacağını umuyoruz.
Açıklamalar
hiç kimse
Teşekkürler
Yazarlar Vanessa Meldener-Harrell'e makalenin eleştirel okuması için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Black Filter Paper 4.25CM PK100 | VWR | 28342-012 | Cut into rectangles that are approximately 46 X 22mm. These are placed between the slide and the coverslip and act as a moist base layer for the embryos during injection. |
| Coverslips | Fisher Scientific | 12-543A | |
| Dissecting Microscope | Any brand | For aligning embryos | |
| Glass slides | Fisher Scientific | 12-550-A3 | Base layer of the microinjection set up Figure 2A |
| Insect cage | custom made or several commercial options | polycarbonate cage for adults holding and mating Lawyer, Phillip, Mireille Killick-Kendrick, Tobin Rowland, Edgar Rowton, and Petr Volf. “Laboratory Colonization and Mass Rearing of Phlebotomine Sand Flies (Diptera, Psychodidae).” Parasite 24. Accessed August 6, 2020. https://doi-org.remotexs.ntu.edu.sg/10.1051/parasite/2017041. | |
| Larval food | custom made | a mix of rabbit chow and rabbit feces Lawyer, Phillip, Mireille Killick-Kendrick, Tobin Rowland, Edgar Rowton, and Petr Volf. “Laboratory Colonization and Mass Rearing of Phlebotomine Sand Flies (Diptera, Psychodidae).” Parasite 24. https://doi-org.remotexs.ntu.edu.sg/10.1051/parasite/2017041. | |
| Microcaps 100 ml | Drummond | 1-000-1000 | Used to back fill microinjection needles |
| Mouth aspirator | John W. Hock Company | Model 612 | mouth aspirator with HEPA filter |
| Olympus SZX12 | Olympus Life Sciences | Microinjection microscope | |
| Ovipots | Nalge company | ovipots are made from 125-ml or 500-ml straigh-sided plolypropylene jars modified by drilling 2.5cm holes in the bottom and filled with 1cm of plaster of Paris. Lawyer, Phillip, Mireille Killick-Kendrick, Tobin Rowland, Edgar Rowton, and Petr Volf. “Laboratory Colonization and Mass Rearing of Phlebotomine Sand Flies (Diptera, Psychodidae).” Parasite 24. Accessed August 6, 2020. https://doi-org.remotexs.ntu.edu.sg/10.1051/parasite/2017041. | |
| Paint Brush 6-0 | Any Art Supply Company | n/a | Used for aligning embryos |
| Propionic acid | Sigma-Aldrich | 402907 | antifungal agent |
| Standard Glass Capillaries | World Precision Instruments | 1B100-3 | Used for making microinjection needles |
| Trio-MPC100 Controller and MP845 Manipulator | Sutter Instruments | Microinjection Controller and Micromanipulator |
Referanslar
- Lawyer, P., Killick-Kendrick, M., Rowland, T., Rowton, E., Volf, P. Laboratory colonization and mass rearing of phlebotomine sand flies (Diptera, Psychodidae). Parasite. 24, 42 (2017).
- Pelletier, I., et al. Specific recognition of Leishmania major poly-beta-galactosyl epitopes by galectin-9: possible implication of galectin-9 in interaction between L. major and host cells. Journal Biological Chemistry. 278 (25), 22223-22230 (2003).
- Kamhawi, S., et al. A role for insect galectins in parasite survival. Cell. 119 (3), 329-341 (2004).
- Louradour, I., Ghosh, K., Inbar, E., Sacks, D. L. CRISPR/Cas9 Mutagenesis in Phlebotomus papatasi: the Immune Deficiency Pathway Impacts Vector Competence for Leishmania major. MBio. 10 (4), (2019).
- Xi, Z., Ramirez, J. L., Dimopoulos, G. The Aedes aegypti toll pathway controls dengue virus infection. PLoS Pathogens. 4 (7), 1000098 (2008).
- Ramirez, J. L., Dimopoulos, G. The Toll immune signaling pathway control conserved anti-dengue defenses across diverse Ae. aegypti strains and against multiple dengue virus serotypes. Development and Comparative Immunology. 34 (6), 625-629 (2010).
- Ramirez, J. L., et al. Reciprocal tripartite interactions between the Aedes aegypti midgut microbiota, innate immune system and dengue virus influences vector competence. PLoS Neglected Tropical Diseases. 6 (3), 1561 (2012).
- Hu, C., Aksoy, S. Innate immune responses regulate trypanosome parasite infection of the tsetse fly Glossina morsitans morsitans. Molecular Microbiology. 60 (5), 1194-1204 (2006).
- Meister, S., et al. Anopheles gambiae PGRPLC-mediated defense against bacteria modulates infections with malaria parasites. PLoS Pathogens. 5 (8), 1000542 (2009).
- Meister, S., et al. Immune signaling pathways regulating bacterial and malaria parasite infection of the mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences U S A. 102 (32), 11420-11425 (2005).
- Telleria, E. L., et al. Caspar-like gene depletion reduces Leishmania infection in sand fly host Lutzomyia longipalpis. Journal of Biological Chemistry. 287 (16), 12985-12993 (2012).
- Sant'Anna, M. R., Alexander, B., Bates, P. A., Dillon, R. J. Gene silencing in phlebotomine sand flies: Xanthine dehydrogenase knock down by dsRNA microinjections. Insect Biochemistry and Molecular Biology. 38 (6), 652-660 (2008).
- Sant'anna, M. R., Diaz-Albiter, H., Mubaraki, M., Dillon, R. J., Bates, P. A. Inhibition of trypsin expression in Lutzomyia longipalpis using RNAi enhances the survival of Leishmania. Parasites and Vectors. 2 (1), 62 (2009).
- Diaz-Albiter, H., Mitford, R., Genta, F. A., Sant'Anna, M. R., Dillon, R. J. Reactive oxygen species scavenging by catalase is important for female Lutzomyia longipalpis fecundity and mortality. PLoS One. 6 (3), 17486 (2011).
- Barrangou, R., et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 315 (5819), 1709-1712 (2007).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Pawelczak, K. S., Gavande, N. S., VanderVere-Carozza, P. S., Turchi, J. J. Modulating DNA Repair Pathways to Improve Precision Genome Engineering. ACS Chemical Biology. 13 (2), 389-396 (2018).
- Martin-Martin, I., Aryan, A., Meneses, C., Adelman, Z. N., Calvo, E. Optimization of sand fly embryo microinjection for gene editing by CRISPR/Cas9. PLoS Neglected Tropical Diseases. 12 (9), 0006769 (2018).
- Meuti, M., Harrell, R. Preparing and Injecting Embryos of Culex Mosquitoes to Generate Null Mutations Using CRISPR/Cas9. JoVE. (163), e61651 (2020).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR-Cas9-Based Genome Editing in the Silverleaf Whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Macias, V. M., et al. Cas9-Mediated Gene-Editing in the Malaria Mosquito Anopheles stephensi by ReMOT Control. Genes, Genomes and Genetics (Bethesda). 10 (4), 1353-1360 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır