Method Article
Sand Fly (Phlebotomus papatasi) Microinjection embryonnaire pour CRISPR/Cas9 Mutagenesis
Dans cet article
Résumé
Ce protocole détaille les étapes de la mutagenèse ciblée CRISPR/Cas9 chez les mouches du sable : collecte d’embryons, injection, élevage et identification d’insectes ainsi que sélection de mutations d’intérêt.
Résumé
Les mouches du sable sont les vecteurs naturels des espèces de Leishmania, les parasites protozoaires produisant un large éventail de symptômes allant des lésions cutanées à la pathologie viscérale. Le décryptage de la nature des interactions vecteurs/parasites est d’une importance primordiale pour une meilleure compréhension de la transmission de la leishmaniose à leurs hôtes. Parmi les paramètres contrôlant la compétence des vecteurs de mouches du sable (c’est-à-dire leur capacité à transporter et à transmettre des agents pathogènes), il a été démontré que les paramètres intrinsèques à ces insectes jouent un rôle clé. La réponse immunitaire des insectes, par exemple, influe sur la compétence des vecteurs de mouches de sable à Leishmania. L’étude de ces paramètres a été limitée par l’absence de méthodes de modification de l’expression génétique adaptées à l’utilisation dans ces organismes non modèles. La downregulation des gènes par petit ARN interférant (SIRNA) est possible, mais en plus d’être techniquement difficile, le silence ne conduit qu’à une perte partielle de fonction, qui ne peut pas être transmise de génération en génération. La mutagenèse ciblée par la technologie CRISPR/Cas9 a récemment été adaptée à la mouche du sable phlebotomus papatasi. Cette technique conduit à la génération de mutations transmissibles dans un locus spécifiquement choisi, permettant d’étudier les gènes d’intérêt. Le système CRISPR/Cas9 repose sur l’induction de ruptures ciblées d’ADN à double brin, réparées plus tard soit par jointage final non homologue (NHEJ) soit par Homology Driven Repair (HDR). NHEJ se compose d’une simple fermeture de la rupture et conduit fréquemment à de petits événements d’insertion / suppression. En revanche, HDR utilise la présence d’une molécule d’ADN donneur partageant l’homologie avec l’ADN cible comme modèle de réparation. Ici, nous présentons une méthode de microinjection embryon de mouche du sable pour la mutagenèse ciblée par CRISPR/Cas9 à l’aide de NHEJ, qui est la seule technique de modification du génome adaptée aux vecteurs de mouches de sable à ce jour.
Introduction
Les maladies à transmission vectorielle sont une menace majeure pour la santé publique en constante évolution. Des centaines d’espèces vectorielles réparties dans des familles phylogéniques très distinctes (moustiques, tiques, puces) sont responsables de la transmission d’un grand nombre d’agents pathogènes microbiens, entraînant plus de 700 000 décès humains par an, selon l’Organisation mondiale de la santé. Parmi les insectes vecteurs, les mouches phlébotomines de sable (Diptera, Psychodidae) constituent un vaste groupe, avec 80 espèces vectorielles éprouvées présentant des traits phénotypiques distincts et des capacités vectorielles que l’on trouve dans différentes régions géographiques. Ils sont des vecteurs pour les parasites protozoaires du genre Leishmania,causant environ 1,3 million de nouveaux cas de Leishmaniose et entre 20.000 et 30.000 décès par an. Les résultats cliniques de Leishmaniases sont divers, avec des symptômes s’étendant des lésions cutanées auto-limitantes à la diffusion viscérale qui est mortelle en l’absence de traitement.
Les mouches du sable sont des insectes strictement terrestres. Leur cycle de vie, relativement long par rapport à d’autres Diptéra, dure jusqu’à trois mois, selon différents paramètres tels que la température, l’humidité et la nutrition. Il se compose d’un stade embryonnaire (6 à 11 jours), de quatre stades larvaux (d’une durée totale de 23 à 25 jours) et d’un stade pupal (9 à 10 jours) suivi de métamorphose, puis d’âge adulte. Les mouches de sable ont besoin d’un environnement humide et chaud pour l’élevage. Les mâles et les femelles se nourrissent de sucres, obtenus à l’état sauvage à partir de nectars floraux. Seules les femelles sont des mangeurs de sang, car elles ont besoin de protéines obtenues à partir de la farine de sang pour la productiond’œufs 1.
L’un des objectifs importants de la recherche est d’identifier la nature des interactions vecteurs/parasites qui mènent au développement d’infections transmissibles. Comme pour les autres insectes vecteurs, il a été démontré que les paramètres intrinsèques aux mouches du sable ont un impact sur leur compétence vectorielle, qui est définie comme leur capacité à transporter et à transmettre des agents pathogènes à leurs hôtes. Par exemple, l’expression des galectines par les cellules de midgut de mouche de sable de Phlebotomus papatasi, agissant comme récepteurs reconnaissant des composants parasites de surface, peut influencer directement leur compétence vectorielle pour Leishmania major2,3. La voie de réponse immunitaire d’insecte, insuffisance immunisée (IMD), est également cruciale pour la compétence de vecteur de mouche de sable de Phlebotomus papatasi pour le major de Leishmania4. Un rôle critique pour les voies de réponse immunitaire des insectes vecteurs dans le contrôle de leur transmission d’agents pathogènes infectieux a également été signalé chez les moustiques Aedes aegypti 5,6,7, dans la mouche tsé-tsé Glossina morsitans8, et chez les moustiques Anopheles gambiae 9,10.
Les études sur les interactions mouches dusable/leishmaniose ont été limitées par l’absence de méthodes de modification de l’expression génétique adaptées pour être utilisées chez ces insectes. Seule la downregulation des gènes par petit ARN interférant (siRNA) avait étéeffectuée 11,12,13,14 jusqu’à récemment. La technique, limitée par la mortalité associée à la microinjection des femelles adultes, ne conduit qu’à une perte partielle de fonction, qui ne peut se transmettre de génération en génération.
La technologie CRISPR/Cas9 a révolutionné la recherche génomique fonctionnelle dans des organismes non modèles tels que les mouches du sable. Modifié à partir du système immunitaire adaptatif chez les procaryotes pour la défense contre les bactériophages15,16, le système CRISPR Cas9 a été rapidement adapté comme un outil d’édition du génome pour les organismes eucaryotes supérieurs, y compris les insectes. Le principe de l’édition ciblée du génome CRISPR/Cas9 est basé sur la complémentarité d’un ARN guide unique (SGRNA) à un locus génomique spécifique. La nucléase Cas9 se lie à l’ARN sg et crée une rupture d’ADN à double brin (DSDNA) dans l’ADN génomique où le sgRNA s’associe à sa séquence complémentaire. Le complexe Cas9-sgRNA est guidé vers la séquence cible par 17 à 20 bases complémentaires dans le sgRNA au locus choisi, la rupture dsDNA peut alors être réparée par deux voies indépendantes : l’assemblage final non homologique (NHEJ) ou la réparation dirigée par homologie (HDR)17. La réparation de NHEJ implique une simple fermeture de la rupture mais mène fréquemment à de petits événements d’insertion/suppression. La réparation de l’ADN par HDR utilise une molécule d’ADN donneur partageant l’homologie avec l’ADN cible comme modèle de réparation. Les insectes possèdent les deux machines.
La technologie CRISPR/Cas9 peut générer des mutations dans un lieu choisi, par la voie de réparation du NHEJ; ou pour des stratégies d’édition du génome plus complexes, telles que les knock-ins ou les reporters d’expression, par le biais de la voie HDR avec un modèle de donneur approprié. Chez les mouches de sable, des allèles mutants nuls du facteur de réponse immunitaire Relish ont été générés par CRISPR nhej-médié dans Phlebotomus papatasi4. Des embryons de mouche de sable ont également été injectés dans une autre étude avec un mélange CRISPR/Cas9 ciblant le gène codant jaune. Pourtant, aucun adulte portant la mutation n’a étéproduit 18. Nous décrivons ici une méthode détaillée de mutagenèse ciblée par CRISPR/Cas9, 24 h/24, avec un accent particulier sur la microinjection embryonnaire, une étape critique du protocole.
Protocole
L’utilisation de souris comme source de sang pour l’alimentation des mouches du sable a été effectuée conformément aux recommandations du Guide pour le soin et l’utilisation des animaux de laboratoire des Instituts nationaux de la santé (NIH). Le protocole a été approuvé par le Comité des soins et de l’utilisation des animaux du NIAID, NIH (numéro de protocole LPD 68E). Les invertébrés ne sont pas couverts par les lignes directrices des NIH.
1. Préparationd’aiguilles ( Figure 1)
- Tirez les aiguilles et biseauté comme décrit dans Meuti et Harrell19. En bref, tirez des aiguilles sur un pull de micropipette en verre à deux étapes, à l’aide de capillaires en verre borosilicate.
- Aiguisez les aiguilles en beveling humide sur le biseau de micropipette, à l’aide d’une pierre extra fine.
2. Collecte et micromanipulation d’embryons( Figure 2)
- Cinq jours avant le jour de l’injection, le sang nourrit les femelles mouches du sable comme cela est effectué régulièrement pour l’entretien des colonies. Pour plus de détails sur les procédures d’élevage des colonies de mouches de sable et les matériaux requis, veuillez consulter Lawyer et coll.1 Maintenir les insectes dans des incubateurs à 70 % d’humidité et à 26 °C pendant tout leur développement.
- Un jour après l’alimentation sanguine, capturer les femelles nourries au sang par groupes de 100-150 dans des pots de plâtre avec un port latéral. Maintenez les femelles en les nourrissant avec la solution de sucre (30% saccharose - assez de volume pour tremper une petite boule de coton) qui est habituelle pour l’entretien de colonie.
- Au jour 2-3 après l’alimentation du sang, ne pas humidifier les pots de plâtre. Garder les femelles sur un substrat sec empêchera la ponte prématurée, puisque les femelles préfèrent pondre des œufs dans un environnement humide.
- Le jour 5 après l’alimentation du sang, effectuer la collecte d’embryons, la micromanipulation et la microinjection. Introduire un papier filtre humide dans la chambre de ponte. Les embryons fraîchement posés n’ont pas de chorion entièrement développé et semblent blancs. Utilisez du papier filtre noir pendant la procédure pour faciliter la visualisation des embryons blancs.
- Transférer un petit groupe de femelles du pot de plâtre à la chambre de ponte par les ports latéraux à l’aide d’un aspirateur buccaux. La présence d’un substrat humide (le papier filtre) incite les femelles à s’ovipositer.
- Après 30-60 min, récupérer soigneusement le papier filtre avec des embryons nouvellement déposés de la chambre. Conservez le papier filtre et les embryons dans une boîte de Pétri jusqu’à 3 heures. Pendant ce temps, évaluez régulièrement le niveau d’humidité du papier filtre pour s’assurer qu’il reste humide. Pendant ce temps, répétez les étapes 2.4 à 2.6 avec de nouveaux groupes de femelles et recueillez autant d’embryons que possible.
- Préparez des diapositives au microscope pour l’injection : recueillez manuellement les œufs un par un avec un pinceau très fin et transférez-les soigneusement sur un autre morceau de papier filtre noir humide placé sur une glissière de microscope surmontée d’un couvercle en verre.
- Ajouter de l’eau au papier filtre, assez pour garder les embryons humides, mais ne pas les faire flotter loin de la couverture ou d’être aspiré sous le coverslip. Alignez les embryons contre le coverslip. Le coverslip agit comme un backstop empêchant les oeufs de rouler loin pendant l’injection.
3. Injections d’embryons( Figure 3)
- Commencez les injections 2,5 à 3 heures après le début de la collecte des œufs. Effectuez des injections à température ambiante et à l’humidité ambiante du laboratoire.
- Assurez-vous que les embryons alignés ont suffisamment d’eau pour qu’ils soient maintenus humides.
REMARQUE : Il est essentiel que les embryons soient maintenus humides pendant les injections. Si elles ne sont pas humides pendant le processus d’injection, les injections deviennent difficiles parce que l’aiguille a du mal à percer l’embryon. La bonne quantité d’eau est le point où les embryons ont un ménisque d’eau autour d’eux, mais le coverslip ne flotte pas sur le dessus de l’eau provoquant les embryons à pousser sous le coverslip. Il est essentiel de surveiller la quantité d’eau autour des embryons pendant les injections. Ajouter de l’eau au besoin pour garder les embryons humides. - Ajouter l’eau soigneusement en mouillant une brosse avec de l’eau et en transférant l’eau à l’extrémité arrière du papier filtre. L’ajout d’eau de cette façon permet d’ajouter de l’eau de façon lente et contrôlée afin d’ajouter juste assez pour garder les embryons humides. Trop d’eau peut faire flotter les embryons hors de l’alignement, ce qui rend difficile l’injection des embryons.
- Mélange d’injection de charge arrière dans l’aiguille de microinjection. Ajouter environ 0,5 à 1 μL de mélange d’injection dans l’aiguille à l’aide d’un remplisseur d’aiguille de borosilicate dessiné à la main, des pointes de pipet de chargement de gel peuvent également être utilisées. Le mélange d’injection est composé d’un ou plusieurs ARN guides (80 ng/μL chacun) conçus pour cibler un locus spécifique mélangé à une protéine commerciale recombinante Cas9 (300 ng/μL).
- En commençant par la pression d’injection à 30 psi, appuyez sur le déclencheur d’injection pour expulser l’air de la pointe de l’aiguille. Cela forcera le mélange d’injection jusqu’à la pointe de l’aiguille, ce qui permettra au mélange d’injection de s’écouler. À ce stade, augmentez lentement la pression de prise/constante jusqu’à ce que le matériel d’injection commence à couler, puis reculez hors de la prise/pression constante de sorte qu’il soit juste au-dessous du point du mélange d’injection coulant de l’aiguille. Le réglage fermé doit fournir juste assez de matériel d’injection de sorte qu’une petite quantité de matériel peut être vu pour entrer dans l’embryon.
REMARQUE : L’injection d’embryons de mouches de sable sous huile d’halocarbone semblable à d’autres protocoles utilisés pour la drosophile et les moustiques a d’abord été testée, mais le pourcentage de survie pour ces injections était très faible. La survie a été améliorée en passant aux injections sur du papier filtre humide tel que décrit ci-dessus. - Insérer l’aiguille dans le côté de l’embryon. Utilisez le coverslip derrière l’embryon comme un backstop qui aidera l’aiguille à percer l’embryon. Livrer une petite quantité de mélange d’injection dans l’embryon avant d’enlever doucement l’aiguille.
- Immédiatement après l’enlèvement de l’aiguille, appuyez sur l’injecteur pour enlever tout matériau remblayé de la pointe de l’aiguille. Cela aidera à empêcher l’aiguille de s’obstruer.
- Procéder à l’embryon suivant. Entre chaque injection, assurez-vous que le papier filtre est humide et que l’aiguille n’est pas obstruée.
- Une fois que tous les embryons ont été injectés, comptez le nombre d’embryons injectés pour maintenir un décompte en cours d’exécution.
- Retirez le coverslip en ajoutant de l’eau au papier filtre afin que le coverslip flotte. À ce stade, utilisez une sonde (bâton applicateur en bois avec broche d’insecte collée à la pointe) pour maintenir le papier filtre en place tandis qu’un doigt est utilisé pour tirer le coverslip loin des embryons injectés.
- Épongez l’excès d’eau du papier filtre une fois que le coverslip a été enlevé.
4. Élevage post-injection (G0) (Figure 4)
- Transférer le papier filtre avec les embryons sur plusieurs couches de papier filtre humide placé dans une boîte de Pétri pour maintenir l’humidité. Gardez les embryons ici pendant le temps nécessaire pour injecter d’autres embryons. Les embryons peuvent être maintenus pendant un maximum de 3 heures comme celui-ci. Après l’injection, ils brunissent lentement.
- Une fois que tous les embryons ont été injectés, transférez-les manuellement sur des pots en plâtre de petite taille préalablement humidifiés. Ne mettez pas trop d’embryons dans chaque pot et maintenez la distance entre eux, pour éviter une contamination fongique possible entre les individus. Couvrez les pots d’un écran et rangez-les comme c’est généralement le cas pour les œufs de colonie de mouches de sable, maintenus dans des incubateurs à 70% d’humidité et 26 °C, pendant tout leur développement.
- Le jour 1 après l’injection, enlever tous les embryons endommagés et morts à l’l’œdure d’un pinceau. Ajouter 100 μL d’acide propionique à 0,5 %, goutte à goutte, sur les pots en plâtre contenant les embryons injectés afin de limiter la contamination fongique. La libération de cytoplasme provenant d’embryons endommagés pendant le processus d’injection est particulièrement favorable à la croissance fongique.
- Vérifiez les pots de plâtre tous les jours et retirez les embryons mauvais ou morts. Si le champignon est présent, enlever tous les embryons infectés et ajouter quelques gouttes d’acide propionique de 0,5%.
- Les larves éclosent entre le jour 8 et 12 après l’injection. Deux fois par jour, transférer les larves nouvellement émergées sur de nouveaux pots de plâtre, en groupes de 5-10 maximum. Ajouter une petite quantité de nourriture et vérifier la nourriture 2-3 fois par semaine.
- Surveillez attentivement la quantité d’aliments larvaire, car trop augmente considérablement le risque de contamination fongique. Les larves de mouches du sable survivent mieux en groupes, mais elles peuvent être cannibales s’il n’y a pas assez de nourriture.
- Lorsque les larves se pupifient, séparez-les par sexe pour maintenir les femelles comme vierges. S’il y a beaucoup de survivants, jetez les mâles et ne gardez que les femelles.
REMARQUE : Les mâles et les femelles peuvent porter et transmettre des mutations. Cependant, comme les femelles doivent être gardées vierges avant qu’elles ne soient croisées, il est plus facile d’utiliser uniquement les femelles injectées par le G0 pour éviter d’avoir à séparer les insectes wt par sexe. Les mâles du G0 peuvent être gardés en renfort si le nombre de survivants adultes est faible et seront dans ce cas arrilés avec des femelles vierges triées.
5. Sélection et sélection d’allèles mutants (Figure 5)
- Traverser en masse les femelles du G0 avec des mâles wt dans une cage. Nourrissez-les complètement, comme ce serait le cas pour l’entretien normal des colonies.
- Un jour après l’alimentation du sang, transférer chaque femelle G0 avec 2-3 mâles wt dans des tubes de plâtre individuels à l’aide d’un aspirateur buccaux. Nourrir les mouches avec du sucre sur une petite boule de coton changée tous les jours et utiliser une seringue d’eau pour s’assurer que l’humidité du plâtre est appropriée pour la ponte.
- Après que les femelles du G0 ont pondu des œufs (correspondant à G1),recueillir leur corps dans des tubes individuels annotés Eppendorf pour le génotypage ultérieur. Maintenir les embryons comme c’est habituellement le cas pour les colonies de wt.
- Extraire l’ADN des femellesG 0 par la méthode de choix.
- Filtrer l’ADN pour la présence de mutations, par exemple en concevant un test PCR à l’aide d’amorces entourant la région des coupes CRISPR attendues.
- Ne gardez que lesembryons G 1 pondus par les femelles G0 montrant des signes de transformation. Lorsque ces embryonsG 1 se développent en nymphes, séparez-les par sexe et ne gardez que les femelles. Traverser les femelles G1 de la même femelle G0 aux mâles wt, les nourrir dans le sang, puis transférer en petits groupes de 2-3 femelles et 4-5 mâles dans des récipients de petite taille.
REMARQUE : Toutes les personnes du G1 ont une chance de porter une mutation unique, donc si le nombre d’individus survivants n’est pas trop élevé, alors il est préférable de croiser les femelles G1 individuellement avec des mâles wt. Le cas de plusieurs femelles portant une mutation différente présente dans un même tube est rare mais peut se produire. Si un tel cas est observé après génotypage, les femelles de descendance G2 devraient alors être acoupées individuellement aux mâles wt. Ce schéma d’accouplement évite la possibilité de mutations multiples dans la descendance. - Après la ponte, recueillir les corps féminins G1 et les dépister pour les mutations. Gardez seulement les tubes où au moins une femelle a montré l’évidence de la mutation.
- Pour les générations suivantes faire une seule paire en croix. Après la ponte, dépister la présence de mutation chez les parents. Répétez à chaque génération jusqu’à ce que les deux parents soient homozygotes pour la même mutation. Une fois identifiés, ils seront les fondateurs d’un stock mutant homozygote.
Résultats
Le protocole de microinjection CRISPR/Cas9 décrit ici pour générer des mutants de mouche de sable a été établi dans une publicationprécédente 4. Cette approche a produit la mutagenesis très efficace, car 11 individus sur 540 ont survécu à la procédure, dont 9 étaient mutants. Lors de la conception de guides pour la mutation CRISPR/Cas9, une première étape cruciale consiste à séquencer la région autour de la zone à cibler. Le modèle de séquençage doit être de la souche qui va être utilisé comme source d’embryons pour l’injection. Il est risqué de se fier uniquement aux séquences génomiques publiées pour concevoir des guides. Il n’est pas rare d’avoir des différences entre le génome publié et les séquences de conception pré-guide. Dans certains cas, les guides conçus à partir de la séquence du génome publié ne sont pas présents lorsque la région autour du gène cible est séquencée (Harrell, observation personnelle). En outre, la séquence peut inclure des polymorphismes nucléotides simples (SNP) qui pourraient être confondus avec de véritables modifications CRISPR pendant le génotypage. Par conséquent, la confirmation de la séquence pour la région cible est essentielle pour que le reste du protocole réussisse.
La modification génétique réussie des insectes par microinjection dépend principalement de deux aspects critiques : la livraison de matériaux (protéines, plasmides ou ARNm) au moment approprié du développement avec le moins de dommages possible aux embryons; et l’élevage d’insectes robustes et sains qui survivront à la procédure et produiront des descendants. La phase initiale de cette procédure, décrite à la figure 2,commence par l’alimentation sanguine des femelles de la colonie wt et procède à la collecte d’embryons et à la microinjection cinq jours plus tard. La deuxième phase consiste à élever les embryons injectés jusqu’à l’âge adulte, à faire les croisements appropriés et à identifier et isoler les mutations d’intérêt.
Les embryons à injection sont prélevés pendant 30 à 60 minutes afin que l’âge relatif en heures après l’oviposition puisse être déterminé. Les embryons sont ensuite autorisés à se développer pendant 3 h avant le début des injections. Cette fenêtre de temps de développement d’insecte permet aux embryons de survivre aux injections. Après cette période de vieillissement, les embryons sont prélevés sur une lame d’injection préparée et les embryons sont roulés en place contre un bord de couverture à l’aide d’une brosse fine. La configuration finale est indiquée dans la figure 3A. Il est important de mouiller suffisamment le papier filtre pour qu’un ménisque se forme au bord du coverslip où les embryons sont assis. Trop d’eau et les embryons seront repoussés loin du bord du coverslip. Trop peu de choses feront que les embryons seront dessinés sous le coverslip. Les embryons doivent être maintenus humides, sinon les membranes embryonnaires deviennent difficiles à injecter. Le bord du coverslip agit comme un arrêt arrière, permettant à l’aiguille de pénétrer dans les embryons lorsqu’elle est pressée contre le bord. C’est la combinaison d’une aiguille tranchante et d’un backstop qui permet à l’aiguille de pénétrer en douceur.
Comme pour la plupart des protocoles de microinjection réussis, une bonne aiguille de microinjection adaptée aux embryons injectés est importante. Les aiguilles bonnes et pointues sont définies comme des aiguilles qui pénètrent facilement dans l’embryon sans permettre au matériau de s’échapper après l’injection. Une bonne pénétration est évidente lorsque l’aiguille se glisse dans l’embryon, causant peu ou pas d’indentation de la membrane embryonnaire pendant la pénétration et aucune fuite matérielle de l’embryon après le retrait de l’aiguille. De bonnes aiguilles pointues sont produites à l’aide de réglages de tire-aiguilles qui produisent une aiguille qui arrive à un point fin (Figure 1A). L’aiguille tirée ne doit pas avoir un cône trop long. Sinon, le lumen de l’aiguille devient très étroit pour une grande partie du cône (Figure 1B), et il devient difficile d’obtenir la pression d’injection assez élevée pour forcer le matériau à travers l’aiguille. Dans ce protocole, des aiguilles biseautés ont été utilisées. Le processus de traction et de biseau des aiguilles est décrit dans Meuti et Harrell19. Dans le cas des embryons de mouche du sable qui se développent sur une longue période de temps, il est particulièrement essentiel d’avoir des aiguilles pointues qui minimisent les dommages à l’embryon, empêchant ainsi le matériel de fuir au site d’injection. Lorsque l’embryoplasme fuit d’un embryon après injection, ce matériau est un milieu riche pour la moisissure et la croissance fongique. Chez les embryons qui se développent sur une plus courte période de temps, l’embryon peut se développer et éclore avant que le moule ne devienne un problème. Tous les embryons qui fuient visiblement l’embryoplasme après l’injection doivent être enlevés.
Pendant les injections, il est important d’ajouter de l’eau au besoin en mouillant un pinceau fin et en le touchant au papier filtre, en répétant au besoin jusqu’à ce que le ménisque de l’eau soit juste à la base des embryons. Il faut noter l’attention portée à l’humidité relative le jour de l’injection. Les jours de faible humidité, il faudra ajouter plus d’eau. Une fois les injections terminées, un peu d’eau supplémentaire est ajoutée au papier filtre de sorte que le coverslip flotte légèrement, ce qui le rend plus facile à enlever. Une fois que le coverslip a été enlevé, le papier filtre avec des embryons injectés peut être effacé, de sorte que le papier filtre est à peine humide. Les embryons peuvent ensuite être transférés dans un pot de plâtre humide pour l’éclosion à l’aide d’un pinceau fin. À ce stade, les embryons sont très fragiles, de sorte que le processus doit être entrepris très soigneusement. Il est également important d’empêcher les embryons de se toucher pour pouvoir enlever les embryons moisi et limiter la propagation de la contamination fongique.
Après l’injection, les embryonsinjectés par le G 0 sont conservés sur des pots en plâtre selon les procédures normales d’élevage. Jusqu’à ce qu’ils éclosent, les pots d’embryons injectés doivent être vérifiés une fois par jour pour enlever les embryons malsains. La figure 4A présente le calendrier prévu de l’élevage individuel G0 du jour de la ponte et de l’injection jusqu’à l’âge adulte. La figure 4B montre des exemplesd’embryons G 0 qui sont en bonne santé et qui devraient être conservés; ou endommagés, contaminés par des champignons, desséchés ou déformés et doivent être jetés. Les individusinjectés par le G 0 sont censés être des mosaïques pour les allèles mutants. Une méthode d’identification des allèles mutants potentiels devrait être conçue, comme un essai PCR de la région entourant le site de coupe prévu. La figure 4C présente un exemple d’analyse PCR montrant une mosaïque G0 individuelle, présentant un produit PCR supplémentaire au produit wt attendu, représentant un allèle mutant.
Une fois que les adultes émergent, les femelles G0 se développant à partird’embryons injectés G 0 sont croisées avec des mâles wt, autorisés à pondre des œufs, et sont génotypés plus tard. Seuls les tubes contenant une mouche G0 montrant des signes de mutation de la méthode de génotypage de choix sont conservés. Les mouches des générations suivantes (femelles G1) sont croisées soit avec des mâles wt ou individuellement entre frères et sœurs (à partir de G2). Ces croix sont autorisées à pondre des œufs, puis génotypées par la méthode de choix. La dernière étape est répétée jusqu’à ce que les mâles mutants homozygotes et les femelles soient obtenus, établissant une lignée mutante homozygote. Une représentation schématique de la succession appropriée de croix pour établir une lignée mutante est donnée à la figure 5A. La figure 5B montre un exemple de PCR génotypage permettant l’identification d’une croix mutante homozygote de frère.

Figure 1 : Aiguilles de microinjection. R. Bonne aiguille. B. Aiguille avec cône extrême pas bon pour les injections. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : Aperçu de la collecte et de la micromanipulation des embryons (ce chiffre avait été adaptéà partir de 4). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3 : Configuration de la microinjection. A. Représentation schématique de la mise en place de la microinjection. B. Plan rapproché de l’embryon aligné pour la microinjection. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
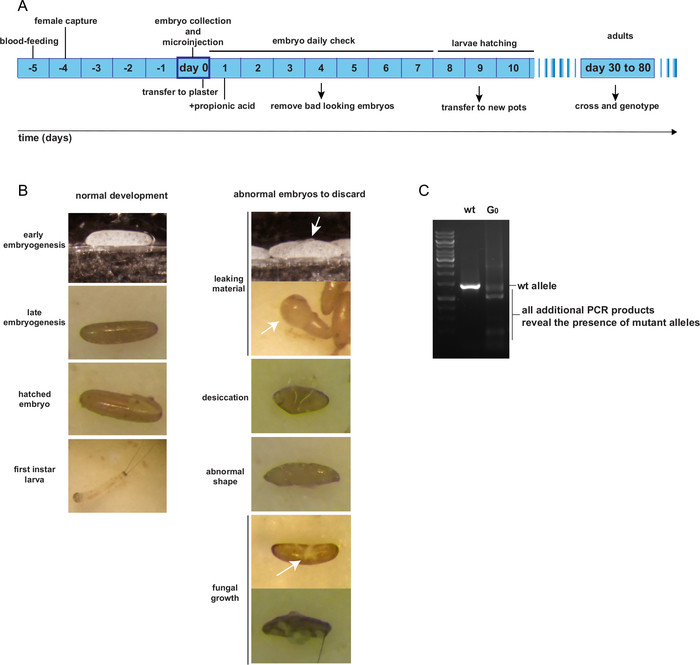
Figure 4 : Élevage et identification de mosaïques G0 individus adultes. R. Calendrier prévu de la microinjection embryonnaire àl’âge adulte G 0. B. Exemples d’embryons beaux et mauvais après injection. C. GR génotypage d’un individu transformé demosaïque de G 0. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5 : Identification et isolement des mutations d’intérêt. A. Représentation schématique de la stratégie expérimentale visant à isoler les allèles mutants et à établir des stocks mutants homozygotes (figure à partir de 4). La couleur représente la présence de cellules transportant des allèles mutants, à l’état hétérozygote (rose) ou homozygote (rouge). B. Exemple d’une stratégie de criblage pcr pour le génotypage des croix individuelles de sibbling des mouches de sable. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Nous présentons ici une méthode de microinjection embryonnaire récemment développée pour la mutagenèse ciblée par CRISPR/Cas9 chez les mouches de sable phlebotomus papatasi. La microinjection embryonnaire pour la modification génétique des insectes a été développée à Drosophila au milieu des années 198021 et est maintenant couramment utilisée chez une grande variété d’insectes. D’autres méthodes de livraison de matériel de modification génétique ont été développées pour être utilisées chez les insectes, telles que reMOT20,21,22,23 et électroporation23. Cependant, la microinjection embryonnaire est actuellement la méthode la plus polyvalente et la plus efficace pour la livraison de ces matériaux. ReMOT est extrêmement prometteur comme méthode d’accouchement et devrait être exploré pour une utilisation dans les mouches du sable, en raison de la facilité relative des injections adultes par rapport aux microinjections embryonnaires. Toutefois, jusqu’à présent, ReMot n’a pas été utilisé avec succès pour CRISPR/Cas9 HDR ou transposon transgenesis. Bien que la technique des microinjections embryonnaires chez les insectes soit fondamentalement la même qu’initialement développée, pour chaque nouvelle espèce, des améliorations des techniques peuvent être nécessaires. Ces différences d’espèces comprennent le modèle et la durée du développement embryonnaire, la structure de l’embryon et l’environnement dans lequel l’embryon se développe normalement. Les embryons de mouche de sable sont particulièrement petits (0.3-0.5 mm de long et 0.1- 0.15 mm de large, représentant approximativement 1/3 de la taille de l’oeuf de Drosophila 1). Cette taille réduite augmente la difficulté de manipuler les œufs sans les endommager. Le niveau d’humidité à chaque étape du protocole doit être surveillé très attentivement, car les embryons de mouches de sable sont particulièrement sensibles à la dessiccation. Cependant, ils ne sont pas aquatiques et mourront s’ils sont complètement immergés dans l’eau pendant une période prolongée. La microinjection embryonnaire de Drosophila nécessite une injection à l’extrémité postérieure de l’embryon. En raison de la forme quasi symétrique des embryons de mouche de sable, il est difficile de déterminer la polarité embryonnaire. Enfin, alors que le développement d’embryons de mouche de sable se produit semblable à Drosophila, il le fait à un rythme beaucoup plus lent. L’embryogenèse dure à elle seule entre 6 et 11 jours, selon les espèces de mouches du sable, tandis que les œufs de Drosophila n’éclosent qu’un jour après la ponte. La cellularisation des ovules de drosophile se produit environ 2 heures après l’oviposition, tandis que les embryons de mouche du sable atteignent ce stade à peu près 9 heures après l’oviposition. Compte tenu de cette différence dans le calendrier de développement, les injections sont ciblées au centre de l’embryon de mouche de sable en développement sur l’hypothèse que les noyaux en développement dans l’embryon syncytial sont situés près du centre de l’embryon en développement à ce stade précoce du développement, ce qui évite la nécessité de distinguer la polarité embryonnaire.
CRISPR/Cas9 crée des pauses dsDNA à un locus génomique choisi. Ces ruptures à double brin sont réparées dans la cellule par NHEJ ou par HDR. La méthode que nous présentons ici a été précédemment utilisée uniquement pour la mutagenèse basée sur le NHEJ, qui a généré de petits événements d’insertion/suppression, des indels, menant à un changement de cadre dans les séquences génétiques, ayant pour résultat les codons prématurés d’arrêt et une protéine manquant de tous les domaines fonctionnels4. Les insectes possèdent également les machines cellulaires pour la réparation de rupture dsDNA par HDR, qui pourrait alors être réacheminé pour concevoir des stratégies plus complexes d’édition du génome. L’édition du génome CRISPR/Cas9 basée sur le HDR doit encore être mise en place pour être utilisé dans les mouches du sable, et devrait permettre le développement de reporters d’expression et de mutants d’expression conditionnelle, entre autres constructions.
Le développement de ce protocole de microinjection ouvre maintenant la porte à l’utilisation d’autres méthodes de modification du génome, telles que CRISPR/Cas9 HDR, transgenèse transposon, systèmes d’expression binaire tels que UAS/Gal4, et recombinaison spécifique au site par phiC31 ou Cre/lox. Le développement de ces autres méthodes permettra d’élargir encore la boîte à outils pour la modification de l’expression des gènes des mouches du sable en permettant une manipulation génomique plus complexe. Toutefois, avant que ces autres méthodes puissent être utilisées, il faudra identifier et isoler les éléments régulateurs pour stimuler l’expression des gènes insérés dans les mouches du sable, ainsi que des marqueurs d’insertion et d’autres composants de ces méthodes, tels que les promoteurs pour stimuler l’expression des transposases et des recombinases.
Enfin, l’édition du génome chez les insectes non modèles est devenue une possibilité, grâce notamment à la révolution de la découverte et de l’adaptation de CRISPR/Cas915,16. Chez les insectes, la plupart des techniques d’édition du génome, à l’exception notable de la nouvelle technique ReMOT, nécessitent une microinjection embryonnaire, une étape à la fois cruciale et techniquement exigeante. Nous espérons que cette publication contribuera à élargir la gamme des techniques de modification de l’expression génétique adaptées aux mouches du sable, et mènera à de nouvelles découvertes sur leur biologie ainsi qu’à la compétence vectorielle des parasites leishmania.
Déclarations de divulgation
aucun
Remerciements
Les auteurs remercient Vanessa Meldener-Harrell pour la lecture critique du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Black Filter Paper 4.25CM PK100 | VWR | 28342-012 | Cut into rectangles that are approximately 46 X 22mm. These are placed between the slide and the coverslip and act as a moist base layer for the embryos during injection. |
| Coverslips | Fisher Scientific | 12-543A | |
| Dissecting Microscope | Any brand | For aligning embryos | |
| Glass slides | Fisher Scientific | 12-550-A3 | Base layer of the microinjection set up Figure 2A |
| Insect cage | custom made or several commercial options | polycarbonate cage for adults holding and mating Lawyer, Phillip, Mireille Killick-Kendrick, Tobin Rowland, Edgar Rowton, and Petr Volf. “Laboratory Colonization and Mass Rearing of Phlebotomine Sand Flies (Diptera, Psychodidae).” Parasite 24. Accessed August 6, 2020. https://doi-org.remotexs.ntu.edu.sg/10.1051/parasite/2017041. | |
| Larval food | custom made | a mix of rabbit chow and rabbit feces Lawyer, Phillip, Mireille Killick-Kendrick, Tobin Rowland, Edgar Rowton, and Petr Volf. “Laboratory Colonization and Mass Rearing of Phlebotomine Sand Flies (Diptera, Psychodidae).” Parasite 24. https://doi-org.remotexs.ntu.edu.sg/10.1051/parasite/2017041. | |
| Microcaps 100 ml | Drummond | 1-000-1000 | Used to back fill microinjection needles |
| Mouth aspirator | John W. Hock Company | Model 612 | mouth aspirator with HEPA filter |
| Olympus SZX12 | Olympus Life Sciences | Microinjection microscope | |
| Ovipots | Nalge company | ovipots are made from 125-ml or 500-ml straigh-sided plolypropylene jars modified by drilling 2.5cm holes in the bottom and filled with 1cm of plaster of Paris. Lawyer, Phillip, Mireille Killick-Kendrick, Tobin Rowland, Edgar Rowton, and Petr Volf. “Laboratory Colonization and Mass Rearing of Phlebotomine Sand Flies (Diptera, Psychodidae).” Parasite 24. Accessed August 6, 2020. https://doi-org.remotexs.ntu.edu.sg/10.1051/parasite/2017041. | |
| Paint Brush 6-0 | Any Art Supply Company | n/a | Used for aligning embryos |
| Propionic acid | Sigma-Aldrich | 402907 | antifungal agent |
| Standard Glass Capillaries | World Precision Instruments | 1B100-3 | Used for making microinjection needles |
| Trio-MPC100 Controller and MP845 Manipulator | Sutter Instruments | Microinjection Controller and Micromanipulator |
Références
- Lawyer, P., Killick-Kendrick, M., Rowland, T., Rowton, E., Volf, P. Laboratory colonization and mass rearing of phlebotomine sand flies (Diptera, Psychodidae). Parasite. 24, 42 (2017).
- Pelletier, I., et al. Specific recognition of Leishmania major poly-beta-galactosyl epitopes by galectin-9: possible implication of galectin-9 in interaction between L. major and host cells. Journal Biological Chemistry. 278 (25), 22223-22230 (2003).
- Kamhawi, S., et al. A role for insect galectins in parasite survival. Cell. 119 (3), 329-341 (2004).
- Louradour, I., Ghosh, K., Inbar, E., Sacks, D. L. CRISPR/Cas9 Mutagenesis in Phlebotomus papatasi: the Immune Deficiency Pathway Impacts Vector Competence for Leishmania major. MBio. 10 (4), (2019).
- Xi, Z., Ramirez, J. L., Dimopoulos, G. The Aedes aegypti toll pathway controls dengue virus infection. PLoS Pathogens. 4 (7), 1000098 (2008).
- Ramirez, J. L., Dimopoulos, G. The Toll immune signaling pathway control conserved anti-dengue defenses across diverse Ae. aegypti strains and against multiple dengue virus serotypes. Development and Comparative Immunology. 34 (6), 625-629 (2010).
- Ramirez, J. L., et al. Reciprocal tripartite interactions between the Aedes aegypti midgut microbiota, innate immune system and dengue virus influences vector competence. PLoS Neglected Tropical Diseases. 6 (3), 1561 (2012).
- Hu, C., Aksoy, S. Innate immune responses regulate trypanosome parasite infection of the tsetse fly Glossina morsitans morsitans. Molecular Microbiology. 60 (5), 1194-1204 (2006).
- Meister, S., et al. Anopheles gambiae PGRPLC-mediated defense against bacteria modulates infections with malaria parasites. PLoS Pathogens. 5 (8), 1000542 (2009).
- Meister, S., et al. Immune signaling pathways regulating bacterial and malaria parasite infection of the mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences U S A. 102 (32), 11420-11425 (2005).
- Telleria, E. L., et al. Caspar-like gene depletion reduces Leishmania infection in sand fly host Lutzomyia longipalpis. Journal of Biological Chemistry. 287 (16), 12985-12993 (2012).
- Sant'Anna, M. R., Alexander, B., Bates, P. A., Dillon, R. J. Gene silencing in phlebotomine sand flies: Xanthine dehydrogenase knock down by dsRNA microinjections. Insect Biochemistry and Molecular Biology. 38 (6), 652-660 (2008).
- Sant'anna, M. R., Diaz-Albiter, H., Mubaraki, M., Dillon, R. J., Bates, P. A. Inhibition of trypsin expression in Lutzomyia longipalpis using RNAi enhances the survival of Leishmania. Parasites and Vectors. 2 (1), 62 (2009).
- Diaz-Albiter, H., Mitford, R., Genta, F. A., Sant'Anna, M. R., Dillon, R. J. Reactive oxygen species scavenging by catalase is important for female Lutzomyia longipalpis fecundity and mortality. PLoS One. 6 (3), 17486 (2011).
- Barrangou, R., et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 315 (5819), 1709-1712 (2007).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Pawelczak, K. S., Gavande, N. S., VanderVere-Carozza, P. S., Turchi, J. J. Modulating DNA Repair Pathways to Improve Precision Genome Engineering. ACS Chemical Biology. 13 (2), 389-396 (2018).
- Martin-Martin, I., Aryan, A., Meneses, C., Adelman, Z. N., Calvo, E. Optimization of sand fly embryo microinjection for gene editing by CRISPR/Cas9. PLoS Neglected Tropical Diseases. 12 (9), 0006769 (2018).
- Meuti, M., Harrell, R. Preparing and Injecting Embryos of Culex Mosquitoes to Generate Null Mutations Using CRISPR/Cas9. JoVE. (163), e61651 (2020).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR-Cas9-Based Genome Editing in the Silverleaf Whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Macias, V. M., et al. Cas9-Mediated Gene-Editing in the Malaria Mosquito Anopheles stephensi by ReMOT Control. Genes, Genomes and Genetics (Bethesda). 10 (4), 1353-1360 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon