Method Article
Sand Fly (Phlebotomus papatasi) Microinjeção de Embrião para Mutagenesis CRISPR/Cas9
Neste Artigo
Resumo
Este protocolo detalha as etapas da mutagênese direcionada do CRISPR/Cas9 em moscas de areia: coleta de embriões, injeção, criação de insetos e identificação, bem como seleção de mutações de interesse.
Resumo
Moscas de areia são os vetores naturais da espécie Leishmania, parasitas protozoários produzindo um amplo espectro de sintomas que vão desde lesões cutâneas até patologia visceral. Decifrar a natureza das interações vetor/parasita é de importância primária para uma melhor compreensão da transmissão de Leishmania aos seus hospedeiros. Entre os parâmetros que controlam a competência vetorial da mosca de areia (ou seja, sua capacidade de transportar e transmitir patógenos), parâmetros intrínsecos a esses insetos mostraram-se um papel fundamental. A resposta imune a insetos, por exemplo, impacta a competência vetorial da mosca da areia para a Leishmania. O estudo desses parâmetros tem sido limitado pela falta de métodos de modificação da expressão genética adaptados para uso nesses organismos não-modelo. A baixa genética por RNA de pequena interferência (siRNA) é possível, mas além de ser tecnicamente desafiador, o silenciamento leva apenas a uma perda parcial de função, que não pode ser transmitida de geração em geração. Mutagênese direcionada pela tecnologia CRISPR/Cas9 foi recentemente adaptada para a mosca de areia Phlebotomus papatasi. Essa técnica leva à geração de mutações transmissíveis em um lócus especificamente escolhido, permitindo estudar os genes de interesse. O sistema CRISPR/Cas9 conta com a indução de quebras de DNA de dois fios direcionados, posteriormente reparados por NHEJ (Non-Homólogos End Joining) ou por Homology Driven Repair (HDR). O NHEJ consiste em um simples fechamento da quebra e frequentemente leva a pequenos eventos de inserção/exclusão. Em contraste, o HDR usa a presença de uma molécula de DNA doador compartilhando a homologia com o DNA alvo como modelo para reparo. Aqui, apresentamos um método de microinjeção de embriões de mosca de areia para mutagênese direcionada pelo CRISPR/Cas9 usando NHEJ, que é a única técnica de modificação do genoma adaptada aos vetores de mosca de areia até o momento.
Introdução
As doenças transmitidas por vetores são uma grande ameaça à saúde pública em constante evolução. Centenas de espécies vetoriais espalhadas por famílias filogênicas muito distintas (por exemplo, mosquitos, carrapatos, pulgas) são responsáveis pela transmissão de um grande número de patógenos microbianos, resultando em mais de 700.000 mortes humanas por ano, de acordo com a Organização Mundial da Saúde. Entre os insetos vetoriais, as moscas de areia de flebotomina (Diptera, Psychodidae) constituem um vasto grupo, com 80 espécies vetoriais comprovadas exibindo traços fenotípicos distintos e capacidades vetoriais encontradas em diferentes regiões geográficas. São vetores para os parasitas protozoários do gênero Leishmania,causando cerca de 1,3 milhão de novos casos de Leishmanioses e entre 20.000 e 30.000 mortes por ano. Os desfechos clínicos das leishmanioses são diversos, com sintomas que vão desde lesões cutâneas auto-limitantes até disseminação visceral que é fatal na ausência de tratamento.
Moscas de areia são insetos estritamente terrestres. Seu ciclo de vida, relativamente longo em comparação com outros Diptera, dura até três meses, dependendo de diferentes parâmetros, como temperatura, umidade e nutrição. Consiste em um estágio embrionário (6 a 11 dias), quatro estágios larvais (com duração total de 23 a 25 dias) e um estágio pupal (9 a 10 dias) seguido de metamorfose e depois idade adulta. Moscas de areia requerem um ambiente úmido e quente para a criação. Tanto machos quanto fêmeas se alimentam de açúcares, obtidos na natureza a partir de néctars de flores. Apenas as fêmeas são alimentadores de sangue, pois necessitam de proteínas obtidas da farinha de sangue para a produção de ovos1.
Um foco importante da pesquisa é identificar a natureza das interações vetor/parasita que levam ao desenvolvimento de infecções transmissíveis. Assim como outros insetos vetoriais, parâmetros intrínsecos às moscas de areia têm mostrado impacto em sua competência vetorial, que é definida como sua capacidade de transportar e transmitir patógenos para seus hospedeiros. Por exemplo, a expressão de galectinas pelos phlebotomus papatasi e células midgut de mosca, agindo como receptores reconhecendo componentes da superfície parasita, pode influenciar diretamente sua competência vetorial para Leishmania maior2,3. A via de resposta imune ao inseto, Immune Deficiency (IMD), também é crucial para a competência vetorial de phlebotomus papatasi para a Leishmania maior4. Um papel crítico para as vias de resposta imune a insetos vetoriais no controle de sua transmissão de patógenos infecciosos tem sido relatado da mesma forma nos mosquitos Aedes aegypti 5,6,7, na mosca tsé-tsé Glossina morsitans8, e em Anopheles gárdias mosquitos 9,10.
Estudos de interações de moscas deareia/Leishmania têm sido limitados pela falta de métodos de modificação da expressão genética adaptados para uso nesses insetos. Apenas a desregulamentação genética por RNA de pequena interferência (siRNA) havia sido realizada11,12,13,14 até recentemente. A técnica, limitada pela mortalidade associada à microinjeção de fêmeas adultas, leva apenas a uma perda parcial de função, que não pode ser transmitida de geração em geração.
A tecnologia CRISPR/Cas9 revolucionou a pesquisa genômica funcional em organismos não-modelo, como moscas de areia. Modificado do sistema imunológico adaptativo em procariotes para defesa contra bacteriófagos15,16, o sistema CRISPR Cas9 foi rapidamente adaptado como uma ferramenta de edição de genomas para organismos eucarióticos superiores, incluindo insetos. O princípio da edição de genoma direcionada do CRISPR/Cas9 baseia-se na complementaridade de um único guia RNA (sgRNA) a um lócus genômico específico. A nuclease Cas9 se liga ao sgRNA e cria uma quebra de DNA de duas vertentes (dsDNA) no DNA genômico onde o sgRNA se associa à sua sequência complementar. O complexo Cas9-sgRNA é guiado à sequência de destino por 17 a 20 bases complementares no sgRNA para o lócus escolhido, o rompimento dsDNA pode então ser reparado por duas vias independentes: junção final nonhomologous (NHEJ) ou reparo direcionado à homologia (HDR)17. O reparo do NHEJ envolve um simples fechamento do intervalo, mas frequentemente leva a pequenos eventos de inserção/exclusão. A reparação de DNA através do HDR usa uma molécula de DNA doador compartilhando a homologia com o DNA alvo como modelo para reparo. Insetos possuem ambas as máquinas.
A tecnologia CRISPR/Cas9 pode gerar mutações em um lócus escolhido, através da via de reparo NHEJ; ou para estratégias de edição de genomas mais complexas, como knock-ins ou repórteres de expressão, através da via HDR com um modelo de doador apropriado. Em moscas de areia, alelos mutantes nulos do fator de resposta imune Relish foram gerados através de CRISPR mediado por NHEJ em Phlebotomus papatasi4. Embriões de mosca de areia também foram injetados em outro estudo com uma mistura CRISPR/Cas9 visando a codificação genética Amarela. Ainda assim, nenhum adulto portador da mutação foi produzido18. Descrevemos aqui um método detalhado de mutagênese direcionada à mosca-da-areia pelo CRISPR/Cas9 mediado pela NHEJ, com um foco particular na microinjeção do embrião, um passo crítico do protocolo.
Protocolo
O uso de camundongos como fonte de sangue para alimentação de moscas de areia foi realizado de acordo com as recomendações do Guia de Cuidado e Uso de Animais de Laboratório dos Institutos Nacionais de Saúde (NIH). O protocolo foi aprovado pelo Comitê de Cuidados e Uso de Animais do NIAID, NIH (número de protocolo LPD 68E). Os invertebrados não estão cobertos pelas diretrizes do NIH.
1. Preparação da agulha(Figura 1)
- Puxe agulhas e bisel como descrito em Meuti e Harrell19. Brevemente, puxe agulhas em um puxador de micropipette de vidro de dois estágios, usando capilares de vidro borossilicato.
- Afie as agulhas molhadas no beveller de micropipette, usando uma pedra extra fina.
2. Coleta e micromanipulação de embriões (Figura 2)
- Cinco dias antes do dia da injeção, a alimentação sanguínea e as fêmeas voam fêmeas como realizada rotineiramente para a manutenção da colônia. Para obter detalhes sobre as colônias de moscas de areia que criam procedimentos e material necessário, consulte Lawyer et al.1 Mantenha os insetos em incubadoras com 70% de umidade e 26 °C, durante todo o seu desenvolvimento.
- Um dia, após a alimentação sanguínea, capture fêmeas alimentadas com sangue por grupos de 100-150 em potes de gesso com uma porta lateral. Mantenha as fêmeas alimentando-as com solução de açúcar (30% de sacarose – volume suficiente para absorver uma pequena bola de algodão) o que é comum para a manutenção da colônia.
- No dia 2-3 pós alimentação sanguínea, NÃO umedeça os potes de gesso. Manter as fêmeas em um substrato seco evitará a colocação prematura de ovos, uma vez que as fêmeas preferem colocar ovos em um ambiente úmido.
- No dia 5 pós-alimentação sanguínea, realize a coleta de embriões, micromanipulação e microinjeção. Introduza um papel filtro úmido na câmara de colocação de ovos. Embriões recém-colocados não têm um acorde totalmente desenvolvido e parecem brancos. Use papel filtro preto durante o procedimento para facilitar a visualização dos embriões brancos.
- Transfira um pequeno grupo de fêmeas da panela de gesso para a câmara de colocação de ovos através das portas laterais usando um aspirador bucal. A presença de um substrato úmido (o papel filtro) induz as fêmeas a oviposit.
- Depois de 30-60 min, recupere cuidadosamente o papel filtro com embriões recém-colocados da câmara. Mantenha o papel filtro e os embriões em uma placa de Petri por até 3 horas. Durante este tempo, avalie regularmente o nível de umidade do papel filtro para garantir que ele permaneça úmido. Durante esse período, repita as etapas 2.4 a 2.6 com novos grupos de fêmeas e colete o maior número possível de embriões.
- Prepare slides de microscópio para a injeção: colete manualmente os ovos um a um com um pincel muito fino e transfira-os cuidadosamente para outro pedaço de papel filtro preto úmido colocado em um slide de microscópio coberto com uma mancha de vidro.
- Adicione água ao papel filtro, o suficiente para manter os embriões úmidos, mas não fazendo com que flutuem para longe da tampa ou sejam sugados sob a tampa. Alinhe os embriões contra o deslizamento. O deslizamento de cobertura age como um backstop impedindo que os ovos se afastem durante a injeção.
3. Injeções de Embriões(Figura 3)
- Iniciar injeções de 2,5 a 3 horas após o início da coleta de ovos. Realizar injeções à temperatura ambiente e umidade do laboratório ambiente.
- Certifique-se de que os embriões alinhados tenham água suficiente para que sejam mantidos úmidos.
NOTA: É fundamental que os embriões sejam mantidos úmidos durante as injeções. Se não estiverem úmidos durante o processo de injeção, as injeções se tornam difíceis porque a agulha tem problemas para perfurar o embrião. A quantidade correta de água é o ponto em que os embriões têm um menisco de água ao seu redor, mas o deslizamento não está flutuando em cima da água fazendo com que os embriões empurrem sob o deslizamento de cobertura. É fundamental monitorar a quantidade de água ao redor dos embriões durante as injeções. Adicione água conforme necessário para manter os embriões úmidos. - Adicione a água cuidadosamente, molhando uma escova com água e transferindo a água para a parte de trás do papel do filtro. Adicionar água desta forma permite que a água seja adicionada de forma lenta e controlada para que apenas o suficiente seja adicionado para manter os embriões úmidos. Muita água pode fazer com que os embriões flutuem para fora do alinhamento, dificultando a injeção dos embriões.
- Misture a injeção de carga na agulha de microinjeção. Adicione aproximadamente 0,5 a 1 μL de mistura de injeção na agulha usando um enchimento de agulha borossilicato desenhado à mão, as pontas de tubulação de carregamento de gel também podem ser usadas. A mistura de injeção é composta de um ou vários RNA guia (80 ng/μL cada) projetado para atingir um lócus específico misturado com proteína Cas9 recombinante comercial (300 ng/μL).
- Começando com a pressão de injeção a 30 psi, pressione o gatilho de injeção para expulsar o ar da ponta da agulha. Isso forçará a mistura de injeção à ponta da agulha permitindo que a mistura de injeção flua. Neste ponto, aumente lentamente a pressão de espera/constante até que o material de injeção comece a fluir, em seguida, recue a pressão de espera/constante para que ele fique logo abaixo do ponto da mistura de injeção que flui da agulha. O ambiente fechado deve fornecer apenas material de injeção suficiente para que uma pequena quantidade de material possa ser vista para entrar no embrião.
NOTA: A injeção de embriões de mosca de areia sob óleo de halocarbono semelhante a outros protocolos usados para Drosophila e mosquitos foi inicialmente testada, porém a porcentagem de sobrevivência dessas injeções foi muito baixa. A sobrevivência foi melhorada com a mudança para injeções em papel filtro úmido como descrito acima. - Insira a agulha na lateral do embrião. Use o deslizamento atrás do embrião como um backstop que ajudará a agulha a perfurar o embrião. Entregue uma pequena quantidade de mistura de injeção no embrião antes de remover suavemente a agulha.
- Imediatamente após a remoção da agulha, pressione o injetor para remover qualquer material reabastecado da ponta da agulha. Isso ajudará a evitar que a agulha entupisse.
- Vá para o próximo embrião. Entre cada injeção, certifique-se de que o papel do filtro está úmido e que a agulha não está entupida.
- Uma vez que todos os embriões tenham sido injetados, conte o número de embriões injetados para manter uma contagem de execução.
- Remova a mancha de cobertura adicionando água ao papel do filtro para que a mancha de cobertura flutue. Neste ponto, use uma sonda (vara aplicadora de madeira com pino de inseto colado na ponta) para manter o papel filtro no lugar enquanto um dedo é usado para puxar a tampa para longe dos embriões injetados.
- Limpe o excesso de água do papel do filtro uma vez que a mancha de cobertura tenha sido removida.
4. Criação pós-injeção (G0)(Figura 4)
- Transfira o papel filtro com os embriões em cima de várias camadas de papel filtro úmido colocado em uma placa de Petri para manter a umidade. Mantenha os embriões aqui durante o tempo necessário para injetar outros embriões. Embriões podem ser mantidos por um máximo de 3 horas como este. Após a injeção, eles vão lentamente ficar marrons.
- Uma vez que todos os embriões tenham sido injetados, transfira manualmente-os para potes de gesso de pequeno porte previamente umedecidos. Não coloque muitos embriões em cada pote e mantenha distância entre eles, para evitar uma possível contaminação fúngica entre os indivíduos. Cubra os potes com uma tela e armazene-os como normalmente seria feito para ovos de colônia de moscas de areia, mantidos em incubadoras a 70% de umidade e 26 °C, durante todo o seu desenvolvimento.
- No primeiro dia pós-injeção, remova todos os embriões danificados e mortos com um pincel. Adicione 100 μL de ácido propiônico de 0,5%, gota a gota, nos potes de gesso contendo os embriões injetados para limitar a contaminação fúngica. A liberação de citoplasma de embriões danificados durante o processo de injeção é particularmente favorável ao crescimento fúngico.
- Verifique os potes de gesso todos os dias e remova os embriões ruins ou mortos. Se o fungo estiver presente, remova todos os embriões infectados e adicione algumas gotas de ácido propiônico de 0,5%.
- Larvas eclodem entre os dias 8 e 12 pós-injeção. Duas vezes por dia, transfira as larvas recém-emergidas para novos potes de gesso, em grupos de 5-10 no máximo. Adicione uma pequena quantidade de comida e verifique a comida 2-3 vezes por semana.
- Monitore cuidadosamente a quantidade de alimentos larvais, pois aumenta muito o risco de contaminação fúngica. Larvas de mosca de areia sobrevivem melhor em grupos, porém podem ser canibais se não houver comida suficiente.
- Quando as larvas pupar, separe-as por sexo para manter as fêmeas como virgens. Se houver muitos sobreviventes, descarte os machos e mantenha apenas as fêmeas.
NOTA: Tanto os machos quanto as fêmeas podem carregar e transmitir mutações. No entanto, como as fêmeas têm que ser mantidas virgens antes de serem cruzadas, é mais fácil usar apenas as fêmeas injetadas do G0 para evitar ter que separar os insetos wt por sexo. Os machos G0 podem ser mantidos como reforço se o número de sobreviventes adultos for baixo e, neste caso, será acasalado com fêmeas virgens classificadas.
5. Seleção e triagem de alelos mutantes(Figura 5)
- Cruze em massa as fêmeas G0 com machos em uma gaiola. Alimenta-os completamente, como seria feito para a manutenção normal da colônia.
- Um dia, após a alimentação sanguínea, transfira cada fêmea G0 com machos de 2-3 wt em tubos individuais de gesso usando um aspirador bucal. Alimente as moscas com açúcar em uma pequena bola de algodão trocada todos os dias e use uma seringa de água para garantir que a umidade do gesso seja adequada para a colocação de ovos.
- Após as fêmeas G0 colocarem ovos (correspondentes ao G1),recolher seus corpos em tubos Eppendorf anotados para genotipagem posterior. Mantenha os embriões como normalmente feito para colônias wt.
- Extrair o DNA das fêmeas G0 pelo método de escolha.
- Trie o DNA para a presença de mutações, por exemplo, projetando um ensaio pcr usando primers em torno da região de cortes crocantes esperados.
- Mantenha apenas os embriões G1 colocados por fêmeas G0 mostrando evidências de transformação. Quando esses embriões G1 se desenvolverem em pupas, separem-nos pelo sexo e mantenham apenas as fêmeas. Cruze as fêmeas G1 do mesmo sexo feminino G0 para os machos, alimenta-os com sangue, depois transfira em pequenos grupos de 2-3 fêmeas e 4-5 machos em recipientes de pequeno porte.
NOTA: Todos os indivíduos do G1 têm a chance de carregar uma mutação única, portanto, se o número de indivíduos sobreviventes não é muito alto, então é melhor cruzar as fêmeas G1 individualmente com os machos wt. O caso de várias fêmeas carregando uma mutação diferente presente em um mesmo tubo é raro, mas pode ocorrer. Se esse caso for observado após a genotipagem, as fêmeas progêneras G2 devem então ser acasaladas individualmente para os machos wt. Este esquema de acasalamento evita a possibilidade de múltiplas mutações na prole. - Após a colocação de ovos, colete os corpos femininos G1 e trie-os para mutações. Mantenha apenas os tubos onde pelo menos uma fêmea mostrou evidência de mutação.
- Para gerações posteriores fazer um par único em cruzes. Depois da colocação de ovos, pais de tela para a presença de mutação. Repita em cada geração até que ambos os pais sejam homozigosos para a mesma mutação. Uma vez identificados, eles serão os fundadores de um estoque mutante homozigoso.
Resultados
O protocolo de microinjeção CRISPR/Cas9 descrito aqui para gerar mutantes de moscas de areia foi estabelecido em uma publicação anterior4. Essa abordagem produziu mutagênese altamente eficiente, já que 11 dos 540 indivíduos sobreviveram ao procedimento, dos quais 9 eram mutantes. Ao projetar guias para mutação CRISPR/Cas9, um primeiro passo crítico é sequenciar a região ao redor da área a ser alvo. O modelo para sequenciamento deve ser da cepa que será usada como fonte de embriões para injeção. É arriscado confiar apenas em sequências de genoma publicadas para projetar guias. Não é incomum ter diferenças entre o genoma publicado e as sequências de design pré-guia. Em alguns casos, guias projetados a partir da sequência de genoma publicada não estão presentes quando a região ao redor do gene alvo é sequenciada (Harrell, observação pessoal). Além disso, a sequência pode incluir Polimorfismos de Nucleotídeos Únicos (SNPs) que podem ser confundidos como edições CRISPR reais durante a genotipagem. Portanto, confirmar a sequência para a região alvo é fundamental para que o resto do protocolo tenha sucesso.
A modificação genética bem sucedida dos insetos por microinjeção depende principalmente de dois aspectos críticos: a entrega de materiais (proteína, plasmídeo ou mRNA) no momento apropriado em desenvolvimento com o menor dano possível aos embriões; e criação de insetos robustos e saudáveis que sobreviverão ao procedimento e produzirão descendentes. A fase inicial deste procedimento, descrita na Figura 2,começa com a alimentação sanguínea das fêmeas da colônia wt e segue para coleta e microinjeção de embriões cinco dias depois. A segunda fase consiste em criar os embriões injetados até a idade adulta, fazer as cruzes apropriadas e identificar e isolar mutações de interesse.
Os embriões para injeção são coletados por 30 a 60 minutos para que a idade relativa em horas pós-oviposition possa ser determinada. Embriões são então autorizados a desenvolver-se por 3 h antes do início das injeções. Esta janela temporal de desenvolvimento de insetos permite que os embriões sobrevivam às injeções. Após esse período de envelhecimento, os embriões são coletados em um slide de injeção preparado e os embriões são enrolados no lugar contra uma borda de deslizamento de tampa usando uma escova fina. A configuração final é mostrada na Figura 3A. É importante molhar o papel filtro o suficiente para que um menisco se forme na borda do deslizamento de cobertura onde os embriões se sentam. Muita água e os embriões serão empurrados para longe da borda da tampa. Muito pouco fará com que os embriões sejam desenhados sob o deslizamento. Os embriões precisam ser mantidos úmidos, caso contrário as membranas de embriões se tornam difíceis de injetar. A borda do deslizamento de cobertura age como uma parada traseira, permitindo que a agulha penetre os embriões quando pressionada contra a borda. É a combinação de uma agulha afiada e um backstop que permite que a agulha penetrásse suavemente.
Como acontece com os protocolos de microinjeção mais bem sucedidos, uma boa agulha de microinjeção adequada aos embriões que estão sendo injetados é importante. Agulhas boas e afiadas são definidas como agulhas que penetram facilmente no embrião sem permitir que o material escape após a injeção. Uma boa penetração é evidente quando a agulha desliza para dentro do embrião, causando pouco ou nenhum recuo da membrana embrionária durante a penetração e nenhum material vaza do embrião após a retirada da agulha. Boas agulhas afiadas são produzidas usando ajustes de puxador de agulha que produzem uma agulha que chega a um ponto fino(Figura 1A). A agulha puxada não deve ter um taper que é muito longo. Caso contrário, o lúmen da agulha torna-se muito estreito para uma grande parte do taper(Figura 1B), e torna-se difícil obter a pressão de injeção alta o suficiente para forçar o material através da agulha. Neste protocolo, agulhas chanfradas foram usadas. O processo de puxar e bivelar agulhas é descrito em Meuti e Harrell19. No caso de embriões de mosca de areia que se desenvolvem por um longo período de tempo, é particularmente crítico ter agulhas afiadas que minimizam danos ao embrião, evitando assim que o material vaze no local da injeção. Quando o embrioplasma vaza de um embrião pós-injeção, este material é um meio rico para o e crescimento fúngico. Em embriões que se desenvolvem em um período mais curto de tempo o embrião pode desenvolver e eclodir antes que o molde se torne um problema. Quaisquer embriões que estejam visivelmente vazando embrioplasma após a injeção devem ser removidos.
Durante as injeções, é importante adicionar água conforme necessário, molhando um pincel fino e tocando-o no papel do filtro, repetindo-se conforme necessário até que o menisco da água esteja apenas na base dos embriões. Atenção à umidade relativa no dia da injeção precisa ser notada. Em dias de baixa umidade, mais água precisará ser adicionada. Uma vez que as injeções são concluídas, um pouco de água extra é adicionada ao papel do filtro para que a tampa flutue ligeiramente, facilitando a remoção. Uma vez removido o deslizamento de tampa, o papel filtro com embriões injetados pode ser apagado, de modo que o papel filtro é apenas pouco úmido. Embriões podem então ser transferidos para um pote de gesso úmido para eclodir usando um pincel fino. Nesta fase, os embriões são muito frágeis, por isso o processo tem que ser realizado com muito cuidado. Também é importante evitar que os embriões se toquem entre si para serem capazes de remover embriões mofados e limitar a propagação da contaminação fúngica.
Após a injeção, os embriões injetados do G0 são mantidos em potes de gesso conforme procedimentos normais de criação. Até chocarem, os potes de embrião injetados devem ser verificados uma vez por dia para remover embriões insalubres. A Figura 4A apresenta a linha do tempo esperada de criação individual G0 desde o dia da colocação e injeção de ovos até a idade adulta. A Figura 4B mostra exemplos de embriões G0 saudáveis e devem ser mantidos; ou danificado, contaminado por fungo, dessecado ou deformado e deve ser descartado. Os indivíduos injetados do G0 são supostamente mosaicos para alelos mutantes. Um método para identificar potenciais alelos mutantes deve ser projetado, como um teste pcr da região em torno do local de corte esperado. A Figura 4C apresenta um exemplo de um teste pcr mostrando um mosaico G0 individual, exibindo um produto PCR adicional ao produto wt esperado, representando um alelo mutante.
Uma vez que os adultos emergem, as fêmeas G0 que se desenvolvem a partir de embriões injetados G0 são cruzadas com machos wt, permitidas a colocar ovos, e são genótipadas mais tarde. Apenas os tubos contendo uma mosca G0 mostrando evidências de mutação do método de escolha genotipagem são retidos. As moscas das próximas gerações (fêmeas G1) são cruzadas com machos wt ou individualmente entre irmãos (a partir de G2). Estas cruzes são permitidas para colocar ovos e, em seguida, genótipo pelo método de escolha. O último passo é repetido até que machos e fêmeas mutantes homozigos sejam obtidos, estabelecendo uma linha mutante homozigosa. Uma representação esquemática da sucessão adequada de cruzes para estabelecer uma linha mutante é dada na Figura 5A. A Figura 5B mostra um exemplo de um PCR genotipagem permitindo a identificação de uma cruz de irmãos mutantes homozigos.

Figura 1: Agulhas de microinjeção. A. Boa agulha. B. Agulha com taper extremo não é bom para injeções. Clique aqui para ver uma versão maior desta figura.

Figura 2: Visão geral da coleta de embriões e micromanipulação (Esta figura foi adaptada a partir de4). Clique aqui para ver uma versão maior desta figura.

Figura 3: Configuração de microinjeção. A. Representação esquemática da configuração da microinjeção. B. Close-up de embrião alinhado para microinjeção. Clique aqui para ver uma versão maior desta figura.
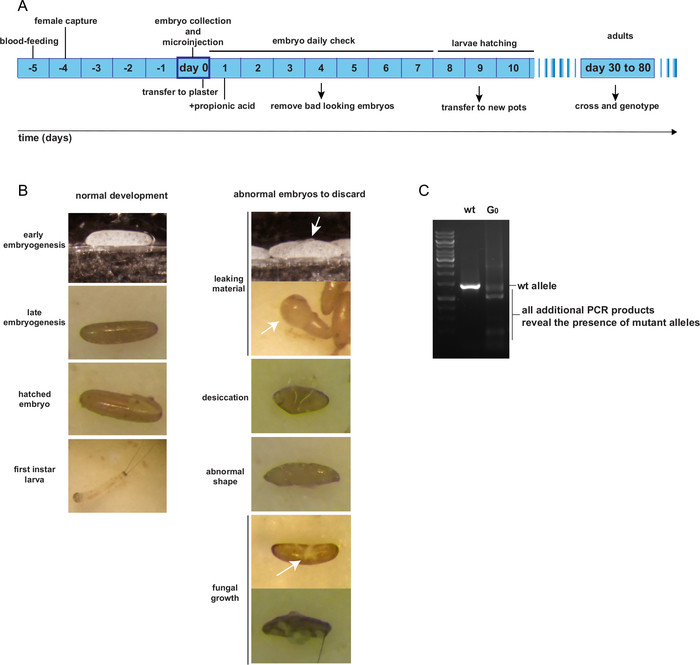
Figura 4: Criação e identificação de indivíduos adultos do mosaico G0. A. Cronograma esperado da microinjeção de embriões para g0 na idade adulta. B. Exemplos de embriões de boa e má aparência pós-injeção. C. PCR genotipping de um indivíduo de mosaico G0 transformado. Clique aqui para ver uma versão maior desta figura.

Figura 5: Identificação e isolamento de mutações de interesse. A. Representação esquemática da estratégia experimental para isolar alelos mutantes e estabelecer estoques mutantes homozigos (figura a partir de 4). A cor representa a presença de células carregando alelos mutantes, no estado heterozigo (rosa) ou homozigoso (vermelho). B. Exemplo de uma estratégia de triagem PCR para genotipagem de cruzes individuais de moscas de areia. Clique aqui para ver uma versão maior desta figura.
Discussão
Apresentamos aqui um método de microinjeção de embriões recentemente desenvolvido para mutagênese direcionada por CRISPR/Cas9 em moscas de areia Phlebotomus papatasi. A microinjeção de embriões para modificação genética de insetos foi desenvolvida em Drosophila em meados da década de 198021 e agora é usada rotineiramente em uma grande variedade de insetos. Outros métodos para a entrega de materiais de modificação genética foram desenvolvidos para uso em insetos, como ReMOT20,21,22,23 e eletroporação23. No entanto, a microinjeção de embriões é atualmente o método mais versátil e eficiente para a entrega desses materiais. O ReMOT é extremamente promissor como um método de entrega e deve ser explorado para uso em moscas de areia, devido à relativa facilidade de injeções adultas em comparação com microinjeções de embriões. No entanto, até agora o ReMot não foi usado com sucesso para CRISPR/Cas9 HDR ou transgênese transposon. Embora a técnica de microinjeções de embriões em insetos seja basicamente a mesma desenvolvida inicialmente, para cada nova espécie podem ser necessários refinamentos das técnicas. Essas diferenças de espécies incluem o padrão e a duração do desenvolvimento do embrião, estrutura de embriões e o ambiente em que o embrião normalmente se desenvolve. Os embriões de mosca de areia são particularmente pequenos (0,3-0,5 mm de comprimento e 0,1- 0,15 mm de largura, representando cerca de 1/3 do tamanho do ovo de Drosophila 1). Esse tamanho reduzido aumenta a dificuldade de manusear os ovos sem danificá-los. O nível de umidade em cada etapa do protocolo deve ser monitorado com muito cuidado, pois os embriões de moscas de areia são particularmente sensíveis à dessecação. No entanto, eles não são aquáticos e morrerão se completamente submersos na água por um longo período. Microinjeção de embrião de drosophila requer injeção na extremidade posterior do embrião. Devido à forma quase simétrica dos embriões de mosca de areia, determinar a polaridade do embrião é difícil. Finalmente, enquanto o desenvolvimento de embriões de moscas de areia prossegue semelhante ao Drosophila,ele o faz a uma taxa muito mais lenta. Só a embriogênese dura entre 6 a 11 dias, dependendo das espécies de moscas de areia, enquanto os ovos de Drosophila eclodem apenas um dia após a colocação de ovos. A celularização do ovo de drosophila ocorre cerca de 2 horas após a oviposição, enquanto os embriões de moscas de areia chegam a esta fase em quase 9 horas após oviposição. Dada essa diferença no tempo de desenvolvimento, as injeções são direcionadas ao centro do embrião de mosca de areia em desenvolvimento, supondo que os núcleos em desenvolvimento no embrião sincicial estejam localizados perto do centro do embrião em desenvolvimento neste estágio inicial de desenvolvimento, evitando assim a necessidade de distinguir a polaridade do embrião.
CRISPR/Cas9 cria quebras dsDNA em um lócus genômico escolhido. Estas quebras de dois fios são reparadas na célula por NHEJ ou por HDR. O método aqui presente foi utilizado anteriormente apenas para mutagênese baseada em NHEJ, que gerou pequenos eventos de inserção/exclusão, indels, levando a uma mudança de quadro em sequências genéticas, resultando em codons de parada prematura e uma proteína sem todos os domínios funcionais4. Os insetos também possuem o maquinário celular para o reparo de quebra dsDNA através do HDR, que poderia então ser redirecionado para projetar estratégias de edição de genomas mais complexas. A edição do genoma CRISPR/Cas9 baseada em HDR ainda precisa ser configurada para uso em moscas de areia, e deve permitir o desenvolvimento de repórteres de mutantes de expressão e expressão condicional, entre outras construções.
O desenvolvimento deste protocolo de microinjeção abre agora as portas para o uso de outros métodos de modificação do genoma, como CRISPR/Cas9 HDR, transgênese transposon, sistemas de expressão binária, como uas/gal4, e recombinação específica do local por phiC31 ou Cre/lox. O desenvolvimento desses outros métodos expandirá ainda mais a caixa de ferramentas para modificação da expressão genética da mosca de areia, permitindo uma manipulação genômica mais complexa. No entanto, antes que esses outros métodos possam ser empregados, serão necessários trabalhar na identificação e isolamento de elementos reguladores para impulsionar a expressão de genes inseridos em moscas de areia, bem como marcadores de inserção e outros componentes desses métodos, como promotores para impulsionar a expressão de transposases e recombinases.
Finalmente, a edição de genomas em insetos não-modelo tornou-se agora uma possibilidade, graças em particular à revolução da descoberta e adaptação crispr/cas915,16. Nos insetos, a maioria das técnicas de edição de genomas, para a notável exceção da recém-desenvolvida técnica ReMOT, requerem microinjeção de embriões, um passo crucial e tecnicamente exigente. Esperamos que esta publicação ajude a expandir a gama de técnicas de modificação da expressão genética adaptadas às moscas de areia, e leve a novas descobertas sobre sua biologia, bem como competência vetorial aos parasitas da Leishmania.
Divulgações
nenhum
Agradecimentos
Os autores agradecem a Vanessa Meldener-Harrell pela leitura crítica do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Black Filter Paper 4.25CM PK100 | VWR | 28342-012 | Cut into rectangles that are approximately 46 X 22mm. These are placed between the slide and the coverslip and act as a moist base layer for the embryos during injection. |
| Coverslips | Fisher Scientific | 12-543A | |
| Dissecting Microscope | Any brand | For aligning embryos | |
| Glass slides | Fisher Scientific | 12-550-A3 | Base layer of the microinjection set up Figure 2A |
| Insect cage | custom made or several commercial options | polycarbonate cage for adults holding and mating Lawyer, Phillip, Mireille Killick-Kendrick, Tobin Rowland, Edgar Rowton, and Petr Volf. “Laboratory Colonization and Mass Rearing of Phlebotomine Sand Flies (Diptera, Psychodidae).” Parasite 24. Accessed August 6, 2020. https://doi-org.remotexs.ntu.edu.sg/10.1051/parasite/2017041. | |
| Larval food | custom made | a mix of rabbit chow and rabbit feces Lawyer, Phillip, Mireille Killick-Kendrick, Tobin Rowland, Edgar Rowton, and Petr Volf. “Laboratory Colonization and Mass Rearing of Phlebotomine Sand Flies (Diptera, Psychodidae).” Parasite 24. https://doi-org.remotexs.ntu.edu.sg/10.1051/parasite/2017041. | |
| Microcaps 100 ml | Drummond | 1-000-1000 | Used to back fill microinjection needles |
| Mouth aspirator | John W. Hock Company | Model 612 | mouth aspirator with HEPA filter |
| Olympus SZX12 | Olympus Life Sciences | Microinjection microscope | |
| Ovipots | Nalge company | ovipots are made from 125-ml or 500-ml straigh-sided plolypropylene jars modified by drilling 2.5cm holes in the bottom and filled with 1cm of plaster of Paris. Lawyer, Phillip, Mireille Killick-Kendrick, Tobin Rowland, Edgar Rowton, and Petr Volf. “Laboratory Colonization and Mass Rearing of Phlebotomine Sand Flies (Diptera, Psychodidae).” Parasite 24. Accessed August 6, 2020. https://doi-org.remotexs.ntu.edu.sg/10.1051/parasite/2017041. | |
| Paint Brush 6-0 | Any Art Supply Company | n/a | Used for aligning embryos |
| Propionic acid | Sigma-Aldrich | 402907 | antifungal agent |
| Standard Glass Capillaries | World Precision Instruments | 1B100-3 | Used for making microinjection needles |
| Trio-MPC100 Controller and MP845 Manipulator | Sutter Instruments | Microinjection Controller and Micromanipulator |
Referências
- Lawyer, P., Killick-Kendrick, M., Rowland, T., Rowton, E., Volf, P. Laboratory colonization and mass rearing of phlebotomine sand flies (Diptera, Psychodidae). Parasite. 24, 42 (2017).
- Pelletier, I., et al. Specific recognition of Leishmania major poly-beta-galactosyl epitopes by galectin-9: possible implication of galectin-9 in interaction between L. major and host cells. Journal Biological Chemistry. 278 (25), 22223-22230 (2003).
- Kamhawi, S., et al. A role for insect galectins in parasite survival. Cell. 119 (3), 329-341 (2004).
- Louradour, I., Ghosh, K., Inbar, E., Sacks, D. L. CRISPR/Cas9 Mutagenesis in Phlebotomus papatasi: the Immune Deficiency Pathway Impacts Vector Competence for Leishmania major. MBio. 10 (4), (2019).
- Xi, Z., Ramirez, J. L., Dimopoulos, G. The Aedes aegypti toll pathway controls dengue virus infection. PLoS Pathogens. 4 (7), 1000098 (2008).
- Ramirez, J. L., Dimopoulos, G. The Toll immune signaling pathway control conserved anti-dengue defenses across diverse Ae. aegypti strains and against multiple dengue virus serotypes. Development and Comparative Immunology. 34 (6), 625-629 (2010).
- Ramirez, J. L., et al. Reciprocal tripartite interactions between the Aedes aegypti midgut microbiota, innate immune system and dengue virus influences vector competence. PLoS Neglected Tropical Diseases. 6 (3), 1561 (2012).
- Hu, C., Aksoy, S. Innate immune responses regulate trypanosome parasite infection of the tsetse fly Glossina morsitans morsitans. Molecular Microbiology. 60 (5), 1194-1204 (2006).
- Meister, S., et al. Anopheles gambiae PGRPLC-mediated defense against bacteria modulates infections with malaria parasites. PLoS Pathogens. 5 (8), 1000542 (2009).
- Meister, S., et al. Immune signaling pathways regulating bacterial and malaria parasite infection of the mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences U S A. 102 (32), 11420-11425 (2005).
- Telleria, E. L., et al. Caspar-like gene depletion reduces Leishmania infection in sand fly host Lutzomyia longipalpis. Journal of Biological Chemistry. 287 (16), 12985-12993 (2012).
- Sant'Anna, M. R., Alexander, B., Bates, P. A., Dillon, R. J. Gene silencing in phlebotomine sand flies: Xanthine dehydrogenase knock down by dsRNA microinjections. Insect Biochemistry and Molecular Biology. 38 (6), 652-660 (2008).
- Sant'anna, M. R., Diaz-Albiter, H., Mubaraki, M., Dillon, R. J., Bates, P. A. Inhibition of trypsin expression in Lutzomyia longipalpis using RNAi enhances the survival of Leishmania. Parasites and Vectors. 2 (1), 62 (2009).
- Diaz-Albiter, H., Mitford, R., Genta, F. A., Sant'Anna, M. R., Dillon, R. J. Reactive oxygen species scavenging by catalase is important for female Lutzomyia longipalpis fecundity and mortality. PLoS One. 6 (3), 17486 (2011).
- Barrangou, R., et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 315 (5819), 1709-1712 (2007).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Pawelczak, K. S., Gavande, N. S., VanderVere-Carozza, P. S., Turchi, J. J. Modulating DNA Repair Pathways to Improve Precision Genome Engineering. ACS Chemical Biology. 13 (2), 389-396 (2018).
- Martin-Martin, I., Aryan, A., Meneses, C., Adelman, Z. N., Calvo, E. Optimization of sand fly embryo microinjection for gene editing by CRISPR/Cas9. PLoS Neglected Tropical Diseases. 12 (9), 0006769 (2018).
- Meuti, M., Harrell, R. Preparing and Injecting Embryos of Culex Mosquitoes to Generate Null Mutations Using CRISPR/Cas9. JoVE. (163), e61651 (2020).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR-Cas9-Based Genome Editing in the Silverleaf Whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Macias, V. M., et al. Cas9-Mediated Gene-Editing in the Malaria Mosquito Anopheles stephensi by ReMOT Control. Genes, Genomes and Genetics (Bethesda). 10 (4), 1353-1360 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados