Method Article
Yüksek Çözünürlüklü Sağlam Tüm Retina ve Vitreus Görüntüleme için Mikrocerrahi Diseksiyon ve Doku Temizleme
Bu Makalede
Özet
Burada, göz küresinin dış opak/pigmentli katmanlarının cerrahi olarak çıkarıldığı ve retinayı saydam hale getirmek için optik temizlemenin uygulandığı, periferik retina ve hyaloid vaskülatür işlemlerinin ışık tabakası floresan mikroskobu kullanılarak sağlam retinada görüntülenmesini sağlayan sağlam tüm retina görüntüleme protokolü sunulmaktadır.
Özet
Fizyolojik ve patolojik durumlarda retinanın nöronal ve vasküler yapıları, konvansiyonel retinal flat mount preparatları ve kesitlerine kıyasla sağlam tüm retina görüntüleme teknikleri kullanılarak daha iyi görüntülenebilmekte ve karakterize edilebilmektedir. Bununla birlikte, sağlam tüm retinanın immünofloresan görüntülemesi, göz küresinin opak kaplamaları, yani sklera, koroid ve retina pigment epitelinin (RPE) ve retina tabakalarının tam kat yüksek çözünürlüklü optik görüntülemeyi engelleyen ışık saçılma özellikleri tarafından engellenir. Pigmentli tabakaların kimyasal ağartılması ve doku temizleme protokolleri bu engelleri ele almak için tarif edilmiştir; bununla birlikte, şu anda tarif edilen yöntemler, sağlam tüm retinada yeşil floresan proteini (GFP) gibi endojen floresan moleküllerin görüntülenmesi için uygun değildir. Diğer yaklaşımlar, pigmentli tabakaların ve göz küresinin ön segmentinin cerrahi olarak çıkarılmasıyla bu sınırlamayı atlayarak sağlam göz görüntülemesine izin verdi, ancak periferik retina ve hyaloid yapılar bozuldu. Burada, sklera/koroid/retina pigment epitel (RPE) tabakalarının cerrahi diseksiyonu ile modifiye doku temizleme yöntemi ve ışık tabakası floresan mikroskobu (LSFM) kombine edilen sağlam bir tam retina ve vitreus immünofloresan görüntüleme protokolü sunulmuştur. Yeni yaklaşım, patolojik durumlarda retinanın bozulmamış vasküler ve nöronal elemanlarının yanı sıra vitreus ve hyaloid vasküler sistemin eşi görülmemiş bir görünümünü sunmaktadır.
Giriş
Sağlıklı ve hastalık durumlarında retinal, nöronal ve vasküler elemanlar arasındaki etkileşim, geleneksel olarak parafin veya kriyo-fikse retina dokusunun fiziksel bölümleri veya retina düz preparatları üzerinde immünofloresan çalışmalarla araştırılmaktadır1. Bununla birlikte, doku kesiti retina nöronal ve vasküler sürekliliğini bozar ve komşu retina bölümlerinin üç boyutlu rekonstrüksiyonu olası bir çözüm olarak önerilse de, yine de hatalara ve artefaktlara tabidir. Retina düz montaj preparatları ayrıca retinal, vasküler ve nöronal elemanların bütünlüğünü ve bitişik retina alanları arasındaki coğrafi bağlantıyı belirgin şekilde bozar2. Alternatif olarak, retinal, nöronal ve vasküler bileşenlerin üç boyutlu projeksiyonlarını doğal anatomik pozisyonlarındagörselleştirmek için yakın zamanda sağlam tüm retina görüntülemesi tanıtılmıştır 2,3,4,5.
Sağlam tüm retina görüntülemede, sağlam bir tüm retinanın bitişik retina alanlarının (döşemeleri) vasküler ve nöronal elemanlarından gelen floresan sinyaller, bir ışık tabakası mikroskobu kullanılarak yakalanır; Bu karolar daha sonra tüm retina 2,3,4,5,6'nın üç boyutlu bir görüntüsünü yeniden oluşturmak için bir araya getirilir. Bozulmamış tüm retina görüntüleme, retinal vasküler, dejeneratif ve inflamatuar hastalıkların patogenezini incelemek için retinanın benzeri görülmemiş bir görünümünü sağlar 2,3,4,5,6. Örneğin, Prahst ve ark. sağlam bir tüm retinanın canlı görüntülemesini kullanarak oksijen kaynaklı retinopati (OIR) modelinde patolojik vasküler tutamlara, anormal hücre motilitesine ve değişmiş filopodia dinamiklerine daha önce "takdir edilmemiş" bir düğümlü morfoloji ortaya çıkardı2. Benzer şekilde, Henning ve ark., Singh ve ark. ve Chang ve ark. sağlam tüm retinalarda karmaşık üç boyutlu retinal vasküler ağı göstermiştir 3,4,6. Vigouroux ve ark. perinatal dönemderetinanın organizasyonunu ve görsel projeksiyonları göstermek için sağlam bir tüm göz görüntüleme yöntemi kullanmışlardır 5. Retinanın bu tür benzersiz üç boyutlu görüntülerini oluşturabilmek için, sağlam tüm retina görüntüleme protokolleri iki ana sınırlamanın üstesinden gelmiştir: 1) göz küresinin opak ve pigmentli kaplamalarının varlığı (sklera, koroid ve RPE) ve 2) retinal nükleer ve pleksiform tabakaların ışık saçılma özelliklerinin neden olduğu ışığın tam retina kalınlığından sınırlı penetrasyonu. Henning ve ark. ve Vigouroux ve ark. sağlam bir retinayı görüntüleyebilmek için koroid/RPE pigmentlerinin H2O2 ağartmasını uyguladılar 3,5. Bununla birlikte, ağartma, yeşil floresan proteini (GFP) gibi endojen floroforlara sahip hayvan suşları için veya in vivo immünofloresan boyamalardansonra uygun değildir 3,5,7. Ek olarak, Henning ve ark.'nın H2O2 muamelesi yöntemi, retina dekolmanı ile sonuçlanan mikro kabarcıklar oluşturabilen sulu koşullarda gerçekleştirilmiştir. Ayrıca, H2O2 tedavisi 55 ° C'de gerçekleştirildi, bu da doku antikor afinitesini daha da bozan bir durum. Ayrıca, ağartma, oksitlenmiş melanin8'den kaynaklanan ağır otofloresan uygulayabilir. Potasyum permanganat ve oksalik asit kullanan göz kesitleri için diğer depigmentasyon protokolleri, embriyonik kesitlerde RPE pigmentlerini çıkarabilmiştir, ancak bu depigmentasyon yönteminin aynı zamanda immünoetiketlemenin etkinliğini azalttığı gösterilmiştir 9,10. Beyazlatmaya alternatif olarak, Prahst ve ark., Singh ve ark. ve Chang ve ark. mikroskop ışığına ulaşılabilir hale getirmek için sklera ve koroid ve korneayı çıkardılar 2,4,6. Bununla birlikte, kornea, lens ve periferik retinanın çıkarılması, periferik retina ve hyaloid damarları bozabilir ve bozabilir, bu da bu yöntemleri periferik retina ve hyaloid vaskülatürü incelemek için uygun hale getirmeyebilir.
Şu anda mevcut olan tüm sağlam tüm göz görüntüleme protokolleri, retinakatmanları 2,3,4,5'in ışık saçılma özelliklerinin üstesinden gelmek için bir doku optik temizleme adımının kullanımını içerir. Doku optik temizleme, ışık saçılımını ve emilimini en aza indirmek için belirli bir dokunun, burada retinanın tüm hücresel ve hücreler arası elementleri boyunca kırılma indisini eşitleyerek retinayı mikroskop ışığına karşı şeffaf hale getirir11. Göz küresinin pigmentli kaplamaları (koroid ve RPE) yeterince temizlenemediği için retinaya doku optik temizleme uygulanmadan önce koroid ve RPE çıkarılmalı veya ağartılmalıdır6,12,13,14,15,16,17,18.
Prematüre retinopatisi (ROP), persistan fetal vasküler sistem (PFV), Norrie Hastalığı ve Stickler Hastalığı gibi patolojik durumlarda vitreus ve hyaloid vasküler sistemin katılımı ve katkıları en iyi retina ve hyaloid damarların doku hazırlığında bozulmadığı durumlarda çalışılır 19,20,21,22,23. Sağlam tüm retina görüntüleme için mevcut yöntemler ya vitreusu ve damar sistemini doğal olarak bozan gözün ön segmentini çıkarır ya da endojen floroforları uzaklaştırabilen ağartma ajanları uygular. Vitreus gövdesini ve damar sistemini sağlam, el değmemiş durumlarında görselleştirmek için yayınlanmış yöntemler eksiktir. Burada, göz küresinin pigmentli ve opak kaplamalarının cerrahi diseksiyonu, retina için optimize edilmiş modifiye doku optik temizliği ve ışık tabakası floresan mikroskobundan oluşan tüm retina ve vitreus görüntüleme yöntemini tarif ediyoruz. Numune hazırlama, doku optik temizleme, ışık tabakası mikroskobu ve görüntü işleme adımları aşağıda detaylandırılmıştır.
Protokol
Tüm deneyler Teksas Üniversitesi Tıp Şubesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylandı. Hayvan kullanımı ve bakımı, Görme ve Oftalmoloji Araştırmaları Derneği'nin (ARVO) oftalmik ve görme araştırmalarında hayvanların kullanımına ilişkin beyanına uygun olarak yapılmıştır. Bu prosedürü gerçekleştirmek için gerekli tüm malzemeler Malzeme Tablosunda listelenmiştir. Her adımı gerçekleştirirken pudrasız eldiven giyin. 6. ve 7. adımlar için ayrıca resmi mikroskop kullanım kılavuzuna bakın.
1. Hayvanların hazırlanması
- Deney farelerini geçerli Kurumsal Hayvan Bakımı ve Kullanımı Komitesi onaylı protokole uygun olarak ötenazi yapın (burada Ketamin 60 mg / kg ve Deksmedetomidin 0.5 mg / kg kombinasyonu ile anestezi ve ardından servikal çıkık kullanıldı). Hemen hayvanı diseksiyon ve kalp perfüzyonu için bir platformda stabilize etmeye devam edin.
NOT: Deney hayvanları, bireysel çalışma tasarımına göre seçilir. - Kalbi ortaya çıkarmak için karın ve toraksı diseksiyon edin. Sol ventriküle yerleştirilen 27 G'lik bir iğne ile kalbi transfüze ederek kardiyak perfüzyon yapın ve kanın çıkışına izin vermek için sağ atriyumda küçük (~ 1 mm) bir kesi oluşturun24.
- İlk olarak, 30-50 mL buz gibi soğuk fosfat dengeli salin solüsyonu (PBS) ve ardından 30-50 mL taze hazırlanmış% 4 paraformaldehit (PFA) transfüzyonu.
- Başarılı bir PFA transfüzyonu olup olmadığını kontrol etmek için vücutta ve kuyrukta görünür kas seğirmeleri olup olmadığını kontrol edin. Enükleasyon adımına geçin.
2. Göz küresi enükleasyonu ve fiksasyonu
- Göz küresini yuvasından çıkmaya zorlamak için üst veya alt göz kapağını hafifçe itmek için kavisli bir kuyumcu forseps kullanın. Konjonktivayı yandan delmek ve küreyi optik sinir tarafından tutmak için başka bir kuyumcu veya benzeri forseps seti kullanın. Optik sinirden ayrılana kadar küreyi yavaşça yuvasından kaldırın.
- Küreyi taze hazırlanmış buz gibi %4 PFA içeren bir tüpe aktarın. Tüpü buna göre etiketleyin. Dünyanın 4 °C'lik bir buzdolabında 4 saat (gece boyunca) %12 PFA'da kalmasına izin verin.
NOT: Küreyi aktarmak için kesik uçlu plastik bir transfer pipeti kullanın. Keskin kenarlı numuneye zarar vermemek için kesilen ucun açıklığını ikinci bir pipet ucuyla genişletin.
3. Numunenin diseksiyonu (Şekil 1 ve Şekil 2)
- Stereomikroskop altında, kornea-sklera bileşkesini bulun (Şekil 1A) ve kornea-sklera bileşkesinin yaklaşık 0,5-1 mm gerisinde sklerada çok yüzeysel bir kesim yapmak için 30 G'lık bir iğnenin keskin kesici ucunu kullanın (Şekil 1B).
- Keskin uçlu bir diseksiyon makasının bıçaklarından birini, sklera / koroid / RPE ile retina arasındaki potansiyel boşluğa yeni yapılan kesiden ilerletin (Şekil 1C). Makası ilerletin ve sklera/koroid/RPE retinanın dış yüzeyinden soyulabilene kadar çevresel olarak kesin (Şekil 1D,E).
NOT: Retinanın delinmesini önlemek için bu adımı yavaş ve nazikçe gerçekleştirmek önemlidir. İlk birkaç kesi, retinayı kesmekten kaçınmak için özellikle kritiktir. - Gerekirse, çevresel kesme işlemini ve ardından optik sinirin ve sklera/koroid/RPE'nin soyulmasını kolaylaştırmak için sklera/koroid/RPE üzerinde radyal rahatlatıcı kesimler yapın. PBS'ye batırılmış 1 numara bir boyama fırçası kullanarak küçük RPE lekelerini (Şekil 1F) çıkarın.
- Sağlam göz küresinin tamamını PBS içeren bir tüpe aktarın. Hemen bir sonraki adıma geçin veya immün etiketleme için 4 °C'de muhafaza edin.
NOT: Enükleasyondan sonra göz küresine işaretler yerleştirilebilir ve ardından gerekirse gözün yönünü korumak için diseksiyondan sonra göz küresine yerleştirilebilir. Protokol burada duraklatılabilir ve numuneler sonraki adımlara geçmeden önce 4 °C'lik bir buzdolabında gece boyunca saklanabilir.
4. Vasküler boyama
- Dokuyu oda sıcaklığında 20 dakika boyunca %0.2 Tween-20 içeren PBS'ye daldırarak geçirgen hale getirin.
- Numuneyi PBS ile 10 dakika boyunca bir çalkalayıcı üzerinde 3 kez yıkayın.
- Numuneyi% 0.25 Triton X-100 içeren PBS'de% 5 normal keçi serumu (NGS) ile oda sıcaklığında 1 saat inkübe edin.
- Birincil antikor ile gece boyunca 4 ° C'de inkübe edin. Burada, bir anti-fare Kollajen IV antikoru kullanıldı (nihai konsantrasyon% 0.2 Tween-20 içeren PBS'de hazırlandı).
- PBS ile 3 kez, yıkama başına 5 dakika yıkayın.
- Numuneyi floresan etiketli ikincil antikorlarla inkübe edin. Burada, bir anti-tavşan Alexa Fluor 568, 4 ° C'de 12 saat boyunca kullanıldı (% 0.2 Tween-20 içeren PBS'de 1:200 seyreltme).
- PBS ile her biri 1 saat boyunca 3 kez yıkayın ve ardından doku temizleme adımlarına devam edin.
5. 2,2" -tiyodietanol (TDE) ile optik temizleme
- %10, %20, %30, %40, %50 ve %60 hacim-hacim (h/v) nihai konsantrasyon için PBS'li stok TDE solüsyonu kullanarak çalışma TDE konsantrasyonlarını hazırlayın. Dokuya nüfuz etmek için yeterli fazla hacim sağlamak için her göz örneği için en az 2 mL solüsyon hazırlayın.
- Numuneleri, artan TDE konsantrasyonunda 6 veya 12 oyuklu bir plaka kuyusunda inkübe edin. Sağlam bütün gözbebeklerini oda sıcaklığında bir çalkalayıcı üzerinde 2-4 saat boyunca %10 TDE solüsyonuna batırarak başlayın. Art arda numuneyi her TDE konsantrasyonunda 2-4 saat boyunca daha yüksek bir TDE konsantrasyonuna aktarın (Şekil 2C).
NOT: Retina %40-50 konsantrasyonlarda temizlenmeye başlar, ancak maksimum temizleme% 60'lık bir çözelti içinde inkübasyondan sonra gerçekleşir. Retina %70 ve daha yüksek konsantrasyonlarda daha az saydam hale gelir (Şekil 2D). - Gerekirse, birbirini izleyen takas borsası adımlarından herhangi birinde takas sürecini gece boyunca durdurun.
6. Işık tabakası mikroskobu kullanarak tüm göz görüntüleme
- Kullanılan ışık tabakası mikroskop platformunun konfigürasyonunu göz önünde bulundurarak sağlam tüm göz örneklerini monte edin. Işık tabakası hizalaması ve optik yolların aydınlatılması ve algılanması dahil olmak üzere toplama parametrelerini ayarlamak için mikroskop ve edinme yazılımı talimatlarını izleyin.
NOT: Bu deneyde kullanılan örnekler, kornea tarafından hipodermik bir iğnenin ucuna bir insülin şırıngası üzerine yapıştırılmıştır (Şekil 2E). Numune daha sonra mikroskop odasının içinde askıya alındı. - Mikroskop odasını temizleme çözeltisi olarak% 60 TDE ile doldurun.
- Numuneyi ışık tabakası mikroskop odasına %60 TDE çözeltisine (son temizleme konsantrasyonu) daldırın.
- Temizlenmiş gözü çeşitli ticari veya özel yapım konfokal ve ışık tabakası mikroskopları aracılığıyla görüntüleyin. Bu protokolde, çift taraflı aydınlatmalı ışık tabakası mikroskobu kullanılmaktadır.
- Özellikle döşeme ile birleştirildiğinde hücresel morfolojiyi ve hücresel süreç izlemeyi görüntülemek için düşük çözünürlüklü ve düşük büyütmeli görüntüleme (5x, NA 0.16) kullanın. Hem hücresel morfolojiyi hem de çekirdekler ve mitokondriyal kümeler gibi büyük hücre altı organelleri görüntülemek için yüksek çözünürlüklü ve büyütmeli görüntüleme (20x, NA 1.0) kullanın.
7. Edinme sonrası görüntü işleme
NOT: Edinme sonrası işlem, dosyanın türüne ve görüntülenen dosyalarla uyumlu yazılıma bağlıdır.
- Görüntülenen döşemeleri birleştirmeden önce ham görüntüleri daha da artırmak için bulanıklaştırma veya evrişim giderme uygulayın. Görüntülerin bulanıklığını gidermek için bir Weiner filtresi uygulanabilir. Alternatif olarak, Richardson-Lucy evrişim giderme ve ImageJ PSF jeneratör eklentisi25 gibi modelleme araçları kullanılarak teorik veya deneysel olarak ölçülen bir PSF ile gürültü giderme işleminden sonra görüntüler yinelemeli olarak dekonvolüsyon yapılabilir.
- Çeşitli ticari veya kamu malı yazılım paketlerini (ImageJ – BigStitcher eklentisi) kullanarak önceden işlenmiş z-yığınlarının birleştirilmesini ve afin ve rijit olmayan hacim dönüşümlerini ve ardından çoklu görünüm hacim kaydını ve füzyonunu gerçekleştirin26.
Sonuçlar
Peripapiller vasküler ağ ve mikroglia'nın sıfır açılı izdüşümü Şekil 3A'da gösterilmiştir. Ayrıca, bir CX3CR1-GFP faresindeki bozulmamış tüm retina mikroglia dağılımı Şekil 3B'de sunulmuştur. Burada sunulan yöntemin önemli bir avantajı, doğuştan gelen floroforları görüntüleme yeteneğidir. Şekil 3C,D, mevcut bozulmamış tüm göz görüntüleme yöntemi (Şekil 3C) ve düz montaj hazırlıkları (Şekil 3D) ile hazırlanan örneklerden elde edilen temsili Z projeksiyonlarında (yeşil kanal) mikrogliayı göstermektedir. Mikroglia, bozulmamış tüm retina ve düz montaj preparatlarından rastgele seçilen ilgi bölgelerinde ölçüldü ve karşılaştırıldı. Mikroglia sayıları açısından düz mount ve sağlam tüm retina görüntüleme arasında istatistiksel olarak anlamlı bir fark gözlenmedi (Şekil 3E). Şekil 3'teki tüm temsili görüntüler CX3CR1-GFP fare retinasından alınmıştır.
Mevcut bozulmamış tüm retina görüntüleme protokolü kullanılarak görüntülenen bir CX3CR1-GFP fare retinasındaki GFP etiketli mikroglia (yeşil kanal) ve vasküler ağ (kırmızı kanal), Ek Video 1'de daha ayrıntılı olarak açıklanmaktadır. Koroid ve RPE pigmentasyonunu gidermek için Henning ve ark.3 ve Vigouroux ve ark.5 tarafından kullanılan pigment ağartma yöntemleri kullanılsaydı, endojen ve in vivo boyama floroforları ağartılırdı. Ek Video 2, hyaloid damarların ve retrolental vasküler pleksusun doğal haldeki görünümünü göstermektedir. Prahst ve ark.2 ve Chang ve ark.4 tarafından tarif edildiği gibi gözün ön segmentinin çıkarılmasının hyaloid damarları rahatsız edeceği de belirtilmelidir.

Şekil 1: Sklera/koroid/retina pigment epitelinin diseksiyonu. (A-F) Dış opak ve pigmentli tabakaların çıkarılması, çevredeki pigmentli yapılardan etkilenmeden retina ve vitreus boşluğunun yüksek çözünürlüklü optik görüntülemesine izin verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Sağlam tüm göz görüntülemesi için numune hazırlama. (A) Örneklemeden sonra, göz küresi opak sklera, koroid ve RPE ile kaplandı. (B) Opak sklera/koroid/RPE diseke edildi, ancak retina dokusu mikroskobik görüntüleme için hala nispeten optik olarak opaktı. (C) Artan TDE konsantrasyonlarına art arda daldırma, numuneyi berrak hale getirdi. Numune berraklaştıktan (D) sonra, yüksek çözünürlüklü görüntüleme için ışıklı levha mikroskop platformuna monte edildi. (E) Bu deneyde kullanılan ışık tabakası mikroskop sistemi için, sağlam tüm retina, siyanoakrilat yapıştırıcı kullanılarak bir şırınga üzerindeki hipodermik bir iğnenin ucuna monte edildi. Numune daha sonra, temizleme maddesinin son konsantrasyonu ile doldurulmuş olan görüntüleme odasının içine yerleştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
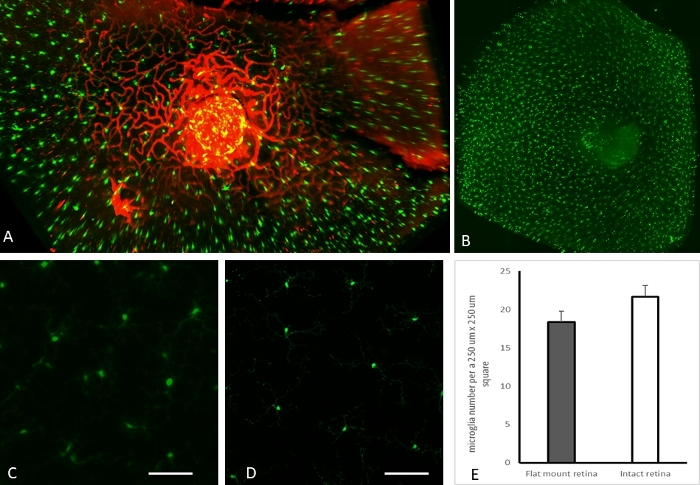
Şekil 3: Sağlam tüm retina görüntülemesi için temsili sonuçlar. (A) 8 aylık bir dişi CX3CR1-GFP faresinde sağlam tüm retinada peripapiller vasküler ağın ve mikroglianın sıfır açılı projeksiyonu. (B) 8 aylık bir dişi CX3CR1-GFP faresinden alınan sağlam bir tüm retinada mikroglia dağılımını gösteren yeşil kanalın düz projeksiyonu. Periferik retina, fincan şeklindeki sağlam retinanın bu düz projeksiyonunda bozuldu. (C-D). Her ikisi de 8 aylık dişi CX3CR1-GFP farelerinden (ölçek çubuğu 50 μm) sağlam bir tam retina taramasından (C) ve düz montaj hazırlığından (D) temsili 250 μm x 250 μm kare düz projeksiyon. (E) Işık tabakası floresan mikroskobu kullanılarak bozulmamış tüm retina görüntülemeye karşı düz montaj preparatlarında retinal mikroglia sayımı: Mikroglia ölçümü için orta periferik retinadan rastgele üç ilgi alanı (ROI) seçildi. Her bir ROI için yeşil kanalda tüm retina kalınlığının ortogonal projeksiyonları hazırlandı. Mikroglia sayıları ImageJ içinde sayıldı. İki kuyruklu bir Student'ın t-testi, düz montajlı ve sağlam tüm göz preparatlarındaki mikroglia sayısında istatistiksel olarak anlamlı bir fark göstermedi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek video 1: CX3CR1-GFP farenin bozulmamış tüm retina görüntülemesi. Retina damarları bir bütün olarak görüntülendi. Görüntüleme koroid/RPE pigment beyazlatma yapılmadan yapıldı. Bu GFP etiketli farede (ve doğuştan gelen floroforlu benzer suşlarda), koroid / RPE ağartma, GFP etiketli mikroglia sinyallerini ortadan kaldırmış olacaktır. Bu videoda, retinal mikroglia dağılımının üç boyutlu tasviri, bu yöntemin mikroglia dağılımını ve aktivasyonunu tespit etmedeki gücünü vurgulamaktadır. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek video 2: 4 günlük bir farede hyaloid vasküler sistem sistemi ve retrolental vasküler pleksus. Kornea, iris ve lens dahil olmak üzere göz küresinin ön segmenti çıkarılmadı, bu da vitreus boşluğuna ve damar sistemine dokunulmadı. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Retina ve vitreus gelişimi ve patolojileri en iyi, retinanın kesitler veya düz montaj hazırlıkları için kesilmediği sağlam tüm retina görüntüleme teknikleriyle incelenir. Mevcut sağlam tüm göz görüntüleme yöntemleri ya doğuştan gelen floroforları ortadan kaldıran pigment ağartmayı içerir ya da periferik retina ve vitreus gövdesini bozabilecek gözün ön segmenti ile birlikte göz küresinin opak kaplamalarının (RPE, koroid ve sklera) fiziksel olarak çıkarılmasını içerir. Chang ve ark. ve Prahst ve ark. göz küresinin dış kaplamalarının yanı sıra korneayı da çıkardılar, böylece muhtemelen vitreus gövdesini ve hyaloid vaskülatürü ve periferik retinayı bozdu 2,4. Bu nedenle, yöntemleri retina ve vitreus gelişiminin hücresel özelliklerini ve hyaloid vaskülatürleri içeren patolojileri incelemek için uygun olmayabilir. Alternatif olarak, Henning ve ark. ve Vigouroux ve ark. mikroskobik görüntüleme için koroid ve RPE'yi şeffaf hale getirmek için bir teknik olarak pigment ağartmayı kullandılar 3,5. Bununla birlikte, pigment ağartma GFP'yi ortadan kaldırır ve diğer doğuştan / endojen floroforların yanı sıra görüntülemeprobları 7 olarak in vivo boyama için kullanılan floroforların performansını tehlikeye atabilir. Burada tanıtılan yöntemde beyazlatma kullanılmadı ve kornea, iris ve lense dokunulmadan bırakılırken sklera, koroid ve RPE diseke edildi ve gözün ön segmenti, periferik retina ve hyaloid damarların bozulmamış durumda görüntülenmesine izin verildi.
Persistan fetal vaskülatür (PFV) ve prematüre retinopatisi (ROP) gibi hastalıklarda hyaloid damarların görüntülenmesi için tanımlanan mevcut yöntemler, vitreus gövdesini ve kaçınılmaz olarak hyaloid vaskülatürü bozan gözün ön segmentinin diseksiyonunu içerir22,23. Bu yöntemlerin aksine, mevcut protokol hyaloid ve retrolental vaskülatürü bozmaz, böylece Ek Video 2'de gösterildiği gibi sağlam hyaloid vaskülatürünün görselleştirilmesine izin verir.
Yukarıda özetlenen yöntem de dahil olmak üzere, bozulmamış tüm göz görüntüleme için mevcut tüm yöntemler, ışık saçılımını ve emilimini en aza indirmek için bir dokunun kırılma indisini çevreleyen ortamla eşleştiren bir işlem olan doku optik temizlemeyi içerir11,27. Üç ana doku temizleme yaklaşımı, dokuyu temizlemek için kullanılan ajana bağlı olarak hidrofobik, hidrofilik ve hidrojel bazlı yöntemleri içerir 13,27,28,29,30,31. Bu doku temizleme tekniklerinin çeşitli maddeleri, daha önce tarif edilen bozulmamış tüm göz görüntüleme yöntemlerinde başarıyla kullanılmıştır, ancak hepsi zaman alıcıdır ve 3 ila 7 gün sürer 4,5. Burada ayrıntıları verilen protokol, daha önce tarif edilen 2,2'-tiyodietanol (TDE) değişim yönteminin retina dokusuna32 uyacak şekilde bir modifikasyonunu kullanır. Mevcut protokolde, sağlam tüm retina / vitreus, dokunun kırılma indisini kademeli olarak eşitlemek ve iki günden daha kısa sürede berrak hale getirmek için art arda artan bir TDE konsantrasyonuna daldırıldı. TDE, yüksek kırılma indisi çözeltisinin dokuya nüfuz etmesine izin vermek için bir konsantrasyon gradyanı oluşturmayı mümkün kılan herhangi bir oranda su ile karışabilen bir glikol türevi hidrofilik temizleme maddesidir. TDE, CLARITY ve CUBIC33 gibi diğer bazı temizleme yöntemlerinden farklı olarak çeşitli floroforların floresansını söndürmez. Ek olarak, TDE, benzil benzoat/benzil alkol (BABB) gibi organik solvent bazlı temizleme maddelerinde olduğu gibi ekipmana zarar verme potansiyeline sahip değildir. Ayrıca, fruktoz bazlı SeeDB temizleme yöntemi33 ile gözlemlenen kirletici organizmaların büyümesini de önler.
Işık Tabakası Floresan Mikroskobu, kalın dokuları görüntülemek için yüksek zamansal ve uzamsal çözünürlüğe sahip etkili bir araçtır 2,3,4,5,6,34. LSFM'de, floroforları yalnızca ince bir görüntüleme düzleminde uyarmak için ince bir ışık tabakası numune boyunca yönlendirilir ve bu da daha düşük fototoksisite ve fotoağartma, daha hızlı görüntüleme ve minimum odak dışı uyarma nedeniyle daha yüksek kontrast sağlar. Burada tarif edildiği gibi diseke edilmiş ve optik olarak temizlenmiş tüm murin gözlerinin görüntülenmesi, piyasada bulunan birçok LSFM veya konfokal mikroskoptan biri kullanılarak gerçekleştirilebilir. Mevcut yöntemde LSFM, retinal nöronların ve damarların hızlı ve ayrıntılı bir görünümünü sunar ve mikroglia yoğunluğunun kantitatif bir analizini sağlar.
Mevcut yöntem, diseksiyon sırasında RPE'nin çıkarılması nedeniyle fotoreseptör-RPE etkileşimini göstermede sınırlıdır. Bu tür bir etkileşim, ağartma kullanan ve diseksiyonu atlayan yöntemlerle daha iyi incelenebilir 3,5. Doku büzülmesi ve olası distorsiyon, burada açıklanan yöntem de dahil olmak üzere tüm doku fiksasyon ve temizleme yöntemlerinin doğal sınırlamalarıdır. Mevcut ve diğer benzer yöntemlerle elde edilen sonuçlar yorumlanırken bu sınırlamalar kabul edilmelidir. Bu yöntemin başarısına katkıda bulunan iki kritik adım, optik temizleme ajanı olarak TDE uygulaması ile birlikte retinaya zarar vermeden oküler kaplamaların iyi bir cerrahi diseksiyonunu içerir. Küçük bir kemirgen gözünde sklera / koroid / RPE tabakalarının diseksiyonu teknik olarak zor olabilir ve periferik retinayı veya gözün ön segmentini kesmekten kaçınılmalıdır. Bu tekniğe hakim olmak, retina düz montaj hazırlığında kullanılan aynı beceri setini gerektirir ve deneyimlerimize göre, yukarıda açıklanan diseksiyon adımlarını üç ila beş göz üzerinde gerçekleştirdikten sonra temel el becerisi elde edilebilir. Yöntemin daha büyük hayvan (tavşan gibi) gözlerine uygulanması gerekiyorsa, her temizleme adımı için kuluçka süresi değiştirilebilir. Primer ve sekonder antikorların vitreus boşluğuna enjekte edilmesiyle modifiye edilmiş bir immünoetiketleme tekniği ile hyaloid damarın daha iyi lekelenip lekelenmediğinin gelecekte araştırılması gerekmektedir.
Özetle, burada açıklanan yöntem, sağlam bir tüm retina ve vitreusta doğuştan gelen ve in vivo boyama floroforları dahil olmak üzere moleküler ve yapısal hedeflerin görüntülenmesini sağlayan yüksek çözünürlüklü tüm retina görüntüleme için daha önce açıklanan tekniklerin daha da geliştirilmesine dayanmaktadır. Bu yöntem, mevcut sağlam tüm retina hazırlama yöntemlerinin birçok sınırlamasını ele alırken, sağlam retinadaki hyaloid vaskülatürünün benzeri görülmemiş bir şekilde görüntülenmesi için yeni bir yaklaşım sunar.
Açıklamalar
İlgili ticari çıkar çatışması yok.
Teşekkürler
Bu çalışma Texas Üniversitesi Tıp Şubesi'nde yapılmıştır. Yazarlar Harald'ı takdir ediyor
Junge, PhD, Debora Ferrington, PhD ve Heidi Roehrich, Minnesota Üniversitesi, Şekil 1 ve film 2'nin hazırlanmasındaki yardımları için. LO, NIEHS T32 Eğitim Hibe T32ES007254 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Experimental animal | |||
| CX3CR1-GFP Mouse | The Jackson Laboratory | 5582 | |
| Anesthetic | |||
| Dexmedetomidine | Par Pharmaceutical | 42023-146-25 | |
| Ketamine | Fresenius Kabi | ||
| Tissue harvesting, fixation, and sample dissection | |||
| cardiac perfusion pump | Fisher scientific | NC9069235 | |
| Cyanoacrylate superglue | amazon.com | ||
| Fine scissors-sharp | Fine Science Tools | 14160-10 | |
| Fine tweezers | Fine Science Tools | 11412-11 | |
| Paraformaldehyde (PFA) | Electrone microscopy sciences | 15710-S | |
| Phosphate buffered saline (PBS) | Gibco | 10010049 | |
| size 1 painting brush | dickblick.com | ||
| straight spring scissors | Fine Science Tools | 15000-03 | |
| syringe, needle tip, 27 gauge x 1.25" | BD | ||
| Tubes 1.5 ml, 15 ml, 50 ml | Thermo sceintific | ||
| Tween-20 | ThermoFisher | 85114 | |
| Immunofluorescent staining | |||
| Anti-mouse collagen IV antibody | Abcam | ab19808 | 1:200 dilution |
| Anti-rabbit Alexa Fluor 568 | Invitreogen | A-11011 | 1:200 dilution |
| Normal goat serum | ThermoFisher | 50062Z | 10% concentration |
| Tissue clearing | |||
| 2,2′-thiodiethanol (TDE) | Fluka analytica | STBD7772V | |
| Rocking shaker | Fisher scientific | 02-217-765 | |
| Microscopy | |||
| Fluorescent microspheres | TetraSpeck | T14792 | |
| Light sheet fluorescent microscope (LSFM) | Zeiss | Z1 | |
| Microglia enumeration | |||
| ImageJ | National Institue of Health |
Referanslar
- Usui, Y., et al. Neurovascular crosstalk between interneurons and capillaries is required for vision. Journal of Clinical Investigation. 125, 2335-2346 (2015).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779 (2020).
- Henning, Y., Osadnik, C., Malkemper, E. P. EyeCi: Optical clearing and imaging of immunolabeled mouse eyes using light-sheet fluorescence microscopy. Experimental Eye Research. 180, 137-145 (2019).
- Chang, C. C., et al. Selective Plane Illumination Microscopy and Computing Reveal Differential Obliteration of Retinal Vascular Plexuses. bioRxiv. , (2020).
- Vigouroux, R. J., César, Q., Chédotal, A., Nguyen-Ba-Charvet, K. T. Revisiting the role of DCC in visual system development with a novel eye clearing method. eLife. 9, 51275 (2020).
- Singh, J. N., Nowlin, T. M., Seedorf, G. J., Abman, S. H., Shepherd, D. P. Quantifying three-dimensional rodent retina vascular development using optical tissue clearing and light-sheet microscopy. Journal of Biomedical Optics. 22, 076011 (2017).
- Kim, S. Y., Assawachananont, J. A new method to visualize the intact subretina from retinal pigment epithelium to retinal tissue in whole mount of pigmented mouse eyes. Translational Vision Science and Technology. 5, 1-8 (2016).
- Kayatz, P., et al. Oxidation causes melanin fluorescence. Investigative Ophthalmology and Visual Science. 42, 241-246 (2001).
- Iwai-Takekoshi, L., et al. Retinal pigment epithelial integrity is compromised in the developing albino mouse retina. Journal of Comparative Neurology. 524, 3696-3716 (2016).
- Alexander, R. A., Cree, I. A., Foss, A. J. The immunoalkaline phosphatase technique in immunohistochemistry: the effect of permanganate-oxalate melanin bleaching upon four final reaction products. British Journal of Biomedical Science. 53, 170-171 (1996).
- Ueda, H. R., et al. Whole-Brain Profiling of Cells and Circuits in Mammals by Tissue Clearing and Light-Sheet Microscopy. Neuron. 106, 369-387 (2020).
- Hillman, E. M. C., Voleti, V., Li, W., Yu, H. Light-Sheet Microscopy in Neuroscience. Annual Review of Neuroscience. 42, 295-313 (2019).
- Jing, D., et al. Tissue clearing of both hard and soft tissue organs with the pegasos method. Cell Research. 28, 803-818 (2018).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159, 911-924 (2014).
- Hohberger, B., Baumgart, C., Bergua, A. Optical clearing of the eye using the See Deep Brain technique. Eye. 31, 1496-1502 (2017).
- Kuwajima, T., et al. ClearT: A detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development (Cambridge). 140, 1364-1368 (2013).
- Lee, H., Park, J. H., Seo, I., Park, S. H., Kim, S. Improved application of the electrophoretic tissue clearing technology, CLARITY, to intact solid organs including brain, pancreas, liver, kidney, lung, and intestine. BMC Developmental Biology. 14, 48 (2014).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13, 859-867 (2016).
- Hegde, S., Srivastava, O. Different gene knockout/transgenic mouse models manifesting persistent fetal vasculature: Are integrins to blame for this pathological condition. Life Sciences. 171 (15), 30-38 (2016).
- Hartnett, M. E., Penn, J. S. Mechanisms and Management of Retinopathy of Prematurity. New England Journal of Medicine. 367, 2515-2526 (2012).
- Pierce, E. A., Foley, E. D., Smith, L. E. H. Regulation of vascular endothelial growth factor by oxygen in a model of retinopathy of prematurity. Archives of Ophthalmology. 114, 1219-1228 (1996).
- Ash, J., McLeod, D. S., Lutty, G. A. Transgenic expression of leukemia inhibitory factor (LIF) blocks normal vascular development but not pathological neovascularization in the eye. Molecular Vision. 11, 298-308 (2005).
- Reichel, M. B., et al. High frequency of persistent hyperplastic primary vitreous and cataracts in p53-deficient mice. Cell Death and Differentiation. 5, 156-162 (1998).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), 3564 (2012).
- Kirshner, H., Aguet, F., Sage, D., Unser, M. 3-D PSF fitting for fluorescence microscopy: Implementation and localization application. Journal of Microscopy. 249, 13-25 (2013).
- Hörl, D., et al. BigStitcher: reconstructing high-resolution image datasets of cleared and expanded samples. Nature Methods. 16, 870-874 (2019).
- Susaki, E. A., Ueda, H. R. Whole-body and Whole-Organ Clearing and Imaging Techniques with Single-Cell Resolution: Toward Organism-Level Systems Biology in Mammals. Cell Chemical Biology. 23, 137-157 (2016).
- Tian, B., et al. Efficacy of novel highly specific bromodomain-containing protein 4 inhibitors in innate inflammation–driven airway remodeling. American Journal of Respiratory Cell and Molecular Biology. 60, 68-83 (2019).
- Zaman, R. T., et al. Changes in morphology and optical properties of sclera and choroidal layers due to hyperosmotic agent. Journal of Biomedical Optics. 16, 077008 (2011).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10, 508-513 (2013).
- Renier, N., et al. IDISCO: A simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159, 896-910 (2014).
- Costantini, I., et al. A versatile clearing agent for multi-modal brain imaging. Scientific Reports. 5, 9808 (2015).
- Aoyagi, Y., Kawakami, R., Osanai, H., Hibi, T., Nemoto, T. A rapid optical clearing protocol using 2,2'-thiodiethanol for microscopic observation of fixed mouse brain. PLoS One. 10, 0116280 (2015).
- Icha, J., et al. Using Light Sheet Fluorescence Microscopy to Image Zebrafish Eye Development. Journal of Visualized Experiments. (110), e53966 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır