Method Article
Dissecção microcirúrgica e limpeza de tecidos para imagens de retina inteira e vítreo intactas de alta resolução
Neste Artigo
Resumo
Apresentado aqui é um protocolo para imagem de retina inteira intacta em que as camadas externas opacas / pigmentadas do globo ocular são removidas cirurgicamente e a limpeza óptica é aplicada para tornar a retina transparente, permitindo a visualização da retina periférica e da vasculatura hialóide na retina intacta usando microscopia fluorescente de folha de luz.
Resumo
As estruturas neuronais e vasculares da retina em condições fisiológicas e patológicas podem ser melhor visualizadas e caracterizadas usando técnicas de imagem de retina inteira intacta em comparação com as preparações e cortes convencionais de montagem plana da retina. No entanto, a imagem imunofluorescente de toda a retina intacta é prejudicada pelos revestimentos opacos do globo ocular, ou seja, esclera, coroide e epitélio pigmentar da retina (EPR) e pelas propriedades de dispersão de luz das camadas da retina que impedem imagens ópticas de alta resolução de espessura total. O branqueamento químico das camadas pigmentadas e os protocolos de limpeza de tecidos foram descritos para resolver esses obstáculos; no entanto, os métodos atualmente descritos não são adequados para imagens de moléculas fluorescentes endógenas, como a proteína fluorescente verde (GFP) em toda a retina intacta. Outras abordagens contornaram essa limitação pela remoção cirúrgica das camadas pigmentadas e do segmento anterior do globo ocular, permitindo imagens oculares intactas, embora a retina periférica e as estruturas hialóides tenham sido interrompidas. Apresentamos aqui um protocolo de imagem imunofluorescente de retina inteira intacta e vítreo que combina dissecção cirúrgica das camadas de esclera / coróide / epitélio pigmentar da retina (RPE) com um método de limpeza de tecido modificado e microscopia fluorescente de folha de luz (LSFM). A nova abordagem oferece uma visão sem precedentes dos elementos vasculares e neuronais não perturbados da retina, bem como do sistema vascular vítreo e hialoide em condições patológicas.
Introdução
A interação entre os elementos neuronais e vasculares da retina em estados saudáveis e de doença é tradicionalmente explorada por estudos de imunofluorescência em seções físicas de tecido de retina fixado em parafina ou crio-fixada ou em preparações planas de retina1. No entanto, a secção de tecido interrompe a continuidade neuronal e vascular da retina e, embora a reconstrução tridimensional das seções adjacentes da retina seja sugerida como uma possível solução, ela ainda está sujeita a erros e artefatos. As preparações de montagem plana da retina também perturbam acentuadamente a integridade dos elementos vasculares e neuronais da retina e a conexão geográfica entre as áreas retinianas adjacentes2. Alternativamente, a imagem de retina inteira intacta foi recentemente introduzida para visualizar as projeções tridimensionais dos componentes neuronais e vasculares da retina em sua posição anatômica natural 2,3,4,5.
Na imagem de retina inteira intacta, os sinais fluorescentes dos elementos vasculares e neuronais das áreas adjacentes da retina (telhas) de uma retina inteira intacta são capturados usando um microscópio de folha de luz; Esses ladrilhos são então "costurados" para reconstruir uma visão tridimensional de toda a retina 2,3,4,5,6. A imagem de retina inteira intacta fornece uma visão sem precedentes da retina para estudar a patogênese das doenças vasculares, degenerativas e inflamatórias da retina 2,3,4,5,6. Por exemplo, Prahst et al. revelaram uma morfologia de nó anteriormente "não apreciada" para tufos vasculares patológicos, motilidade celular anormal e dinâmica de filopódios alterada em um modelo de retinopatia induzida por oxigênio (OIR) usando imagens ao vivo de uma retina inteira intacta2. Da mesma forma, Henning et al., Singh et al. e Chang et al. demonstraram a complexa rede vascular tridimensional da retina em retinas inteiras intactas 3,4,6. Vigouroux et al. usaram um método de imagem de olho inteiro intacto para mostrar a organização da retina e as projeções visuais no período perinatal5. Para poder criar visualizações tridimensionais incomparáveis da retina, os protocolos de imagem de retina inteira intacta superaram duas limitações principais: 1) a presença de revestimentos opacos e pigmentados do globo ocular (esclera, coróide e EPR) e 2) a penetração limitada da luz através da espessura total da retina causada pelas propriedades de dispersão de luz das camadas nuclear e plexiforme da retina. Henning et al. e Vigouroux et al. aplicaram o clareamento H2O2 dos pigmentos coróide/EPR para poder obter imagens de uma retina intacta 3,5. No entanto, o branqueamento não é adequado para cepas animais com fluoróforos endógenos, como proteína fluorescente verde (GFP) ou após colorações imunofluorescentes in vivo 3,5,7. Além disso, o método de Henning et al. de tratamento com H2O2 foi realizado em condições aquosas que podem gerar microbolhas que resultam em descolamento de retina. Além disso, o tratamento com H2O2 foi realizado a 55 °C, uma condição que deteriora ainda mais a afinidade dos anticorpos teciduais. Além disso, o branqueamento pode introduzir autofluorescência pesada originada da melanina oxidada8. Outros protocolos de despigmentação para seções oculares usando permanganato de potássio e ácido oxálico foram capazes de remover pigmentos de EPR em cortes embrionários, mas esse método de despigmentação também demonstrou reduzir a eficácia da imunomarcação 9,10. Como alternativa ao clareamento, Prahst et al., Singh et al. e Chang et al. removeram esclera, coróide e córnea para tornar toda a retina acessível à luz do microscópio 2,4,6. No entanto, a remoção da córnea, do cristalino e da retina periférica pode distorcer e romper a retina periférica e os vasos hialóides, tornando esses métodos inadequados para estudar a retina periférica e a vasculatura hialóide.
Todos os protocolos de imagem de olho inteiro intactos atualmente disponíveis incluem o uso de uma etapa de limpeza óptica do tecido para superar as propriedades de dispersão de luz das camadas retinianas 2,3,4,5. A limpeza óptica do tecido torna a retina transparente à luz do microscópio, equalizando o índice de refração de um determinado tecido, aqui a retina, em todos os seus elementos celulares e intercelulares para minimizar a dispersão e absorção de luz11. A coroide e o EPR devem ser removidos ou branqueados antes que a limpeza óptica do tecido seja aplicada à retina, pois os revestimentos pigmentados do globo ocular (coróide e EPR) não podem ser suficientemente limpos 6,12,13,14,15,16,17,18.
A participação e as contribuições do sistema vascular vítreo e hialoide em condições patológicas como retinopatia da prematuridade (ROP), vasculatura fetal persistente (VPP), doença de Norrie e doença de Stickler são mais bem estudadas quando a retina e os vasos hialoides não são rompidos na preparação do tecido 19,20,21,22,23. Os métodos existentes para imagens de retina inteira intacta removem o segmento anterior do olho, o que naturalmente interrompe o vítreo e sua vasculatura, ou aplicam agentes clareadores, que podem remover fluoróforos endógenos. Faltam métodos publicados para visualizar o corpo vítreo e a vasculatura em sua condição intacta e intocada. Descrevemos aqui um método de imagem de retina e vítreo completo que consiste na dissecção cirúrgica de revestimentos pigmentados e opacos do globo ocular, uma limpeza óptica de tecido modificada otimizada para retina e microscopia fluorescente de folha de luz. As etapas de preparação de amostras, limpeza óptica de tecidos, microscopia de folha de luz e processamento de imagem são detalhadas abaixo.
Protocolo
Todos os experimentos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Divisão Médica da Universidade do Texas (IACUC). O uso e os cuidados com os animais estavam de acordo com a declaração da Association for Research in Vision and Ophthalmology (ARVO) para o uso de animais em pesquisas oftalmológicas e de visão. Todos os materiais necessários para realizar este procedimento estão listados na Tabela de Materiais. Use luvas sem pó ao executar cada etapa. Para as etapas 6 e 7, consulte também o manual de operação oficial do microscópio.
1. Preparação dos animais
- Eutanasiar os camundongos experimentais de acordo com o protocolo aprovado pelo Comitê Institucional de Cuidados e Uso de Animais aplicável (anestesia com uma combinação de cetamina 60 mg / kg e dexmedetomidina 0,5 mg / kg seguida de luxação cervical foi usada aqui). Proceda imediatamente à estabilização do animal em uma plataforma para dissecção e perfusão cardíaca.
NOTA: Os animais experimentais são escolhidos com base no desenho do estudo individual. - Disseque o abdômen e o tórax para expor o coração. Realizar a perfusão cardíaca por transfusão do coração através de uma agulha 27 G colocada no ventrículo esquerdo e criar uma pequena incisão (~1 mm) no átrio direito para permitir a saída de sangue24.
- Primeiro, transfunda 30-50 mL de solução salina balanceada de fosfato gelado (PBS) e, em seguida, 30-50 mL de paraformaldeído a 4% (PFA) recém-preparado.
- Para verificar se há uma transfusão de PFA bem-sucedida, verifique se há espasmos musculares visíveis em todo o corpo e cauda. Prossiga para a etapa de enucleação.
2. Enucleação e fixação do globo ocular
- Use uma pinça de joalheiro curva para empurrar suavemente a pálpebra superior ou inferior para forçar o globo ocular para fora de sua órbita. Use outro conjunto de pinças de joalheiro ou semelhantes para perfurar a conjuntiva pelo lado e segurar o globo pelo lado do nervo óptico. Levante lentamente o globo de seu encaixe até que seja separado do nervo óptico.
- Transfira o globo para um tubo contendo PFA 4% gelado recém-preparado. Rotule o tubo de acordo. Deixe o globo permanecer em 4% de PFA em uma geladeira a 4 ° C por 12 h (durante a noite).
NOTA: Use uma pipeta de transferência de plástico com uma ponta cortada para transferir o globo. Alargue a abertura da ponta cortada com uma segunda ponta de pipeta para evitar danificar a amostra com bordas afiadas.
3. Dissecção da amostra (Figura 1 e Figura 2)
- Sob um estereomicroscópio, localize a junção córnea-esclera ( Figura 1A ) e use a ponta afiada de corte de uma agulha de 30 G para fazer um corte muito superficial na esclera aproximadamente 0,5 a 1 mm atrás da junção córnea-esclera ( Figura 1B ).
- Avance uma das lâminas de uma tesoura de dissecação de ponta afiada através da incisão que acabou de ser feita no espaço potencial entre a esclera / coróide / EPR e a retina (Figura 1C). Avance a tesoura e corte circunferencialmente até que a esclera / coróide / EPR possa ser removida da superfície externa da retina (Figura 1D, E).
NOTA: É importante executar esta etapa lenta e suavemente para evitar perfurar a retina. Os primeiros cortes são particularmente críticos para evitar cortar a retina. - Se necessário, faça cortes radiais relaxantes na esclera / coróide / EPR para facilitar o processo de corte circunferencial e a subsequente descamação do nervo óptico e esclera / coróide / EPR. Remova pequenas manchas de EPR (Figura 1F) usando um pincel de pintura tamanho 1 embebido em PBS.
- Transfira todo o globo ocular intacto para um tubo contendo PBS. Prossiga imediatamente para a próxima etapa ou preserve em 4 ° C para imunomarcação.
NOTA: As marcas podem ser colocadas no globo ocular após a enucleação e, em seguida, após a dissecção, para preservar a orientação do olho, se necessário. O protocolo pode ser pausado aqui, e as amostras podem ser preservadas durante a noite em uma geladeira a 4 ° C antes de prosseguir para as próximas etapas.
4. Coloração vascular
- Permeabilize o tecido imergindo-o em PBS contendo 0,2% de Tween-20 em temperatura ambiente por 20 min.
- Lave a amostra com PBS 3 vezes em uma coqueteleira por 10 min.
- Incubar a amostra com 5% de soro de cabra normal (NGS) em PBS contendo 0,25% de Triton X-100 à temperatura ambiente por 1 h.
- Incubar com o anticorpo primário a 4 °C durante a noite. Aqui, um anticorpo anti-colágeno IV de camundongo foi usado (a concentração final foi preparada em PBS contendo 0,2% de Tween-20).
- Lave 3 vezes com PBS, por 5 min por lavagem.
- Incube a amostra com anticorpos secundários marcados com fluorescência. Aqui, um Alexa Fluor 568 anti-coelho foi usado por 12 h a 4 ° C (diluição 1: 200 em PBS contendo 0,2% de Tween-20).
- Lave com PBS 3 vezes, por 1 h cada, e depois prossiga com as etapas de limpeza do tecido.
5. Limpeza óptica com 2,2′-tiodietanol (TDE)
- Prepare as concentrações de TDE de trabalho usando a solução TDE de estoque com PBS para uma concentração final de 10%, 20%, 30%, 40%, 50% e 60% volume a volume (v/v). Prepare pelo menos 2 mL de solução para cada amostra de olho para permitir que o excesso de volume penetre no tecido.
- Incubar as amostras em uma placa de 6 ou 12 poços com concentração crescente de TDE. Comece imergindo os globos oculares inteiros intactos em solução TDE a 10% por 2–4 h em um shaker em temperatura ambiente. Sucessivamente, transfira a amostra para uma concentração TDE mais alta por 2–4 h em cada concentração TDE (Figura 2C).
NOTA: A retina começa a clarear em concentrações de 40% a 50%, mas a clareação máxima ocorre após a incubação em uma solução de 60%. A retina torna-se menos transparente em concentrações de 70% ou mais (Figura 2D). - Interrompa o processo de compensação durante a noite, se necessário, em qualquer uma das etapas sucessivas da troca de compensação.
6. Imagem de todo o olho usando uma microscopia de folha de luz
- Monte as amostras de olho inteiro intactas considerando a configuração da plataforma de microscópio de folha de luz que está sendo usada. Siga as instruções do microscópio e do software de aquisição para configurar os parâmetros de aquisição, incluindo alinhamento da folha de luz e iluminação e detecção de caminhos ópticos.
NOTA: As amostras utilizadas neste experimento foram coladas do lado da córnea à ponta de uma agulha hipodérmica em uma seringa de insulina (Figura 2E). A amostra foi então suspensa dentro da câmara do microscópio. - Encha a câmara do microscópio com TDE a 60% como solução de limpeza.
- Mergulhe a amostra na câmara do microscópio de folha de luz em solução TDE a 60% (a concentração final de limpeza).
- Crie imagens do olho limpo por meio de uma variedade de microscópios confocais e de folha de luz comerciais ou personalizados. Neste protocolo, é utilizado um microscópio de folha de luz de iluminação de dupla face.
- Use imagens de baixa resolução e baixa ampliação (5x, NA 0,16) para obter imagens da morfologia celular e do rastreamento do processo celular, especialmente quando combinadas com ladrilhos. Use imagens de alta resolução e ampliação (20x, NA 1.0) para obter imagens da morfologia celular e de grandes organelas subcelulares, como núcleos e aglomerados mitocondriais.
7. Processamento de imagem pós-aquisição
NOTA: O processamento pós-aquisição depende do tipo de arquivo e software compatível com os arquivos de imagem.
- Aplique desfoque ou deconvolução para aumentar ainda mais as imagens brutas antes de costurar os blocos de imagem. Um filtro Weiner pode ser aplicado para desfocar as imagens. Alternativamente, as imagens podem ser deconvolvidas iterativamente após a remoção de ruído com a deconvolução de Richardson-Lucy e um PSF medido teórica ou experimentalmente usando ferramentas de modelagem, como o plug-in gerador ImageJ PSF25.
- Execute a costura de pilhas z pré-processadas e transformações de volume afim e não rígidas, seguidas de registro e fusão de volume de visualização múltipla usando uma variedade de pacotes de software comerciais ou de domínio público (ImageJ – plug-in BigStitcher)26.
Resultados
Uma projeção de ângulo zero da rede vascular peripapilar e da microglia é mostrada na Figura 3A. Além disso, a distribuição intacta de toda a microglia da retina em um camundongo CX3CR1-GFP é apresentada na Figura 3B. Uma grande vantagem do método apresentado aqui é sua capacidade de obter imagens de fluoróforos inatos. A Figura 3C, D mostra a microglia em projeções Z representativas (canal verde) de amostras preparadas com o método atual de imagem de olho inteiro intacto (Figura 3C) e preparações de montagem plana (Figura 3D). As microglias foram quantificadas e comparadas em regiões de interesse selecionadas aleatoriamente a partir de retina inteira intacta e preparações de montagem plana. Nenhuma diferença estatisticamente significativa foi observada entre a montagem plana e a imagem de retina inteira intacta em termos de números de microglia (Figura 3E). Todas as imagens representativas na Figura 3 foram capturadas da retina de camundongos CX3CR1-GFP.
A microglia marcada com GFP (canal verde) e a rede vascular (canal vermelho) em uma retina de camundongo CX3CR1-GFP que foi fotografada usando o protocolo de imagem de retina inteira intacta atual são descritas em mais detalhes no Vídeo Suplementar 1. Os fluoróforos de coloração endógenos e in vivo teriam sido branqueados se os métodos de clareamento de pigmento usados por Henning et al.3 e Vigouroux et al.5 fossem usados para remover a pigmentação de coroide e EPR. O Vídeo Suplementar 2 mostra uma visão dos vasos hialóides e do plexo vascular retrolental em seu estado natural. Deve-se notar também que a remoção do segmento anterior do olho, conforme descrito por Prahst et al.2 e Chang et al.4 , teria perturbado os vasos hialóides.

Figura 1: Dissecção da esclera / coróide / epitélio pigmentar da retina. (A-F) A remoção de camadas externas opacas e pigmentadas permite imagens ópticas de alta resolução da retina e da cavidade vítrea sem interferência das estruturas pigmentadas circundantes. Clique aqui para ver uma versão maior desta figura.

Figura 2: Preparação da amostra para imagens intactas do olho inteiro. (A) Após a amostragem, o globo ocular foi coberto com esclera opaca, coróide e EPR. (B) Esclera opaca / coróide / EPR foram dissecadas, mas o tecido da retina ainda era relativamente opticamente opaco para imagens microscópicas. (C) A imersão sucessiva em concentrações crescentes de TDE tornou a amostra clara. Depois que a amostra ficou clara (D), ela foi montada na plataforma do microscópio de folha de luz para imagens de alta resolução. (E) Para o sistema de microscópio de folha de luz usado neste experimento, toda a retina intacta foi montada na ponta de uma agulha hipodérmica em uma seringa usando cola de cianoacrilato. A amostra foi então colocada dentro da câmara de imagem que foi preenchida com a concentração final do agente de limpeza. Clique aqui para ver uma versão maior desta figura.
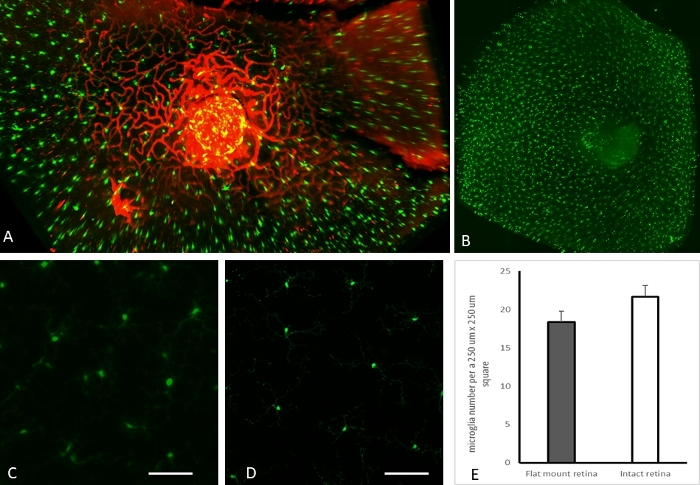
Figura 3: Resultados representativos para imagens de retina inteira intacta. (A) Projeção de ângulo zero da rede vascular peripapilar e microglia em uma fêmea CX3CR1-GFP de 8 meses de idade (B) Projeção plana do canal verde mostrando a distribuição da microglia em uma retina inteira intacta de um camundongo CX3CR1-GFP fêmea de 8 meses. A retina periférica foi distorcida nesta projeção plana da retina intacta em forma de taça. (C-D). Projeção plana quadrada representativa de 250 μm x 250 μm a partir de varreduras de retina inteiras intactas (C) e preparação de montagem plana (D), ambas de camundongos CX3CR1-GFP fêmeas de 8 meses de idade (barra de escala de 50 μm). (E) Enumeração da microglia retiniana em preparações de montagem plana versus imagem de retina inteira intacta usando microscópio fluorescente de folha de luz: Três regiões de interesse (ROI) foram selecionadas aleatoriamente da retina periférica média para quantificação da microglia. Projeções ortogonais de toda a espessura da retina em canal verde foram preparadas para cada ROI. Os números da microglia foram contados no ImageJ. Um teste t de Student bicaudal não mostrou diferença estatisticamente significativa no número de micróglias em montagens planas e intactas de olhos inteiros. Clique aqui para ver uma versão maior desta figura.
Vídeo suplementar 1: Imagem de retina inteira intacta de um camundongo CX3CR1-GFP. Os vasos retinianos foram visualizados em sua totalidade. A imagem foi realizada sem branqueamento do pigmento coróide/EPR. Neste camundongo marcado com GFP (e cepas semelhantes com fluoróforos inatos), o branqueamento da coróide / RPE teria removido os sinais de microglia marcados com GFP. Neste vídeo, a representação tridimensional da distribuição da microglia retiniana destaca a força desse método na detecção da distribuição e ativação da microglia. Clique aqui para baixar este vídeo.
Vídeo suplementar 2: Vasculatura hialóide e plexo vascular retrolental em um camundongo de 4 dias de idade. O segmento anterior do globo ocular, incluindo a córnea, a íris e o cristalino, não foi removido, deixando a cavidade vítrea e sua vasculatura intocadas. Clique aqui para baixar este vídeo.
Discussão
O desenvolvimento e as patologias da retina e do vítreo são melhor estudados com técnicas de imagem de retina inteira intacta, nas quais a retina não é cortada para cortes ou para preparações de montagem plana. Os métodos de imagem de olho inteiro intactos existentes incorporam clareamento de pigmento, que remove fluoróforos inatos, ou envolvem a remoção física dos revestimentos opacos do globo ocular (EPR, coroide e esclera) junto com o segmento anterior do olho, o que pode perturbar a retina periférica e o corpo vítreo. Chang et al. e Prahst et al. removeram os revestimentos externos do globo ocular, bem como da córnea, possivelmente rompendo o corpo vítreo, a vasculatura hialóide e a retina periférica 2,4. Como tal, seu método pode não ser adequado para estudar características celulares da retina e desenvolvimento vítreo e patologias envolvendo vasculaturas hialóides. Alternativamente, Henning et al. e Vigouroux et al. usaram o branqueamento de pigmentos como uma técnica para tornar a coróide e o EPR transparentes para imagens microscópicas 3,5. No entanto, o branqueamento de pigmentos remove a GFP e pode comprometer o desempenho de outros fluoróforos inatos/endógenos, bem como os fluoróforos usados para coloração in vivo como sondas de imagem7. No método aqui apresentado, nenhum clareamento foi usado, e a esclera, coróide e EPR foram dissecados enquanto a córnea, íris e cristalino foram deixados intocados, permitindo a visualização do segmento anterior do olho, retina periférica e vasos hialóides em seu estado não perturbado.
Os métodos existentes descritos para visualização de vasos hialóides em doenças como vasculatura fetal persistente (VPF) e retinopatia da prematuridade (ROP) envolvem a dissecação do segmento anterior do olho que perturba o corpo vítreo e, inevitavelmente, a vasculatura hialóide22,23. Em contraste com esses métodos, o protocolo atual não perturba a vasculatura hialoide e retrolental, permitindo assim a visualização da vasculatura hialóide intacta, conforme mostrado no Vídeo Suplementar 2.
Todos os métodos existentes para imagens de olho inteiro intacto, incluindo o método descrito acima, envolvem limpeza óptica do tecido, um processo que combina o índice de refração de um tecido com o meio circundante para minimizar a dispersão e absorção de luz11,27. Três abordagens principais de limpeza de tecidos incluem métodos hidrofóbicos, hidrofílicos e baseados em hidrogel, dependendo do agente usado para limpar o tecido 13,27,28,29,30,31. Uma variedade dessas técnicas de limpeza de tecidos tem sido usada com sucesso nos métodos de imagem de olho inteiro intacto descritos anteriormente, mas todas têm sido demoradas, levando de 3 a 7 dias 4,5. O protocolo aqui detalhado usa uma modificação do método de troca de 2,2′-tiodietanol (TDE) descrito anteriormente para se adequar ao tecido da retina32. No protocolo atual, a retina/vítreo inteiro intacto foi imerso em uma concentração sucessivamente crescente de TDE para equalizar gradualmente o índice de refração do tecido e torná-lo claro em menos de dois dias. O TDE é um agente de limpeza hidrofílico derivado do glicol miscível com água em qualquer proporção que possibilite a criação de um gradiente de concentração para permitir a penetração da solução de alto índice de refração no tecido. O TDE não extingue a fluorescência de vários fluoróforos, ao contrário de outros métodos de limpeza, como CLARITY e CUBIC33. Além disso, o TDE não tem o potencial de danificar o equipamento, como é o caso de agentes de limpeza à base de solvente orgânico, como benzoato de benzila/álcool benzílico (BABB). Também evita o crescimento de organismos contaminantes que é observado com o método de limpeza SeeDB à base de frutose33.
A microscopia fluorescente de folha de luz é uma ferramenta eficiente com alta resolução temporal e espacial para imagens de tecidos espessos 2,3,4,5,6,34. No LSFM, uma fina folha de luz é direcionada através da amostra para excitar os fluoróforos apenas em um plano de imagem fino que, por sua vez, permite menor fototoxicidade e fotobranqueamento, imagens mais rápidas e maior contraste devido à excitação mínima fora de foco. A imagem dos olhos murinos inteiros dissecados e opticamente limpos, conforme descrito aqui, pode ser realizada utilizando um dos muitos microscópios LSFM ou confocais disponíveis comercialmente. No método atual, o LSFM oferece uma visão rápida e detalhada dos neurônios e vasos da retina e permite uma análise quantitativa da densidade da microglia.
O método atual é limitado em mostrar a interação fotorreceptor-EPR porque o EPR está sendo removido durante a dissecção. Essa interação pode ser melhor estudada com métodos que utilizem clareamento e pulem a dissecção 3,5. O encolhimento do tecido e a possível distorção são limitações inerentes a todos os métodos de fixação e limpeza do tecido, incluindo o método descrito aqui. Essas limitações devem ser reconhecidas ao interpretar os resultados obtidos com o método atual e outros métodos semelhantes. Duas etapas críticas que contribuem para o sucesso desse método incluem uma boa dissecção cirúrgica dos revestimentos oculares sem danificar a retina em combinação com a aplicação de TDE como agente de limpeza óptica. A dissecação das camadas esclera / coróide / EPR em um olho pequeno de roedor pode ser tecnicamente desafiadora e cortar a retina periférica ou o segmento anterior do olho deve ser evitado. Dominar essa técnica requer o mesmo conjunto de habilidades utilizadas na preparação da montagem plana da retina e, em nossa experiência, a destreza essencial pode ser adquirida após a realização das etapas de dissecção descritas acima em três a cinco olhos. O período de incubação para cada fase de limpeza pode ser modificado se o método tiver de ser aplicado em olhos de animais maiores (como coelhos). Se o vaso hialoide se coa melhor com uma técnica de imunomarcação modificada injetando os anticorpos primários e secundários na cavidade vítrea precisa ser explorado no futuro.
Em resumo, o método descrito aqui é baseado no desenvolvimento de técnicas descritas anteriormente para imagens de retina inteira de alta resolução, permitindo imagens dos alvos moleculares e estruturais, incluindo fluoróforos de coloração inatos e in vivo em uma retina inteira intacta e vítrea. Este método aborda várias das limitações dos métodos existentes de preparação de retina inteira intacta, oferecendo uma nova abordagem para uma visualização sem precedentes da vasculatura hialóide na retina intacta.
Divulgações
Nenhum conflito de interesses comercial relevante.
Agradecimentos
Este trabalho foi feito no Ramo Médico da Universidade do Texas. Os autores apreciam Harald
Junge, PhD, Debora Ferrington, PhD, e Heidi Roehrich, Universidade de Minnesota, por sua ajuda na preparação da Figura 1 e do filme 2. O LO foi apoiado pelo NIEHS T32 Training Grant T32ES007254.
Materiais
| Name | Company | Catalog Number | Comments |
| Experimental animal | |||
| CX3CR1-GFP Mouse | The Jackson Laboratory | 5582 | |
| Anesthetic | |||
| Dexmedetomidine | Par Pharmaceutical | 42023-146-25 | |
| Ketamine | Fresenius Kabi | ||
| Tissue harvesting, fixation, and sample dissection | |||
| cardiac perfusion pump | Fisher scientific | NC9069235 | |
| Cyanoacrylate superglue | amazon.com | ||
| Fine scissors-sharp | Fine Science Tools | 14160-10 | |
| Fine tweezers | Fine Science Tools | 11412-11 | |
| Paraformaldehyde (PFA) | Electrone microscopy sciences | 15710-S | |
| Phosphate buffered saline (PBS) | Gibco | 10010049 | |
| size 1 painting brush | dickblick.com | ||
| straight spring scissors | Fine Science Tools | 15000-03 | |
| syringe, needle tip, 27 gauge x 1.25" | BD | ||
| Tubes 1.5 ml, 15 ml, 50 ml | Thermo sceintific | ||
| Tween-20 | ThermoFisher | 85114 | |
| Immunofluorescent staining | |||
| Anti-mouse collagen IV antibody | Abcam | ab19808 | 1:200 dilution |
| Anti-rabbit Alexa Fluor 568 | Invitreogen | A-11011 | 1:200 dilution |
| Normal goat serum | ThermoFisher | 50062Z | 10% concentration |
| Tissue clearing | |||
| 2,2′-thiodiethanol (TDE) | Fluka analytica | STBD7772V | |
| Rocking shaker | Fisher scientific | 02-217-765 | |
| Microscopy | |||
| Fluorescent microspheres | TetraSpeck | T14792 | |
| Light sheet fluorescent microscope (LSFM) | Zeiss | Z1 | |
| Microglia enumeration | |||
| ImageJ | National Institue of Health |
Referências
- Usui, Y., et al. Neurovascular crosstalk between interneurons and capillaries is required for vision. Journal of Clinical Investigation. 125, 2335-2346 (2015).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779(2020).
- Henning, Y., Osadnik, C., Malkemper, E. P. EyeCi: Optical clearing and imaging of immunolabeled mouse eyes using light-sheet fluorescence microscopy. Experimental Eye Research. 180, 137-145 (2019).
- Chang, C. C., et al. Selective Plane Illumination Microscopy and Computing Reveal Differential Obliteration of Retinal Vascular Plexuses. bioRxiv. , (2020).
- Vigouroux, R. J., César, Q., Chédotal, A., Nguyen-Ba-Charvet, K. T. Revisiting the role of DCC in visual system development with a novel eye clearing method. eLife. 9, 51275(2020).
- Singh, J. N., Nowlin, T. M., Seedorf, G. J., Abman, S. H., Shepherd, D. P. Quantifying three-dimensional rodent retina vascular development using optical tissue clearing and light-sheet microscopy. Journal of Biomedical Optics. 22, 076011(2017).
- Kim, S. Y., Assawachananont, J. A new method to visualize the intact subretina from retinal pigment epithelium to retinal tissue in whole mount of pigmented mouse eyes. Translational Vision Science and Technology. 5, 1-8 (2016).
- Kayatz, P., et al. Oxidation causes melanin fluorescence. Investigative Ophthalmology and Visual Science. 42, 241-246 (2001).
- Iwai-Takekoshi, L., et al. Retinal pigment epithelial integrity is compromised in the developing albino mouse retina. Journal of Comparative Neurology. 524, 3696-3716 (2016).
- Alexander, R. A., Cree, I. A., Foss, A. J. The immunoalkaline phosphatase technique in immunohistochemistry: the effect of permanganate-oxalate melanin bleaching upon four final reaction products. British Journal of Biomedical Science. 53, 170-171 (1996).
- Ueda, H. R., et al. Whole-Brain Profiling of Cells and Circuits in Mammals by Tissue Clearing and Light-Sheet Microscopy. Neuron. 106, 369-387 (2020).
- Hillman, E. M. C., Voleti, V., Li, W., Yu, H. Light-Sheet Microscopy in Neuroscience. Annual Review of Neuroscience. 42, 295-313 (2019).
- Jing, D., et al. Tissue clearing of both hard and soft tissue organs with the pegasos method. Cell Research. 28, 803-818 (2018).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159, 911-924 (2014).
- Hohberger, B., Baumgart, C., Bergua, A. Optical clearing of the eye using the See Deep Brain technique. Eye. 31, London, England. 1496-1502 (2017).
- Kuwajima, T., et al. ClearT: A detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development (Cambridge). 140, 1364-1368 (2013).
- Lee, H., Park, J. H., Seo, I., Park, S. H., Kim, S. Improved application of the electrophoretic tissue clearing technology, CLARITY, to intact solid organs including brain, pancreas, liver, kidney, lung, and intestine. BMC Developmental Biology. 14, 48(2014).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13, 859-867 (2016).
- Hegde, S., Srivastava, O. Different gene knockout/transgenic mouse models manifesting persistent fetal vasculature: Are integrins to blame for this pathological condition. Life Sciences. 171 (15), 30-38 (2016).
- Hartnett, M. E., Penn, J. S. Mechanisms and Management of Retinopathy of Prematurity. New England Journal of Medicine. 367, 2515-2526 (2012).
- Pierce, E. A., Foley, E. D., Smith, L. E. H. Regulation of vascular endothelial growth factor by oxygen in a model of retinopathy of prematurity. Archives of Ophthalmology. 114, 1219-1228 (1996).
- Ash, J., McLeod, D. S., Lutty, G. A. Transgenic expression of leukemia inhibitory factor (LIF) blocks normal vascular development but not pathological neovascularization in the eye. Molecular Vision. 11, 298-308 (2005).
- Reichel, M. B., et al. High frequency of persistent hyperplastic primary vitreous and cataracts in p53-deficient mice. Cell Death and Differentiation. 5, 156-162 (1998).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), 3564(2012).
- Kirshner, H., Aguet, F., Sage, D., Unser, M. 3-D PSF fitting for fluorescence microscopy: Implementation and localization application. Journal of Microscopy. 249, 13-25 (2013).
- Hörl, D., et al. BigStitcher: reconstructing high-resolution image datasets of cleared and expanded samples. Nature Methods. 16, 870-874 (2019).
- Susaki, E. A., Ueda, H. R. Whole-body and Whole-Organ Clearing and Imaging Techniques with Single-Cell Resolution: Toward Organism-Level Systems Biology in Mammals. Cell Chemical Biology. 23, 137-157 (2016).
- Tian, B., et al. Efficacy of novel highly specific bromodomain-containing protein 4 inhibitors in innate inflammation–driven airway remodeling. American Journal of Respiratory Cell and Molecular Biology. 60, 68-83 (2019).
- Zaman, R. T., et al. Changes in morphology and optical properties of sclera and choroidal layers due to hyperosmotic agent. Journal of Biomedical Optics. 16, 077008(2011).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10, 508-513 (2013).
- Renier, N., et al. IDISCO: A simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159, 896-910 (2014).
- Costantini, I., et al. A versatile clearing agent for multi-modal brain imaging. Scientific Reports. 5, 9808(2015).
- Aoyagi, Y., Kawakami, R., Osanai, H., Hibi, T., Nemoto, T. A rapid optical clearing protocol using 2,2'-thiodiethanol for microscopic observation of fixed mouse brain. PLoS One. 10, 0116280(2015).
- Icha, J., et al. Using Light Sheet Fluorescence Microscopy to Image Zebrafish Eye Development. Journal of Visualized Experiments. (110), e53966(2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados