Method Article
דיסקציה מיקרוכירורגית וניקוי רקמות להדמיית רשתית שלמה ברזולוציה גבוהה והזגוגית
In This Article
Summary
מוצג כאן פרוטוקול להדמיית רשתית שלמה שלמה שבה השכבות החיצוניות האטומות/פיגמנטיות של גלגל העין מוסרות בניתוח, וניקוי אופטי מיושם כדי להפוך את הרשתית לשקופה המאפשרת הדמיה של הרשתית ההיקפית וכלי הדם ההיאלואידים ברשתית שלמה באמצעות מיקרוסקופ פלואורסצנטי של יריעות קלות.
Abstract
ניתן לדמיין טוב יותר מבנים עצביים וכלי דם של הרשתית במצבים פיזיולוגיים ופתולוגיים על ידי שימוש בטכניקות הדמיה שלמות של רשתית שלמה בהשוואה לתכשירים וחתכים קונבנציונליים של הרכבה שטוחה ברשתית. עם זאת, הדמיה אימונו-פלואורסצנטית של רשתית שלמה שלמה מונעת על ידי הציפוי האטום של גלגל העין, כלומר, סקלרה, כורואיד ואפיתל פיגמנט רשתית (RPE) ותכונות פיזור האור של שכבות הרשתית המונעות הדמיה אופטית ברזולוציה גבוהה בעובי מלא. הלבנה כימית של שכבות הפיגמנט ופרוטוקולי ניקוי רקמות תוארו כדי להתמודד עם מכשולים אלה; עם זאת, השיטות המתוארות כיום אינן מתאימות להדמיה של מולקולות פלואורסצנטיות אנדוגניות כגון חלבון פלואורסצנטי ירוק (GFP) ברשתית שלמה שלמה. גישות אחרות עקפו מגבלה זו על ידי הסרה כירורגית של שכבות פיגמנטיות והמקטע הקדמי של גלגל העין המאפשר הדמיית עין שלמה, אם כי הרשתית ההיקפית והמבנים ההיאלואידים שובשו. מוצג כאן פרוטוקול הדמיה אימונו-פלואורסצנטי שלם של רשתית שלמה וזגוגית המשלב דיסקציה כירורגית של שכבות אפיתל פיגמנט סקלרה/כורואיד/רשתית (RPE) עם שיטת ניקוי רקמות שונה ומיקרוסקופיה פלואורסצנטית של יריעות אור (LSFM). הגישה החדשה מציעה מבט חסר תקדים על מרכיבי כלי הדם והעצבים של הרשתית כמו גם מערכת כלי הדם הזגוגית וההיאלואידית במצבים פתולוגיים.
Introduction
האינטראקציה בין האלמנטים העצביים וכלי הדם ברשתית במצבי בריאות וחולי נחקרת באופן מסורתי על ידי מחקרים אימונופלואורסצנטיים על חתכים פיזיים של רקמת רשתית קבועה בפרפין או קריו או על תכשירים שטוחים ברשתית1. עם זאת, חתך רקמות משבש את המשכיות העצבים וכלי הדם ברשתית, ולמרות ששחזור תלת מימדי של מקטעי הרשתית הסמוכים מוצע כפתרון אפשרי, הוא עדיין נתון לשגיאות וחפצים. תכשירי הרכבה שטוחה ברשתית מפריעים באופן ניכר גם לשלמות האלמנטים של כלי הדם והעצבים ברשתית ולקשר הגיאוגרפי בין אזורי הרשתית הסמוכים2. לחלופין, לאחרונה הוצגה הדמיית רשתית שלמה שלמה כדי להמחיש את ההקרנות התלת מימדיות של רכיבי עצב וכלי דם ברשתית במיקומם האנטומי הטבעי 2,3,4,5.
בהדמיית רשתית שלמה שלמה, אותות פלואורסצנטיים מהאלמנטים כלי הדם והעצביים של אזורי רשתית סמוכים (אריחים) של רשתית שלמה שלמה נלכדים באמצעות מיקרוסקופ גיליון אור; לאחר מכן אריחים אלה "נתפרים" יחד כדי לשחזר תצוגה תלת מימדית של כל הרשתית 2,3,4,5,6. הדמיית רשתית שלמה שלמה מספקת מבט חסר תקדים על הרשתית לחקר הפתוגנזה של מחלות כלי דם, ניווניות ודלקתיות ברשתית 2,3,4,5,6. לדוגמה, פרהסט ועמיתיו חשפו מורפולוגיה מסוקסת "לא מוערכת" בעבר לציציות כלי דם פתולוגיות, תנועתיות תאים לא תקינה ודינמיקת פילופודיה משתנה במודל רטינופתיה המושרה על ידי חמצן (OIR) באמצעות הדמיה חיה של רשתית שלמהשלמה 2. באופן דומה, הנינג ואחרים, סינג ואחרים וצ'אנג ואחרים הדגימו את רשת כלי הדם התלת מימדית המורכבת ברשתית שלמה 3,4,6. Vigouroux et al. השתמשו בשיטת הדמיית עין שלמה שלמה כדי להראות את ארגון הרשתית וההקרנות החזותיות בתקופה סביב הלידה5. על מנת להיות מסוגלים ליצור תצוגות תלת מימדיות חסרות תקדים כאלה של הרשתית, פרוטוקולי הדמיית רשתית שלמה שלמים התגברו על שתי מגבלות עיקריות: 1) נוכחות של ציפויים אטומים ופיגמנטיים של גלגל העין (סקלרה, כורואיד ו-RPE) ו-2) החדירה המוגבלת של האור דרך עובי הרשתית המלא הנגרמת על ידי תכונות פיזור האור של שכבות הגרעין והפרספקס של הרשתית. הנינג ואחרים ו-Vigouroux et al. יישמו הלבנת H2O2 של פיגמנטים כורואידים/RPE כדי להיות מסוגלים לדמות רשתיתשלמה 3,5. עם זאת, הלבנה אינה מתאימה לזנים של בעלי חיים עם פלואורופורים אנדוגניים כגון חלבון פלואורסצנטי ירוק (GFP) או לאחר צביעה אימונו-פלואורסצנטית in-vivo 3,5,7. בנוסף, השיטה של הנינג ועמיתיו לטיפול ב-H2O2 בוצעה בתנאים מימיים שעלולים ליצור מיקרו-בועות שגורמות להיפרדות רשתית. יתר על כן, הטיפול ב-H2O2 בוצע ב-55 מעלות צלזיוס, מצב שמדרדר עוד יותר את זיקת הנוגדנים לרקמות. יתר על כן, הלבנה עלולה להכניס אוטופלואורסצנטיות כבדה שמקורה במלניןמחומצן 8. פרוטוקולי דה-פיגמנטציה אחרים לחלקי עיניים באמצעות אשלגן פרמנגנט וחומצה אוקסלית הצליחו להסיר פיגמנטים RPE בחתכים עובריים, אך שיטת דה-פיגמנטציה זו הוכחה גם כמפחיתה את היעילות של תיוג חיסוני 9,10. כחלופה להלבנה, Prahst et al., Singh et al., ו- Chang et al. הסירו סקלרה וכורואיד וקרנית כדי להפוך רשתית שלמה לנגישה לאור מיקרוסקופ 2,4,6. עם זאת, הסרת הקרנית, העדשה והרשתית ההיקפית עלולה לעוות ולשבש את הרשתית ההיקפית וכלי הדם ההיאלואידים, מה שהופך את השיטות הללו לבלתי מתאימות לחקר הרשתית ההיקפית וכלי הדם ההיאלואידים.
כל פרוטוקולי הדמיית העין השלמה הזמינים כיום כוללים שימוש בשלב ניקוי אופטי של רקמות כדי להתגבר על תכונות פיזור האור של שכבות הרשתית 2,3,4,5. ניקוי אופטי של רקמות הופך את הרשתית לשקופה לאור מיקרוסקופ על ידי השוואת מקדם השבירה של רקמה נתונה, כאן הרשתית, על פני כל האלמנטים התאיים והבין-תאיים שלה כדי למזער את פיזור האור וספיגתו11. יש להסיר או להלבין כורואיד ו-RPE לפני החלת ניקוי אופטי של רקמות על הרשתית מכיוון שלא ניתן לנקות מספיק את הציפוי הפיגמנטי של גלגל העין (כורואיד ו-RPE) 6,12,13,14,15,16,17,18.
ההשתתפות והתרומה של מערכת כלי הדם הזגוגית וההיאלואידית במצבים פתולוגיים כגון רטינופתיה של פגות (ROP), כלי דם עובריים מתמשכים (PFV), מחלת נורי ומחלת סטיקלר נחקרת בצורה הטובה ביותר כאשר הרשתית וכלי הדם ההיאלואידים אינם מופרעים בהכנת הרקמות 19,20,21,22,23. השיטות הקיימות להדמיית רשתית שלמה מסירות את החלק הקדמי של העין, המשבש באופן טבעי את הזגוגית ואת כלי הדם שלה, או מורחות חומרי הלבנה, שעשויים להסיר פלואורופורים אנדוגניים. חסרות שיטות שפורסמו להמחשת גוף הזגוגית וכלי הדם במצבם השלם והבתולי. אנו מתארים כאן שיטת הדמיה שלמה של רשתית וזגוגית המורכבת מדיסקציה כירורגית של ציפויים פיגמנטיים ואטומים של גלגל העין, ניקוי אופטי של רקמות מותאמות לרשתית ומיקרוסקופיה פלואורסצנטית של יריעות קלות. הכנת דגימה, ניקוי אופטי של רקמות, מיקרוסקופ גיליון אור ושלבי עיבוד תמונה מפורטים להלן.
Protocol
כל הניסויים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של הסניף הרפואי של אוניברסיטת טקסס (IACUC). השימוש והטיפול בבעלי חיים היו בהתאם להצהרת האגודה לחקר הראייה והעיניים (ARVO) לשימוש בבעלי חיים במחקר עיניים וראייה. כל החומרים הנדרשים לביצוע הליך זה מפורטים בטבלת החומרים. ללבוש כפפות ללא אבקה בעת ביצוע כל שלב. לשלבים 6 ו-7, עיין גם במדריך ההפעלה הרשמי של המיקרוסקופ.
1. הכנת בעלי החיים
- המתת חסד של עכברי הניסוי בהתאם לפרוטוקול הרלוונטי שאושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (נעשה שימוש כאן בהרדמה עם שילוב של קטמין 60 מ"ג/ק"ג ודקסמדטומידין 0.5 מ"ג/ק"ג ואחריו פריקת צוואר הרחם). המשך מיד לייצוב החיה על פלטפורמה לדיסקציה וזלוף לב.
הערה: חיות ניסוי נבחרות על סמך תכנון של מחקר פרטני. - נתח את הבטן ובית החזה כדי לחשוף את הלב. בצע זלוף לב על ידי עירוי הלב באמצעות מחט 27 גרם המונחת בחדר השמאלי וצור חתך קטן (~1 מ"מ) בפרוזדור הימני כדי לאפשר יציאת דם24.
- ראשית, העבירו 30-50 מ"ל של תמיסת מלח מאוזנת פוספט קר כקרח (PBS) ולאחר מכן, 30-50 מ"ל של 4% פרפורמלדהיד טרי (PFA).
- כדי לבדוק עירוי PFA מוצלח, בדוק אם יש עוויתות שרירים גלויות בכל הגוף והזנב. המשך לשלב ההוצאה.
2. העלאת גלגל העין וקיבוע
- השתמשו במלקחיים מעוקלים של תכשיטן כדי לדחוף בעדינות את העפעף העליון או התחתון כדי להוציא את גלגל העין מהארובה שלו. השתמש בסט אחר של תכשיטן או מלקחיים דומים כדי לנקב את הלחמית מהצד ולהחזיק את הגלובוס מצד עצב הראייה. הרם לאט את הגלובוס מהשקע שלו עד שהוא מנותק מעצב הראייה.
- העבירו את הגלובוס לצינור המכיל 4% PFA טרי קר כקרח. סמן את הצינור בהתאם. הניחו לגלובוס להישאר ב-4% PFA במקרר של 4 מעלות צלזיוס למשך 12 שעות (לילה).
הערה: השתמש בפיפטת העברה מפלסטיק עם קצה חתוך כדי להעביר את הגלובוס. הרחב את פתח קצה החיתוך עם קצה פיפטה שני כדי למנוע פגיעה בדגימה עם קצוות חדים.
3. דיסקציה של המדגם (איור 1 ואיור 2)
- תחת סטריאומיקרוסקופ, אתרו את צומת הקרנית-סקלרה (איור 1A) והשתמשו בקצה החיתוך החד של מחט 30 G כדי לבצע חתך שטחי מאוד בסקלרה כ-0.5-1 מ"מ מאחורי צומת הקרנית-סקלרה (איור 1B).
- התקדמו באחד הלהבים של קצה חד שמנתח מספריים דרך החתך שזה עתה נעשה לתוך החלל הפוטנציאלי שבין הסקלרה/כורואיד/RPE והרשתית (איור 1C). התקדמו את המספריים וחתכו בצורה היקפית עד שניתן לקלף את הסקלרה/כורואיד/RPE מהמשטח החיצוני של הרשתית (איור 1D,E).
הערה: חשוב לבצע שלב זה לאט ובעדינות כדי למנוע ניקוב הרשתית. החתכים הראשונים קריטיים במיוחד כדי למנוע חיתוך דרך הרשתית. - במידת הצורך, בצע חתכים רדיאליים מרגיעים על הסקלרה/כורואיד/RPE כדי להקל על תהליך החיתוך ההיקפי והקילוף הבא של עצב הראייה והסקלרה/כורואיד/RPE. הסר טלאים קטנים של RPE (איור 1F) באמצעות מברשת ציור בגודל 1 ספוגה ב-PBS.
- העבירו את כל גלגל העין השלם לצינור המכיל PBS. המשך מיד לשלב הבא או שמור ב-4 מעלות צלזיוס לתיוג חיסוני.
הערה: ניתן להניח סימנים על גלגל העין לאחר הוצאת העין ולאחר מכן, לאחר דיסקציה כדי לשמור על כיוון העין במידת הצורך. ניתן להשהות את הפרוטוקול כאן, והדגימות עשויות להישמר למשך הלילה במקרר של 4 מעלות צלזיוס לפני שתמשיך לשלבים הבאים.
4. מכתים בכלי הדם
- לחדור את הרקמה על ידי טבילתה ב-PBS המכיל 0.2% Tween-20 בטמפרטורת החדר למשך 20 דקות.
- שטפו את הדגימה עם PBS 3 פעמים על שייקר למשך 10 דקות.
- דגרו את הדגימה עם 5% סרום עיזים רגיל (NGS) ב-PBS המכיל 0.25% טריטון X-100 בטמפרטורת החדר למשך שעה.
- יש לדגור עם הנוגדן הראשוני בטמפרטורה של 4 מעלות צלזיוס למשך הלילה. כאן נעשה שימוש בנוגדני קולגן IV נגד עכברים (הריכוז הסופי הוכן ב-PBS המכיל 0.2% Tween-20).
- יש לשטוף 3 פעמים עם PBS, למשך 5 דקות לכל כביסה.
- דגרו את הדגימה עם נוגדנים משניים המסומנים בפלואורסצנט. כאן, נעשה שימוש באנטי-ארנב Alexa Fluor 568 במשך 12 שעות ב-4 מעלות צלזיוס (דילול של 1:200 ב-PBS המכיל 0.2% Tween-20).
- שטפו עם PBS 3 פעמים, למשך שעה כל אחת, ולאחר מכן המשיכו בשלבי ניקוי הרקמות.
5. ניקוי אופטי עם 2,2′-תיודיתאנול (TDE)
- הכן ריכוזי TDE עובדים באמצעות תמיסת TDE מלאי עם PBS לריכוז סופי של 10%, 20%, 30%, 40%, 50% ו-60% נפח לנפח (v/v). הכן לפחות 2 מ"ל תמיסה לכל דגימת עין כדי לאפשר מספיק נפח עודף לחדור לרקמה.
- דגרו את הדגימות בצלחת של 6 או 12 בארות היטב בריכוז הולך וגדל של TDE. התחילו בטבילת גלגלי העיניים השלמים בתמיסת 10% TDE למשך 2-4 שעות על שייקר בטמפרטורת החדר. ברצף, העבירו את הדגימה לריכוז TDE גבוה יותר למשך 2-4 שעות בכל ריכוז TDE (איור 2C).
הערה: הרשתית מתחילה להתנקות בריכוזים של 40%-50%, אך ניקוי מקסימלי מתרחש לאחר הדגירה בתמיסה של 60%. הרשתית הופכת פחות שקופה בריכוזים של 70% ומעלה (איור 2D). - עצור את תהליך הסליקה בן לילה, במידת הצורך, בכל אחד משלבי חילופי הסליקה העוקבים.
6. הדמיית עין שלמה באמצעות מיקרוסקופ גיליון אור
- הרכיב את דגימות העין השלמות בהתחשב בתצורה של פלטפורמת מיקרוסקופ גיליון האור המשמשת. עקוב אחר הוראות המיקרוסקופ ותוכנת הרכישה כדי להגדיר פרמטרי רכישה כולל יישור גיליון אור והארה וזיהוי נתיבים אופטיים.
הערה: הדגימות ששימשו בניסוי הזה הודבקו מהצד של הקרנית לקצה של מחט תת-עורית במזרק אינסולין (איור 2E). לאחר מכן הדגימה הושעתה בתוך תא המיקרוסקופ. - מלאו את תא המיקרוסקופ ב-60% TDE כתמיסת ניקוי.
- טבלו את הדגימה בתוך תא המיקרוסקופ של גיליון האור בתמיסת TDE של 60% (ריכוז הפינוי הסופי).
- דמיין את העין הצלולה באמצעות מגוון מיקרוסקופים קונפוקליים ויריעות אור מסחריות או מותאמות אישית. בפרוטוקול זה נעשה שימוש במיקרוסקופ גיליון אור תאורה דו-צדדי.
- השתמש בהדמיה ברזולוציה נמוכה ובהגדלה נמוכה (5x, NA 0.16) כדי לדמות מורפולוגיה תאית ומעקב אחר תהליכים תאיים, במיוחד בשילוב עם אריחים. השתמש בהדמיה ברזולוציה גבוהה ובהגדלה (20x, NA 1.0) כדי לדמות הן מורפולוגיה תאית והן אברונים תת-תאיים גדולים כגון גרעינים ואשכולות מיטוכונדריה.
7. עיבוד תמונה לאחר רכישה
הערה: העיבוד לאחר הרכישה תלוי בסוג הקובץ ובתוכנה התואמים לקובצי ההדמיה.
- החל טשטוש או דה-קונבולוציה כדי להגדיל עוד יותר את התמונות הגולמיות לפני תפירת האריחים המצולמים. ניתן להחיל מסנן Weiner כדי לטשטש את התמונות. לחלופין, ניתן לבטל את הקונבולציה של תמונות באופן איטרטיבי לאחר דה-קונבולוציה של ריצ'רדסון-לוסי ו-PSF תיאורטי או נמדד באופן ניסיוני באמצעות כלי מידול כגון תוסף מחולל ImageJ PSF25.
- בצע תפירה של ערימות z מעובדות מראש וטרנספורמציות נפח אפין ולא קשיח ולאחר מכן רישום ומיזוג של אמצעי אחסון מרובי תצוגות באמצעות מגוון חבילות תוכנה מסחריות או ציבוריות (תוסף ImageJ – BigStitcher)26.
תוצאות
הקרנה בזווית אפס של רשת כלי דם פריפפילרית ומיקרוגליה מוצגת באיור 3A. כמו כן, התפלגות מיקרוגליה שלמה ברשתית בעכבר CX3CR1-GFP מוצגת באיור 3B. יתרון מרכזי של השיטה המוצגת כאן, הוא היכולת שלה לדמות פלואורופורים מולדים. איור 3C,D מראה מיקרוגליה בהקרנות Z מייצגות (תעלה ירוקה) מדגימות שהוכנו בשיטה הנוכחית של הדמיית עין שלמה שלמה (איור 3C) ותכשירי הרכבה שטוחה (איור 3D). מיקרוגליה כומתו והושוו באזורי עניין שנבחרו באופן אקראי מתכשירים שלמים של רשתית שלמה ותכשירים שטוחים. לא נצפה הבדל מובהק סטטיסטית בין הדמיית הרשתית השטוחה לבין הדמיית רשתית שלמה שלמה במונחים של מספרי מיקרוגליה (איור 3E). כל התמונות המייצגות באיור 3 צולמו מרשתית העכבר CX3CR1-GFP.
מיקרוגליה מתויגת GFP (ערוץ ירוק) ורשת כלי הדם (ערוץ אדום) ברשתית עכבר CX3CR1-GFP שצולמה באמצעות פרוטוקול הדמיית הרשתית השלמה השלם הנוכחי מתואר בהרחבה בסרטון משלים 1. פלואורופורים אנדוגניים וצביעה in vivo היו מולבנים אם שיטות הלבנת הפיגמנטים המשמשות את Henning et al.3 ו-Vigouroux et al.5 היו משמשות להסרת פיגמנטציה של כורואיד ו-RPE. סרטון משלים 2 מציג מבט על כלי הדם ההיאלואידים ומקלעת כלי הדם הרטרולנטלית במצבם הטבעי. כמו כן, יש לציין כי הסרת המקטע הקדמי של העין כפי שתואר על ידי Prahst et al.2 ו-Chang et al.4 הייתה מפריעה לכלי הדם ההיאלואידיים.

איור 1: דיסקציה של אפיתל פיגמנט סקלרה/כורואיד/רשתית. (א-ו) הסרת שכבות חיצוניות אטומות ופיגמנטיות מאפשרת הדמיה אופטית ברזולוציה גבוהה של הרשתית וחלל הזגוגית ללא הפרעה ממבנים פיגמנטיים שמסביב. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הכנת דגימה להדמיית עין שלמה שלמה. (A) אחרי הדגימה, גלגל העין היה מכוסה בסקלרה, כורואיד ו-RPE אטומים. (B) סקלרה/כורואיד/RPE אטומים נותחו החוצה, אולם רקמת הרשתית עדיין הייתה אטומה יחסית מבחינה אופטית להדמיה מיקרוסקופית. (C) טבילה רצופה בריכוזים הולכים וגדלים של TDE הפכה את הדגימה לברורה. לאחר שהדגימה הייתה ברורה (D), היא הורכבה על פלטפורמת מיקרוסקופ גיליון האור להדמיה ברזולוציה גבוהה. (E) עבור מערכת המיקרוסקופ של יריעות האור ששימשה בניסוי הזה, הרשתית השלמה השלמה הורכבה לקצה של מחט תת-עורית על מזרק באמצעות דבק ציאנואקרילט. לאחר מכן הדגימה הונחה בתוך תא ההדמיה שהתמלא בריכוז הסופי של חומר הניקוי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
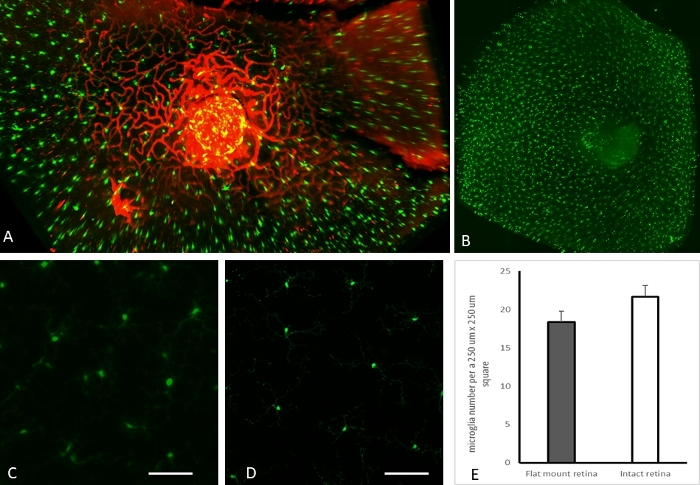
איור 3: תוצאות מייצגות עבור הדמיית רשתית שלמה שלמה. (A) הקרנה בזווית אפס של רשת כלי הדם ההיקפפילרית ומיקרוגליה בעכבר CX3CR1-GFP נקבה בת 8 חודשים שלמה. (B) הקרנה שטוחה של התעלה הירוקה שמראה פיזור מיקרוגליה ברשתית שלמה שלמה מעכבר CX3CR1-GFP נקבה בת 8 חודשים. הרשתית ההיקפית הייתה מעוותת בהקרנה שטוחה זו של הרשתית השלמה בצורת. (ג-ד). הקרנה שטוחה מייצגת של 250 מיקרומטר x 250 מיקרומטר מרובעת מסריקות רשתית שלמות (C) והכנה שטוחה (D), שניהם מעכברי CX3CR1-GFP נקבות בנות 8 חודשים (סרגל קנה מידה 50 מיקרומטר). (E) ספירת מיקרוגליה ברשתית בתכשירים שטוחים לעומת הדמיית רשתית שלמה שלמה באמצעות מיקרוסקופ פלואורסצנטי של יריעת אור: שלושה אזורי עניין (ROI) נבחרו באופן אקראי מהרשתית ההיקפית האמצעית לכימות מיקרוגליה. הקרנות אורתוגונליות של כל עובי הרשתית בתעלה ירוקה הוכנו עבור כל החזר ROI. מספרי מיקרוגליה נספרו בתוך ImageJ. מבחן t של סטודנט דו-זנבי לא הראה הבדל מובהק סטטיסטית במספר המיקרוגליה בתכשירים שטוחים ושלמים לעיניים שלמות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרטון משלים 1: הדמיית רשתית שלמה שלמה של עכבר CX3CR1-GFP. כלי הרשתית הודגמו בשלמותם. ההדמיה בוצעה ללא הלבנת פיגמנט כורואיד/RPE. בעכבר זה המתויג GFP (וזנים דומים עם פלואורופורים מולדים), הלבנת כורואיד/RPE הייתה מסירה את אותות המיקרוגליה המתויגים ב-GFP. בסרטון זה, התיאור התלת מימדי של התפלגות מיקרוגליה ברשתית מדגיש את כוחה של שיטה זו בזיהוי התפלגות והפעלה של מיקרוגליה. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים 2: כלי דם היאלואידים ומקלעת כלי דם רטרולנטית בעכבר בן 4 ימים. החלק הקדמי של גלגל העין, כולל הקרנית, הקשתית והעדשה, לא הוסר, והותיר את חלל הזגוגית וכלי הדם שלו ללא פגע. אנא לחץ כאן להורדת סרטון זה.
Discussion
התפתחות רשתית וזגוגית ופתולוגיות נחקרות בצורה הטובה ביותר באמצעות טכניקות הדמיה שלמות של רשתית שלמה שבהן הרשתית אינה נחתכת למקטעים או לתכשירים שטוחים. שיטות הדמיה שלמות קיימות של עין שלמה משלבות הלבנת פיגמנט, המסירה פלואורופורים מולדים, או כרוכות בהסרה פיזית של הציפוי האטום של גלגל העין (RPE, כורואיד וסקלרה) יחד עם המקטע הקדמי של העין, מה שעלול להפריע לרשתית ההיקפית ולגוף הזגוגית. צ'אנג ואחרים ופרהסט ואחרים הסירו את הציפוי החיצוני של גלגל העין כמו גם את הקרנית ובכך אולי שיבשו את גוף הזגוגית ואת כלי הדם ההיאלואידים והרשתית ההיקפית 2,4. ככזה, ייתכן שהשיטה שלהם לא תתאים לחקר מאפיינים תאיים של רשתית והתפתחות זגוגית ופתולוגיות הכוללות כלי דם היאלואידים. לחלופין, Henning et al. ו-Vigouroux et al. השתמשו בהלבנת פיגמנטים כטכניקה להפיכת כורואיד ו-RPE לשקופים להדמיה מיקרוסקופית 3,5. עם זאת, הלבנת פיגמנט מסירה GFP ועלולה לפגוע בביצועים של פלואורופורים מולדים/אנדוגניים אחרים, כמו גם את הפלואורופורים המשמשים לצביעה in vivo כבדיקות הדמיה7. בשיטה שהוצגה כאן, לא נעשה שימוש בהלבנה, והסקלרה, הכורואיד וה-RPE נותחו החוצה בעוד הקרנית, הקשתית והעדשה נותרו ללא מגע, מה שמאפשר הדמיה של המקטע הקדמי של העין, הרשתית ההיקפית וכלי הדם ההיאלואידים במצבם ללא הפרעה.
השיטות הקיימות המתוארות להדמיה של כלי דם היאלואידים במחלות כגון כלי דם עובריים מתמשכים (PFV) ורטינופתיה של פגות (ROP) כוללות ניתוח מקטע קדמי של העין המפריע לגוף הזגוגית ובהכרח כלי דם היאלואידים 22,23. בניגוד לשיטות אלו, הפרוטוקול הנוכחי אינו מפריע לכלי הדם ההיאלואידים והרטרולנטלים ובכך מאפשר הדמיה של כלי הדם ההיאלואידים השלמים כפי שמוצג בסרטון משלים 2.
כל השיטות הקיימות להדמיית עין שלמה שלמה, כולל השיטה שתוארה לעיל, כוללות ניקוי אופטי של רקמות, תהליך המתאים את מקדם השבירה של הרקמה למדיום הסובב כדי למזער את פיזור האור וספיגתו11,27. שלוש גישות עיקריות לניקוי רקמות כוללות שיטות הידרופוביות, הידרופיליות ומבוססות הידרוג'ל בהתאם לחומר המשמש לניקוי הרקמה 13,27,28,29,30,31. מגוון טכניקות ניקוי רקמות אלה שימשו בהצלחה בשיטות הדמיית העין השלמה שתוארו קודם לכן, אך כולן גוזלות זמן, ולוקחות 3 עד 7 ימים 4,5. הפרוטוקול המפורט כאן משתמש בשינוי של שיטת ההחלפה 2,2′-תיודיתנול (TDE) שתוארה קודם לכן כדי להתאים לרקמת הרשתית32. בפרוטוקול הנוכחי, הרשתית/הזגוגית השלמה הייתה שקועה בריכוז הולך וגדל של TDE כדי להשוות בהדרגה את מקדם השבירה של הרקמה ולהפוך אותו לנקי תוך פחות מיומיים. TDE הוא חומר ניקוי הידרופילי נגזרת גליקול הניתן לערבוב עם מים בכל יחס המאפשר ליצור שיפוע ריכוז המאפשר חדירה של תמיסת מקדם שבירה גבוה לרקמה. TDE אינו מרווה את הקרינה של פלואורופורים שונים בניגוד לשיטות ניקוי מסוימות אחרות כגון CLARITY ו-CUBIC33. בנוסף, ל-TDE אין פוטנציאל לפגוע בציוד, כפי שקורה עבור חומרי ניקוי אורגניים מבוססי ממס כגון בנזיל בנזואט/בנזיל אלכוהול (BABB). זה גם מונע צמיחה של אורגניזמים מזהמים שנצפית בשיטת ניקוי SeeDB מבוססת פרוקטוז33.
מיקרוסקופיה פלואורסצנטית של גיליון אור היא כלי יעיל בעל רזולוציה זמנית ומרחבית גבוהה להדמיית רקמות עבות 2,3,4,5,6,34. ב-LSFM, יריעת אור דקה מופנית דרך הדגימה כדי לעורר פלואורופורים רק במישור הדמיה דק שבתורו מאפשר פוטוטוקסיות נמוכה יותר והלבנת פוטו, הדמיה מהירה יותר וניגודיות גבוהה יותר עקב עירור מינימלי מחוץ לפוקוס. הדמיה של עיני העכברים השלמות המנותחות והמנוקות אופטית כמתואר כאן עשויה להתבצע באמצעות אחד מהמיקרוסקופים הרבים הזמינים מסחרית LSFM או קונפוקליים. בשיטה הנוכחית, LSFM מציע תצוגה מהירה ומפורטת של נוירונים וכלי דם ברשתית ומאפשר ניתוח כמותי של צפיפות המיקרוגליה.
השיטה הנוכחית מוגבלת בהצגת האינטראקציה בין קולטני האור ל-RPE מכיוון ש-RPE מוסר במהלך הדיסקציה. אינטראקציה כזו עשויה להילמד טוב יותר בשיטות המשתמשות בהלבנה ולדלג על הדיסקציה 3,5. התכווצות רקמות ועיוות אפשרי הן מגבלות אינהרנטיות של כל שיטות הקיבוע והניקוי של הרקמות כולל השיטה המתוארת כאן. יש להכיר במגבלות אלה בעת פירוש תוצאות המתקבלות בשיטות הנוכחיות ובשיטות דומות אחרות. שני שלבים קריטיים התורמים להצלחת שיטה זו כוללים דיסקציה כירורגית טובה של ציפויי העיניים מבלי לפגוע ברשתית בשילוב עם יישום TDE כחומר ניקוי אופטי. ניתוח שכבות סקלרה/כורואיד/RPE בעין מכרסם קטנה יכול להיות מאתגר מבחינה טכנית ויש להימנע מחיתוך דרך הרשתית ההיקפית או המקטע הקדמי של העין. שליטה בטכניקה זו דורשת את אותו סט מיומנויות המשמש בהכנת הרכבה שטוחה של הרשתית, ומניסיוננו, ניתן לרכוש מיומנות חיונית לאחר ביצוע שלבי הדיסקציה שתוארו לעיל על שלוש עד חמש עיניים. ניתן לשנות את תקופת הדגירה עבור כל שלב פינוי אם יש צורך ליישם את השיטה על עיני בעלי חיים גדולים יותר (כגון ארנב). האם כלי הדם ההיאלואידי מכתים טוב יותר עם טכניקת תיוג חיסוני שונה על ידי הזרקת הנוגדנים הראשוניים והמשניים לחלל הזגוגית צריך להיבדק בעתיד.
לסיכום, השיטה המתוארת כאן מבוססת על פיתוח נוסף של טכניקות שתוארו בעבר להדמיית רשתית שלמה ברזולוציה גבוהה המאפשרות הדמיה של המטרות המולקולריות והמבניות, כולל פלואורופורים מולדים ו-in-vivo ברשתית שלמה וזגוגית. שיטה זו מתייחסת לכמה מהמגבלות של שיטות הכנת רשתית שלמה שלמות הקיימות תוך הצעת גישה חדשה להדמיה חסרת תקדים של כלי הדם ההיאלואידים ברשתית שלמה.
Disclosures
אין ניגוד עניינים מסחרי רלוונטי.
Acknowledgements
עבודה זו נעשתה בשלוחה הרפואית של אוניברסיטת טקסס. המחברים מעריכים את האראלד
ד"ר יונג, דבורה פרינגטון, והיידי רוריך, מאוניברסיטת מינסוטה על עזרתם בהכנת איור 1 וסרט 2. LO נתמך על ידי NIEHS T32 Training Grant T32ES007254.
Materials
| Name | Company | Catalog Number | Comments |
| Experimental animal | |||
| CX3CR1-GFP Mouse | The Jackson Laboratory | 5582 | |
| Anesthetic | |||
| Dexmedetomidine | Par Pharmaceutical | 42023-146-25 | |
| Ketamine | Fresenius Kabi | ||
| Tissue harvesting, fixation, and sample dissection | |||
| cardiac perfusion pump | Fisher scientific | NC9069235 | |
| Cyanoacrylate superglue | amazon.com | ||
| Fine scissors-sharp | Fine Science Tools | 14160-10 | |
| Fine tweezers | Fine Science Tools | 11412-11 | |
| Paraformaldehyde (PFA) | Electrone microscopy sciences | 15710-S | |
| Phosphate buffered saline (PBS) | Gibco | 10010049 | |
| size 1 painting brush | dickblick.com | ||
| straight spring scissors | Fine Science Tools | 15000-03 | |
| syringe, needle tip, 27 gauge x 1.25" | BD | ||
| Tubes 1.5 ml, 15 ml, 50 ml | Thermo sceintific | ||
| Tween-20 | ThermoFisher | 85114 | |
| Immunofluorescent staining | |||
| Anti-mouse collagen IV antibody | Abcam | ab19808 | 1:200 dilution |
| Anti-rabbit Alexa Fluor 568 | Invitreogen | A-11011 | 1:200 dilution |
| Normal goat serum | ThermoFisher | 50062Z | 10% concentration |
| Tissue clearing | |||
| 2,2′-thiodiethanol (TDE) | Fluka analytica | STBD7772V | |
| Rocking shaker | Fisher scientific | 02-217-765 | |
| Microscopy | |||
| Fluorescent microspheres | TetraSpeck | T14792 | |
| Light sheet fluorescent microscope (LSFM) | Zeiss | Z1 | |
| Microglia enumeration | |||
| ImageJ | National Institue of Health |
References
- Usui, Y., et al. Neurovascular crosstalk between interneurons and capillaries is required for vision. Journal of Clinical Investigation. 125, 2335-2346 (2015).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779(2020).
- Henning, Y., Osadnik, C., Malkemper, E. P. EyeCi: Optical clearing and imaging of immunolabeled mouse eyes using light-sheet fluorescence microscopy. Experimental Eye Research. 180, 137-145 (2019).
- Chang, C. C., et al. Selective Plane Illumination Microscopy and Computing Reveal Differential Obliteration of Retinal Vascular Plexuses. bioRxiv. , (2020).
- Vigouroux, R. J., César, Q., Chédotal, A., Nguyen-Ba-Charvet, K. T. Revisiting the role of DCC in visual system development with a novel eye clearing method. eLife. 9, 51275(2020).
- Singh, J. N., Nowlin, T. M., Seedorf, G. J., Abman, S. H., Shepherd, D. P. Quantifying three-dimensional rodent retina vascular development using optical tissue clearing and light-sheet microscopy. Journal of Biomedical Optics. 22, 076011(2017).
- Kim, S. Y., Assawachananont, J. A new method to visualize the intact subretina from retinal pigment epithelium to retinal tissue in whole mount of pigmented mouse eyes. Translational Vision Science and Technology. 5, 1-8 (2016).
- Kayatz, P., et al. Oxidation causes melanin fluorescence. Investigative Ophthalmology and Visual Science. 42, 241-246 (2001).
- Iwai-Takekoshi, L., et al. Retinal pigment epithelial integrity is compromised in the developing albino mouse retina. Journal of Comparative Neurology. 524, 3696-3716 (2016).
- Alexander, R. A., Cree, I. A., Foss, A. J. The immunoalkaline phosphatase technique in immunohistochemistry: the effect of permanganate-oxalate melanin bleaching upon four final reaction products. British Journal of Biomedical Science. 53, 170-171 (1996).
- Ueda, H. R., et al. Whole-Brain Profiling of Cells and Circuits in Mammals by Tissue Clearing and Light-Sheet Microscopy. Neuron. 106, 369-387 (2020).
- Hillman, E. M. C., Voleti, V., Li, W., Yu, H. Light-Sheet Microscopy in Neuroscience. Annual Review of Neuroscience. 42, 295-313 (2019).
- Jing, D., et al. Tissue clearing of both hard and soft tissue organs with the pegasos method. Cell Research. 28, 803-818 (2018).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159, 911-924 (2014).
- Hohberger, B., Baumgart, C., Bergua, A. Optical clearing of the eye using the See Deep Brain technique. Eye. 31, London, England. 1496-1502 (2017).
- Kuwajima, T., et al. ClearT: A detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development (Cambridge). 140, 1364-1368 (2013).
- Lee, H., Park, J. H., Seo, I., Park, S. H., Kim, S. Improved application of the electrophoretic tissue clearing technology, CLARITY, to intact solid organs including brain, pancreas, liver, kidney, lung, and intestine. BMC Developmental Biology. 14, 48(2014).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13, 859-867 (2016).
- Hegde, S., Srivastava, O. Different gene knockout/transgenic mouse models manifesting persistent fetal vasculature: Are integrins to blame for this pathological condition. Life Sciences. 171 (15), 30-38 (2016).
- Hartnett, M. E., Penn, J. S. Mechanisms and Management of Retinopathy of Prematurity. New England Journal of Medicine. 367, 2515-2526 (2012).
- Pierce, E. A., Foley, E. D., Smith, L. E. H. Regulation of vascular endothelial growth factor by oxygen in a model of retinopathy of prematurity. Archives of Ophthalmology. 114, 1219-1228 (1996).
- Ash, J., McLeod, D. S., Lutty, G. A. Transgenic expression of leukemia inhibitory factor (LIF) blocks normal vascular development but not pathological neovascularization in the eye. Molecular Vision. 11, 298-308 (2005).
- Reichel, M. B., et al. High frequency of persistent hyperplastic primary vitreous and cataracts in p53-deficient mice. Cell Death and Differentiation. 5, 156-162 (1998).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), 3564(2012).
- Kirshner, H., Aguet, F., Sage, D., Unser, M. 3-D PSF fitting for fluorescence microscopy: Implementation and localization application. Journal of Microscopy. 249, 13-25 (2013).
- Hörl, D., et al. BigStitcher: reconstructing high-resolution image datasets of cleared and expanded samples. Nature Methods. 16, 870-874 (2019).
- Susaki, E. A., Ueda, H. R. Whole-body and Whole-Organ Clearing and Imaging Techniques with Single-Cell Resolution: Toward Organism-Level Systems Biology in Mammals. Cell Chemical Biology. 23, 137-157 (2016).
- Tian, B., et al. Efficacy of novel highly specific bromodomain-containing protein 4 inhibitors in innate inflammation–driven airway remodeling. American Journal of Respiratory Cell and Molecular Biology. 60, 68-83 (2019).
- Zaman, R. T., et al. Changes in morphology and optical properties of sclera and choroidal layers due to hyperosmotic agent. Journal of Biomedical Optics. 16, 077008(2011).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10, 508-513 (2013).
- Renier, N., et al. IDISCO: A simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159, 896-910 (2014).
- Costantini, I., et al. A versatile clearing agent for multi-modal brain imaging. Scientific Reports. 5, 9808(2015).
- Aoyagi, Y., Kawakami, R., Osanai, H., Hibi, T., Nemoto, T. A rapid optical clearing protocol using 2,2'-thiodiethanol for microscopic observation of fixed mouse brain. PLoS One. 10, 0116280(2015).
- Icha, J., et al. Using Light Sheet Fluorescence Microscopy to Image Zebrafish Eye Development. Journal of Visualized Experiments. (110), e53966(2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved