Method Article
Renal Korteks-Hipokampus Organotipik Dilim Kültürlerinde Epileptogenez Modeli
Bu Makalede
Özet
Burada, renal korteks-hipokampus organotipik dilimlerin hazırlanmasını anlatıyoruz. Serumun kademeli ve kontrollü yoksunluğu altında, bu dilimler gelişen epileptik benzeri olayları tasvir eder ve epileptogenezin ex vivo modeli olarak kabul edilebilir. Bu sistem, spontan aktivitenin dinamiklerini izlemek ve epileptogenez boyunca nöroinflamatuar özelliklerin ilerlemesini değerlendirmek için mükemmel bir aracı temsil eder.
Özet
Organotipik dilim kültürleri beyin bozukluklarını modellemek için yaygın olarak kullanılmıştır ve bir ilacın nöroprotektif ve terapötik potansiyelini değerlendirmek için mükemmel platformlar olarak kabul edilir. Organotipik dilimler eksizyonlu dokudan hazırlanır ve karmaşık çok hücreli eks vivo ortamı temsil eder. Beyin hücrelerinin üç boyutlu sitotarşikture ve lokal çevresini korurlar, nöronal bağlantıyı ve nöron-glia karşılıklı etkileşimini korurlar. Hipokampal organotipik dilimler epileptogenezin temel mekanizmalarını araştırmak için uygun kabul edilir, ancak klinik araştırmalar ve epilepsi hayvan modelleri, perirhinal ve entorhinal kortiklerden oluşan renal korteksin nöbet oluşturmada ilgili bir rol oynadığını öne sürmektedir.
Burada, renal korteks-hipokampus organotipik dilimlerin hazırlanmasını anlatıyoruz. Tam büyüme ortamı ile perfüzyon altında, fizyolojik sıcaklıkta ve farmakolojik manipülasyonların yokluğunda CA3 bölgesinden spontan aktivite kayıtları, bu dilimlerin kültürde zaman boyunca gelişen epileptik benzeri olayları tasvir ettiğini göstermiştir. Propidium iyodür alma tahlilleri yoluyla hücre ölümü ve floresan bağlantılı immünotitokimya ile değerlendirilen glioz da gözlendi. Sunulan deneysel yaklaşım, epileptogenezin dinamiklerini ve ilerlemesini incelemek ve bu beyin patolojisi için potansiyel terapötik hedefleri taramak için bir platform olarak renal korteks-hipokampus organotipik dilim kültürlerinin değerini vurgulamaktadır.
Giriş
Dünya çapında en sık görülen nörolojik bozukluklardan biri olan epilepsi, beyinde senkronize ve aşırı nöronal aktivitenin periyodik ve öngörülemeyen oluşumu ile karakterizedir. Mevcut çeşitli antiepileptik ilaçlara (ADE'ler) rağmen, epilepsili hastaların üçte biri tedavi1'e refrakterdir ve nöbetler ve bilişsel düşüş yaşamaya devam eder. Ayrıca, mevcut AED'ler nöronal aktivite üzerine nispeten genelleştirilmiş eylemleri nedeniyle bilişi engeller. Epileptogenez, çoklu ve heterojen epileptojenik yaralanmalar, aylar ila on yıllar süren uzun gizli dönemler ve ilk spontan nöbet sonrası antikomvülsan tedavisinin yanıltıcı etkileri nedeniyle insanlarda çalışmak zordur.
Epilepsi tedavisi için potansiyel terapötik ajanların tanımlanması, epilepsi hayvan modelleri nedeniyle mümkün hale gelmiştir: 1) nöbetlerin kendiliğinden veya duyusal bir uyarana yanıt olarak meydana geldiği genetik yatkın hayvanları kullanan genetik modeller; 2) elektriksel stimülasyon kaynaklı nöbet modelleri; ve 3) pilokarpin (bir kas-nüksör agonist), kainat (kainat reseptör agonisti) veya 4-aminopyridin (potasyum kanal bloker) kullanan nöbet indüksiyonunun farmakolojik modelleri. Bu modeller, epilepsinin altında bulunan moleküler ve hücresel mekanizmaların yanı sıra davranış değişikliklerinin anlaşılmasında çok önemliydi ve birçokAED'ninkeşfedilmesine yol açtılar 2 .
Ex vivo preparatları ayrıca epileptogenez ve iktogenezin altında kalan mekanizmaları keşfetmek için güçlü bir araçtır. 6-12 saatlik bir süre boyunca canlı hücrelerin elektrofizyolojik çalışmalarını sağlayan akut hipokampal dilimler ve bir inkübatörde günler veya haftalar boyunca korunabilen organotipik hipokampal dilimler epileptikform aktivite çalışmalarında yoğun olarak kullanılmaktadır3.
Organotipik beyin dilimleri eksiz dokudan hazırlanır ve beynin fizyolojik üç boyutlu modelini temsil eder. Bu dilimler ilgi çekici bölgenin sitotarşiktürü korur ve tüm beyin hücrelerini ve hücreler arası iletişimlerini içerir4. Uzun süreli organotipik kültürler için en çok kullanılan bölge hipokampus'tür, çünkü bu bölge birden fazla nörodejeneratif durumda nöronal kayıptan etkilenir. Beyin bozukluklarını modellemek için yaygın olarak kullanılmıştır ve bir ilacın nöroprotektif ve terapötik potansiyelini değerlendirmek için mükemmel araçlar olarak kabuledilirler 5,6. Hipokampal organotipik dilimlerde epileptogenez, inme ve Aβ kaynaklı toksisite modelleritanımlanmıştır 7,8,9,10. Parkinson hastalığı ventral mezensefalon ve striatum'un yanı sıra korteks-korpus callosum-striatum-substantia nigra, organotipik dilimlerde araştırıldı11. Organotipik serebellar dilim kültürleri akson miyelinasyon ve serebellar fonksiyonların birçok yönünü taklit eder ve multipl sklerozda yeni terapötik stratejileri araştırmak için yaygın bir modeldir12.
Bununla birlikte, epilepsinin klinik araştırmaları ve hayvan modelleri, perirhinal ve entorhinal kortizonlar tarafından oluşturulan renal korteksin nöbet kuşağında rol oynadığını öne sürtür13. Böylece, renal korteks-hipokampus organotipik dilimlerde epileptogenez modeli kuruldu14. Serumun kademeli ve kontrollü yoksunluğu altında, rinal korteks-hipokampus organotipik dilimler, her zaman serum içeren bir ortamda tutulan benzer dilimlerin aksine, gelişen epileptik benzeri olayları tasvir eder.
Epilepside, merkezi sinir sisteminin birçok akut ve kronik hastalığında olduğu gibi, nörosantrik görme, hastalığın başlangıcı ve ilerlemesinin altında kalan mekanizmaları aydınlatamaz. Klinik ve deneysel kanıtlar, mikroglia ve astrositlerin epileptik sürece katkıda bulunan kilit oyunculardan biri olarak ilgili bir rol oynadığı beyin iltihabına işaret eder. Epilepsi hayvan modellerinde farmakolojik deneyler, antiepileptojenik etkilerin pro-enflamatuar yolların hedeflenmesiyle elde edilebileceğini göstermektedir ve günümüzde nöroinflamatuar epilepsi için terapötik yaklaşımların geliştirilmesi için yeni bir seçenek olarak kabul edilir15.
Burada, rinal korteks-hipokampus organotipik dilim kültürlerinin hazırlanmasını ve onlardan spontan epileptiform aktivitenin kaydedilip kaydedilmemiş bunların ayrıntılarını ayrıntılı olarak açıklıyoruz. Bu sistemin epilepsinin birkaç nöroinflamatuar yönünü taklit ettiğini, bu nedenle glial hücrelerin ve nöroinflamatuarasyonun bu patolojideki rolünü keşfetmeye uygun olduğunu vurguluyoruz. Ayrıca, epilepsi için potansiyel terapötik yaklaşımların taranmasının kolay bir platformunu temsil eder.
Protokol
Portekiz yasalarına ve Avrupa Birliği yönergelerine (2010/63/AB), hayvanların bilimsel amaçlarla korunmasına ilişkin tüm prosedürlerde saygı duyulmuştır. Burada açıklanan tüm yöntemler iMM'nin Kurumsal Hayvan Refahı Kurumu (ORBEA-iMM) ve Ulusal yetkili makam (DGAV – Direção Geral de Alimentação e Veterinária) tarafından onaylanmıştır.
1. Renal korteks-hipokampus dilimlerinin hazırlanması
NOT: Renal korteks-hipokampus dilimlerinin hazırlanmasında P6-7 Sprague-Dawley sıçanları yöğüterlenmiştir.
- Kültür kurulumu ve orta hazırlık
- Kültürden bir gün önce, gerekli ortamı hazırlayın ve 4 ° C'ye yerleştirin.
- Diseksiyon ortamını hazırlayın: Gey'in Dengeli Tuz Çözeltisinde (GBSS) 25 mM glikoz.
- Kültür ortamını hazırlayın: %50 Opti-MEM, %25 HBSS, %25 At Serumu (HS), 25 mM glikoz, 30 μg/mL Gentamycin.
- Bakım ortamını hazırlayın: Nörobasal-A (NBA), %2 B27, 1 mM L-glutamin, 30 μg/mL Gentamycin, HS (%15, %10, %5 ve %0).
- Beyin hasadı
- Kültüre başlamadan hemen önce, P1000 pipetli 6 kuyulu plakanın her kuyusuna 1,1 mL kültür ortamı ekleyin ve 37 °C'ye yerleştirin.
- Tüm ekipmanı (diseksiyon mikroskobu, doku doğrayıcı, diseksiyon lambası, diseksiyon aletleri, elektrotlar, plakalar, kesici uçlar ve filtre kağıtları) biyolojik güvenlik kabininin içine yerleştirin ve UV ışığı altında 15 dakika sterilize edin.
- Dilim kalınlığını 350 μm'ye ayarlayın.
- GBSS'i buzdolabından çekin. Altı Petri kabına 5 mL GBSS ekleyin. Hayvan başına altı Petri kabı gerekecektir.
- Fare yavrularını ötenazi edin. Hayvanın beyin sapının tabanında keskin bir makas kullanarak kafa kesme işlemi gerçekleştirin.
- Hayvan kafasını soğuk GBSS'de üç kez yıkayın ve güvenlik kabininin içine alın.
- Doku izolasyonu ve dilimlerin hazırlanması
- Başı tutmak için göz yuvalarına keskin tokmaklar sıkıca yerleştirin.
- İnce bir makas kullanarak omur forameninden başlayarak ön loblara doğru orta çizgi boyunca cildi / kafa derisini kesin ve bir kenara koyun.
- Kafatası ve serebral enine fissür boyunca (beyin ve beyincik arasındaki boşluk) aynı şekilde kesin. Kavisli uzun uzun uzuna çarpmalarla, birbirinden ayırın.
- Koku ampullerini bir spatula ile atın. Beyni kafadan çıkarın ve sırt yüzeyi yukarı dönük buz gibi GBSS'ye yerleştirin (Şekil 1A).
- İnce yaban arılarını beyinciğin içine yerleştirin ve her yarımküreyi çok dikkatli bir şekilde açan spatula ile orta çizgi boyunca ilerleyin (Şekil 1B).
- Kısa eğrili dikinçlerle, hipokampal yapıya dokunmadan hipokampiyi kaplayan fazla dokuyu dikkatlice çıkarın. Daha sonra bir spatula ile, her hipokampüsün altında kesin (Şekil 1C).
- Bir yarımküreyi alın ve hipokampus yukarı bakacak şekilde bir filtre kağıdına yerleştirin. Prosedürü diğer yarımküre ile tekrarlayın ve filtre kağıdına ilkine paralel olarak yerleştirin. Filtre kağıdını, yarımküreler bıçağa dik olacak şekilde doku helikopterine koyun ve yarımküreleri 350 μm dilimler halinde kesin (Şekil 1D).
- Dilimlenmiş dokuyu soğuk GBSS(Şekil 1E)içeren bir Petri kabına yerleştirin.
- Yuvarlak uçlu elektrotları kullanarak dilimleri dikkatlice ayırın (Şekil 1F). Sadece yapısal olarak bozulmamış bir rinal korteks ve hipokampus içeren dilimleri saklayın. DG ve CA alanlarının yanı sıra entorhinal ve perirhinal korteks(Şekil 1G)mükemmel bir şekilde tanımlanmalıdır.
- Her dilimi bir spatula ve yuvarlak uçlu bir elektrot ile kesici ucun üzerine (Şekil 1H-I) yerleştirin. Her dilimin etrafındaki fazla diseksiyon ortamını bir P20 pipetle çıkarın (Şekil 1J). Dört renal korteks-hipokampus dilimi tek bir kesici uçta kültürlenebilir (Şekil 1K).
- Kültür bakımı
- Ortamı iki günde bir değiştirin.
- Ortamı 37 °C'de ısıtın.
- Kuvözden plakaları al. Plastik kenarı asalarla tutarak her kesici ucu alın (Şekil 1L).
- Ortamı kuyudan aspire etmek için serbest bir el kullanın. Kesici ucu tekrar kuyuya yerleştirin ve P1000 pipet ile taze ısıtılmış ortam (Şekil 1M) ile 1mL ekleyin. Tüm ekler için yineleyin. Membran ve ortam arasında hava kabarcıkları sıkışmamasını unutmayın.
NOT: Epileptik benzeri dilimler, ortamda kademeli ve kontrollü bir serum yoksunluğuna uğrar. 9 Days In Vitro (DIV) tarihinden itibaren, dilimler NBA'de HS14olmadan korunur.
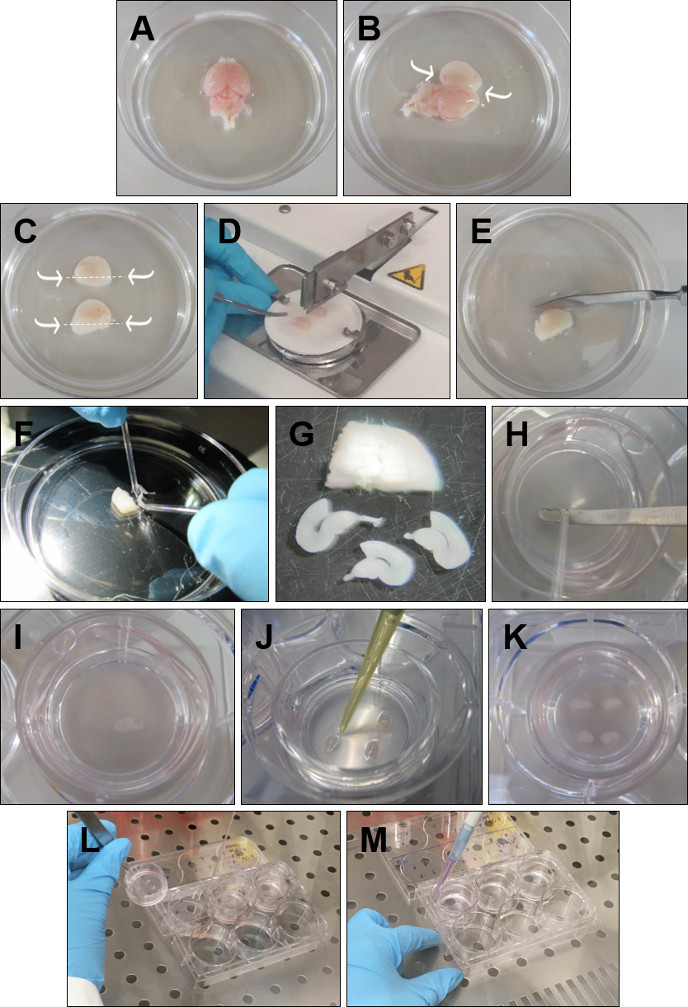
Şekil 1: Renal korteks-hipokampus organotipik dilimlerin hazırlanması için ayrıntılı prosedür. (A) Beyni kafadan çıkarın ve sırt yüzeyi yukarı dönük olarak buz gibi GBSS'ye yerleştirin. (B) Yaban arılarını beyinciğe yerleştirin. Beyni orta çizgiden açın ve hipokampus üzerindeki fazla dokuyu çıkarın. (C) Hipokampüsün altında oklarla belirtildiği gibi kesilmiş bir spatula ile. (D) Her iki hipokampiyi filtre kağıdına yukarı bakacak ve birbirine paralel olarak yerleştirin ve doku helikopterine 350 μm dilim kesin. (E) Dilimlenmiş hipokampusu buz gibi GBSS'ye yerleştirin. (F) Dilimleri yuvarlak uçlu cam elektrotlar yardımıyla ayırın. (G) Sadece bozulmamış bir rinal korteks ve hipokampus gösteren dilimleri seçin. (H, I) Yuvarlak uçlu cam elektrot yardımıyla her dilimi spatulaya itin ve kesici ucun üzerine yerleştirin. (J) Dilimi çevreleyen GBSS'yi çıkarın. (K) Kesici uç başına dört dilim yerleştirin. (L) Ortamı değiştirmek için kesici ucu kaldırın ve ortamı cam pipetle aspire edin. (M) Pipetleri kesici uç ile 6 kuyu plakasının duvarları arasına yerleştirerek taze ortam ekleyin. Dilimlerin altında hava kabarcığı olmadığından emin olun. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Elektrofizyolojik kayıtlar
NOT: Elektrofizyolojik kayıtlar rinal korteks-hipokampus organotipik dilimlerde 7, 14 ve 21 DIV'de arayüz tipi bir odada gerçekleştirildi. Kayıtlar amplifikatörle elde edildi, dijitalleştirildi ve yazılımla analiz edildi. Tüm kayıtlar bant geçişli filtreliydi (60 Hz'de sekiz kutuplu Bessel filtresi ve 600 Hz'de Gauss filtresi).
- Kurulum hazırlığı
- 1 mL B27 ve 250 μL L-Glutamin ile 50 mL NBA ortamı hazırlayın. 37 °C'de ısın.
- Elektrofizyoloji kurulumunu yakın devrede ayarlayın. Akış hızının 2 mL/dk olup olmadığını doğrulayın.
- Araç kutusunu (%5 CO2/%95O2)açın ve sistemdeki su seviyesini kontrol edin.
- Fazla ortamı boşaltmak için filtre kağıdını arayüz kayıt odasına ve dilime ortam sağlamak için çerçevenin altındaki lens temizleme kağıdını koyun.
- Sıcaklık kontrol cihazını, amplifikatörleri ve mikromanipülatörü açın.
- Kayıtlara başlamadan önce arayüz odasındaki sıcaklığın 37 °C'de sabitlenmesine izin verin.
- Yapay beyin omurilik sıvısı (aCSF: 124 mM NaCl, 3mM KCl, 1.2 mM NaH2PO4, 25 mM NaHCO3, 10 mM glikoz, 2 mM CaCl2, 1 mM MgSO4 pH 7.4 ile) hazırlayın ve cam elektrodu bir şırıng ile doldurmak için kullanın. Alıcı elektroda yerleştirin.
- Spontan aktivite kayıtları
- Sıcaklık sabit olduğunda, plakayı inkübatörden çıkarın ve kesici uçtan bir dilimi son derece keskin bir bıçakla kesin. Bir damla orta ile 60 mm'lik bir tabağa yerleştirin. Arayüz kayıt odasına götürün.
- Dilimi sağ altta hipokampus olacak şekilde arayüz odasına yerleştirin. Alıcı elektrodu CA3 piramidal hücre katmanına yerleştirin.
- Sürekli alım protokolüne geçin ve 30 dakika boyunca kaydedin.
3. PI alımı tahlilleri
NOT: Hücre ölümü floresan boya propidium iyodürün (PI) hücresel alımı izlenerek değerlendirildi. PI, hasarlı hücre zarları olan hücrelere giren ve kırmızı floresan yayan DNA ile etkileşime giren bir kutup bileşiğidir (emicilik 493 nm, emisyon 630 nm). PI canlı hücrelere nüfuz olmadığından, popülasyondaki ölü hücreleri tespit etmek için kullanılır.
- PI inkübasyonu
- Kültür ortamında PI stoğunun taze 1:10 seyreltilmesini hazırlayın.
- PI alımı için plakayı inkübatörden çıkarın ve kesici ucu dikkatlice kaldırın. P20 pipet ile ortama 13 μL PI ekleyin ve 2 μM'lik son bir konsantrasyon elde edin. Kesici ucu yerine koymadan önce plakayı yavaşça çalkala. Dilimlerin altında kabarcık olmadığından emin olun.
- Dilimleri 2 saat boyunca 37 °C inkübatöre geri koyun.
- Bir sonraki bölümde açıklandığı gibi immünhistokrömi protokolüne devam edin. PI ışığa duyarlı olduğundan plakaları alüminyumla örtün.
4. İmmünohistokinoloji
NOT: İmmünohistokistride nörona özgü bir antikorun yanı sıra mikroglia ve astrositlerin istirahat ve reaktif fenotiplerini ayırt edebilen antikorlar, renal korteks-hipokampus epileptik benzeri organotipik dilimlerde nöronal ölüm ve gliozun uzatılmasını değerlendirmek için kullanılmıştır.
- Doku fiksasyonu
- Plakayı inkübatörden çıkarın ve ortamı aspire edin. Dilimlerin altına ve üstüne P1000 pipet ile 1 mL PFA ekleyerek, RT'de 1 saat boyunca %4 paraformaldehit (PFA) ile dilimleri sabitleyin.
- PFA'yı çıkarın ve 1 mL PBS ekleyin. Ayrıca dilimlerin altına ve üstüne PBS ekleyin.
- Dilimleri 4 °C'de, PBS'de, daha fazla kullanıma kadar saklayın. Kurumasını önlemek için her zaman plakaların etrafına parafilm koyun.
- İmmünasyon adımları
- Her seferinde 1 mL PBS ile iki kez, 10 dakika yıkayın.
- PBS'de %1 Triton-X100, %10 HS ve %10 BSA içeren permeabilizasyon/blokaj çözeltisi hazırlayın. %5 BSA çözümü hazırlayın.
- Hidrofobik kalemle iki dikdörtgen çizin (Şekil 2A). Kesici uçtan dilimleri (Şekil 2B) son derece keskin bir bıçakla kesin. Slayt başına iki dilim koyun (Şekil 2C) ve bir P200 pipeti kullanarak her dilimin üstüne 140 μL permeabilizasyon / engelleme çözeltisi ekleyin. RT'de 3 saat kuluçkaya yaslanın.
- PBS'de % 5 BSA'da birincil antikorları çalışma seyreltmeye seyreltin. Primer antikorlarla gece boyunca 4 °C'de kuluçkaya yatırın.
- RT'de 4 saat boyunca ikincil antikorlarla kuluçkaya yatırın. Bu adımdan itibaren, floroforlarla çalışıldığı için plakayı ışıktan koruyun.
- Her dilimin üstüne 50 μL'lik bir Hoechst çözeltisi bırakın ve RT'de 20 dakika kuluçkaya yatırın.
- Kuluçkalar arasında yıkayın. PBS-T ile her zaman üç kez, her seferinde 10 dakika yıkayın.
- Hoechst'i çıkarın ve tavsiye edilen şekilde yıkayın.
- Her dilimin üstüne 50 μL montaj ortamı ekleyin. Cam bir kapakçıkla örtün ve oje ile çevrelenin(Şekil 2D).
- RT'de 24 saat kurumasına izin verin.
- Konfokal mikroskop altında immünostainingi görselleştirin. Lekeli dilimleri -20 °C'de tutun.

Şekil 2: İmmünohistokmya tahlil için özel prosedür. (A) Hidrofobik kalem ile slaytta iki kare çizin. (B) Dilimi içeren kesici uç parçasını kesin. (C) Her dilimi hidrofobik kalemle çizilen karelere yerleştirin ve permeabilizasyon/blokaj adımını başlatın. (D) Protokolü tamamladıktan sonra dilimleri montaj ortamına monte ederek, cam bir kapakla kaplayarak ve oje ile çevreleyerek bitirin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Organotipik hipokampal dilimlerde epileptik sinyal analizinin önceki açıklamalarına dayanarak, interiktal epileptiform akıntılar burada, polaritede ani bir değişiklikle ve düşük frekansta meydana gelen paroksismal akıntılar olarak tanımlanır (<2 Hz). 10 sn'den fazla süren ve daha yüksek frekansta (≥2 Hz) meydana gelen paroksismal akıntılar ictal epileptiform aktivite olarak karakterizedir. Bir öncekinden sonra 10 s içinde bir ictal olay meydana gelirse, bu iki olay yalnızca bir ictal olay olarak kabul edilir.
7 DIV'de Rhinal korteks-hipokampus organotipik dilimler (Şekil 3A) karışık interiktal ve ictal benzeri aktiviteyi tasvir eder. At 14 DIV(Şekil 3B), spontan aktivite, 21 DIV'de ezici bir ictal aktiviteye evrilen ictal akıntılar ile karakterizedir ve >1 dk (Şekil 3C)süren ictal olaylar ile karakterizedir.
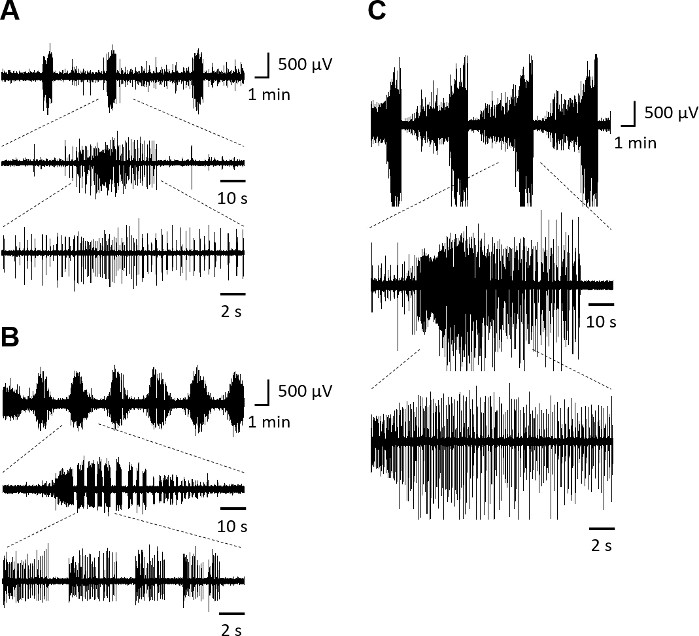
Şekil 3: Rinal korteks-hipokampus organotipik dilimlerin spontan epileptiform aktivitesi. Arayüz tipi bir odada CA3 alanından kaydedilen temsili elektrografik nöbet benzeri olaylar,(A) 7 DIV, (B) 14 DIV ve (C) 21 DIV. Nöbet ayrıntıları daha düşük izlerde gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
PI alımı tahlilini, nöronal ölümü tanımlamayı amaçlayan nöronal belirteç NeuN'a karşı immünhistokimya izledi. Granül ve piramidal nöronlar tarafından PI alımı 7 DIV diliminde (Şekil 4A'dakioklar) gözlendi, ancak PI+ nöron sayısı 14 DIV'de (Şekil 4B'dekioklar) arttı ve epileptogenez ilerlemesi ile artan nöronal ölümü doğruladı.
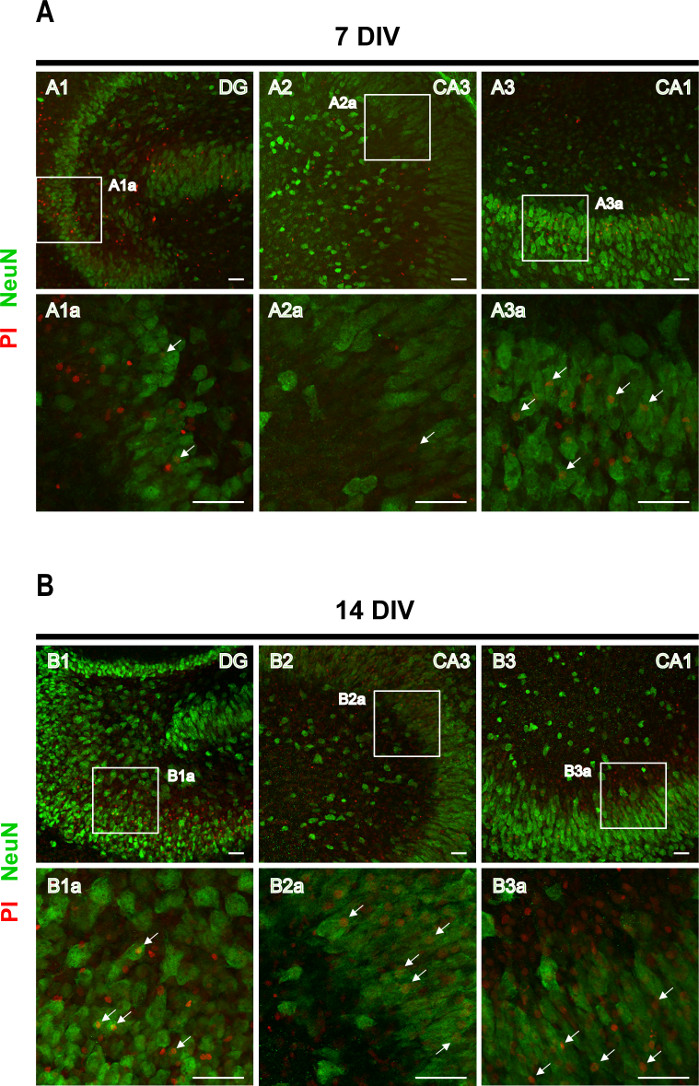
Şekil 4: NeuN ve PI lekeli rinal korteks-hipokampus organotipik dilimlerin temsili görüntüleri. NeuN lekeli olgun nöronların ve PI pozitif hücrelerin görüntüleri (A) 7 DIV ve (B) 14 DIV'de, 20x hedefe sahip bir konfokal lazer mikroskopta elde edildi. Kesikli alanların büyütülmüş görüntüleri gösterilir. Oklar ölüm nöronlarını (turuncu) işaret eder. Ölçek çubuğu, 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Mikroglia fenotipini değerlendirmek için CD68 ile birlikte Iba1'in çift boyanma kullanıldı. Iba1 bir mikroglia/makrofaj belirtecidir, CD68 ise reaktif mikroglia ile yüksek seviyelerde ve mikroglia dinlendirerek düşük seviyelerde ifade edilen lizozomal bir proteindir. 7 DIV dilimlerinde, düşük CD68 ekspresyonlu ramified mikroglia (Şekil 5A'dakioklar) Iba1+/ CD68+ reaktif mikrogliadan (Şekil 5A'dakiok uçları) daha boldur, oysa 14 DIV'de, hipokampüsün tüm alanlarında, Iba1+/ CD68+ gür / amoeboid M1 mikroglia (Şekil 5B'dekiok uçları) düşük bir CD68 ifadesiyle mikrogliayı aşar (Şekil 5B'dekioklar). 14 DIV'de hiper-ramifikasyon görünümüne sahip bazı Iba1+/ CD68+ hücreleri tam olarak tespit edilebilir (Şekil 5B'deaçık ok uçları ), bu da mikroglianın M2 anti-enflamatuar fenotipinin oluşumunu önerebilir. Ancak, bu konu daha fazla çalışma gerektirir.
Son çalışmalar, farklı başlangıç CNS yaralanmalarının A1 ve A2 olmak üzere en az iki tür reaktif astrosit ortaya koyabileceğini ve A1 astrositlerinin nörotoksik16olduğunu göstermiştir. Astrositlerin A1 alt tipi, Tamamlayıcı C316 , 17,18'in artan bir ifadesi ile karakterizedir. Kompleman sisteminin aktivasyonunda merkezi bir rol oynayan Kompleman C3, iC3b, C3dg ve C3d19'a daha da bozulan C3b üretir. Böylece astrogliyozun değerlendirilmesi için GFAP ve C3d'nin çift lekesi kullanıldı. 7 DIV'de C3d ekspresyasyonu zar zor tespit edilebilir (Şekil 6A), 14 DIV diliminde hipertrofik GFAP+/ C3d+ astrositler gözlenebilir (Şekil 6B'dekiok uçları), A1 astrositlerinin aşamalı bir aktivasyonunu düşündürür.
Sonuçlar, epilepsi hastalarında ve bu patolojinin hayvan modellerinde açıklanan olayları taklit ederek, epileptogenez boyunca mikroglia ve astrositlerin ilerleyici bir aktivasyonunu göstermektedir.
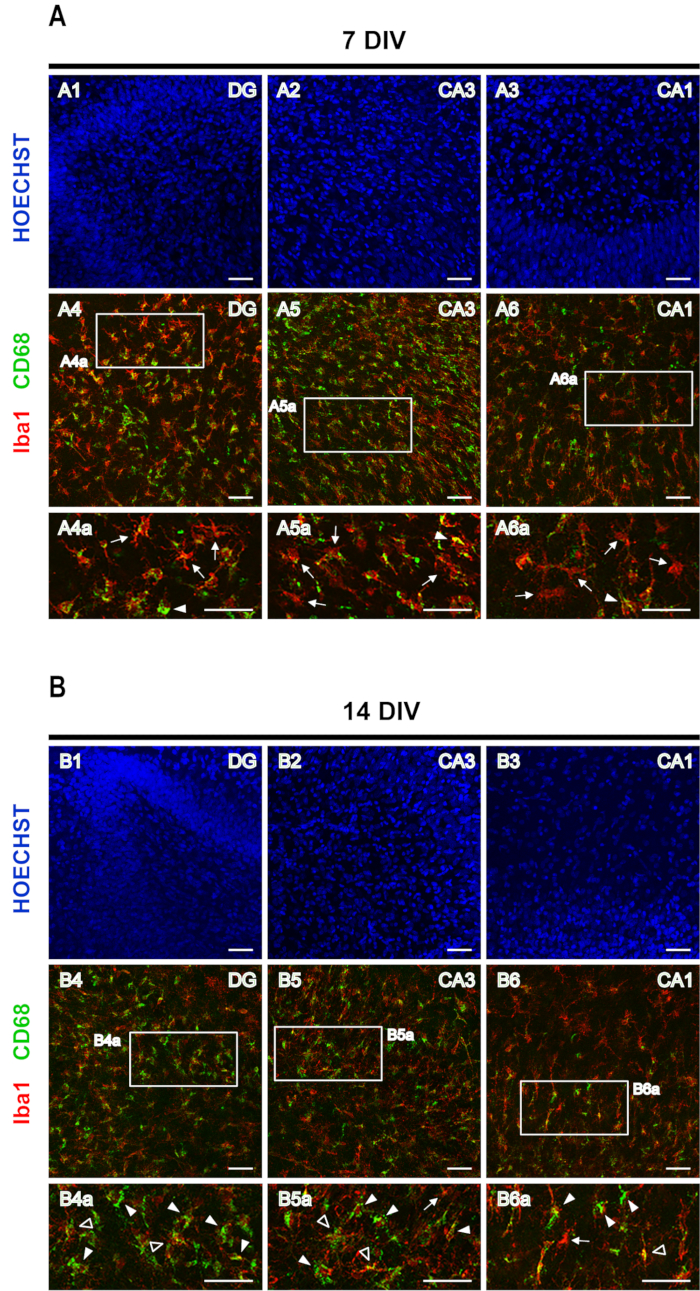
Şekil 5: Iba1 ve CD68 lekeli rinal korteks-hipokampus organotipik dilimlerin temsili görüntüleri. Iba1 ve CD68 lekeli mikroglia ve Hoechst lekeli çekirdek görüntüleri,(A) 7 DIV ve (B) 14 DIV'de, 20x hedefe sahip bir konfokal lazer mikroskopta elde edildi. Kesikli alanların büyütülmüş görüntüleri gösterilir. Oklar Iba1+/ CD68' e işaret eder - dinlenme mikrogliası, ok uçları Iba1+/ CD68+ gür / amoeboid mikroglia'yı gösterir ve açık ok uçları Iba1+/ CD68+ hiper ramified mikroglia'yı gösterir. Ölçek çubuğu, 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
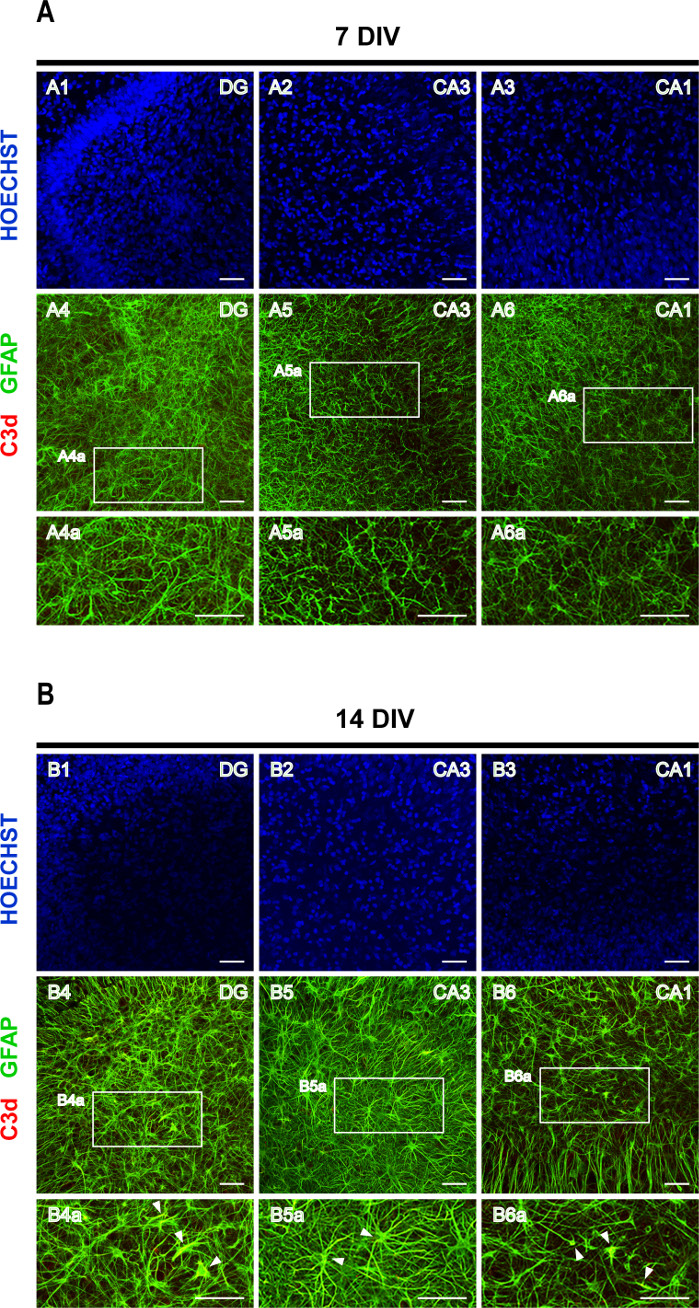
Şekil 6: GFAP ve C3d lekeli rinal korteks-hipokampus organotipik dilimlerin temsili görüntüleri. GFAP ve C3d lekeli astrositlerin ve Hoechst lekeli çekirdeklerin görüntüleri, 20x hedefe sahip bir konfokal lazer mikroskop üzerinde(A) 7 DIV ve (B) 14 DIV'de elde edildi. Kesikli alanların büyütülmüş görüntüleri gösterilir. Ok uçları GFAP+/C3d+ reaktif A1 astrositlerini (sarı) işaret eder. Ölçek çubuğu, 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Epilepsi hayvan modelleri birçok AED'nin keşfi için çok önemli olmuştur, ancak birçok hayvan gerektirir ve çoğu nöbet başlangıcı için gizli süre nedeniyle zaman alıcıdır. Hipokampal akut dilimlerde epilepsiform aktivitenin düşük magnezyum indüksiyonu da literatürde iyice revize edilmiştir3, ancak akut dilimler 6-12 saat canlılığa sahiptir ve bu da uzun süreli değişikliklerin değerlendirilmesini imkansız hale getirir. Organotipik dilimler kültürde günlerce haftadan haftalara korunabilir, akut dilimlerin kısa canlılık süresinin üstesinden gelinebilir ve organotipik hipokampal dilimlerde epileptogenez modelleri önerilmiştir3,7,8.
Burada, ren korteksi ve hipokampusu içeren organotipik dilimlerin hazırlanmasını açıklıyoruz. Bu dilimlerin hayvan başına hazırlanması 15-20 dakika sürer, hayvan kurbanından başlayarak kesici uçlara dilimlerin yerleştirilmesine kadar ve yarımküre başına 6-8 dilim elde edilebilir. Hipokampusu açığa çıkarmak için yarımküreyi açarken ve dokuyu dilimlemeden sonra filtre kağıdından çıkarırken ekstra dikkatli olunmalıdır. Hipokampüsün üzerindeki fazla doku da dilimleme sırasında dilim bütünlüğünü tehlikeye atabilir.
Renal korteks-hipokampus organotipik dilimler, in vivo epilepsiye benzeyen gelişen epileptik benzeri bir aktiviteyi tasvir eder. Kültürde bir hafta sonra, çoğu dilim, kültürde zamanla sadece ictal benzeri olaylara ilerleyen karışık interiktal ve ictal benzeri aktiviteyi tasvir eder. Şimdiye kadar 2-3 haftalık dilimler halinde birkaç interictal akıntı kaydettik. Bu sistemde, epileptik benzeri aktivite organotipik hipokampal dilimlere göre daha hızlı gelişir. Bu, hipokampusa fonksiyonel girdilerin çoğunu koruyan ren korteksinin varlığına bağlanabilir. Bu sorunu tam olarak ele almak için, bu dilimler tarafından kültürde zaman boyunca görüntülenen epileptik sinyallerin, ictal olayların sayısı ve süresi gibi, genlikleri ve frekansları ile birlikte tam bir karakterizasyonu yapılmaktadır.
Bu sistem kültürde üç haftadan fazla sürdürülebilir ve nöronal ölüm, mikroglia ve astrositlerin aktivasyonu ve pro-enflamatuar sitokinlerin üretiminin artması gibi epilepsinin birçok moleküler korelasyonunu taklit eder14Bu yönlerin uzun süreli bir karakterizasyonuna izin verir. Ayrıca, belirli hücresel yolları hedefleyen farmakolojik müdahalelerin uygulanabileceği ve potansiyel terapötik hedeflerin test edilebildiği kullanımı kolay bir tarama platformunu temsil eder. Kuşkusuz, burada sunulan sistem epileptogenez mekanizmalarını daha da aydınlatmaya yardımcı olabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, görüntü alımıyla ilgili tüm öneriler için Instituto de Medicina Molecular João Lobo Antunes Biyogörüntüleme Birimi'ni kabul etmek istiyor.
Bu proje, Avrupa Birliği'nin Horizon 2020 araştırma ve inovasyon programından Nº 952455 hibe anlaşması, Fundação para a Ciênciae Tecnologia (FCT) projesi PTDC/MEDFAR/30933/2017 ve Faculdade de Medicina da Universidade de Lisboa aracılığıyla fon almıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 50 mL Centrifuge Tube, Conical Bottom | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira, Lda | UN1170 | |
| Amplifier | Axon Instruments | Axoclamp 900A | |
| Amplifier | Axon Instruments | Digidata 1440A | |
| Anti-C3d (goat) | R&D Systems | AF2655 | Dilute at a ratio 1:1000 |
| Anti-CD68 (mouse) | Abcam | ab31630-125ug | Dilute at a ratio 1:250 |
| Anti-GFAP (mouse) | Millipore SAS | MAB360 | Dilute at a ratio 1:500 |
| Anti-Iba1 (rabbit) | Abcam | ab108539 | Dilute at a ratio 1:600 |
| Anti-NeuN (rabbit) | Werfen | 16712943S | Dilute at a ratio 1:500 |
| Artificial cerebrospinal fluid (aCSF) | Homemade | ||
| B-27™ Supplement (50X), serum free | Thermo Fisher Scientific | 17504-044 | |
| Blades for scalpel handle | Fine Science Tools | 10011-00 | |
| Bovine Serum Albumin (BSA) | NZYTech | MB04602 | 5% BSA is used to dilute the primary antibodies. Add 0.5g BSA in 10 mL PBS. |
| Brain/Tissue Slice Chamber System | Warner Instruments | ||
| Calcium chloride dihydrate | Merck Millipore | 1.02382.0500 | |
| Cell culture inserts, 30 mm, hydrophilic PTFE | Millipore SAS | PICM03050 | |
| Cold light source | SCHOTT | KL 300 LED | |
| Confocal laser microscope | Zeiss | LSM 710 | |
| Conventional incubator | Thermo Scientific Heraeus | BB15, Function Line | Set to 37 °C and 5% CO2 |
| D(+)-Glucose monohydrate | Merck Millipore | 1.08342.1000 | |
| D-(+)-Glucose solution, 45% in water | Sigma | G8769 | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| Dissecting microscope/magnifier | MEIJI TECHNO CO. LTD | 122285 | |
| Donkey anti-goat IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A11057 | Dilute at a ratio 1:200 |
| Donkey anti-mouse IgG (H+L) coupled to Alexa Fluor 488 | Invitrogen | A21202 | Dilute at a ratio 1:200 |
| Donkey anti-mouse IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A10037 | Dilute at a ratio 1:200 |
| Donkey anti-rabbit IgG (H+L) coupled to Alexa Fluor 488 | Invitrogen | A21206 | Dilute at a ratio 1:500 |
| Donkey anti-rabbit IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A10042 | Dilute at a ratio 1:500 |
| Dumont #5 Fine Forceps Biologie Inox | Fine Science Tools | 11254-20 | |
| Dumont #5 Forceps Standard Inox | Fine Science Tools | 11251-20 | |
| Dumont #7 Forceps Standard Dumoxel | Fine Science Tools | 11271-30 | |
| Dumont Medical #7S Forceps Short Curve Inox | Fine Science Tools | 11273-22 | |
| Gentamycin stock solution, 50 mg/mL | Thermo Fisher Scientific | 15750-037 | |
| Gey’s Balanced Salt Solution (GBSS) | Biological Industries | 01-919-1A | |
| Glass Electrodes | Science Products | GB150F-10 | Round tips homemade |
| Glass Pasteur pipettes, 230 mm | VWR International | 612-1702 | |
| Hank’s Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 24020-091 | |
| Hoechst 33342 | Invitrogen | H1399 | Stock solution at 2 mg/mL in PBS |
| Horse Serum, Heat Inactivated (HS) | Thermo Fisher Scientific | 26050-088 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 | |
| Hydrophobic Pen | Dako | S200230-2 | |
| INCU-Line IL10 | VWR | 390-0384 | |
| Interface chamber | Warner Instruments | BSC-HT Haas Top | |
| Iris Spatula Curved | Fine Science Tools | 10092-12 | |
| Labculture Class II Biological Safety Cabinet | HERASafe | HS 12 | |
| Lens Cleaning Paper | TIFFEN | ||
| L-Glutamine solution 200 mM (Q) | Thermo Fisher Scientific | 25030-024 | |
| Magnesium sulfate heptahydrate | Merck Millipore | 1.05886.0500 | |
| Micro tube 0.5 mL, PP | SARSTEDT | 72,699 | |
| Micro tube 1.5 mL, PP | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL, PP | SARSTEDT | 72.691 | |
| Micromanipulators | Sutter Instrument | MP-285 | |
| Miroscope Cover Glasses, 24 mm x 60 mm | Marienfeld | 102242 | |
| Nail polish | Cliché | ||
| Neurobasal-A Medium (NBA) | Thermo Fisher Scientific | 10888-022 | |
| Opti-MEM® I Reduced-Serum Medium | Thermo Fisher Scientific | 31985-047 | |
| Paraformaldehyde, powder | VWR Chemicals | 2,87,94,295 | |
| Peristaltic pump | Gilson | M312 | |
| Phosphate saline buffer (PBS) | Homemade. PBS with 0.5% Tween-20 (PBS-T) is used to wash slices during the immunohistochemistry assay. | ||
| Phosphate standard solutions, PO43- in water | BDH ARISTAR | 452232C | |
| Pipette set | Gilson | P2, P10, P20, P100, P200, P1000 | |
| Platinum 5 blades | Gillette | ||
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide (PI) | Sigma-Aldrich | P4170-25MG | Stock solution at 1 mg/mL in water. |
| Qualitative Filter Paper, Cellulose, Grade 1, 55 mm | Whatman | 1001-055 | Medium retention 11µm |
| Qualitative Filter Paper, Cellulose, Grade 1, 90 mm | Whatman | 1001-090 | Medium retention 11µm |
| Scalpel handle | Fine Science Tools | 91003-12 | |
| Slip Tip Insulin Syringe without Needle 1 mL | SOL-M | 161000 | |
| Sodium chloride | VWR Chemicals | 27800.360 | |
| Sodium dihydrogen phosphate monohydrate | Merck Millipore | 1.06346.1000 | |
| Sodium hydrogen carbonate | Merck Millipore | 1.06329.1000 | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Stimulator | Astro Med Inc GRASS Product Group | S48 Stimulator | |
| Student Scissors Straight SharpSharp 12cm | Fine Science Tools | 91402-12 | |
| SuperFrost Plus™ Adhesion slides | Thermo Fisher Scientific | J1800AMNZ | |
| TC-Treated Sterile 60 x 15mm Tissue Culture Dish | Corning | CORN430166 | |
| TC-Treated Sterile 6-Wells Plates | Corning | CORN3516 | |
| Temperatue controller | MEDICAL SYSTEMS CORP. | TC-102 | |
| Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 350 μm |
| Triton X-100 | BDH | 14630 | |
| Tween-20 | Sigma | P2287 |
Referanslar
- Fisher, R. S., et al. Electrical stimulation of the anterior nucleus of thalamus for treatment of refractory epilepsy. Epilepsia. 51, 899-908 (2010).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20, 359-368 (2011).
- Heinemann, U., Kann, O., Schuma, S., Pitkänen, A., Schwartzkroin, P. A., Moshé, S. L. An overview of in vitro seizure models in acute and organotypic slices. Models of seizures and epilepsy. , 35-44 (2006).
- Sundstrom, L., Morrison, B., Bradley, M., Pringle, A. Organotypic cultures as tools for functional screening in the CNS. Drug Discovery Today: Targets. 10, 993-1000 (2005).
- Holopainen, I. E. Organotypic hippocampal slice cultures: a model system to study basic cellular and molecular mechanisms of neuronal cell death, neuroprotection, and synaptic plasticity. Neurochemical Research. 30, 1521-1528 (2005).
- Noraberg, J., et al. Organotypic hippocampal slice cultures for studies of brain damage, neuroprotection and neurorepair. CNS Neurological Disorders Drug Targets. 4, 435-452 (2005).
- Dyhrfjeld-Johnsen, J., Berdichevsky, Y., Swiercz, W., Sabolek, H., Staley, K. J. Interictal spikes precede ictal discharges in an organotypic hippocampal slice culture model of epileptogenesis. Journal of Clinical Neurophysiology. 27, 418-424 (2010).
- Chong, S. A., et al. Intrinsic Inflammation Is a Potential Anti-Epileptogenic Target in the Organotypic Hippocampal Slice Model. Neurotherapeutics. 15, 470-488 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5, 19-33 (2007).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Doussau, F., Dupont, J. L., Neel, D., Schneider, A., Poulain, B., Bossu, J. L. Organotypic cultures of cerebellar slices as a model to investigate demyelinating disorders. Expert Opinion on Drug Discovery. 12 (10), 1011-1022 (2017).
- Vismer, M. S., Forcelli, P. A., Skopin, M. D., Gale, K., Koubeissi, M. Z. The piriform, perirhinal, and entorhinal cortex in seizure generation. Frontiers in Neural Circuits. 9, 27 (2015).
- Magalhães, D. M., Pereira, N., Rombo, D. M., Beltrão-Cavacas, C., Sebastião, A. M., Valente, C. A. Ex vivo model of epilepsy in organotypic slices - a new tool for drug screening. Journal of Neuroinflammation. 15, 203 (2018).
- Ravizza, T., Balosso, S., Vezzani, A. Inflammation and prevention of epileptogenesis. Neuroscience Letters. 497 (3), 223-230 (2011).
- Liddelow, S. A., et al. Neurotoxic reactive astrocytes are induced by activated microglia. Nature. 541, 481-487 (2017).
- Wu, T. Complement C3 is activated in human AD brain and is required for neurodegeneration in mouse models of amyloidosis and tauopathy. Cell Reports. 28 (8), 2111-2123 (2019).
- Hartmann, K., et al. Complement 3+-astrocytes are highly abundant in prion diseases, but their abolishment led to an accelerated disease course and early dysregulation of microglia. Acta Neuropathologica Communications. 7, 83 (2019).
- Nilsson, U. R., Funke, L., Nilsson, B., Ekdahl, K. N. Two conformational forms of target-bound iC3b that distinctively bind complement receptors 1 and 2 and two specific monoclonal antibodies. Upsala Journal of Medical Sciences. 116, 26-33 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır