Method Article
מודל של אפילפטוגנזה בתרבויות פרוסות קליפת המוח-היפוקמפוס של רינאל קליפת המוח
In This Article
Summary
כאן, אנו מתארים את הכנת פרוסות אורגנוטיפיק קליפת המוח הריאנלית-היפוקמפוס. תחת קיפוח הדרגתי ומבוקר של סרום, פרוסות אלה מתארות אירועים מתפתחים דמויי אפילפטיים ויכולים להיחשב מודל אקס ויוו של אפילפטוגנזה. מערכת זו מייצגת כלי מצוין לניטור הדינמיקה של פעילות ספונטנית, כמו גם להערכת ההתקדמות של תכונות נוירואינפלמטוריות לאורך כל מהלך אפילפטוגנזה.
Abstract
תרבויות פרוסות Organotypic כבר בשימוש נרחב מודל הפרעות מוחיות נחשבים פלטפורמות מצוינות להערכת הפוטנציאל neuroprotective וטיפולי של התרופה. פרוסות Organotypic מוכנות מרקמה מוסברת ומייצגות סביבת אקס ויוו רב-תאית מורכבת. הם משמרים את הציטו-ארכיטקטורה התלת מימדית והסביבה המקומית של תאי המוח, שומרים על הקישוריות העצבית ועל האינטראקציה ההדדית בין הנוירונים לגליה. פרוסות אורגנוטיפיות בהיפוקמפוס נחשבות מתאימות לחקור את המנגנונים הבסיסיים של אפילפטוגנזה, אך מחקר קליני ומודלים של בעלי חיים של אפילפסיה הראו כי קליפת המוח הריאנלית, המורכבת מקליפת המוח הפרירינלית והאנטורינית, ממלאת תפקיד רלוונטי בדור ההתקפים.
כאן, אנו מתארים את הכנת פרוסות אורגנוטיפיק קליפת המוח הריאנלית-היפוקמפוס. הקלטות של פעילות ספונטנית מאזור CA3 תחת זלוף עם מדיום צמיחה מלא, בטמפרטורה פיזיולוגית ובהיעדר מניפולציות תרופתיות, הראו כי פרוסות אלה מתארות אירועים מתפתחים דמויי אפילפטיים לאורך זמן בתרבות. מוות תאי מוגבר, באמצעות propidium יודיד ספיגת asssay, גליוזיס, מוערך עם אימונוהיסטוכימיה פלואורסצנטית, נצפתה גם. הגישה הניסיונית שהוצגה מדגישה את הערך של תרבויות פרוסות קליפת המוח-היפוקמפוס rhinal כפלטפורמה לחקר הדינמיקה וההתקדמות של אפילפטוגנזה ולסנן מטרות טיפוליות פוטנציאליות עבור פתולוגיה זו של המוח.
Introduction
אפילפסיה, אחת ההפרעות הנוירולוגיות הנפוצות ביותר בעולם, מאופיינת בהתרחשות תקופתית ובלתי צפויה של פעילות עצבית מסונכרנת ומוגזמת במוח. למרות תרופות אנטי אפילפטיות שונות (AEDs) זמין, שליש מהחולים עם אפילפסיה הם עקשן לטיפול1 וממשיכים לחוות התקפים וירידה קוגניטיבית. יתר על כן, AEDs זמין לעכב קוגניציה בשל פעולות כלליות יחסית שלהם על פעילות עצבית. אפילפטוגנזה קשה ללמוד בבני אדם, בשל פציעות אפילפטוגניות מרובות והטרוגניות, תקופות סמויות ארוכות שנמשכות חודשים עד עשרות שנים, ואת ההשפעות המטעות של טיפול נוגד פרוצים לאחר ההתקף הספונטני הראשון.
זיהוי של סוכנים טיפוליים פוטנציאליים לטיפול באפילפסיה התאפשר עקב מודלים של בעלי חיים של אפילפסיה: 1) מודלים גנטיים, המשתמשים בבעלי חיים נטייה גנטית שבהם התקפים מתרחשים באופן ספונטני או בתגובה לגירוי חושי; 2) מודלים של התקפים הנגרמים על ידי גירוי חשמלי; ו -3) מודלים תרופתיים של אינדוקציה התקפים המשתמשים pilocarpine (אגוניסט קולטן muscarinic), kainate (אגוניסט קולטן kainate) או 4-aminopyridine (חוסם ערוץ אשלגן), בין היתר. מודלים אלה היו חיוניים בהבנת השינויים ההתנהגותיים, כמו גם מנגנונים מולקולריים ותאיים שבבסיס האפילפסיה, והם הובילו לגילוי של AEDs רבים2.
ההכנות Ex vivo הם גם כלי רב עוצמה לחקור את המנגנונים הבסיסיים אפילפטוגנזה ו ictogenesis. פרוסות היפוקמפוס חריפות, המאפשרות מחקרים אלקטרופיזיולוגיים של תאים חיים על פני תקופה של 6-12 שעות, ופרוסות היפוקמפוס אורגנוטיפי שניתן לשמר באינקובטור על פני תקופה של ימים או שבועות שימשו בהרחבה במחקרים על פעילות אפילפטיפורם3.
פרוסות מוח אורגנוטיפיות מוכנות מרקמה מושתלת ומייצגות מודל תלת מימדי פיזיולוגי של המוח. פרוסות אלה משמרות את הציטו-ארכיטקטורה של אזור העניין וכוללות את כל תאי המוח ואת התקשורת הבין-תאית שלהם4. האזור הנפוצץ ביותר עבור תרבויות organotypic לטווח ארוך הוא ההיפוקמפוס, כמו אזור זה מושפע אובדן עצבי בתנאים ניווניים מרובים. הם היו בשימוש נרחב כדי מודל הפרעות מוחיות נחשבים כלים מצוינים להערכת הפוטנציאל neuroprotective וטיפולי של התרופה5,6. מודלים של אפילפטוגנזה, שבץ ורעילות הנגרמת על ידי Aβ תוארו בפרוסות אורגנוטיפיות בהיפוקמפוס7,8,9,10. מחלת פרקינסון נחקרה במזנספלון גחוני ובסטריאטום, כמו גם בקליפת המוח-קורפוס כפיסטום-סטריאטום-סובסטנציה ניגרה, פרוסות אורגנוטיפיות11. תרבויות פרוסת המוח הקטן Organotypic לחקות היבטים רבים של myelination אקסון ותפקודים מוחיים והם מודל נפוץ לחקור אסטרטגיות טיפוליות חדשניות בטרשת נפוצה12.
עם זאת, מחקר קליני ומודלים של בעלי חיים של אפילפסיה הציעו כי קליפת המוח הריאנאלית, המורכבת על ידי קליפות קליפת המוח הפרירינלית והאנטוריניאלית, ממלאת תפקיד בדור ההתקפים13. לכן, מודל של אפילפטוגנזה בקליפת המוח הריאנאלית-היפוקמפוס פרוסות organotypic הוקמה14. תחת קיפוח הדרגתי ומבוקר של סרום, פרוסות אורגנוטיפיות של קליפת המוח הריאנלית-היפוקמפוס מתארות אירועים מתפתחים דמויי אפילפטיות, שלא כמו פרוסות אנלוגיות שתמיד נשמרות במדיום המכיל סרום.
באפילפסיה, כמו במחלות חריפות וכרוניות רבות של מערכת העצבים המרכזית, הראייה הנוירוצנטרית אינה מצליחה להבהיר את המנגנונים שבבסיס הופעת המחלה והתקדמותה. ראיות קליניות וניסיוניות מצביעות על דלקת במוח, שבה מיקרוגליה ואסטרוציטים ממלאים תפקיד רלוונטי, כאחד משחקני המפתח התורמים לתהליך האפילפטי. ניסויים תרופתיים במודלים של בעלי חיים של אפילפסיה מראים כי השפעות אנטי אפילפטוגניות ניתן להשיג על ידי מיקוד מסלולים פרו דלקתיים, וכיום neuroinflammation נחשב כאפשרות חדשנית לפיתוח גישות טיפוליות עבור אפילפסיה15.
כאן, אנו מתארים ביסודיות את הכנת תרבויות פרוסות קליפת המוח-היפוקמפוס rhinal, כמו גם את הפרטים לתיעוד פעילות אפילפטיפורמית ספונטנית מהם. אנו מדגישים כי מערכת זו מחקה מספר היבטים נוירו-אינפלציה של אפילפסיה, ובכך מתאים לחקור את התפקיד של תאי גליה ו neuroinflammation בפתולוגיה זו. יתר על כן, הוא מייצג פלטפורמה קלה לשימוש להקרנה של גישות טיפוליות פוטנציאליות לאפילפסיה.
Protocol
החוק הפורטוגלי והנחיות האיחוד האירופי (2010/63/EU) כובדו בכל ההליכים הנוגעים להגנה על בעלי חיים למטרות מדעיות. כל השיטות המתוארות כאן אושרו על ידי הגוף המוסדי לרווחת בעלי חיים (ORBEA-iMM) והרשות הלאומית המוסמכת (DGAV – Direção Geral de Alimentação e Veterinária).
1. הכנת פרוסות קליפת המוח הריאנלית-היפוקמפוס
הערה: הכנת פרוסות קליפת המוח הריאנלית-היפוקמפוס משתמשת בחולדות P6-7 ספראג-דוולי.
- מערך תרבות והכנה בינונית
- ביום שלפני התרבות, הכינו את המדיה הנדרשת והניחו אותם על 4 מעלות צלזיוס.
- הכינו מדיום ניתוח: 25 מ"מ גלוקוז בתמיסת המלח המאוזן (GBSS) של גיי.
- הכינו מדיום תרבותי: 50% Opti-MEM, 25% HBSS, 25% סרום סוסים (HS), 25 מ"מ גלוקוז, 30 מיקרוגרם/מ"ל גנטמיצין.
- הכן אמצעי תחזוקה: נוירובסאל-A (NBA), 2% B27, 1 מ"מ ל-גלוטמין, 30 מיקרוגרם/מ"ל גנטמיצין, HS (15%, 10%, 5% ו-0%).
- קצירת מוח
- רגע לפני תחילת התרבות, הוסיפו 1.1 מ"ל של מדיום תרבות לכל באר של צלחת 6 בארות עם פיפטה P1000 ומניחים אותה ב 37 °C (66 °F).
- מניחים את כל הציוד (מיקרוסקופ דיסקציה, מסוק רקמות, מנורת ניתוח, כלי ניתוח, אלקטרודות, צלחות, מוסיף ונייר סינון) בתוך ארון הבטיחות הביולוגית לעקר תחת אור UV במשך 15 דקות.
- להתאים את עובי הפרוסה ל 350 מיקרומטר.
- משוך את GBSS מהמקרר. הוסיפו 5 מ"ל של GBSS לשש מנות פטרי. שש מנות פטרי יידרשו לכל חיה.
- המתת חסד לגור החולדות. בצע עריפת ראש באמצעות מספריים חדים בבסיס גזע המוח של החיה.
- לשטוף את ראש החיה שלוש פעמים GBSS קר ולקחת אותו בתוך ארון הבטיחות.
- בידוד רקמות והכנת פרוסות
- הכנס בחוזקה מלקחיים חדים לארובות העין כדי להחזיק את הראש.
- באמצעות מספריים דק לחתוך את העור / הקרקפת לאורך קו האמצע החל הקדמי החוליות לכיוון האונות הקדמיות ולשים אותו בצד.
- חותכים באותו אופן את הגולגולת ולאורך הסדק הרוחבי המוחי (רווח בין המוח למוח הקטן). עם מלקחיים ארוכים מעוגלים, תזיזו את זה לגזרים.
- השלך את נורות הריח עם מרית. הסירו את המוח מהראש והניחו אותו ב-GBSS קר כקרח כשמשטח הגב פונה כלפי מעלה (איור 1A).
- הכנס את המלקחיים העדינים לתוך המוח הקטן ולך לאורך קו האמצע עם המרית שפותחת כל חצי כדור בזהירות רבה(איור 1B).
- עם מלקחיים עקומים קצרים, להסיר בזהירות את הרקמה העודפת המכסה את ההיפוקמפי, מבלי לגעת במבנה ההיפוקמפוס. לאחר מכן, עם מרית, חותכים מתחת לכל היפוקמפוס(איור 1C).
- להרים חצי כדור אחד ומניחים אותו, עם היפוקמפוס פונה כלפי מעלה, על נייר סינון. חזור על ההליך עם ההמיספרה האחרת ומקם אותו במקביל לראשון, בנייר הסינון. שים את נייר הסינון על מסוק הרקמות, כאשר ההמיספרות ניצבות ללהב, וחתך את ההמיספרות בפרוסות של 350 מיקרומטר(איור 1D).
- מניחים את הרקמה הפרוסה בצלחת פטרי עם GBSS קר(איור 1E).
- הפרד בזהירות את הפרוסות באמצעות אלקטרודות הקצה העגול(איור 1F). שמור רק את הפרוסות עם קליפת רין שלם מבנית והיפוקמפוס. אזורי DG ו- CA צריכים להיות מוגדרים בצורה מושלמת, כמו גם את קליפת המוח האנטורינלית והפרירינאלית(איור 1G).
- מניחים כל פרוסה על התוסף (איור 1H-I), עם מרית ואלקטרודה עם קצה עגול. הסר מדיום ניתוח עודף סביב כל פרוסה באמצעות פיפטה P20 (איור 1J). ארבע פרוסות קליפת המוח הריאנלית-היפוקמפוס יכולות להיות תרבותיות בהכנסה אחת(איור 1K).
- תחזוקת תרבות
- לשנות את המדיום כל יומיים.
- מחממים את המדיום ב 37 מעלות צלזיוס.
- קח את הצלחות מהחממה. הרם כל הוספה על-ידי החזקת קצה הפלסטיק עם מלקחיים (איור 1L).
- השתמש ביד חופשית כדי לשאוף את המדיום מהבאר. מניחים את ההוספה בחזרה לבאר ומוסיפים 1 מ"ל, עם פיפט P1000, של מדיום מחומם טרי (איור 1M). חזור על הפעולה עבור כל התוספות. ודא שאין בועות אוויר לכודים בין הממברנה למדיום.
הערה: פרוסות דמויי אפילפטיות עוברות מחסור הדרגתי ומבוקר בסרום במדיום. מ 9 ימים במבחנה (DIV) על, פרוסות נשמרים ב-NBA ללא HS14.
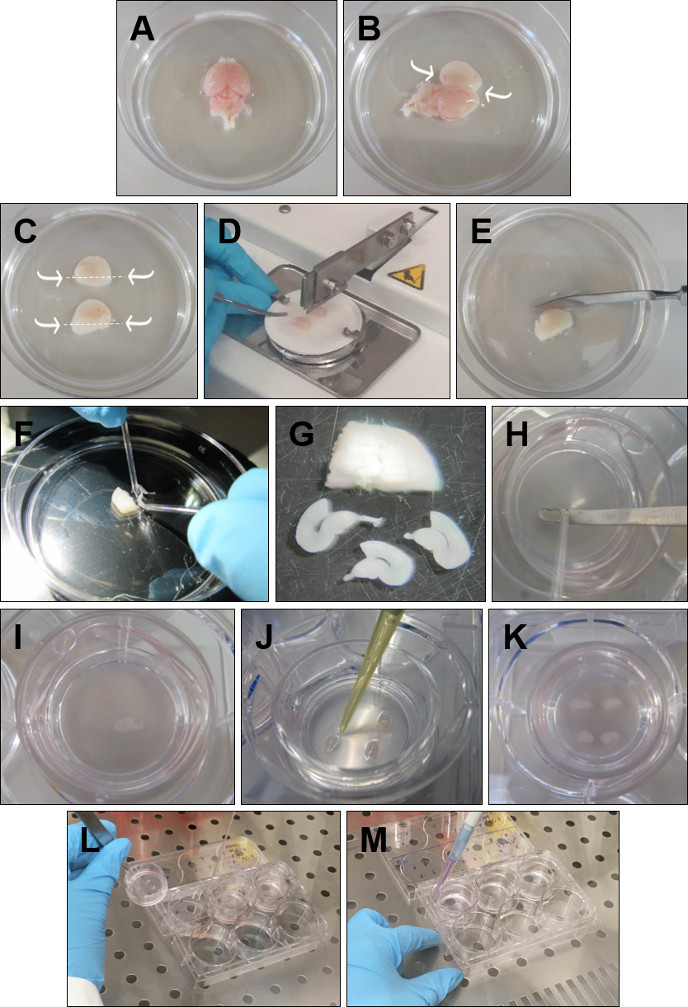
איור 1: הליך מפורט להכנת פרוסות אורגנוטיפיות של קליפת המוח הריאנלית-היפוקמפוס. (A)הסר את המוח מהראש והנח אותו ב GBSS קר כקרח עם משטח הגב פונה כלפי מעלה. (B) הכנס את המלקחיים לתוך המוח הקטן. פתח את המוח דרך קו האמצע ולהסיר את הרקמה העודפת מעל ההיפוקמפוס. (C) עם מרית לחתוך מתחת להיפוקמפוס, כפי שצוין על ידי החצים. (D)מניחים את ההיפוקמפי פונים כלפי מעלה ומקבילים זה לזה על נייר המסנן וחותכים פרוסות 350 מיקרומטר על מסוק הרקמות. (E)מניחים את ההיפוקמפוס הפרוס ב- GBSS קר כקרח. (ו)להפריד את הפרוסות בעזרת אלקטרודות זכוכית עגולות. (G) בחר רק את הפרוסות המתארות קליפת רין שלמה והיפוקמפוס. (H, I) בעזרת אלקטרודה זכוכית עגולה הטה לדחוף כל פרוסה למרית ומניחים אותו על הכנס. (J) הסר את GBSS המקיף את הפרוסה. (K) מקם ארבע פרוסות לכל הוספה. (L)כדי לשנות את המדיום, הרם את ההכנס ושואף את המדיום עם פיפטה מזכוכית. (M) הוסף מדיום טרי על ידי הצבת פיפטה בין הכנס ואת הקירות של צלחת 6 בארות. ודא שאין בועות אוויר מתחת לפרוסות. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. הקלטות אלקטרופיזיולוגיות
הערה: הקלטות אלקטרופיזיולוגיות בוצעו בפרוסות אורגנוטיפיות של קליפת המוח הריאנלית-היפוקמפוס ב-7, 14 ו-21 DIV בתא מסוג ממשק. הקלטות התקבלו עם מגבר, דיגיטציה ונותחו עם תוכנה. כל ההקלטות סוננו על ידי מעבר פס (מסנן בסל שמונה עמודים במסנן 60 הרץ וגאוסיאני ב-600 הרץ).
- הכנת התקנה
- הכן 50 מ"ל של מדיום NBA עם 1 מ"ל של B27 ו 250 μL של L-גלוטמין. להתחמם ב 37 מעלות צלזיוס.
- הגדר את מערך האלקטרופיזיולוגיה במעגל סגור. ודא אם קצב הזרימה הוא 2 מ"ל לדקה.
- פתח את תיבת התיו (5% CO2/95% O2)שסתום ולבדוק את מפלס המים במערכת.
- שים את נייר המסנן בתא הקלטת הממשק כדי לנקז מדיום עודף ואת נייר ניקוי העדשה מתחת למסגרת כדי לספק בינוני לפרוסה.
- הפעל את בקר הטמפרטורה, את המגברים ואת המיקרומניפולטור.
- תן את הטמפרטורה בתא ממשק להתייצב ב 37 °C (69 °F) לפני תחילת ההקלטות.
- הכן נוזל שדרתי מלאכותי (aCSF: 124 mM NaCl, 3mM KCl, 1.2 mM NaH2PO4, 25 מ"מ NaHCO3, 10 מ"מ גלוקוז, 2 mM CaCl2, 1 mM MgSO4 עם pH 7.4) ולהשתמש בו כדי למלא את אלקטרודה זכוכית עם מזרק. שים את זה באלקטרודה המקבלת.
- הקלטות של פעילות ספונטנית
- לאחר שהטמפרטורה יציבה, מוציאים את הצלחת מהחממה וחותכים פרוסה אחת מההכנסה עם להב חד מאוד. מניחים אותו בצלחת 60 מ"מ עם טיפה של בינוני. קח את זה לתא ההקלטה של הממשק.
- מניחים את הפרוסה בתא הממשק עם ההיפוקמפוס בפינה הימנית התחתונה. מקם את האלקטרודה המקבלת בשכבת התא הפירמידלי CA3.
- המשך לפרוטוקול הרכישה הרציף ורשומה למשך 30 דקות.
3. מבחני ספיגת PI
הערה: מוות תאי הוערך על ידי ניטור ספיגת הסלולר של יודיד צבע פלואורסצנטי (PI). PI הוא תרכובת קוטבית, אשר נכנס לתאים עם קרום התא פגום אינטראקציה עם DNA פולט פלואורסצנטיות אדומה (ספיגה 493 ננומטר, פליטה 630 ננומטר). מאז PI אינו חדיר לתאים חיים, הוא משמש כדי לזהות תאים מתים באוכלוסייה.
- דגירה PI
- הכן, במדיום תרבות, דילול טרי 1:10 של מלאי PI.
- לבדיקת ספיגת PI להסיר את הצלחת מן החממה בזהירות להעלות את הכנס. הוסף 13 μL של PI למדיום, עם פיפטה P20, קבלת ריכוז סופי של 2 מיקרומטר. להתסיס לאט את הצלחת לפני לשים את הכנס בחזרה במקום. ודא שאין בועות מתחת לפרוסות.
- מחזירים את הפרוסות לאינקובטור של 37 מעלות צלזיוס למשך 2 שעות.
- המשך עם פרוטוקול האימונוהיסטוכימיה, כמתואר בסעיף הבא. מכסים את הצלחות עם אלומיניום, שכן PI הוא רגיש לאור.
4. אימונוהיסטוכימיה
הערה: באימונוהיסטוכימיה נוגדן ספציפי לנוירונים, כמו גם נוגדנים המסוגלים להפלות פנוטיפים נחים ומגיבים של מיקרוגליה ואסטרוציטים, שימשו להערכת משך המוות העצבי והגליוזיס בפרוסות אורגנוטיפיות דמויי קליפת המוח הריאנלית-היפוקמפוס.
- קיבוע רקמות
- מוציאים את הצלחת מהחממה ושואבים את המדיום. לתקן את הפרוסות עם 4% paraformaldehyde (PFA) במשך 1 שעה ב RT, על ידי הוספת 1 מ"ל של PFA מתחת ומעל הפרוסות, עם פיפטה P1000.
- הסר את PFA ולהוסיף 1 מ"ל של PBS. הוסיפו גם PBS מתחת ומעל לפרוסות.
- שמור את הפרוסות ב 4 מעלות צלזיוס, ב PBS, עד לשימוש נוסף. תמיד לשים parafilm סביב הצלחות, כדי למנוע ייבוש.
- שלבים חיסוניים
- לשטוף פעמיים, 10 דקות בכל פעם, עם 1 מ"ל של PBS.
- הכינו פתרון חדירות/חסימה המכיל 1% טריטון-X100, 10% HS ו-10% BSA ב-PBS. הכן פתרון BSA של 5%.
- ציירו שני מלבנים בעזרת העט ההידרופובי (איור 2A). חותכים את הפרוסות מההכנסה (איור 2B)בלהב חד במיוחד. שים שתי פרוסות לשקופית (איור 2C)והוסף 140 μL של פתרון חדירה/חסימה בחלק העליון של כל פרוסה, באמצעות פיפטה P200. דגירה במשך 3 שעות ב RT.
- לדלל את הנוגדנים העיקריים לדילול העבודה ב 5% BSA ב PBS. דגירה עם הנוגדנים העיקריים לילה ב 4 מעלות צלזיוס.
- דגירה עם הנוגדנים המשניים עבור 4 שעות ב RT. משלב זה הלאה, להגן על הצלחת מפני אור מאז פלואורופורים הם עובדים עם.
- מניחים טיפה 50 μL של פתרון Hoechst על החלק העליון של כל פרוסה דגירה במשך 20 דקות ב RT.
- לשטוף בין הדגירה. תמיד לשטוף שלוש פעמים, במשך 10 דקות בכל פעם, עם PBS-T.
- הסר Hoechst ולשטוף כמומלץ.
- מוסיפים 50 μL של מדיום הרכבה בחלק העליון של כל פרוסה. מכסים בכיסויי זכוכית ומקיפים בלק ציפורניים (איור 2D).
- תן לו להתייבש ב RT במשך 24 שעות.
- דמיינו את המערכת החיסונית מתחת למיקרוסקופ קונפוקאלי. שמור את הפרוסות המוכתמות ב -20 מעלות צלזיוס.

איור 2: הליך ספציפי לבדיקת האימונוהיסטוכימיה. (A) עם העט ההידרופובי לצייר שני ריבועים בשקופית. (B) גזור את פיסת ההוספה המכילה את הפרוסה. (ג)מניחים כל פרוסה בריבועים המצוירים בעט הידרופובי ומתחילים את שלב ההחלחלה/חסימה. (D) לאחר סיום הפרוטוקול, לסיים על ידי הרכבה פרוסות בינוני הרכבה, מכסה עם כיסוי זכוכית ומקיף אותו עם לק. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
בהתבסס על תיאורים קודמים של ניתוח אותות אפילפטיים בפרוסות היפוקמפוס אורגנוטיפיות, הפרשות אפילפטיות בין-מדינתיות מוגדרות כאן כפריקים פרוקסימליים המובחנים בבירור מפעילות רקע, עם שינוי פתאומי בקוטביות ומתרחשים בתדר נמוך (<2 הרץ). הפרשות Paroxysmal שנמשך יותר מ 10 s ומתרחשים בתדירות גבוהה יותר (≥2 הרץ) מאופיינים כפעילות אפילפטיפורם ictal. אם אירוע ictal מתרחש בתוך 10 s לאחר הקודם, שני אירועים אלה נחשבים רק אירוע ictal אחד.
פרוסות אורגנוטיפיות של קליפת המוח הריאנאלית ב-7 DIV (איור 3A)מתארות פעילות מעורבת דמוית אינטרקלים ואינטלים. ב-14 DIV (איור 3B),פעילות ספונטנית מאופיינת בהפרשות ictal, המתפתחות לפעילות ictal מדהימה ב- 21 DIV, עם אירועי ictal הנמשכים >1 דקות (איור 3C).
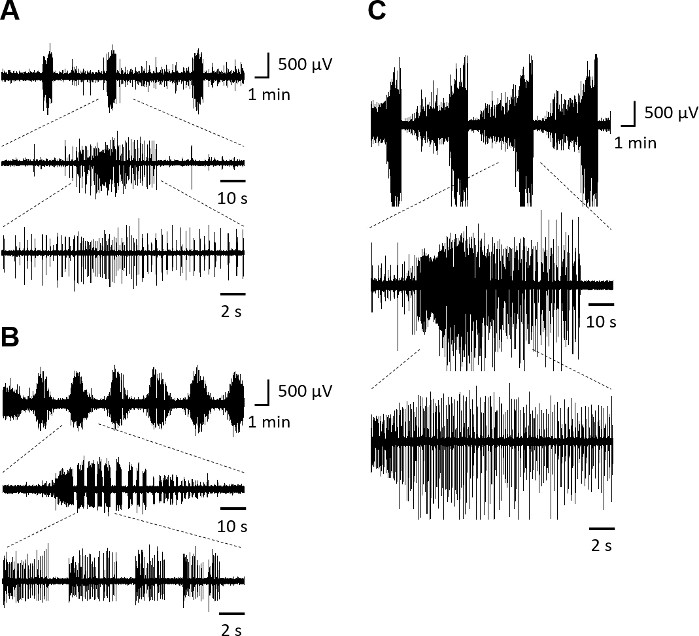
איור 3: פעילות אפילפטיפורמית ספונטנית של פרוסות אורגנוטיפיק קליפת המוח הריאנלית-היפוקמפוס. אירועים אלקטרוגרפיים מייצגים דמויי תפיסה, המתועדים מאזור CA3 בתא מסוג ממשק, לאחר (A) 7 DIV, (B) 14 DIV ו - (C) 21 DIV. פרטי תפיסה מוצגים במעקבים נמוכים יותר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בדיקות ספיגת PI ואחריו אימונוהיסטוכימיה נגד הסמן העצבי NeuN שמטרתו לזהות מוות עצבי. ספיגת PI על ידי נוירונים פרטניים ופירמידליים נצפתה ב-7 פרוסות DIV (חצים באיור 4A),אך מספר תאי העצב PI+ גדל ב-14 DIV (חצים באיור 4B),מה שמאשש מוות עצבי מוגבר עם התקדמות האפילפטוגנזה.
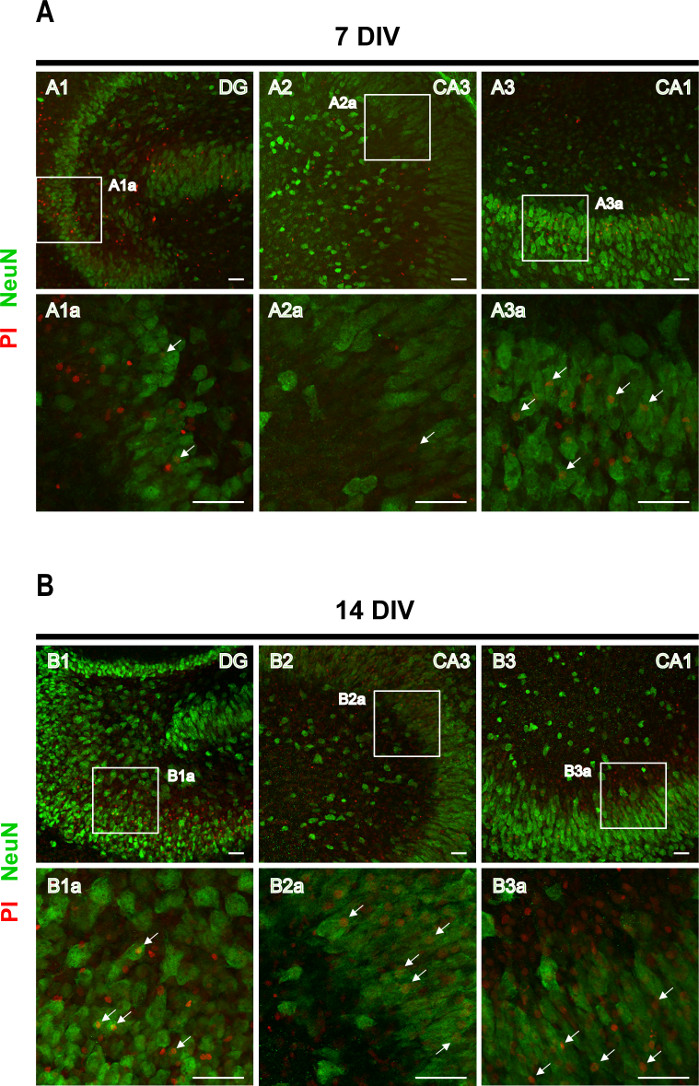
איור 4: תמונות מייצגות של פרוסות אורגנוטיפיות מוכתמות בקליפת המוח של נויN ו-PI בהיפוקמפוס. תמונות של נוירונים בוגרים מוכתמים NeuN ותאים חיוביים PI נרכשו ב (A) 7 DIV ו - (B) 14 DIV, על מיקרוסקופ לייזר confocal עם מטרה 20x. מוצגות תמונות מוגדלות של האזורים המקווקווים. החצים מצביעים על נוירונים למוות (בכתום). סרגל קנה מידה, 50 מיקרומטר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כתם כפול של Iba1, יחד עם CD68, שימש להערכת פנוטיפ microglia. Iba1 הוא סמן microglia/מקרופאגים, בעוד CD68 הוא חלבון ליזוזומלי לידי ביטוי ברמות גבוהות על ידי microglia תגובתי ברמות נמוכות על ידי מנוחה microglia. ב-7 פרוסות DIV, מיקרוגליה פרועה עם ביטוי CD68 נמוך (חצים באיור 5A)שופעת יותר מאיבא1+/CD68+ מיקרוגליה תגובתית (ראשי חץ באיור 5A),ואילו ב-14 DIV, בכל אזורי ההיפוקמפוס, Iba1+/CD68+ microglia M1 סבוך/אמובואיד (ראשי חץ באיור 5B)חורגים ממיקרוגליה עם ביטוי CD68 נמוך (חצים באיור 5B). ב 14 DIV כמה Iba1+/CD68+ תאים עם מראה היפר-השלכות ניתן להצביע (ראשי חץ פתוחים באיור 5B), אשר עשוי להציע את המופע של פנוטיפ אנטי דלקתי M2 של microglia. עם זאת, עניין זה דורש מחקר נוסף.
מחקרים שנעשו לאחרונה הראו כי פציעות מערכת העצבים המרכזית ייזום שונים יכולים לעורר לפחות שני סוגים של אסטרוציטים תגובתי, A1 ו- A2, עם אסטרוציטים A1 להיות neurotoxic16. A1 תת סוג של אסטרוציטים מאופיין בביטוי מוגבר של משלים C316,17,18. המשלים C3, אשר ממלא תפקיד מרכזי בהפעלת המערכת המשלימה, מייצר C3b, אשר מושפל עוד יותר iC3b, C3dg ו C3d19. לכן, כתם כפול של GFAP ו C3d הועסק כדי להעריך אסטרוליוזיס. ב- 7 DIV הביטוי של C3d בקושי ניתן לגילוי (איור 6A), ואילו ב- 14 פרוסות DIV ניתן לצפות ב- GFAPהיפרטרופי +/C3d+ אסטרוציטים (ראשי חץ באיור 6B), דבר המצביע על הפעלה הדרגתית של אסטרוציטים A1.
התוצאות מראות הפעלה מתקדמת של microglia ואסטרוציטים לאורך כל אפילפטוגנזה, מחקה את האירועים המתוארים בחולים עם אפילפסיה ובמודלים של בעלי חיים של פתולוגיה זו.
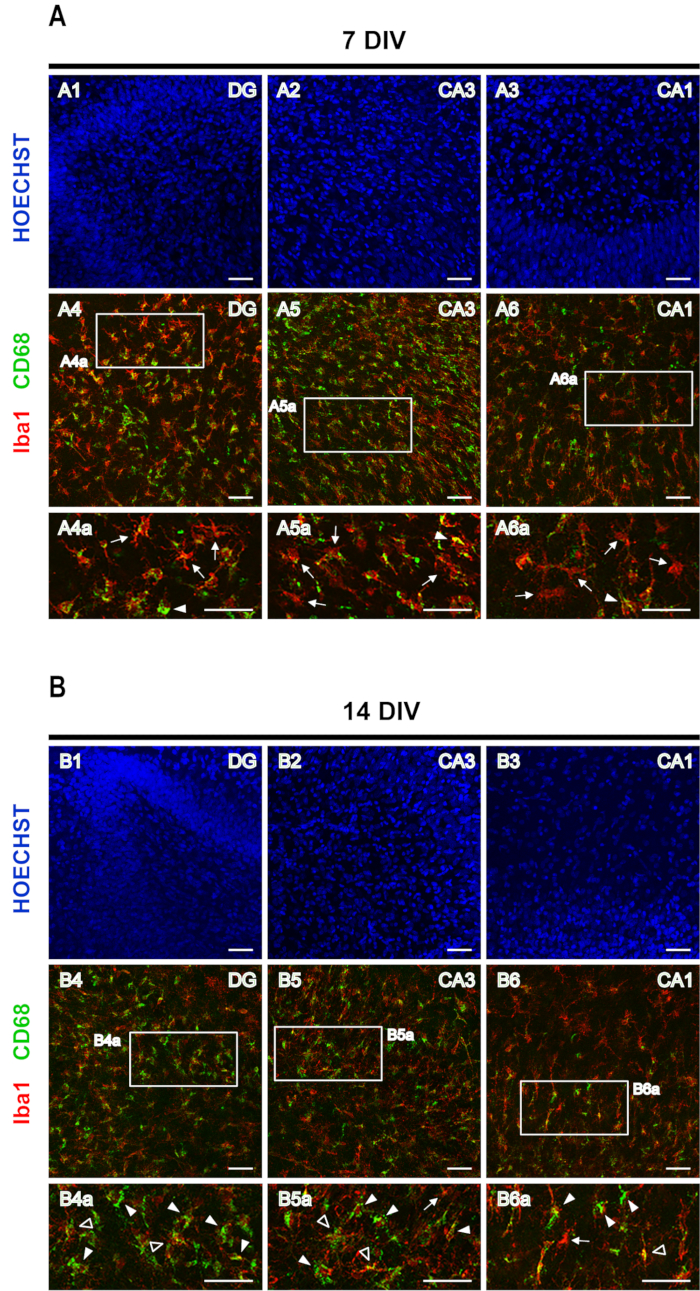
איור 5: תמונות מייצגות של איבא1 ו-CD68 מוכתמות בפרוסות אורגנוטיפיק קליפת המוח-היפוקמפוס מוכתמות. תמונות של איבא1 ו- CD68 מיקרוגליה מוכתמת, וגרעיני מוכתם Hoechst, נרכשו ב (A) 7 DIV ו - (B) 14 DIV, על מיקרוסקופ לייזר confocal עם מטרה 20x. מוצגות תמונות מוגדלות של האזורים המקווקווים. החצים מצביעים על Iba1+/CD68- נח microglia, ראשי חץ מצביעים Iba1+/ CD68+ microglia סבוך / אמובואיד וראשי חץ פתוחים לחשוף Iba1+/ CD68+ microglia hyper-ramified. סרגל קנה מידה, 50 מיקרומטר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
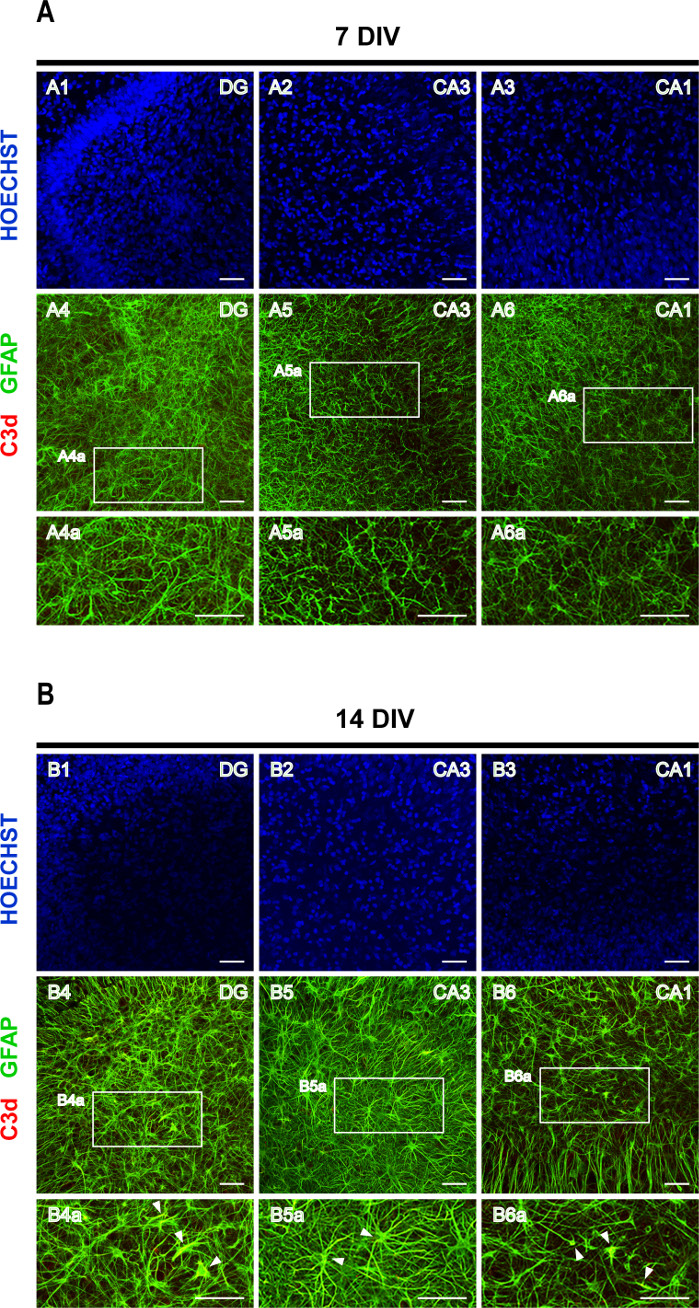
איור 6: תמונות מייצגות של GFAP ופרוסות אורגנוטיות מוכתמות בקליפת המוח-היפוקמפוס C3d. תמונות של אסטרוציטים מוכתמים GFAP ו- C3d, וגרעיני מוכתם Hoechst, נרכשו ב (A) 7 DIV ו - (B) 14 DIV, על מיקרוסקופ לייזר קונפוקלי עם מטרה 20x. מוצגות תמונות מוגדלות של האזורים המקווקווים. ראשי חץ מצביעים על GFAP+/C3d+ אסטרוציטים A1 תגובתי (בצהוב). סרגל קנה מידה, 50 מיקרומטר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
מודלים של בעלי חיים של אפילפסיה היו חיוניים לגילוי של AEDs רבים, אולם הם דורשים בעלי חיים רבים ורובם זמן רב בשל התקופה הסמויה להתפרצות התקפים. אינדוקציה מגנזיום נמוך של פעילות אפילפטיפורם בפרוסות חריפה ההיפוקמפוס גם תוקן ביסודיות בספרות3, אבל פרוסות חריפות יש כדאיות 6-12 שעות מה שהופך את זה בלתי אפשרי להעריך שינויים ארוכי טווח. פרוסות organotypic ניתן לשמור בתרבות מימים עד שבועות, המאפשר להתגבר על זמן הכדאיות הקצרה של פרוסות חריפות, מודלים של אפילפטוגנזה בפרוסות היפוקמפוס organotypic הוצעו3,7,8.
כאן אנו מתארים את הכנת פרוסות organotypic, הכולל את קליפת המוח rhinal ואת ההיפוקמפוס. לפרוסות אלה לוקח 15-20 דקות להכין לכל בעל חיים, החל מהקרבת בעלי חיים ועד להצבת פרוסות על התוספות, וניתן להשיג 6-8 פרוסות לכל חצי כדור. יש לנקוט משנה זהירות בעת פתיחת חצי הכדור כדי לחשוף את ההיפוקמפוס וכאשר מסירים את הרקמה מנייר הסינון לאחר ההסתעפות. עודף רקמה מעל ההיפוקמפוס יכול גם לסכן את שלמות הפרוסה במהלך ההחתכה.
פרוסות אורגנוטיפיות של קליפת המוח הריאנלית-היפוקמפוס מתארות פעילות מתפתחת דמוית אפילפטית הדומה לאפילפסיה של vivo. לאחר שבוע בתרבות, רוב הפרוסות מתארות פעילות מעורבת דמוית ictal, אשר מתקדמת לאירועים דמויי ictal בלבד עם זמן בתרבות. עד כה, רשמנו כמה הפרשות interictal בפרוסות עם 2-3 שבועות. במערכת זו, פעילות דמוית אפילפטית נראה לפתח מהר יותר מאשר פרוסות היפוקמפוס organotypic. ניתן לייחס זאת לנוכחות קליפת המוח הריאנלית, המשמרת את רוב הקלט הפונקציונלי להיפוקמפוס. כדי לטפל באופן מלא בבעיה זו, אפיון מלא של האותות האפילפטיים המוצגים על ידי פרוסות אלה לאורך זמן בתרבות, כגון מספר ומשך האירועים ictal, יחד עם משרעת ותדירות שלהם, מתבצע כעת.
מערכת זו יכולה להישמר בתרבות במשך יותר משלושה שבועות, ומחקה קורלציות מולקולריות רבות של אפילפסיה, כגון מוות עצבי, הפעלה של microglia ואסטרוציטים וייצור מוגבר של ציטוקינים פרו דלקתיים14, המאפשר אפיון ארוך טווח של היבטים אלה. הוא מייצג גם פלטפורמת סינון קלה לשימוש, שבה ניתן ליישם התערבויות תרופתיות המכוונות למסלולים תאיים ספציפיים וניתן לבדוק מטרות טיפוליות פוטנציאליות. אין ספק, המערכת המוצגת כאן יכולה לעזור להאיר עוד יותר את המנגנונים של אפילפטוגנזה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים רוצים להכיר ביחידת הביו-הדמיה של המכון המולקולרי של מדיצ'ינה ז'ואאו לובו אנטונס, על כל ההצעות הנוגעות לרכישת תדמית.
פרויקט זה קיבל מימון מתוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת הסכם המענק Nº 952455, Fundação para a Ciênciae Tecnologia (FCT) באמצעות פרויקט PTDC/MEDFAR/30933/2017 ופקולדה דה מדיצ'ינה דה אוניברסיטת ליסבון.
Materials
| Name | Company | Catalog Number | Comments |
| 50 mL Centrifuge Tube, Conical Bottom | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira, Lda | UN1170 | |
| Amplifier | Axon Instruments | Axoclamp 900A | |
| Amplifier | Axon Instruments | Digidata 1440A | |
| Anti-C3d (goat) | R&D Systems | AF2655 | Dilute at a ratio 1:1000 |
| Anti-CD68 (mouse) | Abcam | ab31630-125ug | Dilute at a ratio 1:250 |
| Anti-GFAP (mouse) | Millipore SAS | MAB360 | Dilute at a ratio 1:500 |
| Anti-Iba1 (rabbit) | Abcam | ab108539 | Dilute at a ratio 1:600 |
| Anti-NeuN (rabbit) | Werfen | 16712943S | Dilute at a ratio 1:500 |
| Artificial cerebrospinal fluid (aCSF) | Homemade | ||
| B-27™ Supplement (50X), serum free | Thermo Fisher Scientific | 17504-044 | |
| Blades for scalpel handle | Fine Science Tools | 10011-00 | |
| Bovine Serum Albumin (BSA) | NZYTech | MB04602 | 5% BSA is used to dilute the primary antibodies. Add 0.5g BSA in 10 mL PBS. |
| Brain/Tissue Slice Chamber System | Warner Instruments | ||
| Calcium chloride dihydrate | Merck Millipore | 1.02382.0500 | |
| Cell culture inserts, 30 mm, hydrophilic PTFE | Millipore SAS | PICM03050 | |
| Cold light source | SCHOTT | KL 300 LED | |
| Confocal laser microscope | Zeiss | LSM 710 | |
| Conventional incubator | Thermo Scientific Heraeus | BB15, Function Line | Set to 37 °C and 5% CO2 |
| D(+)-Glucose monohydrate | Merck Millipore | 1.08342.1000 | |
| D-(+)-Glucose solution, 45% in water | Sigma | G8769 | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| Dissecting microscope/magnifier | MEIJI TECHNO CO. LTD | 122285 | |
| Donkey anti-goat IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A11057 | Dilute at a ratio 1:200 |
| Donkey anti-mouse IgG (H+L) coupled to Alexa Fluor 488 | Invitrogen | A21202 | Dilute at a ratio 1:200 |
| Donkey anti-mouse IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A10037 | Dilute at a ratio 1:200 |
| Donkey anti-rabbit IgG (H+L) coupled to Alexa Fluor 488 | Invitrogen | A21206 | Dilute at a ratio 1:500 |
| Donkey anti-rabbit IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A10042 | Dilute at a ratio 1:500 |
| Dumont #5 Fine Forceps Biologie Inox | Fine Science Tools | 11254-20 | |
| Dumont #5 Forceps Standard Inox | Fine Science Tools | 11251-20 | |
| Dumont #7 Forceps Standard Dumoxel | Fine Science Tools | 11271-30 | |
| Dumont Medical #7S Forceps Short Curve Inox | Fine Science Tools | 11273-22 | |
| Gentamycin stock solution, 50 mg/mL | Thermo Fisher Scientific | 15750-037 | |
| Gey’s Balanced Salt Solution (GBSS) | Biological Industries | 01-919-1A | |
| Glass Electrodes | Science Products | GB150F-10 | Round tips homemade |
| Glass Pasteur pipettes, 230 mm | VWR International | 612-1702 | |
| Hank’s Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 24020-091 | |
| Hoechst 33342 | Invitrogen | H1399 | Stock solution at 2 mg/mL in PBS |
| Horse Serum, Heat Inactivated (HS) | Thermo Fisher Scientific | 26050-088 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 | |
| Hydrophobic Pen | Dako | S200230-2 | |
| INCU-Line IL10 | VWR | 390-0384 | |
| Interface chamber | Warner Instruments | BSC-HT Haas Top | |
| Iris Spatula Curved | Fine Science Tools | 10092-12 | |
| Labculture Class II Biological Safety Cabinet | HERASafe | HS 12 | |
| Lens Cleaning Paper | TIFFEN | ||
| L-Glutamine solution 200 mM (Q) | Thermo Fisher Scientific | 25030-024 | |
| Magnesium sulfate heptahydrate | Merck Millipore | 1.05886.0500 | |
| Micro tube 0.5 mL, PP | SARSTEDT | 72,699 | |
| Micro tube 1.5 mL, PP | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL, PP | SARSTEDT | 72.691 | |
| Micromanipulators | Sutter Instrument | MP-285 | |
| Miroscope Cover Glasses, 24 mm x 60 mm | Marienfeld | 102242 | |
| Nail polish | Cliché | ||
| Neurobasal-A Medium (NBA) | Thermo Fisher Scientific | 10888-022 | |
| Opti-MEM® I Reduced-Serum Medium | Thermo Fisher Scientific | 31985-047 | |
| Paraformaldehyde, powder | VWR Chemicals | 2,87,94,295 | |
| Peristaltic pump | Gilson | M312 | |
| Phosphate saline buffer (PBS) | Homemade. PBS with 0.5% Tween-20 (PBS-T) is used to wash slices during the immunohistochemistry assay. | ||
| Phosphate standard solutions, PO43- in water | BDH ARISTAR | 452232C | |
| Pipette set | Gilson | P2, P10, P20, P100, P200, P1000 | |
| Platinum 5 blades | Gillette | ||
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide (PI) | Sigma-Aldrich | P4170-25MG | Stock solution at 1 mg/mL in water. |
| Qualitative Filter Paper, Cellulose, Grade 1, 55 mm | Whatman | 1001-055 | Medium retention 11µm |
| Qualitative Filter Paper, Cellulose, Grade 1, 90 mm | Whatman | 1001-090 | Medium retention 11µm |
| Scalpel handle | Fine Science Tools | 91003-12 | |
| Slip Tip Insulin Syringe without Needle 1 mL | SOL-M | 161000 | |
| Sodium chloride | VWR Chemicals | 27800.360 | |
| Sodium dihydrogen phosphate monohydrate | Merck Millipore | 1.06346.1000 | |
| Sodium hydrogen carbonate | Merck Millipore | 1.06329.1000 | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Stimulator | Astro Med Inc GRASS Product Group | S48 Stimulator | |
| Student Scissors Straight SharpSharp 12cm | Fine Science Tools | 91402-12 | |
| SuperFrost Plus™ Adhesion slides | Thermo Fisher Scientific | J1800AMNZ | |
| TC-Treated Sterile 60 x 15mm Tissue Culture Dish | Corning | CORN430166 | |
| TC-Treated Sterile 6-Wells Plates | Corning | CORN3516 | |
| Temperatue controller | MEDICAL SYSTEMS CORP. | TC-102 | |
| Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 350 μm |
| Triton X-100 | BDH | 14630 | |
| Tween-20 | Sigma | P2287 |
References
- Fisher, R. S., et al. Electrical stimulation of the anterior nucleus of thalamus for treatment of refractory epilepsy. Epilepsia. 51, 899-908 (2010).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20, 359-368 (2011).
- Heinemann, U., Kann, O., Schuma, S., Pitkänen, A., Schwartzkroin, P. A., Moshé, S. L. An overview of in vitro seizure models in acute and organotypic slices. Models of seizures and epilepsy. , 35-44 (2006).
- Sundstrom, L., Morrison, B., Bradley, M., Pringle, A. Organotypic cultures as tools for functional screening in the CNS. Drug Discovery Today: Targets. 10, 993-1000 (2005).
- Holopainen, I. E. Organotypic hippocampal slice cultures: a model system to study basic cellular and molecular mechanisms of neuronal cell death, neuroprotection, and synaptic plasticity. Neurochemical Research. 30, 1521-1528 (2005).
- Noraberg, J., et al. Organotypic hippocampal slice cultures for studies of brain damage, neuroprotection and neurorepair. CNS Neurological Disorders Drug Targets. 4, 435-452 (2005).
- Dyhrfjeld-Johnsen, J., Berdichevsky, Y., Swiercz, W., Sabolek, H., Staley, K. J. Interictal spikes precede ictal discharges in an organotypic hippocampal slice culture model of epileptogenesis. Journal of Clinical Neurophysiology. 27, 418-424 (2010).
- Chong, S. A., et al. Intrinsic Inflammation Is a Potential Anti-Epileptogenic Target in the Organotypic Hippocampal Slice Model. Neurotherapeutics. 15, 470-488 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5, 19-33 (2007).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Doussau, F., Dupont, J. L., Neel, D., Schneider, A., Poulain, B., Bossu, J. L. Organotypic cultures of cerebellar slices as a model to investigate demyelinating disorders. Expert Opinion on Drug Discovery. 12 (10), 1011-1022 (2017).
- Vismer, M. S., Forcelli, P. A., Skopin, M. D., Gale, K., Koubeissi, M. Z. The piriform, perirhinal, and entorhinal cortex in seizure generation. Frontiers in Neural Circuits. 9, 27 (2015).
- Magalhães, D. M., Pereira, N., Rombo, D. M., Beltrão-Cavacas, C., Sebastião, A. M., Valente, C. A. Ex vivo model of epilepsy in organotypic slices - a new tool for drug screening. Journal of Neuroinflammation. 15, 203 (2018).
- Ravizza, T., Balosso, S., Vezzani, A. Inflammation and prevention of epileptogenesis. Neuroscience Letters. 497 (3), 223-230 (2011).
- Liddelow, S. A., et al. Neurotoxic reactive astrocytes are induced by activated microglia. Nature. 541, 481-487 (2017).
- Wu, T. Complement C3 is activated in human AD brain and is required for neurodegeneration in mouse models of amyloidosis and tauopathy. Cell Reports. 28 (8), 2111-2123 (2019).
- Hartmann, K., et al. Complement 3+-astrocytes are highly abundant in prion diseases, but their abolishment led to an accelerated disease course and early dysregulation of microglia. Acta Neuropathologica Communications. 7, 83 (2019).
- Nilsson, U. R., Funke, L., Nilsson, B., Ekdahl, K. N. Two conformational forms of target-bound iC3b that distinctively bind complement receptors 1 and 2 and two specific monoclonal antibodies. Upsala Journal of Medical Sciences. 116, 26-33 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved