Method Article
Ein Modell der Epileptogenese in rhinalen Kortex-Hippocampus Organotypischen Schnittkulturen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir die Herstellung von rhinalen Kortex-Hippocampus organotypischen Scheiben. Unter einem allmählichen und kontrollierten Serumentzug zeigen diese Scheiben sich entwickelnde epileptische Ereignisse und können als Ex-vivo-Modell der Epileptogenese angesehen werden. Dieses System stellt ein hervorragendes Werkzeug zur Überwachung der Dynamik spontaner Aktivität sowie zur Beurteilung des Fortschreitens neuroinflammatoratorischer Merkmale im Verlauf der Epileptogenese dar.
Zusammenfassung
Organotypische Schnittkulturen wurden häufig zur Modellierung von Hirnerkrankungen eingesetzt und gelten als hervorragende Plattformen für die Bewertung des neuroprotektiven und therapeutischen Potenzials eines Medikaments. Organotypische Scheiben werden aus explantiertem Gewebe hergestellt und stellen eine komplexe mehrzellige ex vivo Umgebung dar. Sie erhalten die dreidimensionale Zytoarchitektur und die lokale Umgebung der Gehirnzellen, erhalten die neuronale Konnektivität und die neuron-glia-Wechselwirkung. Hippocampus-organotypische Scheiben gelten als geeignet, um die grundlegenden Mechanismen der Epileptogenese zu erforschen, aber klinische Forschung und Tiermodelle der Epilepsie haben gezeigt, dass der rhinale Kortex, bestehend aus perirhinalen und entorhinalen Kortiken, eine relevante Rolle bei der Anfallsgenerierung spielt.
Hier beschreiben wir die Herstellung von rhinalen Kortex-Hippocampus organotypischen Scheiben. Aufzeichnungen spontaner Aktivität aus dem CA3-Bereich unter Perfusion mit vollständigem Wachstumsmedium, bei physiologischer Temperatur und in Abwesenheit pharmakologischer Manipulationen zeigten, dass diese Scheiben sich entwickelnde epileptische Ereignisse im Laufe der Zeit in Kultur darstellen. Ein erhöhter Zelltod durch Propidieniodid-Aufnahmetest und Gliose, die mit fluoreszenzgekoppelter Immunhistochemie beurteilt wurde, wurde ebenfalls beobachtet. Der vorgestellte experimentelle Ansatz unterstreicht den Wert von rhinalen kortex-hippocampus organotypischen Schnittkulturen als Plattform, um die Dynamik und das Fortschreiten der Epileptogenese zu untersuchen und potenzielle therapeutische Ziele für diese Hirnpathologie zu untersuchen.
Einleitung
Epilepsie, eine der weltweit häufigsten neurologischen Erkrankungen, ist durch das periodische und unvorhersehbare Auftreten synchronisierter und übermäßiger neuronaler Aktivität im Gehirn gekennzeichnet. Trotz der verschiedenen verfügbaren Antiepileptika (AEDs) ist ein Drittel der Patienten mit Epilepsie auf Therapie1 refraktär und erlebt weiterhin Anfälle und kognitiven Verfall. Darüber hinaus behindern verfügbare AEDs die Kognition aufgrund ihrer relativ generalisierten Wirkung auf neuronale Aktivität. Epileptogenese ist beim Menschen schwer zu untersuchen, aufgrund der multiplen und heterogenen epileptogenen Verletzungen, langen Latenzzeiten von Monaten bis Jahrzehnten und der irreführenden Wirkung der antikonvulsiven Behandlung nach dem ersten spontanen Anfall.
Die Identifizierung potenzieller therapeutischer Wirkstoffe zur Behandlung von Epilepsie ist durch Tiermodelle der Epilepsie möglich geworden: 1) genetische Modelle, die genetisch prädisponierte Tiere verwenden, bei denen Anfälle spontan oder als Reaktion auf einen sensorischen Reiz auftreten; 2) Modelle von durch elektrische Stimulation induzierten Anfällen; und 3) pharmakologische Modelle der Anfallsinduktion, die unter anderem Pilocarpin (ein Muskarinrezeptoragonist), Kainat (ein Kainatrezeptoragonist) oder 4-Aminopyridin (ein Kaliumkanalblocker) verwenden. Diese Modelle waren entscheidend für das Verständnis der Verhaltensänderungen sowie der molekularen und zellulären Mechanismen, die der Epilepsie zugrunde liegen, und sie haben zur Entdeckung vieler AEDs geführt2.
Ex-vivo-Präparate sind auch ein leistungsfähiges Werkzeug, um die Mechanismen zu erforschen, die der Epileptogenese und Iktogenese zugrunde liegen. Akute Hippocampusscheiben, die elektrophysiologische Untersuchungen lebender Zellen über einen Zeitraum von 6-12 h ermöglichen, und organotypische Hippocampusscheiben, die in einem Inkubator über einen Zeitraum von Tagen oder Wochen konserviert werden können, wurden in Studien zur epileptiformen Aktivität ausgiebig verwendet3.
Organotypische Hirnschnitte werden aus explantiertem Gewebe hergestellt und stellen ein physiologisches dreidimensionales Modell des Gehirns dar. Diese Scheiben bewahren die Zytoarchitektur der interessierenden Region und umfassen alle Gehirnzellen und ihre interzelluläre Kommunikation4. Die am häufigsten verwendete Region für langfristige organotypische Kulturen ist der Hippocampus, da diese Region bei mehreren neurodegenerativen Erkrankungen von neuronalem Verlust betroffen ist. Sie wurden häufig zur Modellierung von Hirnerkrankungen eingesetzt und gelten als hervorragende Werkzeuge zur Beurteilung des neuroprotektiven und therapeutischen Potenzials eines Arzneimittels5,6. Modelle der Epileptogenese, des Schlaganfalls und der Aβ-induzierten Toxizität wurden in hippokampalen organotypischenScheiben 7,8,9,10beschrieben. Die Parkinson-Krankheit wurde in ventralem Mesencephalon und Striatum sowie in Cortex-Corpus callosum-striatum-substantia nigra, organotypischenScheiben 11erforscht. Organotypische Kleinhirnschnittkulturen ahmen viele Aspekte der Axon-Myelinisierung und der Kleinhirnfunktionen nach und sind ein weit verbreitetes Modell zur Untersuchung neuartiger therapeutischer Strategien bei Multipler Sklerose12.
Klinische Forschung und Tiermodelle der Epilepsie haben jedoch gezeigt, dass der rhinale Kortex, der aus perirhinalen und entorhinalen Kortiken besteht, eine Rolle bei der Anfallsgenerierungspielt 13. So wurde ein Modell der Epileptogenese in rhinalen Kortex-Hippocampus-organotypischen Scheiben etabliert14. Unter einem allmählichen und kontrollierten Serumentzug zeigen rhinale kortex-hippocampus organotypische Scheiben entwickelnde epileptische Ereignisse, im Gegensatz zu analogen Scheiben, die immer in einem serumhaltigen Medium aufbewahrt werden.
Bei Epilepsie, wie bei vielen akuten und chronischen Erkrankungen des zentralen Nervensystems, kann das neurozentrische Sehen die Mechanismen, die dem Beginn und dem Fortschreiten der Krankheit zugrunde liegen, nicht aufklären. Klinische und experimentelle Beweise deuten auf eine Gehirnentzündung hin, bei der Mikroglia und Astrozyten eine relevante Rolle spielen, als einer der Hauptakteure, die zum epileptischen Prozess beitragen. Pharmakologische Experimente in Tiermodellen der Epilepsie legen nahe, dass antiepileptogene Wirkungen durch gezielte entzündungsfördernde Wege erreicht werden können, und heutzutage gilt Neuroinflammation als eine neue Option für die Entwicklung von therapeutischen Ansätzen für Epilepsie15.
Hier beschreiben wir ausführlich die Herstellung von rhinalen kortex-hippocampus organotypischen Schnittkulturen sowie die Details zur Aufzeichnung spontaner epileptiformer Aktivität von ihnen. Wir heben hervor, dass dieses System mehrere neuroinflammatorische Aspekte der Epilepsie nachahmt und daher geeignet ist, die Rolle von Gliazellen und Neuroinflammation in dieser Pathologie zu untersuchen. Darüber hinaus stellt es eine einfach zu bedienende Plattform für das Screening potenzieller Therapieansätze für Epilepsie dar.
Protokoll
Das portugiesische Gesetz und die Richtlinien der Europäischen Union (2010/63/EU) wurden bei allen Verfahren zum Schutz von Tieren für wissenschaftliche Zwecke eingehalten. Alle hier beschriebenen Methoden wurden von der Institutional Animal Welfare Body (ORBEA-iMM) des iMM und der zuständigen nationalen Behörde (DGAV – Direção Geral de Alimentação e Veterinária) genehmigt.
1. Herstellung von rhinalen Kortex-Hippocampus-Scheiben
HINWEIS: Bei der Herstellung von rhinalen Kortex-Hippocampus-Scheiben werden P6-7 Sprague-Dawley-Ratten verwendet.
- Kulturaufbau und Medienvorbereitung
- Bereiten Sie am Tag vor der Kultur die erforderlichen Medien vor und legen Sie sie bei 4 °C ab.
- Präpariermedium: 25 mM Glukose in Gey's Balanced Salt Solution (GBSS).
- Aufbereitungsmedium: 50% Opti-MEM, 25% HBSS, 25% Pferdeserum (HS), 25 mM Glukose, 30 μg/ml Gentamycin.
- Erhaltungsmedium vorbereiten: Neurobasal-A (NBA), 2% B27, 1 mM L-Glutamin, 30 μg/ml Gentamycin, HS (15%, 10%, 5% und 0%).
- Gehirn-Ernte
- Kurz vor Beginn der Kultur 1,1 ml Kulturmedium in jede Vertiefung der 6-Well-Platte mit einer P1000-Pipette geben und bei 37 °C platzieren.
- Legen Sie alle Geräte (Seziermikroskop, Tissue Chopper, Sezierlampe, Sezierwerkzeuge, Elektroden, Platten, Einsätze und Filterpapiere) in die biologische Sicherheitswerkbank und sterilisieren Sie sie 15 Minuten lang unter UV-Licht.
- Passen Sie die Scheibendicke auf 350 μm an.
- Ziehen Sie das GBSS aus dem Kühlschrank. Fügen Sie 5 ml GBSS zu sechs Petrischalen hinzu. Pro Tier werden sechs Petrischalen benötigt.
- Euthanasieren Sie den Rattenwelp. Führen Sie die Enthauptung durch, indem Sie eine scharfe Schere an der Basis des Hirnstamms des Tieres verwenden.
- Waschen Sie den Tierkopf dreimal in kaltem GBSS und nehmen Sie ihn in die Sicherheitswerkbank.
- Gewebeisolierung und Aufbereitung von Scheiben
- Setzen Sie eine scharfe Zette fest in die Augenhöhlen ein, um den Kopf zu halten.
- Schneiden Sie mit einer dünnen Schere die Haut / Kopfhaut entlang der Mittellinie, beginnend mit dem Wirbelforamen in Richtung der Frontallappen und legen Sie sie beiseite.
- Schneiden Sie auf die gleiche Weise den Schädel und entlang der zerebralen Querfissur (Raum zwischen Gehirn und Kleinhirn). Mit einer gekrümmten langen Zette bewegen Sie sie auseinander.
- Entsorgen Sie die Riechkolben mit einem Spatel. Entfernen Sie das Gehirn vom Kopf und legen Sie es in eiskaltes GBSS mit der dorsalen Oberfläche nach oben (Abbildung 1A).
- Setzen Sie die feine Zette in das Kleinhirn ein und gehen Sie entlang der Mittellinie, wobei der Spatel jede Hemisphäre sehr vorsichtig öffnet (Abbildung 1B).
- Entfernen Sie mit einer kurzen Kurvenzette vorsichtig das überschüssige Gewebe, das die Hippocampi bedeckt, ohne die Hippocampusstruktur zu berühren. Dann mit einem Spatel unter jedem Hippocampus geschnitten (Abbildung 1C).
- Nehmen Sie eine Hemisphäre auf und legen Sie sie mit dem Hippocampus nach oben auf ein Filterpapier. Wiederholen Sie den Vorgang mit der anderen Hemisphäre und legen Sie sie parallel zur ersten in das Filterpapier. Legen Sie das Filterpapier auf den Tissue Chopper, wobei die Hemisphären senkrecht zur Klinge stehen, und schneiden Sie die Hemisphären in 350 μm Scheiben (Abbildung 1D).
- Legen Sie das geschnittene Gewebe in eine Petrischale mit kaltem GBSS (Abbildung 1E).
- Trennen Sie die Scheiben vorsichtig mit den Rundspitzenelektroden (Abbildung 1F). Bewahren Sie nur die Scheiben mit einem strukturell intakten Rhinalkortex und Hippocampus auf. DG- und CA-Bereiche sollten perfekt definiert sein, ebenso wie der entorhinale und perirhinale Kortex (Abbildung 1G).
- Legen Sie jede Scheibe mit einem Spatel und einer runden Spitzenelektrode auf den Einsatz (Abbildung 1H-I). Entfernen Sie überschüssiges Dissektionsmedium um jede Scheibe mit einer P20-Pipette (Abbildung 1J). Vier rhinale Kortex-Hippocampus-Scheiben können in einem einzigen Einsatz kultiviert werden (Abbildung 1K).
- Kulturpflege
- Wechseln Sie das Medium jeden zweiten Tag.
- Erwärmen Sie das Medium bei 37 °C.
- Nehmen Sie die Platten aus dem Inkubator. Nehmen Sie jeden Einsatz auf, indem Sie die Kunststoffkante mit einer Zette halten (Abbildung 1L).
- Verwenden Sie eine freie Hand, um das Medium aus dem Brunnen abzusaugen. Setzen Sie den Einsatz wieder in den Brunnen und fügen Sie mit einer P1000-Pipette 1 ml frisch erwärmtes Medium hinzu (Abbildung 1M). Wiederholen Sie diesen Vorgang für alle Einfügungen. Stellen Sie sicher, dass keine Luftblasen zwischen der Membran und dem Medium eingeschlossen sind.
HINWEIS: Epileptische Scheiben unterliegen einem allmählichen und kontrollierten Serumentzug im Medium. Ab 9 Tagen In Vitro (DIV) werden Slices in NBA ohne HS14gepflegt.
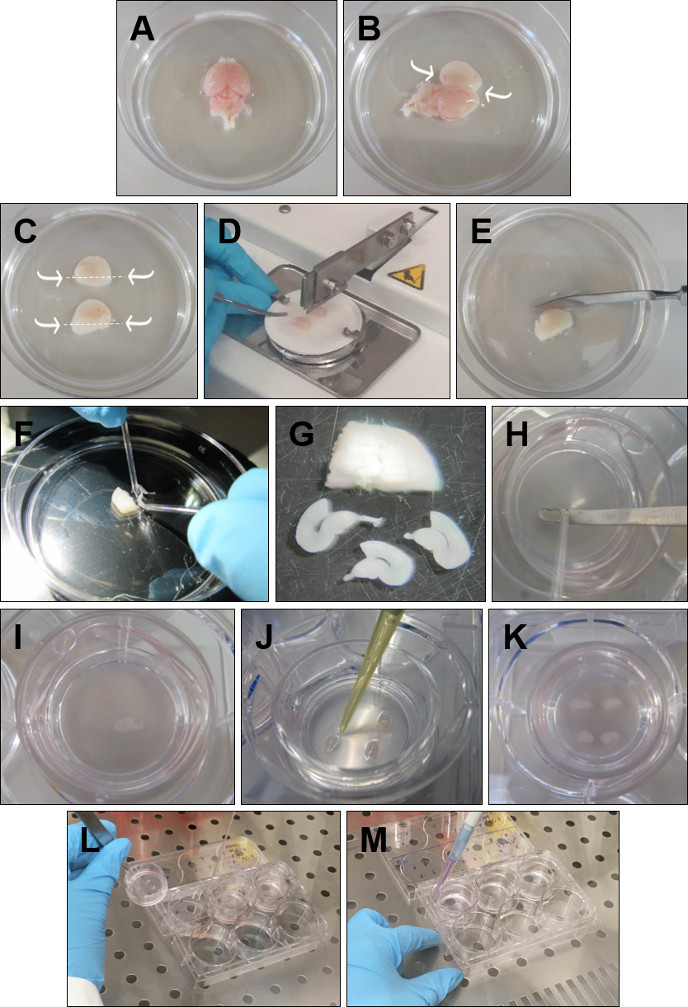
Abbildung 1: Detailliertes Verfahren zur Herstellung von rhinalen Kortex-Hippocampus-organotypischen Scheiben. (A) Entfernen Sie das Gehirn vom Kopf und legen Sie es in eiskaltes GBSS mit der dorsalen Oberfläche nach oben. (B) Setzen Sie die Zette in das Kleinhirn ein. Öffnen Sie das Gehirn durch die Mittellinie und entfernen Sie das überschüssige Gewebe über dem Hippocampus. (C) Mit einem Spatel, der unterhalb des Hippocampus geschnitten ist, wie durch die Pfeile angezeigt. (D) Legen Sie beide Hippocampi nach oben und parallel zueinander auf das Filterpapier und schneiden Sie 350 μm Scheiben auf den Tissue Chopper. (E) Legen Sie den in Scheiben geschnittenen Hippocampus in eiskalte GBSS. (F) Trennen Sie die Scheiben mit Hilfe von runden Glaselektroden. (G) Wählen Sie nur die Scheiben, die einen intakten rhinalen Kortex und Hippocampus darstellen. (H, I) Mit Hilfe einer runden Glaselektrode jede Scheibe auf den Spatel drücken und auf den Einsatz legen. (J) Entfernen Sie die GBSS, die das Slice umgibt. (K) Legen Sie vier Scheiben pro Einlage. (L) Um das Medium zu wechseln, heben Sie den Einsatz an und saugen Sie das Medium mit einer Glaspipette an. (M) Fügen Sie frisches Medium hinzu, indem Sie die Pipette zwischen den Einsatz und die Wände der 6-Wells-Platte legen. Stellen Sie sicher, dass sich keine Luftblasen unter den Scheiben befinden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Elektrophysiologische Aufnahmen
HINWEIS: Elektrophysiologische Aufnahmen wurden in rhinalen kortex-hippocampus organotypischen Scheiben an 7, 14 und 21 DIV in einer Grenzflächenkammer durchgeführt. Aufnahmen wurden mit einem Verstärker aufgenommen, digitalisiert und mit Software analysiert. Alle Aufnahmen waren bandpassgefiltert (achtpoliger Besselfilter bei 60 Hz und Gaußscher Filter bei 600 Hz).
- Setup-Vorbereitung
- Bereiten Sie 50 ml NBA-Medium mit 1 ml B27 und 250 μL L-Glutamin vor. Aufwärmen bei 37 °C.
- Stellen Sie das Elektrophysiologie-Setup in einen engen Kreislauf. Überprüfen Sie, ob die Durchflussrate 2 ml/min beträgt.
- Öffnen Sie das Carbox-Ventil(5%CO 2 /95% O2)und überprüfen Sie den Wasserstand im System.
- Legen Sie das Filterpapier in die Aufzeichnungskammer der Schnittstelle, um überschüssiges Medium abzulassen, und das Linsenreinigungspapier unter den Rahmen, um die Scheibe mit Medium zu versorgen.
- Schalten Sie den Temperaturregler, die Verstärker und den Mikromanipulator ein.
- Lassen Sie die Temperatur in der Grenzflächenkammer bei 37 °C stabilisieren, bevor Sie mit den Aufnahmen beginnen.
- Künstliche Zerebrospinalflüssigkeit (aCSF: 124 mM NaCl, 3mM KCl, 1,2 mM NaH2PO4,25 mM NaHCO3,10 mM Glucose, 2 mM CaCl2,1 mM MgSO4 mit pH 7,4) vorbereiten und damit die Glaselektrode mit einer Spritze füllen. Legen Sie es in die Empfangselektrode.
- Aufzeichnungen spontaner Aktivitäten
- Sobald die Temperatur stabil ist, entfernen Sie die Platte aus dem Inkubator und schneiden Sie eine Scheibe aus dem Einsatz mit einer hochscharfen Klinge. Legen Sie es in eine 60-mm-Platte mit einem Tropfen Medium. Bringen Sie es zur Aufnahmekammer der Schnittstelle.
- Legen Sie die Scheibe in die Grenzflächenkammer mit dem Hippocampus unten rechts. Platzieren Sie die Empfangselektrode in der CA3-Pyramidenzellschicht.
- Fahren Sie mit dem kontinuierlichen Erfassungsprotokoll fort und zeichnen Sie 30 Minuten lang auf.
3. PI-Aufnahmetest
HINWEIS: Der Zelltod wurde durch Überwachung der zellulären Aufnahme des Fluoreszenzfarbstoffs Propidiiumiodid (PI) beurteilt. PI ist eine polare Verbindung, die in Zellen mit beschädigten Zellmembranen eindringt und mit DNA interagiert, die rote Fluoreszenz emittiert (Absorption 493 nm, Emission 630 nm). Da PI für lebende Zellen nicht durchdrungen ist, wird es verwendet, um tote Zellen in einer Population zu erkennen.
- PI-Inkubation
- Bereiten Sie in Kulturmedium eine frische 1:10-Verdünnung des PI-Bestands vor.
- Für den PI-Aufnahmetest entfernen Sie die Platte aus dem Inkubator und heben Sie den Einsatz vorsichtig an. 13 μL PI werden mit einer P20-Pipette in das Medium geben, wodurch eine Endkonzentration von 2 μM erreicht wird. Rühren Sie die Platte langsam auf, bevor Sie den Einsatz wieder einsetzen. Stellen Sie sicher, dass sich keine Blasen unter den Scheiben befinden.
- Legen Sie die Scheiben für 2 h wieder in den 37 °C Inkubator.
- Fahren Sie mit dem immunhistochemischen Protokoll fort, wie im nächsten Abschnitt beschrieben. Decken Sie die Platten mit Aluminium ab, da PI lichtempfindlich ist.
4. Immunhistochemie
HINWEIS: In der Immunhistochemie wurden ein neuronenspezifischer Antikörper sowie Antikörper, die ruhende und reaktive Phänotypen von Mikroglia und Astrozyten unterscheiden können, verwendet, um das Ausdehnen des neuronalen Todes und der Gliose in rhinalen Kortex-Hippocampus-epileptischen organotypischen Scheiben zu bewerten.
- Gewebefixierung
- Entfernen Sie die Platte aus dem Inkubator und saugen Sie das Medium an. Fixieren Sie die Scheiben mit 4% Paraformaldehyd (PFA) für 1 h bei RT, indem Sie 1 ml PFA unter und über den Scheiben mit einer P1000-Pipette hinzufügen.
- Entfernen Sie die PFA und fügen Sie 1 ml PBS hinzu. Fügen Sie auch PBS unter und über den Slices hinzu.
- Bewahren Sie die Scheiben bei 4 °C in PBS auf, bis sie weiter verwendet werden. Legen Sie immer Parafilm um die Platten, um ein Austrocknen zu vermeiden.
- Immunanfingende Schritte
- Zweimal waschen, jeweils 10 min, mit 1 ml PBS.
- Permeabilisierungs-/Blockierungslösung mit 1% Triton-X100, 10% HS und 10% BSA in PBS vorbereiten. Bereiten Sie 5% BSA-Lösung vor.
- Zeichnen Sie zwei Rechtecke mit dem hydrophoben Stift (Abbildung 2A). Schneiden Sie die Scheiben aus dem Einsatz (Abbildung 2B) mit einer hochscharfen Klinge. Legen Sie zwei Scheiben pro Objektträger (Abbildung 2C) und fügen Sie 140 μL Permeabilisierungs-/Blockierungslösung mit einer P200-Pipette auf die Oberseite jeder Scheibe hinzu. Inkubieren Sie für 3 h bei RT.
- Verdünnen Sie die primären Antikörper gegen die Arbeitsverdünnung in 5% BSA in PBS. Mit den primären Antikörpern über Nacht bei 4 °C inkubieren.
- Inkubieren Sie mit den sekundären Antikörpern für 4 h bei RT. Schützen Sie die Platte ab diesem Schritt vor Licht, da mit Fluorophoren gearbeitet wird.
- Legen Sie einen 50 μL Tropfen Hoechst-Lösung auf die Oberseite jeder Scheibe und inkubieren Sie sie für 20 Minuten bei RT.
- Zwischen den Inkubationen waschen. Immer dreimal waschen, jedes Mal für 10 min, mit PBS-T.
- Hoechst entfernen und wie empfohlen waschen.
- Fügen Sie 50 μL Montagemedium auf die Oberseite jeder Scheibe hinzu. Mit einem Glasdeckel abdecken und mit Nagellack umgeben (Abbildung 2D).
- Lassen Sie es bei RT für 24 h trocknen.
- Visualisieren Sie die Immunfärbung unter einem konfokalen Mikroskop. Die gebeizten Scheiben bei -20 °C aufbewahren.

Abbildung 2: Spezifisches Verfahren für den immunhistochemischen Assay. (A) Mit dem hydrophoben Stift zwei Quadrate in den Schieber zeichnen. (B) Schneiden Sie das Stück der Einlage, das die Scheibe enthält. (C) Legen Sie jede Scheibe in die mit dem hydrophoben Stift gezeichneten Quadrate und starten Sie den Permeabilisierungs-/Blockierungsschritt. (D) Nach Abschluss des Protokolls werden die Scheiben in einem Montagemedium montiert, mit einem Glasdeckel bedeckt und mit Nagellack umschlossen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Basierend auf früheren Beschreibungen der epileptischen Signalanalyse in organotypischen Hippocampus-Scheiben werden interiktale epileptiforme Entladungen hier als paroxysmale Entladungen definiert, die sich deutlich von der Hintergrundaktivität unterscheiden, mit einer abrupten Polaritätsänderung und bei niedriger Frequenz (<2 Hz) auftreten. Paroxysmale Entladungen, die länger als 10 s dauern und bei höherer Frequenz (≥2 Hz) auftreten, werden als iktale epileptiforme Aktivität charakterisiert. Wenn ein iktales Ereignis innerhalb von 10 s nach dem vorherigen eintritt, werden diese beiden Ereignisse nur als ein iktales Ereignis betrachtet.
Rhinale Kortex-Hippocampus organotypische Scheiben bei 7 DIV (Abbildung 3A) zeigen gemischte interiktale und iktal-ähnliche Aktivität. Bei 14 DIV (Abbildung 3B) ist die spontane Aktivität durch iktale Entladungen gekennzeichnet, die sich bei 21 DIV zu einer überwältigenden italen Aktivität entwickeln, wobei die iktalen Ereignisse >1 min dauern (Abbildung 3C).
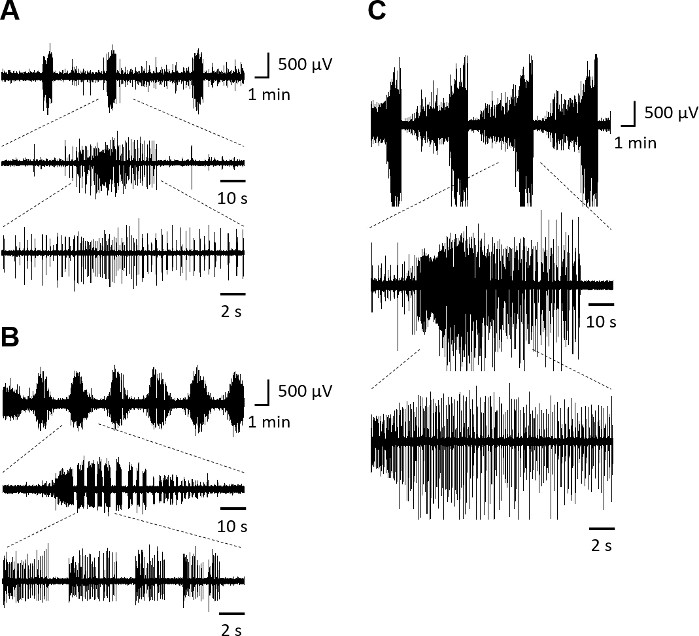
Abbildung 3: Spontane epileptiforme Aktivität von rhinalen Kortex-Hippocampus-organotypischen Scheiben. Repräsentative elektrographische anfallsähnliche Ereignisse, aufgezeichnet aus dem CA3-Bereich in einer Grenzflächenkammer, nach (A) 7 DIV, (B) 14 DIV und (C) 21 DIV. Anfallsdetails werden in niedrigeren Spuren gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
PI-Aufnahmetest gefolgt von Immunhistochemie gegen den neuronalen Marker NeuN zur Identifizierung des neuronalen Todes. Die PI-Aufnahme durch granulare und pyramidale Neuronen wurde in 7 DIV-Slices (Pfeile in Abbildung 4A)beobachtet, aber die Anzahl der PI+ -Neuronen stieg bei 14 DIV (Pfeile in Abbildung 4B),was einen erhöhten neuronalen Tod mit Epileptogenese-Progression bestätigt.
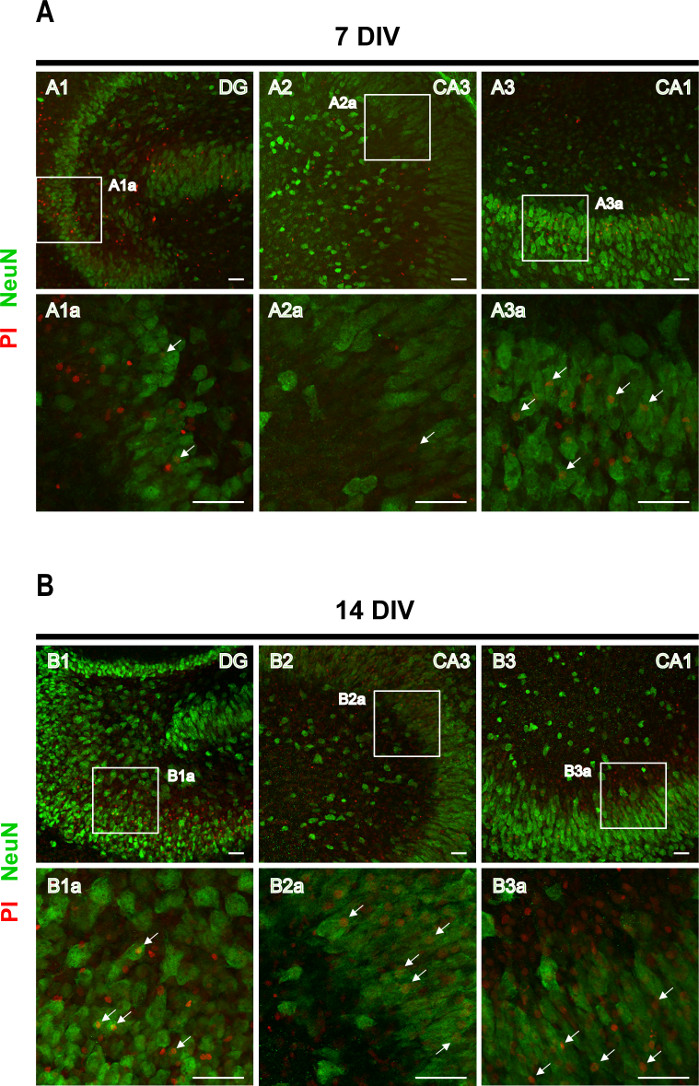
Abbildung 4: Repräsentative Bilder von neuN- und PI-gefärbten rhinalen Kortex-Hippocampus-organotypischen Scheiben. Bilder von NeuN-gefärbten reifen Neuronen und PI-positiven Zellen wurden bei (A) 7 DIV und (B) 14 DIV auf einem konfokalen Lasermikroskop mit einem 20-fachen Objektiv aufgenommen. Vergrößerte Bilder der gestrichelten Bereiche werden angezeigt. Pfeile zeigen auf Todesneuronen (orange). Scale-Bar, 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Eine Doppelfärbung von Iba1 zusammen mit CD68 wurde verwendet, um den Mikroglia-Phänotyp zu bewerten. Iba1 ist ein Mikroglia/Makrophagen-Marker, während CD68 ein lysosomales Protein ist, das in hohen Konzentrationen durch reaktive Mikroglia und in niedrigen Konzentrationen durch ruhende Mikroglia exprimiert wird. Bei 7 DIV-Scheiben sind verzweigte Mikroglia mit einer niedrigen CD68-Expression (Pfeile in Abbildung 5A)häufiger als Iba1+/CD68+ reaktive Mikroglia (Pfeilspitzen in Abbildung 5A),während bei 14 DIV in allen Bereichen des Hippocampus Iba1+/CD68+ buschige/amöboide M1-Mikroglia (Pfeilspitzen in Abbildung 5B)Mikroglia mit einer niedrigen CD68-Expression (Pfeile in Abbildung 5B)übersteigen. Bei 14 DIV können einige Iba1+/ CD68+ Zellen mit einem hyperverzweigten Aussehen lokalisiert werden (offene Pfeilspitzen in Abbildung 5B),was auf das Auftreten des entzündungshemmenden M2-Phänotyps von Mikroglia hindeuten könnte. Diese Angelegenheit bedarf jedoch weiterer Untersuchungen.
Neuere Studien haben gezeigt, dass verschiedene auslösende ZNS-Verletzungen mindestens zwei Arten von reaktiven Astrozyten hervorrufen können, A1 und A2, wobei A1-Astrozyten neurotoxischsind 16. A1-Subtyp von Astrozyten ist durch eine erhöhte Expression von Komplement C316,17,18gekennzeichnet. Komplement C3, das eine zentrale Rolle bei der Aktivierung des Komplementsystems spielt, erzeugt C3b, das weiter zu iC3b, C3dg und C3d19abgebaut wird. So wurde eine doppelte Färbung von GFAP und C3d verwendet, um Astrogliose zu beurteilen. Bei 7 DIV ist die Expression von C3d kaum nachweisbar (Abbildung 6A), während in 14 DIV-Scheiben hypertrophe GFAP+/C3d+ Astrozyten beobachtet werden können (Pfeilspitzen in Abbildung 6B), was auf eine fortschreitende Aktivierung von A1-Astrozyten hindeutet.
Die Ergebnisse zeigen eine fortschreitende Aktivierung von Mikroglia und Astrozyten im Verlauf der Epileptogenese, die die bei Patienten mit Epilepsie und in Tiermodellen dieser Pathologie beschriebenen Ereignisse nachahmt.
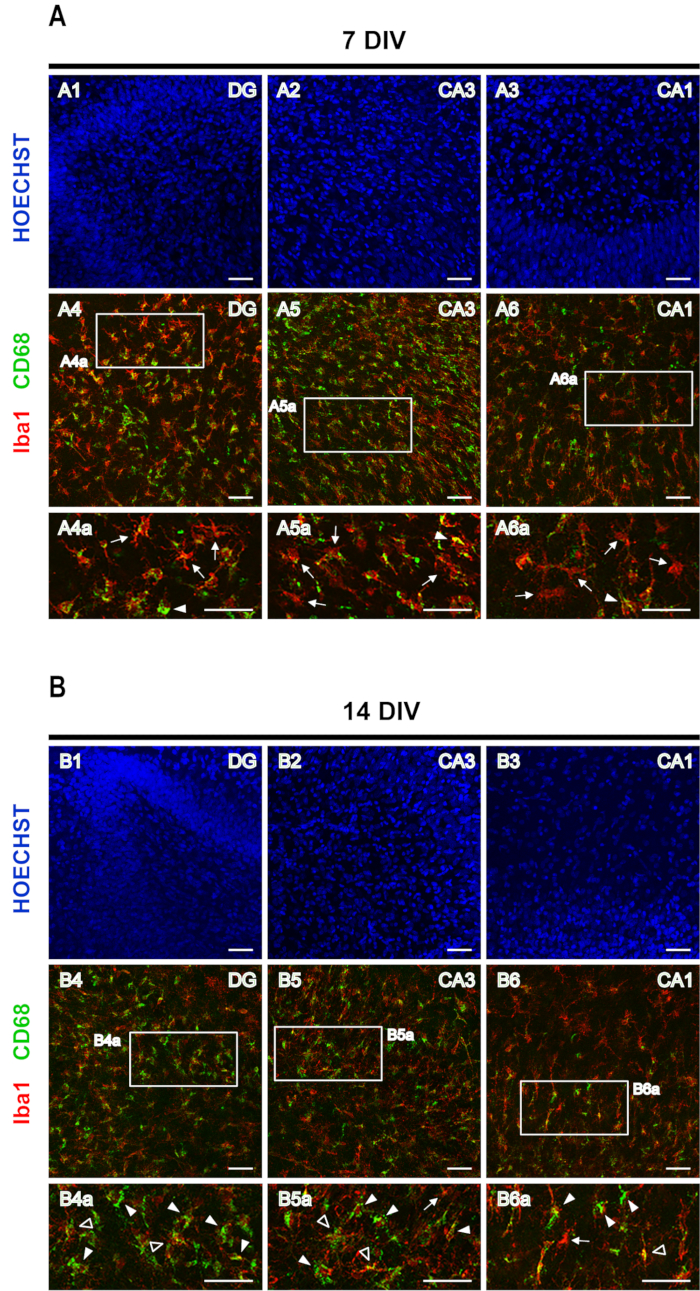
Abbildung 5: Repräsentative Bilder von Iba1- und CD68-gefärbten rhinalen Kortex-Hippocampus-organotypischen Scheiben. Bilder von Iba1 und CD68 gefärbten Mikroglia und Hoechst gefärbten Kernen wurden bei (A) 7 DIV und (B) 14 DIV auf einem konfokalen Lasermikroskop mit einem 20-fachen Objektiv aufgenommen. Vergrößerte Bilder der gestrichelten Bereiche werden angezeigt. Pfeile zeigen auf Iba1+/CD68- ruhende Mikroglia, Pfeilspitzen zeigen Iba1+/CD68+ buschige/amöboide Mikroglia und offene Pfeilspitzen zeigen Iba1+/CD68+ hyperverzweigte Mikroglia. Scale-Bar, 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
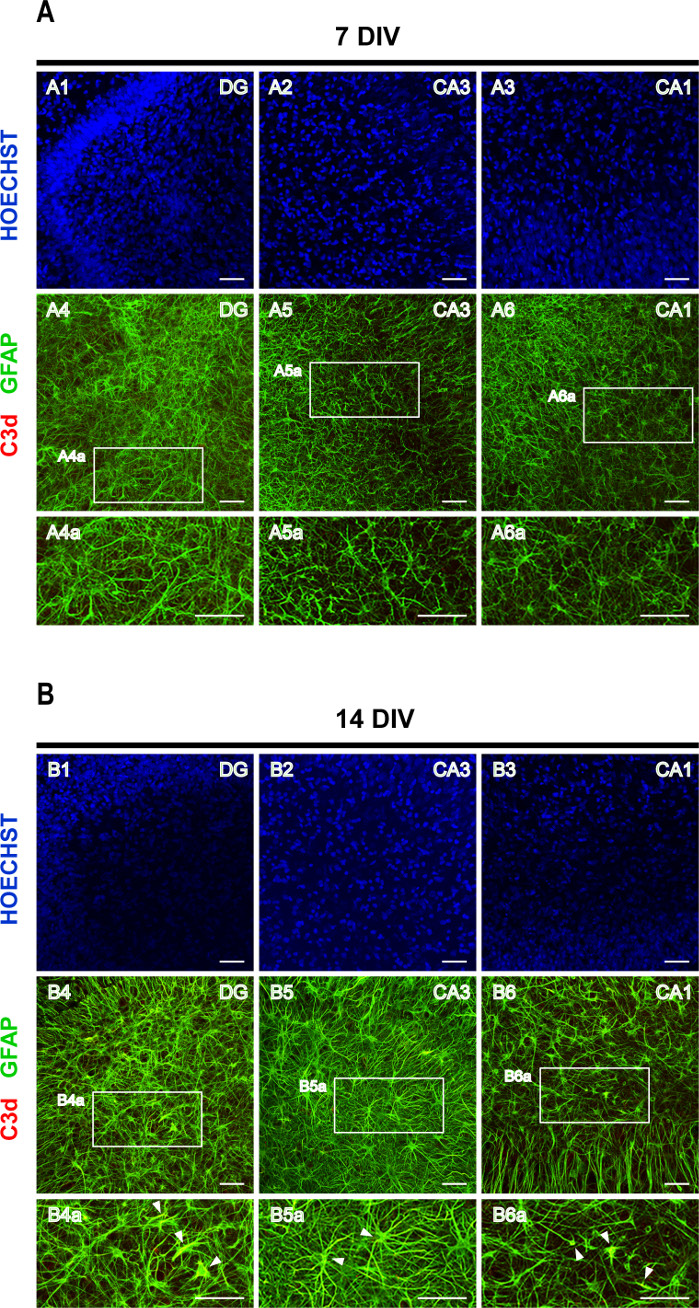
Abbildung 6: Repräsentative Bilder von GFAP- und C3d-gefärbten rhinalen Kortex-Hippocampus-organotypischen Scheiben. Bilder von GFAP- und C3d-gefärbten Astrozyten sowie Hoechst-gefärbten Kernen wurden bei (A) 7 DIV und (B) 14 DIV auf einem konfokalen Lasermikroskop mit einem 20-fachen Objektiv aufgenommen. Vergrößerte Bilder der gestrichelten Bereiche werden angezeigt. Pfeilspitzen zeigen auf GFAP+/C3d+ reaktive A1-Astrozyten (gelb). Scale-Bar, 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Tiermodelle der Epilepsie waren entscheidend für die Entdeckung vieler AEDs, aber sie erfordern viele Tiere und die meisten von ihnen sind aufgrund der Latenzzeit für den Beginn der Anfalls zeitaufwendig. Die magnesiumarme Induktion der epileptiformen Aktivität in hippokampalen akuten Scheiben wurde in der Literatur3 ebenfallsgründlich überarbeitet, aber akute Scheiben haben eine Lebensfähigkeit von 6-12 h, was es unmöglich macht, langfristige Veränderungen zu beurteilen. Organotypische Scheiben können von Tagen bis Wochen in Kultur gehalten werden, so dass die kurze Lebensfähigkeitszeit akuter Scheiben überwunden werden kann, und Modelle der Epileptogenese in organotypischen Hippocampusscheiben wurden vorgeschlagen3,7,8.
Hier beschreiben wir die Herstellung von organotypischen Scheiben, bestehend aus dem rhinalen Kortex und dem Hippocampus. Diese Scheiben brauchen 15-20 Minuten, um pro Tier zubereitet zu werden, beginnend mit dem Tieropfer bis zum Platzieren von Scheiben auf den Einsätzen, und 6-8 Scheiben pro Hemisphäre können erhalten werden. Beim Öffnen der Hemisphäre, um den Hippocampus freizulegen, und beim Entfernen des Gewebes aus dem Filterpapier nach dem Schneiden ist besondere Vorsicht geboten. Überschüssiges Gewebe über dem Hippocampus kann auch die Integrität der Scheibe während des Schneidens beeinträchtigen.
Rhinale Kortex-Hippocampus-organotypische Scheiben zeigen eine sich entwickelnde epileptische Aktivität, die einer In-vivo-Epilepsie ähnelt. Nach einer Woche in der Kultur zeigen die meisten Scheiben gemischte interiktale und iktalartige Aktivitäten, die sich mit der Zeit in der Kultur zu ausschließlich iktalartigen Ereignissen entwickeln. Bisher haben wir mit 2-3 Wochen nur wenige Interktalentladungen in Scheiben aufgenommen. In diesem System scheint sich eine epileptische Aktivität schneller zu entwickeln als in organotypischen Hippocampus-Scheiben. Dies könnte auf das Vorhandensein des rhinalen Kortex zurückgeführt werden, der den größten Teil des funktionellen Inputs zum Hippocampus bewahrt. Um dieses Problem vollständig anzugehen, wird derzeit eine vollständige Charakterisierung der epileptischen Signale durchgeführt, die von diesen Slices während der gesamten Zeit in Kultur angezeigt werden, wie Anzahl und Dauer der iktalen Ereignisse, zusammen mit ihrer Amplitude und Frequenz.
Dieses System kann länger als drei Wochen in Kultur gehalten werden und ahmt viele molekulare Korrelate der Epilepsie nach, wie neuronalen Tod, Aktivierung von Mikroglia und Astrozyten und erhöhte Produktion von entzündungsfördernden Zytokinen14, was eine langfristige Charakterisierung dieser Aspekte ermöglicht. Es stellt auch eine einfach zu bedienende Screening-Plattform dar, auf der pharmakologische Interventionen, die auf bestimmte zelluläre Signalwege abzielen, implementiert und potenzielle therapeutische Ziele getestet werden können. Zweifellos kann das hier vorgestellte System dazu beitragen, die Mechanismen der Epileptogenese weiter aufzuklären.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Die Autoren danken der Bioimaging-Abteilung des Instituto de Medicina Molecular João Lobo Antunes für alle Vorschläge zur Bildaufnahme.
Dieses Projekt wurde aus dem Forschungs- und Innovationsprogramm Horizon 2020 der Europäischen Union im Rahmen der Finanzhilfevereinbarung Nr. 952455, Fundação para a Ciênciae Tecnologia (FCT) durch das Projekt PTDC/MEDFAR/30933/2017 und Faculdade de Medicina da Universidade de Lisboa finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 50 mL Centrifuge Tube, Conical Bottom | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira, Lda | UN1170 | |
| Amplifier | Axon Instruments | Axoclamp 900A | |
| Amplifier | Axon Instruments | Digidata 1440A | |
| Anti-C3d (goat) | R&D Systems | AF2655 | Dilute at a ratio 1:1000 |
| Anti-CD68 (mouse) | Abcam | ab31630-125ug | Dilute at a ratio 1:250 |
| Anti-GFAP (mouse) | Millipore SAS | MAB360 | Dilute at a ratio 1:500 |
| Anti-Iba1 (rabbit) | Abcam | ab108539 | Dilute at a ratio 1:600 |
| Anti-NeuN (rabbit) | Werfen | 16712943S | Dilute at a ratio 1:500 |
| Artificial cerebrospinal fluid (aCSF) | Homemade | ||
| B-27™ Supplement (50X), serum free | Thermo Fisher Scientific | 17504-044 | |
| Blades for scalpel handle | Fine Science Tools | 10011-00 | |
| Bovine Serum Albumin (BSA) | NZYTech | MB04602 | 5% BSA is used to dilute the primary antibodies. Add 0.5g BSA in 10 mL PBS. |
| Brain/Tissue Slice Chamber System | Warner Instruments | ||
| Calcium chloride dihydrate | Merck Millipore | 1.02382.0500 | |
| Cell culture inserts, 30 mm, hydrophilic PTFE | Millipore SAS | PICM03050 | |
| Cold light source | SCHOTT | KL 300 LED | |
| Confocal laser microscope | Zeiss | LSM 710 | |
| Conventional incubator | Thermo Scientific Heraeus | BB15, Function Line | Set to 37 °C and 5% CO2 |
| D(+)-Glucose monohydrate | Merck Millipore | 1.08342.1000 | |
| D-(+)-Glucose solution, 45% in water | Sigma | G8769 | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| Dissecting microscope/magnifier | MEIJI TECHNO CO. LTD | 122285 | |
| Donkey anti-goat IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A11057 | Dilute at a ratio 1:200 |
| Donkey anti-mouse IgG (H+L) coupled to Alexa Fluor 488 | Invitrogen | A21202 | Dilute at a ratio 1:200 |
| Donkey anti-mouse IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A10037 | Dilute at a ratio 1:200 |
| Donkey anti-rabbit IgG (H+L) coupled to Alexa Fluor 488 | Invitrogen | A21206 | Dilute at a ratio 1:500 |
| Donkey anti-rabbit IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A10042 | Dilute at a ratio 1:500 |
| Dumont #5 Fine Forceps Biologie Inox | Fine Science Tools | 11254-20 | |
| Dumont #5 Forceps Standard Inox | Fine Science Tools | 11251-20 | |
| Dumont #7 Forceps Standard Dumoxel | Fine Science Tools | 11271-30 | |
| Dumont Medical #7S Forceps Short Curve Inox | Fine Science Tools | 11273-22 | |
| Gentamycin stock solution, 50 mg/mL | Thermo Fisher Scientific | 15750-037 | |
| Gey’s Balanced Salt Solution (GBSS) | Biological Industries | 01-919-1A | |
| Glass Electrodes | Science Products | GB150F-10 | Round tips homemade |
| Glass Pasteur pipettes, 230 mm | VWR International | 612-1702 | |
| Hank’s Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 24020-091 | |
| Hoechst 33342 | Invitrogen | H1399 | Stock solution at 2 mg/mL in PBS |
| Horse Serum, Heat Inactivated (HS) | Thermo Fisher Scientific | 26050-088 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 | |
| Hydrophobic Pen | Dako | S200230-2 | |
| INCU-Line IL10 | VWR | 390-0384 | |
| Interface chamber | Warner Instruments | BSC-HT Haas Top | |
| Iris Spatula Curved | Fine Science Tools | 10092-12 | |
| Labculture Class II Biological Safety Cabinet | HERASafe | HS 12 | |
| Lens Cleaning Paper | TIFFEN | ||
| L-Glutamine solution 200 mM (Q) | Thermo Fisher Scientific | 25030-024 | |
| Magnesium sulfate heptahydrate | Merck Millipore | 1.05886.0500 | |
| Micro tube 0.5 mL, PP | SARSTEDT | 72,699 | |
| Micro tube 1.5 mL, PP | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL, PP | SARSTEDT | 72.691 | |
| Micromanipulators | Sutter Instrument | MP-285 | |
| Miroscope Cover Glasses, 24 mm x 60 mm | Marienfeld | 102242 | |
| Nail polish | Cliché | ||
| Neurobasal-A Medium (NBA) | Thermo Fisher Scientific | 10888-022 | |
| Opti-MEM® I Reduced-Serum Medium | Thermo Fisher Scientific | 31985-047 | |
| Paraformaldehyde, powder | VWR Chemicals | 2,87,94,295 | |
| Peristaltic pump | Gilson | M312 | |
| Phosphate saline buffer (PBS) | Homemade. PBS with 0.5% Tween-20 (PBS-T) is used to wash slices during the immunohistochemistry assay. | ||
| Phosphate standard solutions, PO43- in water | BDH ARISTAR | 452232C | |
| Pipette set | Gilson | P2, P10, P20, P100, P200, P1000 | |
| Platinum 5 blades | Gillette | ||
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide (PI) | Sigma-Aldrich | P4170-25MG | Stock solution at 1 mg/mL in water. |
| Qualitative Filter Paper, Cellulose, Grade 1, 55 mm | Whatman | 1001-055 | Medium retention 11µm |
| Qualitative Filter Paper, Cellulose, Grade 1, 90 mm | Whatman | 1001-090 | Medium retention 11µm |
| Scalpel handle | Fine Science Tools | 91003-12 | |
| Slip Tip Insulin Syringe without Needle 1 mL | SOL-M | 161000 | |
| Sodium chloride | VWR Chemicals | 27800.360 | |
| Sodium dihydrogen phosphate monohydrate | Merck Millipore | 1.06346.1000 | |
| Sodium hydrogen carbonate | Merck Millipore | 1.06329.1000 | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Stimulator | Astro Med Inc GRASS Product Group | S48 Stimulator | |
| Student Scissors Straight SharpSharp 12cm | Fine Science Tools | 91402-12 | |
| SuperFrost Plus™ Adhesion slides | Thermo Fisher Scientific | J1800AMNZ | |
| TC-Treated Sterile 60 x 15mm Tissue Culture Dish | Corning | CORN430166 | |
| TC-Treated Sterile 6-Wells Plates | Corning | CORN3516 | |
| Temperatue controller | MEDICAL SYSTEMS CORP. | TC-102 | |
| Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 350 μm |
| Triton X-100 | BDH | 14630 | |
| Tween-20 | Sigma | P2287 |
Referenzen
- Fisher, R. S., et al. Electrical stimulation of the anterior nucleus of thalamus for treatment of refractory epilepsy. Epilepsia. 51, 899-908 (2010).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20, 359-368 (2011).
- Heinemann, U., Kann, O., Schuma, S., Pitkänen, A., Schwartzkroin, P. A., Moshé, S. L. An overview of in vitro seizure models in acute and organotypic slices. Models of seizures and epilepsy. , 35-44 (2006).
- Sundstrom, L., Morrison, B., Bradley, M., Pringle, A. Organotypic cultures as tools for functional screening in the CNS. Drug Discovery Today: Targets. 10, 993-1000 (2005).
- Holopainen, I. E. Organotypic hippocampal slice cultures: a model system to study basic cellular and molecular mechanisms of neuronal cell death, neuroprotection, and synaptic plasticity. Neurochemical Research. 30, 1521-1528 (2005).
- Noraberg, J., et al. Organotypic hippocampal slice cultures for studies of brain damage, neuroprotection and neurorepair. CNS Neurological Disorders Drug Targets. 4, 435-452 (2005).
- Dyhrfjeld-Johnsen, J., Berdichevsky, Y., Swiercz, W., Sabolek, H., Staley, K. J. Interictal spikes precede ictal discharges in an organotypic hippocampal slice culture model of epileptogenesis. Journal of Clinical Neurophysiology. 27, 418-424 (2010).
- Chong, S. A., et al. Intrinsic Inflammation Is a Potential Anti-Epileptogenic Target in the Organotypic Hippocampal Slice Model. Neurotherapeutics. 15, 470-488 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5, 19-33 (2007).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Doussau, F., Dupont, J. L., Neel, D., Schneider, A., Poulain, B., Bossu, J. L. Organotypic cultures of cerebellar slices as a model to investigate demyelinating disorders. Expert Opinion on Drug Discovery. 12 (10), 1011-1022 (2017).
- Vismer, M. S., Forcelli, P. A., Skopin, M. D., Gale, K., Koubeissi, M. Z. The piriform, perirhinal, and entorhinal cortex in seizure generation. Frontiers in Neural Circuits. 9, 27 (2015).
- Magalhães, D. M., Pereira, N., Rombo, D. M., Beltrão-Cavacas, C., Sebastião, A. M., Valente, C. A. Ex vivo model of epilepsy in organotypic slices - a new tool for drug screening. Journal of Neuroinflammation. 15, 203 (2018).
- Ravizza, T., Balosso, S., Vezzani, A. Inflammation and prevention of epileptogenesis. Neuroscience Letters. 497 (3), 223-230 (2011).
- Liddelow, S. A., et al. Neurotoxic reactive astrocytes are induced by activated microglia. Nature. 541, 481-487 (2017).
- Wu, T. Complement C3 is activated in human AD brain and is required for neurodegeneration in mouse models of amyloidosis and tauopathy. Cell Reports. 28 (8), 2111-2123 (2019).
- Hartmann, K., et al. Complement 3+-astrocytes are highly abundant in prion diseases, but their abolishment led to an accelerated disease course and early dysregulation of microglia. Acta Neuropathologica Communications. 7, 83 (2019).
- Nilsson, U. R., Funke, L., Nilsson, B., Ekdahl, K. N. Two conformational forms of target-bound iC3b that distinctively bind complement receptors 1 and 2 and two specific monoclonal antibodies. Upsala Journal of Medical Sciences. 116, 26-33 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten