Method Article
Bilinçli farelerde strese bağlı hiperglisemiyi azaltmak için intraperitoneal insülin tolerans testinden önce iklimlendirme
Bu Makalede
Özet
Glikoz seviyelerinde strese bağlı yükselmeler, farelerde bilinçli bir intraperitoneal insülin tolerans testinden elde edilen verilerin yorumlanmasını zorlaştırabilir. Bu yazıda, strese bağlı hiperglisemiyi sınırlamak için insülin tolerans testini gerçekleştirmeden önce fareleri kullanıma, enjeksiyonlara ve kan örneklemesine alıştırmak için bir yöntem açıklıyoruz.
Özet
İnsülin tolerans testi, kemirgenlerde tüm vücut insülin duyarlılığını değerlendirmek için metabolik çalışmalarda yaygın olarak kullanılmaktadır. Tek bir intraperitoneal insülin enjeksiyonunu takiben zaman içinde kan şekeri seviyelerinin ölçülmesini içeren nispeten basit bir testtir. Bilinçli durumda gerçekleştirildiği ve kanın genellikle bir kuyruk parçası yoluyla toplandığı göz önüne alındığında, taşıma ve kan alma ile ilgili kaygı nedeniyle hayvanlardan bir stres tepkisi ortaya çıkarma potansiyeline sahiptir. Bu nedenle, kan şekerinde strese bağlı bir artış meydana gelebilir ve bu da birincil son nokta ölçüsünün, yani kan şekerinde insülin aracılı bir azalmanın tespit edilmesini ve yorumlanmasını zorlaştırır. Bu, birçok fare suşunda görülmüştür ve insülin uygulamasından sonra glikoz seviyelerinin düşmek yerine artabileceği diyabetik db / db farelerde oldukça yaygındır. Burada, insülin tolerans testini gerçekleştirmeden önce fareleri kullanıma, enjeksiyonlara ve kan örneklemesine alıştırmak için bir yöntem açıklıyoruz. Bunun strese bağlı hiperglisemiyi azalttığını ve tüm vücut insülin duyarlılığını daha doğru bir şekilde yansıtan verilerle sonuçlandığını bulduk.
Giriş
Kemirgenlerde metabolik testler, glikoz homeostazını düzenleyen çeşitli parametreleri değerlendirmek için rutin olarak yapılır1. Tüm vücut insülin etkisini in vivo değerlendirmek için altın standart hiperinsülinemik-öglisemik klemp2'dir. Bu test, öglisemiyi korumak için glikoz infüze edilirken dolaşımdaki insülin seviyelerini yükseltmek için insülinin uygulanmasını içerir. Öglisemiyi korumak için gereken glikoz infüzyon hızı, insülin etkisinin göstergesidir. Metabolik araştırmalarda güçlü bir araç olmasına rağmen, farelerde kelepçe tekniği teknik olarak zorlu ve emek yoğundur ve bu nedenle metabolik bir fenotipi karakterize etmede ilk tarama aracı olarak pek uygun değildir. Bu nedenlerden dolayı, genellikle daha basit olan intraperitoneal insülin tolerans testi (ITT) seçilir.
ITT, açlık süresinin ardından (tipik olarak 4-6 saat) bilinçli durumda gerçekleştirilir. İntraperitoneal olarak bir insülin bolusu uygulanır, ardından kan şekeri genellikle 60 dakika süren bir zaman dilimi boyunca izlenir. İnsülinin insüline duyarlı dokulara glikoz alımını kolaylaştırma kabiliyeti nedeniyle kan şekeri seviyelerinin düşmesi beklenir; Bunun meydana gelme derecesi, tüm vücut insülin etkisinin göstergesidir. Bazı durumlarda, insülin uygulamasından sonra glikoz seviyelerinin düşmek yerine paradoksal olarak arttığı gösterilmiştir. Bu fenomen muhtemelen bir stres tepkisine atfedilir. Kullanım, enjeksiyonlar ve kan örneklemesinin tümü streseneden olabilir 3,4,5, bu da hipotalamik-hipofiz-adrenal eksenin (HPA) ve otonom sinir sisteminin (ANS) aktivasyonuna neden olabilir6,7,8. Hem HPA hem de ANS'nin dolaşımdaki glikoz seviyelerindeki artışa katkıda bulunduğu iyi bilinmektedir 9,10,11. Bir ITT'nin başlangıcında strese bağlı hipergliseminin varlığı, insülin uygulaması üzerine glikozdaki düşüşün hızı ve büyüklüğü ile etkileşime girdiği için sorunludur12. Bu, insülin direncinin varlığı ile ilgili yanlış sonuçlara yol açabilir. Bu nedenle, bir ITT sırasında stresin glikoz seviyeleri üzerindeki kafa karıştırıcı etkisini azaltmak için, ITT'yi gerçekleştirmeden önce fareleri kullanım, enjeksiyonlar ve kan örneklemesine alıştırmak için bir yöntem geliştirdik.
Protokol
Burada açıklanan tüm yöntemler, VA Puget Sound Health Care System'in Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır.
NOT: Hipoglisemi yaşayan hayvanların izlenmesi ve/veya müdahalesi için yerel gereksinimler burada açıklananlardan farklı olabilir.
1. Oruç (t= -210 dk)
- Karanlık döngü sona erdikten sonra, fareleri selüloz veya kağıt yatak takımı gibi besleyici olmayan yatak takımlarına sahip yeni bir kafese aktarın (fareler tarafından tüketilirse metabolik uç noktaları etkileyecek olan mısır koçanı yatağı değil)13). Oruç süresi boyunca farelere suya ad libitum erişim sağlayın. Fare grupları arasında günün oruç saati ve süresi ile tutarlı olun. Gösterilen veriler için, yiyecekler 0700 ile 0800 saatleri arasında, yani karanlık döngünün sona ermesinden 1-2 saat sonra çıkarıldı.
- Kafes(ler)i ITT'nin gerçekleştirileceği yere taşıyın. Bu, sıcaklık, gürültü, ışık veya hareket gibi stres faktörlerinin en aza indirildiği sessiz bir alan olmalıdır.
2. Alışma (t = -150 ila -60 dakika)
ÖNEMLİ: Fareleri mümkün olduğunca nazikçe tutun. Mümkünse bir emniyet cihazı kullanmaktan kaçının.
- -150 dakikada vücut ağırlığını ölçün. Bu, ITT için uygulanacak insülin hacminin hesaplanması için kullanılacaktır.
- Fareyi nazikçe kuyruğundan alın ve kuyruğu nazikçe tutarken düz bir masa üstü yüzeyine koyun. Kuyruğun ucunda küçük bir kesi yapmak için 20 G'lik bir iğne (veya cerrahi makas) kullanın. Bölgede bir damla kan oluşmaya başlamalıdır.
- Fareyi pürüzsüz ve sert bir yüzeye yerleştirin ve fareyi kuyruğundan nazikçe tutun.
- Bu sırada kan şekerini kaydetmek için, elde taşınan bir glukometrenin test şeridine kuyruk ucundan bir damla kan yerleştirin. Gerekirse, bir damla kan elde etmek için kuyruğa çok nazikçe masaj yapın.
- Bir insülin şırıngasına 100 μL steril salin çekin. Fareyi hafifçe tırmalama kullanarak alın ve intraperitoneal olarak enjekte edin. Salin enjeksiyonunun zamanını kaydedin.
- Birden fazla fare üzerinde çalışılıyorsa, aşağıdaki sonraki adımlar için zaman tanımak için farelere 1 dakikalık aralıklarla salin enjekte edin.
- Salin enjeksiyonundan 15 dakika sonra, fareyi kuyruğundan nazikçe alın. Kuyruk ucundaki kan pıhtısını nazikçe çıkarmak için gazlı bez kullanın.
- İsteğe bağlı: Adım 2.3'te açıklandığı gibi bu sırada kan şekerini tekrar kaydedin.
- Salin enjeksiyonundan 30 dakika sonra, fareyi yavaşça kuyruğundan alın. İstenirse, adım 2.3'te açıklandığı gibi başka bir kan şekeri ölçümü alın.
- Fareyi kafese geri koyun ve diğer fareler için gerektiği kadar tekrarlayın. Fareleri -90 dakikaya kadar rahatsız etmeyin.
- -90 dakikada, istenirse kan şekeri seviyelerinin ölçümü de dahil olmak üzere 2.3 ila 2.6 arasındaki adımları tekrarlayın.
- Fareyi kafese geri koyun, gerektiği kadar diğer fareler için tekrarlayın. ITT'ye kadar fareleri rahatsız etmeyin (bunun için temel kan şekeri ölçümü -5 dakikada yapılır).
3. İnsülin Tolerans Testi (t= -5 ila +60 dk)
- İstenilen doz 4 μL / g vücut ağırlığında enjekte edilebilecek şekilde steril salin içinde çalışan bir düzenli insülin çözeltisi (DİKKAT) hazırlayın.
NOT: Yanlışlıkla enjeksiyon hipoglisemiye neden olabileceğinden, insülin ile çalışırken dikkatli olunmalıdır. - Farelerde müdahale gerektiren hipoglisemi gelişmesi durumunda elinizin altında bulundurmak için steril salin içinde% 25 (h / h) dekstroz çözeltisi hazırlayın.
- -5 dakikada, fareyi kuyruğundan nazikçe alın. El tipi bir glukometrenin test şeridine kuyruk ucundan bir damla kan koyarak şu anda temel kan şekeri seviyesini belirleyin. Gerekirse, bir damla kan elde etmek için kuyruğa çok nazikçe masaj yapın.
- İnsülin çalışma solüsyonunu bir insülin şırıngasına (tipik bir doz aralığı 0.5-2.0 U / kg için 4 μL / g vücut ağırlığı) hazırlayın. Fareyi hafifçe tırmalama kullanarak alın ve intraperitoneal olarak enjekte edin. İnsülin enjeksiyonunun rekor süresi.
- Birden fazla fare üzerinde çalışılıyorsa, sonraki kan örneklemesi ve aşağıdaki veri kaydı için zaman tanımak için farelere 1 dakikalık aralıklarla insülin enjekte edin.
- İnsülin enjeksiyonundan 15 dakika sonra, fareyi kuyruğundan nazikçe alın. Kuyruk ucundaki kan pıhtısını nazikçe çıkarmak için gazlı bez kullanın. Bu sırada kan şekerini adım 3.3'te açıklandığı gibi tekrar belirleyin.
- Fareyi kafese geri koyun ve hipoglisemi belirtileri (örn. aşırı uyuşukluk) olup olmadığını izleyin. Farelerde hipoglisemi semptomları gelişirse, 5. adımda anlatıldığı gibi kan şekerini ölçün ve gerekirse dekstroz uygulayın. Dekstroz müdahalesi geçiren bir fare bu sırada ITT protokolünden çıkarılacaktır.
- İnsülin enjeksiyonundan 30 dakika sonra 3.5 ve 3.6 adımlarını tekrarlayın.
- İnsülin enjeksiyonundan 45 dakika sonra 3.5 ve 3.6 adımlarını tekrarlayın.
- İnsülin enjeksiyonundan 60 dakika sonra 3.5 ve 3.6 adımlarını tekrarlayın.
- Fareleri, ITT'den kurtarmaya yardımcı olmak için kafesin tabanında birkaç yiyecek peleti içeren ev kafeslerine geri koyun. 30 dakika boyunca izlemeye devam edin ve fareler normal aktivite / davranışı geri kazanmadıysa, adım 3.6'da açıklanan prosedürü izleyin.
NOT: Şekil 1 , yukarıdaki iklimlendirme ve ITT prosedürünü özetlemektedir.
Sonuçlar
Şekil 2A ve Şekil 3A , strese bağlı hiperglisemi ile tutarlı olarak, insülin uygulamasını takip eden 15 dakika içinde diyabetik db / db farelerde kan şekeri seviyelerinde paradoksal bir artış gösteren temsili verilerdir (sırasıyla bireysel ve ortalama veriler). Aynı prosedüre tabi tutulan kontrol diyabetik olmayan littermatlarda (db / + veya +/+) kan şekerinde herhangi bir artış görülmediğini unutmayın. ITT prosedürüne alışmanın kan şekerindeki bu artışı hafifletmede etkili olup olmadığını belirlemek için, aynı farelere yukarıda açıklanan alıştırma protokolü uygulandı. Her ana adım, grafik içindeki dikey çizgilerle gösterilir (Şekil 2B) ve fareler her ele alındığında kan örnekleri alınmıştır. -150 dakikada kullanım ve / veya salin enjeksiyonu, 4 db / db farenin 3'ünde (kırmızı daireler) kan şekerinde bir artışa neden oldu; dördüncü farenin kan şekeri seviyeleri >600 mg / dL idi. Kullanılan glukometre için üst tespit sınırı 600 mg / dL olduğundan, dördüncü farede kan şekerinin yükselip yükselmediğini tespit edemedik. -90 dakikadaki sonraki işlem, 2 farede kan şekerinin artmasına neden oldu. Kan şekeri seviyeleri, kontrol farelerinde (mavi üçgenler) kullanımdan etkilenmedi, ancak t = 0 ile kan şekeri seviyeleri -60 dakikadan daha düşüktü (150 ± 6'ya karşı 175 ± 8 mg / dL; n = 4, p = 0.02). Alışmayı takiben ITT sırasında kan şekeri seviyeleri, insülin uygulamasını takiben tüm zaman noktalarında azaldı. İklimlendirme öncesi ve sonrası ITT için ortalama veriler Şekil 3'te gösterilmektedir. Genel glikoz seviyelerinin iklimlendirilmiş diyabetik db / db farelere kıyasla iklimlendirilmiş ve iklimlendirilmemiş diyabetik db / db farelerde daha düşük olduğunu unutmayın (Şekil 3A; p < 0.05). Ayrıca, insülin uygulamasından sonraki ilk 15 dakika boyunca kan şekeri seviyelerindeki düşüş, alışma protokolünü takiben diyabetik olmayan littermat kontrollerde daha yüksekti (Şekil 3B; p = 0.002).

Şekil 1. Alışma ve ITT sırasında taşıma, enjeksiyon ve kan örnekleme prosedürünü gösteren şematik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
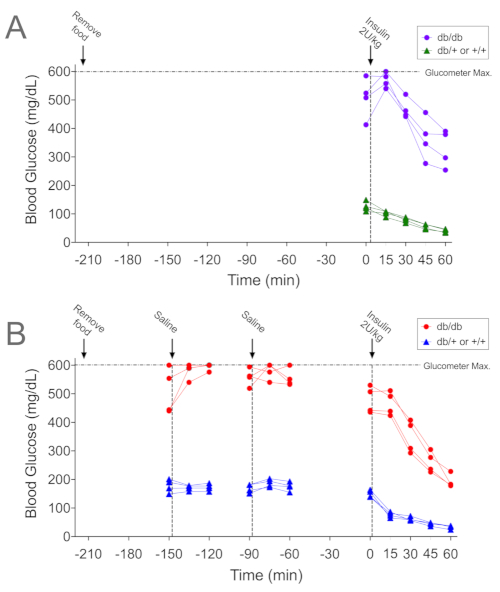
Şekil 2. İklimlendirme paradigması ile ve alışma paradigması olmadan gerçekleştirilen ITT'lerin temsili örnekleri. (A) 3.5 saat (210 dakika) hızlı bir şekilde gerçekleştirilen bir ITT (2 U / kg) sırasında diyabetik db / db farelerde (mor halkalar) ve littermat diyabetik olmayan kontrollerde (db / + veya +/+; yeşil üçgenler) kan şekeri seviyeleri, ancak ek işlem yapılmamıştır. (B) Aynı farelerden alınan kan şekeri seviyeleri (kırmızı daireler içinde db / db, mavi üçgenler içinde kontroller) daha sonra burada açıklanan iklimlendirme prosedürüne tabi tutulur ve ardından ITT (2 U / kg). Panel A'daki prosedürler ile Panel B'deki prosedürler arasındaki zaman aralığı 6 gündü. Veriler tek tek fareler için gösterilmiştir (genotip başına n = 4). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3. Alışma öncesi ve sonrası gerçekleştirilen ITT için ortalama kan şekeri verileri. (A) (Mor) veya (kırmızı) alışma prosedürü olmadan gerçekleştirilen ITT sırasında aynı db / db farelerden alınan ortalama (± SD) kan şekeri seviyeleri; Alışma prosedürünün 0 ila 15 dakika arasındaki glikoz seviyelerindeki artışı ortadan kaldırdığını unutmayın. Ayrıca, genel glikoz seviyeleri, iklimlendirilmiş diyabetik db / db farelere kıyasla daha düşüktür (p < 0.05). n=4 olur. (B) (Yeşil) veya (mavi) iklimlendirme prosedürü olmadan gerçekleştirilen ITT sırasında aynı kontrol db/+ veya +/+ farelerden alınan ortalama (± SD) kan şekeri seviyeleri; Alışma prosedürünün glikoz seviyelerinde 0 ila 15 dakika arasında daha dik bir düşüşe neden olduğunu unutmayın (P = 0.002). n=4 olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Hiperinsülinemik-öglisemik klemp, in vivo insülin etkisini değerlendirmek için altın standart olarak kabul edilir. Klempi gerçekleştirme metodolojisinde yapılan değişiklikler, tekniğin, karotis arter yoluyla kan örneklemesini ve juguler ven yoluyla infüzyonları mümkün kılmak için daha önce iki kateterli bir sistem14 kullanılarak kateterize edilmiş bilinçli, dizginlenmemişfarelerde 2 yapılmasına neden olmuştur. Bu, prosedür sırasında fareleri tutma veya kısıtlama ihtiyacını sınırlar, böylece stres tepkilerini azaltır2. Stresin metabolik çalışmalarda çeşitli son nokta ölçümlerini karıştırabileceği iyi bilinmektedir 1,3. Stres, kan örneklemesi, koku alma uyaranları, gürültü, ışık ve anestezi dahil olmak üzere kullanıma ek olarak çeşitli faktörler tarafından tetiklenebilir 3,4,5. Bunun sonucunda hipotalamik-hipofiz-adrenal eksenin (HPA) ve otonom sinir sisteminin (ANS) aktivasyonu, glikoz seviyeleri üzerinde derin etkilere sahip olabilir 9,10,11.
İnsülin etkisinin fareleri sıkıştırarak ölçülmesi tercih edilen yöntem olsa da, teknik olarak zorlayıcı ve emek yoğun olduğu için genellikle mümkün değildir. Bu nedenlerden dolayı, daha basit olan ITT farelerde daha yaygın olarak gerçekleştirilir. ITT'ler, aç tutulan farelerde intraperitoneal insülin bolusuna yanıt olarak zaman içinde (tipik olarak 60 dakika) kan şekerindeki değişiklikleri izler. Başlangıçta ve daha sonra her 15 dakikada bir kuyruk ucu yoluyla küçük bir hacimde kan örneklenir. ITT'lerin gerçekleştirilmesindeki hususlar, özellikle açlık süresi, insülin dozu ve elde edilen verilerin sunumu ile ilgili olarak daha önce tartışılmıştır 1,12. Burada, ITT'den önceki stresin insüline müteakip glikoz yanıtı üzerindeki etkisini göz önünde bulundurduk. Buna, insülin uygulamasını takiben kan şekerinde azalma yerine sürekli olarak paradoksal bir artış gözlemlediğimiz db / db farelerde yapılan çalışmalardan geldik. ITT'yi gerçekleştirmeden önce fareleri kullanım ve enjeksiyonlara alıştırdıktan sonra, kan şekerindeki artışı azaltabileceğimizi gördük. Bu, stresin muhtemelen ITT'nin başlangıcında gözlenen belirgin hiperglisemide rol oynadığını göstermektedir. Bu fenomen literatürde yaygın olarak görünmektedir. "db" ve "insülin toleransı" arama terimleri kullanılarak bir PubMed araması yapıldı ve 101 sonuç elde edildi (yayın tarihleri 1998 - 2019). Bunlardan 76'sı erişilebilir tam metin içeriğe sahipti, db/db farelerde ITT'ler gerçekleştirdi ve ITT verilerini zaman içinde glikoz seviyeleri (ham değerler ve/veya temel değerlerin yüzdesi) olarak görüntüledi. Bu 76 çalışma arasında, 16 çalışmada (% 21) tedavi edilmemiş db / db farelerde ITT sırasında kan şekeri seviyeleri artmıştır. Ek bir 4 çalışma, diğer fare gruplarında glikoz seviyelerinde artışlar göstermiştir (ör., ilaçla tedavi edilen db / db veya kontrol edilen db olmayan fareler). Son olarak, ek bir 10 çalışma, ITT süresince db / db farelerde insülin uygulamasını takiben glikoz seviyelerinde bir azalma gözlemleyemedi, ancak bu, kullanılan insülin dozu veya farelerde belirgin bir insülin direnci durumu ile ilişkili olabilir. Bizim iken
Çalışma ve literatür taraması DB / DB farelerine odaklanmaktadır, bu fenomenin diğer fare suşlarında da meydana gelmesi muhtemeldir. Bu nedenle, ITT'leri gerçekleştirirken, özellikle veri yorumlamayı nasıl etkileyebileceği açısından, stresin etkisi konusunda daha fazla farkındalığa ihtiyaç vardır.
Bu amaçla, ITT'yi başlatmadan önce gerçekleştirilebilecek bir iklimlendirme protokolü geliştirdik. Kritik adımlar, bir kısıtlama cihazı kullanılmadan farelerin taşınmasını ve enjekte edilmesini içerir. ITT'nin gerçekleştirileceği odadaki ortam gürültüsüne, aydınlatmaya, sıcaklığa ve herhangi bir harekete özel dikkat gösterilmelidir. ITT başlamadan hemen önce ortamdaki değişikliklere maruz kalmayı en aza indirmek için farelerin oruç döneminin başlangıcında bu odaya transfer edilmesi tavsiye edilir. Farelerde kaygı ile ilgili davranışları etkileyebileceğinden, araştırmacının sakin kalması da önemlidir. Db / db farelerde, iklimlendirme prosedürünün ITT sırasında 0 ila 15 dakika arasındaki glikoz seviyelerindeki artışı ortadan kaldırdığını bulduk. Ayrıca, diyabetik olmayan kontrol farelerinde, iklimlendirme prosedürü, ITT sırasında 0 ila 15 dakika arasında glikoz seviyelerinde daha dik bir düşüşe neden oldu. Daha da önemlisi, alıştırılmamış diyabetik olmayan kontrol fareleri, ITT'nin başlangıcında glikoz seviyelerinde bir artış göstermedi, ancak alışma üzerine daha yüksek bir glikoz atma oranı göstererek hala olumlu yanıt verdiler. İkincisi, bir ITT sırasındaki stresin her zaman taban çizgisinin üzerinde yüksek glikoz seviyeleri olarak kendini göstermeyebileceğini, ancak stresi azaltmak için adımlar atmanın verilerin yanlış yorumlanmasını önleyebileceğini öne sürmektedir.
Veriler, bir ITT gerçekleştirmeden önce bir alışma süresinin uygulanmasını desteklemektedir. Bununla birlikte, önerilen yöntemin bazı sınırlamaları vardır. Belki de bunlardan en belirgin olanı, fareleri idare etme ihtiyacıdır. Spesifik olarak, protokol farelerin kuyruk tarafından alınmasını içerir. Daha önceki bir çalışma, bu işleme yöntemini kullanarak glikoz seviyelerini, doğrudan fiziksel kısıtlama olmaksızın işleyicinin açık eldivenli ellerinde kepçeyle alınmayı ve serbestçe dolaşmayı içeren "fincan" yöntemiyle karşılaştırdı. Kupa yönteminin daha düşük açlık glikoz seviyeleri ve daha iyi glikoz toleransının yanı sıra daha düşük plazma kortikosteron konsantrasyonları ve anksiyete benzeri davranışların azalması ile sonuçlandığı bulunmuştur15,16. Bu nedenle, farelerin kuyruk tarafından yakalanma yöntemi hala bir stres tepkisi ortaya çıkarabilir, ancak genel olarak, elleçlemenin hayvanları insan temasına olumlu bir şekilde alıştırdığını kabul etmek önemlidir. Diğer bir sınırlama, kuyruktan kan örneği alma ihtiyacıdır, bu da strese neden olabilir. Kuyruk kesme ile arter örneklemesi 17 yoluyla elde edilen örneklerdeki katekolamin seviyelerini karşılaştıran bir çalışmada, ilkinde katekolaminlerin daha yüksek olması, kesilmiş kuyruk örneklemesinin stresli olabileceğini gösterir. Bununla birlikte, bu yalnızca büyük kan hacimleri (~ 100 μL) örneklendiğinde ve kuyruğa masaj yapıldığında veya sıkıldığında geçerlidir. Gerçekten de, kuyruktan minimum hacimde kan (~ 5 μL) örneklendiğinde, katekolamin seviyeleri yükselmedi17. Bu nedenle, iklimlendirme (ve ITT) prosedürünün glukometre okumaları için yalnızca küçük bir kan hacmi gerektirdiği göz önüne alındığında, kesik kuyruk yöntemi, potansiyel olarak bir stres tepkisini önleyen yararlı bir tekniktir. Bu konuda daha kesin bir iddiayı sınırlayan çalışmanın bir dezavantajı, stres hormonlarının ölçülmemesidir (ki bu büyük bir kan hacmi gerektirirdi).
Verilerle kanıtlandığı gibi, iklimlendirme prosedürü hem diyabetik hem de diyabetik olmayan farelerden daha güvenilir ITT verileri elde etmek için yararlıdır. Prosedürde yapılan ek iyileştirmelerin, bir ITT sırasında stresin etkisini daha da azaltması mümkündür. Örneğin, alışma süresi boyunca, farelerin i.p. salin. Salinin verilmesinin gerçekten gerekli olup olmadığını veya farelerin basitçe ele alınıp alınamayacağını ve intraperitoneal olarak boş bir şırınga yerleştirilip yerleştirilemeyeceğini bilmek faydalı olacaktır. Ayrıca, farelerin ele alınma sayısı ve her bir işlem arasındaki süre test edilebilir. Şu anda protokol, her işlem döneminin başlangıcı arasında 60 dakikalık bir aralık olacak şekilde, alışma süresi boyunca iki kez ele alınacaklarını belirtmektedir. Ek olarak, son işleme / enjeksiyondan ITT'nin başlangıcına kadar 60 dakikalık bir iyileşme süresi ekliyoruz. Daha kısa veya daha uzun bir iyileşme süresinin, db / db farelerde gözlemlediğimiz strese bağlı hiperglisemiyi daha da azaltıp azaltmayacağı henüz belirlenmemiştir. Daha önce, kullanım, gürültü ve IP enjeksiyonları gibi stresli uyaranlara yanıt olarak, kemirgenlerin en az 2 saat boyunca yüksek plazma kortikosteron seviyeleri sergilediği bildirilmiştir18, bu da belki de daha uzun bir iyileşme süresinin yararlı olacağını düşündürmektedir. Ayrıca, stres tepkileri farklı fare türleri arasında farklılık gösterebilir. Örneğin, kuyruk işleme, duyarlı suşlardanöbetleri tetikleyebilir 19. Tüm bu değişkenleri göz önünde bulundurarak, bir ITT'den önce iklimlendirme için kesin koşulların, protokolümüzü başlangıç noktası olarak kullanarak her bir araştırmacı tarafından ampirik olarak belirlenmesi gerekebileceğini öneriyoruz.
Özetle, ITT'leri gerçekleştirmeden önce fareleri kullanıma, enjeksiyonlara ve kan örneklemesine alıştırmak için bir yöntem tanımladık. Bunun strese bağlı hiperglisemiyi önemli ölçüde azalttığını ve insülin etkisini daha doğru bir şekilde yansıtan verilerle sonuçlandığını bulduk.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri hibesi P30 DK-017047 (Washington Üniversitesi Diyabet Araştırma Merkezi, Hücre Fonksiyon Analizi Çekirdeği) ve Amerika Birleşik Devletleri Gazi İşleri Bakanlığı, VA Puget Sound Health Care System (Seattle, WA) tarafından desteklenmiştir. Bu yazının içeriği, ABD Gazi İşleri Bakanlığı veya Birleşik Devletler Hükümeti'nin görüşlerini temsil etmemektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Dextrose-50 | Pfizer Injectables | 00409-6648-16 | For use if mouse experiences hypoglycemia. |
| Gauze pads | Fisher Scientific | 22037907 | To dislodge blood clot on the tail tip. |
| Glucometer | Accu-Chek | M001_us | To measure blood glucose. |
| Gram scale | To measure body weight. | ||
| Insulin (Novolin R) | Novo Nordisk | 0169-1833-11 | For injection. |
| Insulin syringes | VWR | BD-329461 | For injections. |
| Minute timer | |||
| Sterile 20 G needle | VWR | BD-305175 | For tail snip. |
| Sterile saline | Lifeshield | 1261699 | For injections. |
| Surgical scissors | Fine Science Tools | 14088-10 | For tail snip. |
| Test strips | Accu-Chek | 06908217001_us | To measure blood glucose. |
Referanslar
- Ayala, J. E., et al. Standard operating procedures for describing and performing metabolic tests of glucose homeostasis in mice. Disease Models & Mechanisms. 3 (9-10), 525-534 (2010).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Balcombe, J. P., Barnard, N. D., Sandusky, C. Laboratory routines cause animal stress. Contemporary Topics in Laboratory Animal Science. 43 (6), 42-51 (2004).
- Tabata, H., Kitamura, T., Nagamatsu, N. Comparison of effects of restraint, cage transportation, anaesthesia and repeated bleeding on plasma glucose levels between mice and rats. Lab Animal. 32 (2), 143-148 (1998).
- Olfe, J., Domanska, G., Schuett, C., Kiank, C. Different stress-related phenotypes of BALB/c mice from in-house or vendor: alterations of the sympathetic and HPA axis responsiveness. BMC Physiology. 10, 2 (2010).
- Ghalami, J., Zardooz, H., Rostamkhani, F., Farrokhi, B., Hedayati, M. Glucose-stimulated insulin secretion: Effects of high-fat diet and acute stress. Journal of Endocrinological Investigation. 36 (10), 835-842 (2013).
- Thorens, B. Brain glucose sensing and neural regulation of insulin and glucagon secretion. Diabetes, Obesity and Metabolism. 13, 82-88 (2011).
- Pekow, C. Defining, measuring, and interpreting stress in laboratory animals. Contemporary Topics in Laboratory Animal Science. 44 (2), 41-45 (2005).
- Chan, O., Inouye, K., Riddell, M. C., Vranic, M., Matthews, S. G. Diabetes and the hypothalamo-pituitary-adrenal (HPA) axis. Minerva Endocrinol. 28 (2), 87-102 (2003).
- Rosmond, R. Role of stress in the pathogenesis of the metabolic syndrome. Psychoneuroendocrinology. 30 (1), 1-10 (2005).
- Nonogaki, K. New insights into sympathetic regulation of glucose and fat metabolism. Diabetologia. 43 (5), 533-549 (2000).
- McGuinness, O. P., Ayala, J. E., Laughlin, M. R., Wasserman, D. H. NIH experiment in centralized mouse phenotyping: the Vanderbilt experience and recommendations for evaluating glucose homeostasis in the mouse. American Journal of Physiology-Endocrinology and Metabolism. 297 (4), 849-855 (2009).
- Zahorsky-Reeves, J., LW, C. Housing mice on corncob bedding versus hardwood chip may confound research models. American Association for Laboratory Animal Science. , (2010).
- Niswender, K. D., Shiota, M., Postic, C., Cherrington, A. D., Magnuson, M. A. Effects of increased glucokinase gene copy number on glucose homeostasis and hepatic glucose metabolism. Journal of Biological Chemistry. 272 (36), 22570-22575 (1997).
- Ghosal, S., et al. Mouse handling limits the impact of stress on metabolic endpoints. Physiology & Behavior. 150, 31-37 (2015).
- Hurst, J. L., West, R. S. Taming anxiety in laboratory mice. Nature Methods. 7 (10), 825-826 (2010).
- Ayala, J. E., Bracy, D. P., McGuinness, O. P., Wasserman, D. H. Considerations in the design of hyperinsulinemic-euglycemic clamps in the conscious mouse. Diabetes. 55 (2), 390-397 (2006).
- Barrett, A. M., Stockham, M. A. The effect of housing conditions and simple experimental procedures upon the corticosterone level in the plasma of rats. Journal of Endocrinology. 26, 97-105 (1963).
- Heinrichs, S. C. Neurobehavioral consequences of stressor exposure in rodent models of epilepsy. Progress in Neuro-Psychopharmacology & Biological Psychiatry. 34 (5), 808-815 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır