Method Article
意識のあるマウスのストレス誘発性高血糖を軽減するための腹腔内インスリン負荷試験前の順応
要約
ストレスによるグルコースレベルの上昇は、マウスの意識的な腹腔内インスリン負荷試験から得られたデータの解釈を混乱させる可能性があります。この記事では、ストレス誘発性高血糖を制限するために、インスリン負荷試験を実施する前にマウスを取り扱い、注射、および採血に順応させる方法について説明します。
要約
インスリン負荷試験は、げっ歯類の全身インスリン感受性を評価するための代謝研究で一般的に使用されます。これは、インスリンの1回の腹腔内注射後の経時的な血糖値の測定を含む比較的単純なテストです。意識のある状態で行われ、血液はテールスニップを介して採取されることが多いため、取り扱いや採血に伴う不安から動物からストレス反応を引き出す可能性があります。そのため、ストレスによる血糖値の上昇が発生する可能性があり、主要評価項目の測定値、つまりインスリンを介した血糖値の低下を検出して解釈することが困難になります。これは多くのマウス系統で見られ、インスリン投与後にグルコースレベルが減少するのではなく増加する可能性がある糖尿病のdb / dbマウスでは非常に一般的です。ここでは、インスリン負荷試験を行う前に、マウスを取り扱い、注射、および採血に順応させる方法について説明します。これにより、ストレスによる高血糖が低下し、全身のインスリン感受性をより正確に反映するデータが得られることがわかりました。
概要
げっ歯類の代謝試験は、グルコース恒常性を調節するさまざまなパラメータを評価するために定期的に実施されています1。in vivo で全身のインスリン作用を評価するためのゴールド スタンダードは、高インスリン血症-真血糖クランプ2 です。このテストでは、インスリンを投与して循環インスリンレベルを上げ、グルコースを注入して血糖を維持します。真血糖を維持するために必要なグルコース注入速度は、インスリン作用を示しています。.クランプ法は代謝研究において強力なツールですが、マウスのクランプ技術は技術的に困難で労働集約的であるため、代謝表現型を特徴付けるための初期スクリーニングツールとしてはあまり適していません。これらの理由から、より単純な腹腔内インスリン負荷試験(ITT)がしばしば選択されます。
ITTは、絶食期間(通常は4〜6時間)後の意識状態で実行されます。インスリンのボーラスを腹腔内に投与し、その後、血糖値を通常60分間にわたって監視します。血糖値は、インスリンがインスリン感受性組織へのグルコース取り込みを促進する能力により低下すると予想されます。これがどの程度発生するかは、全身のインスリン作用を示しています。.場合によっては、インスリン投与後にグルコースレベルが逆説的に減少するのではなく増加することが示されています。この現象は、ストレス反応に起因する可能性があります。取り扱い、注射、採血はすべてストレスを誘発し、視床下部-下垂体-副腎軸(HPA)と自律神経系(ANS)6,7,8の活性化をもたらす可能性があります。HPAとANSの両方が循環血糖値9,10,11の増加に寄与することはよく知られています。ITTの開始時にストレス誘発性高血糖が存在することは、インスリン投与時のグルコースの低下の速度と大きさを妨げるため、問題があります12。これは、インスリン抵抗性の存在に関して誤った結論につながる可能性があります。したがって、ITT中の血糖値に対するストレスの交絡影響を軽減するために、ITTを実行する前にマウスを取り扱い、注射、および採血に順応させる方法を開発しました。
プロトコル
ここに記載されているすべての方法は、VAピュージェットサウンドヘルスケアシステムの施設用動物管理および使用委員会によって承認されています。
注:低血糖を経験する動物のモニタリングおよび/または介入に関する地域の要件は、ここに記載されているものとは異なる場合があります。
1. ファスティング (t= -210 分)
- 暗期サイクルが終了した後、マウスをセルロースや紙製の寝具などの栄養価の低い寝具(トウモロコシの穂軸の寝具ではなく、マウスが摂取すると代謝エンドポイントに影響を与える)を備えた新しいケージに移します13。絶食期間中、マウスに水への自由なアクセスを提供します。マウスのグループ間での空腹時と期間に一貫性を持たせてください。示されたデータでは、0700時間から0800時間の間に食物が取り除かれました。これは、ダークサイクルが終了してから1〜2時間後でした。
- ITTが実行される場所にケージを移動します。これは、温度、騒音、光、動きなどのストレス要因が最小限に抑えられる静かな空間であるべきです。
2. 順化 (t= -150 から -60 分)
重要: マウスはできるだけ優しく扱ってください。可能であれば、拘束装置の使用を避けてください。
- -150分で体重を測定します。これは、ITT に投与されるインスリンの量の計算に使用されます。
- マウスのテールをそっとつまみ、テールをそっと握ったまま、平らなテーブルトップの表面に置きます。20Gの針(または手術用ハサミ)を使って、尻尾の先端に小さな切開をします。その部位に一滴の血液が形成され始めるはずです。
- マウスを滑らかで硬い面に置き、マウスの尻尾を優しく拘束します。
- このときの血糖値を記録するには、ハンドヘルド血糖値のテストストリップに尾端から一滴の血液を置きます。必要に応じて、尾 を非常に優しく マッサージして一滴の血液を採取します。
- 100 μLの滅菌生理食塩水をインスリン注射器に吸い込みます。やさしく首筋を動かしてマウスを手に取り、腹腔内に注入します。生理食塩水注射の時間を記録します。
- 複数のマウスを研究している場合は、マウスに生理食塩水を1分間隔で注入して、以下の次のステップの時間を確保します。.
- 生理食塩水注射の15分後、マウスの尻尾を優しく拾い上げます。ガーゼを使用して、尾の先端の血栓をやさしく取り除きます。
- オプション: ステップ 2.3 で説明したように、この時点で血糖値を再度記録します。
- 生理食塩水注射の30分後に、マウスの尾を優しく拾います。必要に応じて、ステップ2.3で説明されているように、別の血糖測定値を取得します。
- マウスをケージに戻し、必要に応じて他のマウスについても繰り返します。マウスを-90分まで放置します。
- -90分で、必要に応じて血糖値の測定を含め、手順2.3から2.6を繰り返します。
- マウスをケージに戻し、必要に応じて他のマウスについても繰り返します。ITT(ベースラインの血糖測定が-5分で行われる)までマウスを邪魔しないでください。
3. インスリン負荷試験 (t= -5 から +60 分)
- 滅菌生理食塩水に通常のインスリン(注意)の作業溶液を準備し、希望の用量を4μL / g体重で注射できるようにします。.
注:インスリンの取り扱いには注意が必要です。誤って注射すると低血糖を引き起こす可能性があるためです。 - マウスが介入を必要とする低血糖を発症した場合に備えて、滅菌生理食塩水に25%(v / v)デキストロース溶液を準備します。
- -5分後、マウスの尻尾をそっとつまみます。このときのベースライン血糖値を決定するには、ハンドヘルド血糖値のテストストリップに尾端から血液を一滴垂らします。必要に応じて、尾 を非常に優しく マッサージして一滴の血液を採取します。
- インスリン用溶液をインスリン注射器(体重4μL / g、典型的な用量範囲0.5〜2.0U / kg)に引き込みます。.やさしく首筋を動かしてマウスを手に取り、腹腔内に注入します。インスリン注射の記録的な時間。
- 複数のマウスを研究している場合は、マウスにインスリンを1分間隔で注射して、その後の採血と以下のデータ記録の時間を確保します。.
- インスリン注射の15分後、マウスの尻尾を優しくつまみ上げます。ガーゼを使用して、尾の先端の血栓をやさしく取り除きます。このとき、ステップ3.3で説明したように、血糖値を再度測定します。
- マウスをケージに戻し、低血糖の兆候(過度の嗜眠など)を監視します。マウスに低血糖の症状が現れた場合は、ステップ5で説明したように血糖を測定し、必要に応じてデキストロースを投与します。.デキストロース介入を受けているマウスは、この時点でITTプロトコルから削除されます。
- インスリン注射の30分後に手順3.5と3.6を繰り返します。
- インスリン注射の45分後にステップ3.5と3.6を繰り返します。
- インスリン注射の60分後に手順3.5と3.6を繰り返します。
- マウスを自宅のケージに戻し、ケージの床にいくつかの食物ペレットを入れて、ITTからの回復を助けます。30分間モニターを続け、マウスが正常な活動/行動を取り戻していない場合は、ステップ3.6で説明されている手順に従ってください。
注: 図1 は、上記の順応とITT手順をまとめたものです。
結果
図2A および 図3A は、インスリン投与後15分間の糖尿病db/dbマウスにおける血糖値の逆説的な上昇を示す代表的なデータ(それぞれ個別および平均データ)であり、ストレス誘発性高血糖と一致する。なお、同じ手順を受けた対照の非糖尿病同腹仔(db/+または+/+)では、血糖値の上昇は見られませんでした。ITT手順への順応がこの血糖値の増加を緩和するのに効果的であるかどうかを判断するために、同じマウスに上記の順応プロトコルを受けました。各主要なステップはグラフ内の垂直線で示され(図2B)、マウスが処理されるたびに血液サンプルが採取されました。-150分での取り扱いおよび/または生理食塩水注射により、4 db/dbマウスのうち3匹で血糖値が上昇しました(赤い丸)。4匹目のマウスの血糖値は>600mg/dLでした。使用した血糖値計の検出上限は600mg/dLであるため、4匹目のマウスで血糖値が上昇するかどうかは確認できませんでした。その後の-90分での取り扱いにより、2匹のマウスで血糖値が上昇しました。血糖値は、対照マウス(青い三角形)での取り扱いによる影響を受けませんでしたが、t = 0では、血糖値は-60分時よりも低かった(150 ± 6対175 ± 8 mg / dL;n = 4、p = 0.02)。順応後のITT中の血糖値は、インスリン投与後のすべての時点で低下しました。.順化前後のITTの平均データを 図3に示します。全体的なグルコースレベルは、順応していない糖尿病のdb / dbマウスよりも順応していなかったことに注意してください(図3A;p < 0.05)。さらに、インスリン投与後の最初の15分間の血糖値の低下は、順応プロトコル後の非糖尿病の同腹仔対照群(図3B;p = 0.002)で大きかった。

図 1.順応中の取り扱い、注射、採血手順、ITTを示す模式図。この図の拡大版を表示するには、ここをクリックしてください。
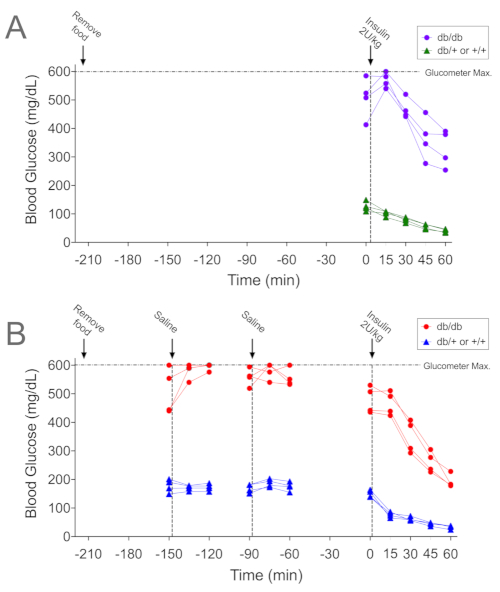
図 2.順応パラダイムの有無にかかわらず実行されるITTの代表的な例。(A)糖尿病患者db / dbマウス(紫色の円)および同腹仔非糖尿病対照(db / +または+/+;緑の三角形)の血糖値は、ITT(2 U / kg)中に3.5時間(210分)の高速に実行されますが、追加の取り扱いはありません。.(B)同じマウスの血糖値(赤丸でdb / db、青の三角形でコントロール)がその後、ここに記載されている順応手順を受け、続いてITT(2 U / kg)が続きます。パネルAとパネルBの処置間の時間間隔は6日でした。データは個々のマウス(遺伝子型あたりn = 4)について示されています。 この図の拡大版を表示するには、ここをクリックしてください。

図 3.順化の前後に実施されたITTの平均血糖値データ。(A)ITT中の同じdb / dbマウスからの平均(± SD)血糖値 (紫)または(赤)順化手順を使用して実施。順応手順により、0〜15分の間のグルコースレベルの上昇がなくなることに注意してください。また、全体的なグルコースレベルは、順応していない糖尿病のdb / dbマウスと比較して順応していません(p < 0.05)。n=4 です。(B)ITT中の同じコントロールdb/+または+/+マウスからの平均(±SD)血糖値(緑)または(青)順化手順なしで実施。順化手順により、0 分から 15 分の間にグルコース レベルが急激に低下することに注意してください (p=0.002)。n=4 です。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
高インスリン血症-正常血糖クランプは、in vivo でのインスリン作用を評価するためのゴールド スタンダードと考えられています。クランプを実施するための方法論の修正は、頸動脈を介した血液サンプリングおよび頸静脈を介した注入を可能にするために、以前に2カテーテルシステム14を使用してカテーテル化された意識のある、拘束されていないマウス2において技術が行われる結果となった。これにより、処置中にマウスを取り扱うか拘束する必要性が制限され、それによってストレス反応が減少する2。代謝研究において、ストレスがさまざまなエンドポイント測定を混乱させる可能性があることはよく認識されています1,3。ストレスは、採血、嗅覚刺激、騒音、光、麻酔など、取り扱いに加えてさまざまな要因によって誘発される可能性があります3,4,5。その結果、視床下部-下垂体-副腎軸(HPA)と自律神経系(ANS)の活性化は、血糖値に大きな影響を与える可能性があります9,10,11。
クランプマウスによるインスリン作用の測定は好ましい方法ですが、技術的に困難で労働集約的であるため、多くの場合、実現不可能です。これらの理由から、マウスではより単純なITTがより一般的に行われます。ITTは、絶食したマウスのインスリンの腹腔内ボーラスに反応して、経時的な血糖値の変化(通常は60分)を監視します。少量の血液は、ベースライン時とその後15分ごとにテールチップからサンプリングされます。ITTを実施する際の考慮事項は、特に絶食期間、インスリンの投与量、および結果データの提示に関して、以前に議論されてきました1,12。ここでは、ITTの前のストレスがその後のインスリンに対するグルコース反応に与える影響について考察しました。これは、db/dbマウスでの研究から得られたもので、インスリン投与後の血糖値の低下ではなく、逆説的な増加が一貫して観察されました。ITTを実行する前にマウスを取り扱いと注射に順応させたところ、血糖値の上昇を緩和できることがわかりました。このことは、ITTの発症時に観察される見かけの高血糖にストレスが関与している可能性が高いことを示唆しています。この現象は文献では一般的であるようです。「db」と「insulin tolerance」という検索語を用いてPubMed検索を行い、101件(1998年から2019年までの発表日)の結果が得られました。そのうち76の出版物は、アクセス可能な全文コンテンツを持ち、db/dbマウスでITTを実施し、ITTデータを経時的なグルコースレベル(生値および/またはベースライン値の割合)として表示しました。これらの76件の研究のうち、16件の研究(21%)で、未治療のdb/dbマウスのITT中に血糖値が上昇しました。さらに4件の研究では、他のマウス群(例:薬物治療db/dbまたは対照非dbマウス)でグルコースレベルの増加が示されました。最後に、さらに10件の研究では、ITTの過程でdb/dbマウスにインスリン投与後のグルコースレベルの低下が観察されなかったが、これはマウスのインスリン使用量または顕著なインスリン抵抗性の状態に関連している可能性がある。私たちの
DB/DBマウスに着目した研究と文献レビューでは、この現象が他のマウス系統でも発生する可能性が高いとされています。したがって、ITTを実行する際には、特にストレスがデータの解釈にどのように影響するかについて、ストレスの影響をより深く認識する必要があります。
そのために、ITTを開始する前に実行できる順化プロトコルを開発しました。重要なステップには、拘束装置を使用せずにマウスを取り扱い、注射することが含まれます。周囲の騒音、照明、温度、およびITTが実行される部屋の動きには特に注意を払う必要があります。ITTが始まる直前の環境の変化への曝露を最小限に抑えるために、絶食期間の開始時にマウスをこの部屋に移すことをお勧めします。また、マウスの不安関連行動に影響を与える可能性があるため、研究者が落ち着いていることも重要です。db/dbマウスでは、ITT中の0分から15分の間のグルコースレベルの上昇が順応手順によって解消されることを発見しました。さらに、非糖尿病の対照マウスでは、順応手順により、ITT中に0〜15分の間にグルコースレベルが急激に低下しました。重要なことに、順応していない非糖尿病対照マウスは、ITTの開始時にグルコースレベルの上昇を示さなかったが、順応すると、グルコース廃棄率が高いことを示して好意的に反応した。後者は、ITT中のストレスが必ずしもベースラインを超えるグルコースレベルの上昇として現れるとは限らないことを示唆していますが、ストレスを軽減するための措置を講じることで、データの誤解を回避できる可能性があります。
このデータは、ITTを実行する前の順応期間の実施をサポートします。ただし、提案された方法にはいくつかの制限があります。おそらく、これらの中で最も明白なのは、マウスを扱う必要性です。具体的には、プロトコルは、マウスが尾部によって拾われることを含む。以前の研究では、この取り扱い方法を使用した血糖値と、すくい上げられ、直接の身体拘束なしにハンドラーの開いた手袋をはめた手で自由に歩き回ることができる「カップ」法を比較しました。カップ法は、空腹時血糖値の低下と耐糖能の改善、血漿コルチコステロン濃度の低下、不安様行動の減少をもたらすことがわかりました15,16。したがって、マウスを尾に拾い上げる方法は、依然としてストレス反応を引き起こす可能性があるが、一般的に、動物をポジティブに扱うことは、動物を人間との接触に慣れさせることを認識することが重要である。また、尾から血液を採取する必要があるため、それ自体がストレスを誘発する可能性があるという制限もあります。テールカットと動脈サンプリング17で得られたサンプル中のカテコールアミンレベルを比較した研究では、カテコールアミンは前者の方が高かったため、テールカットサンプリングはストレスになる可能性があることが示されました。ただし、これは大量の血液(~100 μL)をサンプリングし、尾をマッサージまたは圧迫する場合にのみ当てはまります。実際、テールから最小量の血液(~5μL)をサンプリングした場合、カテコールアミンレベルは上昇しませんでした17。したがって、順応(およびITT)手順では、血糖値計の読み取りに必要な血液量がわずかであることを考えると、カットテール法はストレス応答を潜在的に回避する有用な手法です。この点に関してより決定的な主張を制限するこの研究の欠点は、ストレスホルモンが測定されなかったという事実です(これには大量の血液が必要でした)。
データから明らかなように、この順化手順は、糖尿病マウスと非糖尿病マウスの両方からより信頼性の高いITTデータを取得するのに役立ちます。手順をさらに改良することで、ITT中のストレスの影響をさらに軽減できる可能性があります。例えば、順応期には、マウスに生理食塩水を投与する「模擬」注射を提案します。生理食塩水の送達が本当に必要なのか、それともマウスを単純に扱い、空の注射器を腹腔内に挿入できるのかを知ることは有用です。また、マウスを取り扱う回数や、各取り扱いの間隔もテストできます。現在、プロトコルでは、順応期間中に2回、各処理期間の開始間隔を60分間隔で処理することが示されています。さらに、最後の取り扱い/注入からITTの開始まで60分の回復期間を組み込んでいます。回復期間が短いか長いかが、db/dbマウスで観察されるストレス誘発性高血糖をさらに緩和するかどうかは、まだ決定されていません。以前に、取り扱い、騒音、i.p.注射などのストレスの多い刺激に反応して、げっ歯類は少なくとも2時間血漿コルチコステロンレベルの上昇を示すと報告されました18、おそらくより長い回復期間が有用であることを示唆しています。さらに、ストレス応答はマウスの系統によって異なる場合があります。例えば、テールハンドリングは、感受性株19の発作を引き起こす可能性がある。これらすべての変数を考慮すると、ITT の前の順応の正確な条件は、プロトコルを出発点として、各研究者が経験的に決定する必要がある可能性があることを提案します。
要約すると、ITTを実行する前に、マウスを取り扱い、注射、および採血に順応させる方法について説明しました。これにより、ストレスによる高血糖が大幅に低下し、インスリンの作用をより正確に反映するデータが得られることがわかりました。
開示事項
著者は何も開示していません。
謝辞
この研究は、国立衛生研究所の助成金P30 DK-017047(ワシントン大学糖尿病研究センター、細胞機能分析コア)、および米国退役軍人省のVAピュージェットサウンドヘルスケアシステム(ワシントン州シアトル)の支援を受けました。この原稿の内容は、米国退役軍人省または米国政府の見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Dextrose-50 | Pfizer Injectables | 00409-6648-16 | For use if mouse experiences hypoglycemia. |
| Gauze pads | Fisher Scientific | 22037907 | To dislodge blood clot on the tail tip. |
| Glucometer | Accu-Chek | M001_us | To measure blood glucose. |
| Gram scale | To measure body weight. | ||
| Insulin (Novolin R) | Novo Nordisk | 0169-1833-11 | For injection. |
| Insulin syringes | VWR | BD-329461 | For injections. |
| Minute timer | |||
| Sterile 20 G needle | VWR | BD-305175 | For tail snip. |
| Sterile saline | Lifeshield | 1261699 | For injections. |
| Surgical scissors | Fine Science Tools | 14088-10 | For tail snip. |
| Test strips | Accu-Chek | 06908217001_us | To measure blood glucose. |
参考文献
- Ayala, J. E., et al. Standard operating procedures for describing and performing metabolic tests of glucose homeostasis in mice. Disease Models & Mechanisms. 3 (9-10), 525-534 (2010).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Balcombe, J. P., Barnard, N. D., Sandusky, C. Laboratory routines cause animal stress. Contemporary Topics in Laboratory Animal Science. 43 (6), 42-51 (2004).
- Tabata, H., Kitamura, T., Nagamatsu, N. Comparison of effects of restraint, cage transportation, anaesthesia and repeated bleeding on plasma glucose levels between mice and rats. Lab Animal. 32 (2), 143-148 (1998).
- Olfe, J., Domanska, G., Schuett, C., Kiank, C. Different stress-related phenotypes of BALB/c mice from in-house or vendor: alterations of the sympathetic and HPA axis responsiveness. BMC Physiology. 10, 2 (2010).
- Ghalami, J., Zardooz, H., Rostamkhani, F., Farrokhi, B., Hedayati, M. Glucose-stimulated insulin secretion: Effects of high-fat diet and acute stress. Journal of Endocrinological Investigation. 36 (10), 835-842 (2013).
- Thorens, B. Brain glucose sensing and neural regulation of insulin and glucagon secretion. Diabetes, Obesity and Metabolism. 13, 82-88 (2011).
- Pekow, C. Defining, measuring, and interpreting stress in laboratory animals. Contemporary Topics in Laboratory Animal Science. 44 (2), 41-45 (2005).
- Chan, O., Inouye, K., Riddell, M. C., Vranic, M., Matthews, S. G. Diabetes and the hypothalamo-pituitary-adrenal (HPA) axis. Minerva Endocrinol. 28 (2), 87-102 (2003).
- Rosmond, R. Role of stress in the pathogenesis of the metabolic syndrome. Psychoneuroendocrinology. 30 (1), 1-10 (2005).
- Nonogaki, K. New insights into sympathetic regulation of glucose and fat metabolism. Diabetologia. 43 (5), 533-549 (2000).
- McGuinness, O. P., Ayala, J. E., Laughlin, M. R., Wasserman, D. H. NIH experiment in centralized mouse phenotyping: the Vanderbilt experience and recommendations for evaluating glucose homeostasis in the mouse. American Journal of Physiology-Endocrinology and Metabolism. 297 (4), 849-855 (2009).
- Zahorsky-Reeves, J., LW, C. Housing mice on corncob bedding versus hardwood chip may confound research models. American Association for Laboratory Animal Science. , (2010).
- Niswender, K. D., Shiota, M., Postic, C., Cherrington, A. D., Magnuson, M. A. Effects of increased glucokinase gene copy number on glucose homeostasis and hepatic glucose metabolism. Journal of Biological Chemistry. 272 (36), 22570-22575 (1997).
- Ghosal, S., et al. Mouse handling limits the impact of stress on metabolic endpoints. Physiology & Behavior. 150, 31-37 (2015).
- Hurst, J. L., West, R. S. Taming anxiety in laboratory mice. Nature Methods. 7 (10), 825-826 (2010).
- Ayala, J. E., Bracy, D. P., McGuinness, O. P., Wasserman, D. H. Considerations in the design of hyperinsulinemic-euglycemic clamps in the conscious mouse. Diabetes. 55 (2), 390-397 (2006).
- Barrett, A. M., Stockham, M. A. The effect of housing conditions and simple experimental procedures upon the corticosterone level in the plasma of rats. Journal of Endocrinology. 26, 97-105 (1963).
- Heinrichs, S. C. Neurobehavioral consequences of stressor exposure in rodent models of epilepsy. Progress in Neuro-Psychopharmacology & Biological Psychiatry. 34 (5), 808-815 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved