Method Article
腹膜内胰岛素耐量试验前的驯化以减轻清醒小鼠应激诱导的高血糖
摘要
应激诱导的葡萄糖水平升高会混淆对小鼠有意识腹膜内胰岛素耐量试验得出的数据的解释。在本文中,我们描述了一种在进行胰岛素耐量测试之前使小鼠适应处理、注射和采血的方法,以限制压力诱导的高血糖症。
摘要
胰岛素耐量试验通常用于代谢研究,以评估啮齿动物的全身胰岛素敏感性。这是一项相对简单的测试,涉及在单次腹膜内注射胰岛素后测量血糖水平随时间的变化。鉴于它是在清醒状态下进行的,并且血液通常是通过剪尾收集的,由于与处理和血液采集相关的焦虑,它有可能引起动物的应激反应。因此,可能会发生压力诱导的血糖升高,从而难以检测和解释主要终点指标,即胰岛素介导的血糖降低。这在许多小鼠品系中都已见到,并且在糖尿病 db/db 小鼠中很常见,其中葡萄糖水平在胰岛素给药后会增加而不是降低。在这里,我们描述了一种在进行胰岛素耐量测试之前使小鼠适应处理、注射和采血的方法。我们发现这降低了压力引起的高血糖症,并导致数据更准确地反映全身胰岛素敏感性。
引言
啮齿动物的代谢测试常规进行,以评估调节葡萄糖稳态1 的各种参数。评估体内全身胰岛素作用的金标准是高胰岛素-正常血糖钳夹2。该测试包括给予胰岛素以提高循环胰岛素水平,同时注入葡萄糖以维持血糖正常。维持血糖正常所需的葡萄糖输注速率表明胰岛素的作用。虽然它是代谢研究中的强大工具,但小鼠的夹技术在技术上具有挑战性且劳动强度大,因此不太适合作为表征代谢表型的初始筛选工具。由于这些原因,通常选择更简单的腹膜内胰岛素耐量试验 (ITT)。
ITT 是在禁食期(通常为 4-6 小时)后的清醒状态下进行的。通过腹膜内推注胰岛素,然后在通常持续 60 分钟的时间范围内监测血糖。由于胰岛素能够促进葡萄糖摄取到胰岛素敏感组织中,预计血糖水平会下降;这种情况发生的程度表明全身胰岛素的作用。在某些情况下,已经表明胰岛素给药后葡萄糖水平反常地增加,而不是降低。这种现象可能归因于压力反应。处理、注射和采血都会诱发压力 3,4,5,导致下丘脑-垂体-肾上腺轴 (HPA) 和自主神经系统 (ANS) 激活 6,7,8。众所周知,HPA 和 ANS 都有助于循环葡萄糖水平的增加 9,10,11。在 ITT 开始时存在应激诱导的高血糖是有问题的,因为它会干扰胰岛素给药时葡萄糖下降的速度和幅度12。这可能会导致关于胰岛素抵抗存在的错误结论。因此,为了减轻 ITT 期间压力对葡萄糖水平的混杂影响,我们开发了一种在进行 ITT 之前让小鼠适应处理、注射和采血的方法。
研究方案
此处描述的所有方法均已获得 VA 普吉特海湾医疗保健系统的机构动物护理和使用委员会的批准。
注意:当地对低血糖动物的监测和/或干预要求可能与此处描述的不同。
1. 禁食 (t= -210 分钟)
- 黑暗循环结束后,将小鼠转移到具有非营养垫料的新笼子中,例如纤维素或纸垫料(不是玉米棒垫料,如果被小鼠食用,会影响代谢终点13)。在整个禁食期间为小鼠提供随意饮水的机会。与小鼠组的一天禁食时间和持续时间保持一致。对于显示的数据,食物在 0700 到 0800 小时之间被去除,即黑暗循环结束后的 1-2 小时。
- 将笼子移动到将执行 ITT 的位置。这应该是一个安静的空间,最大限度地减少温度、噪音、光线或运动等压力源。
2. 驯化 (t= -150 至 -60 分钟)
重要提示:尽可能轻柔地处理鼠标。如果可能,避免使用约束装置。
- 在 -150 分钟时,测量体重。这将用于计算将为 ITT 施用的胰岛素量。
- 轻轻地捡起鼠标的尾巴,放在平坦的桌面上,同时仍然轻轻地抓住鼠标的尾巴。使用 20 G 针(或手术剪刀)在尾巴尖端做一个小切口。该部位应开始形成一滴血。
- 将鼠标放在光滑坚硬的表面上,并轻轻地用尾巴约束鼠标。
- 要记录此时的血糖,请将尾尖的一滴血滴在手持式血糖仪的试纸上。如有必要, 非常轻柔 地按摩尾巴以获得一滴血。
- 将 100 μL 无菌生理盐水吸入胰岛素注射器中。轻轻地捡起鼠标并腹膜内注射。记录生理盐水注射的时间。
- 如果正在研究多只小鼠,则每隔 1 分钟向小鼠注射生理盐水,以便为后续步骤留出时间。
- 注射盐水后 15 分钟,轻轻地捡起小鼠的尾巴。用纱布轻轻去除尾尖上的任何血凝块。
- 可选:此时再次记录血糖,如步骤 2.3 中所述。
- 注射盐水后 30 分钟,轻轻地抓住鼠标的尾巴。如果需要,按照步骤 2.3 中的说明进行另一次血糖测量。
- 将鼠标放回笼子中,并根据需要对其他鼠标重复此作。让小鼠不受干扰直到 -90 分钟。
- 在 -90 分钟时,重复步骤 2.3 至 2.6,包括测量血糖水平(如果需要)。
- 将鼠标放回笼子中,根据需要对其他鼠标重复此作。让小鼠不受干扰,直到 ITT(基线血糖测量在 -5 分钟进行)。
3. 胰岛素耐量测试 (t= -5 至 +60 分钟)
- 在无菌盐水中制备普通胰岛素 (CAUTION) 的工作溶液,以便可以以 4 μL/g 体重注射所需剂量。
注意:处理胰岛素时应小心,因为意外注射会导致低血糖。 - 在无菌盐水中制备 25% (v/v) 葡萄糖溶液,以备小鼠出现需要干预的低血糖症时使用。
- 在 -5 分钟时,轻轻地捡起鼠标的尾巴。通过将尾尖的一滴血滴在手持式血糖仪的试纸上,确定此时的基线血糖水平。如有必要, 非常轻柔 地按摩尾巴以获得一滴血。
- 将胰岛素工作溶液吸入胰岛素注射器中(4 μL/g 体重,典型剂量范围为 0.5-2.0 U/kg)。轻轻地捡起鼠标并腹膜内注射。记录胰岛素注射时间。
- 如果正在研究多只小鼠,则每隔 1 分钟向小鼠注射胰岛素,以便有时间进行后续的血液采样和下面的数据记录。
- 注射胰岛素后 15 分钟,轻轻地捡起鼠标的尾巴。用纱布轻轻去除尾尖上的任何血凝块。此时按照步骤 3.3 中的说明再次测定血糖。
- 将鼠标放回笼子并监测低血糖的迹象(例如,过度嗜睡)。如果小鼠出现低血糖症状,请按照步骤 5 中的说明测量血糖,并在必要时给予葡萄糖。此时,接受葡萄糖干预的小鼠将从 ITT 方案中删除。
- 注射胰岛素后 30 分钟重复步骤 3.5 和 3.6。
- 注射胰岛素后 45 分钟重复步骤 3.5 和 3.6。
- 注射胰岛素后 60 分钟重复步骤 3.5 和 3.6。
- 将小鼠放回它们的家笼中,笼子的地板上有一些食物颗粒,以帮助从 ITT 中恢复。继续监测 30 分钟,如果小鼠没有恢复正常的活动/行为,请按照步骤 3.6 中描述的程序进行作。
注意: 图 1 总结了上述驯化和 ITT 程序。
结果
图 2A 和 图 3A 是代表性数据(分别为个体和平均数据),显示糖尿病 db/db 小鼠在胰岛素给药后 15 分钟内血糖水平反常升高,与应激诱导的高血糖一致。请注意,在接受相同程序的对照非糖尿病同窝同窝 (db/+ 或 +/+) 中,血糖没有明显升高。为了确定适应 ITT 程序是否能有效缓解这种血糖升高,同一只小鼠接受了上述驯化方案。每个主要步骤都由图表中的垂直线表示(图 2B),并且每次处理小鼠时都采集血样。在 -150 分钟时处理和/或盐水注射导致 4 只 db/db 小鼠中的 3 只血糖升高(红色圆圈);第 4 只小鼠的血糖水平为 >600 mg/dL。由于 600 mg/dL 是所用血糖仪的检测上限,我们无法确定第四只小鼠的血糖是否升高。随后在 -90 min 的处理导致 2 只小鼠的血糖升高。血糖水平不受对照小鼠(蓝色三角形)处理的影响,尽管 t = 0,血糖水平低于 -60 分钟(150 ± 6 vs. 175 ± 8 mg/dL;n = 4,p = 0.02)。驯化后 ITT 期间的血糖水平在胰岛素给药后的所有时间点均下降。驯化前后 ITT 的平均数据如图 3 所示。请注意,与未适应的糖尿病 db/db 小鼠相比,适应的糖尿病 db/db 小鼠的总体葡萄糖水平较低(图 3A;p < 0.05)。此外,在驯化方案之后,非糖尿病同窝对照中胰岛素给药后前 15 分钟内血糖水平的下降幅度更大 (图 3B;p = 0.002)。

图 1.示意图描述了驯化和 ITT 期间的处理、注射和采血程序。请单击此处查看此图的较大版本。
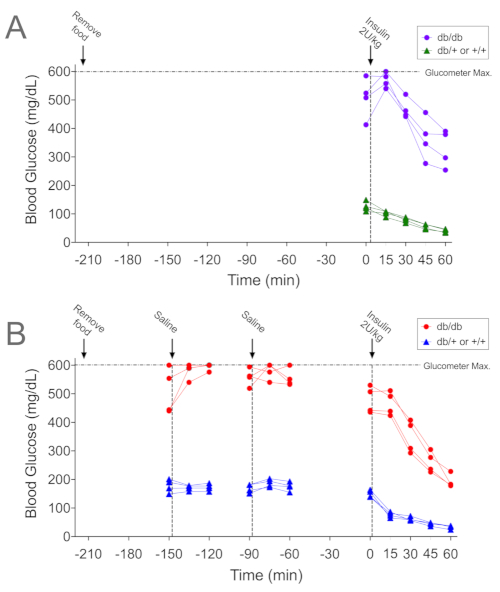
图 2.有和没有驯化范式的 ITT 的代表性例子。(A) 糖尿病 db/db 小鼠(紫色圆圈)和同窝非糖尿病对照(db/+ 或 +/+;绿色三角形)在 3.5 小时(210 分钟)禁食后进行 ITT (2 U/kg) 期间的血糖水平,但没有额外处理。(B) 来自同一只小鼠的血糖水平(红色圆圈中的 db/db,蓝色三角形中的对照)随后接受此处描述的驯化程序,然后是 ITT (2 U/kg)。面板 A 与面板 B 中的程序之间的时间间隔为 6 天。显示了个体小鼠的数据(每个基因型 n=4)。 请单击此处查看此图的较大版本。

图 3.驯化前后进行的 ITT 平均血糖数据。(A) 在无(紫色)或有(红色)驯化程序的 ITT 期间,同一 db/db 小鼠的平均 (± SD) 血糖水平;请注意,驯化程序在 0 到 15 分钟之间消除了葡萄糖水平的升高。此外,与未适应的糖尿病 db/db 小鼠相比,适应的糖尿病 db/db 小鼠的总体葡萄糖水平较低 (p<0.05)。n=4 的。(B) 在无(绿色)或有(蓝色)驯化程序进行 ITT 期间,来自同一对照 db/+ 或 +/+ 小鼠的平均 (± SD) 血糖水平;请注意,驯化过程导致葡萄糖水平在 0 到 15 分钟之间急剧下降 (p = 0.002)。n=4 的。 请单击此处查看此图的较大版本。
讨论
高胰岛素-正常血糖钳夹被认为是评估体内胰岛素作用的金标准。对执行钳夹方法的修改导致该技术在有意识的、不受约束的小鼠2 中完成,这些小鼠之前已使用双导管系统14 进行导管插入,以便通过颈动脉进行血液采样和通过颈静脉输注。这限制了在手术过程中处理或约束小鼠的需要,从而减少压力反应2。众所周知,压力会混淆代谢研究中的各种终点指标 1,3。除了处理之外,压力还可能由各种因素诱发,包括采血、嗅觉刺激、噪音、光线和麻醉 3,4,5。随之而来的下丘脑-垂体-肾上腺轴 (HPA) 和自主神经系统 (ANS) 的激活会对血糖水平产生深远的影响 9,10,11。
虽然通过夹紧小鼠来测量胰岛素作用是首选方法,但通常不可行,因为它在技术上具有挑战性且劳动强度大。由于这些原因,更简单的 ITT 更常在小鼠中进行。ITT 监测空腹小鼠腹膜内推注胰岛素后血糖随时间(通常为 60 分钟)的变化。在基线时通过尾尖采集少量血液,此后每 15 分钟采集一次。之前已经讨论过进行 ITT 的注意事项,特别是关于禁食时间、胰岛素剂量和结果数据的呈现 1,12。在这里,我们考虑了 ITT 前应激对随后葡萄糖对胰岛素反应的影响。我们从对 db/db 小鼠的研究中得出这一点,在那里我们始终观察到胰岛素给药后血糖的反常增加,而不是降低。在进行 ITT 之前让小鼠适应处理和注射后,我们发现我们可以减轻血糖的升高。这表明压力可能在 ITT 开始时观察到的明显高血糖中发挥作用。这种现象在文献中似乎很常见。使用检索词 “db” 和 “insulin tolerance” 进行 PubMed 检索,产生 101 个结果(出版日期 1998 年至 2019 年)。其中,76 篇出版物具有可访问的全文内容,在 db/db 小鼠中进行了 ITT,并将 ITT 数据显示为随时间变化的葡萄糖水平(原始值和/或基线值的百分比)。在这 76 项研究中,16 项研究 (21%) 未治疗的 db/db 小鼠在 ITT 期间血糖水平升高。另外 4 项研究显示其他小鼠组(例如,药物治疗的 db/db 或对照非 db 小鼠)的葡萄糖水平增加。最后,另外 10 项研究未能观察到在 ITT 过程中 db/db 小鼠注射胰岛素后血糖水平降低,尽管这可能与使用的胰岛素剂量或小鼠显着的胰岛素抵抗状态有关。虽然我们的
研究和文献综述侧重于 Db/DB 小鼠,这种现象极有可能也发生在其他小鼠品系中。因此,在执行 ITT 时需要更加了解压力的影响,尤其是在它如何影响数据解释方面。
为此,我们开发了一种驯化方案,可以在开始 ITT 之前进行。关键步骤包括在不使用约束装置的情况下处理和注射小鼠。应特别注意环境噪音、照明、温度和将进行 ITT 的房间内的任何移动。建议在禁食期开始时将小鼠转移到这个房间,以尽量减少在 ITT 开始前暴露于环境变化。研究者保持冷静也很重要,因为这可能会影响小鼠的焦虑相关行为。在 db/db 小鼠中,我们发现驯化程序消除了 ITT 期间 0 到 15 分钟之间葡萄糖水平的升高。此外,在非糖尿病对照小鼠中,驯化程序导致 ITT 期间 0 至 15 分钟之间葡萄糖水平急剧下降。重要的是,未适应的非糖尿病对照小鼠在 ITT 开始时没有表现出葡萄糖水平升高,但在适应后,它们仍然表现出更高的葡萄糖处理率,反应良好。后者表明,ITT 期间的压力可能并不总是表现为血糖水平高于基线,但采取措施减轻压力可以避免对数据的误解。
数据支持在执行 ITT 之前实施适应期。然而,所提出的方法有一些局限性。也许其中最明显的是需要处理老鼠。具体来说,该协议涉及用尾巴捡起老鼠。之前的一项研究将使用这种处理方法的血糖水平与 “杯 ”方法进行了比较,后者涉及被舀起并在处理者张开的手套中自由漫游,而不受直接的物理约束。研究发现,杯法导致空腹血糖水平降低,葡萄糖耐量改善,血浆皮质酮浓度降低,焦虑样行为减少15,16。因此,用尾巴捡起老鼠的方法可能仍然会引起应激反应,尽管重要的是要认识到,一般来说,处理会使动物积极地习惯于与人类的接触。另一个限制是需要从尾巴采集血液样本,这本身就会引起压力。在一项比较通过切尾与动脉取样获得的样本中的儿茶酚胺水平的研究中 17,前者的儿茶酚胺较高,表明切尾取样可能会带来压力。然而,只有当对大量血液 (~100 μL) 进行采样并按摩或挤压尾部时,才会出现这种情况。事实上,当从尾部取样最小体积的血液 (~5 μL) 时,儿茶酚胺水平并没有升高17。因此,鉴于驯化(和 ITT)程序只需要少量血容量来读取血糖仪读数,因此切尾法是一种可能避免应激反应的有用技术。该研究的一个缺点限制了这方面更明确的断言,即没有测量压力荷尔蒙(这需要大量的血容量)。
数据证明,驯化程序可用于从糖尿病和非糖尿病小鼠获得更可靠的 ITT 数据。对该程序的额外改进可能会进一步减轻 ITT 期间压力的影响。例如,在驯化期间,我们建议小鼠接受腹腔注射盐水的“模拟”注射。了解生理盐水的输送是否真的必要,或者是否可以简单地处理小鼠并在腹膜内插入空注射器,这将是有用的。此外,还可以测试处理小鼠的次数以及每次处理之间的时间。目前,该协议表明它们在适应期内处理两次,每个处理期开始之间的间隔为 60 分钟。此外,我们还纳入了从最后一次处理/注射到 ITT 开始的 60 分钟恢复期。更短或更长的恢复期是否会进一步缓解我们在 db/db 小鼠中观察到的压力诱导的高血糖仍有待确定。以前,据报道,在应对作、噪音和 ip注射等压力刺激时,啮齿动物的血浆皮质酮水平升高至少 2 小时18,这表明更长的恢复期可能很有用。此外,不同品系小鼠的应激反应可能不同。例如,尾巴处理会引发易感菌株的癫痫发作19。在考虑所有这些变量时,我们建议可能需要由每个研究者以我们的方案为起点,根据经验确定 ITT 前驯化的确切条件。
总之,我们已经描述了一种在进行 ITT 之前使小鼠适应处理、注射和采血的方法。我们发现这显着降低了压力引起的高血糖症,并导致数据更准确地反映胰岛素作用。
披露声明
作者没有什么可披露的。
致谢
这项工作得到了美国国立卫生研究院拨款 P30 DK-017047(华盛顿大学糖尿病研究中心,细胞功能分析核心)和美国退伍军人事务部弗吉尼亚州普吉特海湾医疗保健系统(华盛顿州西雅图)的支持。本手稿内容不代表美国退伍军人事务部或美国政府的观点。
材料
| Name | Company | Catalog Number | Comments |
| Dextrose-50 | Pfizer Injectables | 00409-6648-16 | For use if mouse experiences hypoglycemia. |
| Gauze pads | Fisher Scientific | 22037907 | To dislodge blood clot on the tail tip. |
| Glucometer | Accu-Chek | M001_us | To measure blood glucose. |
| Gram scale | To measure body weight. | ||
| Insulin (Novolin R) | Novo Nordisk | 0169-1833-11 | For injection. |
| Insulin syringes | VWR | BD-329461 | For injections. |
| Minute timer | |||
| Sterile 20 G needle | VWR | BD-305175 | For tail snip. |
| Sterile saline | Lifeshield | 1261699 | For injections. |
| Surgical scissors | Fine Science Tools | 14088-10 | For tail snip. |
| Test strips | Accu-Chek | 06908217001_us | To measure blood glucose. |
参考文献
- Ayala, J. E., et al. Standard operating procedures for describing and performing metabolic tests of glucose homeostasis in mice. Disease Models & Mechanisms. 3 (9-10), 525-534 (2010).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188(2011).
- Balcombe, J. P., Barnard, N. D., Sandusky, C. Laboratory routines cause animal stress. Contemporary Topics in Laboratory Animal Science. 43 (6), 42-51 (2004).
- Tabata, H., Kitamura, T., Nagamatsu, N. Comparison of effects of restraint, cage transportation, anaesthesia and repeated bleeding on plasma glucose levels between mice and rats. Lab Animal. 32 (2), 143-148 (1998).
- Olfe, J., Domanska, G., Schuett, C., Kiank, C. Different stress-related phenotypes of BALB/c mice from in-house or vendor: alterations of the sympathetic and HPA axis responsiveness. BMC Physiology. 10, 2(2010).
- Ghalami, J., Zardooz, H., Rostamkhani, F., Farrokhi, B., Hedayati, M. Glucose-stimulated insulin secretion: Effects of high-fat diet and acute stress. Journal of Endocrinological Investigation. 36 (10), 835-842 (2013).
- Thorens, B. Brain glucose sensing and neural regulation of insulin and glucagon secretion. Diabetes, Obesity and Metabolism. 13, Suppl 1 82-88 (2011).
- Pekow, C. Defining, measuring, and interpreting stress in laboratory animals. Contemporary Topics in Laboratory Animal Science. 44 (2), 41-45 (2005).
- Chan, O., Inouye, K., Riddell, M. C., Vranic, M., Matthews, S. G. Diabetes and the hypothalamo-pituitary-adrenal (HPA) axis. Minerva Endocrinol. 28 (2), 87-102 (2003).
- Rosmond, R. Role of stress in the pathogenesis of the metabolic syndrome. Psychoneuroendocrinology. 30 (1), 1-10 (2005).
- Nonogaki, K. New insights into sympathetic regulation of glucose and fat metabolism. Diabetologia. 43 (5), 533-549 (2000).
- McGuinness, O. P., Ayala, J. E., Laughlin, M. R., Wasserman, D. H. NIH experiment in centralized mouse phenotyping: the Vanderbilt experience and recommendations for evaluating glucose homeostasis in the mouse. American Journal of Physiology-Endocrinology and Metabolism. 297 (4), 849-855 (2009).
- Zahorsky-Reeves, J., LW, C. Housing mice on corncob bedding versus hardwood chip may confound research models. American Association for Laboratory Animal Science. , AALAS Scientific Session (10 October) (2010).
- Niswender, K. D., Shiota, M., Postic, C., Cherrington, A. D., Magnuson, M. A. Effects of increased glucokinase gene copy number on glucose homeostasis and hepatic glucose metabolism. Journal of Biological Chemistry. 272 (36), 22570-22575 (1997).
- Ghosal, S., et al. Mouse handling limits the impact of stress on metabolic endpoints. Physiology & Behavior. 150, 31-37 (2015).
- Hurst, J. L., West, R. S. Taming anxiety in laboratory mice. Nature Methods. 7 (10), 825-826 (2010).
- Ayala, J. E., Bracy, D. P., McGuinness, O. P., Wasserman, D. H. Considerations in the design of hyperinsulinemic-euglycemic clamps in the conscious mouse. Diabetes. 55 (2), 390-397 (2006).
- Barrett, A. M., Stockham, M. A. The effect of housing conditions and simple experimental procedures upon the corticosterone level in the plasma of rats. Journal of Endocrinology. 26, 97-105 (1963).
- Heinrichs, S. C. Neurobehavioral consequences of stressor exposure in rodent models of epilepsy. Progress in Neuro-Psychopharmacology & Biological Psychiatry. 34 (5), 808-815 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。