Method Article
İmmünofluoresans Mikroskobu kullanılarak Parafin Gömülü Kedi Arteriyel Trombisinde Nötrofil Ekstrasellüler Tuzakların Belirlenmesi
Bu Makalede
Özet
Isıya bağlı antijen alma ve çift immün etiketleme protokolü kullanarak formaldehit sabit ve parafin gömülü kedi kardiyojenik arteriyel trombisinde nötrofil ekstrasellüler tuzaklarını (NET) tanımlamak için bir yöntem tanımladık.
Özet
Hücresiz DNA (cfDNA) ve histones ve nötrofil elastaz (NE) gibi proteinlerden oluşan nötrofil ekstrasellüler tuzakları (NETs), sistemik inflamasyon veya patojenlere yanıt olarak nötrofiller tarafından salınır. Daha önce NET'lerin pıhtı oluşumunu artırıp insanlarda ve köpeklerde fibrinolizi inhibe kleri gösterilmiş olsa da, hipertrofik kardiyomiyopatiye sekonder yaşamı tehdit eden bir komplikasyon olan kardiyojenik arteriyel tromboemboli (CATE) olan kedilerde NET'lerin rolü , bilinmemektedir. Kedilerde kardiyojenik artertrombinde NET'leri tanımlamak ve ölçmek için standartlaştırılmış bir yöntem, CATE'deki patolojik rollerini anlamamızı sağlayacaktır. Burada, nekropsi sırasında çıkarılan aort bifurkasyonu içinde formaldehit-sabit ve parafin gömülü trombi de NETs tanımlamak için bir teknik açıklanmıştır. Ksilen ile deparafinizasyon dan sonra, aort bölümleri dolaylı ısı kaynaklı antijen alma yapıldı. Daha sonra kesitler bloke edildi, permeazize edildi ve ex vivo NET'ler hücresiz DNA (cfDNA), sitilinated histon H3 (citH3) ve nötrofil elastaz (NE) immünofloresan mikroskobu kullanılarak kolokalizasyonu ile tespit edildi. Trombide Nİt'lerin immünosaptasyonuna optimize etmek için doku elementlerinin otofloresansı mikroskopi den önce otofloresan söndürme işlemi ile sınırlandırıldı. Bu teknik, diğer türlerde NETs ve tromboz çalışma için yararlı bir araç olabilir ve bu karmaşık durumun patofizyolojisi içine yeni anlayışlar sunuyor.
Giriş
Hipertrofik kardiyomiyopatisi olan kediler hayatı tehdit eden tromboembolik komplikasyonlar riski altındadır1,2. Kedi kardiyojenik artertromboemboli (CATE) ile ilişkili yüksek morbidite ve mortaliteye rağmen, KEDILERDE CATE'in altta yatan patofizyolojisi tam olarak anlaşılamamıştır. Bu yıkıcı durum riski altında kedileri tedavi etmek ve tanımlamak için sınırlı tanı ve tedavi araçları da vardır3.
Nötrofillerin doğuştan gelen bağışıklıktaki rolüne ek olarak, nötrofillerin, nötrofil elastazı (NE) ve miyeloperoksidaz gibi histones ve granüler proteinler ile kaplanmış hücresiz DNA (cfDNA) ağları olan nötrofil ekstrasellüler tuzakları (NETs) serbest bırakarak trombozda rol oynadığı gösterilmiştir. Nötrofiller sistemik inflamasyona yanıt olarak NETs oluşumu, patojenler ile doğrudan karşılaşma ve aktif trombositlerileetkileşim 4,5,6,7. Köpeklerde nötrofil kaynaklı DNA'nın pıhtı lyzisini inhibe ettiği, NET proteinlerin ise pıhtı oluşumunu hızlandırdığı gösterilmiştir. NETs yeteneği sirkülasyon hücreleri ve pıhtılaşma bileşenleri tuzak da onların trombojenik özellikleri8,9,,10,11,12anahtarıdır.
NET'ler ekstrasellüler nötrofil proteinlerin, histones ve cfDNA'nın kolokalizasyonu ile saptanır. Bu nedenle, deparafinize dokuların immünororesans ile sabit dokularda NETs belirlenmesi ve nicelleştirilmesi parlak alan mikroskopisi 4 kullanarak geleneksel hematoksilin4ve eozin (H & E) leke üstündür 4,5. Immünororesans mikroskopisi kullanarak yapılan çeşitli insan çalışmaları, KORONER arter trombüsü, serebral inme trombozu, aterothrombosis ve venöz trombosit13,14,,15,1616,17yapısal bileşenleri olarak NETs tespit . Bugüne kadar, kedi trombositindeki NET'leri tespit etmek ve ölçmek için standart laştırılmış bir yöntem tanımlanmamıştır. Kedi kardiyojenik artertrombisinde NET'lerin belirlenmesi, NET'lerde ve trombozlarda gelecekteki çeviri araştırmalarını kolaylaştırabileceğinden, kedilerde parafin gömülü arteriyel trombide NET tanımlama ve değerlendirme tekniklerini açıklıyoruz.
Protokol
Burada açıklanan tüm yöntemler, Davis California Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi'nin yönergelerine uygun olarak gerçekleştirilmiştir. Dokuların nekropsi ve biyopsileri sahiplerinin rızası ile yapıldı.
1. Doku fiksasyonu, katıştırma ve kesit
- Aort bifurkasyon dışarı diseksiyon, inen aort dahil, femoral arter, ve ortak iliak arterler(Şekil 1A), kısa bir süre sonra insancıl ötenazi veya ölüm. Blunt fasya yıkıntın (Şekil 1B) tamamen daldırma önce 10% nötr tamponlu formalin en az 24 saat ve en fazla 48 saat.
- Numuneyi susuz hale getirmek için ilk olarak %10 nötr tamponlu formalin ile 37 °C'ye 1 saat boyunca ısıtılır. Daha sonra, 37 °C'ye ısıtılan etanol konsantrasyonlarını (%70, %95, %100) kadar sualtında Her biri 1 saat için 2x. Son olarak, durulama olmadan, 2x 100% toluen 37 °C için 1 saat her ısıtılan batırın.
- 62 °C'ye ısıtılmış parafin ekleyin ve parafinin bir gecede tamamen katılamasını bekleyin.
- Bölüm 2-3 μm parafin gömülü doku bir mikrotom kullanarak ve pozitif yüklü cam slaytlar üzerine yerleştirin. Kesitli dokuları bir sonraki analize kadar -80 °C'de saklayın.
2. Deparafinizasyon, rehidrasyon ve ısıya bağlı antijen alımı
- Cam kaydıraklarda kesitlerin deparafinizasyonunu ve rehidrasyonunu gerçekleştirmek için cam slaytları raflara yerleştirin ve aşağıdaki sırayla işleyerek işlem yapın:
- 3 dk. Bu adımı 2x tekrarlayın için % 100 ksilen tamamen batırın. Adımlar arasında durulama yapmayın.
- Etanol konsantrasyonları azalan tamamen batırın (%100, %95, %70) oda sıcaklığında (RT), 3 dk her biri için 3x. Adımlar arasında durulama yapmayın.
- 2 dk. Tekrarlayın, tamamen deiyonize suya batırın.
- Bölümleri 2-3 dakika boyunca % 0,1 Ara (TBST, pH = 7,6) ile Tris-tamponlu tuzlu içine yerleştirin.
- Rezervuarı 100 °C'ye ısıtılan deiyonize su ile doldurun. Vapur odasının 20 dk boyunca dengede olmasını bekleyin.
NOT: Isıya bağlı antijen alımı en iyi, bir gıda buharı gibi önceden ayarlanmış sıcaklık ayarına sahip bir buharlı tarafından üretilen dolaylı ısıtma ile gerçekleştirilir. - Tris ve EDTA (pH = 9) içeren ticari olarak kullanılabilen antijen alma çözeltisini sıcaklık kontrollü bir sıcak plaka üzerinde 95-97 °C'ye sürekli karıştırarak ısıtın. Kaynamadığından emin olun.
NOT: Çözelti ısındıktan sonra bulutlu olmalıdır. - Isıtılan antijen alma çözeltisini bir slayt kabına dökün ve kabı buhar odasına yerleştirin. Antijen alma çözeltisinin 3-4 dakika boyunca buharlının sıcaklığını dengelemesine izin verin.
- Isıtmalı antijen alma çözeltisi tamamen slaytlar batırın ve 20 dakika boyunca buharlı ile harici ısıtma uygulamasıdevam.
- Slayt kabını buharlı yerden çıkarın ve slaytların ve antijen alma solüsyonunun RT'ye soğumasını bekleyin. Seyreltilmiş antijen alma çözeltisini 4 °C'de saklayın ve gerekirse 2 kata kadar yeniden kullanın.
- 5 dakika tbst ile slaytlar 3x yıkayın.
3. İmmünetiketleme ve otofloresan söndürme
NOT: Tablo 1, aşağıdaki adımlarda kullanılan engelleme arabelleklerinin bileşimini ayrıntılarıyla anlatır.
- Nazik sallanan altında RT 2 saat için Tampon 1 Engelleme inkübat bölümleri (30-50 rpm). Kurumasını önlemek için parafin film ile mühür.
- Yıkamadan, hemen 100 μL seyreltilmiş tavşan poliklonal anti-insan sitülilinated histon H3 (citH3) antikor (0.03 mg/mL bloke tampon seyreltilmiş 1) doğrudan slayt üzerine uygulayın.
- Antikor karışımının eşit şekilde dağıtılmasını sağlamak için her bölüme bir kapak kayması (24 mm x 40 mm x 0,13-0,17 mm) yerleştirin.
- 4 °C'de 12-16 saat boyunca hafif sallanan (30-50 rpm) inkübat. Kurumasını önlemek için parafilm filmi ile mühürleyin.
- 5 dakika TBST ile 3x yıkayın.
- Adım 3.3'te açıklandığı gibi Alexa Fluor 488'e (0.04 mg/mL veya Bloklama Tampon1'de 1:50'lik son konsantrasyona seyreltilmiş) 100 μL keçi anti-tavşan antikor uygulayın. Nazik sallanan altında RT 1 saat için kuluçka (30-50 rpm). Slaytları ışıktan koruyun.
- 5 dakika TBST 3x ile yıkayın.
- Bloklama Tampon 2'deki inkübasyon bölümleri gece boyunca 4 °C'de hafif sallanan (30-50 rpm) altında. Işıktan koruyun.
- 5 dakika TBST 3x ile yıkayın.
- Blok Buffer 3 blok bölümleri olarak adım 3.3 rt 2 saat nazik sallanan altında (30-50 rpm) açıklanmıştır.
- Biyotinylated poliklonal tavşan anti-insan NE antikor (son konsantrasyon = 0.2 μg/mL Engelleme Tampon 3) ile inkübat bölümleri 4 ° C için 12-16 h adımlar 3.2-3.4 açıklandığı gibi.
- 5 dakika TBST 3x ile yıkayın.
- Alexa Fluor 594 streptavidin konjuge ile incubate (1:100 veya 0.02 mg/mL Blokaj Tampon 3) adımlarında açıklandığı gibi 3.2-3.3 için 1 saat RT. Kurumasını önlemek için ışık tan koruyun ve parafin ile mühür.
- 5 dakika TBST 1x ile yıkayın.
- 100 μL otofloresan söndürme çözeltisi karışımını üreticinin talimatıyla 1 dk boyunca doğrudan bölümlere uygulayın.
- Slaytları hemen TBST 6x ile 10 dk yıkayın.
- Her slaydı karanlıkta 5 dakika boyunca 100 μL 300 nM DAPI ile kapatın.
- 3 dk. TBST ile yıkayın 5x toplam bu tekrarlayın.
- Bir damla (~50 μL) antifade montaj ortamı, otomatik floresan söndürme kitinin bir parçası, doğrudan bölümü çevreleyen cam slayt üzerine uygulayın. Herhangi bir kabarcık oluşturmadan bir kapak kaymasını (24 mm x 40 mm x 0,13-0,17 mm) yavaşça bölümün üzerine yerleştirin.
- Montaj ortamı daldırma lensleri ile mikroskobik analiz için sertleşene kadar numunelerin karanlıkta bir gecede 4 °C'de tedavi edilmesine izin verin.
4. Nötrofil ekstrasellüler tuzak tanımlama
NOT: Aşağıdaki protokol, 1.280 x 960 dijital CCD fotoğraf makinesine sahip ters epifloresan mikroskobu kullanır (bkz.
- Trombüs bulmak için, aort uzunluğu boyunca caudally için cranially tetkik, aort bifurkasyon, ve her femoral arter 10x amacı ile faz kontrast mikroskopisi kullanarak. Trombüs, evre kontrastı ve parlak alan mikroskobunda endotel'e bitişik kırmızı kan hücreleri, beyaz kan hücreleri ve trombositiçeren dokuların bir araya edilmesidir(Şekil 2A, Şekil 2B).
- İlk olarak 10x ve 20x hedefleri(Şekil 2C)ile DAPI kanalını (uyarma = 357/44 nm) kullanan NET'ler için bölümleri inceleyin. Faz kontrastı veya parlak alan mikroskobunda görüldüğünde cfDNA'nın bir hücrenin sitoplazmasının sınırları içinde olmayan yoğuşmuş DNA olarak göründüğünü unutmayın.
- Texas Red kanallarında (uyarma = 585/29 nm, emisyon = 628/32 nm) ve yeşil floresan protein kanalı (uyarma = 470/22 nm, emisyon = 525/50 nm) sırasıyla 10, 20 ve 40x hedefleri ile ekstrasellüler NE ve citH3 tanımlayın.
- Image J (NIH) gibi kullanılabilir yazılımları kullanarak trombüs içindeki NET'leri değerlendirin ve analiz edin. NET oluşumu cfDNA, hücre dışı citH3 ve NE'nin daha önce açıklandığı gibi18'inkolokalizasyonuna göre tanımlanır. Piksel yoğunluğunda doygunluğu önlemek için görüntülerin edinimi boyunca her kanalın tutarlı pozlama süresini ve kazançlarını koruyun.
- Her trombüs, aorta en yakın Bölge 1, aorttan en uzak Bölge 3 ve Bölge 2'yi Bölgeler 1 ve 3'e kadar üç eşit bölgeye bölerek alçalan aorta olan yakınlığına göre haritala. Operatör her deneğin tıbbi durumuna kör ile, her bölgede en az on rasgele alanlar almak. Trombüsdeki NET'lerin dağılımını, her bölgede NET'li alanların ortalamasını alarak veya bölge başına ortalama NET işgal alanını hesaplayarak karakterize edin.
Sonuçlar
Bu protokolü deparafinizasyon, ısıya bağlı antijen alımı ve parafin gömülü trombinin çift immünetiketlemesi için kullanarak, kedi CATE'de ilk kez NET'leri tespit ettik. Aort bifurkasyonu içinde trombüs, standart H&E boyama ve faz kontrast lı mikroskopi kullanılarak floresan mikroskobu ve parlak alan mikroskobu ile saptandı. Parlak alan mikroskobunda kedi artertrombisi kırmızı kan hücreleri, lökositler, fibrin ve trombositlerden oluşuyordu(Şekil 3A). H&E belirli NET bileşenlerini lekeleyemerağmen de, NET'ler sıklıkla yakındaki eritrositve lökositleri çevreleyen çeşitli uzunluklarda derin mor iplik ağları olarak ortaya çıkmıştır(Şekil 3A, noktalı anahat). Faz kontrastlı mikroskopide vasküler alan içinde iyi çizilmiş bir yapı olarak trombüs karakterize edildi (Şekil 2A, Şekil 4B). Ayrıca immünoresans mikroskobu ile bu alanlarda NET'lerin varlığını doğruladık(Şekil 3B). Bu alanların büyütülmesi cfDNA, hücre dışı sitH3 ve NE(Şekil 2C, Şekil 3B, beyaz noktalı anahat) oluşan BÜYÜK NET agregaları ortaya koymuştur. CATE'siz kedilerde trombüs ve NET aramak için aynı tekniği kullanarak, zaman zaman endotel'e yakın bir yerde lized nötrofil tabakalarının tespit edilebildiğini bulduk. Bu nötrofiller NET oluşumunun bazı morfolojik özelliklerini gösterseler de, herhangi bir organize trombüs ile ilişkilendirilmemelidir. Kontrol örneklerinin hiçbirinde trombüs tespit edemedik(Şekil 4A).
Şekil 5A, yeşil (488 nm) dalga boyunda görüntülendiğinde eritrosit ler ve kollajen gibi pıhtı elementlerinin derin otofloresansını gösterir ve bu da cfDNA ve protein kolokalizasyonunu algılama yeteneğimizi engeller. Immunolabeling sonrası ticari olarak kullanılabilen bir kit kullanılarak yapılan kısa otofloresan söndürmenin, eritrosit bolluğu olan bölgelerde bile protein kolokalizasyonu ve NET algılama duyarlılığını önemli ölçüde artırdığını bulduk(Şekil 5B, ok başları).
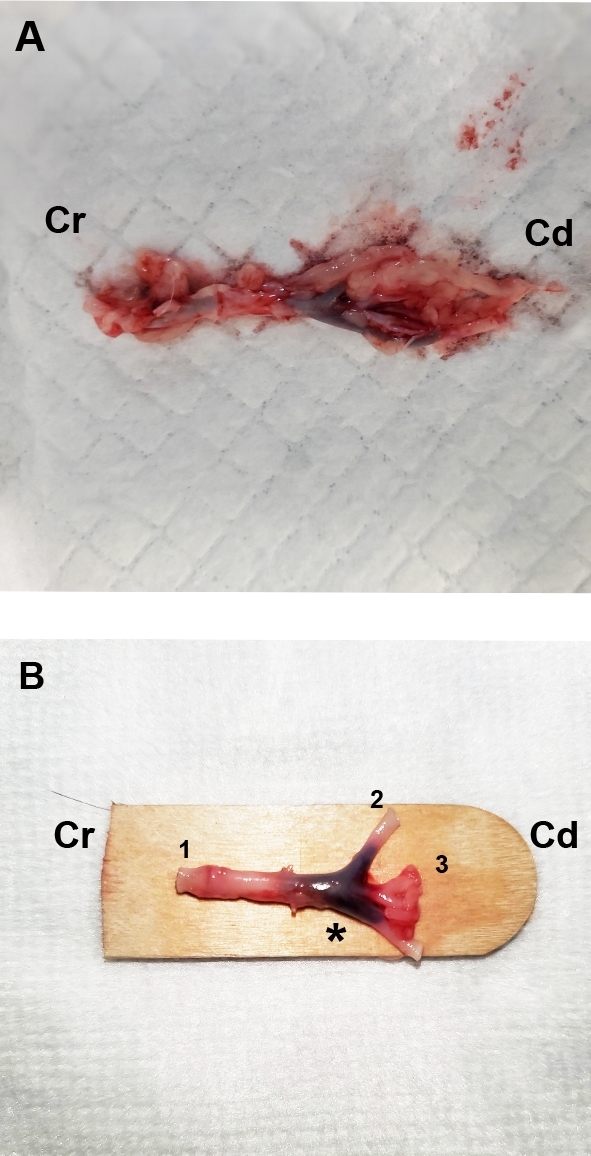
Şekil 1: Kardiyojenik arteriyel tromboemboli olan bir kediden kesilen aort bifurasyonunun temsili nekropsi fotoğrafları. (A) Alçalan aort, aort bifurkasyonuna 4-5 cm kranial (Cr) kesildi. (B) Fasya, alçalan aort (1) ve iliak arterler (2,3) kaudal açıdan (Cd) açıkça görülene kadar dikkatlice kesildi. Aort bifurasyonu (*) içindeki trombüse dikkat edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
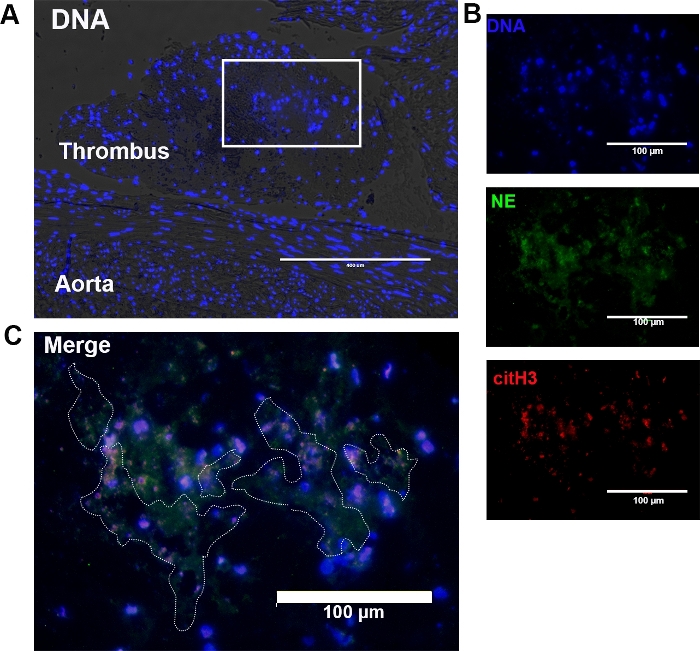
Şekil 2: Kedi aort bifurkasyonunda bulunan trombüsdeki NET'lerin temsili faz kontrastı ve immünofloresan görüntüleri. (A) Faz kontrast mikroskopisi, aorta yakın ayrık ve iyi çizilmiş bir yapı olarak trombüs saptadı. Dna'nın (mavi) kombine faz kontrastı ve floresan boyamasında trombüs içinde lökositler ve hücresiz DNA varlığı saptandı. Kutulu alan hücre içermeyen DNA büyük bir konsantrasyon oluşur. Orijinal 10x büyütme; Ölçek çubuğu = 400 μm. (B) (A)'daki kutulu alan 20x'te daha da büyütüldü. Hücresiz DNA ve hücre içi DNA DAPI (mavi), nötrofil elastaz (NE) ve sitilinated histon H3 (citH3) ile lekeli, sırasıyla yeşil ve kırmızı çıktı. (Orijinal 20x büyütme; Ölçek çubuğu = 100 μm). (C) Hücresiz DNA, hücre dışı NE ve citH3'ün kolokalizasyonuna göre tanımlanan NET'ler ana hatları (noktalı çizgi) olarak sıralandı. Orijinal 40x büyütme; Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
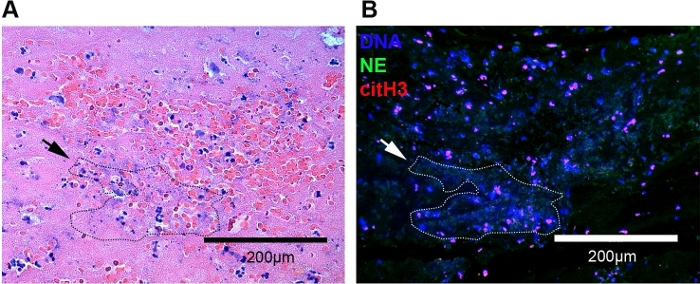
Şekil 3: H&E ve immünoresans boyama kullanarak kedi arteriyel trombüs temsili görüntü. (A) H&E lekelerinde nötrofil ve eritrositlerin büyük konsantrasyonu görüldü. Hücre dışı kromatinler eritrositler ve nötrofiller (noktalı anahat, siyah ok) ile çevrili çeşitli uzunluklarda derin mor iplikler olarak ortaya çıktı. (B) Nötrofil ekstrasellüler tuzakları aynı trombüs (noktalı anahat, beyaz ok) üzerinde immünororesans mikroskopisi kullanılarak kolayca görüntülendi. NET'ler cfDNA (mavi), NE (yeşil) ve citH3 (kırmızı) kolokalizasyonu olarak tanımlandı. Orijinal 20x büyütme; Ölçek çubuğu = 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Aort çatalankasyonlarının temsili faz kontrastı ve immünoresans görüntüleri. (A) Arteriyel trombozsuz bir kedide aort bifurkasyonlarının faz kontrastı ve immünoresans görüntüleri. Arteriyel tromboz olmadan kediden aort bifurkasyonunun lümeni içinde trombofin veya nötrofil agregalarının yokluğuna dikkat edin. (B) Kardiyojenik arteriyel tromboemboli tanısı konmuş bir kedide aort bifurkasyonlarının faz kontrastı ve immünororesans görüntüleri. Aort bifurkasyonları DNA (mavi), nötrofil elastazı (yeşil) ve sitrüllinated histon H3 (kırmızı) için boyandı. Bu durumda, iyi çizilmiş trombüs vasküler duvara şişkin ve aort lümen en işgal kardiyojenik arteriyel tromboemboli ile kedi dikkat çekti. CFDNA, NE ve citH3'ün kolokalizasyonu ile karakterize olan NET'ler trombüs (noktalı anahat) içinde tanımlanmıştı. Orijinal 10x büyütme; Ölçek çubuğu = 400 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
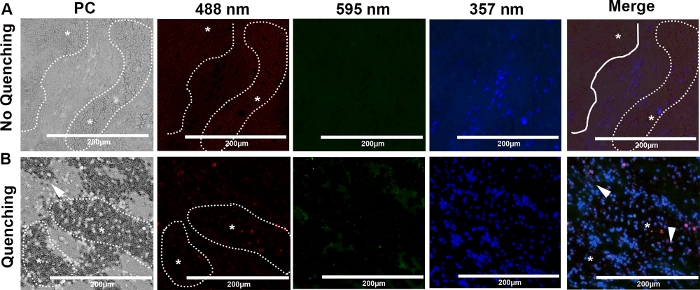
Şekil 5: İki kedinin arteriyel trombositinin temsili faz kontrastı (PC) ve immünofloresan görüntüleri. Slaytlar citH3, NE ve DNA için boyanmış ve 488 nm (kırmızı), 595 nm (yeşil) ve 357 nm (mavi) dalga boylarında, sırasıyla, 40x büyütme de görüntülendi. Kedilerde kardiyojenik arteriyel trombosit eritrosit bolluğu vardı (*, noktalı çizgi). (A) Eritrositlerden gelen otofloresans en çok 488 nm dalga boyu boyunca belirgindi, bu da kolokalizasyon sinyalinin saptanması ve NET'lerin tanımlanmasını azalttı. (B) Quenching özellikle eritrosit konsantrasyonu yüksek olan bölgelerde (*, noktalı çizgi) 488 nm dalga boyunda otofloresansı önemli ölçüde azalttı. Eritrositvarlığında kolokalize proteinler, citH3 ve nötrofil elastaz (ok ucu) saptandı (Ölçek çubuğu = 200 m). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Bir kediden arteriyel trombinin temsili immünoresans görüntüleri. Kesitler DNA (mavi), citH3 (kırmızı) ve ya miyeloperoksidaz (A) veya nötrofil elastaz (B)için boyanmıştır. (A)Kediye özgü miyeloperoksidaz antikor (MPO, 1:5) kullanılmasına rağmen, MPO'nun boyama yoğunluğu zayıf kalmıştır. (B) Birden fazla türle çapraz reaksiyon gösterdiği bilinen poliklonal nötrofil elastaz (NE) antikor kullanılarak immünoreaktivite ve boyama şiddeti anlamlı olarak yüksekti. NE (oklar) ile çevrili nötrofillerin karakteristik lobi çekirdeklerine dikkat edin. Orijinal 40x büyütme; Ölçek çubuğu = 100 μm. Bu rakamı indirmek için lütfen buraya tıklayınız.
| Arabelleği Engelleme | Kompozisyon | |
| 1 | %0.1 Tween-20, %0.1 NP40, %5 keçi serumu ile TBS | |
| 2 | %0.1 Tween-20, %10 tavşan serumu, %0.1 NP-40 ile TBS | |
| 3 | %0,1'lik TBS %0,1'lik TWeen-20, %5 BSA, %0,1 NP-40 | |
Tablo 1: İmmünfloresan için kullanılan blokajların bileşimi.
Tartışmalar
Biz bir çift immünetiketleme protokolü ve immünororesans mikroskopisi kullanarak sabit kedi kardiyojenik arteriyel trombosit NETs tanımlamak için bir protokol açıklar. Sadece kardiyojenik arteriyel trombüs lekelenmiş olmasına rağmen, teoride bu protokol diğer trombüs türleri ve diğer veteriner türleri için kullanılabilir. Kedi artertrombinindeki NET'lerin belirlenmesi, kedilerde trombozda NET'lerin rol oynayabileceğini düşündürmektedir.
Sabit ve parafin gömülü dokuda immünororesans ile NETs tespiti H & E gibi geleneksel histolojik lekeler üstündür, genellikle nötrofiller ile çevrili kromatin iplikleri gösterir13. Sabit arteriyel trombinimmünohistokimya ve immünofloresans cfDNA ve citH3 gibi diğer ekstrasellüler proteinlerin eşzamanlı algılama sağlar, NETs oluşumuna özgü olduğu bilinen18,19. Kriyopreparatlar doku ve trombide NET tespiti için suboptimal olduğundan, örneklerimizi %4 formaldehit ve %10 metanol içeren %10 nötr tamponlu formalin le koruduk. Hücre içermeyen nükleik asitler formaldehit ile doğrudan sabit değildir. Bunun yerine, formaldehit20tarafından indüklenen kısmen geri dönüşümlü metilen köprü çapraz bağlantılar tarafından değiştirilir sabit protein yapıları içinde immobilize edilir. Formaldehit oksidasyonu ile oluşan formik asit ve ketonların neden olduğu artefakt ve otofloresansı daha da sınırlamak için, araştırmacılar fiksasyon için tamponda seyreltilmiş metanoliçermeyen paraformaldehit kullanmayı seçebilirler. Fiksasyon süresi immünoremi etkilediği için, dehidratasyon ve parafin katıştırma işleminden önce 24 saatten daha uzun bir süre için fiksasyon öneririz. Parafin gömülü dokular veya pıhtılar daha sonra deparafinizasyon ve boyama için saklanabilir.
Formaldehit ve paraformaldehit ile kimyasal fiksasyon proteinlerin üçüncül yapısını değiştirir, ilgi antijenleri maskeleme ve belirli epitoplar21antikorların bağlanmasını önler. Metilen köprüsü çapraz bağlantılarını kıran bir süreç olan antijen alma işlemi, formalin-sabit dokularda immünoalgılama işlemi gerçekleştirmeden önce gereklidir. Yazarların deneyimlerine dayanarak, hafif dolaylı ısıtma ile alkali alma solüsyonu (tris/EDTA tamponunda pH = 9) kullanılarak ısıya bağlı antijen alımı, proteinlerin ve NET'lerin algılanmasını artırırken, eserler ve otofloresansı en aza indirir. Antijen alma solüsyonunun sıcaklığı kaynama noktasına (>100 °C) ulaşmamalıdır, çünkü proteinlerin denatüre edilmesi nonspesifik bağlanma ve arka plan gürültüsüne yol açabilir.
Sabit pıhtılarda NET tanımlamanın bir sınırlaması, immünoforesans boyamanın farklı antijen alma koşullarında çok değişken olabileceğidir18. Brinkmann ve ark.'nın elde ettiği sonuçlarla karşılaştırılabilir şekilde, daha yüksek kuluçka sıcaklıklarının (>55 °C) çekirdeklerde histones'un optimal boyanması ve dekontoslanmış kromatin19. Ancak, nötrofiller ve NET'lerde bulunan taneli protein olan miyeloperoksidaz'ın boyama yoğunluğunun önerilen koşullar altında düşük olduğunu bulduk. Miyeloperoksidazın zayıf immünoreaktivitesi kedi spesifik antikor kullanımına rağmen tutarlıydı (Ek Şekil 1). Bu nedenle, araştırmacıları antijen alma sürecinin süresini ve koşullarını (örneğin, pH, sıcaklık) değiştirerek ilginin antijesine dayalı tatmin edici bir sinyal vermeye teşvik ediyoruz.
Veteriner türlerinde NET'lerin belirlenmesinin zorluklarından biri türe özgü antikorların eksikliğidir. Aynı türden kaynaklanan birincil antikorlar kullanılırken karşılaşılan paraziti önlemek için, keçi anti-tavşan ikincil antikorlarında kalan bağlayıcı bölgeleri doygunhale getirmek için yüksek konsantrasyonda tavşan immünglobulinleri kullanan ek bir engelleme adımı da dahil ettik. Bu tekniğin en büyük dezavantajı, birden fazla kuluçka adımı gerektirdiği için zaman alıcı olmasıdır. Araştırmacılar, ikinci immünetiketleme adımında ya birincil antikorları dışlayan iki farklı kontrol içermelidir. Tanımlanan NET yapıların özgüllüğü DNase sindirimi veya CATE'siz kedilerden kaynaklanan aort çatallamalarından oluşan biyolojik kontrollerin dahil edilmesi ile daha da doğrulanabilir(Şekil 5). Buna ek olarak, nonspesifik antikor etkileşimleri, Fc reseptörlerine nonspesifik bağlanma ve hücresel otofloresans imal etmek için birincil antikorlarla aynı isotip kontrol antikorları konsantrasyonundan oluşan negatif kontroller de eklenmelidir. Müfettişlerin bu protokolü türe özgü antikorların mevcudiyetine göre değiştirmeleri tavsiye edilir. Türe özgü antikor yoksa, öncelikle immünositokimya kullanarak antikorların immünoreaktivitesini değerlendirmenizi veya homoloji için ilgi türünden referans lı transkriptlere kadar olan protein transkriptini değerlendirmenizi tavsiye ederiz.
Örnek fiksasyonu, yetersiz deparafinizasyon ve spesifik doku bileşenlerinin varlığı gibi faktörler trombüsde otofloresansa yol açabilir. Aldehit fiksasyonu sırasında aminler, floresan22'yiyayan Schiff baz komplekslerini oluşturmak için aldehitlerle birleşebilir. Eksik deparafinizasyon da kimyasal dokudaki proteinleri değiştirebilir, otofloresan23oluşturarak. Kollajen, elastin ve kırmızı kan hücreleri gibi vasküler örneklerde ekstrasellüler bileşenler memelilerde doğal floresan bildirilmiştir24,25. Doğal veya iyatrojenik otofloresans en çok yeşil dalga boylarında (uyarma = 488 nm, emisyon = 500-550 nm) fark edilir olduğundan, uzak kırmızı floresanların kullanımı bazı otofloresans26'yıen aza indirebilir 26 . Bu protokolde, elektrostatik olarak otofloresan doku elementlerine bağlanması için tasarlanmış, ticari olarak kullanılabilen otofloresan söndürme kitini kullandık. Üreticilerin 5 dk'lık tavsiyesi daha az bol proteinin immünoreaktivitesini azaltabileceğinden, araştırmacıların otofloresan söndürme süresini optimize etmesini öneririz. Alternatif olarak, araştırmacılar da Sudan Siyah B, 3,3'-diaminobenzidin veya trypan mavi27kullanarak otofloresan sönümleyebilirsiniz.
NET'ler heterojen bir trombüs içinde dağıtıldığı için, tüm aort ve iliak arterlerin ayrıntılı bir haritalaması önerilir. CfDNA, citH3 ve NE için pozitif bölgeler daha sonra büyütülür. CFDNA, citH3 ve NE'nin kolokalizasyonu NET oluşumunu tanımlamak ve NET oluşumunu diğer hücre ölüm şekillerinden ayırt etmek için yaygın olarak kullanılmıştır. NETs koroner trombofçevresinde konsantre bulundu yeni bir insan çalışmanın aksine, kedi arteriyel trombosit NETs çoğu pıhtı28kranial açıdan kümelenmiş edildi . NET'leri tanımlamak için standart laştırılmış bir protokol kullanmamıza rağmen, NET'lerin mikroskobik değerlendirilmesi ve nicelleştirilmesi subjektif olmaya devam etmektedir. Burada mikroskobik analiz sırasında gözlemci önyargısını en aza indirmek için kör ve sistematik bir yöntem kullandık. Bir örnekteki NÖTROFIL sayısı nötrofil sayısından etkilenebildiği için, araştırmacılar nötrofil lerin sayısına göre nötrofilsayısını nükleer morfolojiye, hücre çapına ve nötrofillere özgü proteinlerin ekspresyonuna göre ölçebilirler. Mikroskopi ile NET tanımlamanın bir diğer zorluğu da NET'lerin kötü tanımlanmış marjlara sahip olmaları ve birleşerek nebüllöz yapılar oluşturma eğiliminde olmalarıdır. Bu, herhangi bir örnekteki NET sayısının altında veya aşırı tahminine yol açabilir. Bu nedenle, DAPI yerine, NETs net tanımlama ve NETs oluşumundan hücre ekdna denotation için Sytox Green kullanılarak boyanabilir.
Parafin gömülü kedi arteriyel trombositindeki NET'leri tanımlamak için çift immünetiketleme protokolü geliştirdik. Deparafinizasyon, rehidrasyon ve antijen alımı citH3 ve NE immünetiketlemeönce yapılmalıdır. Bu töz kedilerde NET oluşumu nun incelenmesi için değerli bir araç olabilir ve kedilerde CATE patofizyolojisi daha iyi anlaşılmasını sağlar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Çalışma, Kaliforniya Üniversitesi, Davis, Companion Animal Health Merkezi 'nden (CCAH 2018-30-F) gelen fonlar tarafından desteklendi. Yazarlar floresan mikroskobun kullanımı için Dr Kevin Woolard kabul etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4,6-Diamidino-2-phenylin (DAPI) | Life Technologies Corporation | D1306 | |
| Alexa Fluor 594 Streptavidin conjugate | ThermoFisher Scientific | Catalog # S11227 | |
| Anti-citrullinated histone H3 antibody | Abcam | Ab5103 | |
| EVOS FL Cell Imaging System | ThermoFisher Scientific | AMEFC4300 | |
| EVOS Imaging System Objective 10x | ThermoFisher Scientific | AMEP4681 | NA 0.25, WD 6.9/7.45 mm |
| EVOS Imaging System Objective 20x | ThermoFisher Scientific | AMEP4682 | NA 0.40, WD 6.8 mm |
| EVOS Imaging System Objective 40x | ThermoFisher Scientific | AMEP4699 | NA 0.75, WD 0.72 mm |
| Goat anti-rabbit Alexa Fluor 488 antibody | ThermoFisher Scientific | Catalog # A32723 | |
| Goat serum | Jackson Immuno Research Labs | Catalog # NC9660079. Manufacturer Part # 005-000-121 | |
| Neutrophil elastase antibody | Bioss Antibodies | Bs-6982R-Biotin | Rabbit polyclonal Antibody, Biotin conjugated |
| NP40 | Pierce | Product # 28324. Lot # EJ64292 | |
| Positive charged microscope slides | Thomas Scientific | Manufacturer No. 1354W-72 | |
| Rabbit serum | Life Technology | Catalog # 10510 | |
| Target Retrieval Solution | Agilent Dako | S2367 | TRIS/EDTA, pH 9 (10x) |
| TrueVIEW Autofluorescence Quenching Kit | Vector Laboratories | SP-8400 |
Referanslar
- Maron, B. J., Fox, P. R. Hypertrophic cardiomyopathy in man and cats. Journal of Veterinary Cardiology: The Official Journal of the European Society of Veterinary Cardiology. 17, 6-9 (2015).
- Payne, J. R., et al. Prognostic indicators in cats with hypertrophic cardiomyopathy. Journal of Veterinary Internal Medicine. 27 (6), 1427-1436 (2013).
- Borgeat, K., Wright, J., Garrod, O., Payne, J. R., Fuentes, V. L. Arterial Thromboembolism in 250 Cats in General Practice: 2004-2012. Journal of Veterinary Internal Medicine. 28 (1), 102-108 (2014).
- Brinkmann, V., Zychlinsky, A. Beneficial suicide: why neutrophils die to make NETs. Nature Reviews. Microbiology. 5 (8), 577-582 (2007).
- Goggs, R., Jeffery, U., LeVine, D. N., Li, R. H. L. Neutrophil-extracellular traps, cell-free DNA and immunothrombosis in companion animals: A review. Veterinary Pathology. , 300985819861721 (2019).
- de Boer, O. J., Li, X., Goebel, H., van der Wal, A. C. Nuclear smears observed in H & E-stained thrombus sections are neutrophil extracellular traps. Journal of Clinical Pathology. 69 (2), 181-182 (2016).
- Li, R., Tablin, F. A Comparative Review of Neutrophil Extracellular Traps in Sepsis. Frontiers in Veterinary Sciences. 5 (291), (2018).
- Borissoff, J. I., et al. Elevated levels of circulating DNA and chromatin are independently associated with severe coronary atherosclerosis and a prothrombotic state. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (8), 2032-2040 (2013).
- Moschonas, I. C., Tselepis, A. D. The pathway of neutrophil extracellular traps towards atherosclerosis and thrombosis. Atherosclerosis. 288, 9-16 (2019).
- Perdomo, J., et al. Neutrophil activation and NETosis are the major drivers of thrombosis in heparin-induced thrombocytopenia. Nature Communications. 10 (1), 1322 (2019).
- Li, B., et al. Neutrophil extracellular traps enhance procoagulant activity in patients with oral squamous cell carcinoma. Journal of Cancer Research and Clinical Oncology. 145 (7), 1695-1707 (2019).
- Li, R. H. L., Tablin, F. In Vitro Canine Neutrophil Extracellular Trap Formation: Dynamic and Quantitative Analysis by Fluorescence Microscopy. Journal of Visualized Experiments. (138), e58083 (2018).
- de Boer, O. J., Li, X., Goebel, H., van der Wal, A. C. Nuclear smears observed in H&E-stained thrombus sections are neutrophil extracellular traps. Journal of Clinical Pathology. 69 (2), 181-182 (2016).
- Farkas, &. #. 1. 9. 3. ;. Z., et al. Neutrophil extracellular traps in thrombi retrieved during interventional treatment of ischemic arterial diseases. Thrombosis Research. 175, 46-52 (2019).
- Qi, H., Yang, S., Zhang, L. Neutrophil Extracellular Traps and Endothelial Dysfunction in Atherosclerosis and Thrombosis. Frontiers in Immunology. 8, 928 (2017).
- Laridan, E., et al. Neutrophil extracellular traps in ischemic stroke thrombi. Annals of Neurology. 82 (2), 223-232 (2017).
- Laridan, E., Martinod, K., Meyer, S. F. D. Neutrophil Extracellular Traps in Arterial and Venous Thrombosis. Seminars in Thrombosis and Hemostasis. 45 (1), 86-93 (2019).
- Li, R. H. L., Johnson, L. R., Kohen, C., Tablin, F. A novel approach to identifying and quantifying neutrophil extracellular trap formation in septic dogs using immunofluorescence microscopy. BMC Veterinary Research. 14 (1), 210 (2018).
- Brinkmann, V., Abu Abed, U., Goosmann, C., Zychlinsky, A. Immunodetection of NETs in Paraffin-Embedded Tissue. Frontiers in Immunology. 7, 513 (2016).
- Moelans, C. B., Oostenrijk, D., Moons, M. J., van Diest, P. J. Formaldehyde substitute fixatives: effects on nucleic acid preservation. Journal of Clinical Pathology. 64 (11), 960-967 (2011).
- Rait, V. K., Xu, L., O'Leary, T. J., Mason, J. T. Modeling formalin fixation and antigen retrieval with bovine pancreatic RNase A II. Interrelationship of cross-linking, immunoreactivity, and heat treatment. Laboratory Investigation: A Journal of Technical Methods and Pathology. 84 (3), 300-306 (2004).
- Willingham, M. C. An alternative fixation-processing method for preembedding ultrastructural immunocytochemistry of cytoplasmic antigens: the GBS (glutaraldehyde-borohydride-saponin) procedure. The Journal of Histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 31 (6), 791-798 (1983).
- Davis, A. S., et al. Characterizing and Diminishing Autofluorescence in Formalin-fixed Paraffin-embedded Human Respiratory Tissue. The Journal of Histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 62 (6), 405-423 (2014).
- Banerjee, B., Miedema, B. E., Chandrasekhar, H. R. Role of basement membrane collagen and elastin in the autofluorescence spectra of the colon. Journal of Investigative Medicine: The Official Publication of the American Federation for Clinical Research. 47 (6), 326-332 (1999).
- Hirsch, R. E., Zukin, R. S., Nagel, R. L. Intrinsic fluorescence emission of intact oxy hemoglobins. Biochemical and Biophysical Research Communications. 93 (2), 432-439 (1980).
- Billinton, N., Knight, A. W. Seeing the wood through the trees: a review of techniques for distinguishing green fluorescent protein from endogenous autofluorescence. Analytical Biochemistry. 291 (2), 175-197 (2001).
- Mosiman, V. L., Patterson, B. K., Canterero, L., Goolsby, C. L. Reducing cellular autofluorescence in flow cytometry: an in-situ method. Cytometry. 30 (3), 151-156 (1997).
- Ducroux, C., et al. Thrombus Neutrophil Extracellular Traps Content Impair tPA-Induced Thrombolysis in Acute Ischemic Stroke. Stroke. 49 (3), 754-757 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır