Method Article
تحديد الفخاخ نيوتروفيل خارج الخلية في البارافين جزءا لا يتجزأ من الخيط الشرياني Thrombi باستخدام المجهر Immunofluorescence
In This Article
Summary
نحن نصف طريقة لتحديد الفخاخ خارج الخلية العدلات (NETs) في الفورمالديهايد ثابتة والبارافين جزءا لا يتجزأ من القلب القلب والقلب thrombi باستخدام استرجاع المستضد الناجم عن الحرارة وبروتوكول تسمية المناعة المزدوجة.
Abstract
الفخاخ خارج الخلية العدلة (NETs)، تتألف من الحمض النووي خالية من الخلايا (cfDNA) والبروتينات مثل الهستونات واللاستاز العدلات (NE)، يتم تحريرها من قبل العدلات استجابة لالتهاب الجهازية أو مسببات الأمراض. على الرغم من أن NETs قد ثبت سابقا لزيادة تكوين الجلطة وتثبيط الانف في البشر والكلاب، ودور NETs في القطط مع تجلط الشرايين القلب (CATE)، وهي مضاعفات تهدد الحياة الثانوية لاعتلال عضلة القلب فرط التروب ، غير معروف. طريقة موحدة لتحديد وقياس NETs في تجلط الشرايين القلب في القطط سوف تعزز فهمنا لدورها المرضي في CATE. هنا ، نصف تقنية لتحديد NETs في الفورمالديهايد ثابتة والبارافين جزءا لا يتجزأ من thrombi داخل بيثرة الأبهري ، المستخرجة أثناء النخر. بعد إزالة البارافينمع الزيلين، خضعت الأقسام الأبهرية لاسترجاع مستضد غير مباشر بسبب الحرارة. ثم تم حظر الأقسام ، permeabilized ، وex vivo NETs تم تحديدها عن طريق توطين الحمض النووي الخالي من الخلايا (cfDNA) ، citrullinated histone H3 (citH3) ، وelastase العدلات (NE) باستخدام المجهر المناعي. لتحسين الكشف المناعي للNETs في thrombi ، تم الحد من الفلور اتمنامن عناصر الأنسجة باستخدام عملية إخماد الفلور الذاتي قبل المجهر. يمكن أن تكون هذه التقنية أداة مفيدة لدراسة NETs وتجلط الدم في الأنواع الأخرى وتقدم رؤى جديدة في الفيزيولوجيا المرضية لهذه الحالة المعقدة.
Introduction
القطط مع اعتلال عضلة القلب الضخامي هي في خطر من مضاعفات تجلط الدم المهددة للحياة1,2. على الرغم من ارتفاع معدلات الاعتلال والوفيات المرتبطة بتجلط الشرايين القلبوية (CATE) ، فإن الفيزيولوجيا المرضية الكامنة في CATE في القطط غير مفهومة بشكل جيد. وهناك أيضا محدودة أدوات التشخيص والعلاج لعلاج وتحديد القطط المعرضة لخطر هذه الحالة المدمرة3.
بالإضافة إلى دورها في الحصانة الفطرية، وقد ثبت العدلات للعب دور في تجلط الدم من خلال الإفراج عن الفخاخ خارج الخلية العدلة (NETs)، والتي هي شبكات تشبه على شبكة الإنترنت من الحمض النووي خالية من الخلايا (cfDNA) مرصعة الهستون والبروتينات الحبيبية مثل العدلات الإيلاداس (NE) وmyeloperoxidase. العدلات الخضوع لتكوين NETs استجابة لالتهاب الجهازية، ومواجهة مباشرة مع مسببات الأمراض، والتفاعل معالصفائحالدموية المنشط4،,5،,6،,7. في الكلاب ، وقد ثبت الحمض النووي المستمدة من العدلات لمنع تجلط الجلطات ، في حين أن البروتينات NET تسريع تشكيل الجلطة. قدرة NETs على اعتراض الخلايا المتداولة ومكونات التخثر هو أيضا مفتاح لخصائصها تخثر8،9،10،11،12.
يتم الكشف عن NETs عن طريق توطين البروتينات العدلات خارج الخلية، الهستونات، وcfDNA. وبسبب هذا، فإن تحديد وقياس NETs في الأنسجة الثابتة عن طريق immunofluescence من الأنسجة deparaffinized متفوقة على الهيماتوكسيلين التقليدية والإيوسين (H & E) وصمة عار باستخدام المجهر حقل مشرق4،5. حددت العديد من الدراسات البشرية باستخدام المجهر المناعي NETsك المكونات الهيكلية للتجلط الشرياني التاجي، السكتة الدماغية الدماغية، التروثرومبوسيس، وتجلط الرثرة الوريدية13،14،15،16،17. وحتى الآن، لم يتم وصف طريقة موحدة للكشف عن الـ NETs وقياسها كمياً في ثثرم القطط. لأن تحديد NETs في تجلط الشرايين القلب والقلب القطط قد يسهل البحوث الانتقالية في المستقبل في NETs والتجلط، ونحن وصف تقنيات تحديد صافي وتقييم في تجلط الشرايين جزءا لا يتجزأ من البارافين في القطط.
Protocol
تم تنفيذ جميع الأساليب الموصوفة هنا وفقًا للمبادئ التوجيهية للجنة الرعاية والاستخدام المؤسسية للحيوانات في جامعة كاليفورنيا، ديفيس. وأجريت النُقاز وخزعات الأنسجة بموافقة المالكين.
1. تثبيت الأنسجة، والتضمين، وأقسام
- تشريح التشعب الأبهري ، بما في ذلك الشريان الأورطي التنازلي ، الشريان الفخذي ، والشرايين الحرقفية الشائعة(الشكل 1A)، بعد وقت قصير من القتل الرحيم أو الموت الإنساني. بصراحة تشريح اللفافة(الشكل 1B)قبل غمره تماما في 10٪ محايدة عازلة الرسمية لمدة لا تقل عن 24 ساعة وليس أكثر من 48 ساعة.
- لتجفيف العينة، الغمر أولاً في 10% محايد ة المخزنة احتياطيا formalin ساخنة إلى 37 درجة مئوية لمدة 1 ساعة. ثم، غمر في تركيزات متزايدة من الإيثانول ساخنة إلى 37 درجة مئوية (70٪، 95٪، 100٪) 2x ل1 ساعة لكل منهما. وأخيرا، دون الرص، غمر 2x في 100٪ تولوين ساخنة إلى 37 درجة مئوية لمدة 1 ساعة لكل منهما.
- إضافة البارافين ساخنة إلى 62 درجة مئوية والسماح للبارافين لترسيخ تماما بين عشية وضحاها.
- القسم 2-3 ميكرومتر من الأنسجة المضمنة بالبارافين باستخدام ميكروتوم ووضعها على شرائح زجاجية مشحونة بشكل إيجابي. تخزين الأنسجة المقطعة في -80 درجة مئوية حتى مزيد من التحليل.
2. Deparaffinization، الإماهة، واسترجاع المستضد الناجم عن الحرارة
- لإجراء إزالة البارافينة والإماهة من المقاطع على الشرائح الزجاجية، ضع الشرائح الزجاجية في الرفوف وعملية بالترتيب التالي:
- غمر تماما في 100٪ xylene لمدة 3 دقيقة. كرر هذه الخطوة 2x. لا تشطف بين الخطوات.
- الغمر بالكامل في تركيزات تناقص الإيثانول (100٪، 95٪، 70٪) في درجة حرارة الغرفة (RT)، 3x لمدة 3 دقيقة لكل منهما. لا تشطف بين الخطوات.
- غمر تماما في المياه اللامؤنة لمدة 2 دقيقة. كرر.
- ضع المقاطع في خط اللاين المخزن مؤقتًا مع 0.1٪ Tween (TBST، pH = 7.6) لمدة 2-3 دقيقة.
- ملء الخزان مع المياه المنزوعة الأيونات ساخنة إلى 100 درجة مئوية. السماح لغرفة الباخرة للتوازن لمدة 20 دقيقة.
ملاحظة: يتم تنفيذ استرجاع المستضد الناجم عن الحرارة بشكل أفضل مع التدفئة غير المباشرة التي يتم إنشاؤها بواسطة باخرة مع إعداد درجة حرارة محددة مسبقًا، مثل باخرة الطعام. - سخني محلول استرجاع المستضد المتاح تجاريًا الذي يحتوي على Tris و EDTA (درجة الحموضة = 9) إلى 95-97 درجة مئوية على لوحة ساخنة يتم التحكم فيها درجة الحرارة مع التحريك المستمر. تأكد من أنه لا يغلي.
ملاحظة: يجب أن يتحول الحل غائمًا بمجرد تسخينه. - صب محلول استرجاع المستضد ساخنة في حاوية الشريحة ووضع الحاوية في غرفة الباخرة. السماح لمحلول استرجاع المستضد بالاعتدال في درجة حرارة الباخرة لمدة 3-4 دقيقة. تأكد من أن درجة حرارة الغرفة هي ~ 95 درجة مئوية.
- غمر الشرائح تماما في حل استرجاع مستضد ساخنة ومواصلة تطبيق التدفئة الخارجية عبر باخرة لمدة 20 دقيقة.
- قم بإزالة حاوية الشريحة من الباخرة واسمح للشرائح وحل استرداد المستضد بالتبريد إلى RT. احفظ محلول استرداد المستضد المخفف عند درجة حرارة 4 درجة مئوية وإعادة الاستخدام حتى 2x إذا لزم الأمر.
- اغسل الشرائح 3x مع TBST لمدة 5 دقيقة.
3. المناعة وإخماد الفلورات
ملاحظة: الجدول 1 تفاصيل تكوين المخازن المؤقتة حظر المستخدمة في الخطوات التالية.
- أقسام الاحتضان في حظر المخزن المؤقت 1 لمدة 2 ساعة في RT تحت هزاز لطيف (30-50 دورة في الدقيقة). ختم مع فيلم البارافين لتجنب التجفيف.
- دون غسل، وتطبيق على الفور 100 ميكرولتر من الأرانب المخففة المضادة للجلد الإنسان يسيلون H3 (citH3) الأجسام المضادة (0.03 ملغ / مل المخفف في منع العازلة 1) مباشرة على الشريحة.
- ضع قسيمة غطاء (24 مم × 40 مم × 0.13-0.17 مم) على كل قسم للسماح بالتوزيع المتساوى لخليط الأجسام المضادة.
- احتضان لمدة 12-16 ساعة في 4 درجات مئوية مع هزاز لطيف (30-50 دورة في الدقيقة). ختم مع فيلم parafilm لتجنب التجفيف.
- اغسل 3x مع TBST لمدة 5 دقيقة.
- تطبيق 100 ميكرولتر من الماعز المضادة للأرنب الأجسام المضادة الاقتران إلى اليكسا فلور 488 (المخفف إلى تركيز النهائي من 0.04 ملغ / مل أو 1:50 في حظر المخزن المؤقت 1) كما هو موضح في الخطوة 3.3. احتضان لمدة 1 ساعة في RT تحت هزاز لطيف (30-50 دورة في الدقيقة). حماية الشرائح من الضوء.
- يغسل مع TBST 3x لمدة 5 دقيقة.
- أقسام الاحتضان في حظر المخزن المؤقت 2 بين عشية وضحاها في 4 درجة مئوية تحت هزاز لطيف (30-50 دورة في الدقيقة). حماية من الضوء.
- يغسل مع TBST 3x لمدة 5 دقيقة.
- كتلة المقاطع في حظر المخزن المؤقت 3 كما هو موضح في الخطوة 3.3 في RT لمدة 2 ساعة تحت هزاز لطيف (30-50 دورة في الدقيقة).
- أقسام الاحتضان مع الأرانب متعددة النسيلة الحيوية المضادة للإنسان NE الأجسام المضادة (التركيز النهائي = 0.2 ميكروغرام / مل في حظر المخزن المؤقت 3) في 4 درجة مئوية لمدة 12-16 ساعة كما هو موضح في الخطوات 3.2-3.4.
- يغسل مع TBST 3x لمدة 5 دقيقة.
- احتضان مع اليكسا فلور 594 streptavidin الاقتران (تمييع إلى 1:100 أو 0.02 ملغ / مل في حظر المخزن المؤقت 3) كما هو موضح في الخطوات 3.2-3.3 لمدة 1 ساعة في RT. حماية من الضوء وختم مع البارافين لمنع التجفيف.
- يغسل مع TBST 1x لمدة 5 دقيقة.
- تطبيق 100 ميكرولتر من خليط محلول إخماد الفلور الفلور اتوئاك مباشرة على الأقسام لمدة 1 دقيقة وفقا لتعليمات من قبل الشركة المصنعة.
- غسل الشرائح على الفور مع TBST 6x لمدة 10 دقيقة.
- تغطية كل شريحة مع 100 ميكرولتر من 300 nM DAPI لمدة 5 دقيقة في الظلام.
- يغسل مع TBST لمدة 3 دقيقة. كرر هذا لما مجموعه 5x.
- تطبيق قطرة (~ 50 ميكرولتر) من antifade تصاعد المتوسطة، وهي جزء من طقم إخماد autofluorescence، مباشرة على الشريحة الزجاجية المحيطة القسم. ضع قسيمة تغطية (24 مم × 40 مم × 0.13-0.17 مم) برفق على القسم دون إنشاء أي فقاعات.
- السماح للعينات لعلاج بين عشية وضحاها في الظلام في 4 درجة مئوية حتى تصلب المتوسطة المتصاعدة للتحليل المجهري مع عدسات الغمر.
4. نيوتروفيل خارج الخلية فخ تحديد
ملاحظة: يستخدم البروتوكول التالي مجهر ًا مقلوبًا للكشف عن الفلوروسينية مع كاميرا CCD رقمية 1,280 × 960 (انظر جدول المواد).
- لتحديد موقع thrombi، مسح بشكل مؤقت لcaudally على طول الشريان الأورطي، التشعب الأبهري، وكل شريان الفخذ باستخدام المجهر على النقيض المرحلة مع هدف 10x. الجلطة هي تكتل الأنسجة التي تحتوي على خلايا الدم الحمراء وخلايا الدم البيضاء والصفائح الدموية المجاورة للبطانة على تباين المرحلة والمجهر الميداني الساطع(الشكل 2A، الشكل 2B).
- أولا فحص أقسام لNETs باستخدام قناة DAPI (الإثارة = 357/44 نانومتر) مع 10x و 20x الأهداف(الشكل 2C). لاحظ أن cfDNA يظهر كالحمض النووي المجرد الذي ليس ضمن حدود السيتوبلازم من خلية عندما ينظر إليها على النقيض من المرحلة أو المجهر الميداني مشرق.
- تحديد NE خارج الخلية وcitH3 على قنوات تكساس الحمراء (الإثارة = 585/29 نانومتر، والانبعاثات = 628/32 نانومتر) وقناة البروتين الفلوري الأخضر (الإثارة = 470/22 نانومتر، الانبعاثات = 525/50 نانومتر)، على التوالي مع أهداف 10 و 20 و 40x.
- تقييم وتحليل NETs داخل thrombus باستخدام البرامج المتاحة، مثل صورة J (المعاهد القومية للصحة). يتم تحديد تشكيل NET استنادًا إلى التوطين المشترك لـ cfDNA و citH3 خارج الخلية وNE كما سبق وصفه18. الحفاظ على وقت التعرض متسقة والمكاسب من كل قناة في جميع أنحاء اقتناء الصور لتجنب التشبع في كثافة بكسل.
- قم بتعيين كل خثارة استنادًا إلى قربها من الأبهر التنازلي عن طريق تقسيمها إلى ثلاث مناطق متساوية ، مع المنطقة 1 الأقرب إلى الأبهر ، والمنطقة 3 الأبعد من الأبهر ، والمنطقة 2 بين المنطقتين 1 و 3). مع المشغل أعمى عن الحالة الطبية لكل موضوع، واتخاذ ما لا يقل عن عشرة حقول عشوائية في كل منطقة. توصيف توزيع المؤشرات الجديدة في thrombi عن طريق متوسط أعداد الحقول مع NETs في كل منطقة أو حساب متوسط صافي منطقة احتلال لكل منطقة.
النتائج
باستخدام هذا البروتوكول لdeparaffinization، استرجاع المستضد الناجم عن الحرارة، وتسمية المناعة المزدوجة من thrombi البارافين المضمنة، حددنا NETs في FELINE CATE للمرة الأولى. تم تحديد موقع Thrombi داخل التشعب الأبهري عن طريق المجهر الفلوري والمجهر الميداني الساطع باستخدام تلطيخ H & E القياسي والمجهر التباين في المرحلة. على المجهر حقل مشرق، وتجلط الشرايين القطط تتكون من خلايا الدم الحمراء، الكريات البيض، الفيبرين، والصفائح الدموية(الشكل 3A). على الرغم من أن H & E لا يمكن وصمة عار مكونات NET محددة، ظهرت NETs في كثير من الأحيان كشبكات من الخيوط الأرجواني العميق من أطوال مختلفة المحيطة كريات الدم الحمراء القريبة والكريات البيض(الشكل 3A،مخطط منقط). تم وصف الجلطة بأنها بنية مرسومة بشكل جيد داخل الفضاء الوعائي على المجهر على تباين المرحلة(الشكل 2A، الشكل 4B). وأكدنا كذلك وجود NETs داخل هذه المناطق عن طريق المجهر المناعي الفلورسينس(الشكل 3B). كشف التكبير من هذه المناطق مجاميع كبيرة من NETs، تتألف من cfDNA، citH3 خارج الخلية، وNE(الشكل 2C، الشكل 3B،مخطط أبيض منقط). باستخدام نفس التقنية للبحث عن thrombi وNETs في القطط دون CATE ، وجدنا أن أوراق العدلات lyzed يمكن الكشف عنها في بعض الأحيان على مقربة من البطانة. على الرغم من أن هذه العدلات أظهرت بعض الخصائص المورفولوجية لتشكيل NET ، إلا أنه لا ينبغي ربطها بأي خثرة منظمة. لم نحدد أي تجلط في أي من عينات التحكم(الشكل 4A).
يوضح الشكل 5A الفلور العميق لعناصر الجلطة مثل كريات الدم الحمراء والكولاجين عند التصوير على الطول الموجي الأخضر (488 نانومتر) ، مما أعاق قدرتنا على اكتشاف cfDNA وتوطين البروتين. وجدنا أن التنورات الذاتية القصيرة باستخدام مجموعة متاحة تجاريًا بعد وضع العلامات المناعية زادت بشكل كبير من حساسية توطين البروتين واكتشاف NET ، حتى في المناطق التي تحتوي على وفرة من كريات الدم الحمراء(الشكل 5B، رؤوس الأسهم).
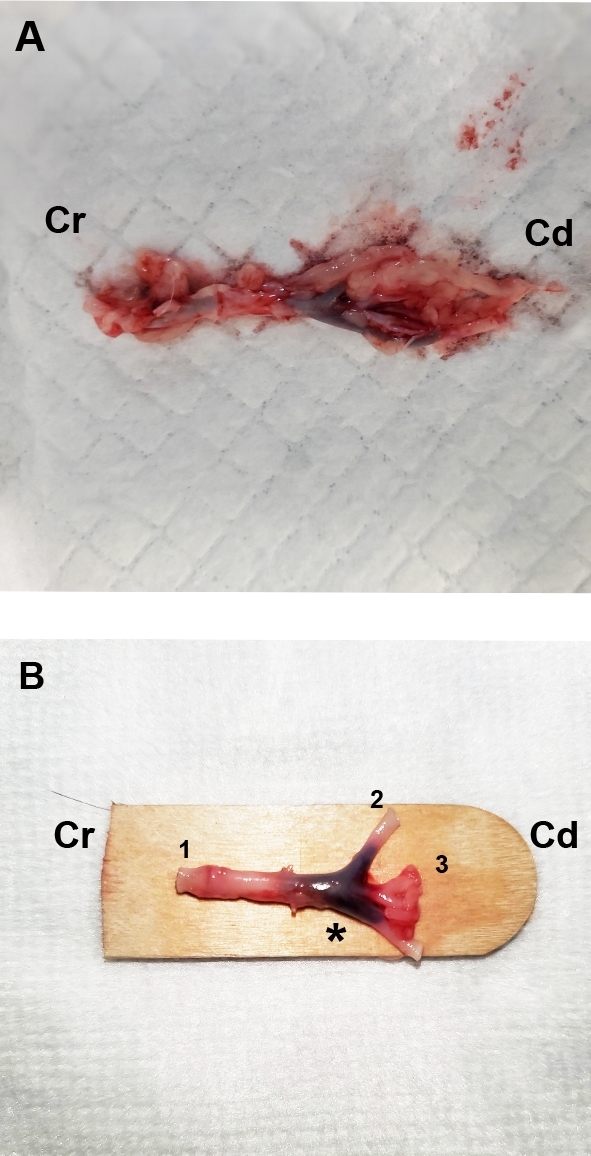
الشكل 1: صور تمثيلية تُشبّل لتشعب أورطي مشرّح من قطة تعاني من تجلط الشرايين القلبية. (أ)تم تشريح الأبهر النازل 4-5 سم الجمجمة (Cr) إلى التشعب الأبهري. (ب)تم تشريح اللفافة بعناية حتى الشريان الأورطا التنازلي (1) والشرايين الحرقفية (2،3) كانت واضحة للعيان في الجانب caudal (Cd). لاحظ الجلطة داخل التشعب الأبهري (*). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
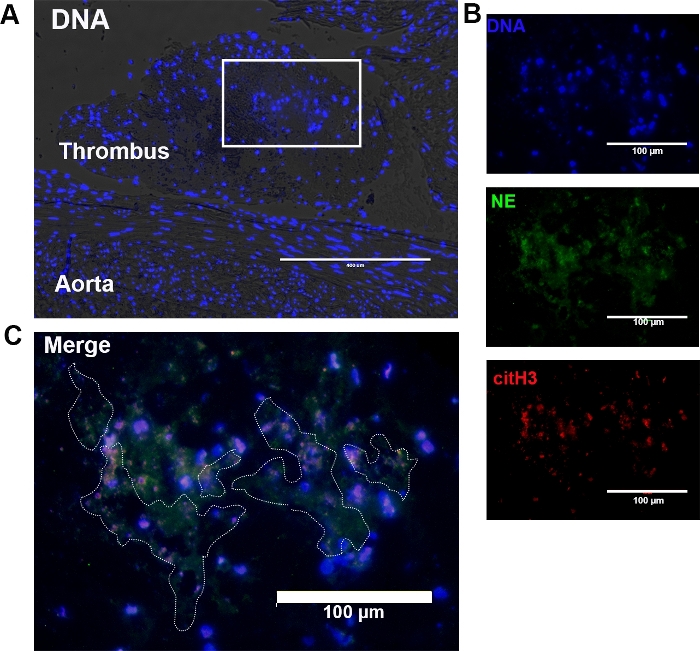
الشكل 2: تباين المرحلة التمثيلية وصور الفلور المناعي لـ NETs في ثثرة موجودة داخل تشعب الأبهر القططي. (أ)كشفت التنظير المجهري للمرحلة عن تجلط كبنية منفصلة ومرسومة بشكل جيد بالقرب من الأبهر. أظهر تباين المرحلة المشتركة وتلطيخ الفلورسيز للحمض النووي (الأزرق) وجود كريات الدم البيضاء والحمض النووي الخالي من الخلايا داخل الخثرة. تتكون المنطقة المحاصرة من تركيز كبير من الحمض النووي الخالي من الخلايا. الأصلي 10x التكبير؛ شريط مقياس = 400 ميكرومتر . (ب) تم زيادة تضخيم المنطقة محاصر في (A) في 20x. الحمض النووي الخالي من الخلايا والحمض النووي داخل الخلايا الملطخة DAPI (الأزرق) ، العدلات اللاستاز (NE) ، وhistrullinated H3 (citH3) ظهرت خضراء وحمراء ، على التوالي. (الأصل 20x التكبير؛ شريط المقياس = 100 ميكرومتر). (C)تم تحديد NETs ، التي تم تحديدها على أساس توطين الحمض النووي الخالي من الخلايا ، NE خارج الخلية ، وcitH3 ، (خط منقط). الأصلي 40x التكبير؛ شريط مقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
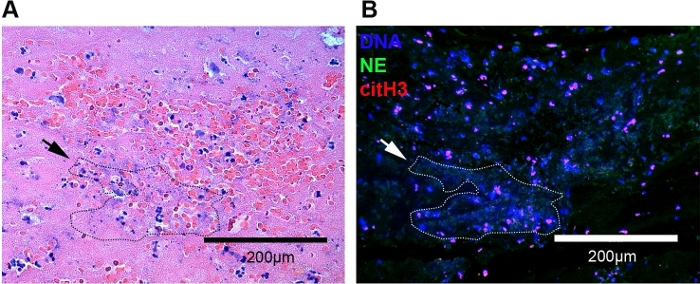
الشكل 3: صورة تمثيلية لخثرة شريانية في القطط باستخدام H & E وتلطيخ الفلور المناعي. (أ)على وصمة عار H & E، كان تركيز كبير من العدلات والكريات الحمراء مرئية. ظهرت الكروماتين خارج الخلية كخيوط أرجوانية عميقة من أطوال مختلفة محاطة بكريات الدم الحمراء والعدلات (مخطط منقط ، سهم أسود). (ب)تم تصور الفخاخ خارج الخلية نيوتروفيل بسهولة باستخدام المجهر المناعي على نفس thrombus (مخطط منقط، السهم الأبيض). تم تحديد NETs كتوطين مشترك لـ cfDNA (الأزرق) وNE (الأخضر) وcitH3 (الأحمر). الأصلي 20x التكبير؛ شريط مقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تباين المرحلة التمثيلية وصور الفلور المناعي للتشعبات الأبهرية. (أ)تباين المرحلة وصور الفلور المناعي ة للتشعبات الأبهرية في قطة بدون تجلط الشرايين. لاحظ عدم وجود تجلط أو مجاميع العدلات داخل تجويف التشعب الأبهري من القط دون تجلط الشرايين. (ب)تباين المرحلة وصور الفلور المناعة من التشعب اتّصال الأبهر يُشخَّص مع الجلطات الشريانية القلبية. كانت التشعبات الأبهرية ملطخة بالحمض النووي (الأزرق) ، وإلاستاز العدلات (الأخضر) ، والهيستون H3 (الأحمر). في هذه الحالة ، لوحظ تجلط مُنسَّد جيدًا في جدار الأوعية الدموية ويحتل معظم التجويف الأبهري في القط ة مع تجلط الشرايين القلبية. تم تحديد NETs ، التي تتميز بتوطين مشترك من cfDNA و NE و citH3 ، داخل الجلطة (مخطط منقط). الأصلي 10x التكبير؛ شريط مقياس = 400 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
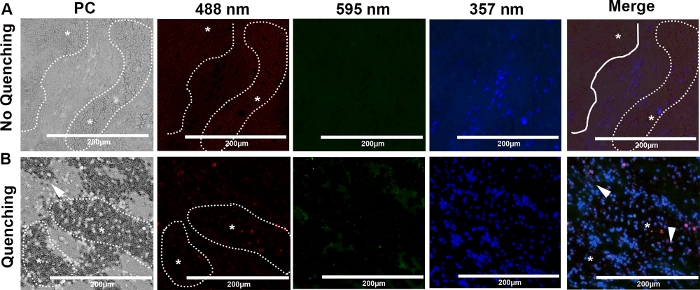
الشكل 5: تباين المرحلة التمثيلية (PC) وصور الفلور المناعة لتجلط الشرايين من قطتين. كانت الشرائح ملطخة بالطول الموجي citH3 و NE و DNA وصورتها بسرعة 488 نانومتر (أحمر) و595 نانومتر (أخضر) و357 نانومتر (أزرق) على التوالي عند التكبير 40x. كان تجلط الشرايين القلبية في القطط وفرة من كريات الدم الحمراء (* ، خط منقط). (أ)كان الفلور الفلورسنيس من كريات الدم الحمراء أبرز ها على طول الموجة 488 نانومتر، مما قلل من الكشف عن إشارة التوطين المشترك وتحديد الخلايا القريبة من الأرض. (ب)إخماد انخفاض كبير في الفلور الفلورية في الطول الموجي 488 نانومتر، وخاصة في المناطق مع تركيز عال من كريات الدم الحمراء (*، خط منقط). وعززت الكشف عن البروتينات المترجمة، citH3، والإيلاستي اتاستاز العدلات (رأس السهم)، في وجود كريات الدم الحمراء (شريط مقياس = 200 ميكرومتر). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
ملحق الشكل 1: صور الفلور المناعة التمثيلية من تجلط الشرايين من القط. كانت المقاطع ملطخة بالحمض النووي (الأزرق) أو citH3 (أحمر) أو السيلوبرسيداز(A)أو الإيلاستاز العدلات(B). (أ)على الرغم من استخدام الأجسام المضادة النخاعية الخاصة القطط (MPO, 1:5), ظلت كثافة تلطيخ MPO الفقراء. (ب)باستخدام جسم مضاد للإلاستاز العدلات متعدد الكلونات (NE) ، والمعروف أنه يتفاعل مع أنواع متعددة ، وكان النشاط المناعي وكثافة تلطيخ أعلى بكثير. لاحظ نواة فصوص مميزة من العدلات محاطة NE (السهام). الأصلي 40x التكبير؛ شريط مقياس = 100 ميكرومتر. يرجى الضغط هنا لتحميل هذا الرقم.
| حظر المخزن المؤقت | تكوين | |
| 1 | TBS مع 0.1٪ Tween-20، 0.1٪ NP40، 5٪ مصل الماعز | |
| 2 | TBS مع 0.1٪ Tween-20، 10٪ مصل أرنب، 0.1٪ NP-40 | |
| 3 | TBS مع 0.1٪ Tween-20، 5٪ BSA، 0.1٪ NP-40 | |
الجدول 1: تكوين المخازن المؤقتة المحظورة المستخدمة في الفلور المناعي.
Discussion
نحن نصف بروتوكول لتحديد NETs في خثرة الشرايين القلب ية الثابتة القطط باستخدام بروتوكول تسمية المناعة المزدوجة والمجهر الفلورات المناعية. على الرغم من أن فقط تجلط الشرايين القلبية كانت ملطخة، من الناحية النظرية يمكن استخدام هذا البروتوكول لأنواع أخرى من thrombi وفي الأنواع البيطرية الأخرى. يشير تحديد NETs داخل الجلقط الشرياني القططي إلى أن NETs قد تلعب دورًا في تجلط الدم في القطط.
الكشف عن NETs عن طريق الفلور المناعة في الأنسجة الثابتة والبارافين جزءا لا يتجزأ متفوقة على البقع النسيجية التقليدية مثل H & E، والذي غالبا ما يظهر خيوط الكروماتين محاطة العدلات13. الكيمياء المناعية والفلورات المناعية للتجلط الشرياني الثابت تسمح بالكشف المتزامن عن cfDNA والبروتينات الأخرى خارج الخلية مثل citH3 ، المعروف أن تكون محددة لتشكيل NETs18،19. نظرًا لأن مستحضرات التبريد دون المستوى الأمثل للكشف عن NET في الأنسجة والخثران، حافظنا على عيناتنا في الفورماين المحايد 10٪، والذي يحتوي على 4٪ الفورمالديهايد و الميثانول بنسبة 10٪. لا يتم إصلاح الأحماض النووية الخالية من الخلايا مباشرة من قبل الفورمالديهايد. بدلا من ذلك، يتم تجميدها داخل هياكل البروتين الثابتة، والتي يتم تغييرها من قبل وصلات جسر الميثيلين عكسها جزئيا الناجمة عن الفورمالديهايد20. ولزيادة الحد من القطع الأثرية والفلورات النفية الناجمة عن حمض الفورميك والكيتونات الناتجة عن أكسدة الفورمالديهايد، يمكن للمحققين اختيار استخدام بارامايدهايد الخالي من الميثانول المخفف في العازلة لتثبيتها. نظرًا لأن مدة التثبيت تؤثر على النشاط المناعي ، نوصي بالتثبيت لمدة لا تزيد عن 24 ساعة قبل الجفاف وتضمين البارافين. يمكن بعد ذلك تخزين الأنسجة أو الجلطات المدمجة بالبارافين للإزالة وتلطيخها.
التثبيت الكيميائي بواسطة الفورمالديهايد وبارافورمالديهايد يغير الهيكل الثالثي للبروتينات ، وإخفاء المستضدات ذات الاهتمام ومنع ربط الأجسام المضادة إلى epitopes محددة21. استرجاع المستضد ، وهي عملية تكسر الروابط المتقاطعة جسر الميثيلين ، أمر ضروري قبل إجراء الكشف المناعي في الأنسجة الرسمية الثابتة. استناداً إلى تجربة المؤلفين، استرجاع المستضد الناجم عن الحرارة باستخدام محلول استرجاع القلوية (درجة الحموضة = 9 في تريس / EDTA المخزن المؤقت) مع التدفئة غير المباشرة خفيفة يعزز الكشف عن البروتينات وNETs مع تقليل القطع الأثرية والفلور الفلور. يجب ألا تصل درجة حرارة محلول استرجاع المستضد إلى نقطة الغليان (أكثر من 100 درجة مئوية) ، لأن إزالة البروتينات يمكن أن تؤدي إلى ضوضاء غير محددة ملزمة وخلفية.
ومن القيود المفروضة على تحديد NET في الجلطات الثابتة أن تلطيخ الفلور المناعي يمكن أن يكون متغيرًا للغاية في ظل ظروف استرجاع مستضد مختلفة18. مقارنة بالنتائج التي عثر عليها برينكمان وآخرون، وجدنا أن ارتفاع درجات حرارة الحضانة (> 55 درجة مئوية) أدى إلى تلطيخ الأمثل للhistones في النوى والكروماتين المزيل للتكثيف19. ومع ذلك، وجدنا أن كثافة تلطيخ النقوي، وهو بروتين حبيبي موجود في العدلات وNETs، كانت منخفضة في ظل الظروف المقترحة. كان النشاط المناعي الضعيف للنقوي البيروروكسيديز ثابتًا على الرغم من استخدام جسم مضاد خاص بالقطط(ملحق الشكل 1). لذلك ، نشجع المحققين على تعديل مدة وشروط (على سبيل المثال ، درجة الحموضة ، درجة الحرارة) لعملية استرجاع المستضد للتوصل إلى إشارة مرضية استنادًا إلى مستضد الفائدة.
وأحد التحديات التي تواجه تحديد الأجسام القريبة من الأرض في الأنواع البيطرية هو الافتقار إلى الأجسام المضادة الخاصة بالأنواع. لمنع التداخل الذي واجهته عند استخدام الأجسام المضادة الأولية الناشئة من نفس النوع ، قمنا بتضمين خطوة حظر إضافية باستخدام تركيز عال من الغلوبولين المناعي للأرانب لتشبع أي مواقع ملزمة متبقية على الأجسام المضادة الثانوية المضادة للأرنب. ومن العيوب الرئيسية لهذه التقنية أنها تستغرق وقتا طويلا، لأنها تتطلب خطوات حضانة متعددة. يجب أن يتضمن المحققون اثنين من الضوابط المختلفة التي تستبعد أي من الأجسام المضادة الأولية في الخطوة الثانية لوضع العلامات المناعية لضمان أن الأجسام المضادة الثانوية من أي خطوة وضع العلامات المناعية يرتبط على وجه التحديد بجسمها المضاد الأساسي. يمكن التحقق من خصوصية هياكل NET المحددة من خلال هضم DNase أو إدراج الضوابط البيولوجية التي تتكون من التشعبات الأبهرية من القطط دون CATE(الشكل 5). بالإضافة إلى ذلك ، يجب تضمين الضوابط السلبية التي تتكون من نفس تركيز الأجسام المضادة للتحكم في النمط الايزوينوع مثل الأجسام المضادة الأولية لاستبعاد تفاعلات الأجسام المضادة غير المحددة ، والربط غير المحدد لمستقبلات Fc ، والفلور الخلوية. وينصح المحققون بتعديل هذا البروتوكول على أساس توافر الأجسام المضادة الخاصة بالأنواع. إذا لم تتوفر أجسام مضادة خاصة بالأنواع، فإننا ننصح أولاً بتقييم النشاط المناعي للأجسام المضادة باستخدام الكيمياء المناعية أو تقييم نسخة البروتين من الأنواع ذات الاهتمام للهومات إلى النصوص المشار إليها.
عوامل مثل تثبيت العينة، وعدم كفاية deparaffinization، ووجود مكونات أنسجة محددة يمكن أن يؤدي إلى الفلور الفلور في thrombi. أثناء تثبيت ألدهيد، قد تتحد الأمينات مع ألدهيدس لتشكيل مجمعات قاعدة شيف، والتي تنبعث منها الفلورسينس22. قد deparaffinization غير مكتملة أيضا تعديل كيميائيا البروتينات في الأنسجة، وخلق autofluorescence23. المكونات خارج الخلية في عينات الأوعية الدموية مثل الكولاجين والإيلاستين وخلايا الدم الحمراء يتم الإبلاغ عنها إلى الفلوربشكل طبيعي في الثدييات24،25. لأن الفلور الفلورات الطبيعية أو الأيطورية هو الأكثر وضوحا في الأطوال الموجية الخضراء (الإثارة = 488 نانومتر، الانبعاثات = 500-550 نانومتر)، واستخدام الفلوروفورين الحمراء البعيدة قد يقلل من بعض الفلور الفلورية26. في هذا البروتوكول، وأننا تستخدم المتاحة تجاريا autofluorescence تروي عدة مصممة لربط كهربائيا لعناصر الأنسجة الفلورية. نوصي المحققين بتحسين مدة إخماد الفلور اتمنفلورسينس، لأن توصية الشركة المصنعة من 5 دقيقة قد يقلل من النشاط المناعي للبروتينات أقل وفرة. بدلا من ذلك، يمكن للمحققين أيضا تخفيف الفلور اتباستخدام السودان الأسود B، 3،3'-diaminobenzidine أو trypan الأزرق27.
نظرًا لأن NETs موزعة بشكل غير متجانس داخل الجلطة ، يوصى برسم خرائط شاملة للالشريان الأورطا والشرايين الحرقفية بأكملها. ثم يتم تكبير المناطق الإيجابية لcfDNA و citH3 و NE. وقد استخدمت على نطاق واسع توطين مشترك من cfDNA، citH3، وNE لتحديد تشكيل NET وتمييز تشكيل NET من أشكال أخرى من موت الخلايا. على عكس دراسة بشرية حديثة وجدت أن NETs تتركز في محيط الجلطة التاجية ، تم تجميع معظم NETs في تجلط الشرايين القططية في الجانب القحفي للجلطة28. وعلى الرغم من أننا استخدمنا بروتوكولاً موحداً لتحديد المؤشرات القريبة من الأرض، فإن التقييم المجهري وتقدير الكميات للكائنات القريبة من الأرض لا يزال ذاتياً. هنا، استخدمنا طريقة عمياء ومنهجية لتقليل تحيز المراقبين أثناء التحليل المجهري. لأن عدد NETs في عينة يمكن أن تتأثر بعدد العدلات، يمكن للمحققين تحديد NETs بالنسبة لعدد العدلات من خلال تحديد العدلات على أساس مورفولوجيا نووية، وقطر الخلية، والتعبير عن البروتينات الخاصة بالعدلات. وثمة تحد آخر لتحديد صافي باستخدام المجهر هو أن المؤشرات الإلكترونية غير محددة جيدا وأنها تميل إلى الاندماج، وتشكيل هياكل غامضة. ويمكن أن يؤدي ذلك إلى التقليل من تقدير عدد الـ NETs في أي عينة معينة أو المبالغة فيه. لذلك ، بدلاً من DAPI ، يمكن تلطيخ NETs باستخدام Sytox Green لتحديد أوضح وتدوين الحمض النووي لـ cell-appendant من تكوين NETs.
لقد قمنا بتطوير بروتوكول تسمية مناعية مزدوجة لتحديد NETs في البارافين جزءا لا يتجزأ من الدم الشرياني القطط. يجب أن يحدث إزالة البارافينين والإماهة واسترجاع المستضد قبل وضع العلامات المناعية للcitH3 و NE. هذا القول يمكن أن يكون أداة قيمة لدراسة تشكيل NET في القطط وتوفير فهم أفضل للفيزيولوجيا المرضية من CATE في القطط.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
تم دعم الدراسة بأموال من جامعة كاليفورنيا، ديفيس، مركز الصحة الحيوانية المرافقة (CCAH 2018-30-F). يود المؤلفون أن ينوهوا بالدكتور كيفن وولارد لاستخدام المجهر الفلوري.
Materials
| Name | Company | Catalog Number | Comments |
| 4,6-Diamidino-2-phenylin (DAPI) | Life Technologies Corporation | D1306 | |
| Alexa Fluor 594 Streptavidin conjugate | ThermoFisher Scientific | Catalog # S11227 | |
| Anti-citrullinated histone H3 antibody | Abcam | Ab5103 | |
| EVOS FL Cell Imaging System | ThermoFisher Scientific | AMEFC4300 | |
| EVOS Imaging System Objective 10x | ThermoFisher Scientific | AMEP4681 | NA 0.25, WD 6.9/7.45 mm |
| EVOS Imaging System Objective 20x | ThermoFisher Scientific | AMEP4682 | NA 0.40, WD 6.8 mm |
| EVOS Imaging System Objective 40x | ThermoFisher Scientific | AMEP4699 | NA 0.75, WD 0.72 mm |
| Goat anti-rabbit Alexa Fluor 488 antibody | ThermoFisher Scientific | Catalog # A32723 | |
| Goat serum | Jackson Immuno Research Labs | Catalog # NC9660079. Manufacturer Part # 005-000-121 | |
| Neutrophil elastase antibody | Bioss Antibodies | Bs-6982R-Biotin | Rabbit polyclonal Antibody, Biotin conjugated |
| NP40 | Pierce | Product # 28324. Lot # EJ64292 | |
| Positive charged microscope slides | Thomas Scientific | Manufacturer No. 1354W-72 | |
| Rabbit serum | Life Technology | Catalog # 10510 | |
| Target Retrieval Solution | Agilent Dako | S2367 | TRIS/EDTA, pH 9 (10x) |
| TrueVIEW Autofluorescence Quenching Kit | Vector Laboratories | SP-8400 |
References
- Maron, B. J., Fox, P. R. Hypertrophic cardiomyopathy in man and cats. Journal of Veterinary Cardiology: The Official Journal of the European Society of Veterinary Cardiology. 17, 6-9 (2015).
- Payne, J. R., et al. Prognostic indicators in cats with hypertrophic cardiomyopathy. Journal of Veterinary Internal Medicine. 27 (6), 1427-1436 (2013).
- Borgeat, K., Wright, J., Garrod, O., Payne, J. R., Fuentes, V. L. Arterial Thromboembolism in 250 Cats in General Practice: 2004-2012. Journal of Veterinary Internal Medicine. 28 (1), 102-108 (2014).
- Brinkmann, V., Zychlinsky, A. Beneficial suicide: why neutrophils die to make NETs. Nature Reviews. Microbiology. 5 (8), 577-582 (2007).
- Goggs, R., Jeffery, U., LeVine, D. N., Li, R. H. L. Neutrophil-extracellular traps, cell-free DNA and immunothrombosis in companion animals: A review. Veterinary Pathology. , 300985819861721 (2019).
- de Boer, O. J., Li, X., Goebel, H., van der Wal, A. C. Nuclear smears observed in H & E-stained thrombus sections are neutrophil extracellular traps. Journal of Clinical Pathology. 69 (2), 181-182 (2016).
- Li, R., Tablin, F. A Comparative Review of Neutrophil Extracellular Traps in Sepsis. Frontiers in Veterinary Sciences. 5 (291), (2018).
- Borissoff, J. I., et al. Elevated levels of circulating DNA and chromatin are independently associated with severe coronary atherosclerosis and a prothrombotic state. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (8), 2032-2040 (2013).
- Moschonas, I. C., Tselepis, A. D. The pathway of neutrophil extracellular traps towards atherosclerosis and thrombosis. Atherosclerosis. 288, 9-16 (2019).
- Perdomo, J., et al. Neutrophil activation and NETosis are the major drivers of thrombosis in heparin-induced thrombocytopenia. Nature Communications. 10 (1), 1322 (2019).
- Li, B., et al. Neutrophil extracellular traps enhance procoagulant activity in patients with oral squamous cell carcinoma. Journal of Cancer Research and Clinical Oncology. 145 (7), 1695-1707 (2019).
- Li, R. H. L., Tablin, F. In Vitro Canine Neutrophil Extracellular Trap Formation: Dynamic and Quantitative Analysis by Fluorescence Microscopy. Journal of Visualized Experiments. (138), e58083 (2018).
- de Boer, O. J., Li, X., Goebel, H., van der Wal, A. C. Nuclear smears observed in H&E-stained thrombus sections are neutrophil extracellular traps. Journal of Clinical Pathology. 69 (2), 181-182 (2016).
- Farkas, &. #. 1. 9. 3. ;. Z., et al. Neutrophil extracellular traps in thrombi retrieved during interventional treatment of ischemic arterial diseases. Thrombosis Research. 175, 46-52 (2019).
- Qi, H., Yang, S., Zhang, L. Neutrophil Extracellular Traps and Endothelial Dysfunction in Atherosclerosis and Thrombosis. Frontiers in Immunology. 8, 928 (2017).
- Laridan, E., et al. Neutrophil extracellular traps in ischemic stroke thrombi. Annals of Neurology. 82 (2), 223-232 (2017).
- Laridan, E., Martinod, K., Meyer, S. F. D. Neutrophil Extracellular Traps in Arterial and Venous Thrombosis. Seminars in Thrombosis and Hemostasis. 45 (1), 86-93 (2019).
- Li, R. H. L., Johnson, L. R., Kohen, C., Tablin, F. A novel approach to identifying and quantifying neutrophil extracellular trap formation in septic dogs using immunofluorescence microscopy. BMC Veterinary Research. 14 (1), 210 (2018).
- Brinkmann, V., Abu Abed, U., Goosmann, C., Zychlinsky, A. Immunodetection of NETs in Paraffin-Embedded Tissue. Frontiers in Immunology. 7, 513 (2016).
- Moelans, C. B., Oostenrijk, D., Moons, M. J., van Diest, P. J. Formaldehyde substitute fixatives: effects on nucleic acid preservation. Journal of Clinical Pathology. 64 (11), 960-967 (2011).
- Rait, V. K., Xu, L., O'Leary, T. J., Mason, J. T. Modeling formalin fixation and antigen retrieval with bovine pancreatic RNase A II. Interrelationship of cross-linking, immunoreactivity, and heat treatment. Laboratory Investigation: A Journal of Technical Methods and Pathology. 84 (3), 300-306 (2004).
- Willingham, M. C. An alternative fixation-processing method for preembedding ultrastructural immunocytochemistry of cytoplasmic antigens: the GBS (glutaraldehyde-borohydride-saponin) procedure. The Journal of Histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 31 (6), 791-798 (1983).
- Davis, A. S., et al. Characterizing and Diminishing Autofluorescence in Formalin-fixed Paraffin-embedded Human Respiratory Tissue. The Journal of Histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 62 (6), 405-423 (2014).
- Banerjee, B., Miedema, B. E., Chandrasekhar, H. R. Role of basement membrane collagen and elastin in the autofluorescence spectra of the colon. Journal of Investigative Medicine: The Official Publication of the American Federation for Clinical Research. 47 (6), 326-332 (1999).
- Hirsch, R. E., Zukin, R. S., Nagel, R. L. Intrinsic fluorescence emission of intact oxy hemoglobins. Biochemical and Biophysical Research Communications. 93 (2), 432-439 (1980).
- Billinton, N., Knight, A. W. Seeing the wood through the trees: a review of techniques for distinguishing green fluorescent protein from endogenous autofluorescence. Analytical Biochemistry. 291 (2), 175-197 (2001).
- Mosiman, V. L., Patterson, B. K., Canterero, L., Goolsby, C. L. Reducing cellular autofluorescence in flow cytometry: an in-situ method. Cytometry. 30 (3), 151-156 (1997).
- Ducroux, C., et al. Thrombus Neutrophil Extracellular Traps Content Impair tPA-Induced Thrombolysis in Acute Ischemic Stroke. Stroke. 49 (3), 754-757 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved