Method Article
使用免疫荧光显微镜鉴定帕芬-嵌入式猫动脉血栓中中性粒细胞外陷阱
摘要
我们描述了一种使用热诱导抗原检索和双免疫标记协议识别甲醛固定和石蜡嵌入的猫科动物心性动脉血栓中嗜中性粒细胞外陷阱(NETs)的方法。
摘要
中性粒细胞外陷阱(NETs),由无细胞DNA(cfDNA)和蛋白质(如组蛋白和嗜中性粒细胞酶酶(NE)组成,由嗜中性粒细胞释放,以响应全身炎症或病原体。虽然NETs以前曾被证明能增强血栓形成和抑制人类和狗的纤维化,但NET在有心性动脉血栓栓塞(CATE)的猫中的作用,这是一种威胁生命的并发症,仅次于肥大心肌病,未知。一种标准化的方法识别和量化猫有氧动脉血栓中的NET,将增进我们对猫在CAT中病理作用的理解。在这里,我们描述了一种技术,用于识别主动脉分叉内甲醛固定和石蜡嵌入血栓中的NET,在尸检期间提取。与二甲苯脱硫后,主动脉部分进行了间接热诱导抗原检索。然后,通过无细胞DNA(cfDNA)、西特鲁普林语H3(citH3)和中性粒细胞酶(NE)共同定位,利用免疫荧光显微镜,发现部分阻塞、渗透和外游性NETs。为了优化血栓中NET的免疫检测,在显微镜之前使用自动荧光淬火过程限制了组织元素的自荧光。这项技术可能是研究其他物种的NET和血栓形成的有用工具,并为这种复杂情况的病理生理学提供了新的见解。
引言
患有肥大心肌病的猫有生命危险血栓栓塞并发症11,2。2尽管与猫科动物心电源性动脉血栓栓塞(CATE)相关的发病率和死亡率很高,但CAT在猫身上的基本病理生理学还知之甚少。也有有限的诊断和治疗工具,以治疗和识别猫在这种毁灭性的条件3的风险。
除了在先天免疫中的作用外,中性粒细胞外嗜中性粒细胞外陷阱(NETs)在血栓形成中发挥了作用,这种陷阱是网络状的无细胞DNA(cfDNA)网络,含有组蛋白和粒状蛋白质,如中性粒细胞酶酶(NE)和骨髓红酶。嗜中性粒细胞在反应全身炎症、直接接触病原体以及与活性血小板44、5、6、75,6,7相互作用时进行神经衰弱的形成。在狗中,中性粒细胞衍生的DNA已被证明能抑制血块性结质,而NET蛋白加速血块形成。NET捕获循环细胞和凝固成分的能力也是其血栓生成特性88、9、10、11、12的关键。,9,10,11,12
通过细胞外嗜中性粒细胞蛋白、组蛋白和cfDNA的共定位检测出NET。因此,通过脱硫素组织的免疫荧光对固定组织中NET的识别和定量优于传统的血氧林和欧辛(H&E)染色,使用明亮的场显微镜44,5。5利用免疫荧光显微镜进行的几项人体研究确定NETs为冠状动脉血栓、脑卒中、动脉炎和静脉血栓13、14、15、16、17的结构成分。13,14,15,16,17迄今为止,尚未描述一种检测和量化猫科动物血栓中NET的标准化方法。由于在猫科动物心性动脉血栓中识别NETs可能有助于未来在NET和血栓的转化研究,我们描述了NET识别和评估在猫的石蜡嵌入动脉血栓的技术。
研究方案
此处描述的所有方法均按照加州大学戴维斯分校机构动物护理和使用委员会的准则执行。在业主同意下进行组织解剖和活检。
1. 组织固定、嵌入和切片
- 在人道安乐死或死亡后不久,切除主动脉分叉,包括下降的主动脉、股动脉和常见的伊利亚动脉(图1A)。布伦特解剖出筋膜 (图 1B) 之前,它完全浸入 10% 中性缓冲形式,至少 24 小时,不超过 48 小时。
- 要脱水样品,首先浸入10%中性缓冲形式中加热至37°C1小时。然后,在乙醇的浓度增加中浸入加热到37°C(70%,95%,100%)2x,每1小时。最后,在不进行润石的情况下,将2倍浸入100%的托鲁烯中加热至37°C,每次加热1小时。
- 将石蜡加热到62°C,让石蜡在一夜之间完全凝固。
- 使用微托姆将石蜡嵌入组织的第 2⁄3 μm 节放在带正电荷的玻璃幻灯片上。将切片组织储存在-80°C,直到进一步分析。
2. 脱硫、补液和热诱导抗原检索
- 要对玻璃滑轨上的部分进行除石化和补液,将玻璃滑板放在机架中,然后按以下顺序进行处理:
- 完全浸入 100% 二甲苯 3 分钟。 重复此步骤 2 倍。不要在步骤之间冲洗。
- 完全浸没在乙醇浓度下降(100%、95%、70%)中室温 (RT), 3x 每 3 分钟.不要在步骤之间冲洗。
- 完全浸入去离子水中2分钟。 重复。
- 将部分放入三酯缓冲盐水中,以 0.1 % Tween (TBST, pH = 7.6) 放置 2~3 分钟。
- 将去离子水加热到 100°C。让蒸箱室平衡20分钟。
注:热诱导抗原检索最好通过具有预设温度设置的蒸水器(如食品蒸水机)产生的间接加热进行。 - 在温度控制热板上将含有Tris和EDTA(pH = 9)的商用抗原回收溶液加热到95~97°C,并持续搅拌。确保它不沸腾。
注:一旦加热,溶液应变为多云。 - 将加热抗原回收溶液倒入滑容器,然后将容器放入蒸水器的腔室中。让抗原回收溶液与蒸水器的温度平衡3~4分钟。确保造型室温度为+95°C。
- 将滑轨完全浸入加热抗原回收溶液中,并通过蒸水器继续应用外部加热 20 分钟。
- 从蒸托器中取出滑动容器,让幻灯片和抗原检索溶液冷却至 RT. 将稀释后的抗原检索溶液储存在 4°C,如果需要,可重复使用多达 2 倍。
- 使用 TBST 将幻灯片 3x 洗涤 5 分钟。
3. 免疫标签和自荧光淬火
注:表 1详细介绍了以下步骤中使用的阻塞缓冲区的组成。
- 在轻柔摇动(30~50 rpm)下,在 RT 下孵育阻塞缓冲区 1 中的 2 小时部分。用石蜡膜密封,避免干燥。
- 不洗,立即将100μL稀释的兔多克隆抗人类血性组蛋白H3(citH3)抗体(0.03毫克/mL稀释在阻塞缓冲液1)直接涂抹在滑道上。
- 在每个部位放置盖玻片(24 毫米 x 40 毫米 x 0.13*0.17 mm),以便均匀分配抗体混合物。
- 在4°C下孵育12~16小时,轻轻摇动(30~50 rpm)。用副膜密封,避免干燥。
- 用 TBST 清洗 3x 5 分钟。
- 将100 μL的山羊抗兔抗体结合在Alexa Fluor 488(稀释至最终浓度0.04毫克/mL或1:50在阻塞缓冲液1)上,如步骤3.3所述。在轻柔摇动(30~50 rpm)下,在 RT 处孵育 1 小时。保护幻灯片免受光线照射。
- 用 TBST 3x 清洗 5 分钟。
- 在温和的摇动(30~50 rpm)下,在4°C下在阻塞缓冲器2中孵育部分过夜。防光。
- 用 TBST 3x 清洗 5 分钟。
- 阻塞缓冲区 3 中的块段,如 RT 步骤 3.3 中所述的 2 小时在温和摇动(30~50 rpm)下。
- 在4°C下孵育具有生物微粒多克隆兔抗人类NE抗体的部分(阻堵缓冲液3中的最终浓度=0.2微克/米)为12~16小时,如步骤3.2~3.4所述。
- 用 TBST 3x 清洗 5 分钟。
- 与Alexa Fluor 594链球菌素结合(稀释至1:100或0.02毫克/米L在阻塞缓冲液3)如步骤3.2~3.3 1小时RT所述。
- 用 TBST 1x 清洗 5 分钟。
- 按照制造商的指示,将 100 μL 的自荧光淬火溶液混合物直接涂抹在部分上 1 分钟。
- 立即用 TBST 6x 清洗幻灯片 10 分钟。
- 在黑暗中用 100 μL 300 nM DAPI 覆盖每张幻灯片 5 分钟。
- 用 TBST 清洗 3 分钟,重复此操作共 5 倍。
- 将一滴(±50 μL)的防褪色安装介质(自动荧光淬火套件的一部分)直接涂抹在部分周围的玻璃滑轨上。将盖玻片(24 毫米 x 40 毫米 x 0.13×0.17 毫米)轻轻放在该部分,而不会产生任何气泡。
- 允许样品在 4°C 的黑暗中固化过夜,直到安装介质硬化,以便使用浸入镜片进行显微分析。
4. 嗜中性细胞外陷阱识别
注:以下协议使用带有 1,280 x 960 数字 CCD 摄像机的倒置出物显微镜(参见材料表)。
- 要定位血栓,使用具有10倍目标的相位对比显微镜,沿主动脉的长度、主动脉分叉和每个股骨动脉进行颅骨扫描。血栓是一种包含红血球、白血球和血小板的组织聚集,在相位对比和明亮场显微镜下与内皮体相邻(图2A,图2B)。
- 首先检查使用 DAPI 通道(激发 = 357/44 nm)具有 10 倍和 20 倍目标的 NT 部分(图 2C)。请注意,当在相位对比或明亮场显微镜上看到时,cfDNA显示为不凝聚的DNA,不在细胞细胞质范围内。
- 识别德州红通道(激发 = 585/29 nm,发射 = 628/32 nm)和绿色荧光蛋白通道(激发 = 470/22 nm,发射 = 525/50 nm)上的细胞外 NE 和 citH3,分别具有 10、20 和 40 倍的目标。
- 使用可用的软件(如图像 J (NIH))评估和分析血栓中的 NET。NET形成基于cfDNA、细胞外citH3和NE的共定位(如前所述的18)进行识别。在整个图像采集过程中,保持每个通道的一致的曝光时间和增益,以避免像素强度饱和。
- 将每个血栓基于其与降序主塔的邻近程度映射,将其划分为三个相等的区域,区域 1 最接近主主塔,区域 3 最远于主塔,区域 1 和 3 区域之间的区域 2)。由于操作员对每个受试者的医疗状况视而不见,因此在每个区域中至少采用十个随机字段。通过在每个区域中平均带 NET 的字段数或计算每个区域的平均 NET 占用面积,描述国家电信电子指标在血栓中的分布情况。
结果
利用该协议进行除石蜡化、热诱导抗原检索和石蜡嵌血栓的双重免疫标签,我们首次确定了猫科动物CATE中的NET。主动脉分叉内的血栓通过荧光显微镜和亮场显微镜使用标准H&E染色和相位对比显微镜定位。在明亮的田间显微镜下,猫动脉血栓由红血球、白细胞、纤维蛋白和血小板组成(图3A)。虽然H&E不能染色特定的NET组件,但NET经常作为围绕附近红细胞和白细胞的各种长度的深紫色线网络出现(图3A,虚线轮廓)。在相位对比显微镜下,血栓被定性为血管空间内的一种划分良好的结构(图2A,图4B)。我们进一步确认,通过免疫荧光显微镜在这些区域内存在NET(图3B)。这些区域的放大显示,由cfDNA、细胞外citH3和NE组成的NT的大聚合(图2C,图3B,白色虚线轮廓)。使用同样的技术,搜索在没有CAT的猫血栓和NET,我们发现,有时可以检测到成片的溶化中性粒细胞接近内皮。虽然这些嗜中性粒细胞表现出NET形成的一些形态特征,但它们不应与任何有组织的血栓有关。我们没有在任何控制样本中识别任何血栓(图4A)。
图5A显示了在绿色(488 nm)波长成像时,血细胞和胶原蛋白等血块元素的深刻自荧光,这阻碍了我们检测cfDNA和蛋白质共定位的能力。我们发现,在免疫标记后,使用市售试剂盒进行短暂的自荧光淬火会,大大提高了蛋白质共定位和NET检测的灵敏度,即使在红细胞丰富的区域(图5B,箭头)。
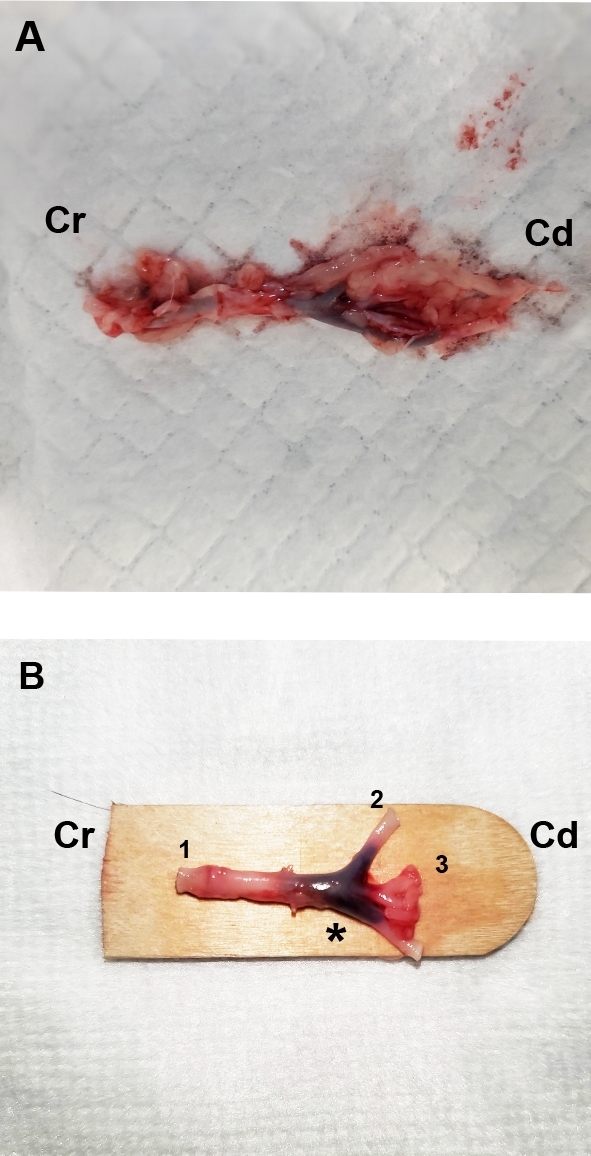
图1:从有心性动脉血栓栓塞的猫的解剖主动脉分叉的代表性解剖照片。(A) 降序主动脉被解剖 4×5 厘米颅骨 (Cr) 到主动脉分叉。(B) Fascia 被仔细解剖,直到下降的主动脉 (1) 和伊利亚动脉 (2,3) 在考达尔方面清晰可见 (Cd)。注意主动脉分叉 (*) 内的血栓。请点击此处查看此图形的较大版本。
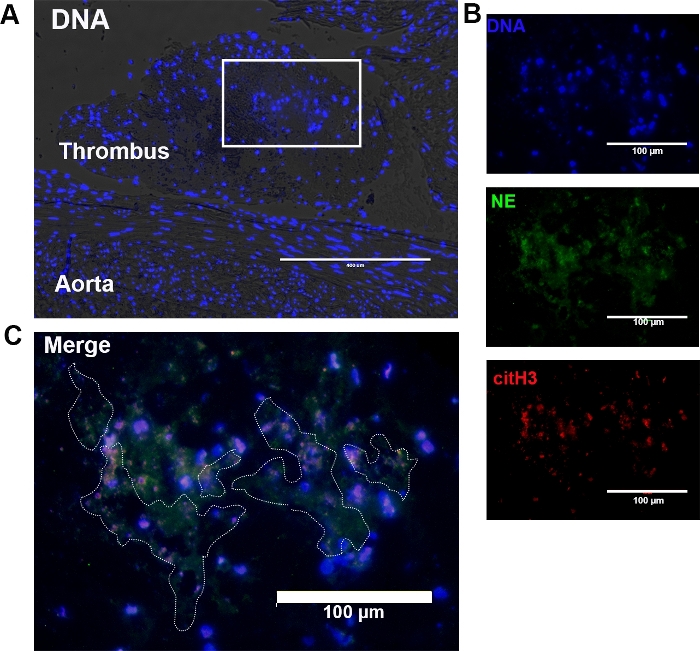
图2:在猫科动物主动脉分叉中发现的血栓中,NET的代表相对比和免疫荧光图像。(A) 相位对比显微镜显示,血栓是靠近主声的离散且标界良好的结构。DNA(蓝色)的相位对比和荧光染色显示,血红细胞和无细胞DNA存在于血栓中。盒装区域由大量无细胞DNA组成。原始 10 倍放大倍率;刻度柱 = 400 μm. (B) (A) 中的盒装面积在 20 倍时进一步放大。无细胞DNA和细胞内DNA分别呈绿色和红色。(原始放大倍率20倍;刻度柱 = 100 μm)。(C) NET,根据无细胞DNA、细胞外NE和citH3的共定位进行识别,概述了(虚线)。原始 40 倍放大倍率;比例尺 = 100 μm。请点击这里查看此图形的较大版本。
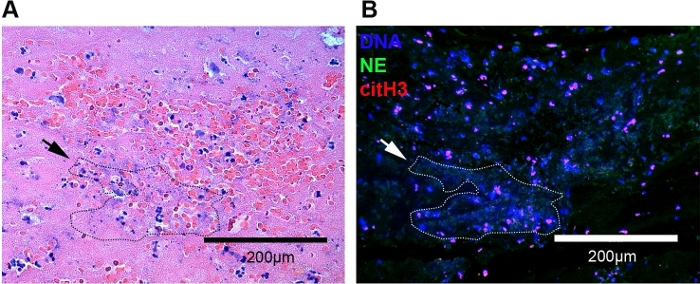
图3:使用H&E和免疫荧光染色的猫科动脉血栓的代表性图像。(A) 在H&E染色时,可以看到大量中微粒和红细胞。细胞外染色质出现为各种长度的深紫色线,周围环绕着红细胞和嗜中性粒细胞(虚线轮廓,黑色箭头)。(B) 中性粒细胞外陷阱使用免疫荧光显微镜在同一血栓(虚线轮廓,白色箭头)上轻松可视化。NET被确定为cfDNA(蓝色)、NE(绿色)和CitH3(红色)的共同本地化。原始 20 倍放大倍率;比例尺 = 200 μm。请点击这里查看此图形的较大版本。

图4:主动脉分叉的代表性相位对比和免疫荧光图像。(A) 无动脉血栓的猫主动脉分叉的相位对比和免疫荧光图像。请注意,在主动脉分叉的流明中,没有动脉血栓或嗜中性粒细胞聚集体, 没有动脉血栓。(B) 诊断为心性动脉血栓栓塞的猫主动脉分叉的相位对比和免疫荧光图像。主动脉分叉被染色为DNA(蓝色)、中性粒细胞酶(绿色)和分叉性组蛋白H3(红色)。在这种情况下,在患有心电动脉血栓栓塞的猫中,注意到了一个划界良好的血栓肿块膨胀到血管壁并占据大部分主动脉流明。以cfDNA、NE和citH3共同定位为特征的NET在血栓(虚线轮廓)内被识别。原始 10 倍放大倍率;比例尺 = 400 μm。请点击这里查看此图形的较大版本。
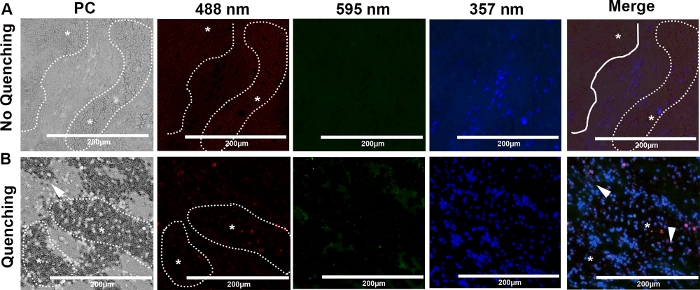
图5:代表阶段对比度(PC)和来自两只猫的动脉血栓的免疫荧光图像。这些幻灯片被染色为CitH3、NE和DNA,分别以40倍的放大倍率在488nm(红色)、595nm(绿色)和357nm(蓝色)波长上成像。猫的心性动脉血栓有丰富的红细胞(*,虚线)。(A) 红细胞的自荧光在488nm波长上最为突出,减少了对共定位信号的检测和NET的识别。(B) 淬火显著减少488 nm波长的自荧光,特别是在红细胞浓度高的区域(*,虚线)。它增强了在红细胞存在的情况下对共地蛋白、西特H3和中性粒细胞酶(箭头)的检测(Scale bar = 200 μm)。请点击此处查看此图形的较大版本。
补充图1:来自猫的动脉血栓的代表性免疫荧光图像。这些部分被染色为DNA(蓝色),西特H3(红色),和骨髓过氧化物酶(A)或中性粒细胞酶(B)。(A) 尽管利用了猫科特性骨髓性脱氧酶抗体(MPO,1:5),MPO 的染色强度仍然较差。(B) 使用多克隆嗜中性乳酶(NE)抗体,已知与多个物种发生交叉反应,免疫反应和染色强度明显较高。注意被NE(箭头)包围的嗜中性粒细胞状细胞核的特征游荡核。原始 40 倍放大倍率;比例尺 = 100 μm。请点击这里下载此图。
| 阻塞缓冲区 | 组成 | |
| 1 | TBS 与 0.1% Tween-20, 0.1% NP40, 5% 山羊血清 | |
| 2 | TBS 与 0.1% Tween-20, 10% 兔血清, 0.1%NP-40 | |
| 3 | TBS 与 0.1% Tween-20, 5% BSA, 0.1% NP-40 | |
表1:用于免疫荧光的阻塞缓冲液的组成。
讨论
我们描述了一种协议,使用双免疫标记协议和免疫荧光显微镜识别固定猫科动物心电源动脉血栓中的NET。虽然只有心电动脉血栓被染色,但理论上,这种协议可用于其他类型的血栓和其他兽医物种。猫动脉血栓内NET的识别表明,NET在猫的血栓形成中可能起一定的作用。
在固定和石蜡嵌入组织中通过免疫荧光检测NET优于H&E等传统组织学污渍,后者通常显示由嗜中性粒细胞包围的染色质线13。固定动脉血栓的免疫组织化学和免疫荧光允许同时检测cfDNA和其他细胞外蛋白质,如citH3,已知是专门于NETs形成18,19。18,由于冷冻制剂在组织和血栓中用于 NET 检测不理想,所以我们将样品保存在 10% 中性缓冲形式素中,其中含有 4% 甲醛和 10% 甲醇。无细胞核酸不是由甲醛直接固定的。相反,它们在固定蛋白质结构内被固定不动,由甲醛20诱导的局部可逆的亚甲桥交界改变。为了进一步限制甲醛氧化产生的甲酸和酮引起的人工制品和自氟,研究人员可以选择在缓冲液中稀释不含甲醇的甲醛进行固定。由于固定持续时间影响免疫反应,我们建议在脱水和石蜡嵌入之前,固定时间不超过 24 小时。然后,可以存储石蜡嵌入组织或凝块,以便进行除石化和染色。
甲醛和甲醛的化学固定会改变蛋白质的三级结构,掩盖感兴趣的抗原,防止抗体与特定表皮结合21。抗原检索,一个打破亚甲桥交叉链接的过程,在正式固定组织中执行免疫检测之前是必不可少的。根据作者的经验,使用碱性检索溶液(pH = 9 在Tris/EDTA缓冲液中)进行温和的间接加热,可增强蛋白质和NET的检测能力,同时最大限度地减少人工制品和自荧光。抗原检索溶液的温度不应达到沸点(>100°C),因为蛋白质的变性会导致非特异性结合和背景噪声。
固定血块中NET识别的一个局限性是,在不同抗原检索条件下,免疫荧光染色可以高度可变。与布林克曼等人发现的结果相比,我们发现较高的孵育温度(>55 °C)导致组蛋白在核中的最佳染色,并解凝染色19。然而,我们发现,在建议的条件下,在嗜中性粒细胞和NET中发现的粒状蛋白——骨髓过氧化物酶的染色强度较低。尽管使用猫科动物特异性抗体,但骨髓再生酶的免疫反应不良是一致的(补充图1)。因此,我们鼓励调查人员修改抗原检索过程的持续时间和条件(例如pH、温度),以产生基于感兴趣的抗原的令人满意的信号。
在兽医物种中识别东北兽的挑战之一是缺乏物种特异性抗体。为了防止使用来自同一物种的初级抗体时遇到的干扰,我们增加了一个阻塞步骤,利用高浓度的兔子免疫球蛋白饱和山羊抗兔二次抗体上剩余的结合位点。该技术的一个主要缺点是它非常耗时,因为它需要多个孵化步骤。研究者应包括两种不同的对照,在第二个免疫标记步骤中排除任何一种主要抗体,以确保免疫标签步骤中的二次抗体与其主要抗体特别结合。通过DNase消化或包括由没有CAT的猫主动脉分叉组成的生物控制,可以进一步验证已识别的NET结构的特异性(图5)。此外,还应包括与主要抗体相同的等感控制抗体浓度的负对照,以排除非特异性抗体相互作用、非特异性结合Fc受体和细胞自荧光。建议调查人员根据物种特异性抗体的可用性修改该协议。如果没有物种特定的抗体可用,我们建议首先使用免疫细胞化学评估抗体的免疫反应活性,或从同源学感兴趣的物种到引用的转录器中评估蛋白质转录。
样品固定、脱硫功能不足以及特定组织成分的存在等因素可能导致血栓的自氟化。在醛固定期间,胺可能与醛结合形成希夫基复合物,从而发出荧光22。不完全脱硫化也可以化学地修饰组织中的蛋白质,产生自荧光23。据报告,血管样本(如胶原蛋白、拉子蛋白和红血球)中的细胞外成分在哺乳动物24、25,25中自然荧光。由于自然或异源自荧光在绿色波长(激发 = 488 nm,发射 = 500~550 nm)中最为明显,因此使用远红荧光波可能会最大限度地减少一些自荧光26。在本协议中,我们使用了一种商业上可用的自荧光淬火套件,该试剂盒设计为静电结合自荧光组织元件。我们建议调查人员优化自荧光淬火的持续时间,因为制造商建议5分钟可能会降低较不丰富的蛋白质的免疫反应活性。或者,调查人员也可以使用苏丹黑B、3,3'-二氨基苯或锥蓝色27来抑制自氟。
由于 NET 在血栓中异质分布,因此建议对整个主动脉和硅动脉进行彻底映射。然后放大 cfDNA、citH3 和 NE 的正区域。cfDNA、citH3和NE的共定位已被广泛用于识别NET形成和区分NET形成与其他形式的细胞死亡。与最近的一项人类研究发现NET集中在冠状动脉血栓的边缘不同,猫科动脉血栓中的大多数NET被聚集在血栓28的颅面。尽管我们使用标准化协议来识别国家电信标准,但对NET的微观评估和定量仍然是主观的。在这里,我们使用了一种盲目的系统方法,以尽量减少微观分析过程中的观察者偏差。由于样本中的 NET 数量可能受中性粒细胞数量的影响,因此研究人员可以通过根据核形态、细胞直径和中性粒细胞特定蛋白质的表达来识别中性粒细胞的嗜中性粒细胞数量, 从而量化与中性粒细胞数量相关的 NET。使用显微镜进行NET识别的另一个挑战是,NET 的边距不明确,它们倾向于合并,形成模糊的结构。这可能导致低估或高估任何给定样本中的 NET 数量。因此,可以使用Sytox Green染色,以更清楚地识别和表示从NET形成的细胞-分状DNA,而不是DAPI。
我们开发了双免疫标签协议,用于识别石蜡内嵌猫动脉血栓中的NET。在免疫标记 citH3 和 NE 之前,必须进行去石蜡化、补液和抗原检索。这种测定是研究猫身上的NET形成的宝贵工具,并更好地了解猫科动物的病理生理学。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了加州大学戴维斯分校动物健康中心(CCAH 2018-30-F)的资金支持。作者要感谢凯文·伍拉德博士使用荧光显微镜。
材料
| Name | Company | Catalog Number | Comments |
| 4,6-Diamidino-2-phenylin (DAPI) | Life Technologies Corporation | D1306 | |
| Alexa Fluor 594 Streptavidin conjugate | ThermoFisher Scientific | Catalog # S11227 | |
| Anti-citrullinated histone H3 antibody | Abcam | Ab5103 | |
| EVOS FL Cell Imaging System | ThermoFisher Scientific | AMEFC4300 | |
| EVOS Imaging System Objective 10x | ThermoFisher Scientific | AMEP4681 | NA 0.25, WD 6.9/7.45 mm |
| EVOS Imaging System Objective 20x | ThermoFisher Scientific | AMEP4682 | NA 0.40, WD 6.8 mm |
| EVOS Imaging System Objective 40x | ThermoFisher Scientific | AMEP4699 | NA 0.75, WD 0.72 mm |
| Goat anti-rabbit Alexa Fluor 488 antibody | ThermoFisher Scientific | Catalog # A32723 | |
| Goat serum | Jackson Immuno Research Labs | Catalog # NC9660079. Manufacturer Part # 005-000-121 | |
| Neutrophil elastase antibody | Bioss Antibodies | Bs-6982R-Biotin | Rabbit polyclonal Antibody, Biotin conjugated |
| NP40 | Pierce | Product # 28324. Lot # EJ64292 | |
| Positive charged microscope slides | Thomas Scientific | Manufacturer No. 1354W-72 | |
| Rabbit serum | Life Technology | Catalog # 10510 | |
| Target Retrieval Solution | Agilent Dako | S2367 | TRIS/EDTA, pH 9 (10x) |
| TrueVIEW Autofluorescence Quenching Kit | Vector Laboratories | SP-8400 |
参考文献
- Maron, B. J., Fox, P. R. Hypertrophic cardiomyopathy in man and cats. Journal of Veterinary Cardiology: The Official Journal of the European Society of Veterinary Cardiology. 17, 6-9 (2015).
- Payne, J. R., et al. Prognostic indicators in cats with hypertrophic cardiomyopathy. Journal of Veterinary Internal Medicine. 27 (6), 1427-1436 (2013).
- Borgeat, K., Wright, J., Garrod, O., Payne, J. R., Fuentes, V. L. Arterial Thromboembolism in 250 Cats in General Practice: 2004-2012. Journal of Veterinary Internal Medicine. 28 (1), 102-108 (2014).
- Brinkmann, V., Zychlinsky, A. Beneficial suicide: why neutrophils die to make NETs. Nature Reviews. Microbiology. 5 (8), 577-582 (2007).
- Goggs, R., Jeffery, U., LeVine, D. N., Li, R. H. L. Neutrophil-extracellular traps, cell-free DNA and immunothrombosis in companion animals: A review. Veterinary Pathology. , 300985819861721 (2019).
- de Boer, O. J., Li, X., Goebel, H., van der Wal, A. C. Nuclear smears observed in H & E-stained thrombus sections are neutrophil extracellular traps. Journal of Clinical Pathology. 69 (2), 181-182 (2016).
- Li, R., Tablin, F. A Comparative Review of Neutrophil Extracellular Traps in Sepsis. Frontiers in Veterinary Sciences. 5 (291), (2018).
- Borissoff, J. I., et al. Elevated levels of circulating DNA and chromatin are independently associated with severe coronary atherosclerosis and a prothrombotic state. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (8), 2032-2040 (2013).
- Moschonas, I. C., Tselepis, A. D. The pathway of neutrophil extracellular traps towards atherosclerosis and thrombosis. Atherosclerosis. 288, 9-16 (2019).
- Perdomo, J., et al. Neutrophil activation and NETosis are the major drivers of thrombosis in heparin-induced thrombocytopenia. Nature Communications. 10 (1), 1322 (2019).
- Li, B., et al. Neutrophil extracellular traps enhance procoagulant activity in patients with oral squamous cell carcinoma. Journal of Cancer Research and Clinical Oncology. 145 (7), 1695-1707 (2019).
- Li, R. H. L., Tablin, F. In Vitro Canine Neutrophil Extracellular Trap Formation: Dynamic and Quantitative Analysis by Fluorescence Microscopy. Journal of Visualized Experiments. (138), e58083 (2018).
- de Boer, O. J., Li, X., Goebel, H., van der Wal, A. C. Nuclear smears observed in H&E-stained thrombus sections are neutrophil extracellular traps. Journal of Clinical Pathology. 69 (2), 181-182 (2016).
- Farkas, &. #. 1. 9. 3. ;. Z., et al. Neutrophil extracellular traps in thrombi retrieved during interventional treatment of ischemic arterial diseases. Thrombosis Research. 175, 46-52 (2019).
- Qi, H., Yang, S., Zhang, L. Neutrophil Extracellular Traps and Endothelial Dysfunction in Atherosclerosis and Thrombosis. Frontiers in Immunology. 8, 928 (2017).
- Laridan, E., et al. Neutrophil extracellular traps in ischemic stroke thrombi. Annals of Neurology. 82 (2), 223-232 (2017).
- Laridan, E., Martinod, K., Meyer, S. F. D. Neutrophil Extracellular Traps in Arterial and Venous Thrombosis. Seminars in Thrombosis and Hemostasis. 45 (1), 86-93 (2019).
- Li, R. H. L., Johnson, L. R., Kohen, C., Tablin, F. A novel approach to identifying and quantifying neutrophil extracellular trap formation in septic dogs using immunofluorescence microscopy. BMC Veterinary Research. 14 (1), 210 (2018).
- Brinkmann, V., Abu Abed, U., Goosmann, C., Zychlinsky, A. Immunodetection of NETs in Paraffin-Embedded Tissue. Frontiers in Immunology. 7, 513 (2016).
- Moelans, C. B., Oostenrijk, D., Moons, M. J., van Diest, P. J. Formaldehyde substitute fixatives: effects on nucleic acid preservation. Journal of Clinical Pathology. 64 (11), 960-967 (2011).
- Rait, V. K., Xu, L., O'Leary, T. J., Mason, J. T. Modeling formalin fixation and antigen retrieval with bovine pancreatic RNase A II. Interrelationship of cross-linking, immunoreactivity, and heat treatment. Laboratory Investigation: A Journal of Technical Methods and Pathology. 84 (3), 300-306 (2004).
- Willingham, M. C. An alternative fixation-processing method for preembedding ultrastructural immunocytochemistry of cytoplasmic antigens: the GBS (glutaraldehyde-borohydride-saponin) procedure. The Journal of Histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 31 (6), 791-798 (1983).
- Davis, A. S., et al. Characterizing and Diminishing Autofluorescence in Formalin-fixed Paraffin-embedded Human Respiratory Tissue. The Journal of Histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 62 (6), 405-423 (2014).
- Banerjee, B., Miedema, B. E., Chandrasekhar, H. R. Role of basement membrane collagen and elastin in the autofluorescence spectra of the colon. Journal of Investigative Medicine: The Official Publication of the American Federation for Clinical Research. 47 (6), 326-332 (1999).
- Hirsch, R. E., Zukin, R. S., Nagel, R. L. Intrinsic fluorescence emission of intact oxy hemoglobins. Biochemical and Biophysical Research Communications. 93 (2), 432-439 (1980).
- Billinton, N., Knight, A. W. Seeing the wood through the trees: a review of techniques for distinguishing green fluorescent protein from endogenous autofluorescence. Analytical Biochemistry. 291 (2), 175-197 (2001).
- Mosiman, V. L., Patterson, B. K., Canterero, L., Goolsby, C. L. Reducing cellular autofluorescence in flow cytometry: an in-situ method. Cytometry. 30 (3), 151-156 (1997).
- Ducroux, C., et al. Thrombus Neutrophil Extracellular Traps Content Impair tPA-Induced Thrombolysis in Acute Ischemic Stroke. Stroke. 49 (3), 754-757 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。