Method Article
Ex-Vivo Konfokal Mikroskopi ile Lenf Nodal Yapısı nın Ve Hücresel Lokalizasyonun Görselleştirilmesi
Bu Makalede
Özet
Bu protokol, organ yapısında değişiklik olmadan lenf düğümlerini boşaltmada farklı hücre popülasyonlarını görüntüleyen bir tekniği tanımlar.
Özet
Lenf düğümleri (LNs) organlar vücuda yayılmış, doğuştan gelen bağışıklık yanıtları adaptif bağışıklık ile bağlayabilirsiniz nerede. Aslında, LNs stratejik lenfdamarların yolunda interposed, LN tüm yerleşik bağışıklık hücreleri ile doku antijenleri samimi temas sağlayan. Böylece, hücresel kompozisyon, dağılım, yer ve etkileşim ex vivo bütün LN görüntüleme kullanarak anlamak vücudun yerel ve sistemik bağışıklık yanıtları koordine nasıl bilgi katacak. Bu protokol, geleneksel konfokal mikroskoplar ve stok reaktifleri kullanılarak çok tekrarlanabilir ve kolay bir metodoloji sağlayan floresan etiketli antikorların in vivo uygulamasının ardından bir ex vivo görüntüleme stratejisi göstermektedir. Antikorların deri altı enjeksiyonu ile, geleneksel immünoreskans mikroskobu tekniği ile potansiyel olarak zarar görebilir doku yapılarını etkilemeden, nn'lerin boşaltılmasında farklı hücre popülasyonlarının etiketedilmesi mümkündür.
Giriş
Lenf düğümleri (LNs) doğuştan gelen ve adaptif bağışıklık yanıtları köprü önemli işlevi ile vücutta yaygın olarak mevcut oval şekilli organlardır. NNs yabancı parçacıklar ve kanserli hücreleri tanımlamak için onlara karşı bir bağışıklık yanıtı monte etmek için lenf filtre1. Antijen sunan hücreler (AAP' ler), T hücreleri ve B hücreleri yabancı parçacıkları ve kanserli hücreleri ortadan kaldırmak için antijene özgü antikorlar (humoral bağışıklık) ve sitotoksik lenfositler (hücresel bağışıklık) oluşturmak için birlikte çalışır2. Böylece, lenfatik sistemde mevcut bağışıklık hücrelerinin dinamikleri anlamak aşı gelişimi ve kanser immünoterapisi için önemli etkileri olacaktır.
Yeni konfokal ve süper çözünürlüklü mikroskoplar da dahil olmak üzere güçlü mikroskopların ortaya çıkışı, farklı bağışıklıkhücre popülasyonlarının doğal ortamlarında nasıl davranışlarını anlamada olağanüstü bir ilerleme sağladı 3. Floresan proteinleri belirlihedeflerinkontrolü altında ifade eden genetiği değiştirilmiş farelerle sondaların bir kombinasyonunu kullanarak birkaç eşzamanlı hücre alt tipini görüntülemek artık mümkün . Aslında, kitle sitometri ve multi-parametrik akış analizi de dahil olmak üzere yüksek boyutlu teknikler, sağlık ve hastalık 6 farklı bağışıklık hücresi bölümleme ve işlevsellik hakkındaki bilgimizi genişletmek için çok önemli olmuştur6, 7. Ancak, bu teknikler için örnek hazırlamak için, dokular sindirim gerekir ve hücreler hücre süspansiyonları analiz edilecek doğal ortamdan ayrılır. Bu sınırlamaları aşmak ve biyolojide daha iyi bir çeviri sağlamak için, burada önerilen protokolün amacı gelişmiş hız, doku yararı ile stok konfokal mikroskoplar kullanarak ex vivo bütün lenf düğümleri görüntü için basit bir metodoloji uygulamaktır konvansiyonel immünoffloresan boyama ile karşılaştırıldığında yapı koruma ve hücre canlılığı. Bu yaklaşımı kullanarak, γδ T hücreleri için eksik fareler göstermek başardık, Patojenlere karşı konak erken savunmadahil T lenfosit bir alt türü 4, yabani tip fareler ile karşılaştırıldığında folikülleri ve T hücre bölgeleri tehlikeye var. Bu bulgular, γδ T hücrelerinin lenfoid organların homeostazında ve humoral immün yanıtta kritik bir rol oynadığını gösterdiğimiz bir çalışma sürdürmemizi sağladı4. Ayrıca, bu protokol, sondalar ve antikorlar lenf düğümü ulaşmak için fizyolojik bir yol sağlar, onlar deri altı uygulanır ve doku lenfatik dolaşım yoluyla dağıtmak gibi, yerinde etiketleme kullanılan önceki raporlar üzerine bina lenfatik ilişkili yapıları görselleştirmek için antikorlar ile8,9, germinal merkezi dinamikleri10,11,12, ve hedefleri kolayca kan akışı için erişilebilir13 ,14,15.
Protokol
Protokol Harvard Tıp Fakültesi Hayvanlar Daimi Komitesi ve Brigham ve Kadın Hastanesi, protokol 2016N000230 tarafından onaylandı.
1. Deney için kullanılan fareler
- Antikor karışımı nı yönetmek için B6 arka planında 8 haftalık erkek ve dişi fareler kullanın.
- Ex vivo bütün LN görüntülemenin muhabir farelere antikor karışımı uygulanmadan uygulanıp uygulanamayacağını belirlemek ve antijen ibraz da dahil olmak üzere mononükleer hücrelerin varlığını araştırmak için CX3CR1GFP1 GFP/WTCCR2RFP/WT farelerini kullanın hücreler ve fagositler ve LN'deki dağılımları.
NOT: CX3CR1GFP/WTCCR2RFP/WT muhabiri farelerde sırasıyla CX3CR1 ve CCR2 organizatörleri kontrolü altında yeşil floresan protein (GFP) ve kırmızı floresan protein (RFP) vardır. Muhabir fareler antikor karışımı enjeksiyonu ile veya olmadan kullanılabilir. Bir muhabir fare antikor karışımı enjeksiyon için referans4 bakın. Antikan enjekte edilmezse ameliyata devam edin.
2. Antikor karışımı hazırlama ve enjeksiyon
NOT: Adım 1.1'de açıklanan fareler üzerinde bu adımları gerçekleştirin.
- Seyreltik 1:10 parlak menekşe (BV) 421 anti-CD4 (GK1.5; 0.2 mg/mL), 1:10 parlak mavi (BB) 515 anti-CD19 (1D3; 0.2 mg/mL) ve 1:20 phycoerythrin (PE) anti-F4/80 (T45-2342; 0.2 mg/mL) pbs uygun son hacmi ile iç uyluk içine enjekte etmek (için görüntü inguinal) veya pençe ped içine (görüntü popliteal için) lenf.
NOT: İzotip olarak kullanın: BV421 Mouse IgG2b, k İzotip Kontrolü (R35-38; 0.2 mg/mL); PE Rat IgG2a, κ İzotip Kontrolü (R35-95; 0.2 mg/mL); BB515 Rat IgG2a, κ İzotip Kontrolü (R35-95; 0.2 mg/mL). Boyama antikor değiştirerek, doğru isotip kullanın. - LN'yi görüntülemek için, antikor karışımının 100 μL'sini alttan iç uyluk içine enjekte edin (Şekil1A). Alternatif olarak, 50 μL'lik antikor karışımını pençe yastığına enjekte ederek popliteal LN (Şekil2A). Hassas 1 mL İnsülin şırıngalar kullanın, (İnsülin U-100) boyutu 0.30 mm × 13 mm (30 gauge × 1/2 inç) iğne ile.
NOT: Inguinal LN boyama enjeksiyonunun subkutan olduğundan ve intraküler (i.m.) olmadığından emin olun, çünkü i.m. uygulaması yapılırsa antikor karışımı düzgün bir şekilde boşaltılmayacaktır. - Antikor karışımı enjeksiyonundan önce hayvanları anestezi etmeyin.
- Organları çıkarmak için en az 3 saat (inguinal dLN) ve 12 saat (popliteal dLN) sonrası enjeksiyon için bekleyin.
- LN hücre etiketleme tamamen parlak menekşe veya parlak mavi gibi büyük polimer floresan boyalar kullanılarak gözlenen değilse, alternatif olarak floresan izotiyoyanat (FITC), PE ve allofikokokyanin (APC) dahil olmak üzere küçük floresan kullanın.
3. Inguinal drenaj lenf düğümü kaldırmak için cerrahi prosedür
- Co2 boğulma sıyrık ve ardından servikal çıkış kullanarak ötenazi fareleri.
- Yapışkan bant ile akrilik aşamada fareler immobilize ve kesi etrafında kürk birikimini önlemek için karın derisine bir pamuklu bez ile mineral yağ uygulayın (Şekil1B). Kürk kaldırma gerekli değildir.
- Mikrocerrahi kavisli makas (11,5 cm) ve mikrocerrahi kavisli forceps (12,5 cm) ile pubis'ten ksifoid sürecine kadar mikrocerrahi eğri kesit (Şekil1C)kullanarak orta hat kesisini gerçekleştirin.
- Karın kaslarını deriden ayırın ( Şekil1D).
- Dikey kesi hattının üst ve alt kısmında yatay deri kesileri yapmak ilgi tarafında deri flepleri oluşturmak için (antikor karışımı enjeksiyon tarafına göre) ve lenf düğümü görselleştirmek için cilt flep (Şekil1E).
- Cilt kapağını akrilik plakaya bantlayın (Şekil 1F).
- Mikrocerrahi kavisli forsepsler kullanarak inguinal drenaj lenf düğümü çıkarın (Şekil 1F). Lenf düğümü cilt altında bir transaklı, genellikle bilobular, küre olarak görünür.
4. Popliteal drenaj lenf düğümü kaldırmak için cerrahi prosedür
- Co2 boğulma sıyrık ve ardından servikal çıkış kullanarak ötenazi fareleri.
- Yapışkan bant ile akrilik aşamada eğilimli bir pozisyonda fareler immobilize ve buzağı ve diz bir pamuk lu bez ile mineral yağ uygulayın (Şekil2A-D).
- Topuktan dize kadar baldırda orta hat kesisi gerçekleştirin (Şekil 2E,F).
- Buzağı kaslarını deriden ayırın ( Şekil2F,G).
- Popliteal fossa maruz (Şekil 2G). Popliteal lenf nodu popliteal fossa bir transaklı küre olarak görünür.
- Mikrocerrahi kavisli forseps (Şekil2G)kullanarak popliteal lenf nodünü çıkarın.
- Alternatif olarak, fareyi supine pozisyonunda ters çevirin ve popliteal LN çıkarılması için pazı femoris ve semitendinosus arasındaki popliteal fossa'ya yaklaşArak baldırın topuktan dizine kadar olan kısmı ayrıştırMa deriden kas.
NOT: Popliteal fossa diz ekleminin arkasında bulunan sığ bir depresyondur. Popliteal lenf düğümlerini görmek için dikkatlice açın.
5. Lenf nodu hazırlığı
- Tüm organı cam alt (35 mm x 10 mm) içeren bir kültür kabına yerleştirin ve mikrocerrahi kavisli forceps kullanarak organı çevreleyen yağı çıkarın (Şekil1G-I ve Şekil 2H).
- Yemeğin ortasındaki organı merkezileştirin (Şekil 1J ve Şekil 2H).
- Hassas görev silecekleri bir parça ile organ kapağı ve oda sıcaklığında tuzlu ile ıslatılmış tutmak 0.9% veya Fosfat Tampon Çözeltisi (Şekil1K-M ve Şekil 2H).
NOT: Çıkarıldıktan sonra lenf bezlerinin yıkanması veya kaputta lenf nodunu çıkarılmasının yapılması gerekli değildir.
6. Ex-vivo konfokal mikroskopi (Görüntüleme)
- Petri kabını ters konfokal mikroskop yuvasına yerleştirin (Şekil 1N ve Şekil 2H).
- Bir konfokal mikroskop altında görüntü nns (Şekil 1O ve Şekil 2H).
- İlk olarak, 4x veya 10x hedefi ile konfokal mikroskobun konvansiyonel ışığını kullanarak doğru odak elde edin. Daha sonra ışık fonksiyonundan lazer moduna geçin.
NOT: Konfokal mikroskop 4x nesnel içermiyorsa, odak 10x hedefi kullanılarak mükemmel bir şekilde elde edilebilir. - Bu görsellerde gösterilen görüntülerde kullanılanlar gibi floresan etiketli antikorlardan otofloresan vespesifik olmayan lekeleri gidermek için izotip lekeli, lekeli veya floresan olmayan bir numune (Tablo 1) kullanarak lazer gücünü, mahsup ve kazancını ayarlayın el yazması (BV-421 anti-CD4, BB515 anti-CD19 ve PE anti-F4/80).
- Lenf düğümünde ilgi alanında sırasıyla mikrometrik ve savaş arabası kullanarak Z ve XY pozisyonlarını ayarlayın.
- LN yapısı ve hücresel dağılıma odaklanan 4x, 10x ve 20x hedefleri altında görüntüler edinin. 1024 x 1024 piksel tanımı kullanın.
NOT: Hayvan başına amaç başına farklı alanlarda en az beş görüntü edinin. - Kanalları ayırmak, ölçek ve ilgi çekici renkler eklemek ve 3B görünümü yeniden oluşturmak için görüntü yazılımını kullanarak görüntüleri analiz edin.
Sonuçlar
Bu el yazması, bu organlardaki belirli hücre popülasyonlarını lekelemek için floresan etiketli antikorların enjeksiyonundan sonra yapılarına zarar vermeden inguinal ve popliteal lenf düğümlerini çıkarma tekniklerini göstermektedir (Şekil1 ve Şekil 2 ).
BV421 anti-CD4 ve BB515 anti-CD19 ve konfokal görüntüleme analizi ile LN hücrelerinin immünetiketleme güçlü kombinasyonu inguinal ve popliteal NNs T hücrelerinin lokalizasyonu tanımlanan (CD4+) ve B hücreleri (CD19+). Her iki organda da B hücre folikülleri T hücre popülasyonları ile çevriliydi (Şekil 3, Şekil 4 ve video 1), LN yapısının bir özelliği1. Lenfatik sinüsleri kaplayan fagositlerin enjekte edilen floresan antikorları yakalayıp hücre belirteçlerinin spesifik olmayan etiketlesonuçlenebileceği ihtimalini göz ardı etmek için, ANTIKor karışımına PE anti-F4/80 dahil edildi. Şekil5'te gösterildiği gibi fagositler enjekte edilen antikorları içselleştirmemiş, B ve T hücre boyamanın spesifik olduğunu göstermiştir. Ayrıca,Video 1, T ve B hücre boyamanın örtüşmediğini göstererek boyama özgüllüğünü doğrular.
LN'deki fagositik mononükleer hücrelerin mekansal lokalizasyonunu araştırmak için CX3CR1GFP/+ CCR2RFP/+'dan inguinal ve popliteal LN'ler görüntülendi. Mononükleer hücreler inguinal LN boyunca bulundu, subkapsüler sinüs de dahil olmak üzere. Bu hücrelerin çoğunluğu CX3CR1GFP/+idi, ccr2RFP/+ ve çift pozitif hücreler (sarı) (Şekil6A-F). Popliteal LN'de hücre dağılımı ve hücre fenotiplerinin aynı modeli gözlenmiştir (Şekil 7A-I). Hem inguinal hem de popliteal LN'ler cx3CR1GFP/+ CCR2RFP/+olmaksızın lenfositler tarafından işgal edilen siyah bölgeleri gösterdi. Ayrıca, CX3CR1+ ve CCR2+ hücreleri LN'lerin iç bölgesinde az bulunan ve dış alanda yoğunlaşarak bu hücrelerin öncelikle LN subkapsüler sinüsünü işgal ettiğini göstermektedir (Şekil 6G-I ve Şekil 7J-L). Böylece, önerilen protokol açıkça lenf düğümlerinde mevcut büyük hücre popülasyonları tanımlayabilir.
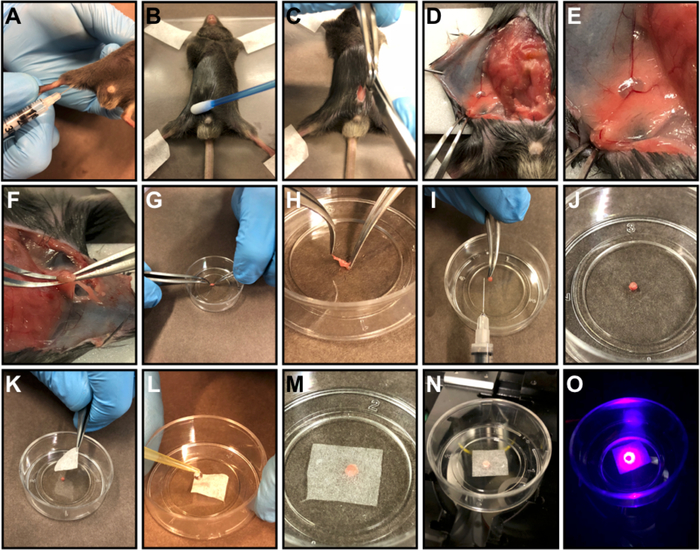
Şekil 1: Inguinal lenf nod hazırlığı.
(A) IÇ uyluk içine FACS antikor ana karışımı subkutan enjeksiyon. (B) enjeksiyondan 3 saat sonra fareyi ötenazi edin, yapışkan bantlı akrilik plaka üzerinde fareyi hareketsiz hale getirin ve kesi çevresinde kürk birikimini önlemek için karın derisine mineral yağ uygulayın. (C) Pubis'ten ksifoid sürecine kadar karında orta hat kesisi yapın. (D) Karın kaslarını deriden ayırın ve deri flebi yapın. (E) Akrilik plaka üzerinde deri kapağı bant. (F) Bir mikrocerrahi kavisli forseps kullanarak inguinal lenf düğümü çıkarın. (G-H) Bir kültür çanak (G) içinde organ yerleştirin ve organ çevreleyen yağ kaldırmak (H). (I) Temizlendikten sonra organ boyutunu gösteren açıklayıcı resim. J-M) Bir petri kabının ortasında organımerkezileştirmek (J), hassas görev silecekleri bir parça ile organ kapağı (K ) ve sıcak ile ıslatılmış tutmak 0.9% salin veya 1x PBS (L,M). (N) Petri kabını mikroskop yuvasına yerleştirin. (O) Organı tazyin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Popliteal lenf nod hazırlığı.
(A, B) PENÇE ped içine FACS antikor ana karışımı subkutan enjeksiyon. (C, D) enjeksiyondan sonra 3 saat, fareyi ötenazi, yapışkan bant (C) ileakrilik bir plaka üzerinde fareimin hareketsizhale getirin ve kesi çevresindeki kürk birikimini önlemek için karın derisine mineral yağ uygulayın (D). (E) Topuktan dizine kadar baldırda orta hat kesiği yapın. (F) Popliteal fossa ortaya çıkarmak. (G) Mikrocerrahi kavisli forsepsler kullanarak popliteal lenf düğümlerini çıkarın. (H) Bir petri kabına organı yerleştirin ve organı çevreleyen yağ kaldırmak, Petri kabının ortasında organ merkezileştirmek, hassas görev silecekleri bir parça ile organ kapağı ve sıcak tuzlu ile ıslatılmış tutmak 0.9% veya 1x PBS. Petri kabını mikroskop yuvasına yerleştirin ve organı tarayıp tlayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
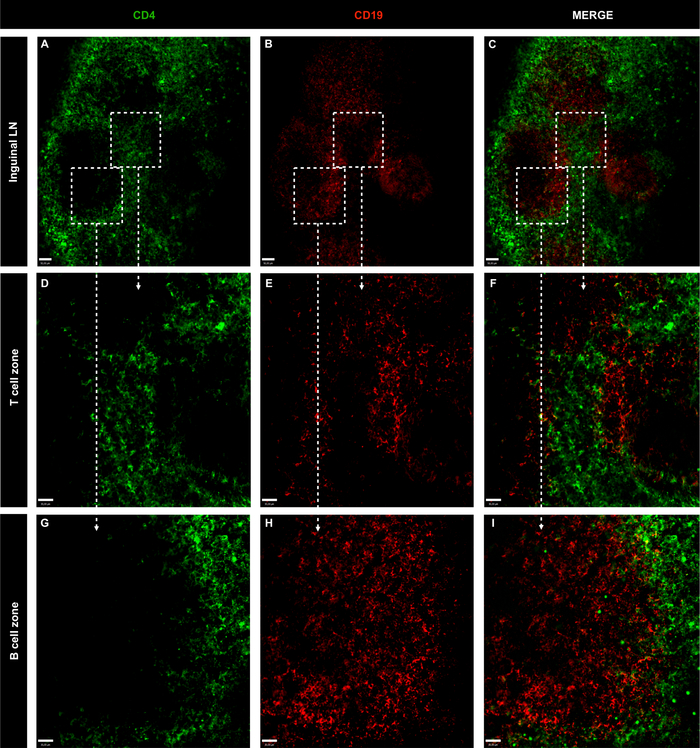
Şekil 3: Bağışıkolmayan naif farelerin bütün inguinal lenf nodlarının temsili konfokal mikroskopi görüntüleri.
(A-C) LN B ve T hücreleri CD4 kullanılarak lekelendi (yeşil; T hücreleri) ve CD19 (kırmızı; B hücreleri); ölçek çubuğu = 50 μm. (D-I) 10x amacı ile belirli bir alanın amplifikasyonu; ölçek çubuğu = 30 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
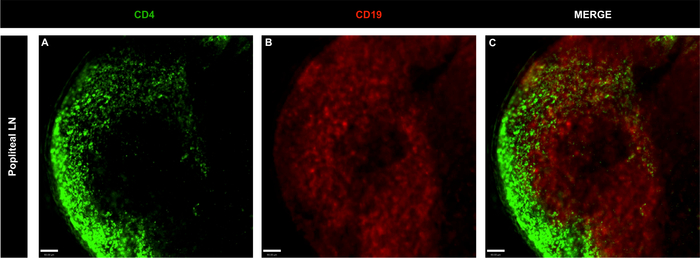
Şekil 4: Aşısız naif farelerin tüm popliteal lenf nodlarının temsili konfokal mikroskopi görüntüleri.
(A-C) LN B ve T hücreleri CD4 kullanılarak lekelendi (yeşil; T hücreleri) ve CD19 (kırmızı; B hücreleri); ölçek çubuğu = 60 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Fagosit gösteren aşısız naif farelerin tüm inguinal lenf nodunun temsili konfokal mikroskopi görüntüleri.
(A-C) LN B ve fagositik hücreler CD19 kullanılarak boyandı (yeşil; B hücreleri) ve F4/80 (mavi; fagositler); ölçek çubuğu = 100 μm; (D-F) LN T ve fagositik hücreler CD3 kullanılarak boyandı (yeşil; T hücreleri) ve F4/80 (beyaz; fagositler); ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
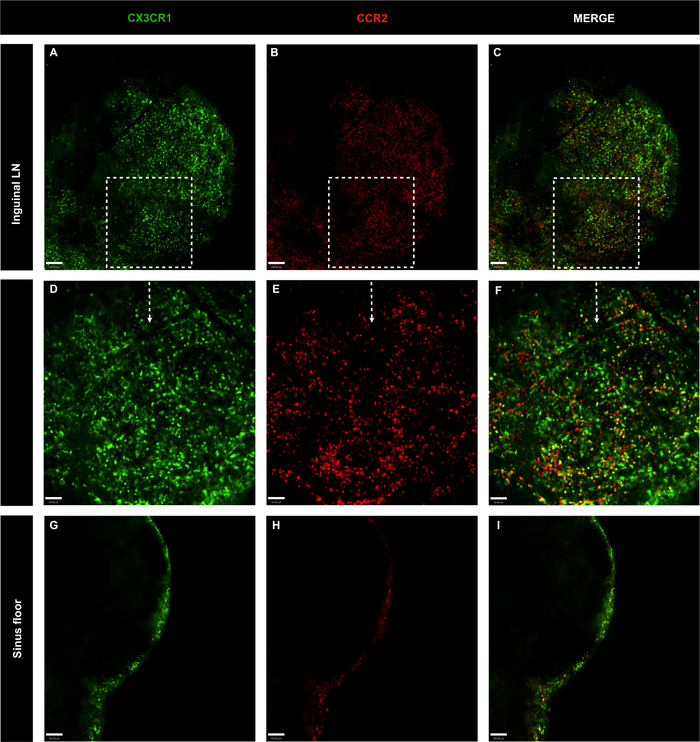
Şekil 6: Genetiği değiştirilmiş CX3CR1'in tüm inguinal lenf nodlarının konfokal mikroskopi görüntüleri GFP/+ CCR2 RFP/+ antikor ana karışımı enjeksiyon olmadan fareler.
(A-C) LN hücre dağılımı CX3CR1 (yeşil) ve CCR2 (kırmızı) ile değerlendirildi; ölçek çubuğu = 100 μm. (D-F) 20x hedefi ile belirli alanın amplifikasyonu; ölçek çubuğu = 50 μm. (G-I) Lenf nodülü sinüs tabanında LN hücre dağılımı; ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
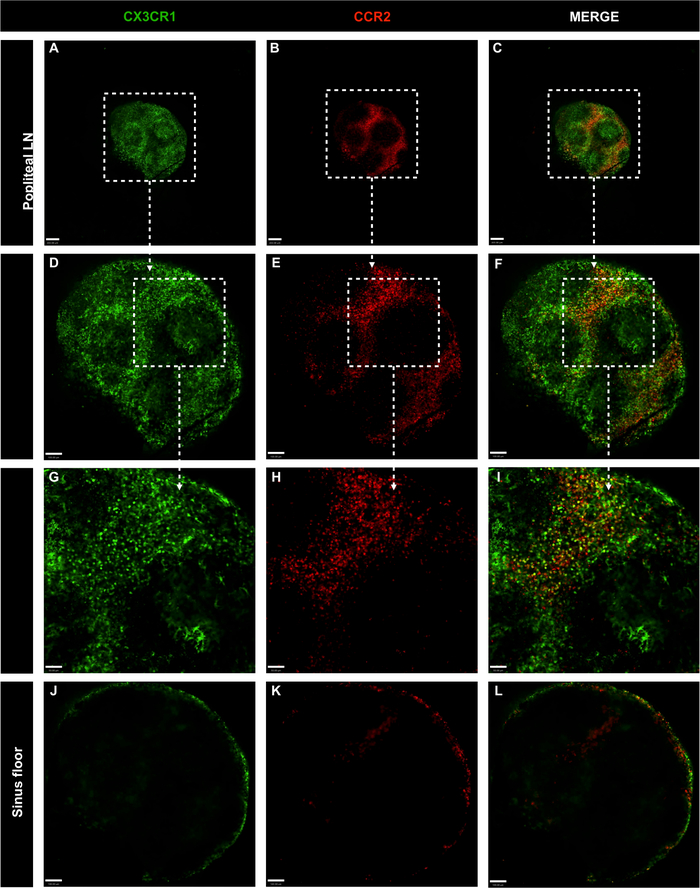
Şekil 7: Genetiği değiştirilmiş CX3CR1'in tüm popliteal lenf nodlarının konfokal mikroskopi görüntüleri GFP/+ CCR2 RFP/+ antikor ana karışımı enjeksiyon olmadan fareler.
(A-C) LN hücre dağılımı CX3CR1 (yeşil) ve CCR2 (kırmızı) ile değerlendirildi; ölçek çubuğu = 200 μm. (D-F) 10x hedefi ile tüm organın amplifikasyonu; ölçek çubuğu = 100 μm. (G-I) 20x hedefi ile belirli alanın amplifikasyonu; ölçek çubuğu = 50 μm. (J-L) Lenf nodülü sinüs tabanında LN hücre dağılımı; ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Video 1: T ve B hücre boyama nın özgüllüğü (İndirmek için sağ tıklatın).
| Lazer | Lazer Gücü | Kazanç | Uzaklık | Iğne deliği |
| 406nm | 20% | 65 | -5 | 60 μm |
| 488nm | 25% | 50 | -5 | 60 μm |
| 561nm | 25% | 65 | -10 | 60 μm |
Tablo 1: Görüntü edinme ayarları.
Tartışmalar
Moleküler biyoloji ve yüksek boyutlu immünofenotiotipleme de dahil olmak üzere diğer teknikler ile görüntüleme kombinasyonu kendi doğal bağlamda bağışıklık hücrelerini araştırmak için yeteneğimizi geliştirdi. Aslında, diğer yaklaşımlar doku sindirimi ve hücre izolasyonu gerektirebilir iken - doku bütünlüğünün kaybına yol açabilir - in vivo veya ex vivo görüntüleme kullanımı coğrafi bir şekilde farklı hücre alt tipleri araştırmada büyük bir avantaj sağlar3 , 16. Hücrelerin özellikle farklı floroforları ifade etmek için hedeflendiği genetiği değiştirilmiş fare suşlarının bulunabilirliğinin hızla artması şaşırtıcı değildir. Daha da önemlisi, muhabir fareler ve antikor karışımı enjeksiyon kombinasyonu aynı organ4farklı hücre popülasyonları in-vivo leke için güçlü bir araçtır. Ayrıca, CRISPR / Cas9 gibi gen düzenleme araçlarının popülerleştirilmesi farklı gruplar hemen hemen her hücre türü şimdi onların iyi niyetli yerde görüntülenebilir bir şekilde fare suşları özelleştirmek için izin verdi17. Bu yaklaşım kullanılarak, farklı hücre tipleri arasındaki mekansal ve işlevsel ilişki derin ayrıntılarla değerlendirilebilir. Ancak, hücre hareketinin veya in vivo dinamik olayların görüntülenmesi zorunlu değilse, daha az karmaşık deneysel bir yaklaşım kullanılabilir. Bu durumda, antikorlar ve problar in vivo olarak teslim edilir ve organ (veya örnek) doğrudan mikroskop içinde görselleştirilir.
Burada doku kriyopreservation ve kriyoselite kullanımını dağıtan ve organ yapılarını potansiyel olarak etkileyebilecek basit bir protokol tanımladık ve in vivo uygulamasından sonra lenf düğümleri içindeki bağışıklık hücrelerinin takdirine izin verdik. floresan etiketli antikorlar. Bu protokoller minimal teknik ve cerrahi beceriler gerektirir ve orijinal konumlarında hemen hemen tüm bağışıklık hücrelerini görselleştirmek için adapte edilebilir. Daha da önemlisi, antikorların bağışıklık yanıtı sırasında antijenlerin ve hücrelerin seyahat ettiği aynı yolları kullanarak lenf düğümlerine ulaşacak şekilde uygulanmasını önerdik. Deri altı uzamda floresan antikorenjekte edilerek, vivo bulunan tüm dokuları ve hemodinamik bariyerleri taklit etmek ve antijen dağılımının kronolojisini tahmin etmek mümkün oldu. Bu uygulamaya ek olarak, floresan etiketli ilaçların biyodağıtımı ve floresan etiketli nano partiküllerin hücre hedefleme çalışmaları için de bu yöntem uygulanabilir ve uygulanabilir.
Ancak, bu yöntemin sınırlamaları vardır. Gerekli antikor miktarı konvansiyonel histoloji yöntemlerine göre daha yüksektir; ancak, konvansiyonel immünoresans mikroskopisi tekniği optimize etmek ve iyi görüntüler elde etmek için doku hazırlama ve boyama birkaç tur gerektirdiğinden, konvansiyonel mikroskopi maliyeti potansiyel yüksek maliyetini aşmak olabilir protokolümüzde kullanılan antikor konsantrasyonu. Sonraki, lenf düğümü içine lenfatik antijen drenaj bilinen özelliklerine göre9,18, etiketleme reaktif boyutu nedeniyle lenfatik vaskülatür mesafe ile hızla azalma olasılığı yüksektir Istihdam. Gerçekten de, bazı görüntülerin siyah alanlar kötü doku penetrasyonu neden olabilir. LN konfokal görüntüleme si ile sadece 40-100 μm derinlik elde edilebilir ve böylece sadece yüzeysel LN bölgeleri görselleştirilebilir. En azından kısmen bu sorunun üstesinden gelmek için bir yolu mikroskop tarafından daha iyi uyarma ve algılama ile floropores kullanmaktır. Başka bir alternatif yaklaşım derin doku görüntüleme için anahtar olmuştur ve konfokal tek foton lazer ile gözlenen şiddetli ışık saçılma sorunları atlatmak için gösterilmiştir yakın kızılötesi uyarma dalga boyu ile multifoton lazer mikroskobu kullanmaktır mikroskopi19. Vivo olarak getirilen antikorlarla boyanmış görüntüleme hücrelerinde sadece hücre yüzeyinde ifade edilen antijenler hedeflenebilir. Kullanılan antikorlar henüz doğrulanmadıysa, otofloresansı dışlamak ve etiketlemeyi doğrulamak için karşılık gelen bir isotip kontrol boyaması yapmak kritik hale gelir. Bu aynı hayvan, yani, hücre hedefleyen antikor karışımı ipsilaterally enjekte ve izotip kontrol karışımı kontrlaterally enjekte yapılabilir. Buna ek olarak, bir hücreyi verimli bir şekilde in vivo lekelemek için gerekli antikor miktarı deneyler ve hücre hatları arasında farklılık gösterebilir ve bu sınırlama için alternatif bir yaklaşım genetik hedefli floresan ekspresyonu kullanmaktır.
Sonuç olarak, doku mimari bütünlüğünü koruyan, tekrarlanabilir, kolay gerçeklebilen ve konvansiyonel konfokal mikroskopların kullanılmasını sağlayan tüm lenf nodu görüntülemesi için yeni bir protokol öneriyoruz. Bu teknik, basit yöntemlerin düzenli laboratuvar yapılarının bağışıklık sistemi araştırmalarında önemli ilerlemeler sağlayan poli-fonksiyonel platformlar olarak çalışmasına nasıl olanak sağlayacağını göstermektedir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma NIH (R01 AI43458 - H.L.W.) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BV421 anti-CD4 | BD Horizon | 562891 | GK1.5; 0.2 mg mL-1 |
| BB515 anti-CD19 | BD Horizon | 564509 | 1D3; 0.2 mg mL-1 |
| BB515 Rat IgG2a, κ Isotype Control | BD Horizon | 564418 | R35-95; 0.2 mg mL-1 |
| BV421 Mouse IgG2b, K Isotype Control | BD Horizon | 562603 | R35-38 0.2 mg mL-1 |
| Cellview culture dish | Greiner-Bio | 627861 | 35x10 mm with glass bottom |
| Insulin syringes | BD Plastipak | - | Insulin U-100 |
| Kimwipes | Kimtech Science Brand | 7557 | size 21 x 20 cm / 100 sheets per box |
| Microsurgery curved forceps | WEP Surgical Instruments | custom made | 12.5 cm |
| Microsurgery curved scissors | WEP Surgical Instruments | custom made | 11.5 cm |
| Needle | BD PrecisionGlide | - | 30 gauge × ½ inch |
| Nikon Eclipse Te + A1R confocal head | Nikon | - | loaded with main 4 laser lines (405, 488, 543 and 647 nm) |
| PE anti-F4/80 | BD Pharmigen | 565410 | T45-2342; 0.2 mg mL-1 |
| PE Rat IgG2a, κ Isotype Control | BD Pharmigen | 553930 | R35-95; 0.2 mg mL-1 |
| Zeiss LSM 710 confocal microscope | Zeiss | - | loaded with main 4 laser lines (405, 488, 543 and 647 nm) |
Referanslar
- Willard-Mack, C. L. Normal structure, function, and histology of lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Tas, J. M., et al. Visualizing antibody affinity maturation in germinal centers. Science. 351, 1048-1054 (2016).
- David, B. A., et al. Combination of Mass Cytometry and Imaging Analysis Reveals Origin, Location, and Functional Repopulation of Liver Myeloid Cells in Mice. Gastroenterology. 151, 1176-1191 (2016).
- Rezende, R. M., et al. gammadelta T cells control humoral immune response by inducing T follicular helper cell differentiation. Nature Communications. 9, 3151 (2018).
- Nakagaki, B. N., et al. Generation of a triple-fluorescent mouse strain allows a dynamic and spatial visualization of different liver phagocytes in vivo. Anais da Academia Brasileira de Ciencias. 91 (suppl 1), e20170317 (2019).
- Ajami, B., et al. Single-cell mass cytometry reveals distinct populations of brain myeloid cells in mouse neuroinflammation and neurodegeneration models. Nature Neuroscience. 21, 541-551 (2018).
- Becher, B., et al. High-dimensional analysis of the murine myeloid cell system. Nature Immunology. 15, 1181-1189 (2014).
- McElroy, M., et al. Fluorescent LYVE-1 antibody to image dynamically lymphatic trafficking of cancer cells in vivo. Journal of Surgical Research. 151, 68-73 (2009).
- Gerner, M. Y., Casey, K. A., Kastenmuller, W., Germain, R. N. Dendritic cell and antigen dispersal landscapes regulate T cell immunity. The Journal of Experimental Medicine. 214, 3105-3122 (2017).
- Hauser, A. E., et al. Definition of germinal-center B cell migration in vivo reveals predominant intrazonal circulation patterns. Immunity. 26, 655-667 (2007).
- Allen, C. D., Okada, T., Tang, H. L., Cyster, J. G. Imaging of germinal center selection events during affinity maturation. Science. 315, 528-531 (2007).
- Arnon, T. I., Horton, R. M., Grigorova, I. L., Cyster, J. G. Visualization of splenic marginal zone B-cell shuttling and follicular B-cell egress. Nature. 493, 684-688 (2013).
- Sipkins, D. A., et al. In vivo imaging of specialized bone marrow endothelial microdomains for tumour engraftment. Nature. 435, 969-973 (2005).
- Cinamon, G., Zachariah, M. A., Lam, O. M., Foss, F. W., Cyster, J. G. Follicular shuttling of marginal zone B cells facilitates antigen transport. Nature Immunology. 9, 54-62 (2008).
- Pereira, J. P., An, J., Xu, Y., Huang, Y., Cyster, J. G. Cannabinoid receptor 2 mediates the retention of immature B cells in bone marrow sinusoids. Nature Immunology. 10, 403-411 (2009).
- Nakagaki, B. N., et al. Immune and metabolic shifts during neonatal development reprogram liver identity and function. Journal of Hepatology. (6), 1294-1307 (2018).
- Wang, H., La Russa, M., Qi, L. S. CRISPR/Cas9 in Genome Editing and Beyond. Annual Review of Biochemistry. 85, 227-264 (2016).
- Roozendaal, R., et al. Conduits mediate transport of low-molecular-weight antigen to lymph node follicles. Immunity. 30, 264-276 (2009).
- Sarder, P., et al. All-near-infrared multiphoton microscopy interrogates intact tissues at deeper imaging depths than conventional single- and two-photon near-infrared excitation microscopes. Journal of Biomedical Optics. 18, 106012 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır