Method Article
使用前 Vivo 共聚焦显微镜可视化淋巴节点结构和细胞定位
摘要
该协议描述了一种在不改变器官结构的情况下在排空淋巴结中成像不同细胞群的技术。
摘要
淋巴结(LUN)是体内传播的器官,与先天免疫反应可以连接适应性免疫。事实上,LN战略性地插在淋巴血管的路径中,允许组织抗原与LN中所有常驻免疫细胞亲密接触。因此,使用外体全LN成像了解细胞组成、分布、位置和相互作用,将增进有关人体如何协调局部和全身免疫反应的知识。该协议显示了在体内给荧光标记抗体进行体内给药后,使用传统的共聚焦显微镜和库存试剂,允许非常可重复且易于执行的方法的体外成像策略。通过皮下抗体注射,可以在排空LUN中标记不同的细胞群,而不影响可能由传统免疫荧光显微镜技术破坏的组织结构。
引言
淋巴结 (Lun) 是卵形器官,广泛存在于全身,具有桥接先天和自适应免疫反应的关键功能。LUN过滤淋巴,以识别外来颗粒和癌细胞,以对它们进行免疫反应1。抗原呈现细胞(ApCs),T细胞和B细胞一起产生抗原特异性抗体(体液免疫)和细胞毒性淋巴细胞(细胞免疫),以消除外来颗粒和癌细胞2。因此,了解淋巴系统中免疫细胞的动态对疫苗开发和癌症免疫治疗具有重要影响。
强大的显微镜的出现-包括新的共聚焦和超分辨率显微镜-使一个非凡的进步,在理解不同的免疫细胞群体如何在他们的原生环境中如何运行3。现在,可以使用与转基因小鼠结合探针,在特定靶点4、5的控制下表达荧光蛋白,可以成像几个同时发生的细胞亚型。事实上,高维技术,包括大规模细胞学和多参数流分析,对于扩大我们对健康和疾病中不同免疫细胞的分块和功能的知识至关重要。7.然而,为了准备这些技术的样本,组织需要消化,细胞从自然环境中分离出来,在细胞悬浮液中进行分析。为了超越这些限制,并允许生物学更好的翻译,这里提出的协议的目标是应用一个简单的方法,使用库存共聚焦显微镜图像外整个淋巴结,有利于提高速度,组织与传统的免疫荧光染色相比,结构保存和细胞存活。通过这种方法,我们能够证明缺乏β-T细胞的小鼠,一种参与宿主早期防御病原体4的T淋巴细胞的亚型,与野生型小鼠相比,已经破坏了毛囊和T细胞区。这些发现使我们能够进行一项研究,其中我们证明βT细胞在淋巴器官平衡和体液免疫反应4中起关键作用。此外,该协议为探针和抗体到达淋巴结提供了一个生理途径,因为它们在原位标记使用的报告的基础上,通过组织淋巴环流进行皮下施用并消散与抗体可视化淋巴相关结构8,9, 芽中心动力学10,11,12,和目标容易进入血流13 ,14,15.
研究方案
该协议由哈佛医学院动物常设委员会和布里格姆妇女医院批准,协议2016N000230。
1. 用于实验的老鼠
- 在B6背景上使用8周大的雄性小鼠和雌性小鼠进行抗体混合。
- 使用 CX3CR1GFP/WTCCR2RFP/WT小鼠确定是否也可以将前体全 LN 成像应用于报告小鼠,而无需施用抗体混合物,并调查是否存在单核细胞,包括抗原呈现细胞和噬菌体,及其在LN中的分布。
注:CX3CR1GFP/WTCCR2RFP/WT报告小鼠分别在 CX3CR1 和 CCR2 启动子的控制下插入绿色荧光蛋白 (GFP) 和红色荧光蛋白 (RFP)。报告小鼠可使用抗体混合物或不注射抗体混合物。请参阅参考4,了解在报告小鼠中注射抗体混合物。如果没有注射抗体,继续手术。
2. 抗体混合制剂和注射
注: 对步骤 1.1 中描述的小鼠执行这些步骤。
- 稀释 1:10 的亮紫罗兰 (BV) 421 抗 CD4 (GK1.5; 0.2 毫克/升/升,1:10 的亮蓝色 (BB) 515 抗 CD19 (1D3; 0.2 mg/mL) 和 1:20 的植物性二青素 (PE) 抗 F4/80 (T45-2342; 0.2 mg/mL) 在 PBS 与适当的最终体积注入内大腿 (到图像内兆)或到爪垫(图像爆裂)淋巴。
注:用作等型:BV421鼠标IgG2b,k等型控制(R35-38;0.2毫克/升/ 升);PE 大鼠 IgG2a, + 等型控制 (R35-95; 0.2 mg/mL);BB515 大鼠 IgG2a, β 等型控制 (R35-95; 0.2 mg/mL)。如果更改染色抗体,请使用正确的等型。 - 要成像内侧LN,将100μL的抗体分皮混合到大腿内侧(图1A)。或者,将50μL的抗体混合物皮下注射到爪垫中,以成像波石LN(图2A)。使用细腻的 1 mL 胰岛素注射器(胰岛素 U-100)与大小为 0.30 mm × 13 mm(30 规格 = 1/2 英寸)的针头配合使用。
注:确保注射用于宫内LN染色的注射是皮下而不是肌肉内(即),因为如果进行i.m.给药,抗体混合物不会正确排出。 - 在抗体混合注射前,不要对动物进行麻醉。
- 等待至少 3 小时 (内分 dLN) 和 12 h (波石 dLN) 注射后,以删除器官。
- 如果使用大聚合物荧光染料(如亮紫色或亮蓝色)未完全观察到 LN 细胞标记,请使用较小的荧光团,包括氟素异氰酸酯 (FITC)、PE 和异氰酸酯 (APC) 作为替代品。
3. 切除淋巴结的手术程序
- 使用CO2窒息对小鼠实施安乐死,然后进行宫颈脱位。
- 用胶带固定丙烯酸舞台上的老鼠,用棉签涂抹矿物油,防止切口周围毛皮沉积(图1B)。无需去除毛皮。
- 使用显微外科弧形剪刀 ( 11 . 5 厘米 ) 和显微手术弯曲钳 ( 12 . 5 厘米 ) 在腹部执行中线切口 ( 从到西风过程 (图 1C) 。
- 将腹部肌肉与皮肤分离(图1D)。
- 在垂直切口线的顶部和底部进行水平皮肤切口,在感兴趣的一侧创建皮瓣(根据抗体混合注射的一侧),并拍打皮肤以可视化淋巴结(图1E)。
- 将皮片贴在丙烯酸板上(图1F)。
- 使用显微手术弯曲钳去除淋巴结(图1F)。淋巴结将显示为皮肤下的一个变形球体,通常是双叶球体。
4. 切除排泄淋巴结的手术程序
- 使用CO2窒息对小鼠实施安乐死,然后进行宫颈脱位。
- 用胶带固定在丙烯酸舞台上的易发位置的小鼠,并在小腿和膝盖上涂抹棉签矿物油(图2A-D)。
- 在小腿上执行从脚跟到膝盖的中线切口(图2E,F)。
- 将小牛肌肉从皮肤上分离(图2F,G)。
- 露出波石叶 (图 2G).波石淋巴结将作为透明球体出现在波石叶中。
- 使用显微手术弯曲钳去除爆裂淋巴结(图2G)。
- 或者,将鼠标放在上半位置,通过执行从脚跟到膝盖的小腿中线切口,然后切除小腿,接近二头肌和半直肠之间的浮游生物肌肉从皮肤。
注:Popliteal fossa 是位于膝关节后部的浅凹陷。仔细打开以查看波晶淋巴结。
5. 淋巴节点准备
- 将整个器官放在玻璃底部(35 毫米 x 10 毫米)的培养盘中,并使用显微手术弯曲钳去除器官周围的脂肪(图1G-I和图 2H)。
- 集中在菜的中间的器官(图1J和图2H)。
- 用一块细腻的任务雨刷器盖住器官,并用室温盐水0.9%或磷酸盐缓冲液浸泡(图1K-M和图2H)。
注: 拆卸后无需清洗淋巴结或执行罩内淋巴结提取。
6. 前活体共聚焦显微镜(成像)
- 将培养皿置于倒置共聚焦显微镜插槽中(图1N和图2H)。
- 共聚焦显微镜下的图像LUN(图1O和图2H)。
- 首先,使用具有4倍或10倍目标的共聚焦显微镜的常规光获得正确的对焦。然后从光功能更改为激光模式。
注:如果共聚焦显微镜不包含4倍物镜,则可以使用10倍物镜完美地获得对焦。 - 使用同型染色、非染色或非荧光样品(表 1)调整激光功率、偏移和增益,以去除荧光标记抗体中的自荧光和未特异性染色,如图像中使用的抗体所示手稿(BV-421 抗 CD4、BB515 抗 CD19 和 PE 抗 F4/80)。
- 分别使用显微测量和战车在淋巴结的感兴趣区域调整Z和XY位置。
- 获取 4x、10x 和 20x 目标下的图像,专注于 LN 结构和蜂窝分布。使用 1024 x 1024 像素定义。
注:每个动物在不同场中至少获取五个图像。 - 使用图像软件分析图像以分隔通道、添加感兴趣的比例和颜色以及重建 3D 视图。
结果
本手稿展示了在注射荧光标记抗体以染色这些器官的特定细胞群后,在不破坏其结构的情况下去除淋巴结的技术(图1和图2).
LN细胞与BV421抗CD4和BB515抗CD19和共聚焦成像分析的免疫标记的强大组合,定义了T细胞(CD4+)和B细胞(CD19+)在铀素和波普利特LN中的定位。在两个器官中,B细胞卵泡被T细胞群包围(图3,图4和视频1),这是LN结构1的标志。为了排除淋巴窦内方的噬菌体可以捕获注射的荧光抗体并导致细胞标记的非特异性标记的可能性,在抗体混合物中包括PE抗F4/80。如图5所示,方细胞没有内化注入的抗体,表明B细胞和T细胞染色是特异性的。此外,视频1显示T和B细胞染色没有重叠,证实了染色的特异性。
为了研究LN、CX3CR1GFP/+ CCR2RFP/+中方格单核细胞的空间定位。因此,对LN、内古核和波普利特LN进行了成像。单核细胞在整个内腔LN,包括下囊鼻腔。这些细胞大部分是CX3CR1GFP/+,其次是CCR2RFP/+和双阳性细胞(黄色)(图6A-F)。在白细胞LN(图7A-I)中观察到相同的细胞分布和细胞表型模式。内阴和波普利特LN都显示黑色区域没有CX3CR1GFP/* CCR2RFP/+,这是由淋巴细胞占据。此外,CX3CR1+ 和 CCR2+ 细胞在 LUN 的内部区域中稀缺,并且集中在外部区域,这表明这些细胞主要占据 LN 亚囊鼻腔 (图 6G-I和图 7J-L)。因此,建议的协议可以明确定义淋巴结中存在的主要细胞群。
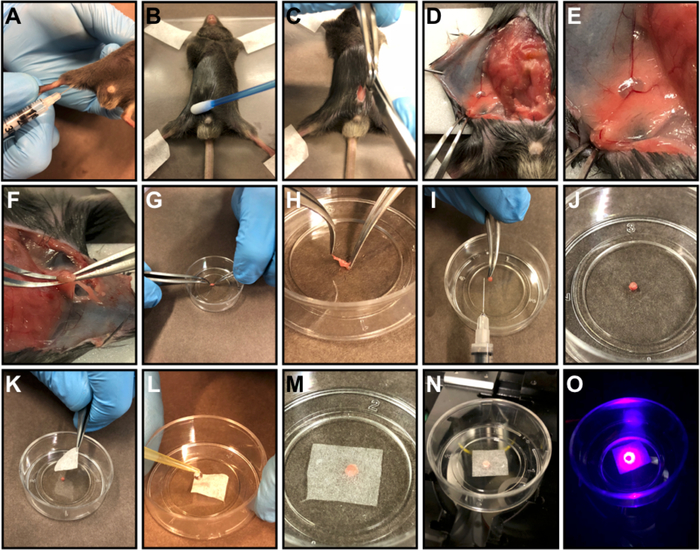
图1:淋巴结制备。
(A) FACS抗体主混合物的皮下注射到大腿内侧。(B) 注射后3小时,对小鼠实施安乐死,用胶带固定小鼠在丙烯酸板上,并将矿物油涂在腹部皮肤上,防止切口周围毛皮沉积。(C) 在腹部进行从到西游乐过程的中线切口。(D) 将腹部肌肉从皮肤上分离,并做皮瓣。(E) 在丙烯酸板上用胶带将皮片胶带。(F) 使用显微手术弯曲钳切除淋巴结。(G-H)将器官放入培养皿 (G) 并去除器官周围的脂肪 (H)。(I) 显示清洁后器官大小的插图图片。J-M) 将器官集中到培养皿 (J) 的中间,用一块精致的任务雨刷器 (K)盖住器官,并用热的 0.9% 盐水或 1x PBS(L、 M) 浸泡。(N) 将培养皿放在显微镜槽中。(O) 扫描器官.请点击此处查看此图的较大版本。

图2:波晶淋巴结制备。
(A, B)下皮注射FACS抗体主混合物到爪垫。(C, D) 注射后 3 小时,对小鼠实施安乐死,用胶带 (C )固定小鼠在丙烯酸板上,并将矿物油涂抹在腹部皮肤上,以防止切口 (D ) 周围毛皮沉积。(E) 在小腿上进行从脚跟到膝盖的中线切口。(F) 露出浮叶。(G) 使用显微外科弯曲的钳子去除波岩淋巴结。(H) 将器官放入培养皿中,去除器官周围的脂肪,将器官集中到培养皿中间,用一块精致的任务雨刷器盖住器官,并用0.9%或1x PBS浸泡。将培养皿放在显微镜槽中并扫描器官。请点击此处查看此图的较大版本。
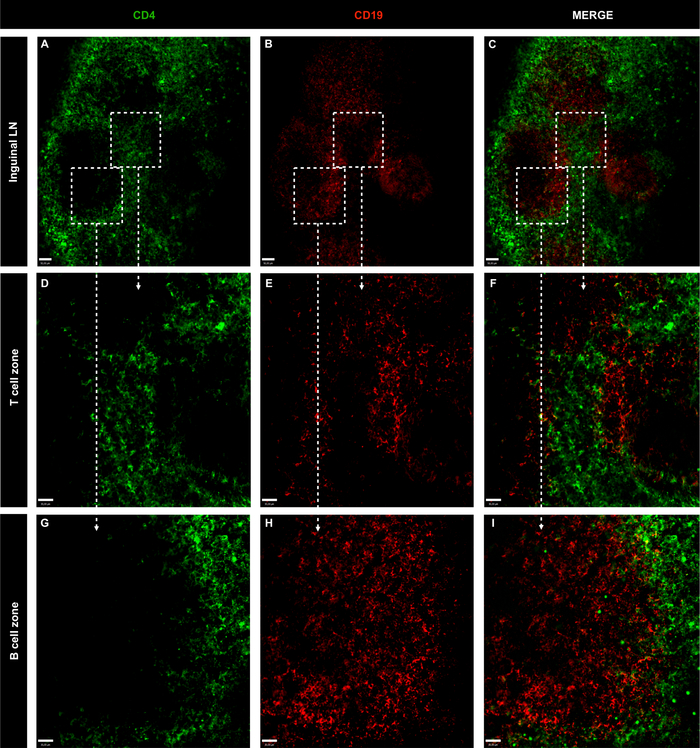
图3:非免疫性幼鼠全淋巴结的代表性共聚焦显微镜图像。
(A-C)使用 CD4 染色 LN B 和 T 细胞(绿色;T 细胞)和 CD19(红色;B细胞);刻度条 = 50 μm。(D-I)以10倍目标放大特定区域;刻度条 = 30 μm。请点击此处查看此图的较大版本。
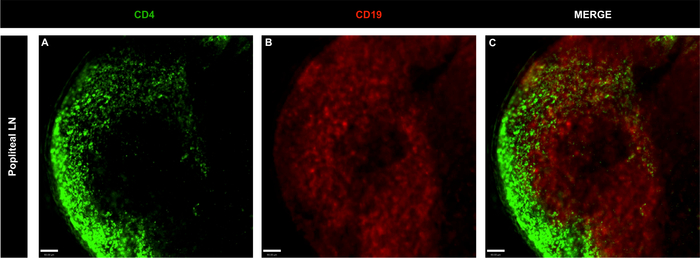
图4:非免疫性幼鼠全波普莱特淋巴结的代表性共聚焦显微镜图像。
(A-C)使用 CD4 染色 LN B 和 T 细胞(绿色;T 细胞)和 CD19(红色;B细胞);刻度条 = 60 μm。请点击此处查看此图的较大版本。

图5:显示噬菌细胞的非免疫幼鼠全肠淋巴结的代表性共聚焦显微镜图像。
(A-C)使用CD19(绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色;绿色B细胞)和F4/80(蓝色;方细胞);刻度条 = 100 μm;(D-F)LN T 和噬菌体细胞使用 CD3 染色(绿色;T细胞)和F4/80(白色;噬细胞);刻度条 = 100 μm。请点击此处查看此图的较大版本。
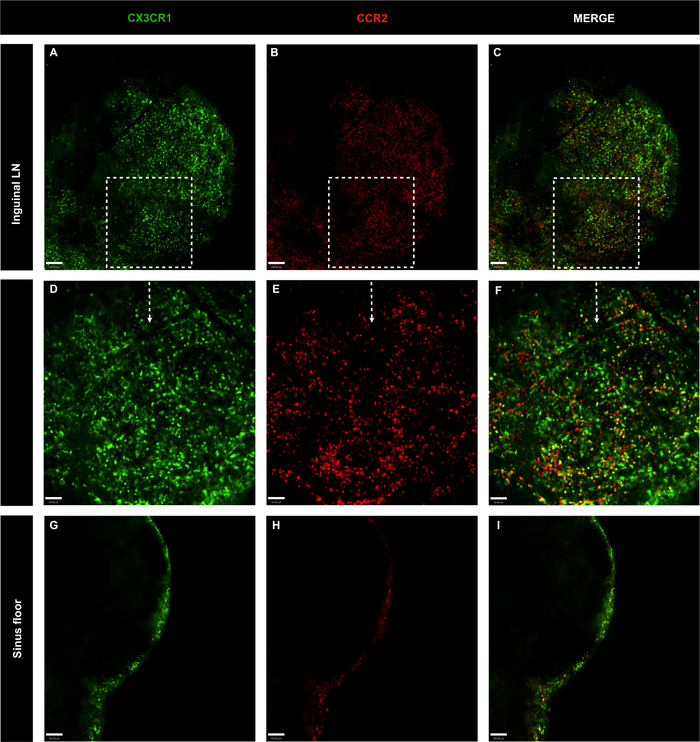
图6:转基因CX3CR1全淋巴结的共聚焦显微镜图像GFP/*CCR2RFP/*没有抗体主混合注射的小鼠。
(A-C)使用 CX3CR1(绿色)和 CCR2(红色)评估 LN 细胞分布;刻度条 = 100 μm。(D-F)以20倍目标放大特定区域;刻度条 = 50 μm。(G-I)淋巴结鼻孔底的LN细胞分布;刻度条 = 100 μm。请点击此处查看此图的较大版本。
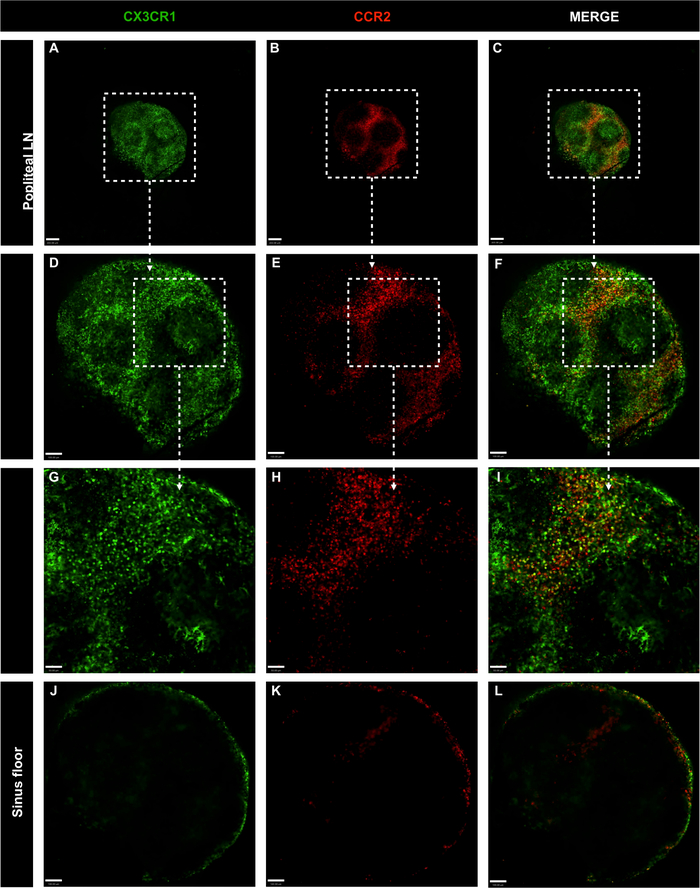
图7:转基因CX3CR1全波普莱特淋巴结的共聚焦显微镜图像GFP/*CCR2RFP/*没有抗体主混合注射的小鼠。
(A-C)使用 CX3CR1(绿色)和 CCR2(红色)评估 LN 细胞分布;刻度条 = 200 μm。(D-F)以10倍目标扩增整个器官;刻度条 = 100 μm。(G-I)以20倍目标放大特定区域;刻度条 = 50 μm。(J-L)淋巴结鼻孔底的LN细胞分布;刻度条 = 100 μm。请点击此处查看此图的较大版本。

视频1:T和B细胞染色的特异性(右键单击下载)。
| 激光 | 激光功率 | 获得 | 抵消 | 针孔 |
| 406纳米 | 20% | 65 | -5 | 60μm |
| 488纳米 | 25% | 50 | -5 | 60μm |
| 561纳米 | 25% | 65 | -10 | 60μm |
表 1:图像采集设置。
讨论
成像与其他技术(包括分子生物学和高维免疫分型)的结合增强了我们在其原生环境中研究免疫细胞的能力。事实上,虽然其他方法可能需要组织消化和细胞分离(这可能导致组织完整性的丧失),但使用体内或前体成像在以地理方式调查不同细胞亚型方面具有很大优势3,16.转基因小鼠菌株的可得性迅速增加,这种菌株专门针对细胞表达不同的荧光。重要的是,报告小鼠和抗体混合物的注射是在同一器官4中染色体内不同细胞群的有力工具。此外,像CRISPR/Cas9这样的基因编辑工具的普及使得不同的群体能够自定义他们的小鼠菌株,几乎任何细胞类型都可以在其真实位置17中成像。使用这种方法,可以深入详细地评估不同细胞类型之间的空间和功能关系。然而,如果细胞运动或体内动态事件的成像不是强制性的,可以使用不太复杂的实验方法。在这种情况下,抗体和探针在体内传递,器官(或样品)在显微镜中直接可视化。
在这里,我们描述了一个简单的协议,分配使用组织冷冻保存和冷冻切片,可能影响器官结构,并允许在体内管理后淋巴结内的免疫细胞的升值荧光标记抗体。这些协议要求最少的技术和手术技能,并可以适应可视化几乎任何免疫细胞在其原始位置。重要的是,我们建议,抗体的施用方式应使抗体使用抗原和细胞在免疫反应期间传播的相同途径到达淋巴结。通过在皮下空间注射荧光抗体,可以模拟体内发现的所有组织和血液动力学屏障,并估计抗原消散的年代。除此应用外,该方法还可用于荧光标记药物的生物分布和荧光标记纳米粒子的细胞靶向研究。
但是,此方法存在限制。所需的抗体量比传统组织学方法高;然而,由于传统的免疫荧光显微镜需要几轮组织制备和染色,以优化技术并获得良好的图像,传统显微镜的成本可以潜在地克服高成本在我们的协议中采用的抗体浓度。其次,根据淋巴抗原引入淋巴结9、18的已知特性,由于标签试剂的大小,标签效率可能会随着与淋巴血管的距离而迅速降低。就业。事实上,某些图像中的黑色区域可能是由于组织渗透不良造成的。LN的共聚焦成像只能达到40-100μm的深度,因此只能显示表面LN区域。至少部分克服此问题的一种方法是使用具有更好的激发和显微镜检测的荧光光。另一种方法是使用具有近红外激发波长的多光子激光显微镜,这是深组织成像的关键,并且已被证明能够避免使用共聚焦单光子激光观察到的严重光散射问题显微镜19.对于在体内传递的抗体染色的成像细胞,只能针对细胞表面表达的抗原。如果所使用的抗体尚未验证,则执行相应的等型控制染色以排除自荧光并验证标签至关重要。这可以在同一动物中执行,即细胞靶向抗体混合物注射益西经和等型对照混合注射反向。此外,有效染色体内细胞所需的抗体量可能因实验和细胞系而异,而这种限制的另一种方法是使用遗传靶向荧光表达。
最后,我们提出了一种全淋巴结成像的新方案,它保持了组织结构的完整性,可重复,易于执行,并使用传统的共聚焦显微镜。该技术演示了简单方法如何允许常规实验室结构作为多功能平台工作,从而在免疫系统研究方面取得重大进展。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NIH(R01 AI43458至H.L.W.)的支持。
材料
| Name | Company | Catalog Number | Comments |
| BV421 anti-CD4 | BD Horizon | 562891 | GK1.5; 0.2 mg mL-1 |
| BB515 anti-CD19 | BD Horizon | 564509 | 1D3; 0.2 mg mL-1 |
| BB515 Rat IgG2a, κ Isotype Control | BD Horizon | 564418 | R35-95; 0.2 mg mL-1 |
| BV421 Mouse IgG2b, K Isotype Control | BD Horizon | 562603 | R35-38 0.2 mg mL-1 |
| Cellview culture dish | Greiner-Bio | 627861 | 35x10 mm with glass bottom |
| Insulin syringes | BD Plastipak | - | Insulin U-100 |
| Kimwipes | Kimtech Science Brand | 7557 | size 21 x 20 cm / 100 sheets per box |
| Microsurgery curved forceps | WEP Surgical Instruments | custom made | 12.5 cm |
| Microsurgery curved scissors | WEP Surgical Instruments | custom made | 11.5 cm |
| Needle | BD PrecisionGlide | - | 30 gauge × ½ inch |
| Nikon Eclipse Te + A1R confocal head | Nikon | - | loaded with main 4 laser lines (405, 488, 543 and 647 nm) |
| PE anti-F4/80 | BD Pharmigen | 565410 | T45-2342; 0.2 mg mL-1 |
| PE Rat IgG2a, κ Isotype Control | BD Pharmigen | 553930 | R35-95; 0.2 mg mL-1 |
| Zeiss LSM 710 confocal microscope | Zeiss | - | loaded with main 4 laser lines (405, 488, 543 and 647 nm) |
参考文献
- Willard-Mack, C. L. Normal structure, function, and histology of lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Tas, J. M., et al. Visualizing antibody affinity maturation in germinal centers. Science. 351, 1048-1054 (2016).
- David, B. A., et al. Combination of Mass Cytometry and Imaging Analysis Reveals Origin, Location, and Functional Repopulation of Liver Myeloid Cells in Mice. Gastroenterology. 151, 1176-1191 (2016).
- Rezende, R. M., et al. gammadelta T cells control humoral immune response by inducing T follicular helper cell differentiation. Nature Communications. 9, 3151 (2018).
- Nakagaki, B. N., et al. Generation of a triple-fluorescent mouse strain allows a dynamic and spatial visualization of different liver phagocytes in vivo. Anais da Academia Brasileira de Ciencias. 91 (suppl 1), e20170317 (2019).
- Ajami, B., et al. Single-cell mass cytometry reveals distinct populations of brain myeloid cells in mouse neuroinflammation and neurodegeneration models. Nature Neuroscience. 21, 541-551 (2018).
- Becher, B., et al. High-dimensional analysis of the murine myeloid cell system. Nature Immunology. 15, 1181-1189 (2014).
- McElroy, M., et al. Fluorescent LYVE-1 antibody to image dynamically lymphatic trafficking of cancer cells in vivo. Journal of Surgical Research. 151, 68-73 (2009).
- Gerner, M. Y., Casey, K. A., Kastenmuller, W., Germain, R. N. Dendritic cell and antigen dispersal landscapes regulate T cell immunity. The Journal of Experimental Medicine. 214, 3105-3122 (2017).
- Hauser, A. E., et al. Definition of germinal-center B cell migration in vivo reveals predominant intrazonal circulation patterns. Immunity. 26, 655-667 (2007).
- Allen, C. D., Okada, T., Tang, H. L., Cyster, J. G. Imaging of germinal center selection events during affinity maturation. Science. 315, 528-531 (2007).
- Arnon, T. I., Horton, R. M., Grigorova, I. L., Cyster, J. G. Visualization of splenic marginal zone B-cell shuttling and follicular B-cell egress. Nature. 493, 684-688 (2013).
- Sipkins, D. A., et al. In vivo imaging of specialized bone marrow endothelial microdomains for tumour engraftment. Nature. 435, 969-973 (2005).
- Cinamon, G., Zachariah, M. A., Lam, O. M., Foss, F. W., Cyster, J. G. Follicular shuttling of marginal zone B cells facilitates antigen transport. Nature Immunology. 9, 54-62 (2008).
- Pereira, J. P., An, J., Xu, Y., Huang, Y., Cyster, J. G. Cannabinoid receptor 2 mediates the retention of immature B cells in bone marrow sinusoids. Nature Immunology. 10, 403-411 (2009).
- Nakagaki, B. N., et al. Immune and metabolic shifts during neonatal development reprogram liver identity and function. Journal of Hepatology. (6), 1294-1307 (2018).
- Wang, H., La Russa, M., Qi, L. S. CRISPR/Cas9 in Genome Editing and Beyond. Annual Review of Biochemistry. 85, 227-264 (2016).
- Roozendaal, R., et al. Conduits mediate transport of low-molecular-weight antigen to lymph node follicles. Immunity. 30, 264-276 (2009).
- Sarder, P., et al. All-near-infrared multiphoton microscopy interrogates intact tissues at deeper imaging depths than conventional single- and two-photon near-infrared excitation microscopes. Journal of Biomedical Optics. 18, 106012 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。