Method Article
İletim Yetmezliği Mekanizmasını İncelemek Için Bağlı Siyatik Sinir ile In Vivo Tek Lifli Kayıt ve Bozulmamış Dorsal Kök Ganglion Kullanımı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Tek lifli kayıt, merkezi ve periferik sinir sistemleri için geçerli olan etkili bir elektrofizyolojik tekniktir. Bağlı siyatik sinir ile bozulmamış DRG hazırlanması ile birlikte, iletim yetmezliği mekanizması incelenir. Her iki protokol de periferik sinir sisteminin ağrı ile ilişkisini geliştirmek.
Özet
Tek lifli kayıt, merkezi ve periferik sinir sistemlerinde sinir lifleri için özel uygulama nedeniyle son birkaç on yıl içinde klasik ve etkili bir elektrofizyolojik teknik olmuştur. Bu yöntem özellikle dorsal kök gangliyonu için geçerlidir (DRG), hangi sinir süreçlerinin bir sözde-unipolar yapısı sergileyen birincil duyusal nöronlar vardır. Aksonlar boyunca geçen etki potansiyellerinin desenleri ve özellikleri bu nöronlarda kaydedilebilir. Bu çalışmada tam Freund's adjuvan (CFA) tedavi sıçanlarda siyatik sinirlerin iletim yetmezliği gözlemlemek için in vivo tek lif kayıtları kullanır. Altta yatan mekanizma in vivo tek lifli kayıtlar kullanılarak çalışılamayacağından, DRG nöronların yama-kelepçe kayıtları bağlı siyatik sinir ile sağlam DRG preparatları üzerinde gerçekleştirilir. Bu kayıtlar, CFA ile tedavi edilen hayvanlarda DRG nöronlarının hiperpolarizasyon sonrası potansiyelinin (AHP) iletim yetmezliği ile yükselen eğimi arasında pozitif bir korelasyon olduğunu ortaya koymaktadır. In vivo tek lif kayıtları için protokol iletim hızı ölçümü ve bazı hastalıklarda sinir liflerinde anormal koşulların izlenmesi yoluyla sinir liflerinin sınıflandırılması sağlar. Bağlı periferik sinir ile Bozulmamış DRG en fizyolojik koşullarda DRG nöronların aktivitesinin gözlem sağlar. Kesin olarak, bozulmamış DRG'lerin elektrofizyolojik kaydı ile birlikte tek fiber kayıt analjezik süreç sırasında iletim yetmezliğinin rolünü incelemek için etkili bir yöntemdir.
Giriş
Sinir lifleri boyunca bilginin normal iletimi sinir sisteminin normal işlevini garanti eder. Sinir sisteminin anormal işleyişi de sinir liflerinin elektrik sinyali iletiminde yansıtılır. Örneğin, santral demiyelinasyon lezyonlarında demiyelinasyon derecesi, müdahale uygulaması 1'den önce vesonra sinir iletim hızındaki değişikliklerin karşılaştırılması yoluyla sınıflandırılabilir. Bu kalamar devi akson2gibi özel preparatlar dışında, hücre içi sinir lifleri kaydetmek zordur. Bu nedenle, elektrofizyolojik aktivite sadece tek liflerin hücre dışı kayıt yoluyla kaydedilebilir. Klasik elektrofizyolojik yöntemlerden biri olan tek fiber kayıt, diğer tekniklerden daha uzun bir geçmişe sahiptir. Ancak, daha az elektrofizyologlar geniş uygulama rağmen bu yöntemi kavrayan. Bu nedenle, uygun uygulama için tek fiber kayıt için standart protokolün ayrıntılı bir giriş gereklidir.
Çeşitli yama-kelepçe teknikleri modern elektrofizyolojik çalışmaya hakim olmasına rağmen, tek-fiber kayıt hala sinir liflerinin faaliyetlerinin kayıt yeri doldurulamaz bir rol oynar, özellikle lifler ile periferik hissi ile iletim dorsal kök ganglion (DRG) bulunan duyu hücresi gövdesi. Burada tek fiber kayıt kullanmanın avantajı, in vivo fiber kaydının hücre içi ortamda bozulma dan yoksun klinik öncesi modellerde doğal uyaranlara verilen tepkileri kaydetme kapasitesiile uzun bir gözlem süresi sağlamasıdır3 , 4 .
Son yirmi yılda çalışmaların giderek artan sayıda sinir lifleri boyunca karmaşık fonksiyonları inceledi5, ve akson boyunca başarısız sinir impuls iletimi bir devlet olarak tanımlanan iletim yetmezliği, birçok farklı mevcuttu periferik sinirler6,7. Bizim soruşturma iletim yetmezliği varlığı C-lifleri boyunca kalıcı nosiceptive giriş modülasyonu için içsel bir kendi kendine inhibitör mekanizma olarak görev yaptı8. Bu iletim yetmezliği önemli ölçüde hiperaljezi koşulları altında zayıflatılmış4,9. Bu nedenle, iletim yetmezliği dahil faktörleri hedefleme nöropatik ağrı için yeni bir tedavi temsil edebilir. İletim arızasını gözlemlemek için, ateşleme deseni tek fiber kayıt temelinde sırayla deşarj sivri temelinde kaydedilmeli ve analiz edilmelidir.
İletim yetmezliği mekanizmasını iyice anlamak için, akson iletim özelliklerini belirlemek için gereklidir, ya da daha doğrusu, DRG nöronların membran özellikleri, onların sözde unipolar anatomik özelliklerine dayalı. Bu alanda birçok önceki çalışmalar ayrıştırılmış DRG nöronlar üzerinde yapılmıştır10,11, hangi iki engel nedeniyle iletim yetmezliği nin araştırılması için mümkün olmayabilir. İlk olarak, drg nöronlar serbest dissosyasyon sürecinde çeşitli mekanik ve kimyasal yöntemler kullanılır, hangi sağlıksız hücrelere neden olabilir veya nöronların fenotip / özellikleri değiştirmek ve bulguları şaşırtmak. İkinci olarak, bağlı periferik sinirler temelde kaldırılır, ve iletim yetmezliği olayları bu preparatlarda gözlemlenebilir değildir. Bu nedenle, bağlı bir sinir ile bozulmamış DRG nöronların bir hazırlık yukarıda belirtilen engelleri önlemek için geliştirilmiştir.
Protokol
Mevcut protokol, Amerika Birleşik Devletleri Halk Sağlığı Servisi'nin Laboratuvar Hayvanlarının İnsani Bakımı ve Kullanımı Politikası'nı takip etti ve Dördüncü Askeri Tıp Üniversitesi Hayvan Deneyleri Etiği Komitesi protokolü onayladı.
1. Hayvanlar
- 24 Sprague-Dawley fareyi (4-8 haftalık) iki gruba ayırın. 14 sıçandan oluşan bir grupta 100 μL CFA intraplantar enjeksiyon uyarak freund'un adjuvan (CFA) modelini ve 10 sıçandan oluşan başka bir grubu salin ile tedavi ederek üretin.
NOT: Tüm hayvanlar Dördüncü Askeri Tıp Üniversitesi Hayvan Merkezi'nden satın alınmıştır. Yetişkin erkek ve dişi Sprague-Dawley sıçanları (150-200 g) tüm işlemler için kullanıldı ve sıçanlar rastgele kafeslere atandı. Kafes başına iki sıçan, yiyecek ve suya ücretsiz erişim ile sabit bir sıcaklıkta (25 ± 1 °C) 12/12 saatlik bir ışık/karanlık döngüsü altında barındırıldı.
2. In Vivo Tek Fiber Kayıt
- Ameliyat öncesi tüm cerrahi aletleri (neşter, cımbız, oftalmik makas, makas, cam ayıran iğne, dikiş iğnesi, kemik rongeur) hazırlayın ve dezenfekte edin. Normal Ringer'ın hücre dışı çözeltisinin 1 L veya 2 L'sini hazırlayın (mM: NaCl 124, KCl 3, MgSO4 1.3, CaCl2 2, NaHCO3 26, NaH2PO4 1.25, glukoz 15; pH 7.4 ve 305 mOsm). Kullanıma kadar 4 °C'de saklayın.
- Anestezi fareleri. CFA enjeksiyonundan sonraki 3-7 günlerde, deney sırasında hayvanları stabil bir estetik durumda tutmak için karışık çözeltinin intraperitoneal enjeksiyonunu (%1 kloralose ve %17 üretan, 5 mL/kg vücut ağırlığı) kullanın. Göz bebeklerini kontrol ettikten ve ağrı stimülasyonuna yanıt verdikten sonra gerekirse ek anestezi enjeksiyonu uygulayın. Vücut Sıcaklığını 37 °C'ye yakın bir şekilde izleyin ve koruyun.
-
Kayıt için siyatik sinir gövdesinin pozu
- Uyluk sırt kısmında deri ve kas açık kesin. Femoral pazı boyunca künt bir diseksiyon gerçekleştirin. Dikkatle oftalmik makas ve cam ayırma iğnesi kullanarak siyatik sinir gövde izole. Ringer'ın solüsyonu kullanarak dokuyu ıslak tutun.
- Bir ev yapımı metal çember üzerinde hayvan sabit (3 cm uzunluğunda, 2 mm genişliğinde metal çember bir demir tel ile 1 mm çapında) etrafında yuvaya deri dikiş yoluyla. Sıvı banyosu kurmak için deriyi hafifçe yukarı çekin.
- Proksimal tarafta 1 cm siyatik sinir gövdesi açığa alın. Kontrastı artırmak ve ince sinir gövdesini net bir şekilde gözlemlemek için sinir gövdesinin altına küçük kahverengi bir platform yerleştirin. Isı sıvı parafin bir su banyosunda 37 °C ve lif yüzeyinin kurumasını önlemek için sinir gövdesinin üstüne bırakın. Siyatik sinir etrafında pia mater spinalis ve dura mater çıkarın.
-
Kayıt oturumu
- Kayıt elektrotolarak platin filament (29 m çapında) seçin. Isı üzerinde daha kolay kalıp lama için, ve çok sonunda küçük bir kanca oluşturun. Elektrotun gerektiği gibi hareket etmesi için elektrotu bir mikromanipülatöre takın.
- Banyoda, bitişik deri altı dokubir referans elektrot yerleştirin. Spinal dura ve pia mater'ı ayırın. Siyatik siniri kayıt havuzundaki tek bir fibere (15-20 μm çapında) ayırın. Sonra, akson ince bir fascicle almak ve 25x büyütme bir stereoskop altında kayıt elektrot kanca üzerinde akson proksimal ucunu askıya.
NOT: Sadece parçalanmış filamentler kalın olma eğilimindedir ve tek bir birim kaydedilene kadar daha fazla ayırma gerektirir. - Mekanik bir uyarıcı (Von Frey kılları) ve termal uyarıcı (50-55 °C su ile küçük pamuk topu) kullanarak tek bir nosiseptif C-fiber alıcı alanını tanımlayın. Kısaca, sinir lifi ateş mekanik uyaranlara ve sıcak su yanıt, o zaman bir polimodal nosiceptive C-fiber4olarak düşünün. Daha sonra, elektriksel uyaranların teslimi için tanımlanan alanın derisine iki iğne uyarıcı elektrot (2 mm aralık) yerleştirin.
- Osiloskopta bir eylem potansiyelinin dalga formunu görüntüleyin ve ani artışları yükseltmek ve kaydetmek için sinyal örnekleme hızı 20 kHz olan bir bilgisayar A/D kartı nı çalıştırın.
- Veri toplama yazılımınıkullanarak veri toplama (Malzeme Tablosu). Verileri bilgisayara kaydedin ve dahasonra profesyonel yazılımlarla analiz edin (Malzeme Tablosu).
3. İletim Hatasının Ölçülmesi
- Farklı frekanslarda (2 Hz, 5 Hz, 10 Hz) tekrarlayan elektriksel uyaranları (0,8 ms süre, 1,5x eşik yoğunluğu) 60 s4,8,9için bir C-fiber'e teslim edin. Uyarıcılar arasında dinlenmek için lif için 10 dk aralığı na izin verin. Hata sayısının tekrarlanan uyarıcı darbelerin sayısına oranını hesaplayın ve iletim hatası derecesini elde etmek için %100 çarpın.
4. Siyatik Sinir Ile Bağlı Iintact DRG hazırlanması
- Adım 2.1'de açıklandığı gibi cerrahi aletler ve Ringer'ın hücre dışı solüsyonu hazırlayın.
- Bağlı siyatik sinir ile DRG ayırın.
- Adım 2.2'de açıklandığı gibi sıçanları anestezi edin (CFA enjeksiyonundan sonra 3 ila 7 gün içinde). Sırt ve bacak üzerinde kesme makas ile saç kesin ve iyot tentürü ile cildi sterilize.
- DRG maruziyeti için, ilk l4 l5 segment düzeyinde arka orta hattan açık deri kesti. Kasları çıkarın, omurga süreci, omurga kurulu, ve omurilik ve DRG vücut ortaya çıkarmak için bir kemik rongeur kullanarak enine süreç. Nöral aktiviteyi korumak için normal Ringer'ın hücre dışı çözeltisi tarafından sızmış pamuklarla maruz kalan omuriliği ve DRG'yi kapatın. Kanamayı durdurun ve kanı zamanında temizleyin.
- Iki yönden siyatik sinir maruz: siyatik sinirproksimal sonunda olan DRG bağlı spinal sinir ortaya çıkarmak için oftalmik makas kullanarak vertebra foramen üzerinde S1 kemik yapısı L4 kaldırın. Orta uyluk siyatik sinir ortaya çıkarmak için deri açık kesin. Ayrı ve kas içine gider sinirin distal ucundan siyatik sinir kesmek, ve kesmeden önce sinir in ucunda cerrahi hat ile sinir gövdesi ligate.
- Sinir ligasyon noktasının kaldırılması yoluyla oftalmik makas kullanarak altta yatan bağ dokusundan siyatik sinir ayırın. Omurilikten dura çıkarın ve siyatik sinirin bitişik kısmına ulaşana kadar dorsal kök kaldırarak altta yatan bağ dokusundan DRG ayırın. Böylece, bağlı bir siyatik sinir ile DRG tüm hazırlık izole.
- DRG'nin yüzeyini temizleyin.
- 4x büyütmede stereoskop altında cımbız kullanarak L4−L6 DRG yüzeylerinde spinal durayı dikkatlice çıkarın.
- 1 mL karışık enzim (%0.2 proteinaz ve %0.32 kollajenaz) içeren cam bir tüpe bağlı siyatik sinir içeren DRG'yi yerleştirin ve 37 °C'lik bir su banyosunda 15 dakika boyunca sindirin (5 dakika aralıkla plastik damlalıkla hafifçe üfleyin).
- Ligasyon hattının ucunu kaldırın ve enzimi temizlemek için normal bir Ringer'ın hücre dışı çözeltisi ile dolu bir tabağa preparatı taşıyın. Daha sonra sindirilmiş DRG'yi kayıt için oksijenli Ringer'ın hücre dışı çözeltisi ile dolu bir kap (Şekil1A) aktarın.
- Kayıt oturumu
- Hücre içi solüsyonu hazırlayın (mM: potasyum glukonat 120, KCl 18, MgCl2, etilen glikol-bis(β-aminoetil eter)-N,N,N',N'-tetraasetik asit [EGTA] 5, HEPES 10, Na-GTP 0.4, Na-GTP 0.4, CaCl2 1; pH 7.2 ve 300 mOs). Kullanıma kadar 0 °C'de tutun.
- Bir dilim çapa kullanarak ganglia stabilize ve bir emme uyarıcı elektrot sinir ucu bağlamak (Şekil1A). 40x büyütmede su daldırma hedefi olan bir DRG nöronunu görselleştirin ve seçin.
- Bir elektrotçekin (Malzeme Tablosu) ve hücre içi çözelti ile doldurun. Tutucuya elektrot yerleştirin ve 4-7 MΩ son dirençle pipete pozitif basınç uygulayın.
- Elektrot hücreye yaklaştırın ve ona dokunun. Pipette negatif basınç verin, GΩ mührü ne zaman ulaşılırsa, membran potansiyelini yaklaşık -60 mV olarak ayarlayın ve tüm hücre kayıt modunu kurun.
- İletken yetmezliği için ekrana emme elektrot yoluyla siyatik sinir 5-50 Hz tekrarlayan uyaranları teslim. Hiperpolarizasyon potansiyelinin (AHP) genliğini taban çizgisinden tepeye ve %80 AHP süresini ölçün.
NOT: Verileri analiz etmek için varyans (ANOVA; ikiden fazla grup için) veya Student'in t-testi (yalnızca iki grup için) tek yönlü çözümleme kullanılmıştır. Veriler ortalamanın ± standart hatası (SEM) olarak sunulur. İstatistiksel anlamlı düzey p < 0.05 olarak belirlendi.
- Deneyi Sona Erdirme
- Fareler hala anestezik durumdayken deneysel görev tamamlandığında, sıçanlar aşırı doz pentobarbital sodyum intrakardiyak enjeksiyonları ile insancıl ötenazi edilirler.
Sonuçlar
Tek fiber kayıt protokolünün sonucu fiber diseksiyonun kalitesine bağlıdır. In vivo deneyler için hayvan kolay diseksiyon için sinir gövdesi sağlıklı tutmak için iyi bir durumda olmalıdır (tartışma bölümünde tavsiye bakınız). Bir ilaç uygulama banyosu liflerüzerinde ilaç teslimi için birçok durumda gereklidir. Şekil 1, in vivo tek lifli kaydın nasıl işletildiğini göstermektedir (Şekil1A) ve CFA ile tedavi edilen hayvanların siyatik sinirinden klasik bir kayıt sunar (Şekil1B).
Aşağıdaki deneyler CFA ile tedavi edilen hayvanlarda iletim yetmezliğinin varlığını araştırdı. Bu araştırma, nosiseptif C-lifleri boyunca iletim yetmezliğinin yaygın bir olgu olduğu varsayımına dayanıyordu ve iletim yetmezliğinin derecesi hiperaljezi koşullarında önemli ölçüde azaldı. önceki çalışmalar4,8,9,12. Şekil 2A normal hayvanlarda C-fiber iletim yetmezliği gözlendiğini göstermektedir. Ancak, cfa enjeksiyonu sonrası CFA enjeksiyonu sonrası cfa kaynaklı hiperaljezi kurulduktan sonra kontrole göre iletim yetmezliği derecesi önemli ölçüde azalmıştır (Şekil2B). Bu veriler, ağrıyla ilgili polimodal nosiceptive C-liflerinin iletim başarısızlığının CFA inflamatuar ağrı modelinde zayıflatılmış olduğunu göstermektedir.
İletim yetmezliği sırasında hücre içi mekanizmayı incelemek için bağlı siyatik sinir ile sağlam DRG hazırlanması kullanılmıştır (Şekil3A,B). Şekil 3C, uyarıcı serileri içinde, bir önceki hiperpolarizasyon sonrası potansiyelinde (AHP) birikmiş tekrarlayan uyaranlara yanıt olarak ani artışlar meydana geldiğini ve aşağıdaki AHP'nin yükselen eğiminde azalmaya yol açtığını göstermektedir (Şekil 3C,D ). Küçük DRG nöronlarda AHP varlığı potansiyel hiperpolarizasyon aktive aktive, döngüsel nükleotit-modüle (HCN) kanalları13,14,15. AHP'nin kümülatif etkisi iletim hatasının oluşmasında rol oynar. Bu nedenle, HCN kanallarını engellemenin iletim yetmezliği etkisini önemli ölçüde artıracağını varsaydık. Aşağıdaki deneyde HCN kanallarının engelleyicisi, ZD7288 kullanılmıştır. Sürekli kayıtlar, konsantrasyona bağlı bir şekilde ZD7288 varlığında iletim yetmezliğinde bir artış olduğunu ortaya koymuştur. Insets belirtilen aralıklar için genişletilmiş izlemegösterir. CFA ile tedavi edilen hayvanların küçük DRG nöronlarında iletim yetmezliği ile AHP'nin yükselen eğimi arasında pozitif korelasyon gözlenmiştir (Şekil3E).
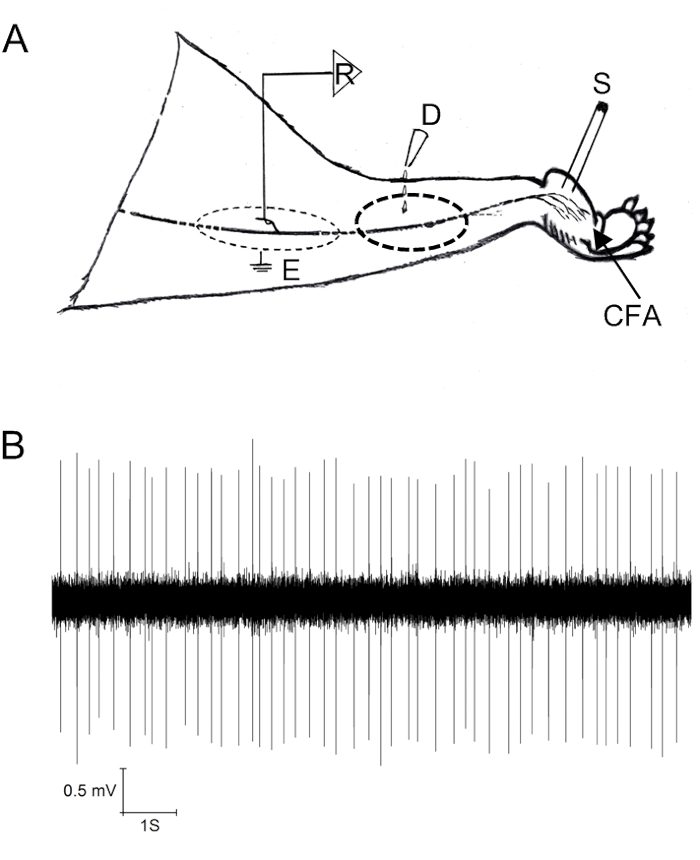
Şekil 1: Sıçan siyatik sinirlerin in vivo tek lif kayıtları. (A) Kayıt için bölgeleri gösteren tek lifli kaydın şematik diyagramı (R) (kayıt için bir filament bölmeden önce, pia mater spinalis ve dura mater burada kaldırıldı), ilaç uygulaması (D), stimülasyon (S) ve CFA sitesi Enjeksiyon. (B) Tonik ateşleme deseni sergileyen siyatik tek lifin temsili kaydı. Bu rakam Wang ve ark.9değiştirilmiştirbu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: CFA ile tedavi edilen sıçanlarda iletim yetmezliği kontrol sıçanlarına göre zayıflatıldı. (A) Kontrol farelerinden 10-Hz elektriksel uyarıma yanıt olarak tek C-fiber ateşlemelerin ardışık kayıtları. Her 20. süpürme gösterilir (ardışık süpürmeler 2's aralıklarla yapılır) ve yukarıdan aşağıya görüntülenir. Inset temsili bir eylem potansiyeli gösterir. (B) CfA enjekte edilen sıçanlardan a panelindekiyle aynı uyarıma yanıt olarak tek C-liflerinin kayıtları. Bu rakam Wang ve ark.9'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Bağlı siyatik sinir ile bozulmamış DRG preparatları kullanılarak C-fiber iletim yetmezliği ölçümü. (A) DRG preparatlarının kurulum ve yerleşimini gösteren şematik diyagram. SE: stimülasyon elektrot; SN: siyatik sinir; FM: floresan mikroskobu; RE: kayıt elektrot. (B) 40x görünümü altında gözlenen tüm DRG örneği, küçük bir DRG nöronun yama için bir mikroelektrot (sağ gölge) kullanılmıştır. (C) CFA ile tedavi edilen sıçanlardan küçük çaplı bir DRG nöronunda kontrol koşulları altında 5-Hz stimülasyona verilen seri ateşleme yanıtlarının sürekli kayıtları veya Farklı ZD7288 konsantrasyonlarının uygulanması. Insets belirtilen kayıt dönemleri için genişletilmiş izlemeleri gösterir. Koyu noktalar başak hatalarını temsil eder. (D) AHP'nin yükselen eğimini ölçmek için kullanılan temsili izler. Yükselen eğim, süreye (uyaran aralığı, saniye cinsinden) bölünen maksimum ve minimum AHP gerilimleri (mV) arasındaki genlik farkına eşitti. Sol panel daha büyük bir yükselen eğim ilerler (C panelindeki ilk iz "*" ile işaretlenmiş) ve sağ panel de ZD7288 uygulamasından (125 μM) sonra "#" ile işaretlenmiş C panelindeki dördüncü izden) daha küçük bir yükselen eğim gösterir. (E) ZD7288'in farklı konsantrasyonlarına yanıt olarak iletim başarısızlığının derecesi ile AHP'nin yükselen eğimi arasındaki ilişki. * ve # P < 0.05 vs kontrol. Bu rakam Wang ve ark.9'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Son çalışmalar vivo16yılında DRG nöronların kalsiyum görüntüleme elde etmiş olmasına rağmen, bireysel DRG nosiceptors in vivo patch-clamp kayıt performans son derece zor kalır. Bu nedenle ağrı alanı için in vivo tek lifli yaklaşım devam ediyor. Mevcut protokolde tek elyaf lı kayıt, iletim yetmezliği olgularının objektif olarak gözlemlemesine olanak sağlar ve bu tekniğin mevcut çalışmada geliştirilen ex vivo preparat ile birleşimi altta yatan mekanizmaların incelenmesine olanak sağlar. preklinik modellerde nosiseptör uyarılabilirlik değişiklikleri. Tek fiber kayıt protokolünün üç adımı başarılı kayıtlar için önemlidir. Öncelikle, hayvanın anestezi dikkat etmek önemlidir. Vivo kayıt deneylerinde, 29 μm platin elektrotun etrafına sarılmış ince lifuzunluğu sadece 2-3 mm'dir ve bu da kayıt işlemi sırasında kolayca müdahale edilebilir. Anestezik durum özellikle stabil değilse, hayvanların küçük hareketleri elektrofizyolojik aktivitelerin kayıt hatalarına yol açabilir. İkinci olarak, hazırlık sürekli parafin ile kaplı olmalıdır. Bu manipülasyon amacı liflerin etkinliğini korumaktır. Uygun bir kayıt yuvası genellikle hayvanların deri kullanılarak inşa edilmiştir. Parafin yağı sızıntısını önlemek için, yuvanın duvarı süper tutkal kullanılarak güçlendirilebilir ve gerektiğinde parafin yağı eklenmelidir. Lif tüm test sırasında kurunamaz. Son olarak, sinir gövdesi çevresindeki çevre sağlıklı muhafaza edilmelidir. Kayıt alanı nın çevresinde her zaman efüzyon sıvısı bulunur ve bu efüzyon kaliteli kayıtlar için bir engeldir. Fiber aktivitesinin genliği azalmaya devam edecek ve sonuçta bir kayıt hatasına neden olan aşırı taban çizgisi gürültüsünden ayırt edilemez hale gelecektir. Bir ev yapımı şırınga tüpü efüzyon sıvı emmek için yuvanın altına derin ulaşmak için gereklidir. Bazen, tuzlu batırılmış bir yarı kuru pamuk topu da yararlıdır.
Bu çalışmada CFA enjeksiyonu sonrası ayak iltihabı ve hiperaljezi üreten CFA modeli uygulanmıştır. Ağrı araştırmalarında rutin bir uygulama olan ve IACUC/Etik komitesi tarafından onaylanan deneyde periferik afferent deşarjın yanı sıra altta yatan mekanizmaların özelliklerini araştırmak için analjezik kullanılmamıştır. Bu çalışmada tekrarlayan elektriksel uyaranlarla sağlanan nosiseptif C-liflerinde oluşan iletim sürecindeki değişiklikleri gözlemlemek için in vivo tek lifli kayıt tekniği tanıtıştır. Hiperaljezik koşullarda iletim yetmezliğinin derecesinin önemli ölçüde azaldığı gösterilmiştir, ancak yama bağlamadaki teknik zorluklar nedeniyle tek fiber kayıt kullanılarak altta yatan mekanizmayı araştırabildik. C lifleri. Bu nedenle, iletim yetmezliği ve küçük çaplı DRG nöronların membran potansiyelindeki değişiklikler arasındaki ilişkinin araştırılması bağlı siyatik sinir ile bozulmamış DRG hazırlanması kullanılarak tespit edildi. Bu tür preparatları kullanarak tek fiber kayıt yerine, iletim arızası üretimi için AHP'ye bağlı mekanizmaları inceler. Bu protokolü kullanarak, sadece birkaç yüzey nöronlar seçilebilir rağmen, DRG nöronlar düzeyinde iletim yetmezliği derecesi hala kaydedilebilir başardı, ilaç yönetimi ile bile.
DRG iki dış membranvar: pia mater spinalis ve dura mater. Dura mater saç yaycı cımbız kullanılarak çıkarılmalıdır ve pia mater spinalis sindirilmelidir (orta sindirim, tek DRG hücrelerinin izolasyonda kullanılan seri olarak değil) yama-kelepçe elektrotlar oluşturmak için DRG hücrelerinin yüzeyine ulaşabilirsiniz sağlamak için bir mühür; aksi takdirde, yama-kelepçe kayıtları elde etmek mümkün değildir. Mevcut yaklaşım daha tamamen DRG artı sinir dilimleri ile karşılaştırıldığında periferik sinir girdisini korur ve DRG nöronların yama-kelepçe kaydı kolayca elde edilmesini sağlar. Bu protokol, farklı kronik ağrı modellerinde farklı DRG nöronlarında elektrofizyolojik değişikliklerin araştırılması gibi, ağrı ile ilgili periferik sinir sisteminin anlaşılmasını geliştirmek için geniş uygulama olanakları vardır17 ,18 ve miyelinli veya miyelinsiz aksonlarla DRG'de anormal spontan aktivitenin altında yatan moleküler mekanizmalar19,20.
Burada sunulan bağlı siyatik sinir ile bozulmamış DRG hazırlanması geleneksel ayrışmış ganglion yöntemi ile karşılaştırıldığında birçok avantajı vardır, DRG yapısı temelde bu hazırlık bozulmadan kalır çünkü. Bu nedenle, vivo gerçek koşulları simüle eder ve fizyolojik aktivite için tercih edilir bir mikroortam sağlar. Bağlı siyatik sinir ile bozulmamış DRG hazırlanması, ikinci süreç daha fazla sindirim enzimleri ve dış fiziksel eylemler (örneğin, kesme ve hücrelerin üfleme) kullandığı ndan, ayrışmış DRG preparatına göre daha az nöronal hasar üretir, hangi hücrelere daha fazla zarar verir. Çoğu elektrofizyolojik çalışmalar hala ayrışmış DRG nöronların üzerinde yapılır21,22, ve ayrıştırma sürecinin kendisi hücrelere zarar, hangi nöronların anormal hipereksicitations sonuçları23. Bu protokolün bir diğer avantajı da hücre dışı afferent elektrofizyolojik aktivitelerin de sinir projeksiyonları kaldığı için elde edilip, bu da afferent ani ani ve somatik DRG spontan etkileşimlerinin araştırılmasına olanak sağlamasıdır. Deşarj. Son olarak, bu hazırlık DRG nöronlar ve uydu glial hücreleri korur, ve sadece DRG nöronlar dissociasyon protokolleri kalır. DrG mikroortamını korumak için gerekli olan uydu glial hücreleri, bireysel DRG nöronlar korumak bir bariyer vardır24, ve bu hücreler daha fazla çalışma garanti.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Çin Ulusal Doğa Bilimleri Vakfı (31671089 ve 81470060) ve Shaanxi İl Sosyal Gelişim Bilim ve Teknoloji Araştırma Projesi (2016SF-250) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Instruments and software used in single fiber recording | |||
| Amplifier | Nihon kohden | MEZ-8201 | Amplification of the electrophysiological signals |
| Bioelectric amplifier monitor | ShangHai JiaLong Teaching instrument factory | SZF-1 | Monitor firing process via sound which is transformed from physiological discharge signal |
| Data acquisition and analysis system | CED | Spike-2 | Software for data acquisition and analysis |
| Electrode manipulator | Narishige | SM-21 | Contro the movement of the electrode as required |
| Hairspring tweezers | A.Dumont | 5# | Separate the single fiber |
| Isolator | Nihon kohden | SS-220J | |
| Memory oscilloscope | Nihon kohden | VC-9 | Display recorded discharge during |
| Experiment | |||
| Stereomicroscope | ZEISS | SV-11 | Have clear observation when separate the local tissue and single fiber |
| Stimulator | Nihon kohden | SEZ-7203 | Delivery of the electrical stimuli |
| Von Frey Hair | Stoelting accompany | Delivery of the mechanical stimuli | |
| Water bath | Scientz biotechnology Co., Ltd. | SC-15 | Heating paroline to maintain at 37 °C |
| Instruments and software used in patch clamp recording | |||
| Amplifier | Axon Instruments | Multiclamp 700B | Monitors the currents flowing through the recording electrode and also controls the stimuli by sending a signal to the electrode |
| Anti-vibration table | Optical Technology Co., Ltd. | Isolates the recording system from vibrations induced by the environment | |
| Camera | Olympus | TH4-200 | See the neurons in bright field; the controlling software allows to take pictures and do live camera image to monitor the approach of the electrode to the cell |
| Clampex | Axon | Clampex 9.2 | Software for data acquisition and delivery of stimuli |
| Clampfit | Axon | Clampfit 10.0 | Software for data analysis |
| Electrode puller | Sutter | P-97 | Prepare recording pipettes of about 2μm diameter with resistance about 5 to 8 MΩ |
| Glass pipette | Sutter | BF 150-75-10 | |
| Micromanipulator | Sutter | MP225 | Give a precise control of the microelectrode |
| Microscope | Olympus | BX51WI | Upright microcope equipped with epifluorescence for clearly observe the cells which would be patched |
| Origin | Origin lab | Origin 8 | Software for drawing picture |
| Perfusion Pump | BaoDing LanGe Co., Ltd. | BT100-1J | Perfusion of DRG in whole-cell patch clamp |
| Other instruments | |||
| Electronic balance | Sartorius | BS 124S | Weighing reagent |
| pH Modulator | Denver Instrument | UB7 | Adjust pH to 7.4 |
| Solutions/perfusion/chemicals | |||
| Calcium chloride | Sigma-Aldrich | C5670 | Extracellular solution |
| Chloralose | Shanghai Meryer Chemical Technology Co., Ltd. | M07752 | Mixed solution for Anesthesia |
| Collagenase | Sigma-Aldrich | SLBQ1885V | Enzyme used for clearing the surface of DRG |
| D (+) Glucose | Sigma-Aldrich | G7528 | Extracellular solution |
| Liquid Paraffin | TianJin HongYan Reagent Co., Ltd. | Maintain fiber wetting | |
| Magnesium sulfate | Sigma-Aldrich | M7506 | Extracellular solution |
| Potassium chloride | Sigma-Aldrich | P3911 | Extracellular solution |
| Protease | Sigma-Aldrich | 62H0351 | Enzyme used for clearing the surface of DRG |
| Sodium bicarbonate | Sigma-Aldrich | S5671 | Extracellular solution |
| Sodium chloride | Sigma-Aldrich | S5886 | Extracellular solution |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | Extracellular solution |
| Sucrose | Sigma-Aldrich | S0389 | Extracellular solution |
| Urethane | Sigma-Aldrich | U2500 | Mixed solution for Anesthesia |
Referanslar
- Koski, C. L., et al. Derivation and validation of diagnostic criteria for chronic inflammatory demyelinating polyneuropathy. Journal of the Neurological Sciences. 277 (1-2), 1-8 (2009).
- Allen, T. J., Knight, D. E. The use of intracellular dialysis to study signal transduction coupling in the squid giant axon. Journal of Neuroscience Methods. 42 (3), 169-174 (1992).
- Schafers, M., Cain, D. Single-fiber recording: in vivo and in vitro preparations. Methods in Molecular Medicine. 99, 155-166 (2004).
- Sun, W., et al. Reduced conduction failure of the main axon of polymodal nociceptive C-fibres contributes to painful diabetic neuropathy in rats. Brain. 135, Pt 2 359-375 (2012).
- Debanne, D. Information processing in the axon. Nature Reviews Neuroscience. 5 (4), 304-316 (2004).
- De Col, R., Messlinger, K., Carr, R. W. Conduction velocity is regulated by sodium channel inactivation in unmyelinated axons innervating the rat cranial meninges. Journal of Physiology. 586 (4), 1089-1103 (2008).
- Debanne, D., Campanac, E., Bialowas, A., Carlier, E., Alcaraz, G. Axon physiology. Physiological Reviews. 91 (2), 555-602 (2011).
- Zhu, Z. R., et al. Conduction failures in rabbit saphenous nerve unmyelinated fibers. Neurosignals. 17 (3), 181-195 (2009).
- Wang, X., et al. A novel intrinsic analgesic mechanism: the enhancement of the conduction failure along polymodal nociceptive C-fibers. Pain. 157 (10), 2235-2247 (2016).
- Smith, T., Al Otaibi, M., Sathish, J., Djouhri, L. Increased expression of HCN2 channel protein in L4 dorsal root ganglion neurons following axotomy of L5- and inflammation of L4-spinal nerves in rats. Neuroscience. 295, 90-102 (2015).
- Zhang, X. L., Albers, K. M., Gold, M. S. Inflammation-induced increase in nicotinic acetylcholine receptor current in cutaneous nociceptive DRG neurons from the adult rat. Neuroscience. 284, 483-499 (2015).
- Zhu, Z. R., et al. Modulation of action potential trains in rabbit saphenous nerve unmyelinated fibers. Neurosignals. 21 (3-4), 213-228 (2013).
- Djouhri, L., Bleazard, L., Lawson, S. N. Association of somatic action potential shape with sensory receptive properties in guinea-pig dorsal root ganglion neurones. Journal of Physiology. 513, 857-872 (1998).
- Fang, X., McMullan, S., Lawson, S. N., Djouhri, L. Electrophysiological differences between nociceptive and non-nociceptive dorsal root ganglion neurones in the rat in vivo. Journal of Physiology. 565, Pt 3 927-943 (2005).
- Young, G. T., Emery, E. C., Mooney, E. R., Tsantoulas, C., McNaughton, P. A. Inflammatory and neuropathic pain are rapidly suppressed by peripheral block of hyperpolarisation-activated cyclic nucleotide-gated ion channels. Pain. 155 (9), 1708-1719 (2014).
- Kim, Y. S., et al. Coupled Activation of Primary Sensory Neurons Contributes to Chronic Pain. Neuron. 91 (5), 1085-1096 (2016).
- Fan, N., Donnelly, D. F., LaMotte, R. H. Chronic compression of mouse dorsal root ganglion alters voltage-gated sodium and potassium currents in medium-sized dorsal root ganglion neurons. Journal of Neurophysiology. 106 (6), 3067-3072 (2011).
- Ma, C., et al. Similar electrophysiological changes in axotomized and neighboring intact dorsal root ganglion neurons. Journal of Neurophysiology. 89 (3), 1588-1602 (2003).
- Boucher, T. J., et al. Potent analgesic effects of GDNF in neuropathic pain states. Science. 290 (5489), 124-127 (2000).
- Ma, C., Greenquist, K. W., Lamotte, R. H. Inflammatory mediators enhance the excitability of chronically compressed dorsal root ganglion neurons. Journal of Neurophysiology. 95 (4), 2098-2107 (2006).
- Gong, K., Ohara, P. T., Jasmin, L. Patch Clamp Recordings on Intact Dorsal Root Ganglia from Adult Rats. Journal of Visualized Experiments. (115), (2016).
- Schoenen, J., Delree, P., Leprince, P., Moonen, G. Neurotransmitter phenotype plasticity in cultured dissociated adult rat dorsal root ganglia: an immunocytochemical study. Journal of Neuroscience Research. 22 (4), 473-487 (1989).
- Zheng, J. H., Walters, E. T., Song, X. J. Dissociation of dorsal root ganglion neurons induces hyperexcitability that is maintained by increased responsiveness to cAMP and cGMP. Journal of Neurophysiology. 97 (1), 15-25 (2007).
- Hanani, M. Satellite glial cells: more than just rings around the neuron. Neuron Glia Biology. 6 (1), 1-2 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır