Method Article
インビボシングルファイバー記録と無傷の後部根神経を用いて伝導障害のメカニズムを調べる
* これらの著者は同等に貢献しました
要約
シングルファイバー記録は、中枢および末梢神経系に適用可能な効果的な電気生理学的手法である。付着した坐骨神経を持つ無傷のDRGの調製と共に、伝導障害のメカニズムが調べられる。両方のプロトコルは、末梢神経系と痛みとの関係の理解を向上させます.
要約
シングルファイバー記録は、中枢および末梢神経系の神経線維に対する特定の用途のために、過去数十年にわたって古典的で効果的な電気生理学的手法となっています。この方法は、神経プロセスの擬似単極構造を示す一次感覚ニューロンである背面根神経節(DRG)に特に適用可能である。軸に沿って渡される作用電位のパターンと特徴は、これらのニューロンで記録可能です。本研究では、生体内単繊維記録を用い、完全なフロイントのアジュバント(CFA)処理ラットにおける坐骨神経の伝導障害を観察する。生体内の単一繊維記録では基礎となるメカニズムを研究できないため、DRGニューロンのパッチクランプ記録は、付着した坐糸神経を有する無傷のDRGの調製に対して行われる。これらの記録は、CFA処理動物におけるDRGニューロンの伝導障害と高偏波後(AHP)の上昇勾配との間に正の相関関係を明らかにする。生体内単一繊維記録のためのプロトコルは、伝導速度の測定と特定の疾患における神経線維の異常な状態の監視を介して神経線維の分類を可能にします。付着した末梢神経を有する無傷のDRGは、ほとんどの生理学的条件におけるDRGニューロンの活性の観察を可能にする。結論として、無傷のDRGの電気生理学的記録と組み合わせた単一繊維記録は、鎮痛プロセス中の伝導不全の役割を調べる効果的な方法である。
概要
神経線維に沿った情報の正常な伝達は、神経系の正常な機能を保証します。神経系の異常な機能は、神経線維の電気信号伝達にも反映される。例えば、中枢脱髄病変における脱髄の程度は、介入適用1の前後の神経伝導速度の変化の比較を介して分類することができる。イカの巨大軸線2などの特別な調製物を除いて、細胞内で神経線維を記録することは困難である。したがって、電気生理学的活性は、単一繊維の細胞外記録によってのみ記録可能である。古典的な電気生理学的方法の一つとして、単一繊維記録は他の技術よりも長い歴史を有する。しかし、その広範な応用にもかかわらず、この方法を把握する電気生理学者は少ない。したがって、その適切なアプリケーションには、シングルファイバ記録のための標準プロトコルの詳細な導入が必要です。
様々なパッチクランプ技術が現代の電気生理学的研究を支配しているが、単一繊維記録は神経線維、特に末梢感覚を伝達する繊維の活動を記録する上で依然としてかけがえのない役割を果たしている。背面根神経節(DRG)に位置する感覚細胞体。ここでシングルファイバー記録を使用する利点は、生体内繊維記録において、細胞内環境の乱れなしに前臨床モデルにおける自然刺激に対する応答を記録する能力を有する長い観察時間を提供することです3,4.
過去20年間に増加した研究の数は、神経線維5に沿って複雑な機能を調べており、軸に沿って失敗した神経インパルス伝達の状態として定義される伝導障害は、多くの異なる存在であった末梢神経6,7.我々の調査における伝導障害の存在は、C繊維8に沿った持続的な受感覚的入力の変調のための本質的な自己阻害機構として役立った。この伝導障害は、過敏症4,9の条件下で有意に減衰した。したがって、伝導不全に関与する因子を標的化することは、神経因性疼痛に対する新たな治療法を表しうる。伝導不良を観察するには、単一繊維記録に基づいて順次排出されたスパイクに基づいて焼成パターンを記録し、分析する必要があります。
伝導不良のメカニズムを完全に理解するためには、擬似単極解剖特性に基づいて、軸方向の透過特性、またはより正確にはDRGニューロンの膜特性を同定する必要があります。この分野における多くの以前の研究は、解離されたDRGニューロン10,11に対して行われており、これは2つの障害による伝導不良の調査では不可能でありかねない。第一に、DRGニューロンを解放する解離プロセスでは、様々な機械的および化学的方法が使用され、不健康な細胞を生み出したり、ニューロンの表現型/特性を変化させたり、その結果を混乱させる可能性があります。第二に、取り付けられた末梢神経は基本的に除去され、伝導不全現象はこれらの調製物では観察できない。従って、前述の障害を避けるために、付着した神経を有する無傷のDRGニューロンの調製が改善された。
プロトコル
現在のプロトコルは、米国公衆衛生サービスの人道的ケアと実験動物の使用に関する方針に従い、第4軍事医科大学の動物実験倫理委員会は、プロトコルを承認しました。
1. 動物
- 24匹のスプラーグ・ドーリーラット(生後4~8週齢)を2つのグループに分けます。生理生殖量で14匹のラットと10匹のラットの別のグループでCFAの100 μLのプランター注射によって完全なフロイントのアジュバント(CFA)モデルを生成する。
注:すべての動物は、第四軍事医学大学の動物センターから取得されました。成人のオスとメスのスプラーグ・ドーリーラット(150-200g)は、すべての手順に使用され、ラットはケージにランダムに割り当てられました。2匹のラットをケージごとに一定温度(25±1°C)で12/12時間の光/暗サイクル下で収容し、食物と水に無料でアクセスした。
2. インビボシングルファイバー録音
- 手術前にすべての手術器具(メス、ピンセット、眼科はさみ、せん断はさみ、ガラス分離針、縫合針、骨ロンゲル)を準備し、消毒します。通常リンガーの細胞外溶液の1Lまたは2Lを調(mM:NaCl 124,KCl3,MgSO4 1.3,CaCl 2,NaHCO3 26,NaH2 PO4 1.25,ブドウ糖15;pH 7.4および305 mOsm)を調用する。 使用するまで4°Cで保管してください。
- ラットを麻酔する。CFA注射後3~7日目に、混合溶液(1%クロラロースおよび17%ウレタン、5mL/kg体重)の腹腔内注射を使用して、実験中に動物を安定した審美的状態に保つ。必要に応じて、瞳孔と痛み刺激に対する反応を確認した後、麻酔薬の補足注射を適用する。37 °C付近の体温を監視し、維持します。
-
記録のための坐神経幹の露出
- 大腿の背中の部分の皮膚と筋肉を切り開きます。大腿二頭筋に沿って鈍い解剖を行う。眼用はさみとガラス分離針を使用して坐骨神経幹を慎重に分離します。リンガーの溶液を使用してティッシュを濡らしておきます。
- 自家製の金属製のフープ(長さ3cm、直径1mmの鉄線付き2mm幅の金属フープ)に、皮膚を縫い付けて周囲のスロットに固定します。体液浴を確立するように皮膚を少し引き上げます。
- 近位側に1cmの坐神経幹を露出させる。コントラストを高め、細かい神経幹をはっきりと観察するために、神経幹の下に小さな茶色のプラットフォームを配置します。水浴中の液体パラフィンを37°Cに熱し、繊維の表面の乾燥を防ぐために神経幹の上に落とします。坐神経の周りにぴあ母性脊椎と硬膜を取り除く。
-
記録セッション
- 記録電極として白金フィラメント(直径29μm)を選択します。より簡単な成形のために加熱し、最後に小さなフックを作成します。マイクロマニピュレータに電極を取り付け、必要に応じて電極を動かします。
- お風呂に、隣接する皮下組織に基準電極を配置する。脊髄硬膜とぴあ母を分割します。坐神経を記録プール内の単一繊維(直径15~20μm)に分離します。次に、軸索の微細なファシクルをピックアップし、25倍の倍率でステレオスコープの下で記録電極のフック上の軸索の近位端を中断します。
注:ちょうど解剖されたフィラメントは厚くなる傾向があり、単一の単位が記録されるまで更なる分離を要求する。 - 機械的刺激(フォン・フレイ・ヘア)と熱刺激(50~55°C水の小さな綿玉)を用いて、単一の受容性C繊維の受容場を特定します。簡単に言えば、神経線維の発火が機械的刺激およびお湯に反応する場合は、ポリモーダルの知覚性C繊維4と考える。次に、電気刺激の送達のために同定された分野の皮膚に2つの針刺激電極(2mm間隔)を挿入する。
- オシロスコープでアクションポテンシャルの波形を表示し、20 kHzの信号サンプリングレートを持つコンピュータA/Dボードを使用してスパイクを増幅し、記録します。
- データ取得ソフトウェア (材料の表)を使用してデータを収集します。コンピュータにデータを保存し、後で専門のソフトウェア (材料の表)で分析します。
3. 伝導不良の測定
- 60 s4,8 ,9の C ファイバに異なる周波数 (2 Hz、5 Hz、10 Hz) で繰り返し電気刺激 (0.8 ミリ秒の持続時間、1.5 倍のしきい値強度) を提供します。繊維が刺激の間にリラックスするための10分間隔を許可します。送達された反復刺激パルスの数に対する故障数の比率を計算し、100%を掛して伝導故障の度合いを得る。
4. 坐神経を装着したIintact DRGの調製
- ステップ2.1で説明されているように、外科用ツールとリンガーの細胞外溶液を準備します。
- 付属の坐神経でDRGを分離します。
- ステップ2.2に記載されているようにラットを麻酔する(CFA注射後の3~7日目)。せん断はさみで背中と脚の毛を切り、ヨウ素のチンキで皮膚を殺菌します。
- DRG曝露の場合は、まずL4セグメントレベルで背面の中間線からL5セグメントレベルまでスキンを切り開きます。筋肉、脊椎板、および脊椎骨のプロセスを取り除き、脊髄とDRG体を露出させるために骨ロンゲールを使用して横断プロセス。神経活動を維持するために、通常のリンガーの細胞外溶液に浸潤した綿で露出した脊髄とDRGをカバーします。出血を止めて 間に合うから血を取り除け
- 坐骨神経を2方向から露出させる:眼科はさみを使用して脊椎前肢の上のL4からS1骨構造を取り除き、坐骨神経の近位端にあるDRGに接続された脊髄神経を露出させる。皮膚を切り開き、中腿部の坐神経を露出させる。坐神経を分離して、筋肉の中に入る神経の遠位端から切り離し、切断前に神経の終わりに外科ラインで神経幹をライゲートします。
- 神経ライゲーションポイントの持ち上げを介して眼用はさみを使用して、基礎となる結合組織から坐骨神経を分離します。脊髄から硬膜を取り除き、坐神経の隣接部分に到達するまで後部根を持ち上げることによって、基礎となる結合組織からDRGを分離する。したがって、付属の坐神経を持つDRGの全調調製物を分離する。
- DRG のサーフェスをクリアします。
- 4倍の倍率でステレオスコープの下にピンセットを使用して、L4−L6 DRGの表面の脊髄硬膜を慎重に取り外します。
- 混合酵素の1 mL(0.2%のタンパク質酵素と0.32%のコラゲナーゼ)を含むガラス管に付着した坐骨神経を付けたDRGを置き、37°Cの水浴で15分間消化します(5分間隔でプラスチックドロキッパーでわずかに吹きます)。
- ライゲーションラインの端を持ち上げ、酵素を洗い流すために通常のリンガーの細胞外溶液で満たされた皿に準備を移動します。次に、消化されたDRGを、記録用の酸素化リンガー細胞溶液で満たされた容器(図1A)に移す。
- 記録セッション
- 細胞内溶液を調用する(mM:グルコン酸カリウム120、 KCl 18, MgCl2 2, エチレングリコールビス(β-アミノエチルエーテル)-N,N',N',N',N'-四面酢酸[EGTA] 5, HEPES 10, Na2-ATP 5, Na-GTP 0.4, CaCl2 1; pH 7.2および300 MOsm.使用するまで0°Cに保ちます。
- スライスアンカーを使用して神経節を安定させ、神経端を吸引刺激電極に接続する(図1A)。40倍の倍率で水浸し目的を持つDRGニューロンを視覚化し、選択します。
- 電極(材料のテーブル)を引っ張り、細胞内溶液で満たします。ホルダーに電極を挿入し、4-7 MΩの最終的な抵抗でピペットに正の圧力を加えます。
- 電極をセルの近くに持ち込み、触れます。ピペットに負圧を与え、GΩシールに達したら、膜電位を約-60 mVに設定し、全細胞記録モードを確立します。
- 5-50 Hzの繰り返し刺激を吸引電極を通して坐骨神経に伝導し、伝導不良をスクリーニングします。ベースラインからピークまでの超偏光電位(AHP)の振幅と80%のAHP持続時間を測定します。
注:分散の一方通行分析(ANOVA;2群以上)または学生のt検定(2つのグループのみ)を使用してデータを分析しました。データは、平均(SEM)の平均±標準誤差として提示される。統計的有意水準はp<0.05に設定された。
- 実験の終了
- ラットがまだ麻酔状態にある間に実験タスクが終了すると、ラットは過剰摂取ペントバルビタールナトリウムの心臓内注射で人道的に安楽死させる。
結果
シングルファイバ記録プロトコルの結果は、繊維解剖の品質に依存します。生体内実験のための動物は、簡単な解剖のために神経幹を健康に保つために良い状況でなければなりません(議論セクションのアドバイスを参照してください)。多くの場合、繊維上での薬物送達には薬物塗布浴が必要です。図1は、インビボシングルファイバー記録がどのように操作されたかを示し(図1A)、CFA処理動物の坐剤神経からの1つの古典的な記録を示す(図1B)。
以下の実験は、CFA処理動物における伝導不良の存在を調べた。この調査は、知覚性C線維に沿った伝導不良が一般的な現象であり、我々がサポートする過敏症の条件下で伝導不良の程度が著しく減衰したという仮定に基づいて行われた。以前の研究4,8,9,12.図2Aは、正常な動物においてC線維伝導不良が観察されたことを示す。しかし、コントロールと比較して、CFA誘発性過敏症の確立後に通行障害の程度が大幅に減少した(図2B)。これらのデータは、疼痛関連ポリモーダル線認識性C繊維の伝導障害が炎症性疼痛のCFAモデルにおいて減衰していることを示している。
伝導不全時の細胞内機構を調べるために、坐骨神経を付着した無傷のDRGの調製が用いた(図3A,B)。図3Cは、刺激系列内で、前の過分電位(AHP)に積み上げられた反復刺激に反応してスパイクが発生し、以下のAHPの上昇勾配が減少したことを示しています(図3C、D)).小さなDRGニューロンにおけるAHPの存在は、潜在的に超分極活性化、環状ヌクレオチド変調(HCN)チャネル13、14、15を活性化する。AHPの累積効果は、伝導不良の発生に役割を果たす。そこで、HCNチャネルを遮断すると伝導不良効果が著しく高めると仮定した。次の実験では、HCNチャネルZD7288のブロッカーを用いて行った。連続記録は、濃度依存的な方法でZD7288の存在下での伝導不良の増加を明らかにした。インセットには、指定した間隔の展開されたトレースが表示されます。CFA処理動物の小さなDRGニューロンにおける伝導障害とAHPの上昇勾配との間に正の相関が認められた(図3E)。
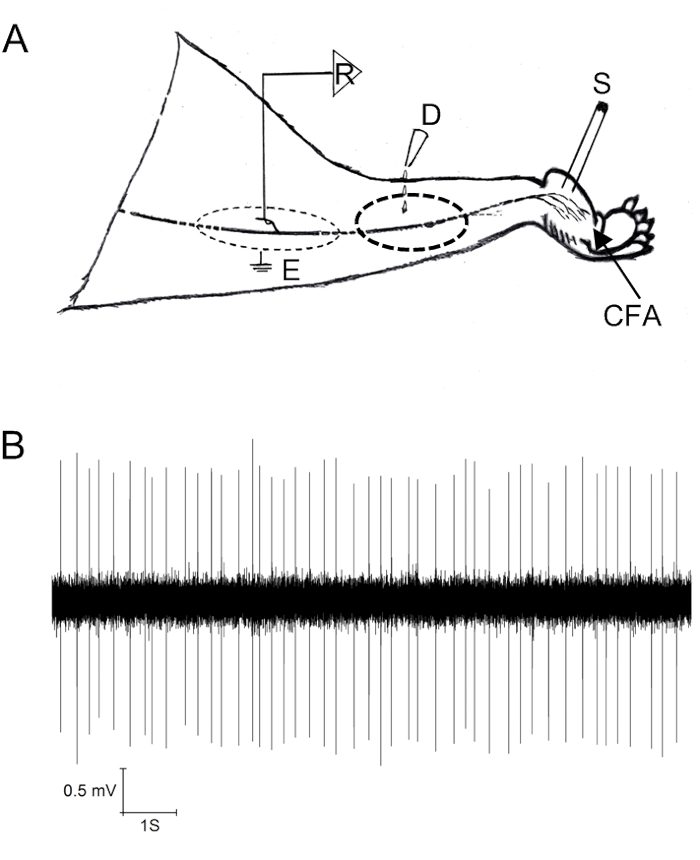
図1:ラット坐神経の生体内単繊維記録。(A) 記録のための領域(R)を示す単一繊維記録の概略図(記録用フィラメントを分割する前に、ピア母脊髄と硬膜をここで除去した)、薬物適用(D)、刺激(S)、およびCFAの部位射出。(B)強壮弾発射パターンを示す坐剤単繊維の代表的な記録。この図は Wang etal. 9 から変更されています。

図2:CFA処理ラットにおける伝導不良は、対照ラットと比較して減衰した。(A) 10Hz電気刺激に応じて制御ラットからの単一のCファイバー発射の元の連続的な記録。20 回目のスイープごとに表示され (連続スイープは 2 秒間隔で表示され、上から下に表示されます)。インセットは、代表的なアクションポテンシャルを示します。(B) パネルAと同じ刺激に応答してCFA注入ラットからの単一C繊維の記録。この図は Wang ら9から変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:坐骨神経を付着した無傷のDRG製剤を用いたC線維伝導不良の測定。(A) DRG製剤のセットアップと配置を示す回路図。SE: 刺激電極;SN: 坐神経;FM:蛍光顕微鏡;RE:記録電極。(B)40倍の視野下で観察された全DRG検体は、小さなDRGニューロンにパッチを当てるマイクロ電極(右影)を用いて用いられた。(C) CFA処理ラットからの小径DRGニューロンにおけるZD7288の異なる濃度の制御条件下または投与下での5Hz刺激に対する一連の発射応答の連続的な記録。インセットには、指定した記録期間の拡張トレースが表示されます。暗いスポットはスパイクの失敗を表します。(D) AHPの上昇勾配を測定するために使用される代表的なトレース。立ち上がる斜面は、最大AHP電圧(mV)を持続時間(刺激間隔、秒単位)で割った振幅差に等しかった。左側のパネルは、より大きな上昇勾配(パネルCの最初のトレースから「*」でマークされた)を示し、右側のパネルはZD7288アプリケーション(125 μM)の後に「#」でマークされたパネルCの4番目のトレースから)小さな上昇勾配を示しています。(E) ZD7288の異なる濃度に応じてAHPの伝導故障の程度と上昇勾配との関係。* と # P < 0.05 対コントロール。この図は Wang ら9から変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
最近の研究では、生体内16におけるDRGニューロンのカルシウムイメージングを達成しているが、個々のDRGノシセプターからの生体内パッチクランプ記録の実行は非常に困難なままである。したがって、疼痛分野に対する生体内単一繊維アプローチは、継続的に重要である。本プロトコルにおける単一繊維記録は、伝導故障現象の客観的な観察を可能にし、本手法と現行の研究で開発されたex vivo製剤との組み合わせにより、前臨床モデルにおける興奮性の変化。シングルファイバ記録プロトコルの3つのステップは、記録を正常に行う上で重要です。まず、動物の麻酔に注意を払う必要があります。生体内記録実験では、29μmの白金電極の周りに包まれた薄い繊維の長さはわずか2〜3mmであり、記録プロセス中に容易に干渉される。麻酔状態が特に安定していない場合、動物の小さな動きは、電気生理学的活動の記録障害につながる可能性があります。第二に、準備はパラフィンで継続的に覆われなければならない。この操作の目的は、繊維の活性を維持することです。適切な記録スロットは、一般に動物の皮膚を用いて構築された。パラフィンオイルの漏れを防ぐために、スロットの壁はスーパー接着剤を使用して強化することができ、パラフィンオイルは必要に応じていつでも追加する必要があります。試験中に繊維が乾燥できません。最後に、神経幹の周りの環境は健康的に維持されなければなりません。記録領域の周りには常に何らかの流出液が存在し、この流出は良質の記録のための障害です。ファイバ アクティビティの振幅は減少し続け、最終的には極端なベースライン ノイズと区別できなくなり、記録エラーが発生します。自家製の注射器チューブは、噴出液を吸い出すためにスロットの底に深く到達する必要があります。時には、生理生理生理生理に浸したセミドライコットンボールも役に立ちます。
本研究では、CFA注射後に足の炎症および過敏症を引き起こすCFAモデルを適用した。末梢アフェレント排出の特性と根本的なメカニズムを調べるため、疼痛研究の日常的な実践であり、IACUC/倫理委員会によって承認された実験には鎮痛剤は使用されなかった。本研究では、反復的な電気刺激を伴う非誘発性C線維で生じる伝達過程の変化を観察する生体内単一繊維記録技術を導入する。過重藻症の状態では伝導不良の程度が著しく減衰していることが実証されましたが、パッチクランプの技術的な問題から、シングルファイバー記録を用いた基礎機構を調査できませんでした。C繊維そこで、小径DRGニューロンの伝導性と膜電位の変化との関係の調査は、付着した坐骨神経を用いた無傷のDRGの調製を用いて検出した。単一ファイバ記録の代わりに、このような調製物を用いてパッチクランプは、伝導故障の生産のためのAHP依存機構を探索する。このプロトコルを使用して、わずか数の表面ニューロンしか選択できなかったが、DRGニューロンのレベルでの伝導障害の程度は、薬物投与であっても記録することができた。
DRGには2つの外膜があります:ピア母脊髄と硬膜母体。デュラ母体はヘアスプリングピンセットを使用して除去する必要があり、ピア母性脊髄は消化する必要があります(単一のDRG細胞の単一の分離で使用されるほど系列ではなく、適度な消化)。シール;それ以外の場合は、パッチクランプ記録を取得することは不可能です。現在のアプローチは、DRGプラス神経のスライスと比較して末梢神経入力をより完全に保持し、DRGニューロンのパッチクランプ記録が容易に達成されることを保証する。このプロトコルは、異なる慢性疼痛モデルにおける異なるDRGニューロンにおける電気生理学的変化の調査など、疼痛に関する末梢神経系の理解を改善するための広範な応用見通しを有する17 ,18および分子機構は、骨髄性または未骨髄性軸母19、20を有するDRGにおける異常な自発的活動の基礎となる。
ここで提示される付着した坐骨神経を有する無傷のDRGの調製は、DRGの構造が基本的にこの調製物で壊れていないままであるため、従来の解離神経節法と比較して多くの利点がある。したがって、それは生体内の実際の条件をシミュレートし、生理学的活動のための好ましい微小環境を提供する。坐骨神経を付いた無傷のDRGの調製は、後者のプロセスがより多くの消化酵素と外部の物理的作用(例えば、細胞のせん断および吹き付け)を使用するので、解離されたDRG調製よりも神経損傷が少ない細胞に多くの損傷を引き起こす。ほとんどの電気生理学的研究は、解離されたDRGニューロン21、22に対して依然として行われ、解離プロセス自体が細胞を損傷し、ニューロン23の異常な過起感をもたらす。このプロトコルのもう一つの利点は、神経突起が残っているので細胞外の電気生理学的活動も得られるため、アフェレントスパイクと体性DRGとの相互作用の調査を自発的に可能にする。放電。最後に、この調製物はDRGニューロンおよび衛星グリア細胞を保持し、解離プロトコルに残るDRGニューロンのみである。DRGの微小環境を維持するために不可欠な衛星グリア細胞は、個々のDRGニューロン24を保護する障壁であり、これらの細胞はさらなる研究を保証する。
開示事項
著者は何も開示していない。
謝辞
この研究は、中国国立自然科学財団(31671089および81470060)と浙西省社会開発科学技術研究プロジェクト(2016SF-250)からの資金援助によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Instruments and software used in single fiber recording | |||
| Amplifier | Nihon kohden | MEZ-8201 | Amplification of the electrophysiological signals |
| Bioelectric amplifier monitor | ShangHai JiaLong Teaching instrument factory | SZF-1 | Monitor firing process via sound which is transformed from physiological discharge signal |
| Data acquisition and analysis system | CED | Spike-2 | Software for data acquisition and analysis |
| Electrode manipulator | Narishige | SM-21 | Contro the movement of the electrode as required |
| Hairspring tweezers | A.Dumont | 5# | Separate the single fiber |
| Isolator | Nihon kohden | SS-220J | |
| Memory oscilloscope | Nihon kohden | VC-9 | Display recorded discharge during |
| Experiment | |||
| Stereomicroscope | ZEISS | SV-11 | Have clear observation when separate the local tissue and single fiber |
| Stimulator | Nihon kohden | SEZ-7203 | Delivery of the electrical stimuli |
| Von Frey Hair | Stoelting accompany | Delivery of the mechanical stimuli | |
| Water bath | Scientz biotechnology Co., Ltd. | SC-15 | Heating paroline to maintain at 37 °C |
| Instruments and software used in patch clamp recording | |||
| Amplifier | Axon Instruments | Multiclamp 700B | Monitors the currents flowing through the recording electrode and also controls the stimuli by sending a signal to the electrode |
| Anti-vibration table | Optical Technology Co., Ltd. | Isolates the recording system from vibrations induced by the environment | |
| Camera | Olympus | TH4-200 | See the neurons in bright field; the controlling software allows to take pictures and do live camera image to monitor the approach of the electrode to the cell |
| Clampex | Axon | Clampex 9.2 | Software for data acquisition and delivery of stimuli |
| Clampfit | Axon | Clampfit 10.0 | Software for data analysis |
| Electrode puller | Sutter | P-97 | Prepare recording pipettes of about 2μm diameter with resistance about 5 to 8 MΩ |
| Glass pipette | Sutter | BF 150-75-10 | |
| Micromanipulator | Sutter | MP225 | Give a precise control of the microelectrode |
| Microscope | Olympus | BX51WI | Upright microcope equipped with epifluorescence for clearly observe the cells which would be patched |
| Origin | Origin lab | Origin 8 | Software for drawing picture |
| Perfusion Pump | BaoDing LanGe Co., Ltd. | BT100-1J | Perfusion of DRG in whole-cell patch clamp |
| Other instruments | |||
| Electronic balance | Sartorius | BS 124S | Weighing reagent |
| pH Modulator | Denver Instrument | UB7 | Adjust pH to 7.4 |
| Solutions/perfusion/chemicals | |||
| Calcium chloride | Sigma-Aldrich | C5670 | Extracellular solution |
| Chloralose | Shanghai Meryer Chemical Technology Co., Ltd. | M07752 | Mixed solution for Anesthesia |
| Collagenase | Sigma-Aldrich | SLBQ1885V | Enzyme used for clearing the surface of DRG |
| D (+) Glucose | Sigma-Aldrich | G7528 | Extracellular solution |
| Liquid Paraffin | TianJin HongYan Reagent Co., Ltd. | Maintain fiber wetting | |
| Magnesium sulfate | Sigma-Aldrich | M7506 | Extracellular solution |
| Potassium chloride | Sigma-Aldrich | P3911 | Extracellular solution |
| Protease | Sigma-Aldrich | 62H0351 | Enzyme used for clearing the surface of DRG |
| Sodium bicarbonate | Sigma-Aldrich | S5671 | Extracellular solution |
| Sodium chloride | Sigma-Aldrich | S5886 | Extracellular solution |
| Sodium phosphate monobasic | Sigma-Aldrich | S0751 | Extracellular solution |
| Sucrose | Sigma-Aldrich | S0389 | Extracellular solution |
| Urethane | Sigma-Aldrich | U2500 | Mixed solution for Anesthesia |
参考文献
- Koski, C. L., et al. Derivation and validation of diagnostic criteria for chronic inflammatory demyelinating polyneuropathy. Journal of the Neurological Sciences. 277 (1-2), 1-8 (2009).
- Allen, T. J., Knight, D. E. The use of intracellular dialysis to study signal transduction coupling in the squid giant axon. Journal of Neuroscience Methods. 42 (3), 169-174 (1992).
- Schafers, M., Cain, D. Single-fiber recording: in vivo and in vitro preparations. Methods in Molecular Medicine. 99, 155-166 (2004).
- Sun, W., et al. Reduced conduction failure of the main axon of polymodal nociceptive C-fibres contributes to painful diabetic neuropathy in rats. Brain. 135, Pt 2 359-375 (2012).
- Debanne, D. Information processing in the axon. Nature Reviews Neuroscience. 5 (4), 304-316 (2004).
- De Col, R., Messlinger, K., Carr, R. W. Conduction velocity is regulated by sodium channel inactivation in unmyelinated axons innervating the rat cranial meninges. Journal of Physiology. 586 (4), 1089-1103 (2008).
- Debanne, D., Campanac, E., Bialowas, A., Carlier, E., Alcaraz, G. Axon physiology. Physiological Reviews. 91 (2), 555-602 (2011).
- Zhu, Z. R., et al. Conduction failures in rabbit saphenous nerve unmyelinated fibers. Neurosignals. 17 (3), 181-195 (2009).
- Wang, X., et al. A novel intrinsic analgesic mechanism: the enhancement of the conduction failure along polymodal nociceptive C-fibers. Pain. 157 (10), 2235-2247 (2016).
- Smith, T., Al Otaibi, M., Sathish, J., Djouhri, L. Increased expression of HCN2 channel protein in L4 dorsal root ganglion neurons following axotomy of L5- and inflammation of L4-spinal nerves in rats. Neuroscience. 295, 90-102 (2015).
- Zhang, X. L., Albers, K. M., Gold, M. S. Inflammation-induced increase in nicotinic acetylcholine receptor current in cutaneous nociceptive DRG neurons from the adult rat. Neuroscience. 284, 483-499 (2015).
- Zhu, Z. R., et al. Modulation of action potential trains in rabbit saphenous nerve unmyelinated fibers. Neurosignals. 21 (3-4), 213-228 (2013).
- Djouhri, L., Bleazard, L., Lawson, S. N. Association of somatic action potential shape with sensory receptive properties in guinea-pig dorsal root ganglion neurones. Journal of Physiology. 513, 857-872 (1998).
- Fang, X., McMullan, S., Lawson, S. N., Djouhri, L. Electrophysiological differences between nociceptive and non-nociceptive dorsal root ganglion neurones in the rat in vivo. Journal of Physiology. 565, Pt 3 927-943 (2005).
- Young, G. T., Emery, E. C., Mooney, E. R., Tsantoulas, C., McNaughton, P. A. Inflammatory and neuropathic pain are rapidly suppressed by peripheral block of hyperpolarisation-activated cyclic nucleotide-gated ion channels. Pain. 155 (9), 1708-1719 (2014).
- Kim, Y. S., et al. Coupled Activation of Primary Sensory Neurons Contributes to Chronic Pain. Neuron. 91 (5), 1085-1096 (2016).
- Fan, N., Donnelly, D. F., LaMotte, R. H. Chronic compression of mouse dorsal root ganglion alters voltage-gated sodium and potassium currents in medium-sized dorsal root ganglion neurons. Journal of Neurophysiology. 106 (6), 3067-3072 (2011).
- Ma, C., et al. Similar electrophysiological changes in axotomized and neighboring intact dorsal root ganglion neurons. Journal of Neurophysiology. 89 (3), 1588-1602 (2003).
- Boucher, T. J., et al. Potent analgesic effects of GDNF in neuropathic pain states. Science. 290 (5489), 124-127 (2000).
- Ma, C., Greenquist, K. W., Lamotte, R. H. Inflammatory mediators enhance the excitability of chronically compressed dorsal root ganglion neurons. Journal of Neurophysiology. 95 (4), 2098-2107 (2006).
- Gong, K., Ohara, P. T., Jasmin, L. Patch Clamp Recordings on Intact Dorsal Root Ganglia from Adult Rats. Journal of Visualized Experiments. (115), (2016).
- Schoenen, J., Delree, P., Leprince, P., Moonen, G. Neurotransmitter phenotype plasticity in cultured dissociated adult rat dorsal root ganglia: an immunocytochemical study. Journal of Neuroscience Research. 22 (4), 473-487 (1989).
- Zheng, J. H., Walters, E. T., Song, X. J. Dissociation of dorsal root ganglion neurons induces hyperexcitability that is maintained by increased responsiveness to cAMP and cGMP. Journal of Neurophysiology. 97 (1), 15-25 (2007).
- Hanani, M. Satellite glial cells: more than just rings around the neuron. Neuron Glia Biology. 6 (1), 1-2 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved