Method Article
Seminifer tübül Squash tekniği fare modeli kullanarak sperma saytolojik analizi için
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu tübül squash teknik hızla hücresel bütünlüğünü koruyarak fare spermatocytes geliştirme saytolojik özellikleri değerlendirmek için hedeftir. Bu yöntem tüm aşamalarında spermatogenez çalışma için izin verir ve diğer biyokimyasal ve moleküler biyolojik yaklaşımlar için fare mayoz çalışmanın yanında kolayca uygulanabilir.
Özet
Erkeklerde segregasyonun ilerleme, son derece düzenlenmiş hücresel olaylar birkaç uyumlu eylem gerektiren bir süreçtir. Mayoz sırasında oluşan hatalar infertilite, gebelik kaybı veya genetik kusurların yol açabilir. Başlangıcı ergenlik ve yetişkinlik devam, başlayan, spermatocytes sürekli yarı zaman uyumlu dalgalar spermatogenez geçmesi ve sonuçta haploit sperm oluştururlar. Fare spermatocytes segregasyonun başlatma geçiren ilk dalga gün 10 post-partum (10 dpp) görünür ve seminifer tübüllerin Lümen 35 dpp, olgun sperm olarak serbest bırakılır. Bu nedenle, faiz zenginleştirilmiş olasılığını elde etmek için bu gelişimsel zaman penceresi içinde fare kullanmak avantajlıdır. Nadir hücre aşamaları analizini tübüllerin içinde hücresel nüfus çeşitliliği artırmak art arda spermatogenic dalgalar katkı nedeniyle büyük farelerde daha zordur. Burada açıklanan yöntemi spermatogonia, spermatocytes ve spermatids de dahil olmak üzere fare, seminifer tübüllerin içinde bulunan hücreler saytolojik değerlendirilmesi için kolayca uygulanan bir tekniktir. Tübül squash teknik izole erkek germ hücreleri bütünlüğünü korur ve diğer teknikleri ile kolayca görselleştirildiği değil hücresel yapılarının incelenmesi sağlar. Bu tübül squash teknik olası uygulamaları göstermek için iğ derleme için ben geçiş metafaz profaz yoluyla ilerliyor spermatocytes (G2/MI geçiş) takip. Buna ek olarak, centrosome çoğaltılması, segregasyonun kromozomal inactivation (MSCI) ve kromozom buket oluşumu bu tübül squash yöntemi kullanarak gözlenen saytolojik yapıları örnek olarak değerlendirildi. Bu teknik spermatogenez sırasında mutasyon veya eksojen pertürbasyon, neden belirli kusurları kesin olarak belirlemek için kullanılabilir ve böylece, sperma moleküler anlayışımızı katkıda bulunur.
Giriş
Mayoz, DNA ikileşmesi bir turu hücre bölünmesi iki ardışık tur tarafından takip edilir karmaşık bir hücresel olaydır. Birkaç mayoz özel olay mayoz doğru kromozom segregasyon sağlamak için ilk aşamalarında koordine edilmelidir. Homolog Rekombinasyon, kardeş ortak yönünü tamamlanması bu olaylar dahil ilk segregasyonun bölünme ve homologs arasında chiasmata gidermek için cohesin kompleksleri kademeli kaybı sırasında kinetochores. Hassas düzenleme bu işlemler, doğurganlık korumak için ve gelişimsel bozukluklar genetik ve spontan düşük1yol açabilir kromozom missegregation olayları önlemek için gereklidir.
Mayoz önemli olaylar ve erkeklerde gerçekleşecek olsa da, önemli zamansal ve mekanik sperma ve oogenesis2farklar. Örneğin, kadın mayoz sırasında embriyonik gelişim sırasında oluşur ve dictyate aşamada ergenlik kadar tutuklamalar profaz. Buna ek olarak, ergenlik ve dalgalar tutuklama olmadan yetişkin hayatı boyunca ilerledikçe, sperma başlar. Erkek ve dişi mayoz arasındaki farklar özellikle spermatocytes ve yumurta bu işlemlerde değerlendirmek doğru yiyecek ve içecek yöntemleri geliştirmek gerek vurgular. Şu anda, büyük ölçüde segregasyonun ilerleme değerlendirirken Kromatin yayılır3,4,5kullanımına dayanıyor. Kromatin yayılır segregasyonun kromozomlar eğitim için yararlı olsa da, onlar Milli mikrotübüller, centrosomes, nükleer zarf ve telomer ekleri gibi hücresel yapıların değerlendirilmesi önleme hücresel bütünlüğünün korunması için başarısız. Canlı görüntüleme ve uzun vadeli kodlamayla teknikleri kadın mayoz anlayışımızı büyük ölçüde gelişti; Tüm sağlam hücre görselleştirmek için benzer yaklaşımlar ancak, daha az sıklıkla spermatogenez6,7çalışma için geçerli olur. Erkek mayoz boyunca dinamik olaylar görselleştirmek için fare spermatocytes8,9geliştirme saytolojik özellikleri hızlı bir şekilde değerlendirmek için kurulan tübül squash teknikleri adapte olması. Burada açıklanan yöntemi birden çok hücresel yapılarının incelenmesi spermatogenez farklı aşamalarında etkinleştirme hücre bütünlüğünü korur.
Bu tübül squash teknik ayirt mikroskobu ile hücresel yapıların değerlendirilmesi için izin verir tüm cep telefonu yaklaşımdır. Haematoxylin ve Eozin gömülü parafin testis ve cryosections immünfloresan etiketleme boyama gibi erkek farelerde segregasyonun ilerleme görselleştirmek için ortak histolojik yaklaşımlar segregasyonun ilerleme geniş bir bakış için izin. Ancak, bu teknikler, mayoz10,11gerçekleşen olayların ayrıntılı analiz için gerekli ölçüde tek hücreler gidermek başarısız. Alternatif teknikleri segregasyonun süreçlerini görselleştirin önemli chemiosmotic kesinti belirleyip nükleer madde3,4,5çözmek için spermatocyte güveniyor. Bu kimyasal tedaviler gözlem hücre tiplerinin dışında birincil spermatocytes engel. Namekawa son zamanlarda açıklanan yöntemle izole spermatocytes nükleer mimarisini korumak araştırma topluluğu sağladı, ama bir cytospin ve bazı laboratuar4' e hazır olmayabilir aksesuar kullanımını gerektirir. Buna ek olarak, tübül squash tekniği sadece çoğu hücre biyoloji laboratuvarlarında genellikle standart ekipman gerektirir.
Burada açıklanan tübül squash yöntem sertoli hücreleri, spermatogonia, birincil ve ikincil spermatocytes ve spermatids de dahil olmak üzere seminifer tübül içinde bulunan farklı hücre tipleri görselleştirmek için kullanılabilir. Bu teknik spermatogenez Juvenil farelerde-zaman uyumlu ilk dalga ile tarafından kaplin, mayoz12ilerledikçe zenginleştirilmiş nüfus spermatogenic hücre elde etmek mümkündür. Bu işlem süreçleri boyunca sperma, erken profaz olayları gibi ayrıntılı analizini, G2/MI ve metafaz anafaz geçişler ve spermiogenesis için izin verir. Ayrıca, tübül squash hazırlıklar kromozomlar (interchromatid etki alanları (ICDs) ve kinetochores gibi) ve centrosomes (centrioles ve pericentriolar malzeme/matrisler) saytolojik özelliklerini görselleştirmek için kullanılabilir. Squash yöntemi Kromatin yayılır ve protein ayıklama gibi diğer deneysel yaklaşımlar ile paralel olarak kolayca gerçekleştirilebilir. Buna ek olarak, bu tekniği yaşam spermatogenic hücreleri doğrudan görselleştirme13slaytlarda yatırmak için başarıyla değiştirildi.
Burada açıklanan yöntemi G2/MI geçiş vahşi tipli C57BL/6J farelerde analiz etmek için tüm cep telefonu seminifer tübül squash tekniği içerir. Birincil spermatocytes ilk segregasyonun bölümü girerek saytolojik özelliklerini segregasyonun iğ gözlemlemek için ayirt mikroskobu ile görüntülenir. Bu çok yönlü teknik diğer segregasyonun aşamaları ve farklı hücre tipleri görselleştirmek için kolayca değiştirilebilir. Ayrıca DNA ve RNA balık yaklaşımlar gibi alternatif görselleştirme stratejileri için mükellef bir tekniktir.
Protokol
Fare kullanımı kurumsal hayvan bakım ve kullanmak Komitesi, Johns Hopkins Üniversitesi tarafından onaylanmıştır. Deneyler gerçekleştirilen çocuk (20-26 gün post-partum, dpp) C57BL/6J fareler, sperma yarı zaman uyumlu ilk nesil yararlanarak. Ancak, bu teknik aynı zamanda yetişkin fare kullanılarak gerçekleştirilebilir.
1. diseksiyon ve fare seminifer tübüllerin yalıtım
- Tablo 1 ve Tablo 2' de anlatıldığı düzeltme/lizis çözüm ve antikor seyreltme arabellek (ADB) hazırlayın.
- Bir 35-mm Petri kabına 1 fosfat tamponlu tuz (1 x PBS, pH 7,4) x 3 mL ile ve 2 mL fare başına düzeltme/lizis çözeltisi ile başka bir 35 mm yemek hazırlamak.
- Fareyi servikal yerinden çıkması veya CO2 Havasızlıktan Boğulma yoluyla kurban ve ventral karın % 70 etanol ile sprey. V şeklinde bir açılış yapmak steril makas kullanarak abdominopelvic boşluğu açın. Sonra testis forseps kullanarak epididimal yağ yastığı çekerek çıkarın ve tunica albuginearahatsız edici kaçının. Testis bir 35 mm 1 x PBS içeren kabında yerleştirin.
Not: Sperma ilk dalga faiz14zenginleştirilmiş hücre nüfusu gözlemlemek amacıyla kullanmaktadır. Sperma belirli aşamalarında farklı fare yaş (Tablo 3) zenginleştirilmiş. - Testis tunica albuginea keskin uçlu Forseps ile doku delinme tarafından kaldırmak ve gevşek seminifer tübüllerin toplamak. Tübüllerin 2 mL düzeltme/lizis çözeltisi içeren yeni 35-mm Petri kabına için transfer.
- Oda sıcaklığında 5 min için düzeltme/lizis çözümde tübüllerin kuluçkaya.
2. seminifer tübüllerin hazırlanması
- Poli-L-lizin kaplamalı cam slayt slayt kenarlarını sıvı engelleyici kalemle özetleyen tarafından hazırlayın.
- Düzeltme/lizis çözeltinin 100 µL cam slayt merkezi için geçerlidir.
- Steril forseps kullanarak ve makas yavaşça alay ayrı seminifer tübüllerin. Uzun bireysel tübül kesmek yaklaşık 20 mm boylarda kesim.
Not: Centrosomes gibi uzun süre sabitleştirici maruz duyarlıdır yapıları görselleştirmek, tübüllerin ilk 1 x PBS ayrı sonra doğrudan yüzeyinde tübüllerin bin dereden su getirmek için düzeltme-lysis çözüm 100 µL içinde Poli-lizin slaytlar kaplı. - Beş 20 mm uzun seminifer tübül segmentleri düzeltme/lizis solüsyon içeren hazır Poli-L-lizin kaplamalı cam slayt aktarın.
- Steril makas kıyma seminifer tübüllerin 1,5-3,0 mm kesimleri içine kullanarak.
- Kullanarak steril forseps böylece hiçbir doku ile çakışıyor, cam slayt tübül kesimlerinde düzenlemek ve tübüllerin eşit olarak dağıtılır.
Not: Bir cam slayt tübül kesimlerinde en uygun sayısı 20 ve 40 arasında olduğunu.
3. ezici, seminifer tübüllerin
- Dağınık seminifer tübül kesimleri üzerine bir benchtop içeren cam slayt aktarın. Aşırı sıvı doku squash adımı sırasında kaybetmemek için laboratuvar mendil kullanarak kaldırın.
- Cam slayt üzerine bir coverslip (22 x 60-1.5 mm) uygulamak ve 10-20 saniye için palmiye topuk ile basınç uygulayın. Spermatocytes seminifer tübüllerin dağıtmak için yeterli kuvvet uygulamak önemlidir.
Not: Böylece tüm tübül kesimleri kesintiye squashing adım optimize etmek için bir diseksiyon mikroskop kullanarak tübüllerin gözlemlemek. - Slayt forseps kullanarak, hemen flaş dondurma cam slayt sıvı N2 küçük bir dewar içinde 15 saniye veya sıvı kabarcık kesildiğinde kadar. Düz kenarlı jilet ile coverslip immunolabeling hemen, kaldırırsanız, ipucu forseps veya 21'lik iğne iyi.
Not: En iyi sonuçlar, immunolabel için hemen slaytlar (bkz. Adım 4). Ancak, bu noktada slaytlar-80 ° C'de iki haftaya kadar korunabilir. Proteinler ve hücresel yapılar ömrünü en üst düzeye çıkarmak için hemen kuru buz veya-80 ° C dondurucu transfer slaytları depolamanızı ve coverslip slayt üzerinde tutun. İmmunolabeling slaytlar saklandığında, coverslip 15 saniye boyunca sıvı N2 slaytları çeker tarafından 3.3 adımda anlatıldığı gibi kaldırın.
4. Immunolabeling bağlı seminifer tübüllerin
- Slayt 1 x PBS ve yıkama üç kez 50 mL Coplin kavanoza 1 x PBS içeren 5 min için bırakın.
Not: Slaytlara asla izin immunolabeling sırasında tamamen kuru. - Antikor seyreltme arabelleği için 1-2 h oksijen odasında engellemek için cam slayt üzerine 1 mL uygulanır.
- Antikor seyreltme arabellek kaldırmak ve birincil antikor antikor seyreltme arabellekte bir oksijen odası içinde seyreltilmiş 100 µL uygulayın.
Not: En iyi sonuçlar için birincil antikorlar gecede 4 ° C'de kuluçkaya Antikor (örneğin 50 µL) daha küçük hacimli bir coverslip veya parafilm içeren slaydı kapsayan tarafından kullanın. Doğrulamak ve birincil antikorlar15en iyi duruma getirme. - Üç kez 5 min için slaytlar 1 x PBS içeren bir 50 mL Coplin kavanoza durulayın.
Not: Yıkar geliştirmek için bir küçük manyetik heyecan çubuğunu kullanarak Coplin kavanoz kışkırtmak ve düşük hızda bir manyetik heyecan tabakta yerleştirin veya düşük hızda masa üstü bir mikser Coplin kavanoz yerleştirin. - İkincil antikor antikor seyreltme arabelleği için 1-1.5 saat oda sıcaklığında bir oksijen odasında seyreltilmiş 100 µL uygulanır. Fotoğraf Birleşik fluorophore antikorlar ağartma önlemek için koyu bir kutu içindeki slaytları kuluçkaya.
Not: Antikor (örneğin 50 µL) daha küçük hacimli bir coverslip veya parafilm içeren slaydı kapsayan tarafından kullanın. - İki kez 5 min için slaytlar 1 x PBS içeren bir 50 mL Coplin kavanoza durulayın.
- Montaj orta (DAPI, 1,5 µg/mL) 4', 6-diamidino-2-phenylindole içeren slayt monte ve coverslips (22 x 60-1.5 mm) uygulayın.
- Coverslips açık oje slaytları korumak ve coverslips taşınmasını engelleme içeren slaytlara kapatın.
5. analiz ve görüntüleme tübül squash hazırlıkları
- Kesin z ekseni hareketi ve görüntü yakalamak için yüksek çözünürlüklü bir kamera sağlar otomatik sahne ile bir epifluorescence mikroskobu kullanın. Alternatif olarak, lazer confocal mikroskop kullanın.
Not: Herhangi bir kullanılabilir donanım ve yazılım için bu adımı kullanın. Örneğin, şekil 1 ve Şekil 2 görüntülenen görüntüleri kullanarak bir hücre gözlemci bir ORCA-Flash 4.0 CMOS kamera bağlı ve Zeiss ZEN 2012 mavi edition görüntü yazılım ile analiz Zeiss Z1 ele geçirildi. - Squash hazırlık kalitesini belirlemek için bir 20 X hedefi kullanarak slaytları değerlendirmek. Kaliteli slaytların eşit şekilde dağıtılır çekirdeği monolayer olacaktır.
Not: Bazı bölümler slaydın diğerlerinden daha iyi olabilir, daha yüksek büyütme kullanarak daha ayrıntılı bir çözümleme için slayt en iyi bölgelerinde bulunabileceği koordinatları Not yararlıdır. - Yüksek büyütme objektif (örneğin 63 X veya 100 X), çekirdek tutarlı bir monolayer var yakalama bölgeleri slayt kullanarak. Bir bölge seçtikten sonra üst ayarla ve tüm odak ışık yakalanır emin olmak için Z-yığınları daha düşük.
Not: Z-yığınlar alt ve üst sınırı arasında yakalanan en uygun sayısı genellikle görüntü alma yazılımı tarafından atanır ve her amaç için farklı değil. - Genişletilmiş derinlik odak resim derlemek için görüntü işleme yazılımı kullanın. Belgili tanımlık bilgisayar yazılımı her Z-yığın, odakta ışıktan birleştirir ve tübül squash hazırlıklar en iyi görüntüleme için esastır.
Sonuçlar
Burada, metafaz profaz geçiren geçici hücre popülasyonlarının görselleştirmek için tübül squash yöntemi kullandık ben (G2/MI) testis sperma (24 ilk dalga geçiyor Juvenil vahşi tipi fareler gelen hasat tarafından zenginleştirilmiş geçiş DPP). Şekil 1 tübül squash yöntemi kullanılarak görüntülenir çeşitli hücre aşamalarında temsilcisi görüntülerini gösteriyor. Zenginleştirilmiş metafaz nüfus ben spermatocytes Alfa-tübülin (şekil 1A) karşı antikor kullanarak görüntülenir. Biz erken ve geç mayoz için işaretleri kullanılan ben sahne segregasyonun ilerleme için. Tübül squash hazırlıklar immunolabeled bir antikor profaz ı. Leptotene/zygotene aşamaları görselleştirmek için SYCP3, synaptonemal kompleks protein ile vardı ve pachytene/diplotene spermatocytes şekil 1Badımında gösterilir. Birinci segregasyonun Ligi geçiren spermatocytes açıkça belirlenebilir Alfa-tübülin karşı antikor kullanarak (şekil 1A ve 1 C). Tübül squashes geç segregasyonun olayları incelemek için hücre döngüsü kinaz Aurora B (AURKB), hangi iç şeması metafaz sırasında yerelleştirir, karşı antikor kullanarak immunolabeled sonra sırasında iğ midzone ve bölünme karık için relocalizes olduğunu anafaz ve sitokinez, sırasıyla (şekil 1 c). Kromozom saytolojik özellikleri ilk segregasyonun bölünme sırasında görüntülenir. ICDs gözlemlemek için tübül squash hazırlıkları vardı mayoz özel Alfa-kleisin alt birimi, cohesin, REC8 karşı antikor kullanarak immunolabeled (şekil 1 d). Kromozom dynamics anafaz sırasında Alfa-tübülin immunolabelling ve DNA leke, DAPI kullanarak değerlendirildi. Bir anafaz köprü içeren bir spermatocyte şekil 1Fiçinde gösterilir iken ilk segregasyonun bölümü başarıyla tamamlayan bir spermatocyte şekil 1Eiçinde gösterilir. Tübül squash tekniği, segregasyonun iğ uzunluğu kullanarak, kromozom hizalama ve segregasyon ölçülebilir ve mutant ve kontrol fareler arasında karşılaştırıldığında.
Belgili tanımlık yarar ben Şekil 2' de gösterilmiştir, ek hücre döngüsü geçişler ve profaz ile ilişkili hücre altı yapıları görüntüleme için bu yöntemin. Profaz leptotene substage sırasında ben, homolog kromozom eşleştirme başlatma dinamik değişiklikler, telomer eklerindeki bir tek kutup nükleer zarf (NE)16, karşı karşıya kromozom kümeleri oluşumu ikna etmek için aracılık ettiği 17 , 18 , 19 , 20. kromozom "buket" olasılığını ve arası homolog etkileşimleri (şekil 2A)sıklığını artırmak için düşünce olarak bilinen bu uyum. Başlatma ve synapsis homolog kromozomlar arasında tamamlanması oluşur zygotene (şekil 2B) ve pachytene substages (şekil 2C), sırasında sırasıyla aşamalı dağılım ile ilgili Kromozom buket. Synapsis ve kromozom buket dinamikleri Juvenil farelerde, biz immunolabeled tübül squash hazırlıklar SYCP3 ve sentromerler antikorlar ile aynı anda değerlendirmek için ve DAPI kullanarak DNA için lekeli. Fare kromozomlar telocentric, bu nedenle şeması immunolabeling telomer Kuzey eklerinde değişiklikleri algılamak için kullanılmıştır.
Segregasyonun kromozomal inactivation (MSCI) erkek mayoz için benzersiz bir hallmark sayede homolog X ve Y kromozomu aşmak denetim noktası etkinleştirme kromozom çapında fosforilasyon Histon varyantın H2AFX (yH2AX; pSer139) geçiren tarafından21 ,22,23. X-Y kromozom çifti transcriptionally susturdu ve "seks beden" olarak adlandırılan bir yoğun nükleer alt etki alanı bölümlere MSCI geçiren spermatocytes kolayca belirlenebilir sırasında pachytene ve diplotene substages tarafından immunolabeling tübül squash hazırlıklar antikorlar ile yH2AX (Ser139). Şekil 2B tasvir bir spermatocyte pachytene substage immunolabelled yH2AX karşı antikor ile (Ser139), sentromerler ve DNA görselleştirmek için DAPI ile lekeli.
Centrosome çoğaltma yarı muhafazakar ve ben erkek mayoz DNA tamamlanmasından sonra elde edilen her kızı hücre iki centrioles (tek centrosome) hücre bölünmesi24,25 takip devralan emin olmak için onarım profaz sırasında gerçekleşir . Centrosomes esnek bir bağlayıcı tarafından bağlı iki uygun düzenlenmiş centrioles oluşur ve proteinlerin pericentriolar malzeme/matris (PCM)26bilinen amorf bir matris tarafından çevrili. Pachytene substage içinde çoğaltma sonra yeni çiftleri birbirinden ayırın ve centrosome olgunlaşması ve zıt kutupları geçiş sırasında iki kutuplu iğ oluşumunu kolaylaştırmak için diplotene sahne tabi centriole oluşan. Yeni kurulan centriole çiftleri disjunction geçiren erken bir diplotene spermatocyte immunolabeling tübül squash hazırlıkları ile pericentrin (PCNT), PCM ve Centrin-3 (CETN3) işaretlemek için protein bileşenidir karşı antikor tarafından görüntülenmiştir centrioles (şekil 2E). Evreleme SYCP3 karşı antikor kullanılarak tespit edildi ve DAPI DNA leke için kullanıldı.
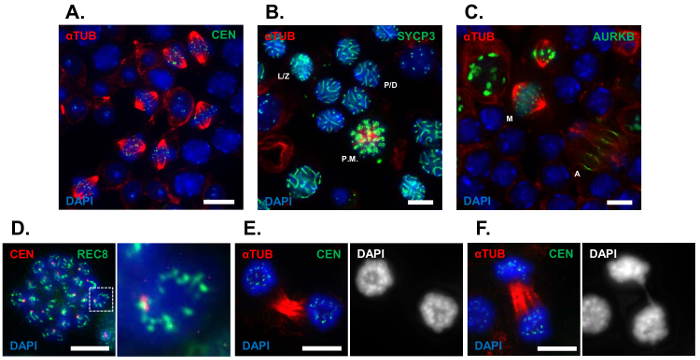
Resim 1 : Tübül squash hazırlıklar kullanarak segregasyonun G2/MI geçiş temsilcisi analizi. C57BL/6J yaşlı fareler 24 dpp seminifer tübül kesimlerinde tübül squash hazırlıklar yapıldı. (A) DNA ve alfa-tübülin (kırmızı), sentromerler (yeşil) karşı antikor ile gelişmekte olan spermatocytes immunolabeled temsilcisi alanında DAPI (4', 6-diamidino-2-phenylindole, mavi) leke. (B) vahşi tipi tübül squashes DAPI (mavi) yanı sıra immunolabeled Alfa-tübülin (kırmızı) karşı antikor ile ve SC, SYCP3 (yeşil) yan unsuru ile lekeli. (C) vahşi tipi tübül squashes DAPI yanı sıra immunolabeled ile Alfa-tübülin (kırmızı) karşı antikor (mavi) ve hücre döngüsü kinaz AURKB ()yeşil ile lekeli). Saytolojik özellikleri ICDs ve anafaz köprüler gibi kromozomların tübül squash hazırlıklar kullanarak görüntülenmeyecektir. (D) ICDs gözlemlemek için prometafaz spermatocytes immunolabeled yanı sıra bir segregasyonun belirli cohesin bileşeni, REC8 (yeşil) (kırmızı) sentromerler karşı antikor ile idi ve DAPI (mavi) ile lekeli. (E, F) Kromozom morfolojisi Alfa-tübülin (kırmızı), sentromerler (yeşil) karşı antikor kullanarak anafaz sırasında görüntülenir ve DAPI leke (mavi). Spermatocytes geliştirme tam kadro-ebilmek var olmak identified tübül squash tekniği (L/Z, leptotene/zygotene sahne spermatocytes; P/D, pachytene/diplotene sahne spermatocytes; ' De, prometafaz spermatocytes; M, metafaz spermatocytes; A, anafaz spermatocytes). Ölçek çubuğu 10 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2 : Ek morfolojik değişiklikler ve yapıları tübül squash hazırlıklar kullanarak erkeklerde segregasyonun profaz ilerleme ile ilgili örnekleri. Tarih C57BL/6J fareler segmentlerinin 12-18 dpp yaşlı ve DAPI (4', 6-diamidino-2-phenylindole, mavi) DNA etiketlemek için lekeli seminifer tübül tübül squash hazırlıklar yapıldı. (A-C) Homolog synapsis oluşumu ve kromozom "buket" ilerici dağılma sırasında profaz ilerleme için birleştirilmiştir. Leptotene (A), zygotene (B)ve pachytene (C) sahne spermatocytes immunolabeled ile SYCP3 (kırmızı) karşı antikor ve sentromerler (yeşil) olduğunu. (D-E) Tübül squash hazırlıklar benzersiz saytolojik değişiklikleri algılamak için kullanılan ve ben segregasyonun kromozomal inactivation (MSCI) ve centrosome çoğaltma gibi ilerleme sırasında erkek profaz yapıları. (D) MSCI geçiren Pachytene sahne spermatocytes karşı antikorlar için yH2AX kullanarak tespit edildi (Ser139 seks-vücut (Yeşil ok), etiket) ve sentromerler kırmızıyla gösterilir. (E) Diplotene sahne spermatocytes SYCP3 (kırmızı) ve centrosomes (ok ucu) karşı antikor kullanarak tespit edilmiştir tespit Centrin-3 (yeşil) ve Pericentrin (macenta) karşı antikor centrioles ve pericentriolar etiket için kullanma malzeme/matris, anılan sıraya göre. Ölçek çubuğu 10 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Madde | Tutar | Son konsantrasyonu |
| 1 x PBS | 10 mL | 1 x |
| % 16 PFA | 500 μL | %0.8 (v/v) |
| PBS TritonX-%100 10 | 100 μL | %0,1 (v/v) |
Tablo 1: düzeltme/lizis çözüm. Açıklama: pH 9 NaOH [50 mM] ile ayarlayın. Çözüm konteyner ışıktan korumak ve 4 ° C'de depolamak için alüminyum folyo şal Bir haftadan fazla Eğer eski düzeltme/lizis çözüm kullanmayın. Katı PFA çözüm yapmak için de kullanılabilir. Bir fumehood kullanılması PFA maruz önlemek için tavsiye edilir.
| Madde | Tutar | Son konsantrasyonu |
| 1 x PBS | 50 mL | 1 x |
| BSA | 1.5 g | %3 (w/v) |
| At Serum | 5 mL | % 10 (v/v) |
| PBS TritonX-%100 10 | 250 μL | %0,05 (v/v) |
Tablo 2: antikor seyreltme arabellek (ADB) tarifi. Açıklama: Mağaza ADB 4 ° C'de veya donma stokları büyük miktarlarda yapma-20 ° c. ADB kontamine olabilirler, iyi aseptik teknikler kullanılır ve kirlenme her kullanımdan önce için çözüm değerlendirmek emin olun. ADB kirlenme en aza indirmek için daha küçük aliquots hazırlayın.
| Hücre tipi | Hücresel süreç | Fare yaş (dpp) |
| Leptotene | DNA DSB oluşumu | 10 - 12 |
| Aksiyel öğeleri Meclisi | ||
| Zygotene | Homolog DSB onarım ve synapsis başlatma | 12 - 16 |
| Pachytene | Otozomal DSB onarım tamamlanması | 16 - 20 |
| Olgunlaşma crossover rekombinasyon olayların | ||
| Homologs arasında tam synapsis | ||
| Segregasyonun kromozomal Inactivation (MSCI) | ||
| Centriole çoğaltma/Centrosome olgunlaşma | ||
| Diplotene ve Diakinesis | SC Desynapsis | 18 - 22 |
| Centrosome ayırma | ||
| Metafaz ben | İğ denetim noktası | 22 - 26 |
| Yuvarlak Spermatid | Protamine değiştirme | > 24 |
| Acrosome oluşumu |
Tablo 3: sperma Juvenil farelerde yakınındaki-zaman uyumlu ilk dalgası. Açıklama: Sperma belirli aşamalarında farklı yaşlardaki çocuk fare zenginleştirilmiş.
Tartışmalar
Fareler spermatogenez sırasında segregasyonun ilerleme yöneten hücresel olaylar çalışmak için faydalı model organizma olduğu kanıtlanmıştır. Ayrıca, ben segregasyonun profaz gibi birçok olay, çıkmak çünkü spermatogenez çalışma için yiyecek ve içecek araçları geliştirmek için gerekli, cinsel dimorfik vardır. Bu iletişim kuralı görselleştirme ve fare spermatogenez farklı aşamalarında incelenmesi için seminifer tübül squash yöntemi açıklar. Bu yöntem hücresel bütünlüğü korur ve böylece nükleer ve sitoplazmik yapıların detaylı analizler sağlar. Bu çalışmada tasvir temsil edici sonuçlar yardımcı programı birincil spermatocytes segregasyonun ilerleme geçiren değerlendirirken bu protokol gösterilmektedir. Ayrıca, bu iletişim kuralı diğer hücresel süreçler yayılması ve spermatogonia farklılaşma ve spermiogenesis27,28aşamalarını da dahil olmak üzere spermatogenez sırasında çalışmak için de kullanılabilir. İçinde açıklanan yöntemleri çoğu yukarıda açıklanan tübül squash teknikleri8,9adapte. Ancak, bu iletişim kuralı tüm reaktifler ve gerekli, Floresans mikroskobu ile tek hücreleri görüntülenmesi için tübüllerin doğrulamasına adımları kapsayan ilk ayrıntılı rehber olduğunu. Ayrıca, biz centriole ve tekniği ile görüntülenmiştir telomer buket de dahil olmak üzere ek hücresel özellikleri görüntüleri sundu.
Anahtar tübül squash hazırlıklar optimize etmek için vardır birkaç teknik unsurlar vardır. İlk olarak, bir cam coverslip için uygun miktarda güç uygulamanız gerekir. En hücreler seminifer tübüllerin içinde kalacak gibi yeterli kuvvet uygulamak için başarısızlık slaytlar kaç yapisan hücrelerle üretecek. İkinci olarak, bir düzeltme/lizis çözüm testis malzeme uygun süre boyunca kuluçkaya gerekir. Genel olarak, fiksasyon için 5 dk sınırlı olmalıdır, ama bir aralığı 5 ve 15 dk arasında kabul edilebilir. Uzun bir süre sabit tübüllerin değiştirmek ve kötü sonuçlar zor olacak. Ancak, İngiltere'de yılın konsantrasyonu azaltarak kuluçka süresini uzatmak için mümkündür. Örneğin İngiltere'de yılın yüzde %0,5 düşürücü artan kuluçka kez düzeltme/lizis çözüm için izin verecek. Biz sundu yönteminde permeabilization ve fiksasyon adımlar aynı anda, ancak adımları gerçekleştirilebilir, birbiri ardına sırasıyla gerçekleşir. Permeabilization ve fiksasyon adımları ayıran sitoplazmik arka plan sinyal düzeylerini azaltmaya yardımcı olabilir. Fiksasyon ve/veya permeabilization stratejileri varyasyonu da belirli hücre altı yapısı veya antikor değerlendirmesi için koşulları optimize etmek için test edilebilir. Örneğin, görselleştirme centrosomal ve Milli proteinler gelişmiş yerine İngiltere'de yılın29,30,31metanol kullanarak. Ayrıca, sperma (yaklaşık 10-26 dpp) ilk dalga ile amacıyla özellikle ilerliyor ve sağlam nadir segregasyonun hücresel olaylar12görselleştirmek Juvenil fare kullanmak faydalıdır. Alternatif olarak, seminifer tübül32içinde ışık emilimi model gözlemleyerek yetişkin fareler sahne özgü segregasyonun hücreleri izole etmek mümkündür. Sperma zaman uyumsuz döngüsünün yetişkin fareler göz önüne alındığında, ancak, nadir segregasyonun olaylar ayrıntılı olarak analiz etmek zor olabilir. Bu sınırlama ile bisdichloroacetyldiamine, 18,446, kazanmak hangi blok A vitamini metabolizma farelere enjekte edilerek üstesinden gelebilir ve spermatogonial farklılaşma33durdurur. KAZANMAK 18,466, sperma yeniden başlamasını ile tedavi aşağıdaki zaman uyumlu olarak, zenginleştirilmiş germ hücre popülasyonlarının olgun hayvan34üzerinden büyük miktarlarda verimli ortaya çıkar. Bu eşitleme stratejisi tübül squash teknik önce spermatogenez yetişkin35,36, ortaya çıkan bu ilk yarı zaman uyumlu dalgaları arasındaki farklar araştırmak için kullanılabilir 37. Ayrıca, baba tarafından yaşlanma ve anöploidi arasında korelasyon da kazanmak 18,466 eşitleme ve değerlendirmeye yönelik kromozom segregasyon tübül squash yöntemiyle ile tespit edilebilir.
Özet olarak, bu yöntem ayirt mikroskobu ile birlikte hücrelere sperma farklı aşamalarında gözlemlemek için kullanılabilir. Daha geniş uygulanan, bu teknik de spermatogonia, spermatocytes ve spermatids alt nüfus değerlendirmek için kullanılabilir ve çok çeşitli işlemler sırasında spermatogenez eğitim için uygun olabilir. Bu yaklaşım spermatocytes görüntüleme ve modifiye canlı hücre için a değişiklik-in hücresel ve biyokimyasal araştırmalar38,39,40yapmak için kullanılmıştır. Bu kolayca insan40da dahil olmak üzere diğer memeli sistemlere uygulanması gerektiğini düşündüren fare ve sıçan seminifer tübüllerin için tübül squash tekniği kullanılmıştır. Bu teknik infertilite ve sperm anöploidi ortaya çıkmasına hücresel tedirginlikler tanımlamak yardımcı olabilir.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser NIGMS (R01GM11755) için P.W.J. ve S.R.W. ve J.H. eğitim grant bursu üzerinden Ulusal Kanser Enstitüsü (NIH) (CA009110) tarafından desteklenmiştir
Malzemeler
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde Aqueous | Electron Microscopy Sciences (EMS) | 15710 | |
| 10x PBS | Quality Biological | 119-069-161 | |
| Triton X-100 | Sigma | T8787 | |
| BSA | Sigma | A1470 | |
| Horse Serum | Sigma | H-1270 | |
| 35mm x 10mm Petri Dish, Sterile, non-treated | CellTreat | P886-229638 | |
| Poly-L-lysine coated glass slides | Sigma | P0425-72EA | |
| Liquid Blocker Pen | Electron Microscopy Sciences (EMS) | 71310 | |
| Humid Box | Evergreen | 240-9020-Z10 | |
| Wheaton Coplin Glass Staining Dish for 5 or 10 Slides | Fisher | 08-813E | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Labs | H-1200 | |
| Microscope Cover Slides (22mmx60mm) | Fisher | 12-544-G | |
| Clear Nail Polish | Amazon | N/A | |
| Microsopes | |||
| Name | Company | Catalog Number | Comments |
| SteREO Discovery.V8 | Zeiss | 495015-0001-000 | |
| Observer Z1 | Zeiss | 4109431007994000 | |
| Zeiss ZEN 2012 blue edition image software | Zeiss | ||
| ORCA-Flash 4.0 CMOS camera | Hamamatsu | ||
| Primary Antibodies | |||
| Name | Company | Catalog Number | Comments |
| Mouse anti-SYCP3 | Santa Cruz | sc-74569 | 1 in 50 |
| Rabbit anti-SYCP3 | Fisher (Novus) | NB300-231 | 1 in 1000 |
| Goat anti-SCP3 | Santa Cruz | sc-20845 | 1 in 50 |
| Human anti-Centromere Protein | Antibodies Incorporated | 15-235 | 1 in 100 |
| Mouse anti-alpha tubulin | Sigma | T9026 | 1 in 1000 |
| Mouse anti-AIM1 | BD Biosciences | 611082 | 1 in 200 |
| Mouse anti-γH2AX | Thermo Fisher | MA1-2022 | 1 in 500 |
| Mouse anti-CENT3 | Abnova | H00001070-M01 | 1 in 200 |
| Rabbit anti-pericentrin | Abcam | ab4448 | 1 in 200 |
| Rabbit anti-REC8 | Courtesy of Dr. Karen Schindler | N/A | 1 in 1000 |
Referanslar
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nature Rev Genet. 13 (7), 493-504 (2012).
- Morelli, M. A., Cohen, P. E. Not all germ cells are created equal: Aspects of sexual dimorphism in mammalian meiosis. Reproduction. 130 (6), 761-781 (2005).
- Sun, F., Handel, M. A. Regulation of the meiotic prophase I to metaphase I transition in mouse spermatocytes. Chromosoma. 117 (5), 471-485 (2008).
- Namekawa, S. H. Slide preparation method to preserve three-dimensional chromatin architecture of testicular germ cells. J Vis Exp. (83), e50819 (2014).
- La Salle, S., Sun, F., Handel, M. A. Isolation and short-term culture of mouse spermatocytes for analysis of meiosis. Methods Mol Biol. 558, 279-297 (2009).
- Galdon, G., Atala, A., Sadri-Ardekani, H. In vitro spermatogenesis: how far from clinical application?. Curr Urol Rep. 17 (7), (2016).
- Staub, C. A century of research on mammalian male germ cell meiotic differentiation in vitro. J Androl. 22 (6), 911-926 (2001).
- Page, J., Suja, J. A., Santos, J. L., Rufas, J. S. Squash procedure for protein immunolocalization in meiotic cells. Chromosome Res. 6 (8), 639-642 (1998).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nat Methods. 1 (3), 249-254 (2004).
- Xu, X., Xu, P. A modified cryosection method for mouse testis tissue. Tissue Cell. 33 (2), 208-210 (2001).
- Hess, R., Moore, B. Histological methods for evaluation of the testis. Methods Toxicol. 3 (Pt A), 52-85 (1993).
- Bellvé, A. R. Purification, culture, and fractionation of spermatogenic cells. Methods Enzymol. 225, 84-113 (1993).
- Ventela, S., Toppari, J., Parvinen, M. Intercellular organelle traffic through cytoplasmic bridges in early spermatids of the rat: mechanisms of haploid gene product sharing. Mol Biol Cell. 14 (July), 2768-2780 (2003).
- Bellvé, A. R., et al. Dissociation of the mouse testis and characterization of isolated spermatogenic cells. J Histochem Cytochem. 25 (7), 480-494 (1977).
- Burry, R. W. Controls for immunocytochemistry: an update. J Histochem Cytochem. 59 (1), 6-12 (2011).
- Zickler, D., Kleckner, N. Recombination, pairing, and synapsis of homologs during meiosis. Cold Spring Harb Perspect Biol. 7 (6), 1-26 (2015).
- Hunter, N. Meiotic recombination: the essence of heredity. Cold Spring Harb Perspect Biol. 7 (12), 1-36 (2015).
- Scherthan, H., et al. Centromere and telomere movements during early meiotic prophase of mouse and man are associated with the onset of pairing. J Cell Biol. 134 (5), 1109-1125 (1996).
- Zickler, D., Kleckner, N. The leptotene-zygotene transition of meiosis. Annu Rev Genet. 32, 619-697 (1998).
- Scherthan, H. A bouquet makes ends meet. Nat Rev Mol Cell Biol. 2 (8), 621-627 (2001).
- Turner, J. Meiotic sex chromosome inactivation. Development. 134 (10), 1823-1831 (2007).
- Royo, H., et al. ATR acts stage specifically to regulate multiple aspects of mammalian meiotic silencing. Genes Dev. 27 (13), 1484-1494 (2013).
- Turner, J. M., et al. Silencing of unsynapsed meiotic chromosomes in the mouse. Nat Genet. 37 (1), 41-47 (2005).
- Marjanović, M., et al. CEP63 deficiency promotes p53-dependent microcephaly and reveals a role for the centrosome in meiotic recombination. Nat Commun. 6, 7676 (2016).
- Inanç, B., Dodson, H., Morrison, C. G. A Centrosome-autonomous signal that involves centriole disengagement permits centrosome duplication in G2 phase after DNA damage. Mol Biol Cell. 21, 3866-3877 (2010).
- Firat-Karalar, E. N., Sante, J., Elliott, S., Stearns, T. Proteomic analysis of mammalian sperm cells identifies new components of the centrosome. J Cell Sci. 127 (Pt 19), 4128-4133 (2014).
- Fukuda, N., et al. The transacting factor CBF-A/Hnrnpab binds to the A2RE/RTS element of protamine 2 mRNA and contributes to its translational regulation during mouse spermatogenesis. PLoS Genet. 9 (10), e1003858 (2013).
- Lahn, B. T., et al. Previously uncharacterized histone acetyltransferases implicated in mammalian spermatogenesis. Proc Natl Acad Sci U S A. 99 (13), 8707-8712 (2002).
- Mermoud, J. E., Tassin, A. M., Pehrson, J. R., Brockdorff, N. Centrosomal association of histone macroH2A1.2 in embryonic stem cells and somatic cells. Exp Cell Res. 268 (2), 245-251 (2001).
- Shanmugam, M., Hernandez, N. Mitotic functions for SNAP45, a subunit of the small nuclear RNA-activating protein complex SNAPc. J Biol Chem. 283 (21), 14845-14856 (2008).
- Ganem, N. J., Godinho, S. A., Pellman, D. A mechanism linking extra centrosomes to chromosomal instability. Nature. 460 (7252), 278-282 (2009).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nat Methods. 1 (3), 249-254 (2004).
- Amory, J. K., et al. Suppression of spermatogenesis by bisdichloroacetyldiamines is mediated by inhibition of testicular retinoic acid biosynthesis. J Androl. 32 (1), 111-119 (2011).
- Hogarth, C. A., et al. Turning a spermatogenic wave into a tsunami: synchronizing murine spermatogenesis using WIN 18,446. Biol Reprod. 88 (2), 40 (2013).
- Yoshida, S., et al. The first round of mouse spermatogenesis is a distinctive program that lacks the self-renewing spermatogonia stage. Development. 133 (8), 1495-1505 (2006).
- Kluin, P. M., Kramer, M. F., Rooij, D. G. Spermatogenesis in the immature mouse proceeds faster than in the adult. Int J Androl. 5 (3), 282-294 (1982).
- Rodriguez, I., Ody, C., Araki, K., Garcia, I., Vassalli, P. An early and massive wave of germinal cell apoptosis is required for the development of functional spermatogenesis. EMBO J. 16 (9), 2262-2270 (1997).
- Kangasniemi, M., et al. Modulation of basal and FSH dependent cyclic AMP production in rat seminiferous tubules staged by an improved transillumination technique. Anat Rec. 227 (1), 62-76 (1990).
- Martianov, I., et al. Late arrest of spermiogenesis and germ cell apoptosis in mice lacking the TBP-like TLF/TRF2 gene. Mol Cell. 7 (3), 509-515 (2001).
- Henriksén, K., Parvinen, M. Stage-specific apoptosis of male germ cells in the rat: Mechanisms of cell death studied by supravital squash preparations. Tissue Cell. 30 (6), 692-701 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır