Method Article
טכניקה סקווש צנורית וכמה לניתוח Cytological של יצירת זרע שימוש במודל עכבר
In This Article
Summary
מטרת טכניקה זו סקווש צנורית הוא להעריך במהירות תכונות cytological של פיתוח העכבר spermatocytes תוך שמירה על תקינות הסלולר. שיטה זו מאפשרת הלימוד בכל שלבי יצירת זרע, ניתן ליישם בקלות לצד הביוכימי והמולקולרי ביולוגי גישות אחרות לצורך המחקר של העכבר מיוזה.
Abstract
התקדמות meiotic של הזכרים הוא תהליך הדורש פעולה מתואמת של מספר אירועים הסלולר בעלות רגולציה. שגיאות שאירעו במהלך המיוזה יכול להוביל פוריות, אובדן הריון או פגמים גנטיים. . מתחיל עם תחילת גיל ההתבגרות וממשיכים לאורך הבגרות, גלים סינכרונית למחצה רציפה של spermatocytes עוברים יצירת זרע, ובסופו של דבר להקים זרע הפלואידי. הגל הראשון של העכבר spermatocytes שעברו חניכה meiotic מופיעים ב יום 10 לכתיבה (10 dpp), משתחררים לתוך לומן של בקוריאנית וכמה כמו זרע בוגרת ב 35 dpp. לכן, זה יתרון כדי לנצל עכברים בתוך חלון הזמן התפתחותית זו כדי להשיג את אוכלוסיות מועשר עניין. ניתוח נדיר תא שלבים קשה יותר בעכברים בוגרים בשל תרומתה של גלים spermatogenic רצופים, אשר מגבירים את המגוון של אוכלוסיות סלולר בתוך בקוריאנית. השיטה המתוארת כאן היא טכניקה מיושמים בקלות על הערכה cytological של התאים המצויים על בקוריאנית וכמה עכברים, כולל spermatogonia, spermatocytes ו- spermatids. הטכניקה סקווש צנורית שומר על השלמות בתאי הנבט זכר מבודדת ומאפשרת בחינת מבנים הסלולר לא דמיינו בקלות עם טכניקות טיפול נוספות. כדי להדגים את היישומים האפשריים של טכניקה זו סקווש צנורית, פלך הרכבה היה בפיקוח spermatocytes להתקדם דרך prophase כדי מפה של שאני מעבר (מעבר G2/MI). בנוסף, שכפול centrosome, כרומוזום מין meiotic איון (MSCI) ואת היווצרות כרומוזום זר היו העריכו דוגמאות של המבנים cytological כי יכול להיות שנצפו בשיטה זו סקווש צנורית. טכניקה זו ניתן לאתר פגמים ספציפיים במהלך יצירת זרע שנגרמות על ידי מוטציה או ההפרעות אקסוגני, וכך, תורם להבנת מולקולרית יצירת זרע.
Introduction
מיוזה הוא אירוע הסלולר מורכב שבו סבב אחד של שכפול ה-DNA ואחריו שני כדורים רצופים של חלוקת התא. מספר אירועים ספציפיים מיוזה חייבת להיות מתואמת במהלך בשלבים הראשונים של מיוזה כדי להבטיח הפרדה בין כרומוזום מדויק. אירועים אלו כוללים השלמת רקומבינציה הומולוגית, כיוון משותף של אחותי kinetochores במהלך לליגת העל meiotic, ואובדן stepwise cohesin מתחמי כדי לפתור chiasmata בין homologs. ויסות מדויק של תהליכים אלה הוא הכרחי כדי לשמור על פוריות וכדי למנוע אירועים missegregation כרומוזום זה יכול להוביל גנטי הפרעות התפתחותיות והפלה ספונטנית1.
בזמן האירועים מפתח של מיוזה מתקיימים בזכרים ונקבות, הבדלים משמעותיים הטמפורלי, מכניסטית להתקיים בין יצירת זרע ו oogenesis2. לדוגמה, במהלך המיוזה הנשי, prophase מתרחשת במהלך התפתחות ואני מעצרים בשלב dictyate עד גיל ההתבגרות. לעומת זאת, יצירת זרע מתחילה גיל ההתבגרות ומתקדמת בגלים לאורך כל חיי הבוגרים ללא מעצר. ההבדלים בין זכר ונקבה מיוזה מדגישה את הצורך לפתח שיטות ייענו במיוחד לקראת הערכת תהליכים אלה, הן spermatocytes והן oocytes. כיום, הערכת התקדמות meiotic במידה רבה מסתמך על השימוש של כרומטין כפולות3,4,5. בעוד כרומטין כפולות הם שימושיים ללימוד כרומוזומים meiotic, הם נכשלים לשמר את שלמות הסלולר, מניעת הערכה של מבנים הסלולר כגון ציר microtubules, centrosomes, מעטפת הגרעין, טלומר קבצים מצורפים. חיים הדמיה, טכניקות culturing לטווח ארוך מאוד מתקדמת ההבנה שלנו של מיוזה נקבה; עם זאת, גישות דומות כדי להמחיש את כל התא ללא פגע, בתדירות נמוכה יותר מיושמות לחקר יצירת זרע6,7. על מנת להמחיש את האירועים דינמי במהלך המיוזה זכר, אנחנו הסתגלו צנורית הוקמה טכניקות סקווש להעריך במהירות את התכונות cytological של פיתוח העכבר spermatocytes8,9. השיטה המתוארת כאן שומר על שלמות התא, המאפשר לימוד מספר מבנים הסלולר בשלבים שונים של יצירת זרע.
טכניקה זו סקווש צנורית היא גישה כל התא, המאפשר להערכת מבנים הסלולר באמצעות מיקרוסקופ immunofluorescence. גישות נפוצות היסטולוגית להמחיש התקדמות meiotic בעכברים זכרים כגון haematoxylin ואאוזין מכתים של פרפין מוטבע האשכים, תיוג immunofluorescent של cryosections לאפשר סקירה רחבה של התקדמות meiotic. עם זאת, שיטות אלה להיכשל לפתור תאים בודדים במידה הנדרשת עבור ניתוח מפורט של האירועים המתרחשים במהלך המיוזה10,11. טכניקות חלופיות כדי לחזות תהליכים meiotic להסתמך על הפרעה chemiosmotic משמעותית spermatocyte כדי לבודד ולפתור חומרים גרעיניים3,4,5. טיפולים כימיים אלה לעכב את ההתבוננות סוגי תאים חוץ spermatocytes הראשי. שיטה תיאר לאחרונה על ידי Namekawa אפשרה את קהילת המחקר לשמר את הארכיטקטורה הגרעין של spermatocytes מבודדים, אך מחייב שימוש cytospin ואביזרים עשויים להיות לא זמינים כמה מעבדות4. לעומת זאת, הטכניקה סקווש צנורית רק דורש ציוד זה מקובל בדרך כלל במעבדות בביולוגיה ברוב של התא.
סקווש צנורית השיטה המתוארת כאן ניתן להמחיש את סוגי תאים מגוונים נמצא בתוך צנורית וכמה, כולל תאי סרטולי, spermatogonia, spermatocytes הראשיים והמשניים של spermatids. על ידי צימוד טכניקה זו עם הגל הראשון ליד סינכרוני של יצירת זרע בעכברים לנוער, זה ניתן לקבל מועשר אוכלוסיות של תאי spermatogenic כפי שהם התקדמות דרך מיוזה12. תהליך זה מאפשר ניתוח מפורט של תהליכי במהלך יצירת זרע, כגון אירועים prophase מוקדם, G2/MI מפה של מעברים "אנאפאזה", spermiogenesis. יתר על כן, ההכנות סקווש צנורית ניתן להמחיש התכונות cytological של כרומוזומים (למשל interchromatid תחומים (ICDs) ו- kinetochores), centrosomes (centrioles ו- pericentriolar חומר/מטריצות). השיטה סקווש ניתן לבצע בקלות במקביל עם גישות אחרות, כגון כפולות כרומטין והפקת חלבונים. בנוסף, טכניקה זו שונתה בהצלחה להפקיד מתאים spermatogenic חיים בשקופיות עבור פריט חזותי ישיר13.
השיטה המתוארת כאן כרוכה טכניקה סקווש צנורית וכמה התא כולו כדי לנתח את המעבר G2/MI בעכברים C57BL/6J פראי-סוג. התכונות cytological של ראשי spermatocytes הזנת לליגת העל meiotic היו דמיינו מיקרוסקופ immunofluorescence להתבונן על ציר meiotic. טכניקה זו תכליתי ניתן לשנות בקלות לדמיין אחרים בשלבים meiotic, סוגי תאים שונים. הטכניקה היא גם נוטה אסטרטגיות ויזואליזציה חלופיים, כגון גישות DNA ו RNA דגים.
Protocol
השימוש של עכברים אושרה על ידי טיפול בעלי חיים מוסדיים ו להשתמש הוועדה של אוניברסיטת ג'ונס הופקינס. נערכו ניסויים לנוער (20-26 ימים לכתיבה, dpp) C57BL/6J עכברים, ניצול של הגל הראשון סינכרונית למחצה של יצירת זרע. עם זאת, טכניקה זו ניתן גם לבצע שימוש בעכברים בוגרים.
1. ניתוח ובידוד של העכבר וכמה בקוריאנית
- להכין תקן/פירוק פתרון ונוגדן דילול המאגר (ADB) שמתואר בטבלה 1 ו- 2 בטבלה.
- להכין צלחת פטרי אחת של 35 מ מ עם 3 מ ל 1 x buffered פוספט תמיסת מלח (1 x PBS, pH 7.4), תבשיל אחר 35 מ מ עם 2 מ של תיקון/פירוק פתרון לכל העכבר.
- להקריב את העכבר דרך נקע בצוואר הרחם או חנק2 CO, לרסס את הבטן הגחון עם 70% אתנול. פתח את חלל abdominopelvic באמצעות מספריים סטרילי, עושה חור בצורת V. ואז להסיר את האשכים על ידי משיכת על כרית השומן epididymal באמצעות מלקחיים, ולהימנע מטריד את tunica albuginea. מקם את האשכים בצלוחית 35 מ מ המכיל 1 x PBS.
הערה: לנצל את הגל הראשון של יצירת זרע על מנת לצפות אוכלוסיה תא מועשר של עניין14. בשלבים מסוימים של יצירת זרע מועשרים בגילאים שונים בעכבר (טבלה 3). - הסר את האשכים tunica albuginea על-ידי ניקב את הרקמה עם מלקחיים משופעת חדה ולאסוף את בקוריאנית וכמה רופף. להעביר את בקוריאנית המכיל 2 מ"ל של פתרון תיקון/פירוק פטרי 35 מ מ חדש.
- דגירה של בקוריאנית בפתרון fix/פירוק למשך 5 דקות בטמפרטורת החדר.
2. הכנת וכמה בקוריאנית
- הכן שקופית פולי-L-ליזין מצופה זכוכית על ידי חלוקה לרמות את הקצוות של השקופית עם עט חוסם נוזלי.
- החל µL 100 של פתרון תיקון/פירוק למרכז השקופית זכוכית.
- בעזרת מלקחיים סטרילי, מספריים להקניט בעדינות לגזרים את בקוריאנית וכמה. חיתוך צנורית זמן בודדים מגזרים כ 20 מ מ אורך.
הערה: לדמיין מבנים רגישים חשיפה ממושכת מקבע, כגון centrosomes, להפריד את בקוריאנית לראשונה ב-, טוב, מגניב 1 x, ואז ישירות מינצ בקוריאנית על פני השטח של השקופיות פולי-ליזין מצופה µL 100 בפתרון fix-פירוק. - להעביר חמישה קטעים צנורית וכמה זמן 20 מ מ השקופית מוכן פולי-L-ליזין מצופה זכוכית המכיל תיקון/פירוק פתרון.
- באמצעות מספריים סטרילי האוהב בקוריאנית וכמה למקטעים 1.5 ל 3.0 מ מ.
- בעזרת מלקחיים סטרילי לסדר את מקטעי צנורית בשקופית זכוכית כך אין רקמות חופף, ולא בקוריאנית מפוזרים באופן אחיד.
הערה: מספר אופטימלי מקטעי צנורית על משטח זכוכית הוא בין 20 ל- 40.
3. מועך של בקוריאנית וכמה
- להעביר את השקופית זכוכית המכיל מקטעים צנורית וכמה מפוזרת על גבי benchtop. להסיר את עודף נוזל באמצעות מגבון מעבדה כדי להימנע מאובדן רקמת במהלך השלב סקווש.
- להחיל על coverslip (22 x 60-1.5 מ"מ) על גבי השקופית זכוכית והפעילו לחץ על העקב של כף היד למשך 10-20 שניות. חשוב להפעיל מספיק כוח כדי לפזר את spermatocytes מן בקוריאנית וכמה.
הערה: לבחון את בקוריאנית באמצעות מיקרוסקופ לנתיחה על מנת לייעל את הצעד squashing כך כל מקטעי צנורית הם שיבשו. - בעזרת מלקחיים שקופיות, מיד פלאש להקפיא השקופית זכוכית דיואר קטנה של נוזל N2 למשך 15 שניות, או עד שהנוזל חודל בועה. אם immunolabeling להסיר לאלתר, את coverslip עם סכין גילוח שוליים ישרים, בסדר עצה מלקחיים או מחט בקוטר 21.
הערה: לקבלת תוצאות מיטביות, immunolabel השקופיות באופן מיידי (ראה שלב 4). עם זאת, בשלב זה שקופיות יכולים להישמר ב-80 מעלות צלזיוס עד שבועיים. כדי להגדיל את אורך החיים של חלבונים ו מבנים הסלולר, מיד מאחסנות את השקופיות קרח יבש או העברת מקפיא-80 ° C, ולשמור את coverslip בשקופית. כאשר immunolabeling לאחסן שקופיות, להסיר את coverslip במועט השקופיות N נוזלי2 למשך 15 שניות, כפי שמתואר בשלב 3.3.
4. Immunolabeling של בקוריאנית וכמה הנטען
- לטבול את השקופית 1 x PBS ולאחר שטיפת שלוש פעמים במשך 5 דקות בתוך צנצנת Coplin 50-mL המכיל 1 x PBS.
הערה: לעולם לא. תרשה שהשקופיות יבש לחלוטין במהלך immunolabeling. - החל מ ל 1 נוגדן מאגר דילול אותן לשקופית זכוכית לחסום במשך 1-2 h בתוך תא humidified.
- להסיר את המאגר דילול נוגדן ולהחיל µL 100 של נוגדן ראשוני מדולל במאגר דילול נוגדן בתוך תא humidified.
הערה: לקבלת תוצאות מיטביות, דגירה נוגדנים העיקרי בין לילה ב 4 º C. השתמש כרכים קטנים של נוגדנים (למשל 50 µL) על ידי כיסוי השקופית עם coverslip או מצלמות-מיקרוסקופים. לאמת ולמטב נוגדנים ראשי15. - לשטוף שקופיות שלוש פעמים במשך 5 דקות בתוך צנצנת Coplin 50 מ ל המכיל 1 x PBS.
הערה: כדי לשפר את מנקי, להתסיס צנצנות Coplin באמצעות בר קטן מערבבים מגנטי, מניחים על צלחת מגנטית מערבבים במהירות נמוכה, או למקם את הצנצנת Coplin על שולחן מערבל במהירות נמוכה. - החל µL 100 של נוגדנים משניים מדולל במאגר דילול נוגדנים עבור h 1 1.5 בתוך תא humidified בטמפרטורת החדר. דגירה השקופיות בקופסה כהה כדי למנוע צילום הלבנה של נוגדנים fluorophore מצומדת.
הערה: השתמש כרכים קטנים של נוגדנים (למשל 50 µL) על ידי כיסוי השקופית עם coverslip או מצלמות-מיקרוסקופים. - שטיפה שקופיות פעמיים במשך 5 דקות בתוך צנצנת Coplin 50-mL המכיל 1 x PBS.
- הר השקופיות הרכבה בינונית המכיל 4', 6-diamidino-2-phenylindole (דאפי, µg 1.5/mL) ולהחיל coverslips (22 x 60-1.5 מ"מ).
- חותם על coverslips על השקופיות עם לק ברורה כדי לשמר את השקופיות ולמנוע את coverslips לנוע.
5. ניתוח וההכנות הדמיה צנורית סקווש
- השתמש במיקרוסקופ epifluorescence עם שלב אוטומטי המאפשר תנועה ציר z מדויק של מצלמה ברזולוציה גבוהה עבור לכידת תמונה. לחלופין, השתמש מיקרוסקופ קונפוקלי לייזר.
הערה: להשתמש בכל תוכנה וחומרה זמין בשלב זה. לדוגמה, התמונות המוצגות באיור 1 ו- 2 איור נלכדו באמצעות Zeiss תא הצופה Z1 מקושר מצלמת CMOS 4.0 אורקה-פלאש וניתח עם התוכנה תמונות מהדורה 2012 זן Zeiss כחול. - להעריך את השקופיות בעזרת מטרה X 20 כדי לקבוע את איכות התכשיר סקווש. שקופיות באיכות טובה יש של טפט של גרעינים המופצים באופן שווה.
הערה: כמה קטעים של השקופית יכול להיות יותר טוב מאחרים, זה שימושי כדי לציין את הקואורדינטות של שם ניתן למצוא את האזורים הטובים ביותר של השקופית לצורך ניתוח נוסף באמצעות הגדלה גבוהה יותר. - שימוש גבוה יותר אובייקטיבי ההגדלה (למשל 63 X או 100 X), לכידת אזורים של השקופית שיש של טפט עקבית של גרעין האטום. ברגע אזור נבחר, קבע העליון ולהוריד Z-במחסן כדי להבטיח כי כל האור בפוקוס נלכד.
הערה: המספר האופטימלי של Z-במחסן נתפס בין הגבול העליון והתחתון מיועד בדרך כלל על ידי תוכנת רכישת התמונה, והוא שונה עבור כל מטרה. - להשתמש בתמונה בתוכנת עיבוד כדי לקמפל תמונה המוקד עומק מורחב. התוכנה משלבת האור בפוקוס כל Z-מחסנית, חיוני עבור הדמיה אופטימלית של צנורית סקווש ההכנות.
תוצאות
כאן השתמשנו בשיטת סקווש צנורית להמחיש תא חלוף אוכלוסיות שעברו את prophase כדי מפה של אני (G2/MI) המעבר, אשר היו מועשר בבציר האשכים של עכברים פראי-סוג לנוער העוברים את הגל הראשון של יצירת זרע (24 dpp). איור 1 מציג תמונות נציג של השלבים השונים תא זה ניתן לאבחן באמצעות השיטה סקווש צנורית. מועשר אוכלוסיות של מפה של אני spermatocytes היו visualized באמצעות נוגדנים נגד אלפא-טובולין (איור 1 א'). אנחנו מנוצל סמנים עבור מיוזה מוקדם ומאוחר את התקדמות meiotic הבמה. צנורית סקווש ההכנות היו immunolabeled עם נוגדן ל החלבון synaptonemal מורכב, SYCP3, כדי להמחיש את שלבי prophase א Leptotene/zygotene, spermatocytes pachytene/diplotene מוצגות באיור איור 1B. Spermatocytes שעברו לליגת העל meiotic יכול להופיע בבירור באמצעות נוגדנים נגד אלפא-טובולין (איור 1 א' , 1 ג). במחקר מאוחר אירועים meiotic, דלעת צנורית היו immunolabeled באמצעות נוגדנים נגד מחזור התא קינאז אורורה B (AURKB), אשר רגישה כדי תאים פנימית במהלך כל, ואז relocalizes כדי midzone פלך פארו המחשוף במהלך "אנאפאזה", ציטוקינזה, בהתאמה (איור 1C). התכונות cytological של כרומוזומים היו דמיינו במהלך לליגת העל meiotic. להתבונן ICDs, סקווש צנורית ההכנות היו immunolabeled באמצעות נוגדנים נגד יחידת משנה מיוזה ספציפיים אלפא-kleisin של cohesin, REC8 (איור 1D). דינמיקה כרומוזום במהלך "אנאפאזה" היו העריכו באמצעות אלפא-טובולין immunolabelling ו- DNA הכתם, דאפי. Spermatocyte בהצלחה השלמת החלוקה meiotic הראשון מוצג באיור 1E, בזמן spermatocyte הכולל גשר "אנאפאזה" מוצג באיור 1F. באמצעות טכניקה סקווש צנורית, אורך ציר meiotic, כרומוזום והיישור סגרגציה ולהשוואה ביחס בין עכברים מוטנטים ושליטה.
השירות של שיטה זו עבור ויזואליזציה של מעברים נוספים של מחזור התא ומבני subcellular המשויך prophase הוא הפגין באיור2. במהלך substage leptotene של prophase אני, חניכה של כרומוזום הומולוגי ההתאמה מתווך על ידי שינויים דינמיים בקבצים מצורפים טלומר לזירוז היווצרות כרומוזום אשכולות מול מוט יחיד של מעטפת הגרעין (NE)16, 17 , 18 , 19 , 20. זה קונפורמציה, המכונה "זר" הכרומוזום נחשב כדי להגביר את הסבירות ואת התדירות של אינטראקציות בין-homolog (איור 2 א). ייזום והשלמת של synapsis בין כרומוזום הומולוגי מתרחשת בתקופת zygotene (איור 2B) , pachytene substages (איור 2C), בהתאמה, עם פיזור מתקדמת כרומוזום זר... להעריך בו זמנית dynamics זר פרחים synapsis, כרומוזום בעכברים לנוער, אנחנו immunolabeled צנורית סקווש ההכנות עם נוגדנים SYCP3, את centromeres, אבל עבור הדנ א באמצעות דאפי. העכבר כרומוזומים telocentric, לכן צנטרומר immunolabeling שימש כדי לזהות שינויים בקבצים מצורפים NE טלומר.
כרומוזום מין meiotic איון (MSCI) מהווה סימן היכר ייחודי מיוזה זכר, לפיה ה-X הומולוגית ו כרומוזום Y לעקוף מחסום ההפעלה על-ידי עוברת זרחון כרומוזום ברוחב של היסטון משתנה H2AFX (yH2AX; pSer139)21 22, ,23. זוג כרומוזום X-Y transcriptionally מושתקים, מידרו לתוך תחום משנה גרעיני צפוף שנקרא "הגוף סקס". Spermatocytes שעברו MSCI ניתן בקלות לזהות במהלך substages pachytene ו- diplotene באמצעות immunolabeling צנורית סקווש בהכנות עם נוגדנים yH2AX (Ser139). איור דו-ממדי מתאר של spermatocyte-immunolabelled substage pachytene עם נוגדנים נגד yH2AX (Ser139), centromeres מוכתם דאפי להמחיש את ה-DNA.
שכפול centrosome הינו שמרני למחצה, מתרחשת במהלך prophase שמלך מיוזה זכר עם סיומו של ה-DNA לתקן על מנת להבטיח כי כל תא וכתוצאה מכך הבת יורש שני centrioles (אחד centrosome) בעקבות חלוקת התא24,25 . Centrosomes להכיל שתי centrioles orthogonally מסודרים מחובר באמצעות מקשר גמיש ומוקפות מטריקס אמורפי של חלבונים המכונה pericentriolar חומר/מטריצה (PCM)26. לאחר מכן שכפול ב substage pachytene, הקימו לאחרונה צנטריול זוגות להתנתק אחד מהשני, עוברים התבגרות centrosome, הגירה ההפוכים בשלב diplotene כדי להקל על היווצרות הצירים הפרעה דו קוטבית. Spermatocyte מוקדמת diplotene שעברו disjunction של זוגות צנטריול שהוקם היה דמיינו ידי immunolabeling צנורית סקווש ההכנות עם נוגדנים נגד pericentrin (PCNT), מרכיב חלבון של PCM, Centrin-3 (CETN3) כדי לסמן centrioles (דמות 2E). היערכות נקבע באמצעות נוגדנים נגד SYCP3, דאפי שימש כדי להכתים את הדנ א.
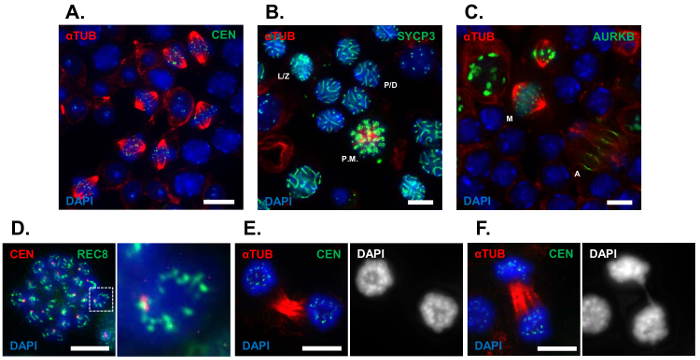
איור 1 : ניתוח נציג של המעבר G2/MI meiotic באמצעות תכשירים סקווש צנורית- ההכנות סקווש צנורית בוצעו על צנורית וכמה קטעים של C57BL/6J עכברים בגיל 24 dpp. (א) נציג בתחום המתפתח immunolabeled spermatocytes עם נוגדנים נגד אלפא-טובולין (אדום), centromeres (ירוק), ה-DNA כתם דאפי (4', 6-diamidino-2-phenylindole, כחול). (B) פראי-סוג צנורית דלעת היו מוכתמים דאפי (כחול) כמו גם immunolabeled עם נוגדנים נגד אלפא-טובולין (אדום), והאלמנט לרוחב של SC, SYCP3 (ירוק). (ג) פראי-סוג צנורית דלעת היו מוכתמים דאפי (כחול) כמו גם immunolabeled עם נוגדנים נגד אלפא-טובולין (אדום), וירוק של מחזור התא קינאז AURKB (). התכונות cytological של כרומוזומים כגון ICDs והגשרים "אנאפאזה", ניתן לאבחן באמצעות צנורית סקווש ההכנות. (ד) להתבונן ICDs, prometaphase spermatocytes היו immunolabeled עם נוגדנים נגד centromeres (אדום) כמו גם רכיב ספציפי meiotic cohesin, REC8 (ירוק) מוכתם דאפי (כחול). (E, F) מורפולוגיה כרומוזום היה מדמיין במהלך "אנאפאזה" באמצעות נוגדנים נגד אלפא-טובולין (אדום), centromeres (ירוק), דאפי כתם (כחול). השלמה מלאה של פיתוח spermatocytes ניתן לזהות בטכניקה צנורית סקווש (L/Z, leptotene/zygotene spermatocytes הבמה; P/D, pachytene/diplotene spermatocytes הבמה; אחה צ, prometaphase spermatocytes; M, מפה של spermatocytes; א, spermatocytes "אנאפאזה"). סרגל קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2 : דוגמאות נוספות שינויים מורפולוגיים ומבנים הקשורים עם התקדמות meiotic prophase אצל גברים באמצעות תכשירים סקווש צנורית- ההכנות סקווש צנורית בוצעו על צנורית וכמה קטעים של עכברים C57BL/6J בגילאי 12-18 dpp ולא היו מוכתמים דאפי (4', 6-diamidino-2-phenylindole, כחול) כדי להדביק תווית ה-DNA. (א-ג) Homolog synapsis הוא מצמידים את היווצרות ופיזור פרוגרסיבי של כרומוזום "זר" במהלך התקדמות prophase. Leptotene (א)zygotene (B), pachytene (ג) שלב spermatocytes היו immunolabeled עם נוגדנים נגד SYCP3 (אדום) centromeres (ירוק). (D-E) ההכנות סקווש צנורית יכול לשמש כדי לזהות שינויים cytological ייחודי ומבנים במהלך prophase זכר אני התקדמות כולל כרומוזום מין meiotic איון (MSCI) ושכפול centrosome. (ד) Pachytene spermatocytes הבמה שעברו MSCI אותרו באמצעות נוגדנים כדי yH2AX (Ser139) כדי להדביק תווית הסקס-הגוף (חץ ירוק), centromeres מוצגים באדום. (ה) Diplotene spermatocytes הבמה זוהו באמצעות נוגדנים נגד SYCP3 (אדום) ו centrosomes (חץ) אותרו באמצעות נוגדנים נגד Centrin-3 (ירוק) ו Pericentrin (מגנטה) לסמן את centrioles, את pericentriolar חומר/מטריצה, בהתאמה. סרגל קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| פריט | כמות | ריכוז סופי |
| 1 x PBS | 10 מ | 1 x |
| 16% PFA | 500 ΜL | 0.8% (v/v) |
| 10% TritonX-100 ב- PBS | 100 ΜL | 0.1% (v/v) |
טבלה 1: תיקון/פירוק פתרון. תיאור/הוראות: להתאים את ה-pH ל- 9 עם NaOH [50 מ מ. לעטוף את הגורם המכיל של פתרון בנייר אלומיניום כדי להגן מפני אור ולאחסן ב 4 º C. אל תשתמש הפתרון תיקון/פירוק אם ישנים יותר משבוע. כדורגלן מוצק יכול לשמש גם כדי להפוך את הפתרון. השימוש fumehood מומלץ להימנע מחשיפה מחברים.
| פריט | כמות | ריכוז סופי |
| 1 x PBS | 50 מ | 1 x |
| BSA | 1.5 גרם | 3% (w/v) |
| סרום סוס | 5 מ | 10% (v/v) |
| 10% TritonX-100 ב- PBS | 250 ΜL | 0.05% (v/v) |
בטבלה 2: נוגדן דילול מאגר (ADB) המתכון. תיאור/הוראות: חנות ADB ב 4 ° C או להקפיא מניות ב-20 ° C אם מבצעים את כמויות גדולות יותר. ADB יכולים להיות מזוהמים, ודא טכניקות aseptic טוב משמשים ולהעריך את הפתרון עבור זיהום לפני כל שימוש. להכין aliquots קטן של ADB כדי למזער את הזיהום.
| סוג התא | תהליך הסלולר | עכבר גיל (dpp) |
| Leptotene | מבנה ה-DNA DSB | 10 - 12 |
| הרכבה של אלמנטים צירית | ||
| Zygotene | חניכה של הומולוגי synapsis ותיקון DSB | 12 - 16 |
| Pachytene | השלמת תיקון DSB אוטוזומלית | 16 - 20 |
| ההבשלה של אירועי רקומבינציה מוצלב | ||
| Synapsis מלאה בין homologs | ||
| כרומוזום מין meiotic איון (MSCI) | ||
| ההבשלה של הכפילות/Centrosome צנטריול | ||
| Diplotene, Diakinesis | SC Desynapsis | 18 - 22 |
| Centrosome ההפרדה | ||
| מפה של אני | פלך במחסום | 22 - 26 |
| Spermatid עגול | ? מה לעזאזל קרה חלופי | > 24 |
| היווצרות acrosome |
טבלה 3: ליד סינכרוני הגל הראשון של יצירת זרע בעכברים לנוער- תיאור/הוראות: שלבים ספציפיים של יצירת זרע מועשרים בשלבים שונים של פיתוח העכבר לנוער.
Discussion
עכברים הוכיחו להיות אורגניזם מודל שימושי ללמוד את האירועים הסלולר המפקחים על התקדמות meiotic במהלך יצירת זרע. עוד יותר, הוא צורך לפתח כלים ששירתה המחקר של יצירת זרע כי אירועים רבים, כגון יציאה מן meiotic prophase אני, הם dimorphic מינית. פרוטוקול זה מתאר שיטה סקווש צנורית וכמה עבור ויזואליזציה ולימוד בשלבים שונים של יצירת זרע העכבר. שיטה זו משמרת שלמות הסלולר של ובכך מאפשר ניתוח מפורט של מבנים cytoplasmic גרעינית. התוצאות נציג המתוארים במחקר זה להפגין את התועלת של פרוטוקול זה בהערכת spermatocytes העיקרי בתהליך התקדמות meiotic. יתר על כן, פרוטוקול זה יכול לשמש גם כדי לחקור תהליכים תאיים אחרים במהלך יצירת זרע, כולל הפצת הבידול של spermatogonia ו בשלבים של27,spermiogenesis28. השיטות המתוארות הן בתוך מותאמים צנורית שתואר לעיל סקווש טכניקות8,9. עם זאת, פרוטוקול זה הוא המדריך מפורט הראשון, כיסוי ריאגנטים כל השלבים הדרושים, מקבלת את בקוריאנית כדי להמחיש תאים בודדים באמצעות מיקרוסקופ קרינה פלואורסצנטית. יתר על כן, הוצגו תמונות על תכונות סלולר נוספות, לרבות צנטריול את הזר טלומר, אשר ניתן לאבחן עם הטכניקה.
ישנם כמה אלמנטים טכניים המהווים מפתח עבור מיטוב צנורית סקווש ההכנות. ראשית, אחד עליך להחיל את הכמות הנכונה של כוח coverslip זכוכית. כשל להפעיל כוח מספיק יהיה לייצר שקופיות עם כמה תאים חסיד, כמו רוב התאים יישארו בתוך וכמה בקוריאנית. שנית, אחד תקופת דגירה את החומר testis בפתרון fix/פירוק עבור משך הזמן המתאים. בדרך כלל, קיבוע צריך להיות מוגבל ל 5 דקות, אבל טווח בין 5 ל-15 דקות מקובל. בקוריאנית שתוקנו לתקופה ממושכת יהיה קשה לתמרן, להניב תוצאות המסכן. זה אפשרי, עם זאת, כדי להאריך את זמן הדגירה על-ידי הפחתת הריכוז של מחברים. לדוגמה הורדת האחוזים מחברים ל- 0.5% תאפשר הדגירה מוגברת פעמים בפתרון fix/פירוק. בשיטה שלו הוצגו, המדרגות permeabilization, קיבוע להתרחש בו זמנית, עם זאת ניתן לבצע את הפעולות הבאות בזו אחר זו, בהתאמה. הפרדת השלבים permeabilization של קיבעון יכול לעזור להפחית את רמות של רקע cytoplasmic אות. וריאציה של אסטרטגיות קיבוע ו/או permeabilization יכול להיבדק גם כדי לייעל את התנאים להערכה של מבנה subcellular ספציפי או נוגדנים. לדוגמה, ויזואליזציה של centrosomal, פלך חלבונים יכול להיות מוגברת על ידי שימוש מתנול במקום PFA29,30,31. בנוסף, מומלץ להשתמש עכברים לנוער מתקדמים דרך הגל הראשון של יצירת זרע (כ 10-26 dpp) על מנת במיוחד והמחש robustly נדירים meiotic הסלולר אירועים12. לחלופין, זה אפשרי לבודד תאים meiotic ספציפי בשלב העכברים למבוגרים על ידי התבוננות התבנית קליטת האור בתוך צנורית וכמה32. בהינתן מחזור אסינכרוני של יצירת זרע בעכברים למבוגרים, עם זאת, ניתוח אירועים נדירים meiotic בפירוט יכול להיות מאתגר. מגבלה זו ניתן להתגבר באמצעות הזרקת עכברים עם bisdichloroacetyldiamine, לזכות 18,446, מטבוליזם ויטמין A אילו קוביות, עוצר בידול spermatogonial33. לאחר הטיפול עם 18,466 לנצח, חידוש יצירת זרע תתרחש באופן סינכרוני, מניב כמויות גדולות של אוכלוסיות מועשר תא נבט מ34בוגרת של בעלי חיים. אסטרטגיה זו סינכרון יכול לשמש לפני הטכניקה סקווש צנורית לחקור את ההבדלים בין הגלים סינכרונית למחצה הראשון של יצירת זרע לאלה המתרחשים מבוגרים35,36, 37. יתר על כן, מתאם בין הזדקנות אבהית אנאפלואידיה יכול גם להיות מוערך באמצעות סגרגציה כרומוזום סינכרון והערכה לנצח 18,466 עם השיטה סקווש צנורית.
לסיכום, בשיטה זו ניתן להשתמש בשילוב עם מיקרוסקופ immunofluorescence להתבונן תאים בשלבים שונים של יצירת זרע. חלה להפכה, טכניקה זו יכולה לשמש גם כדי להעריך תת אוכלוסיות של spermatogonia, spermatocytes, spermatids, והיא התפורות ללמוד מגוון רחב של תהליכים במהלך יצירת זרע. גישה זו שימש במשך חיים התא הדמיה של spermatocytes, שונה כדי לנהל מגוון של מחקרים ביוכימיים הסלולר-38,-39,-40. הטכניקה סקווש צנורית שימש במשך בקוריאנית וכמה עכבר, חולדה, רומז כי זה בקלות להחיל מערכות יונקים אחרים, כולל האדם40. טכניקה זו יכולה לעזור להגדיר את לפליטת הסלולר כי להצמיח פוריות, aneuploidy זרע.
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי NIGMS (R01GM11755) כדי P.W.J. על ידי מלגת גראנט ההדרכה מ הלאומי סרטן המכון (NIH) (CA009110) S.R.W., ג'יי-אייץ
Materials
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde Aqueous | Electron Microscopy Sciences (EMS) | 15710 | |
| 10x PBS | Quality Biological | 119-069-161 | |
| Triton X-100 | Sigma | T8787 | |
| BSA | Sigma | A1470 | |
| Horse Serum | Sigma | H-1270 | |
| 35mm x 10mm Petri Dish, Sterile, non-treated | CellTreat | P886-229638 | |
| Poly-L-lysine coated glass slides | Sigma | P0425-72EA | |
| Liquid Blocker Pen | Electron Microscopy Sciences (EMS) | 71310 | |
| Humid Box | Evergreen | 240-9020-Z10 | |
| Wheaton Coplin Glass Staining Dish for 5 or 10 Slides | Fisher | 08-813E | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Labs | H-1200 | |
| Microscope Cover Slides (22mmx60mm) | Fisher | 12-544-G | |
| Clear Nail Polish | Amazon | N/A | |
| Microsopes | |||
| Name | Company | Catalog Number | Comments |
| SteREO Discovery.V8 | Zeiss | 495015-0001-000 | |
| Observer Z1 | Zeiss | 4109431007994000 | |
| Zeiss ZEN 2012 blue edition image software | Zeiss | ||
| ORCA-Flash 4.0 CMOS camera | Hamamatsu | ||
| Primary Antibodies | |||
| Name | Company | Catalog Number | Comments |
| Mouse anti-SYCP3 | Santa Cruz | sc-74569 | 1 in 50 |
| Rabbit anti-SYCP3 | Fisher (Novus) | NB300-231 | 1 in 1000 |
| Goat anti-SCP3 | Santa Cruz | sc-20845 | 1 in 50 |
| Human anti-Centromere Protein | Antibodies Incorporated | 15-235 | 1 in 100 |
| Mouse anti-alpha tubulin | Sigma | T9026 | 1 in 1000 |
| Mouse anti-AIM1 | BD Biosciences | 611082 | 1 in 200 |
| Mouse anti-γH2AX | Thermo Fisher | MA1-2022 | 1 in 500 |
| Mouse anti-CENT3 | Abnova | H00001070-M01 | 1 in 200 |
| Rabbit anti-pericentrin | Abcam | ab4448 | 1 in 200 |
| Rabbit anti-REC8 | Courtesy of Dr. Karen Schindler | N/A | 1 in 1000 |
References
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nature Rev Genet. 13 (7), 493-504 (2012).
- Morelli, M. A., Cohen, P. E. Not all germ cells are created equal: Aspects of sexual dimorphism in mammalian meiosis. Reproduction. 130 (6), 761-781 (2005).
- Sun, F., Handel, M. A. Regulation of the meiotic prophase I to metaphase I transition in mouse spermatocytes. Chromosoma. 117 (5), 471-485 (2008).
- Namekawa, S. H. Slide preparation method to preserve three-dimensional chromatin architecture of testicular germ cells. J Vis Exp. (83), e50819 (2014).
- La Salle, S., Sun, F., Handel, M. A. Isolation and short-term culture of mouse spermatocytes for analysis of meiosis. Methods Mol Biol. 558, 279-297 (2009).
- Galdon, G., Atala, A., Sadri-Ardekani, H. In vitro spermatogenesis: how far from clinical application?. Curr Urol Rep. 17 (7), (2016).
- Staub, C. A century of research on mammalian male germ cell meiotic differentiation in vitro. J Androl. 22 (6), 911-926 (2001).
- Page, J., Suja, J. A., Santos, J. L., Rufas, J. S. Squash procedure for protein immunolocalization in meiotic cells. Chromosome Res. 6 (8), 639-642 (1998).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nat Methods. 1 (3), 249-254 (2004).
- Xu, X., Xu, P. A modified cryosection method for mouse testis tissue. Tissue Cell. 33 (2), 208-210 (2001).
- Hess, R., Moore, B. Histological methods for evaluation of the testis. Methods Toxicol. 3 (Pt A), 52-85 (1993).
- Bellvé, A. R. Purification, culture, and fractionation of spermatogenic cells. Methods Enzymol. 225, 84-113 (1993).
- Ventela, S., Toppari, J., Parvinen, M. Intercellular organelle traffic through cytoplasmic bridges in early spermatids of the rat: mechanisms of haploid gene product sharing. Mol Biol Cell. 14 (July), 2768-2780 (2003).
- Bellvé, A. R., et al. Dissociation of the mouse testis and characterization of isolated spermatogenic cells. J Histochem Cytochem. 25 (7), 480-494 (1977).
- Burry, R. W. Controls for immunocytochemistry: an update. J Histochem Cytochem. 59 (1), 6-12 (2011).
- Zickler, D., Kleckner, N. Recombination, pairing, and synapsis of homologs during meiosis. Cold Spring Harb Perspect Biol. 7 (6), 1-26 (2015).
- Hunter, N. Meiotic recombination: the essence of heredity. Cold Spring Harb Perspect Biol. 7 (12), 1-36 (2015).
- Scherthan, H., et al. Centromere and telomere movements during early meiotic prophase of mouse and man are associated with the onset of pairing. J Cell Biol. 134 (5), 1109-1125 (1996).
- Zickler, D., Kleckner, N. The leptotene-zygotene transition of meiosis. Annu Rev Genet. 32, 619-697 (1998).
- Scherthan, H. A bouquet makes ends meet. Nat Rev Mol Cell Biol. 2 (8), 621-627 (2001).
- Turner, J. Meiotic sex chromosome inactivation. Development. 134 (10), 1823-1831 (2007).
- Royo, H., et al. ATR acts stage specifically to regulate multiple aspects of mammalian meiotic silencing. Genes Dev. 27 (13), 1484-1494 (2013).
- Turner, J. M., et al. Silencing of unsynapsed meiotic chromosomes in the mouse. Nat Genet. 37 (1), 41-47 (2005).
- Marjanović, M., et al. CEP63 deficiency promotes p53-dependent microcephaly and reveals a role for the centrosome in meiotic recombination. Nat Commun. 6, 7676 (2016).
- Inanç, B., Dodson, H., Morrison, C. G. A Centrosome-autonomous signal that involves centriole disengagement permits centrosome duplication in G2 phase after DNA damage. Mol Biol Cell. 21, 3866-3877 (2010).
- Firat-Karalar, E. N., Sante, J., Elliott, S., Stearns, T. Proteomic analysis of mammalian sperm cells identifies new components of the centrosome. J Cell Sci. 127 (Pt 19), 4128-4133 (2014).
- Fukuda, N., et al. The transacting factor CBF-A/Hnrnpab binds to the A2RE/RTS element of protamine 2 mRNA and contributes to its translational regulation during mouse spermatogenesis. PLoS Genet. 9 (10), e1003858 (2013).
- Lahn, B. T., et al. Previously uncharacterized histone acetyltransferases implicated in mammalian spermatogenesis. Proc Natl Acad Sci U S A. 99 (13), 8707-8712 (2002).
- Mermoud, J. E., Tassin, A. M., Pehrson, J. R., Brockdorff, N. Centrosomal association of histone macroH2A1.2 in embryonic stem cells and somatic cells. Exp Cell Res. 268 (2), 245-251 (2001).
- Shanmugam, M., Hernandez, N. Mitotic functions for SNAP45, a subunit of the small nuclear RNA-activating protein complex SNAPc. J Biol Chem. 283 (21), 14845-14856 (2008).
- Ganem, N. J., Godinho, S. A., Pellman, D. A mechanism linking extra centrosomes to chromosomal instability. Nature. 460 (7252), 278-282 (2009).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nat Methods. 1 (3), 249-254 (2004).
- Amory, J. K., et al. Suppression of spermatogenesis by bisdichloroacetyldiamines is mediated by inhibition of testicular retinoic acid biosynthesis. J Androl. 32 (1), 111-119 (2011).
- Hogarth, C. A., et al. Turning a spermatogenic wave into a tsunami: synchronizing murine spermatogenesis using WIN 18,446. Biol Reprod. 88 (2), 40 (2013).
- Yoshida, S., et al. The first round of mouse spermatogenesis is a distinctive program that lacks the self-renewing spermatogonia stage. Development. 133 (8), 1495-1505 (2006).
- Kluin, P. M., Kramer, M. F., Rooij, D. G. Spermatogenesis in the immature mouse proceeds faster than in the adult. Int J Androl. 5 (3), 282-294 (1982).
- Rodriguez, I., Ody, C., Araki, K., Garcia, I., Vassalli, P. An early and massive wave of germinal cell apoptosis is required for the development of functional spermatogenesis. EMBO J. 16 (9), 2262-2270 (1997).
- Kangasniemi, M., et al. Modulation of basal and FSH dependent cyclic AMP production in rat seminiferous tubules staged by an improved transillumination technique. Anat Rec. 227 (1), 62-76 (1990).
- Martianov, I., et al. Late arrest of spermiogenesis and germ cell apoptosis in mice lacking the TBP-like TLF/TRF2 gene. Mol Cell. 7 (3), 509-515 (2001).
- Henriksén, K., Parvinen, M. Stage-specific apoptosis of male germ cells in the rat: Mechanisms of cell death studied by supravital squash preparations. Tissue Cell. 30 (6), 692-701 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved