Method Article
用小鼠模型对精子发生细胞学分析的精管壁球技术
摘要
这个小管壁技术的目的是快速评估发育中鼠精的细胞学特征, 同时保持细胞完整性。这种方法允许研究精子发生的所有阶段, 并可以很容易地实现与其他生物化学和分子生物学方法的研究小鼠减数分裂。
摘要
雄性的减数分裂是一个过程, 需要一些高度调控的细胞事件的协同作用。减数分裂过程中发生的错误会导致不孕、流产或遗传缺陷。从青春期开始到成年, 持续的半同步波精经历精子发生, 最终形成单倍体精子。第一波的小鼠精进行减数分裂开始出现在10天产后 (10 民进党), 并被释放到管腔的精管作为成熟精子35民进党。因此, 利用小鼠在这个发展的时间窗口, 以获得高度丰富的利益群体是有利的。在老年小鼠中, 由于连续生精波的作用, 对稀有细胞阶段的分析比较困难, 从而增加了微管内细胞数量的多样性。本文所描述的方法是一种易于实现的技术, 用于细胞学评价小鼠的精管中发现的细胞, 包括精, 精, 和精子。小管壁技术保持了孤立的雄性生殖细胞的完整性, 并允许检查不容易与其他技术可视化的细胞结构。为了证明这种小管壁技术的可能应用, 在精过程中, 通过前期到中期 I 过渡 (G2/MI 过渡), 对主轴总成进行了监测。此外, 中心复制, 减数分裂性染色体失活 (MSCI) 和染色体花束形成被评估为例子的细胞学结构, 可以观察使用这种小管壁法。这种技术可以用来精确地确定精子发生过程中的特定缺陷, 这是由突变或外源性扰动引起的, 从而有助于我们对精子生成的分子理解。
引言
减数分裂是一个复杂的细胞事件, 其中一个单一的一轮 DNA 复制后, 连续两轮细胞分裂。在减数分裂的初始阶段, 必须协调几个减数分裂的特定事件, 以确保准确的染色体分离。这些事件包括完成同源重组, 在第一次减数分裂的姐妹 kinetochores 的共同取向, 和逐步失去内聚力配合, 以解决交叉之间的同系物。对这些过程进行精确的调控是保持生育力和防止染色体 missegregation 事件的必要条件, 这可能导致遗传发育障碍和自发性流产1。
虽然减数分裂的关键事件发生在男性和女性, 重要的时间和机械差异之间存在精子生成和卵子2。例如, 在女性减数分裂期间, 我发生在胚胎发育和 dictyate 阶段的逮捕, 直到青春期。相比之下, 精子发生在青春期就开始了, 在成年生活中也没有被逮捕。男性和女性减数分裂的区别强调需要制定方法, 专门用于评估这些过程在精和卵母细胞。目前, 评估减数分裂的进展主要依赖于使用染色质传播3,4,5。虽然染色质传播是有用的研究减数分裂染色体, 他们不能保持细胞完整性, 防止评估细胞结构, 如纺锤微管, 体, 核包络, 和端粒附着。活体成像和长期培养技术大大提高了我们对女性减数分裂的认识;然而, 类似的方法来可视化整个完整的细胞, 不太经常实施的研究的精子发生6,7。为了在整个雄性减数分裂中可视化动态事件, 我们已经适应了已建立的小管壁技术, 以快速评估开发鼠标精8,9的细胞学特征。这里描述的方法保持细胞的完整性, 使研究多细胞结构在不同阶段的精子发生。
这种小管壁技术是一种完整的细胞方法, 可以通过免疫荧光显微镜对细胞结构进行评估。常见的组织学方法, 以可视化的雄性小鼠减数分裂进展, 如苏木和曙红染色石蜡嵌入睾丸, 和荧光标记 cryosections 允许广泛的概述减数分裂进展。但是, 这些技术无法将单个单元格解析为对整个减数分裂1011中发生的事件进行详细分析所必需的程度。可视化减数分裂过程的替代技术依赖于对精的重大 chemiosmotic 中断来隔离和修复核材料3,4,5。这些化学处理阻碍了除原精以外的细胞类型的观察。Namekawa 最近描述的一种方法使研究界能够保护孤立精的核结构, 但需要使用一些实验室4可能不容易获得的 cytospin 和附件。相比之下, 小管壁技术只需要在大多数细胞生物学实验室中通常是标准的设备。
这里描述的小管壁方法可以用来可视化在精曲管内发现的各种细胞类型, 包括支持细胞, 精, 初级和次级精, 和精子。通过将这一技术与幼鼠精子发生的近同步第一波结合起来, 在通过减数分裂12的过程中, 可以获得生精细胞的富集种群。这一过程允许详细分析整个精子发生过程, 如早期前期事件, G2/MI 和中期到后期过渡, 和精子。此外, 小管壁的准备可用于可视化的细胞学特征的染色体 (如 interchromatid 域 (服务) 和 kinetochores) 和体 (中心和 pericentriolar 材料/矩阵)。壁球法可以很容易地与其他实验方法, 如染色质传播和蛋白质提取并行执行。此外, 该技术已成功地修改, 以存放活体生精细胞的幻灯片直接可视化13。
本文所述方法涉及一种全细胞精管壁球技术, 用于分析野生型 C57BL/6J 小鼠的 G2/MI 转变。用免疫荧光显微镜观察了初级精进入第一减数分裂的细胞学特征, 以观测减数分裂纺锤体。这种多才多艺的技术可以很容易地修改, 以可视化其他减数分裂阶段和不同的细胞类型。该技术还可用于替代的可视化策略, 如 DNA 和 RNA 鱼的方法。
研究方案
约翰·霍普金斯大学机构动物保育和使用委员会批准了对老鼠的使用。利用半同步第一波精子发生的方法, 对小鼠 (20-26 天产后、民进党) C57BL/6J 进行了实验。然而, 这种技术也可以使用成年小鼠进行。
1. 小鼠输精管解剖和分离
- 准备表 1和表 2中描述的修复/溶解解决方案和抗体稀释缓冲 (ADB)。
- 准备一个35毫米的培养皿, 3 毫升的1x 磷酸缓冲盐水 (1x PBS, pH 7.4), 和另一个35毫米的菜, 每只老鼠2毫升的固定/溶解溶液。
- 通过颈部脱位或 CO2窒息, 用70% 乙醇喷洒腹腹部。用无菌剪刀打开盆腔, 形成 V 形开口。然后用镊子拔出附睾脂肪垫, 避免扰乱白。将睾丸放在含有 1x PBS 的35毫米培养皿中。
注意:利用第一波的精子发生, 以观察丰富的细胞人口的利益14。在不同的小鼠年龄 (表 3) 丰富了精子发生的特定阶段。 - 用锋利的尖刺钳刺穿组织, 取出睾丸的白, 并收集松散的精小管。将小管转移到新的35毫米培养皿中, 其中含有2毫升的固定/溶解液。
- 在室温下孵育5分钟的固定/溶解液中的小管。
2. 生精小管的制备
- 通过用液体阻挡笔勾勒出幻灯片的边缘, 准备一张多聚 l-赖氨酸涂层玻璃玻片。
- 将100µL 的固定/溶解液应用于玻璃滑板的中心。
- 用无菌钳和剪刀轻轻地把生精小管分开。切割长的单个小管段约20毫米的长度。
注意:为了可视化对长时间固定暴露敏感的结构, 如体, 在 1x PBS 中先分离小管, 然后直接将在100µL 的聚赖氨酸片表面上的小管剁碎。 - 将五 20 mm 长的生精小管段转移到含有固定/溶解溶液的制备的多聚 l-赖氨酸涂层玻璃玻片上。
- 用无菌剪刀把生精小管分成1.5 到3.0 毫米的部分。
- 用无菌钳将小管段排列在玻片上, 使无组织重叠, 小管分布均匀。
注意:在玻片上的小管段的最佳数目是在20和40之间。
3. 生精小管的挤压
- 将含有分散的生精小管段的玻璃玻片转移到台式上。使用实验室擦拭去除多余的液体, 避免在壁球过程中丢失组织。
- 将片 (22 x 60-1.5 mm) 涂抹在玻璃片的顶部, 用手掌的脚跟按压 10-20 秒。从生精小管中应用足够的力来分散精是很重要的。
注意:用解剖显微镜观察小管, 以优化挤压步骤, 使所有的管节都受到破坏。 - 使用滑动钳, 立即闪光冻结玻璃在一个小杜瓦瓶的液体 N2 15 秒, 或直到液体停止起泡。如果 immunolabeling 立即, 删除片与直刃刀片, 罚款尖端钳或21口径针。
注意:为了获得最佳结果, 请立即 immunolabel 幻灯片 (请参见步骤 4)。然而, 在这一点上, 幻灯片可以保存在-80 ° c 最多两周。为了最大限度地延长蛋白质和细胞结构的寿命, 立即将幻灯片存储在干冰上或转移到-80 ° c 的冰箱, 并将片放在幻灯片上。当 immunolabeling 存储幻灯片时, 如步骤3.3 所述, 将幻灯片浸泡在液态 N2中15秒, 以删除片。
4. Immunolabeling 的生精小管
- 在 1x pbs 中浸泡幻灯片, 并在包含 1x pbs 的50毫升 Coplin 罐中洗涤三次, 5 分钟。
注意:不要让幻灯片完全干燥在 immunolabeling。 - 将1毫升的抗体稀释缓冲液涂抹在玻片上, 在湿化室中对 1-2 h 进行阻挡。
- 去除抗体稀释缓冲液, 在湿化室中应用抗体稀释缓冲液中稀释的原抗体100µL。
注意:为取得最佳效果, 在4° c 的夜间孵育主抗体。使用较小数量的抗体 (例如50 µL), 用片或膜覆盖该幻灯片。验证和优化主抗体15。 - 冲洗幻灯片三次5分钟, 在50毫升 Coplin 罐含有 1x PBS。
注意:为了增强洗涤, 使用小的磁性搅拌棒, 在低速的磁性搅拌板上搅拌 Coplin 罐, 或在低速时将 Coplin 罐放在台式搅拌机上。 - 在室温下, 在湿化室内应用100µL 抗体稀释缓冲液中的二次抗体稀释1至 1.5 h。在一个黑暗的盒子中孵育幻灯片, 以避免荧光共轭抗体的照片漂白。
注意:使用较小数量的抗体 (例如50 µL), 用片或膜覆盖该幻灯片。 - 在含有 1x PBS 的50毫升 Coplin 罐中, 冲洗两次幻灯片5分钟。
- 将幻灯片装入包含 4 "、6-diamidino-2-吲 (DAPI、1.5 µg/mL) 的安装介质中, 并应用片 (22 x 60-1.5 mm)。
- 用清晰的指甲油将片密封在幻灯片上, 以保存幻灯片, 防止片移动。
5. 分析和成像小管壁球准备
- 使用荧光显微镜与自动化阶段, 使精确的 Z 轴运动和高分辨率相机的图像捕捉。或者, 使用激光共聚焦显微镜。
注意:在此步骤中使用任何可用的硬件和软件。例如, 在图 1和图 2中显示的图像是使用蔡司单元观察器 Z1 链接到一个虎鲸-闪光 4.0 CMOS 相机, 并与蔡司禅宗2012蓝色版图像软件进行分析。 - 使用20X 目标评估幻灯片, 以确定壁球准备的质量。质量好的幻灯片具有均匀分布的单层原子核。
注意:幻灯片的某些部分可能比其他章节更好, 因此可以在使用更高的放大倍数的情况下, 找到幻灯片的最佳区域的坐标, 以便进一步分析。 - 使用更高的放大率目标 (例如63X 或 100X), 捕获具有一致单层核的幻灯片区域。选定区域后, 设置上部和下部 Z 堆栈, 以确保捕获所有聚焦光。
注意:在上限和下限之间捕获的 Z 栈的最优数通常由图像采集软件指定, 对每个目标都是不同的。 - 使用图像处理软件来编译一个扩展的深度聚焦图像。该软件结合了聚焦光从每个 Z 栈, 是必不可少的最佳成像小管壁的准备工作。
结果
在这里, 我们使用小管壁的方法, 以可视化的过渡细胞人口经历前期到中期 I (G2/MI) 转变, 这是丰富的收获睾丸从幼鼠的第一波精子发生 (24民进党)。图 1描述了可以使用小管壁方法可视化的各种细胞阶段的代表性图像。中期 I 精的富集种群是使用抗α-蛋白 (图 1A) 的抗体可视化的。我们利用标记的早期和晚期减数分裂 I 阶段减数分裂的进展。小管壁的准备是 immunolabeled 与抗体的联会复合蛋白, SYCP3, 以可视化阶段前期 i. 期/偶和线/双精显示在图 1B。精进行第一次减数分裂可以清楚地识别使用抗体对α-蛋白(图 1A 和1C)。为了研究晚期减数分裂事件, 小管南瓜 immunolabeled 使用抗体对细胞周期激酶极光 B (AURKB), 这本地化对内丝中期, 然后 relocalizes 到纺锤 midzone 和沟沟期间后期和胞分别(图 1C)。在第一次减数分裂过程中, 染色体的细胞学特征是可视化的。为了观察服务, 小管壁的准备是 immunolabeled 使用抗体对减数分裂特定的α-kleisin 亚基内聚力, REC8 (图 1D)。采用α-蛋白 immunolabelling 和 DNA 染色 DAPI 对后期染色体动力学进行了评价。成功完成第一个减数分裂的精在图 1E中显示, 而包含后期桥的精显示在图 1F中。采用小管壁技术, 可测量突变体与对照组的减数分裂纺锤体长度、染色体排列和偏析。
在图 2中演示了此方法对与前期 I 相关的附加单元周期转换和亚细胞结构可视化的效用。在前期 I 期 substage 中, 同源染色体配对的启动是由端粒附着体的动态变化介导的, 从而诱导在核包络的单极 (NE)16中形成染色体簇,17,18,19,20. 这个构象, 被称为染色体 "花束" 被认为是增加同源间相互作用的可能性和频率(图 2A)。同源染色体间联会的启动和完成发生在偶(图 2B)和线阶段(图 2C)中, 分别对应于逐步散布染色体花束为了同时评估幼鼠联会和染色体束的动态变化, 我们 immunolabeled 小管壁球的制备与 SYCP3 和丝抗体, 并染色的 DNA 使用 DAPI。小鼠染色体是 telocentric 的, 因此丝 immunolabeling 被用来检测端粒的变化。
减数分裂性染色体失活 (MSCI) 是一种独特的男性减数分裂的标志, 据此, 非同源 X 和 Y 染色体通过进行染色体范围的组蛋白变体 H2AFX (yH2AX; pSer139) 21, 绕过检查点激活 ,22,23。X y 染色体对被转录沉默并分割成一个叫做 "性身体" 的稠密核子域。精在线和双阶段的过程中, 可以很容易地识别出 immunolabeling 管壁 yH2AX (Ser139) 的抗体。图 2D描绘了精线 substage immunolabelled 与 yH2AX (Ser139) 的抗体, 丝和染色与 DAPI, 以可视化的 DNA。
中心复制是半保守性的, 在完成 DNA 修复后, 在雄性减数分裂的前期 I 发生, 以确保每个产生的子细胞继承两个中心 (一个中心) 在细胞分裂之后24,25.体包括两个正交安排中心连接由一个灵活的链接器和周围的非晶矩阵的蛋白质称为 pericentriolar 材料/矩阵 (PCM)26。在重复线 substage, 新形成的中心对脱离彼此和经历中心成熟和迁移到对面的两极在双阶段, 以利于形成双极纺锤。早期双精正接受新形成的中心对的分离, 通过 immunolabeling 小管壁的抗 pericentrin (PCNT) 的抗体、PCM 和 Centrin-3 (CETN3) 的蛋白质成分来标记中心(图 2E)。分期是使用抗体对 SYCP3, 和 DAPI 被用来染色 DNA。
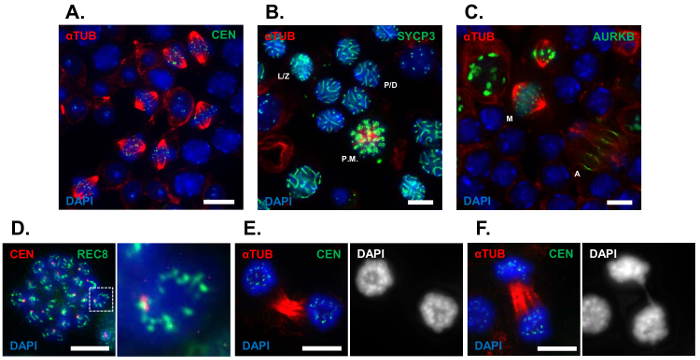
图 1: 用小管壁准备法对减数分裂 G2/MI 过渡的代表性分析.在24岁的 C57BL/6J 小鼠的输精管上进行管壁球管的制备。(A)具有抗α-蛋白 (红色)、丝 (绿色) 和 DNA 染色 DAPI (4 "、6-diamidino-2-吲、蓝色) 抗体的精 immunolabeled 的代表性领域。(B)野生型小管南瓜染有 DAPI (蓝色) 以及 immunolabeled 抗体抗α-蛋白 (红色), 以及 SC、SYCP3 (绿色) 的外侧元素。(C)野生型小管南瓜染有 DAPI (蓝色) 以及 immunolabeled 抗体对α-蛋白 (红色) 和细胞周期激酶 AURKB (绿色)。服务和后期桥等染色体的细胞学特征可以用小管壁球的制备来可视化。(D)观察服务, 中期精是 immunolabeled 抗体对丝 (红色) 以及减数分裂特定内聚力成分 REC8 (绿色) 和染色与 DAPI (蓝色)。(E, F)在后期使用抗α-蛋白 (红)、丝 (绿色) 和 DAPI 染色 (蓝色) 的抗体对染色体形态进行了可视化。利用小管壁技术 (左/Z、期/偶级精;线/双阶段精;下午, 中期精;M, 中期精;A, 后期精)。缩放栏 = 10 µm.请单击此处查看此图的较大版本.

图 2: 在男性使用小管壁的准备过程中, 与减数分裂前期进展相关的其他形态学改变和结构的例子.对 12-18 C57BL/6J 小鼠的细曲管段进行管壁的准备, 并染色 DAPI (4, 6-diamidino-2-吲, 蓝色) 来标记 DNA。(A-c)同源联会在前期进展过程中与染色体 "花束" 的形成和逐渐扩散相耦合。期(A)、偶(B)和线(C)阶段精是 immunolabeled 与 SYCP3 (红色) 和丝 (绿色) 的抗体。(D-E)小管壁球的准备可以用来检测独特的细胞学变化和结构在男性前期 I 进展包括减数分裂性染色体失活 (MSCI) 和中心重复。(D)线阶段精接受 MSCI 检测使用抗体 yH2AX (Ser139) 标记性体 (绿色, 箭头), 和丝显示为红色。(E)双阶段精使用抗体对 SYCP3 (红色) 进行识别, 体 (箭头) 检测到使用抗 Centrin-3 (绿色) 和 Pericentrin (洋红) 的抗体来标记中心和 pericentriolar材料/矩阵分别。缩放栏 = 10 µm.请单击此处查看此图的较大版本.
| 项目 | 量 | 最终浓度 |
| 1x PBS | 10毫升 | 1x |
| 16% 粉煤灰 | 500μ l | 0.8% (v/五) |
| 10% TritonX-100 在 PBS | 100μ l | 0.1% (v/五) |
表 1: 修复/溶解解决方案.说明: 调整 pH 值为9与氢氧化钠 [50mM]。在4° c 的情况下, 用铝箔包裹溶液的容器以保护光线和贮存。不使用固定/溶解解决方案, 如果超过一周的老。固体粉煤灰也可以用来解决问题。建议使用通风橱以避免接触煤灰。
| 项目 | 量 | 最终浓度 |
| 1x PBS | 50毫升 | 1x |
| 波塞军 | 1.5 克 | 3% (w/五) |
| 马血清 | 5毫升 | 10% (v/五) |
| 10% TritonX-100 在 PBS | 250μ l | 0.05% (v/五) |
表 2: 抗体稀释缓冲 (ADB) 食谱.说明: 存储亚行在4° c 或冻结股票在-20 ° c, 如果作出较大的数量。亚行可能会受到污染, 确保使用良好的无菌技术, 并在每次使用前评估污染的解决方案。准备小等分的亚行, 以减少污染。
| 单元格类型 | 细胞过程 | 老鼠年龄 (民进党) |
| 期 | DNA 争端形成 | 10-12 |
| 轴向元件装配 | ||
| 偶 | 同源争端修复与联会的启动 | 12-16 |
| 线 | 常染色体修复的完成 | 16-20 |
| 交叉重组事件的成熟度 | ||
| 完整的联会之间的同系物 | ||
| 减数分裂性染色体失活 (MSCI) | ||
| 中心复制/中心成熟 | ||
| 双和变 | SC Desynapsis | 18-22 |
| 中心分离 | ||
| 中期 I | 主轴检查点 | 22-26 |
| 圆形精 | 鱼精蛋白替代 | > 24 |
| 顶体形成 |
表 3: 幼鼠精子发生的近同步第一波.描述: 在幼鼠发育的不同阶段, 精子发生的特定阶段被丰富。
讨论
小鼠已被证明是一个有用的模型有机体研究的细胞事件, 控制减数分裂进程的精子发生。此外, 有必要开发用于研究精子发生的工具, 因为许多事件, 如减数分裂前期 I 的退出, 都是性二。本协议描述了一种用于小鼠精子发生不同阶段可视化和研究的精曲管壁法。这种方法保留细胞完整性, 从而允许详细分析核和细胞质结构。本研究的代表性结果表明该协议在评估初级精减数分裂进程中的效用。此外, 该协议还可用于研究精子发生过程中的其他细胞过程, 包括精的增殖和分化以及精子27,28的各个阶段。所描述的方法是从以前描述的小管壁技术8,9中改编的。然而, 该协议是第一个详细的指南, 涵盖所有的试剂和步骤所需的, 从获得小管到可视化单细胞通过荧光显微镜。此外, 我们还提供了更多的细胞功能的图像, 包括中心和端粒花束, 可以用这种技术来可视化。
对于优化小管壁的制备, 有几个关键的技术因素。首先, 必须对玻璃片施加适量的力。如果不使用足够的力, 就会产生少量附着细胞的滑动, 因为大多数细胞会留在精细管中。其次, 在适当的时间长度内, 必须在固定/溶解液中孵育睾丸物质。一般来说, 固定应限制在5分钟, 但一个范围介于5和15分钟是可以接受的。长时间固定的小管很难操作, 结果也不好。但是, 通过降低粉煤灰的浓度, 可以延长孵化时间。例如, 将粉煤灰的百分比降低到 0.5%, 就可以在固定/溶解溶液中增加潜伏期。在我们提出的方法中, 性和固定步骤同时发生, 但这些步骤可以分别执行。分离性和固定步骤有助于降低细胞质背景信号的水平。改变固定和/或性的策略也可以测试, 以优化条件, 评估特定的亚细胞结构或抗体。例如, 使用甲醇代替粉煤灰29、30、31, 可以增强中心和纺锤蛋白的可视化。此外, 通过第一波精子发生 (约 10-26 民进党) 进行的幼鼠的使用, 是有益的, 以具体和稳健的可视化罕见的减数分裂细胞事件12。另外, 通过观察细精小管32中的光吸收模式, 可以从成年老鼠身上分离出特定阶段的减数分裂细胞。然而, 考虑到成年小鼠精子发生的异步循环, 详细分析罕见的减数分裂事件可能具有挑战性。这一限制可以克服注射小鼠 bisdichloroacetyldiamine, 赢 18446, 这阻断维生素 A 代谢和停止原分化的33。在获得18466的治疗后, 恢复精子发生将同步进行, 从成熟的动物中产生大量的富集生殖细胞34。此同步策略可在小管壁技术之前使用, 以研究第一次精子发生半同步波与成人35、36、37. 此外, 还可以通过使用 WIN 18466 同步和用小管壁法评估染色体分离来评估父亲衰老与倍的相关性。
总之, 该方法可与免疫荧光显微镜结合, 观察精子发生不同阶段的细胞。应用更广泛, 这项技术也可以用来评估亚群的精, 精和精子, 并可以定制, 以研究在精子发生过程中的各种进程。该方法已用于精的活细胞成像, 并对各种细胞和生物化学研究进行了修改38,39,40。小管壁球技术已被用于老鼠和大鼠精细管, 这表明它应该很容易应用于其他哺乳动物系统, 包括人类的40。这种技术可以帮助定义细胞的扰动, 引起不孕和精子倍。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了研究院 (R01GM11755) 对 P.W.J. 的支持, 以及由国家癌症研究所 (NIH) (CA009110) 向 S.R.W. 和 j.h 提供的培训补助金奖学金。
材料
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde Aqueous | Electron Microscopy Sciences (EMS) | 15710 | |
| 10x PBS | Quality Biological | 119-069-161 | |
| Triton X-100 | Sigma | T8787 | |
| BSA | Sigma | A1470 | |
| Horse Serum | Sigma | H-1270 | |
| 35mm x 10mm Petri Dish, Sterile, non-treated | CellTreat | P886-229638 | |
| Poly-L-lysine coated glass slides | Sigma | P0425-72EA | |
| Liquid Blocker Pen | Electron Microscopy Sciences (EMS) | 71310 | |
| Humid Box | Evergreen | 240-9020-Z10 | |
| Wheaton Coplin Glass Staining Dish for 5 or 10 Slides | Fisher | 08-813E | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Labs | H-1200 | |
| Microscope Cover Slides (22mmx60mm) | Fisher | 12-544-G | |
| Clear Nail Polish | Amazon | N/A | |
| Microsopes | |||
| Name | Company | Catalog Number | Comments |
| SteREO Discovery.V8 | Zeiss | 495015-0001-000 | |
| Observer Z1 | Zeiss | 4109431007994000 | |
| Zeiss ZEN 2012 blue edition image software | Zeiss | ||
| ORCA-Flash 4.0 CMOS camera | Hamamatsu | ||
| Primary Antibodies | |||
| Name | Company | Catalog Number | Comments |
| Mouse anti-SYCP3 | Santa Cruz | sc-74569 | 1 in 50 |
| Rabbit anti-SYCP3 | Fisher (Novus) | NB300-231 | 1 in 1000 |
| Goat anti-SCP3 | Santa Cruz | sc-20845 | 1 in 50 |
| Human anti-Centromere Protein | Antibodies Incorporated | 15-235 | 1 in 100 |
| Mouse anti-alpha tubulin | Sigma | T9026 | 1 in 1000 |
| Mouse anti-AIM1 | BD Biosciences | 611082 | 1 in 200 |
| Mouse anti-γH2AX | Thermo Fisher | MA1-2022 | 1 in 500 |
| Mouse anti-CENT3 | Abnova | H00001070-M01 | 1 in 200 |
| Rabbit anti-pericentrin | Abcam | ab4448 | 1 in 200 |
| Rabbit anti-REC8 | Courtesy of Dr. Karen Schindler | N/A | 1 in 1000 |
参考文献
- Nagaoka, S. I., Hassold, T. J., Hunt, P. A. Human aneuploidy: mechanisms and new insights into an age-old problem. Nature Rev Genet. 13 (7), 493-504 (2012).
- Morelli, M. A., Cohen, P. E. Not all germ cells are created equal: Aspects of sexual dimorphism in mammalian meiosis. Reproduction. 130 (6), 761-781 (2005).
- Sun, F., Handel, M. A. Regulation of the meiotic prophase I to metaphase I transition in mouse spermatocytes. Chromosoma. 117 (5), 471-485 (2008).
- Namekawa, S. H. Slide preparation method to preserve three-dimensional chromatin architecture of testicular germ cells. J Vis Exp. (83), e50819 (2014).
- La Salle, S., Sun, F., Handel, M. A. Isolation and short-term culture of mouse spermatocytes for analysis of meiosis. Methods Mol Biol. 558, 279-297 (2009).
- Galdon, G., Atala, A., Sadri-Ardekani, H. In vitro spermatogenesis: how far from clinical application?. Curr Urol Rep. 17 (7), (2016).
- Staub, C. A century of research on mammalian male germ cell meiotic differentiation in vitro. J Androl. 22 (6), 911-926 (2001).
- Page, J., Suja, J. A., Santos, J. L., Rufas, J. S. Squash procedure for protein immunolocalization in meiotic cells. Chromosome Res. 6 (8), 639-642 (1998).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nat Methods. 1 (3), 249-254 (2004).
- Xu, X., Xu, P. A modified cryosection method for mouse testis tissue. Tissue Cell. 33 (2), 208-210 (2001).
- Hess, R., Moore, B. Histological methods for evaluation of the testis. Methods Toxicol. 3 (Pt A), 52-85 (1993).
- Bellvé, A. R. Purification, culture, and fractionation of spermatogenic cells. Methods Enzymol. 225, 84-113 (1993).
- Ventela, S., Toppari, J., Parvinen, M. Intercellular organelle traffic through cytoplasmic bridges in early spermatids of the rat: mechanisms of haploid gene product sharing. Mol Biol Cell. 14 (July), 2768-2780 (2003).
- Bellvé, A. R., et al. Dissociation of the mouse testis and characterization of isolated spermatogenic cells. J Histochem Cytochem. 25 (7), 480-494 (1977).
- Burry, R. W. Controls for immunocytochemistry: an update. J Histochem Cytochem. 59 (1), 6-12 (2011).
- Zickler, D., Kleckner, N. Recombination, pairing, and synapsis of homologs during meiosis. Cold Spring Harb Perspect Biol. 7 (6), 1-26 (2015).
- Hunter, N. Meiotic recombination: the essence of heredity. Cold Spring Harb Perspect Biol. 7 (12), 1-36 (2015).
- Scherthan, H., et al. Centromere and telomere movements during early meiotic prophase of mouse and man are associated with the onset of pairing. J Cell Biol. 134 (5), 1109-1125 (1996).
- Zickler, D., Kleckner, N. The leptotene-zygotene transition of meiosis. Annu Rev Genet. 32, 619-697 (1998).
- Scherthan, H. A bouquet makes ends meet. Nat Rev Mol Cell Biol. 2 (8), 621-627 (2001).
- Turner, J. Meiotic sex chromosome inactivation. Development. 134 (10), 1823-1831 (2007).
- Royo, H., et al. ATR acts stage specifically to regulate multiple aspects of mammalian meiotic silencing. Genes Dev. 27 (13), 1484-1494 (2013).
- Turner, J. M., et al. Silencing of unsynapsed meiotic chromosomes in the mouse. Nat Genet. 37 (1), 41-47 (2005).
- Marjanović, M., et al. CEP63 deficiency promotes p53-dependent microcephaly and reveals a role for the centrosome in meiotic recombination. Nat Commun. 6, 7676 (2016).
- Inanç, B., Dodson, H., Morrison, C. G. A Centrosome-autonomous signal that involves centriole disengagement permits centrosome duplication in G2 phase after DNA damage. Mol Biol Cell. 21, 3866-3877 (2010).
- Firat-Karalar, E. N., Sante, J., Elliott, S., Stearns, T. Proteomic analysis of mammalian sperm cells identifies new components of the centrosome. J Cell Sci. 127 (Pt 19), 4128-4133 (2014).
- Fukuda, N., et al. The transacting factor CBF-A/Hnrnpab binds to the A2RE/RTS element of protamine 2 mRNA and contributes to its translational regulation during mouse spermatogenesis. PLoS Genet. 9 (10), e1003858 (2013).
- Lahn, B. T., et al. Previously uncharacterized histone acetyltransferases implicated in mammalian spermatogenesis. Proc Natl Acad Sci U S A. 99 (13), 8707-8712 (2002).
- Mermoud, J. E., Tassin, A. M., Pehrson, J. R., Brockdorff, N. Centrosomal association of histone macroH2A1.2 in embryonic stem cells and somatic cells. Exp Cell Res. 268 (2), 245-251 (2001).
- Shanmugam, M., Hernandez, N. Mitotic functions for SNAP45, a subunit of the small nuclear RNA-activating protein complex SNAPc. J Biol Chem. 283 (21), 14845-14856 (2008).
- Ganem, N. J., Godinho, S. A., Pellman, D. A mechanism linking extra centrosomes to chromosomal instability. Nature. 460 (7252), 278-282 (2009).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nat Methods. 1 (3), 249-254 (2004).
- Amory, J. K., et al. Suppression of spermatogenesis by bisdichloroacetyldiamines is mediated by inhibition of testicular retinoic acid biosynthesis. J Androl. 32 (1), 111-119 (2011).
- Hogarth, C. A., et al. Turning a spermatogenic wave into a tsunami: synchronizing murine spermatogenesis using WIN 18,446. Biol Reprod. 88 (2), 40 (2013).
- Yoshida, S., et al. The first round of mouse spermatogenesis is a distinctive program that lacks the self-renewing spermatogonia stage. Development. 133 (8), 1495-1505 (2006).
- Kluin, P. M., Kramer, M. F., Rooij, D. G. Spermatogenesis in the immature mouse proceeds faster than in the adult. Int J Androl. 5 (3), 282-294 (1982).
- Rodriguez, I., Ody, C., Araki, K., Garcia, I., Vassalli, P. An early and massive wave of germinal cell apoptosis is required for the development of functional spermatogenesis. EMBO J. 16 (9), 2262-2270 (1997).
- Kangasniemi, M., et al. Modulation of basal and FSH dependent cyclic AMP production in rat seminiferous tubules staged by an improved transillumination technique. Anat Rec. 227 (1), 62-76 (1990).
- Martianov, I., et al. Late arrest of spermiogenesis and germ cell apoptosis in mice lacking the TBP-like TLF/TRF2 gene. Mol Cell. 7 (3), 509-515 (2001).
- Henriksén, K., Parvinen, M. Stage-specific apoptosis of male germ cells in the rat: Mechanisms of cell death studied by supravital squash preparations. Tissue Cell. 30 (6), 692-701 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。