Method Article
Aort yüzük ortak kültür tahlil: Mezenkimal Stromal hücre Vitro anjiogenik potansiyelini değerlendirmek için uygun bir araç
Bu Makalede
Özet
Burada, prelabelled Mezenkimal hücrelerin sıçan aort kaynaklı endotel ağları ile birlikte kültürlü nerede aort yüzük testin yeni bir uygulama mevcut. Bu roman yöntemi görselleştirme Mezenkimal Stromal hücre (MSCs) posta ve endotel ağları ile entegrasyon, miktar ağ özellikleri ve MSC immunophenotypes ve gen ifade değerlendirme sağlar.
Özet
Anjiogenez bir karmaşık, yüksek düzenlenmiş sağlayan ve yeterli doku perfüzyon sürdürmek sorumlu işlemidir. Aşırı bol vasküler geliştirme kanser ve enflamatuar bozuklukları ile ilişkili olmakla birlikte yetersiz damarlara bakım ve patolojik malformasyonlar ağır iskemik hastalıklar, neden olabilir. Pro-anjiogenik tedavi bir umut verici yeni damarlara geliştirmek için düzenleyici faktörler de fiziksel destek sağlayabilir anjiogenik hücre kaynaklarının biçimidir.
Mezenkimal Stromal hücre (MSCs) algılamak ve iskemik veya iltihaplı dokulara ev için kapsamlı bir şekilde incelenen parakrin etkileri ve yeteneklerini nedeniyle damar rejenerasyon adaylarıdır. Özellikle ilk üç aylık dönem insan göbek kordonu Perivasküler (FTM HUCPVCs) onların pericyte gibi özellikler, proliferatif ve multilineage potansiyeli yüksek, bağışıklık ayrıcalıklı özellikler ve sağlam parakrin nedeniyle son derece gelecek vaat eden bir aday hücrelerdir profil. Etkili bir şekilde potansiyel anjiogenik rejeneratif hücre değerlendirmek için onlara güvenilir ve "çevrilebilir" önceden klinik deneyleri test için gerekli olduğunu. Aort yüzük tahlil endotel yapılar kolay miktar için sağlar, Aksesuar destekleyici hücreleri ve hücre dışı Matriks (ECM) ana bilgisayardan sağlayan, inflamatuar bileşenleri hariç, ve bir ex vivo angiogenez modelidir hızlı ve ucuz ayarlamak. Bu zaman içinde vivo modelleri (örneğin, kornea tahlil, Matrigel tak tahlil); göre avantajlıdır Aort yüzük tahlil yönetilen hücreleri izleyebilir ve hücreler arası etkileşimler xeno-bağışıklık ret kaçınırken gözlemlemek.
Biz gelişmekte olan fare aort endotel ağları ile ortak kültürde insan MSCs içerir aort yüzük testin roman bir uygulama için bir iletişim kuralı mevcut. Bu tahlil analiz oluşumu ve gelişimi fiziksel pericyte gibi etkileşimleri aracılığıyla tüp için MSC katkı ve onların potens aktif angiogenez sitelere geçirmek için ve yeteneklerini gerçekleştirmek ve arabuluculuk değerlendirmek için izin verir ECM işleme. Bu iletişim kuralı MSC fenotip ve gen ifade ortak kültür aşağıdaki değişiklikler üzerinde daha fazla bilgi sağlar.
Giriş
Karmaşık süreç angiogenez geliştirir ve damarlara1önceden varolan yeni kan damarı geliştirme teşvik ederek doku perfüzyon korur. Pro-anjiogenik ve anti-anjiogenik faktörler tarafından sıkı bir şekilde düzenlenmiş, dengeli bir süreçtir. Bu sistemde herhangi bir eksikliği, yetersiz gemi bakım ya da büyüme, miyokardiyal hastalığı, inme ve nörodejeneratif hastalıklar da dahil olmak üzere ağır iskemik hastalıklar neden neden olabilir. Ancak, abartılı vasküler geliştirme kanser ve enflamatuar bozuklukları2dahil olmak üzere koşullar özelliğidir.
Olumlu doku rejenerasyonu ulaşmak için anjiogenezi kontrol hedefliyoruz tedaviler geliştirmek anahtar öneme sahiptir. Geniş preklinik ve klinik araştırmalar rağmen istenilen sonuçları3,4,5ulaşmak pro-anjiogenik faktörler ve mikroRNA'lar kullanarak angiogenez uyarmak için girişimleri başarısız. Geçici efektler için olası nedenler şunlardır: anjiogenik proteinler ve nükleik asitleri ve sınırlı sayıda sınırlı uzun ömürlü hedeflenen büyüme faktörleri6,7. Çözünür anjiogenik faktörler angiogenez başlatmak için gerekli olmakla birlikte, bakım ve damarlara işlevselliğini perisitlerden ve düz kas hücreleri8de dahil olmak üzere hücre tipleri destekleyen bağlıdır. Pro-anjiogenik tedavi alan artık fiziksel olarak destekleyen yeni geliştirilen damarlara, kendini sürekli yenileyen veya içine bile ayırt ederken anjiogenik faktörler yerel olarak sağlayabilir potansiyel kök hücre ve progenitör hücre kaynakları keşfetmek endotel benzeri hücreler9,10. Hücre tipleri bu fonksiyonel gereksinimleri yerine getirmek için yeteneği ile en uygun anjiogenik bulma iskemik doku rejenerasyonu için büyük söz sahibidir.
Başarılı bir şekilde potansiyel hücre tabanlı terapiler klinik çevirmek için önceden klinik çalışmalar onların etkinliğini göstermek ve temel anjiogenik mekanizmaları vurgulamak gerekir. Kurulan angiogenez deneyleri yüksek sayıda rağmen alan güvenilir bir şekilde potansiyel aday hücre türleri11,12, etkinliğini değerlendirmek olabilir bir "altın standart" vitro tahlil yoksun 13. (endotel proliferasyon, geçiş ve tüp oluşumu deneyleri de dahil olmak üzere) çoğu vitro angiogenez deneyleri genellikle endotel hücre phenotypical değişiklikler veya içine farklılaşma hücre veya bileşikler etkilerini değerlendirmek borulu ve ağ yapıları14,15. Bu özellikler angiogenez için kritik olmakla birlikte, bir "çevrilebilir" tahlil da değerlendirmelidir: 1) büyütme veya yenisi ile değiştirme perisitlerden veya düz kas hücreleri, ECM ve/veya membran, 2) işlenmesi de dahil olmak üzere destek hücre tiplerinin ve 3). fonksiyonel microvasculature oluşumu tanıtmak için verimlilik. Vivo angiogenez modeller, kornea tahlil ve Matrigel tak tahlil, benzersiz vivo içinde microenvironment özetlemek ama yönetilen izleme hücre zorluk fiziksel etkileşim gözlemlemek için zorlanmaktadır. Ayrıca, in vivo modellerinde, potansiyel allojeneik hücre terapisi aday16test ederken xeno-bağışıklık ret oluşabilir. Ex vivo angiogenez modelleri, özellikle aort yüzük tahlil sağlayabilir: 1) kolay gözlem ve miktar ECM 3) 4) dışlama inflamatuar ana bilgisayar ve yapay malzemeleri, tübüler yapıların, 2) Aksesuar destekleyici hücreleri, bileşenler ve 5) hızlı ve ucuz17,18. Genellikle, aort yüzük tahlil küçük salgı proteinler, farmakolojik ve transgenik kemirgen modelleri19,20,21anjiogenik potansiyelinin test edebilirsiniz.
MSCs öncelikle den onların etkileri parakrin aracılı22,23,24vasküler rejenerasyon için umut verici adaylardır. Vasküler endotelyal büyüme faktörü (VEGF), hepatosit büyüme faktörü (HGF), dahil olmak üzere anahtar anjiogenik faktör salgılaması için MSCs gösterilmiştir İnsülin benzeri büyüme faktörü-1 (IGF-1), temel Fibroblast büyüme faktörü (bFGF) ve angiopoeitin-1 (Ang-1)25 ,26. MSCs da algılayabilir ve ev sahipliği iskemik veya iltihaplı doku, ancak, tam mekanizmalar hâlâ soruşturuluyor. Giderek, edebiyat çoğu MSCs Perivasküler hücrelerden ortaya, pericyte işaretleri co hızlı ve perisitlerden27gibi davranabilir hipotezi destekler. HUCPVCs insan göbek kordonu Perivasküler bölgesinden elde edilen MSCs genç bir kaynaktır. Onlar MSCs nüfusu pericyte benzeri özellikleri ile temsil ve FTM ve terimi göbek bağları ile karakterizedir. FTM HUCPVCs yüksek bir ifade CD146 ve NG2, proliferatif ve multilineage potansiyeli yüksek, bağışıklık ayrıcalıklı özellikler de dahil olmak üzere pericyte işaretlerinin göstermek ve bir sağlam parakrin profil28görüntüler. FTM HUCPVCs yaralı doku pericyte benzeri özellikleri ile yeni damarlara teşviki ile rejenerasyon teşvik için ideal bir aday hücre tipi vardır.
Anjiogenik potansiyeli ve insan MSCs pericyte gibi özelliklerini sınamak için anjiogenez deneyleri çok sınırlı sayıda mevcut olumlu nerede angiotropic geçiş (bundan sonra "posta" olarak anılacaktır), işleme ECM ve fiziksel gelişimi vardır hücre tipleri arasındaki etkileşimler, microvasculature gelişimi üzerine Nicel veri alırken soruşturma.
Bu vesile ile aort yüzük testin yeni bir uygulamayı açıklayan bir iletişim kuralı mevcut. İnsan MSCs oluşumu, olgunlaşma ve homeostasis tüp için yaptıkları katkı değerlendirmek için gelişmekte olan fare kaynaklı aort endotel ağları ile birlikte kültürlü. Aort yüzük tahlil bu sürümü yetenek ve kudret eve angiogenez sitelere gerçekleştirmek ve ECM işleme aracılık ve pericyte gibi fiziksel kurulması ile endotel borulu gelişmeye katkıda hücre terapisi adayların değerlendiriyor etkileşimler. MSCs net etkisi vitro endotel ağ oluşumu üzerinde miktarının ve hücreler arası etkileşimler gözlemleyerek ek olarak, biz de ortak kültürler MSCs yalıtmak için bir protokol optimize. Akış Sitometresi ve qPCR gerçekleştirerek, MSC fenotip ve gen ifade ortak kültür aşağıdaki değişiklikleri tanımlamak mümkündür. Olarak model hücre tipleri, biz ontogenetically erken göre (doğum öncesi) ve insan MSCs geç (Yetişkin) kaynakları: FTM HUCPVCs ve insan kemik iliği türevi MSCs (BMSC), sırasıyla, aort yüzük tahlil içinde. Önerdiğimiz aort yüzük tahlil soruşturma zaman anjiogenik rejeneratif uygulamaları altında fiziksel olarak destekleyen herhangi bir hücre tipi anjiogenik potansiyelinin çalışma için kullanılabilir.
Protokol
hayvanları içeren tüm çalışmaları yürütülen ve varış yönergeleri 29 göre bildirdi. Tüm çalışmaları kurumsal araştırma Etik Kurulu onayı (REB numarası 4276) ile yapıldı. Tüm hayvan yordamlar Üniversitesi Sağlık ağı (Toronto, Kanada), hayvan bakımı Komitesi tarafından kabul edildi ve tüm hayvan insana ilişkin bakım bakım ve laboratuvar hayvanlarının kullanım kılavuzu, 8 th edition () uygun olarak alınan Sağlık 2011 Ulusal Enstitüleri).
1. aort yüzük tahlil kurulum
- izole sıçan Aortası.
- Euthanize 8 - 10 haftalık Sprague-Dawley Rat CO 2 boğulma kullanarak: Set CO %2 20 odalarına gaz değiştirme (akış hızı 0.2 x odası birim/dk =). Çimdik refleks ve kalp atım yokluğunda tarafından göğüs palpating tarafından onaylayın.
- Kürk göğüs bölgesinde % 70 etanol ile steril gazlı bez kullanarak üzerinde ıslak. Kesik göğüs orta hat yapmak ve cilt ve kas katmanından kesmek için sterilize forseps ve makas kullanın. Göğüs kafesi maruz sonra
- her iki tarafta göğüs kafesi kesilmiş ve göğüs kemiği yukarı doğru yaklaşık 5 mm'den her iki tarafta katlayın. Taze kadavraları interkostal arterler bazı kanama beklenen.
- Kalp ve akciğer dokusu aort damarı ortaya çıkarmak için anatomik sağ tarafa itin. Aort beyazdır bulunan gemi omurga için bitişik renkli.
- (Aort sonra) aort pinch ve Cerrahi makas Forseps ile aort tutarken ilk kesi yapmak kullanmak için kullanım forseps. Aort kesme, üzerine göğüs boşluğu kanla hızlı bir şekilde doldurur, bu nedenle kan pıhtılaşması önce aort elde etmek için hızlı bir şekilde çalışmak önemlidir.
- Aort tutun ve hafifçe aşağı doğru aort omurga uzak soyma kullanım forseps. Çekme olmadan daha fazla insizyon interkostal arterler sever. Aort karın boşluğunda iki dalı böler ve aort karkas dışarı kesme önce yaklaşık 10 cm doku ve/veya edinin. Kaudal yönü aort bölümlerini düşürmek için erişim kazanmak için gerekirse diyafram itin.
Not: yoğun güç gözyaşı neden olabilir çünkü aort hafifçe kabuğu. Aort gözyaşları kan pıhtılaşması birkaç saniye için izin ve pıhtılaşmış kan kaldırmak için kağıt havlu kullanın, kalan aort görünürlüğünü izin. - 15 mL tüp 10 mL buz gibi Hank ile aort yer ' dengeli tuz çözüm (HBSS) takıma % 1 penisilin/streptomisin ile (P/S) s. Tüpler buz üzerinde tutmak
Not: Aortik doku buz üzerinde 1-2 saat sürebilir ama mümkün olduğunca hızlı bir şekilde işlemek en iyisi.
- Steril Biyogüvenlik Kabini (BSC) aort yüzük tahlil kültür medyada hazırlamak.
- Hazırla %2 Fetal sığır Serum (FBS), % 1 gentamisin ve büyüme faktörleri (Tablo malzemeleri görmek) 500 mL endotel Bazal orta (EBM) filtre uygulamak için bir filtrasyon ünitesi kullanarak endotelyal büyüme orta (EGM). Boncuk veya su banyosu 37 50 mL süzülmüş medya yerleştirin ° C.
- 100 mL filtre uygulamak için başka bir filtrasyon ünitesi kullanın, %2 FBS ve % 1 ile EBM EBM P/S için hazırlanan % 2 FBS (EBM-FBS) ve 4'te ° C.
- Kat 12-iyi doku kültürü plakaları Bazal membran ayıklamak (BME) ile buz üzerinde çalışırken.
- Yer soğuk bir yüzey (büyük buz torbası veya tepsi) 12-şey tabağa. 200 µL/iyi taze çözdürülen BME kullanmanın pipet ipuçları buzdolabında ve hatta kaplama emin olmak için BME girdap ekleyin. Hızlı bir şekilde BME düzensiz polimerizasyon önlemek için çalışma.
Not: Tipik aort eksizyon 20 aort halkaları verir. Aort yüzük deneyleri arasında değişkenlik hesaba katan tedavi grubu başına en az üç aort yüzük deneyleri kurulum ve denetim içerir. Kaynak izin verirse, tedavi grubu başına 6 halkası önerilir. - Yer kaplamalı plakalar oksijen kuluçka (%95 bağıl nem, 37 ° C, % 5 CO 2; bundan sonra tüm oksijen kuluçka adımlar için geçerlidir bu koşullar) 30 dk. yer 1000-20 ° C için adım 1.5.3 µL pipet ipuçları geri.
Not: Bazal membran özü hisse senedi konsantrasyon kullanılırken, tutarlılık ve sertlik sıkı bir şekilde kontrol polimerizasyon zaman. Tam aynı polimerizasyon zaman tüm paralellikler ve bağımsız denemeleri için tutmak için emin olun.
- Yer soğuk bir yüzey (büyük buz torbası veya tepsi) 12-şey tabağa. 200 µL/iyi taze çözdürülen BME kullanmanın pipet ipuçları buzdolabında ve hatta kaplama emin olmak için BME girdap ekleyin. Hızlı bir şekilde BME düzensiz polimerizasyon önlemek için çalışma.
- Aort Tekdüzen yüzük içine bölüm.
- Aort 15 mL tüp alıp 10 mL % 1'ile takıma taze HBSS ile 10 cm çanak içine yerleştirin P/S.
- İki set forseps dikkatle aşırı bağ dokusu, yağ dokusu ve aort için neşterden interkostal arterler kalan dalları için bağlı kullanım ayırmak için kullanın. Bu değişkenlik kalan dokusunun farklı düzeylerine göre yüzük birimler arasında azaltır. Herhangi bir kalıntı pıhtılaşmış kan aort içinde kaldır.
- Bir cetvel ya da kılavuz tam olarak 1-2 mm geniş steril neşter ve forseps kullanarak aort bölümlerini kesmek için altında 10 cm çanak yerleştirin. Bölümleri birimleri arasındaki değişkenliği azaltmak mümkün olduğunca kesin olarak kesmek.
- Aort Yüzüklerin BME embed.
Not: Aortik halkaları kesit BME polimerizasyon kuluçka önce tamamlanmazsa, kaplamalı plakalar oksijen İnkübatörler kaldırın ve EBM 100 µL polimerizasyon sonlandırmak için her şey için ekleyin. Tam zamanlama olarak BME aşırı polimerizasyonu ile endotel ağ geliştirme ve hücre göç engelleyebilir önemlidir. Aort Yüzüklerin hazırlanır sonra EBM kuyulardan kaldırmak ve 1.5.2 adımından devam.- Kaplı BME wells oksijen İnkübatörler kaldırmak ve lisans için iade.
- Dikkatle Forseps ile bireysel aort yüzük almak ve her BME kaplı iyi ortasında yer. Tekrar kalan aort yüzük için.
Not: medya ile birlikte aort yüzük transfer polimerizasyon usulsüzlük önlemek için en az tutulmalıdır. - Kullanımı (-20 ° C) 1.000 µL pipet ipuçları BME 300 µL üstünde tepe-in her aort halka eklemek ve eşit BME kuyunun etrafında dağıtmak için soğutmalı.
- Katıştırılmış aort Yüzüklerin 30 dakika süreyle oksijen kuluçka için dönmek
- Katıştırılmış aort yüzük ile plakalar oksijen İnkübatörler kaldırmak ve yavaş 1.000 µL EGM (hazır ve ılık, adım 1.2.1), pipet yerleştirerek uç kültür duvara de ekleyin.
Not: Doğrudan medya BME üzerine pipetting polimerli BME ve sürekli endotel ağ geliştirme engel bozmak. Kullanılabilir uygun bir çok kanallı pipet kullanın. - Takiben 24 h, EGM 1.000 µL kaldırmak ve EBM-FBS adım 1.2.2, yine yavaş yavaş kültür yan karşı iyi pipetting tarafından hazırlanmış 1000 µL yerine.
- Aort yüzük tahlil EBM-FBS 500 µL taze EBM-FBS (37 ° C) 500 µL ile her 48 h. değiştirerek korumak
Not: Bkz: snTion MSC kültür genişleme aort yüzük tahlil kuruluş olarak aynı gün başlatmak için 2. Bu endotel ağlar hazır olduğunuzda MSCs ortak kültürü için hazır olduğunu garanti eder. - Aort yüzük tahlil endotel ağ geliştirme takip etmek parlak alan mikroskobu kullanın (en iyi ağ geliştirme için başvuru olarak şekil 1 bakınız). Şekil 2 ' de gösterildiği gibi endotel ağlar yönüdür sonra aort yüzük tahlil-MSC ortak kültürler (Bölüm 3) ayarlama ile devam etmek. Adım 4.1 endotel ağları görüntüleme daha ayrıntılı bilgi için aşağıdaki anlamlara.
2. Doku kültürü
- doku kültürü medya hisse senedi çözümleri hazırlayın.
- Kültür FTM HUCPVCs (daha önce kurulmuş, n ≥ her biri için 3 bağımsız hattı) 30 ve alfa-MEM %10 FBS ve % 1 ile desteklenmiş olarak piyasada bulunan BMSCs P/S.
- 0.2 µm gözenek boyutu filtre şişeler kullanarak ortamın sterilize.
- Hazırlanan medya çözümleri 4 ° C'de 3 haftaya kadar mağaza.
- Oksijen İnkübatörler ve geçiş faz kontrast mikroskobu tarafından belirlenen % 70-80 confluency, FTM HUCPVC korumak ve BMSC kültürlerde. Doku kültürü çanak boyutu için medya kullanımı uygun birimler (Yani 10 cm tabak içinde 10 mL) kullanılır. Bakımı ve MSCs passaging Bu kültür koşullar kullanın.
- Passaging için MSC monolayers ayırmak veya aort yüzük tahlil-MSC bir ayrılma enzim çözüm (4 mL/10 cm çanak) kullanarak ortak kültürler ve 3 dk. emin olun dekolmanı parlak alan mikroskobu kullanarak hücrelerin oksijen İnkübatörler kuluçkaya; kuluçkaya gerekirse bir ek 1-2 min için.
- 15 mL tüp ve vasıl 400 x g 5 dakika süreyle santrifüj Disosiye hücrelere transfer
- Hücre Pelet bozmadan süpernatant Aspire edin ve bir hücre sayaç sayım için uygun bir kültür ortamının (alfa-MEM komple medya hücreleri veya EBM-FBS aort yüzük tahlil/MSC ortak kültürler için passaging için) 1 mL hücrelerde resuspend.
3. Aort yüzük tahlil/MSC ortak kültürler hazırlanması
- tohum 10 4 MSCs her gömülü aort yüzük (9,000 hücreler/cm 2 / 12-şey plaka). Aort yüzük deneyleri sayısına göre uygun, devredilemez floresan boya MSCs önceden leke. MSCs olmadan aort halkalar bir kontrol grubu için en az üç kuyu korumak.
- 10 5 MSCs/mL EBM-FBS medya leke, 2.5 µL kalıcı olarak eklemek için devredilemez floresan boya/mL medya (5 mikron) 15 mL tüp ve yer 30 dakika süreyle oksijen kuluçka kuluçka yarım tüp karışımı yavaşça.
- Aşağıdaki 30 dk kuluçka, taze EBM-FBS lekeli hücrelere 1 birim ekleme ve 400 x g 5 dakika süreyle de spin
- Süpernatant kaldırmak ve hücre Pelet 1 mL EBM-FBS medya yeniden askıya alma. Başarılı Floresans mikroskobu kullanılarak MSCs boyama onaylayın.
- Aort yüzüğü içeren levhalar her kuyudan EBM-FBS 500 µL sökün oksijen kuluçka ve.
- Dikkatle 10 4 MSCs EBM-FBS 500 µL her katıştırılmış aort halkası üzerinde eşit olarak endotel ağlar pipetting tarafından tohum. Hatta dağıtım kültür plaka hafifçe sallayarak olun.
- Aort yüzük tahlil/MSC işbirliği kültürü üzerinde medya hacmi 1000 µL olduğundan emin olmak için ek EBM FBS ekleyin.
- Aort yüzük tahlil fluorescently etiketli MSCs görselleştirmek için Floresans mikroskobu kullanın.
4. mikroskopi
- aort yüzük tahlil/MSC önce sıçan endotel ağlar görüntüye kullanım alanı parlak mikroskobu ortak kültürlerin endotel ağ özellikleri (örneğin, ağ temel (0 gün) ölçülerini Uzunluk, ağ döngüler). Görüntü 4 kadranın aort yüzük kuyudan endotel ağı bu çeyreği içinde en uzak kısmına başına.
Aort yüzüğü takip
- görüntü aort ring ağlarında tahlil/MSC 3, 5 ve 7 gün ortak kültürler. Endotel ağ geliştirme MSC etkisini ölçmek için bu görüntüleri kullanın.
- Aort yüzük tahlil önceden etiketli MSCs görüntüye Floresans mikroskobu kullanın.
- Aşağıdaki 24 aort yüzük tahlil/MSC s ortak kültürler, Floresans mikroskobu MSC posta, uzama ve endotel ağları ile entegrasyon görselleştirmek için kullanın. MSCs floresan görüntüleri her iki hücre tiplerinin colocalization gözlemlemek için endotel hücreleri parlak alan görüntüleri ile örtüşüyor.
- Görüntü gelişmiş endotel ağları proksimal aort yüzük doku içerisinde lokalize MSCs ve yeni ağlar distal aort yüzük doku ( Şekil 2) geliştirme içinde lokalize MSCs.
5. Akış Sitometresi ve qPCR
- 4 ° C'de O donmuş dispase aort ring endotel ağları, dissociating önce bir gün tezcan/i. Bölüm 5.3 Akış Sitometresi ve qPCR için aynı.
- 50 mL dispase ve 37 ° C boncuk veya su banyosunda % 0.5 tripsin 50 mL sıcak.
- Aort yüzük tahlil/MSC ortak kültür analizi için hücreleri almak.
- Sonra 1 hafta aort yüzük tahlil/MSC ortak kültür, kültür ortamını çıkarın ve 1 mL olarak Phosphate-Buffered serum fizyolojik (yavaş yavaş her 3 dakikadır iyi ve kaldırmak için PBS) ekleyin. Bu yıkama iki kez daha tekrarlayın.
- Eklemek 800 µL, dispase her şey için önceden ısıttı ve 15 dakika süreyle oksijen İnkübatörler kuluçkaya
- Tabakaları oksijen İnkübatörler kaldırmak ve dispase kadar BME kırmak için (5-10 x) pipetting tarafından askıya alma ve her şey içeriğini ayrı 15 mL tüpler içine aktarmak. Hiçbir kalıntı kadar taze Önceden ısıtılmış dispase ile tekrar
- tekrar adım 5.3.3 BME kültüründe de görülmektedir. %3 ile desteklenmiş PBS 1 birim ekleme FBS dispase-hücre süspansiyon için dispase devre dışı bırakabilirsiniz. Aort Yüzüklerin pipet ipuçlarını kullanarak hücre süspansiyon içinde yüzen kaldırmak.
- Spin hücre süspansiyonlar 400 x g de 5 dk. için çıkarmak süpernatant dikkatle, hücre süspansiyon 3 mL 15 mL tüp bırakarak.
Not: Bir açık, katı Pelet görünür olmayabilir ama hücreleri ve BME hediyesi. - Prewarmed % 0.5 tripsin 3 mL hücre süspansiyon ve şiddetle resuspend (5-10 x pipetting tarafından) hücreleri ekleyin. 10 dakika süreyle oksijen İnkübatörler trypsinized hücre çözümlerinde kuluçkaya
- Trypsinized hücre süspansiyonlar oksijen İnkübatörler kaldırmak ve PBS %3 FBS ve resuspend 6 mL ekleyin birkaç times. Hücre süspansiyonlar 400 x g 5 dakika süreyle, spin
- Dikkatle hücre Pelet tüp bırakarak tüm süpernatant, kaldırmak ve 1 mL %3 ile desteklenmiş PBS hücrelerde resuspend her tüpün içinde FBS.
- Toplanan hücre ve kalan BME hücre süspansiyon kaldırmak için bir 70 µm hücre süzgeç kullanma 1 mL hücre süspansiyon filtre. Hücrelerin hücre süspansiyon hücre sayaç 1 ml.
- Hücreleri Akış Sitometresi için hazırlamak.
- Incubate hücre süspansiyonlar (%3 ile takıma 200 µL PBS 10 5 hücrelerde FBS) fluorophore Birleşik (FITC veya APC) birincil antikorlar ile (TRA-1 - 85-, CD146, CD31) konsantrasyon = 1:40) 30 dk için 4 ° C'de korumalı gelen ışık.
Not: Hong vd tarafından 2013 28 Akış Sitometresi MSCs için optimize edildi. En az 10.000 hücrelerinin doğru okumalar için gereklidir. - 30 dk kuluçka takip resuspend 2 mL %3 FBS ve santrifüj (400 x g, 5 min) ile desteklenmiş PBS hücrelerde.
- Tutun hücreleri ışıktan Akış Sitometresi (en az 1 x 10 4 olaylar) tarafından analiz kadar korumalı içinde 1 h 4 ° C'de. Perdeleme strateji için tamamlayıcı şekil 1 bakınız. Sıralama insan MSCs anti-TRA-1-85 (APC) kullanarak (konsantrasyon: 1:40 ve % 0,5 FBS/PBS) ve sıralama hücreleri içine hücre lizis arabelleği qPCR analiz için 350 µL.
Not: Gelecekteki qPCR analiz için 3 aya kadar-80 ° C'de Lysed hücreleri saklanabilir.
- Incubate hücre süspansiyonlar (%3 ile takıma 200 µL PBS 10 5 hücrelerde FBS) fluorophore Birleşik (FITC veya APC) birincil antikorlar ile (TRA-1 - 85-, CD146, CD31) konsantrasyon = 1:40) 30 dk için 4 ° C'de korumalı gelen ışık.
- QPCR analiz için hücreleri hazırlayın.
- Lysed hücreleri sütunlara göre RNA izolasyon Kitleri kullanarak RNA yalıtmak ve RNA konsantrasyon ve kalite belirlemek.
- Hazırlama cDNA RNA 5 µg başına 100 üzerinden µL transkriptaz tepki. RNA verim düşükse bir öncesi amplifikasyon adımıysa (< 10 ng/µL). 100'den küçük kullanımı ng RNA'ın yanlış negatifleri yüksek bir oran içinde sonuçlanacaktır.
Not: CDNA şablonları-20 ° c daha fazla çözümleme için 4 aya kadar saklanabilir. - Gen ifadesinde değişiklikleri algılamak için angiogenez ifade profiler dizileri kullanma qPCR gerçekleştirin. CDNA reaksiyon (40 döngüleri, 60 ° C sıcaklık tavlama/genişletme) başına kullanım 5 ng. Kat değişiklik farklılaşmamış türetilmiş MSC cDNA örnekleri için karşılaştırıldığında ifade hızlı. Uygun negatif denetimleri (aort yüzük olmadan insan MSCs) çalıştırmak.
6. Ağ miktar aşağıdaki aort yüzük tahlil/MSC ortak kültür
- ile birlikte angiogenez Çözümleyicisi eklenti 31 ImageJ gibi görüntüleme yazılımı indirmek.
- Alınan endotel ağ görüntüleri içe ve açmak belgili tanımlık bilgisayar yazılımı ı.
- Kullanılan mikroskop teknik özellikleri temel görüntüyü ölçekler dönüştürmek.
- Radyal ağ büyüme ölçmek için bir düz çizgi aracını kullanın.
- Hücre sayacı aracını kullanarak endotel ağ döngüler saymak (döngüler en az 4 kenarlara sahip sayılabilir).
- Ağ özellikleri, ek miktar kullanmak için angiogenez Çözümleyicisi eklenti veya benzer diğer eklentileri ana segmentleri, analiz etmek için toplam kesim uzunluğu, toplam ağ alanları ve kavşak sayısı. Aort yüzük doku ve yanlış pozitif hesaplamalar önlemek için boşluk bulanıklık için bulanık maskesi aracını kullanın.
- Aort yüzük tahlil/MSC ortak kültürler takip bir istatistik programı ve graph endotel ağ özellikleri için değerleri transfer.
Sonuçlar
Aort yüzük/MSC ortak kültür tahlil oluşturmak için şematik iş akışı şekil 1' de gösterilmiştir. Ana adımları şunlardır: rat aort yalıtım, kesit ve aort Yüzüklerin katıştırma, endotel çimlenme ve ağ geliştirme, izleme ve son olarak etiketleme ve MSCs yönetme. Endotel ağ analizi kronolojisi ortak kültür her dönem için uygun analizleri için pencere özetliyor: gün 1, 5 & 7. Ek notlar noktalı kutuları ile vurgulanır.
Aort yüzük endotel hücre kültürlerinde yapısal olarak farklı bölgeleri tanımlaması parlak alan mikroskobu, 3-5 aort Yüzüklerin ECM (Şekil 2) gömülü sonra d tarafından gerçekleştirilir. Yapılandırılmamış alan (şekil 2A) yüksek hücre çoğalması ama düşük yapısal organizasyon aort dokusu doğrudan çevresinde bir bölge olarak karakterizedir. Gelişmiş endotel ağları (şekil 2B) ağları nerede tam olarak kurulan ve ağırlıklı olarak MSCs ilavesi bile önce kapalı döngüler oluşan yüksek yapısal organizasyon bölgeleriyle bakın. Gelişmekte olan ağlar (şekil 2C) endotel kültürlerin alanları distal yer almaktadır. Bunlar, endotel hücre göç ve uzama en yeni ağ yapıları biçimi olarak sitelerdir. Yukarıda belirtilen 3 bölgeleri deneyler kolayca tanımlanabilen ve nerede MSCs co kültürlerde eve gönderme yaparken kullanılır. Tüm üç ağ kesimi geliştirdik zaman prelabelled MSCs aort yüzük tahlil ile birlikte kültürlü olmalıdır. Miktar MSC ortak kültürler takip endotel ağların gelişmiş ve gelişmekte olan ağ (Şekil 2, beyaz çerçeve) bölgelerinde bulunmaktadır.
Floresans mikroskobu MSC geçiş, tümleştirme ve Morfoloji aort yüzük-MSC ortak kültür tahlil (şekil 3) endotel ağlarda geliştirme ile birlikte nitel ölçümler için izin verir. Uygun, sitoplazmik fluorophore ile etiketli MSCs 24 h eş kültürler için yönetim sonra görüntüsü. FTM HUCPVCs gelişmekte olan endotel ağlar çevre bulundu, uzun hücre türleri Morfoloji görüntülenen ve endotel ağları (şekil 3A, B) daha da gelişmesine katkıda bulunmuştur. Karşılaştırma için endotel hücreleri (şekil 3 c, D) ile daha az etkileşim görüntülerken gelişmekte olan ağa BMSCs bağlantılı. Yüksek büyütme görüntüleri 72 h FTM HUCPVCs yüksek kapsama ve endotel ağlarda ortak kültürleri sınırlı endotel ağları (şekil 3E entegrasyonu ile küresel türleri Morfoloji mevcuttur BMSCs ise istikrar devam gösterdi , F). Gözlenen farklılıklar açıkça insan MSC türleri arasındaki nitel, işlevsel farklılıklar gösteriyor. Önemli posta ve endotel tümleştirme özellikleri olan bir tedavi aday hücre tipi (şekil 3A, B & E) hücre tipi endotel ve sınırlı bir ağ tümleştirme ve büyütme ile karşılaştırıldığında öne çıkmaktadır yetenekleri (şekil 3 c, D & F).
Yüksek büyütme Floresans mikroskobu görüntüleri daha fazla borulu ağlar endotel hücreleri ve FTM HUCPVCs arasındaki etkileşimler fiziksel incelemek için satın alınan. Önceden etiketli FTM HUCPVCs (şekil 4A, yeşil) kalarak günahı endotel hücreleri ile gösterilir (şekil 4A, beyaz ok). FTM HUCPVCs eksen ve eki yüzeyine düğümler arasında hizmet ederek endotel hücreleri için yapısal destek sağlamak için bulunamadı. Aort ring endotel ağları da benzer şekilde (şekil 4B, kırmızı) Boyama Master Programı için uygun bir fluorophore kullanarak önceden etiketli olabilir. Çift Kişilik lekeli co kültürlerde Floresans mikroskobu işbirliği ve destekleyici hücre davranış gözlem kuvvetlendirici iki hücre türleri arasında uzun yapışıklıklar ortaya koydu.
Endotel ağ yapısal özellikleri miktar MSC ortak kültürlerin (şekil 5) 5 gün gerçekleştirildi. Tek tip çeyrek dairelerin tüm aort halka endotel ağ (Şekil 2, beyaz çerçeve) boyunca ölçüm için tanımlanmış. Kötü ağ büyüme için sağdaki distal kapalı döngüler (RADIUS boyutu) aort halka ilk proksimal kapalı ağ döngüler mesafe olarak hesaplanmıştır (şekil 5A). Aort yüzük-MSC ortak kültürlerin kötü ağ büyüme olduğunu aşağıdaki gibi: FTM HUCPVCs (2.98 ±0.3 mm) ve BMSCs (1.5 ±0.15 mm). Tedavi edilmemiş endotel ağlar ortalama yarıçap 1.9 ±0.1 mm olarak geliştirdi. MSC tedavi grupları arasında istatistiksel karşılaştırma FTM HUCPVCs BMSCs ve tedavi edilmezse ağları (p ≤0.001) ile karşılaştırıldığında önemli ölçüde daha fazla ağ büyüme katkıda gösterdi. Tedavi edilmemiş endotel ağları önemli ölçüde geliştirilmiş daha çok ortak kültürler (p ≤0.01) içeren BMSC (şekil 5B).
Döngüler toplam sayısına her çeyreğinde hesaplanır ve ortalama toplam döngü oluşum (şekil 5C) olarak dile getirdi. Toplam kapalı döngü ortalama sayısını olduğunu aşağıdaki gibi: FTM HUCPVC tedavi ortak kültürler (81 ±7), BMSCs (26 ±3) ve tedavi edilmezse halkalar (55 ±7). FTM HUCPVCs BMSCs (p ≤0.01) ve tedavi edilmezse ağları (p ≤0.01) ile karşılaştırıldığında önemli ölçüde daha fazla endotel döngü oluşumuna katkıda bulunmuştur. BMSC işbirliği içinde sonuçlandı az endotel kültürlerin ağ tedavi edilmeyen ağlara (p ≤0.01) karşılaştırıldığında döngüler. Bu miktar bile endotel ağlar bozabilen bir hücre tipi ve endotel ağ geliştirme (FTM HUCPVC) üzerinde önemli ölçüde olumlu bir etkiye sahiptir bir hücre türü tanımlar. Bu önemli ölçüde artan ağ geliştirme de endotel ağlarda MSC kapsama ile ilişkilendirmek için gözlendi belirtmek etmektir. Bu doğrudan etkileşim destekleyici işlevleri yürütmek MSCs için çok önemli olduğunu göstermektedir.
Aort yüzük ortak kültür işyerlerinin mümkün tuzaklar şekil 6' da temsil edilir. BME yetersiz veya düzensiz polimerizasyonu ile başarılı endotel ağ geliştirme engelleyebilir bir sorundur. BME polimerizasyon tam olarak 30 dakika zamanlama ve polimer aksatmadan medya aktarma sağlam, fonksiyonel BME faz (şekil 6A) sağlayacaktır. Uzun süreli kuluçka kez için MSCs boyama ve uzun süre cips MSCs sağlayan hücre morfolojisi ve ortak kültürü üzerinde fenotip ile girişime neden olabilir. FTM için 1 h lekeli ve izin HUCPVCs şekil 5B gösterir1 önce ortak kültür s için cips, hem alt-optimal zamanlamaları varlık. FTM HUCPVCs sitelerine endotel ağların tercih görünmüyor ve ağ dağılmış. Düzgün karşılaştırma hücreleri (şekil 3) mishandled FTM HUCPVCs için tedavi, yuvarlak hücre morfolojisi ve endotel hücreleri (şekil 6B) ile sınırlı hücre hücre etkileşimleri mishandled hücreleri görüntüler. Aort yüzük tahlil diseksiyon günde kurulmuş, son olarak, aortas-80 ° c % 10 Dimetil sülfoksit (DMSO) ve % 10 ile EGM-C medya saklanabilir FBS. Endotel ağ geliştirme taze dokusu ile karşılaştırıldığında çözdürülen aort yüzük uygularken 1-3 d daha uzun sürebilir, ama endotel ağlar MSC ortak kültür kuruluş (şekil 6C) yeterli olacaktır.
Aort yüzük ortak kültür değerlendirme olarak bir alternatif devam etmeden, gömülü BME aort yüzük hücresel kısmını çıkarılan ve Akış Sitometresi (ek şekil 1) tarafından analiz. İnsan belirli işaret TRA-1-85 (ek şekil 1A, B, y ekseni) pozitif hücre nüfus FTM HUCPVC ortak kültürleri içeren insan MSCs tespit edilmiştir. Co etiketleme düşük ifade endotel hücre işaretçisini CD31 (ek şekil 1A) ve yüksek ifade pericyte işaretin CD146 (tamamlayıcı şekil 1B) insan belirli işaret pozitif hücre nüfus içinde gösterdi. Böyle değerlendirme nihai immunophenotypic ve endotel hücreleri ile etkileşimler tarafından indüklenen MSCs lineage taahhüt değişiklikleri deşifre ve daha fazla test edilmiş hücre tipi hakkında değerli bilgiler sağlamak. Hücreleri FC analiz için yeterli sayıda elde etmek için aynı deney grubu paralel kuyulardan elde hücreler birleştirilebilir. Öncesi lekeli MSC uygun boya anımsatan floresan antikor ile ilgili fluorophores sinyal ile müdahale değil aort Yüzüklerin Akış Sitometresi Analizi için içeren kullanarak dikkate almak önemlidir. Aksi takdirde olumsuz çoğunluğuna önceden lekeli hücre Floresans dikkate almalıdır.
Biz insan MSCs ayıklanan formu aort yüzük ortak kültürler (günü 7 ortak kültür) sıralı insan hücre yüzey marker spesifik antikor (TRA-1-85) kullanarak. FTM HUCPVCs ve BMSCs aort yüzük tahlil kurtarılan anjiogenik genlerin ifade sınamak qPCR analiz için işlendi. Bir piyasada bulunan qPCR kullanarak, üç aort yüzük ortak kültürler genetik materyal ifade 84 insan büyüme faktörü genlerin (ek şekil 2A) ölçmek için yeterli miktarda sağlanan. İlk sonuçlar FTM HUCPVCs ve BMSCs anahtar salgılanan anjiogenik faktörler (ek şekil 2B) karşılaştırılabilir düzeyde ifade gösterir. Farklı hücre tipleri tahlil düzeyde ifade karşılaştırma yanı sıra, hücreleri EBM için aktarma etkisi tahlil genişleme kültür ortamlarına medyadan düşünülmesi gereken temel. Daha yüksek fenotipik veya genetik plastisite hücrelerinin kullanırken, EBM medya - aort dokusu - olmadan insan MSCs karşılaştırıcı kontrol grubu değerlendirme içinde bulunmalıdır.
MSCs anjiogenik faktör ifadesi benzerlikler gösteriyor onların ağ büyütme önemli fark farklı parakrin faaliyetleri sonucu değildir. Bu endotel ağ kalkınmayı teşvik etmek için artan doğrudan hücreler arası etkileşim görünür daha önceki gözlem ile uyum olduğunu.

Resim 1: Aortik yüzük tahlil kurulumunun bir roman uygulama şematik diyagramı.
Kur ana adımları ve analiz aort yüzük tahlil ile MSC ortak kültürlerin katı kutularına açıklanmıştır ve ek notlar noktalı kutularına özetlenmiştir. Ölçek çubuğu 1000 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2: Temsilcisi görüntüsü aort Ring ağ analizi.
Endotel ağlar üzerinde yapısal farklılıkları dayalı üç konsantrik bölgeye ayrılır: Aortik yüzük doku(a), endotel ağlar (B) geliştirilen/yapısal ve gelişmekte olan ağları birbirine yakın yapılandırılmamış alan ex vivo doku kültürü (C) çevre içinde yer. Radyal ağ büyüme ve döngü sayımı için Tekdüzen çeyreği gelişmiş endotel ağ (B) içinde tanımlanır. x: kapalı endotel devre Tekdüzen çeyreğinde sayılır. Ölçek çubuğu 250 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
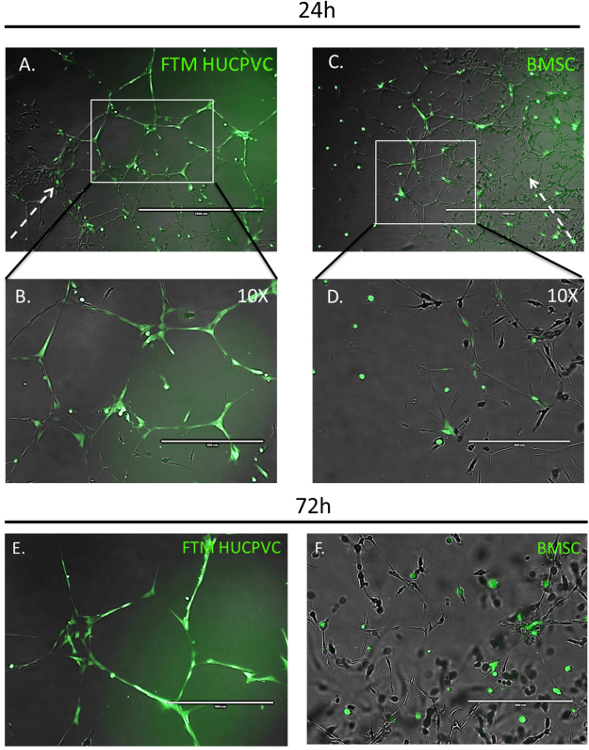
Şekil 3: Floresan Imaging, şebeke bölge bağlı entegrasyon, insan MSCs aort yüzük tahlil 24 takip & 72 h.
Prestained (yeşil) FTM HUCPVCs ve BMSCs gelişmekte olan aort ring endotelyal tüp ağları için eklenmiştir. Floresans mikroskobu 24 h MSC ortak kültürler ECM ve ev periferik gelişmekte olan endotel ağlara(a)üzerinden göç FTM HUCPVCs görüntülemek kurduktan sonra çekilen görüntüleri. Yüksek büyütme görüntüler, FTM HUCPVCs endotel ağları (B) ile yakın temas ederken uzun türleri Morfoloji görüntüler. Daha az BMSCs işlemi ECM ve periferik gelişmekte olan ağlara (C) hiçbir gözlemlenebilir tercihi olan endotel ağlara ev. BMSCs küresel hücre türleri Morfoloji (D) görüntüler.
Yüksek büyütme Floresans mikroskobu görüntüleri sıçan aort yüzük tahlil ortak kültür (E, F) 72 h takip prestained MSCs. FTM HUCPVCS hem ağ düğümleri ve tübüllerin (E) endotel kapsama endotel hücreleri (katı beyaz ok) ile doğrudan hücre hücre etkileşimleri aracılığıyla görüntülerken uzun türleri Morfoloji mevcut. BMSCs küresel hücre türleri Morfoloji endotel ağ düğümleri (F) kümelenmiş korumak. Broken arrow aort yüzük dokusundan endotel ağ büyüme yönünü temsil eder. Bir, C: Ölçek çubuğu 1000 µm B, = D: ölçekçubuk 400 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
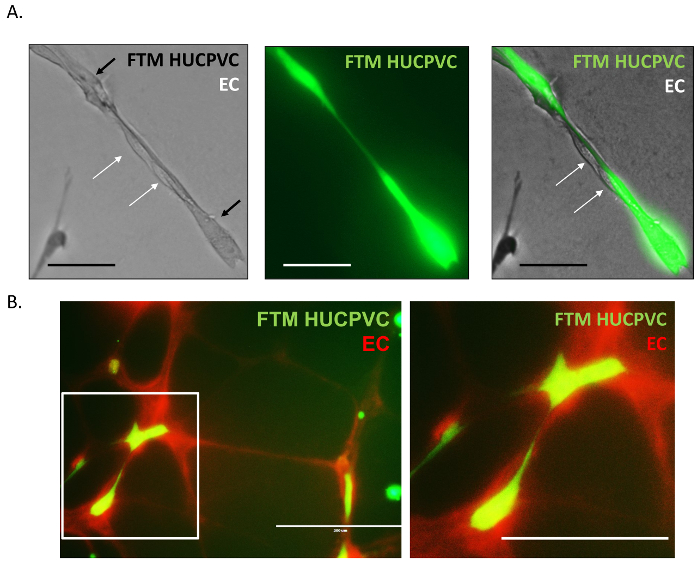
Şekil 4: Yüksek büyütme Floresans mikroskobu görüntüleri Pericyte endotel hücre fiziksel etkileşimleri.
Günahı endotel hücreleri sürekli çıkıntılar önceden lekeli FTM HUCPVCs borulu ağ(a)bağlama ile ilişkili bulunmuştur. Floresan görüntüleri önceden lekeli FTM HUCPVCs (FTM, yeşil) ile önceden lekeli endotel ağların (EC, kırmızı) etkileşimleri pericyte etkileşimleri (B) endotel hücre, recapitulating göstermektedir. Re: ölçek çubuğu 100 µm B: ölçek çubuğu = 200 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 5: Miktar ağ büyüme MSC tedavi grupları 5 D ortak kültür kuruluş sonra.
Düşük büyütme faz kontrast mikroskobu görüntüler ölçü ağ büyüme ve gelişme(a)aort yüzük tedavi gruplarından alınmıştır. Dağınık ok ağ büyüme yönünü gösterir. Ölçek çubuğu = 250 µm. mikroskobu görüntüleri ortalama ağ büyüme içeren ağ özelliklerini ölçmek ve ağ döngü oluşumu bir tahlil Çeyreği'demek için kullanılmıştır. FTM BMSC ortak kültürler ve tedavi edilmezse ağları (p ≤0.001) ile karşılaştırıldığında daha fazla ağ büyüme katkıda HUCPVCs (B). Bir tek yönlü ANOVA kullanarak p değeri hesaplanır p <Tukey'nın kullanarak 0,0001 sonrası test (N = 3). Ağ döngüler en az dört kapalı kenarlara sahip sayılabilir (C). FTM HUCPVC ortak BMSC ortak kültürler (p ≤0.001) ve tedavi edilmezse ağları (p ≤0.01) ile karşılaştırıldığında gelişmiş büyük ağ döngüler kültürler. P değeri p olması gerekiyordu bir tek yönlü ANOVA kullanılarak hesaplanmıştır < 0.0001 Tukey'nın Post testi kullanma (N = 3). 4 endotel ağlar alanlarında ortalaması sayılabilir. Ölçek çubuğu 250 µm =. İkili karşılaştırma için * p ≤0.05 = ** p ≤0.01 = *** p ≤0.001 =. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 6: Aortik yüzük tahlil işyerinde olası hatalar.
Aort yüzükleri eksik BME polimerizasyon içinde gömülü tutarsız ve kırık endotel ağlarına(a)neden olabilir. FTM HUCPVCs boyama ve ortak kültür, verim en az posta ve endotel hücre etkileşimleri (B) kurulması arasında büyük zaman boşluklar ile uzun süre lekeli. Sıçan Aortası endotel ağdan-80 ° C'de depolanan ve aort yüzük tahlil (C) çözdürülen. Re: ölçek çubuğu = 250 µm B, C: ölçek çubuğu 400 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Ek resim 1: Sitometresi Analizi insan FTM HUCPVCs aort yüzük ortak kültürler çıkarılan akışı.
Aort yüzük kültürlerin hücresel kesirler izole ve Akış Sitometresi Analizi için işlenir. İnsan belirli hücre yüzey marker (TRA-1-85, APC) karşı Fluorophore konjuge antikor endotel işaretleyici (CD31, FITC,(a)) veya pericyte (CD146, FITC, (B)) işareti belirli antikorlar ile birlikte uygulandı. Hücre nüfus için insan işaretleyici (y ekseni) pozitif düşük pozitifliği (A, Q2) endotel işaretçi CD31 için ve yüksek pozitif pericyte işaretçisi CD146 için (B, S6) test edilmiştir. Bu FTM HUCPVCs aort yüzük ortak kültürlerin nesnelerin Perivasküler hücre özelliklerini muhafaza ve endotel bir fenotip geliştirmek değil göstermektedir. Çeyrek dairelerin araziler üzerinde uygulanan birincil antikorlar eşleşen izotip denetimlerini kullanarak tanımlanmış olan. Bu dosyayı indirmek için buraya tıklayınız.
Ek resim 2: Kantitatif PCR anahtar anjiogenik genlerin analizi.
FTM HUCPVCs ve BMSCs 1 haftalık ortak kültür aort yüzük tahlil(a)aşağıdaki anahtar anjiogenik genlerin benzer gen ekspresyonu. Temsilcisi CT değerleri (B) tabloda gösterilmiştir. Bu dosyayı indirmek için buraya tıklayınız.
Tartışmalar
Bir başarılı aort yüzük tahlil MSC ortak kültür deney ortamında birkaç kritik aşama vardır. İlk olarak, yalıtma ve aort kesit en önemli adımlar şunlardır: 1) aort; sadece torasik segment elde etme 2) dikkatle dallanma kan damarları, bağ ve yağ dokusu kaldırma ve; 3) kesme bile bölümleri her tahlil arasında değişkenlik sınırlamak için aort (~ 1 mm). İkinci olarak, başarılı aort halkaları BME gömme bu tahlil için önemlidir. BME tamamen polimerli ya da düzensiz polimerli BME içinde gömülü Yüzüklerin aort endotel çimlenme başlatmak mümkün olmayacaktır veya kesintili endotel ağlar gelişebilir. BME polimerizasyon yetersiz ise, deneyleri miktar için güvenilir değildir. Üçüncü olarak, komple faktör zenginleştirilmiş endotel medya aort Yüzüklerin çimlenme başlatmak için besin sağlamak gereklidir. Bir kez aort yüzük yüzük gemi çimlenme başlattık, sonraki kritik yaklaşan adımlar test edilecek hücre türü içerir. Bu amaçla, MSCs başarıyla önceden lekeli ve çimlenme aort Yüzüklerin yönetilen gerekir. Bu bölüm için iki kritik yordamlar vardır. 1) seçerek tohumlama için uygun gün: ağlar gelişmekte olan aşamasında olmalı ve kültür yüksek kapsama de ulaşmak değil. MSCs zamanında yönetilen değil, ağ geliştirme net MSCs etkilerini ölçmek zor olur. 2) prestaining yanı sıra önce MSCs: MSCs aşırı lekeli veya Pelet içinde geniş bir süre için kalır, topaklanma bu posta ve endotel ağları içinde entegrasyonu bozar gerçekleşir. Uygun kontrollerin hazırlanan son olarak, ağlar miktarının kolayca elde edilebilir. MSCs olmadan aort yüzük endotel ağlar çimlenme aort kendisi destekler ama MSCs bu el yazması açıklandığı gibi farklı ağ yapıları ile büyük ağ geliştirme teşvik olabilir çünkü gelişecektir. Endotel ağlar miktar gerçekleştirilen en az 5 d aşağıdaki kurulması ortak kültürler olmalıdır. Kapalı sistem nedeniyle geçici anjiogenik yanıttır ve yaklaşık 7 d takip oluşan bozucu endotel ağların başlangıç. Gözlem amacı endotel ağlar gelişimi üzerinde test edilmiş hücre türü etkisi değerlendirecekse, ortak kültür ve ilk hafta içinde görüntüleri elde.
Olası bir değişiklik geçerli testin birincil insan dokusu uygulama olabilir. Sıçan Aortası 1 mm bölümünü ortak kültürü için bir birim yapar gibi insan aortas yüksek sayıda bölümü son derece tutarlı ölçümleri ile sağlayabilirsiniz. Uygun insan birincil dokusu son derece sınırlı kullanılabilirlik rağmen potansiyel fizibilite yüksek çıkış öneriyor. Bir tahlil için büyük ölçekli değerlendirme geliştirirken, tahlil ön şekillendirme ve hücreleri test etmek için kullanılabilir olana kadar bileşenleri depolamak kabul edilebilir. BME kaplama doku kültürü Tabaklarda hazırlanan ve daha uzun süreler için dondurulmuş, kurutulmuş formunda depolanan. Ayrıca, biz bizim laboratuvar test gibi sıçan aort dokusu donmuş ve daha sonra uygulama, böylece yapım çalışma ile daha rahat testin en önemli unsur için depolanır.
Rağmen pek çok avantajı aort yüzük testin listelenecek bazı sınırlamalar vardır. İlk olarak, tahlil kültürler kurulması zor olabilir. Mevcut haliyle, rutin uygulama yeterli el ile beceri gerektirir. Operatör hatalarını değişkenlik tanıtabilirsiniz. Bu ağ büyüme yansıtılabilir ve güvenilir yönetilen hücreleri etkisi ve sonuç olarak önemli anjiogenik özelliklerini değerlendirmek zorlaştırabilir. Ancak, bu sorunlar değil daha küçük Eğer o diğer yöntemleri karşılaştırıldığında benzer ve gerekli eğitim dönemi uygun kısa ve in vivo deneyler karşı ekonomik olabilir. İkinci olarak, ex vivo aort doku ve hücre Yönetim zaman işaretleri ilk ağ geliştirme katılmasını arasında bir gecikme süresi için kullanıcı tarafından hesaba katılması gerekir. Üçüncü olarak, endotel ağ özellikleri miktar zaman alıcı olabilir ama radiyal büyüme dahil olmak üzere hallmark parametreleri atayarak çözülebilir, uzunluğu ve ağ kafes boyutları tüp. Bu tutarlı ve güvenilir miktar için gerekli süreyi önemli ölçüde kısaltıp görüntüleri (görüntü J), bilgisayar destekli analizi kullanılarak gerçekleştirilebilir. Dördüncü olarak, her tahlil arasında değişkenlik hayvan doku kaynak ve operatör tarafından işleme hafif tutarsızlıklarına bir sonucu olarak ortaya çıkabilir. Bu meydan okuma etkili bir şekilde üstesinden gelebilir ve miktar her tedavi grubu için triplicates ayarlayarak istatistiksel olarak güvenilir olur bulduk. Son olarak, ayıklama ve insan hücreleri ve sonrası tahlil analiz için fare kökeni sıralama zor olabilir. Ancak, belirli proteinases dispase ve hücre kurtarma çözümü de dahil olmak üzere, immunophenotypic veya gen ifade analizi için hücreleri kurtarmak için uygulanabilir.
Bir tek endotel hücre türü kültür ya da canlı hayvan sistemleri mevcut yöntemlerine göre bu tahlil anlamları ex vivo aort dokusu ve BME kombinasyonu sundu. Bu ayar kullanıcının hem nitel hem de Nicel veri hücre terapisi adaylar anjiogenik özelliklerini elucidating sağlar. BME ve çok hücreli ex vivo doku birleştiren yakından tedavi hücre tipi yerel yönetim sonra karşılaşabileceğiniz microenvironment taklit eden özellikleri sağlar. Yüksek sayıda paralellikler ve kültür koşulları üzerinde yakın kontrol olasılığı nedeniyle, operatör ortadan kaldırarak değişkenleri ve tutarsızlıkları bulundu iken güvenilir değerlendirme için gerekli öğeleri içeren bir sistem ile sağlanır hayvan modelleri. Ayrıca, maliyet ve tekrarlanan hayvan yordamlar gereksinimi azalttığı Değerlendirmeler daha uygun. Tek hücre deneyleri ve en hayvan modelleri faktörler ve başka hücre terapisi adayların klinik uygulamada oluşacak bağışıklık yanıtı tarafından tanıtıldı değişkenleri eksikliği. İnflamatuar yanıt anjiogenez ve bu nedenle, implante maddeler tedavi edici etkisini değiştirir veya hücreleri doğru quantified olamaz. Aort yüzük tahlil tahlil ölçümleri rahatsız inflamatuar bileşenlerinin çoğunun dışlar. Ancak, microvasculature geliştirme32önemli oyuncular ikamet makrofajlar içerir. Prestained insan hücreleri ve endotel ağ kolay tanımlanması, salgılanan MSC inflamatuar sitokinlerin etkisi ve hatta hücresel bağışıklık sistemi unsurları kolayca bu tahlil kullanarak görülebilmektedir.
Daha fazla öğeleri Giriº sistem için tahlil koşulları ve deneysel Kur tekrarlanabilir doğası üzerinde kullanıcı tarafından yüksek kontrolü sağlar. İlk olarak, aort yüzük tahlil bir yaralanma model olarak kullanılabilir. Aort halkalar ve endotel çimlenme katılmasını takiben, deneyleri iskemik yaralanma, tahrik edici faktör (TNF-α) veya bakteriyel lipopolysaccharide (LPS), olası kurtarma görevi anjiogenik belirlemek için MSC Ayrıca takip tanıttı olabilir yaralanma aşağıdaki yanıt. İkinci olarak, olası mekanizmaları aydınlatmak için nasıl MSCs anjiogenik yanıt neutrali katkıdaZing antikorlar potansiyel reseptörleri hücre hücre etkileşimleri için kritik susturmak için yararlı olabilir. Son olarak, MSCs parakrin özelliklerini araştırmak için aort yüzük tahlil parakrin özellikleri hücre hücre etkileşimleri anjiogenik yanıt ama odak etkisini dışlamak için bir transwell sistemi kurulabilir.
Özetle, aort yüzük tahlil yeteneği değerlendirmek ve kudret işleme, ECM arabuluculuk hücre terapisi adayların angiogenez bölgelerine göç ve fiziksel temas yoluyla gemi gelişmeye katkıda bulunmak. Aort yüzük ex vivo angiogenez tahlil rejeneratif terapi için aday hücre hatları için değerli, nicel bir ön eleme araç olarak geliştirilebilir.
Açıklamalar
Dr. Clifford L. Librach olduğunu ortak patent sahibinin: yalıtım ve ilk üç aylık göbek kordonu dokusundan elde edilen hücre kullanım yöntemleri. Kanada ve Avustralya'verildi.
Teşekkürler
Yazarlar aşağıdaki personel üye teşekkür ve araştırma personeli: Andrée Gauthier-Fisher, Matthew Librach, Tanya Barretto, Tharsan Velauthapillai ve Sarah Laronde.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alpha-MEM | Gibco | 12571071 | For FTM HUCPVC and BMSC culture media. |
| APC-conjugated anti human TRA-1-85 | R&D Systems | FAB3195A | Human-specific cell marker for flow cytometry and cell sorting |
| Basal membrane extract (BME) (Matrigel) | Corning | 354234 | For aorta embedding |
| Bullet-kit | Lonza | CC-3162 | Includes: Gentamicin/Amphotericin-B (GA)human Epidermal Growth Factor (hEGF); Vascular Endothelial Growth Factor (VEGF); R3- Insulin-like Growth Factor-1 (R3-IGF-1); Ascorbic Acid; Hydrocortisone; human Fibroblast Growth Factor-Beta (hFGF-β); Heparin; Fetal Bovine Serum (FBS). Required to prepare EGM |
| CellTracker Green CMFDA Dye | Thermo-fisher | C2925 | For staining MSCs, green is picked up optimally by MSCs |
| CKX53 Culture Microscope | Olympus | For bright-field imaging of endothelial network development | |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting for MSC culture, flow cytometry and qPCR |
| Dispase | StemCell technologies | 7923 | For dissociating aortic ring-MSC co-cultures (pre-warm at 37 °C) |
| Disposable sterile scalpels | VWR | 21909-654 | For sectioning aorta |
| Dulbecco's phosphate buffered saline | Sigma-Aldrich | D8537 | PBS. 1X, Without calcium chloride and magnesium chloride |
| Endothelial basal media (EBM) | Lonza | CC-3156 | Basal media required for culturing aortic ring assay-MSC co-cultures (warm at 37 °C before use). Required for EGM and EBM-FBS |
| Ethanol, 70%, Biotechnology Grade | VWR | 97064-768 | To sterilize surfaces |
| EVOS | Life Technologies | In-house fluorescent microscope to track MSC migration and integration | |
| Fetal bovine serum (FBS) (Hyclone) | GE Healthcare | SH3039603 | Serum component of cell culture medium |
| FITC-conjugated anti-CD31 antibody | BD | 558068 | Human endothelial marker for flow cytometry |
| FITC-conjugated anti-CD146antibody | BD | 560846 | Human pericyte marker for flow cytometry |
| Forceps | Almedic | 7727-A10-704 | For handing rat tissue. Can use any similar forceps |
| Hank's Balanced Salt Solution (HBSS) | Life Technologies | 14175-094 | 1X Without calcium chloride and magnesium chloride |
| HERAcell 150i CO2 Incubator | Thermo Fisher Scientific | 51026410 | For incubating cells |
| Human Angiogenesis RT2 profiler PCR array | Qiagen | PAHS-024Z | Human specific and includes primers for 84 genes involved in angiogenesis. Each well is 1 primer reaction |
| ImageJ | Open source image processing software. Require Angiogenesis analyzer plugin | ||
| LSR II | BD | UHN SickKids FC Facility. For flow cytometry. | |
| MoFlo Astrios | Beckman Coulter | UHN SickKids FC Facility. For cell sorting. | |
| Penicillin/streptomycin | Gibco | 15140122 | Antibiotic component to buffers and cell culture medium |
| RNeasy Mini Kit | Qiagen | 74104 | For RNA purification. Includes cell lysis buffer |
| RT2Easy First Strand Kit | Qiagen | 330421 | For preparation of cDNA for qPCR |
| RT2PreAMP cDNA Synthesis Kit | Qiagen | 330451 | Pre-amplification of cDNA if low-yield RNA |
| Surgical scissors | Fine Science Tools | 14059-11 | For cutting skin, muscle and aorta |
| Sterile gauze | VWR | 3084 | To dampen and sterilize chest fur |
| TrypleE | Thermo Fisher Scientific | 12605036 | MSC dissociation enzyme pre-warm at 37 °C |
| 0.2 μm pore filtration unit | Thermo Fisher Scientific | 566-0020 | To sterilize tissue culture media |
| 0.25% Trypsin/EDTA | Gibco | 25200056 | For cell dissociation, pre-warm at 37 °C |
| 10 cm tissue culture dishes | Corning | 25382-428 | For cleaning and sectioning aorta and MSC cell culture |
| 12 well-cell culture plates | Corning-Sigma Aldrich | CLS3513 | For setting up aortic ring assay-MSC co-cultures |
| 15 mL tube | BD Falcon | 352096 | For general tissue culture procedures |
| 70 μm cell strainer | Fisherbrand | 22363548 | To ensure a single cell suspension before flow cytometry or sorting |
Referanslar
- Potente, M., Gerhardt, H., Carmeliet, P. Basic and therapeutic aspects of angiogenesis. Cell. 146 (6), 873-887 (2011).
- Hoeben, A., Landuyt, B., Highley, M. S., Wildiers, H., Van Oosterom, A. T., De Bruijn, E. A. Vascular endothelial growth factor and angiogenesis. Pharmacol Rev. 56 (4), 549-580 (2004).
- Khan, T. A., Sellke, F. W., Laham, R. J. Gene therapy progress and prospects: therapeutic angiogenesis for limb and myocardial ischemia. Gene Ther. 10 (4), 285-291 (2003).
- Gupta, R., Tongers, J., Losordo, D. W. Human studies of angiogenic gene therapy. Circ Res. 105 (8), 724-736 (2009).
- Chu, H., Wang, Y. Therapeutic angiogenesis: controlled delivery of angiogenic factors. Ther Deliv. 3 (6), 693-714 (2012).
- Cao, Y. Therapeutic angiogenesis for ischemic disorders: what is missing for clinical benefits?. Discov Med. 9 (46), 179-184 (2010).
- Said, S. S., Pickering, J. G., Mequanint, K. Advances in growth factor delivery for therapeutic angiogenesis. J Vasc Res. 50 (1), 35-35 (2013).
- Bergers, G., Song, S. The role of pericytes in blood-vessel formation and maintenance. Neuro Oncol. 7 (4), 452-464 (2005).
- Leeper, N. J., Hunter, A. L., Cooke, J. P. Stem cell therapy for vascular regeneration: adult, embryonic, and induced pluripotent stem cells. Circulation. 122 (5), 517-526 (2010).
- Sieveking, D. P., Ng, M. K. Cell therapies for therapeutic angiogenesis: back to the bench. Vasc Med. 14 (2), 153-166 (2009).
- Staton, C. A., Reed, M. W., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Auerbach, R., Lewis, R., Shinners, B., Kubai, L., Akhtar, N. Angiogenesis assays: a critical overview. Clin Chem. 49 (1), 32-40 (2003).
- Tahergorabi, Z., Khazaei, M. A review on angiogenesis and its assays. Iran J Basic Med Sci. 15 (6), 1110-1126 (2012).
- Arnaoutova, I., George, J., Kleinman, H. K., Benton, G. The endothelial cell tube formation assay on basement membrane turns 20: state of the science and the art. Angiogenesis. 12 (3), 267-274 (2009).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat Protoc. 5 (4), 628-635 (2010).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10 (3), 588-612 (2006).
- Nicosia, R. F. The aortic ring model of angiogenesis: a quarter century of search and discovery. J Cell Mol Med. 13 (10), 4113-4136 (2009).
- Baker, M., et al. Use of the mouse aortic ring assay to study angiogenesis. Nat Protoc. 7 (1), 89-104 (2011).
- Guo, J., et al. A secreted protein (Canopy 2, CNPY2) enhances angiogenesis and promotes smooth muscle cell migration and proliferation. Cardiovasc Res. 105 (3), 383-393 (2015).
- Wittig, C., Scheuer, C., Parakenings, J., Menger, M. D., Laschke, M. W. Geraniol Suppresses Angiogenesis by Downregulating Vascular Endothelial Growth Factor (VEGF)/VEGFR-2 Signaling. PLoS One. 10 (7), e0131946 (2015).
- Masson, V. V., et al. Mouse Aortic Ring Assay: A New Approach of the Molecular Genetics of Angiogenesis. Biol Proced Online. 4, 24-31 (2002).
- Caplan, A. I. Adult mesenchymal stem cells for tissue engineering versus regenerative medicine. J Cell Physiol. 213 (2), 341-347 (2007).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Keating, A. Mesenchymal stromal cells: new directions. Cell Stem Cell. 10 (6), 709-716 (2012).
- Kilroy, G. E., et al. Cytokine profile of human adipose-derived stem cells: expression of angiogenic, hematopoietic, and pro-inflammatory factors. J Cell Physiol. 212 (3), 702-709 (2007).
- Tang, Y. L., et al. Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction. Ann Thorac Surg. 80 (1), 229-236 (2005).
- Caplan, A. I. All MSCs are pericytes?. Cell Stem Cell. 3 (3), 229-230 (2008).
- Hong, S. H., et al. Ontogeny of human umbilical cord perivascular cells: molecular and fate potential changes during gestation. Stem Cells Dev. 22 (17), 2425-2439 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: The ARRIVE guidelines for reporting animal research. J Pharmacol Pharmacother. 1 (2), 94-99 (2010).
- Sarugaser, R., Ennis, J., Stanford, W. L., Davies, J. E. Isolation, propagation, and characterization of human umbilical cord perivascular cells (HUCPVCs). Methods Mol Biol. 482, 269-279 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Gelati, M., Aplin, A. C., Fogel, E., Smith, K. D., Nicosia, R. F. The angiogenic response of the aorta to injury and inflammatory cytokines requires macrophages. J Immunol. 181 (8), 5711-5719 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır