Method Article
Le dosage de co-culture anneau aortique : Un outil pratique pour évaluer le potentiel angiogénique de cellules stromales mésenchymateuses In Vitro
Dans cet article
Résumé
Nous présentons ici une nouvelle application du test de l’anneau aortique où prémarqués cellules mésenchymateuses sont conjointement cultivés avec réseaux endothéliales dérivées aorte de rat. Cette nouvelle méthode permet la visualisation des homing cellules stromales mésenchymateuses (CSM) et intégration aux réseaux endothéliales, quantification des propriétés du réseau et l’évaluation des MSC immunophenotypes et l’expression génique.
Résumé
L’angiogenèse est un processus complexe, fortement réglementé, responsable de fournir et de maintenir la perfusion tissulaire adéquate. Entretien de vascularisation insuffisante et des malformations pathologiques peuvent entraîner maladies ischémiques sévères, tandis que trop abondante développement vasculaire est associée avec le cancer et les troubles inflammatoires. Une forme prometteuse de pro-angiogénique thérapie est l’utilisation de sources de cellules angiogéniques, qui peuvent fournir des facteurs de régulation ainsi que le soutien physique pour développer nouvellement système vasculaire.
Cellules stromales mésenchymateuses (CSM) sont intensivement étudiés candidats pour régénération vasculaire en raison de leurs effets paracrine et leur capacité à détecter et abritant les tissus ischémiques ou enflammées. En particulier, premier trimestre des cellules du cordon ombilical humain périvasculaires (FTM HUCPVCs) sont un candidat très prometteur en raison de leurs propriétés pericyte, fort potentiel prolifératif et multilignée, privilège immunitaire propriétés et paracrine robuste Voir le profil. Evaluer efficacement potentiellement angiogénique cellules régénératrices, c’est une condition pour tester en fiable et « traduisible » essais précliniques. L’essai de l’anneau aortique est un modèle d’angiogenèse ex vivo qui permet pour la simple quantification des structures tubulaires d’endothéliales, fournit les accessoires cellules de soutien et de la matrice extracellulaire (MEC) de l’hôte, exclut les composantes inflammatoires et est rapide et peu coûteuse à mettre en place. Ceci est avantageux par rapport aux modèles in vivo (p. ex., cornée dosage, Matrigel prise test) ; l’essai de l’anneau aortique peut suivre les cellules administrées et observer les interactions intercellulaires tout en évitant le rejet de xeno-immunitaire.
Nous présentons un protocole pour une nouvelle application du test de l’anneau aortique, qui comprend les MSCs humaines dans des cultures co avec le développement de réseaux endothéliales aortiques de rat. Ce test permet l’analyse de la contribution de MSC dans le tube de formation et développement grâce à des interactions de type pericyte physiques et de leur puissance de migration activement aux sites de l’angiogenèse et pour évaluer leur capacité à effectuer et médiation Traitement de l’ECM. Ce protocole prévoit plus d’informations sur les changements MSC phénotype et l’expression génique suite co-culture.
Introduction
Le processus complexe de l’angiogenèse améliore et maintient la perfusion tissulaire en favorisant le développement de navire du sang neuf de préexistant vascularisation1. C’est un processus fortement réglementé, équilibré par des facteurs pro-angiogéniques et anti-angiogéniques. Toute carence dans ce système peut conduire à l’entretien insuffisant de navire ou de croissance, provoquant de graves maladies ischémiques, y compris la maladie myocardique, accident vasculaire cérébral et les maladies neurodégénératives. Cependant, développement vasculaire exagérée est caractéristique pour les conditions, y compris le cancer et les troubles inflammatoires,2.
Développement de thérapies visant à contrôler l’angiogenèse pour atteindre la régénération tissulaire favorable est d’une importance capitale. Malgré des recherches précliniques et cliniques approfondies, tentatives de stimuler l’angiogenèse à l’aide de micro-ARN et facteurs pro-angiogéniques ont échoué à atteindre les résultats souhaités3,4,5. Les raisons possibles pour les effets transitoires incluent : longévité limitée de protéines angiogéniques et acides nucléiques et le nombre fini de ciblée des facteurs de croissance6,7. Bien que les facteurs angiogéniques solubles sont essentiels pour initier l’angiogenèse, l’entretien et la fonctionnalité du système vasculaire dépendent supportant les types de cellules, y compris les péricytes et muscle lisse cellules8. Le domaine des thérapies pro-angiogénique étudie maintenant les sources potentielles de cellule cellules souches et progénitrices qui pourraient constituer des facteurs angiogéniques localement, tandis que physiquement soutenir nouvellement développé vascularisation, renouvellement automatique ou même différencier en cellules endothéliales9,10. Trouver l’angiogénique optimale des types de cellules ayant la capacité de répondre à ces exigences fonctionnelles est un très prometteur pour la régénération des tissus ischémiques.
Afin de les traduire avec succès des thérapies potentielles sur les cellules dans les essais cliniques, des études précliniques doivent démontrer leur efficacité et de mettre en évidence les mécanismes angiogéniques. Malgré le nombre élevé d’essais établis l’angiogenèse, le champ n’est pas un essai de « étalon-or » in vitro qui pourrait sûrement évaluer l’efficacité du potentiel candidat cell types11,12, 13. plupart in vitro l’angiogenèse essais (y compris les essais de formation tube, la migration et la prolifération endothéliales) généralement évaluer les effets des cellules ou des composés sur changements phénotypiques ou la différenciation en cellules endothéliales tubulaire et des structures de réseau14,15. Alors que ces caractéristiques sont essentielles pour l’angiogenèse, un test « traduisible » devrait également évaluer : 1) l’augmentation mammaire ou le remplacement des prise en charge types de cellules y compris les péricytes ou 2) le traitement des ECM ou membrane basale, les cellules musculaires lisses, et 3). l’efficacité pour promouvoir la formation de microcirculation fonctionnelle. Modèles in vivo angiogenèse, y compris le dosage cornéenne et Matrigel fiche dosage, récapitulent le microenvironnement unique in vivo mais sont contestées par la difficulté des cellules de suivi administré d’observer des interactions physiques. En outre, dans des modèles in vivo , rejet de xeno-immunitaire peut se produire lors du test de potentiels cellules allogéniques thérapie candidats16. Ex vivo angiogenèse modèles, en particulier le dosage de l’anneau aortique peut fournir : observation 1) facile et quantification des structures tubulaires, des cellules de soutien 2) accessoires, ECM 3) de l’hôte et fournitures artificiels, 4) exclusion d’inflammatoire composants et 5) installation rapide et peu coûteux de17,18. En règle générale, l’essai de l’anneau aortique peut tester le potentiel angiogénique de petites protéines sécrétoires, agents pharmacologiques et les modèles de rongeurs transgéniques19,20,21.
MSCs sont prometteurs pour la régénération vasculaire principalement par leurs effets médiés par les paracrine22,23,24. MSCs auraient dû être divulgués à sécréter des facteurs angiogéniques clés dont le facteur de croissance endothélial vasculaire (VEGF), facteur de croissance des hépatocytes (HGF), Insulin-like Growth Factor-1 (IGF-1), basic Fibroblast Growth Factor (bFGF) et angiopoeitin-1 (Ang-1)25 ,26. MSCs peuvent également détecter et tissus abrite ischémique ou enflammés, cependant, les mécanismes exacts sont toujours sous enquête. De plus en plus, la littérature soutient l’hypothèse que MSCs la plupart proviennent des cellules périvasculaires, expriment co pericyte marqueurs et peuvent se comporter comme des péricytes27. HUCPVCs sont une source de jeune de MSCs, dérivée de la région périvasculaire du cordon ombilical humain. Ils représentent une population de MSCs ayant des propriétés pericyte et ont été caractérisés de FTM et à terme des cordons ombilicaux. FTM HUCPVCs démontrent une forte expression de marqueurs pericyte y compris CD146 et NG2, fort potentiel prolifératif et multilignée, propriétés immunitaires de privilèges et afficher une robuste paracrine profil28. FTM HUCPVCs sont un type de cellule du candidat idéal pour favoriser la régénération des tissus lésés par le biais de la promotion du nouveau système vasculaire par l’intermédiaire de leurs propriétés pericyte.
Pour tester le potentiel angiogénique et pericyte-comme des propriétés de MSCs humaines, un nombre très limité d’essais de l’angiogenèse est disponible où positive angiotropic migrations (ci-après dénommé « homing »), ECM traitement et développement de physique interactions entre les types de cellules peuvent être étudiées, tout en obtenant des données quantitatives sur le développement de la microcirculation.
Par les présentes, nous présentons un protocole décrivant une nouvelle application du test de l’anneau aortique. MSCs humaines ont été conjointement cultivés avec développement dérivée de rat aortiques endothéliale des réseaux afin d’évaluer leur contribution pour la formation, la maturation et l’homéostasie de tube. Cette version du test de l’anneau aortique évalue la capacité et la puissance des candidats de thérapie cellulaire Accueil aux sites de l’angiogenèse, effectuer et médiation traitement ECM, et contribuer à endothélial développement tubulaire en créant des pericyte forme physique interactions. En plus de la quantification de l’effet net de MSCs sur la formation de réseau endothéliales in vitro et en observant les interactions intercellulaires, nous avons également optimisé un protocole visant à isoler les MSCs des co-cultures. En effectuant de qPCR et cytométrie en flux, il est possible de caractériser les changements MSC phénotype et gene expression suite co-culture. En tant que types de modèle de cellule, nous avons comparé ontologiquement au début (prénatal) et des sources tardives (adultes) de MSCs humaines : FTM HUCPVCs et MSCs de moelle osseuse humaine (BMSC), respectivement, dans l’essai de l’anneau aortique. Nous proposons que l’essai de l’anneau aortique peut être utilisé pour étudier le potentiel angiogénique de n’importe quel type de cellule physiquement soutien lorsque incriminés pour applications régénératrice angiogénique.
Protocole
toutes les études portant sur des animaux ont été effectuées et selon arrivée directives 29. Toutes les études sont effectuées avec l’approbation du Conseil de recherche institutionnelle éthique (nombre de CÉR 4276). Animal toutes les procédures ont été approuvées par le Comité de protection des animaux de l’University Health Network (Toronto, Canada), et tous les animaux ont reçu des soins compatissants en conformité avec le Guide pour le soin et l’utilisation des animaux de laboratoire, 8 ème édition ( Les instituts nationaux de santé 2011).
1. installation de dosage anneau aortique
- isolat l’aorte de rat.
- Euthanasier 8 - rats Sprague-Dawley de 10 semaines à l’aide de CO 2 asphyxie : remplacement de gaz CO Set 2 chambres à 20 % (débit = 0,2 x chambre volume/min). Confirmer en l’absence de pincement réflexe et le coeur bat en palpant poitrine.
- Mouiller la fourrure sur la région de la poitrine à l’aide de gaze stérilisé avec l’éthanol à 70 %. Utiliser des ciseaux et pinces stérilisées pour pratiquer une incision dans la médiane de la poitrine et couper à travers les couches de peau et le muscle.
- Une fois la cage thoracique est exposée, la cage thoracique, découpez chaque côté et plier vers le haut environ 5 mm du sternum sur chaque côté. Des saignements sont attendu à partir des artères intercostales dans les cadavres frais.
- Pousser le tissu pulmonaire et le cœur vers la droite anatomique pour exposer l’aorte. L’aorte est le blanc de couleur navire situé adjacente à la colonne vertébrale.
- Utilisation pince à pincer l’aorte (après la crosse aortique) et utiliser des ciseaux chirurgicaux pour faire l’incision première tout en tenant l’aorte avec une pince. Après coupure de l’aorte, la cage thoracique se remplira rapidement avec le sang, c’est pourquoi il est essentiel de travailler rapidement pour obtenir de l’aorte avant la coagulation sanguine.
- Pinces à utiliser pour tenir l’aorte et décoller doucement l’aorte vers le bas, la colonne vertébrale. La traction va rompre les artères intercostales sans autres incisions. Obtenir environ 10 cm de tissu et/ou avant de l’aorte se divise en deux branches dans la cavité abdominale et coupe l’aorte de la carcasse. Pousser le diaphragme si nécessaire à la direction caudale pour gagner accès à des sections de l’aorte à.
NOTE : Peler l’aorte doucement car force intense peut amener à déchirer. Si les larmes de l’aorte, permettent la coagulation du sang pendant quelques secondes et utilisez un essuie-tout pour enlever le sang coagulé, assurant une visibilité de l’aorte restante. - Placer l’aorte dans un tube de 15 mL avec 10 mL de Hank glacee ' s Balanced Salt Solution (HBSS) additionné de 1 % la pénicilline/streptomycine (P/S). Garder les lampes sur glace
NOTE : Le tissu aortique peut durer pendant 1-2 h sur la glace, mais il est préférable de le traiter aussi rapidement que possible.
- Préparer les milieux de culture de dosage anneau aortique dans une armoire de biosécurité stérile (BSC).
- Préparer le milieu de croissance endothéliale (EGM) en utilisant une unité de filtration pour filtre 500 mL de milieu Basal endothélial (EBM) additionné de 2 % sérum bovin fœtal (SVF), 1 % de gentamicine et facteurs de croissance (voir Table des matières). Placer 50 mL des médias filtrées dans un talon ou le bain-marie à 37 ° C.
- Une autre unité de filtration permet de filtrer 100 mL de EBM additionné de 2 % de SVF et 1 % P/S à préparé l’EBM 2 % SVF (EBM-BF) et conserver à 4 ° C.
- Enduire des plaques de culture de tissu de 12 puits avec l’extrait de Membrane basale (BME) alors qu’il travaillait sur la glace.
- Place une plaque de 12 puits sur une surface froide (gros bloc de glace ou un plateau). Ajouter 200 µL/puits d’utilisation de BME fraîchement décongelées réfrigéré pointes de pipette et agiter les Afro-Caribéens afin d’assurer le même revêtement. Travail rapidement pour éviter une polymérisation inégale de la BME.
Remarque : Une excision aorte typique donne 20 anneaux aortiques. Pour tenir compte de la variabilité entre les essais de l’anneau aortique, configurer au moins trois essais de l’anneau aortique par groupe de traitement et inclure un contrôle. Si la source le permet, il est recommandé de 6 anneaux par groupe de traitement. - Placer les plaques revêtues en incubateurs humidifiés (95 % d’humidité relative, 37 ° C, 5 % CO 2 ; ces conditions s’appliquent à toutes les étapes de l’incubateur humidifié ci-après) pendant 30 min. Place 1 000 µL pipette bascule à-20 ° C pour l’étape 1.5.3.
NOTE : Tandis que l’extrait de la membrane basale est utilisé en concentration stock, sa consistance et la rigidité est strictement contrôlé par le temps de polymérisation. Veillez à garder les mêmes temps de polymérisation exacte pour tous les parallèles et les expériences indépendantes.
- Place une plaque de 12 puits sur une surface froide (gros bloc de glace ou un plateau). Ajouter 200 µL/puits d’utilisation de BME fraîchement décongelées réfrigéré pointes de pipette et agiter les Afro-Caribéens afin d’assurer le même revêtement. Travail rapidement pour éviter une polymérisation inégale de la BME.
- La section de l’aorte en rondelles uniformes.
- Prenez l’aorte du tube de 15 mL et placez-le dans un plat de 10 cm avec 10 mL de HBSS frais additionné de 1 % P/S.
- Utiliser deux paires de pinces pour séparer soigneusement l’excès de tissu conjonctif, le tissu adipeux et utilisez un scalpel pour les autres branches des artères intercostales connecté à l’aorte. Cela réduit la variabilité entre les unités de l’anneau issu des différents niveaux du tissu résiduel. Enlever tout résidu coagulé sang prélevé à l’intérieur de l’aorte.
- Placer une règle ou une grille sous le plat de 10 cm pour couper précisément à 1-2 mm larges sections de l’aorte à l’aide de forceps et bistouri stérile. Couper les sections aussi exacte que possible de réduire la variabilité entre les unités.
- Incorporer les anneaux aortiques dans BME.
Remarque : Si le sectionnement des anneaux aortiques n’est pas terminé avant l’incubation de polymérisation BME, enlever les plaques de revêtement de l’incubateur humidifié et ajouter 100 µL de l’EBM dans chaque puits de mettre fin à la polymérisation. Chronologie exacte est critique car trop de polymérisation des afro-caribéens peut-être interférer avec la migration de développement et de la cellule endothéliale réseau. Une fois que les anneaux aortiques sont prêts, retirer les puits de l’EBM et continuer sur l’étape 1.5.2.- Supprime les puits BME enduite des incubateurs humidifiés et retourne à la GCS.
- Soigneusement ramasser les anneaux aortiques individuels avec une pince et placez-en un au milieu de chaque puits BME-enduit. Répéter pour les reste des anneaux aortiques.
NOTE : Media transféré avec l’anneau aortique doit être maintenu un minimum afin d’éviter des irrégularités de polymérisation. - Utilisation refroidi (-20 ° C) 1 000 pointes de pipette µL d’ajouter 300 µL d’afro-caribéens sur le dessus de chaque anneau aortique et répartir uniformément le BME autour du puits.
- Retourner les anneaux aortiques embarqués pour les incubateurs humidifiés pendant 30 min.
- Enlever les plaques avec l’anneau aortique incorporé les incubateurs humidifiés et ajouter lentement 1 000 µL d’EGM (préparé et réchauffé à étape 1.2.1) en plaçant la pipette Astuce contre le mur de la culture bien.
NOTE : Pipetage directement les médias sur les Afro-Caribéens peut perturber le BME polymérisée et entraver le développement du réseau endothéliales continue. Utilisez une pipette multicanaux appropriée, le cas échéant. - Après 24 h, retirez 1 000 µL d’EGM et remplacez-le par 1 000 µL de EBM-FBS préparées à l’étape 1.2.2, encore une fois en pipettant également lentement contre le côté de la culture bien.
- Maintenir l’essai de l’anneau aortique en remplaçant 500 µL de EBM-FBS avec 500 µL de frais EBM-FBS (37 ° C) chaque 48 h
Remarque : Voir section 2 pour démarrer l’expansion de la culture du SMC sur le même jour que la création de test anneau aortique. Cela garantira que MSCs sont prêts pour la co-culture, lorsque les réseaux endothéliales sont prêts. - Utiliser la microscopie lumineuse pour suivre le développement de réseau endothéliales test anneau aortique (voir la Figure 1 comme référence pour le développement de réseau optimale). Une fois l’aspect endothéliales réseaux tel qu’illustré à la Figure 2, procéder à la mise en place de l’anneau aortique dosage-MSC co-cultures (section 3). Reportez-vous à l’étape 4.1 pour plus de détails sur l’imagerie des réseaux endothéliales.
2. Culture de tissus
- préparation des solutions mères de milieux de culture de tissu.
- Culture FTM HUCPVCs (précédemment établie, n ≥ 3 lignes indépendantes pour chacune) 30 et BMSC commercialement disponible en alpha-MEM additionné de 10 % de SVF et 1 % P/S.
- Stériliser les médias à l’aide de 0,2 µm pore taille filtre bouteilles.
- Stocker les solutions supports préparés à 4 ° C pendant 3 semaines.
- Maintenir FTM HUCPVC et BMSC cultures dans des incubateurs humidifiés ou passage à la confluence de 70 à 80 % déterminé par microscopie à contraste de phase. Utilisation des volumes appropriés des médias pour la taille du plat de la culture de tissus utilisés (c'est-à-dire 10 mL dans un plat de 10 cm). Utilisez ces conditions de culture pour le maintien et le passage des MSCs.
- Se dissocient les monocouches MSC pour passage ou anneau aortique dosage-MSC conjointement les cultures à l’aide d’une solution d’enzyme de dissociation (plat de 4 mL/10 cm) et incuber dans les incubateurs humidifiés pendant 3 min. veiller à ce détachement des cellules à l’aide de la microscopie en champ clair ; incuber pour un 1-2 min supplémentaire, si nécessaire.
- Transférer les cellules dissociées dans un tube de 15 mL et centrifuger à 400 x g pendant 5 min.
- Aspirer le surnageant sans déranger le culot cellulaire et remettre en suspension les cellules dans 1 mL d’un milieux de culture appropriés (alpha-MEM de médias complet pour le passage des cellules ou EBM-FBS pour anneau aortique dosage/MSC co-cultures) pour le comptage en utilisant un compteur cellulaire.
3. Préparation de l’anneau aortique dosage/MSC co-cultures
- 10 graines 4 MSCs sur chacun incorporé anneau aortique (9 000 cellules/cm 2 / plaque de 12 puits). Basée sur le nombre d’épreuves de l’anneau aortique, pré tacher les MSCs avec colorant fluorescent viable et non transférable. Maintenir au moins trois puits des anneaux aortiques sans MSCs pour un groupe de contrôle.
- Pour colorer 10 médias 5 MSCs/mL EBM-FBS, ajouter 2,5 µL de viable, médias non transférable colorant fluorescent/mL (5 µM) dans un tube de 15 mL et placez dans l’incubateur humidifié pendant 30 min. mélangent doucement le tube au milieu de l’incubation.
- Suivant les 30 min d’incubation, ajouter 1 volume de EBM-FBS fraîches aux cellules colorées et essorer à 400 x g pendant 5 min.
- Enlever le surnageant et Resuspendre le culot dans 1 mL de médias de EBM-FBS. Confirmer la coloration réussie des MSCs à l’aide de la microscopie de fluorescence.
- Sortir les plaques contenant de l’anneau aortiques de l’incubateur humidifié et retirez chaque puits de 500 µL de EBM-FBS.
- Graines soigneusement 10 4 MSCs dans 500 µL de EBM-FBS sur chaque anneau aortique embarqué par pipetage uniformément autour des réseaux endothéliales. Répartissent en le secouant doucement la plaque de culture.
- Ajouter EBM-FBS supplémentaires pour s’assurer que le volume total des médias sur l’anneau aortique dosage/MSC co-cultures est 1 000 µL.
- La microscopie de fluorescence permet de visualiser les MSCs fluorescent étiquetés dans l’essai de l’anneau aortique.
4. microscopie
- utilisation brillante-microscopie d’imager les réseaux endothéliales rat avant l’anneau aortique dosage/MSC cultures conjointement des mesures de référence (jour 0) des propriétés réseau endothéliales (p. ex., réseau longueur, boucles de réseau). Image 4 quadrants / puits de l’anneau aortique à la section plus éloignée du réseau endothéliale dans ce quadrant.
Réseaux d’anneau
- image de l’aorte après l’anneau aortique dosage/MSC cultures co 3, 5 et 7 jours. Utiliser ces images pour quantifier l’effet MSC sur le développement du réseau endothéliales.
- Utiliser la microscopie de fluorescence pour image préétiquetés MSCs dans l’essai de l’anneau aortique.
- 24h suivant de l’anneau aortique dosage/MSC co-cultures, utiliser la microscopie de fluorescence pour visualiser MSC homing, élongation et intégration avec les réseaux endothéliales. Se chevauchent les images fluorescentes de MSCs avec les images de champ lumineux des cellules endothéliales à observer la co-localisation des deux types de cellules.
- D’image les MSCs localisées au sein des réseaux endothéliales développés proximales pour le tissu de l’anneau aortique et les MSCs localisées à l’intérieur nouvellement développement réseaux distales dans le tissu de l’anneau aortique ( Figure 2).
5. Flow Cytometry et qPCR
- un jour avant la dissociation des réseaux endothéliales anneau aortique, décongeler a gelé à 4 ° C O/N. Section 5.3 est identique pour la cytométrie en flux et qPCR.
- Chauffer 50 mL d’a et 50 mL de 0,5 % trypsine dans bain de perle ou de l’eau 37 ° C.
- Récupérer les cellules pour l’analyse de l’anneau aortique dosage/MSC co-cultures.
- Après 1 semaine de culture mixte de dosage/MSC anneau aortique, retirez le support de culture et ajouter 1 mL de Phosphate-Buffered Saline (PBS) lentement pour chacun bien pendant 3 min et retirer. Répétez ce laver deux fois plus.
- Ajouter 800 µL de préchauffée a dans chaque puits et incuber dans les incubateurs humidifiés pendant 15 min.
- Retirer les plaques les incubateurs humidifiés et suspendre a de pipetage (5-10 x) pour défaire les afro-caribéens et transférer le contenu de chaque puits dans des tubes distincts 15 mL.
- Répéter l’étape 5.3.3 avec frais a préchauffé jusqu'à aucun résiduel BME est observée dans la culture bien. Ajouter 1 volume de PBS additionné de 3 % SBF à la suspension de cellules a pour inactiver l’a. Retirer les anneaux aortiques flottant dans la suspension de cellules à l’aide de pointes de pipette.
- Tourner les suspensions cellulaires à 400 g pour 5 min. Retirez le surnageant avec soin, laissant 3 mL de suspension cellulaire dans le tube de 15 mL.
Remarque : Une pastille évidente, solide n’est peut-être pas visible, mais les cellules et les Afro-Caribéens sont présents. - Ajouter 3 mL de préchauffée trypsine de 0,5 % pour les cellules de remettre (5-10 x par pipetage) suspension cellulaire et vigoureusement. Incuber les solutions de débris cellulaires dans les incubateurs humidifiés pendant 10 min.
- Enlever les suspensions de débris cellulaires de l’incubateur humidifié et ajouter 6 mL de PBS additionné de 3 % FBS et remettre quelques times. Faites tourner les suspensions cellulaires à 400 g pendant 5 min.
- Soigneusement retirer tous le surnageant, en laissant le culot cellulaire dans le tube et remettre en suspension des cellules dans 1 mL de PBS additionné de 3 % FBS dans chaque tube.
- Filtrer la suspension cellulaire de 1 mL à l’aide d’une passoire de cellule 70 µm pour enlever les cellules agrégées et BME résiduelle de la suspension cellulaire. Compter les cellules dans 1 mL de suspension cellulaire à l’aide d’un compteur de cellules.
- Préparer les cellules pour la cytométrie en flux.
- Incuber les cellules des suspensions (10 cellules de 5 à 200 µL de PBS additionné de 3 % FBS) conjugué à un fluorophore (FITC ou APC) les anticorps primaires (TRA-1 - 85-, CD146, CD31) concentration = 01:40) à 4 ° C pendant 30 min, l’abri de la lumière.
NOTE : Cytométrie en flux pour MSCs a été optimisé par Hong et al., 2013 28. Il faut un minimum de 10 000 cellules pour une lecture précise. - Après l’incubation de 30 min, de remettre en suspension les cellules dans 2 mL de PBS additionné de 3 % FBS et centrifuger (400 x g, 5 min).
- Cellules de conserver à 4 ° C, abri de la lumière jusqu'à ce que l’analyse par cytométrie en flux (au moins 1 x 10 4 événements) à 1 h. Pour la stratégie de blocage, voir supplémentaire Figure 1. Trier les MSCs humaines à l’aide d’anti-TRA-1-85 (APC) (concentration : 01:40 et à 0,5 % FBS/PBS) et trier des cellules dans 350 µL de tampon de lyse cellulaire pour l’analyse de qPCR.
Remarque : Les cellules lysées peuvent être stockées à-80 ° C jusqu'à 3 mois pour l’analyse des futurs qPCR.
- Incuber les cellules des suspensions (10 cellules de 5 à 200 µL de PBS additionné de 3 % FBS) conjugué à un fluorophore (FITC ou APC) les anticorps primaires (TRA-1 - 85-, CD146, CD31) concentration = 01:40) à 4 ° C pendant 30 min, l’abri de la lumière.
- Préparer les cellules pour l’analyse de qPCR.
- Isoler l’ARN des cellules lysées à l’aide de kits d’isolation RNA basée sur les colonnes et déterminer la concentration d’ARN et de la qualité. Réaction de
- Prepare cDNA de jusqu'à 5 µg d’ARN par 100 µL de la transcriptase inverse. Exécuter une étape de pré amplification si le rendement de RNA est faible (< 10 ng/µL). Utilisation de moins de 100 ng d’ARN se traduira par un taux élevé de faux négatifs.
Remarque : Les modèles de cDNA peuvent être stockés à-20 ° C pour une analyse ultérieure jusqu'à 4 mois. - Effectuer le qPCR l’utilisation de l’angiogenèse expression profileur tableaux pour détecter des changements dans l’expression des gènes. L’utilisation de 5 ng de l’ADNc par réaction (40 cycles, 60 ° C température de recuit/extension). Express pli changement d’expression par rapport aux échantillons de cDNA MSC dérivé indifférenciées. Exécuter les contrôles négatifs appropriés (anneau aortique sans humains MSCs).
6. Réseau de Quantification suivante aortique Ring test/MSC co-cultures
- Télécharger le logiciel d’imagerie comme ImageJ ainsi que de l’angiogenèse Analyzer plugin 31.
- Importer les images réseau endothéliales prises et d’ouvrir en utilisant le logiciel.
- Convertir les échelles d’image basés sur les spécifications du microscope utilisé.
- Un outil linéaire permet de mesurer la croissance du réseau radial.
- Compter les boucles endothéliales réseau à l’aide de l’outil de compteur de cellules (les boucles au moins 4 côtés doivent être quantifiés).
- Pour quantification supplémentaire des propriétés du réseau, utilisez le plugin angiogenèse Analyzer ou autres plugins similaires pour analyser les segments maîtres, total longueur de segment, zones de l’ensemble du réseau et nombre de jonctions. Utilisez l’outil de masque flou pour brouiller les tissus de l’anneau aortique et des espaces vides pour éviter des fausses positifs calculs.
- Transférer les valeurs dans un programme et graphique réseau endothéliales propriétés des statistiques suite à l’anneau aortique dosage/MSC co-cultures.
Résultats
Le flux de travail schématique pour établir le dosage de co-culture anneau aortique/MSC est illustré dans la Figure 1. Les étapes principales incluent : isolement de l’aorte, sectionnement et incorporation des anneaux aortiques, suivi l’endothéliale de la germination et le développement de réseau et enfin l’étiquetage et administrer les MSCs de rat. La chronologie de l’analyse de réseau endothéliales décrit la fenêtre pour les analyses réalisables pour chaque période de co-culture : jour 1, 5 & 7. Notes complémentaires sont mises en évidence par des zones en pointillés.
L’identification des régions structurellement distinctes dans les cultures de cellules endothéliales de l’anneau aortique est réalisée par microscopie en champ clair, 3-5 jours après que les anneaux aortiques sont incorporés dans l’ECM (Figure 2). Le secteur non structuré (Figure 2 a) est caractérisé comme une région de prolifération cellulaire élevée mais faible organisation structurale dans le voisinage direct du tissu aortique. Les réseaux développés endothéliales (Figure 2 b) se référer aux régions avec une forte structure de l’organisation, où les réseaux sont pleinement mis en place et principalement composés de boucles fermées, même avant l’addition de MSCs. Les développement des réseaux (Figure 2) sont situés dans les régions distales des cultures endothéliales. Ce sont les sites de migration des cellules endothéliales et l’allongement sous la nouvelle forme de structures de réseau. Les 3 régions mentionnées ci-dessus sont facilement identifiables au cours des expériences et sont utilisées lorsque vous référencez où les MSCs abrite dans les cultures co. Les MSCs prémarqués doivent être co cultivés avec le test de l’anneau aortique lorsque tous les trois segments du réseau ont mis au point. La quantification des réseaux endothéliales suite MSC co-cultures incluent les régions des pays développé et en développement réseau (Figure 2, cadre blanc).
La microscopie en fluorescence permet des mesures qualitatives de MSC migration, intégration et morphologie en conjonction avec le développement de réseaux endothéliales dans l’essai de co-culture de l’anneau aortique-MSC (Figure 3). Les MSCs étiquetés avec un fluorophore viable, cytoplasmique ont été imagées 24h après son administration aux cultures co. FTM HUCPVCs ont été trouvées à la périphérie des réseaux endothéliales en voie de développement, affiche des morphologies de cellules allongées et a contribué à la poursuite du développement des réseaux endothéliales (Figure 3 a, B). Pour comparaison, BMSC hébergés pour les développement des réseaux tout en affichant moins d’interaction avec les cellules endothéliales (Figure 3, D). Images de grossissement élevé après 72 h ont montré que les FTM HUCPVCs maintenu une couverture élevée et la stabilisation des réseaux endothéliales tandis que BMSC co-cultures présentées une morphologie sphérique avec intégration limitée dans les réseaux endothéliales (Figure 3E , F). L’observé différences démontrent clairement les différences qualitatives et fonctionnelles entre les types humains de MSC. Un type de cellule de candidat ayant homing significative et propriétés intégration endothéliales (Figure 3 a, B & E) se distingue par rapport à un type de cellule avec intégration réseau endothéliales limité et augmentation mammaire capacités (Figure 3, D & F).
Images de microscopie de fluorescence fort grossissement ont été acquises pour disséquer davantage des interactions physiques entre les cellules endothéliales et FTM HUCPVCs dans réseaux tubulaires. Le préétiquetés HUCPVCs FTM (Figure 4 a, vert) sont montrés adhérant avec des cellules endothéliales non colorés (Figure 4 a, blanc flèches). FTM HUCPVCs trouvées à apporter un soutien structurel aux cellules endothéliales en servant comme une surface axe et l’attachement entre les nœuds. Les réseaux endothéliale de l’anneau aortique peuvent également être préalablement marqués à l’aide d’un fluorophore viable de même vers le MSC coloration (Figure 4 b, rouge). En doubles co-cultures tachées, microscopie à fluorescence a révélé allongées des adhérences entre les deux types cellulaires, fortifiant l’observation de la coopération et le comportement de la cellule de soutien.
La quantification des propriétés structurelles endothéliales réseau a été réalisée au jour 5 des co-cultures MSC (Figure 5). Quadrants uniformes ont été définis pour le mesurage dans tout le réseau endothéliales tout anneau aortique (Figure 2, cadre blanc). La croissance du réseau moyenne a été calculée comme la distance entre les boucles de réseau fermé proximale premières en anneau aortique aux plus éloignées boucles fermées distales (taille de rayon) (Figure 5 a). La croissance moyenne réseau des co-cultures anneau aortique-MSC étaient comme suit : FTM HUCPVCs (2,98 ±0, 3 mm) et BMSC (1,5 ±0, 15 mm). Les réseaux endothéliales non traités mis au point un rayon moyen de 1,9 ± 0,1 mm. La comparaison statistique entre les groupes de traitement MSC a démontré que FTM HUCPVCs a contribué à la croissance réseau significativement plus élevée par rapport à BMSC et réseaux non traités (p 0,001). Le non traitées réseaux endothéliales développé considérablement plus de BMSC contenant des co-cultures (p ≤0.01) (Figure 5 b).
Le nombre total de boucles ont été calculé dans chaque quadrant et exprimé en formation moyenne totale du circuit (Figure 5). Le nombre moyen de boucles fermées totales étaient comme suit : FTM HUCPVC traités co-cultures (81 ±7), BMSC (±3 26) et n’est pas traité les anneaux (55 ± 7). FTM HUCPVCs contribué à significativement plus grande boucle endothéliales formation comparativement aux BMSC (p ≤0.01) et de réseaux non traités (p ≤0.01). Le BMSC co cultures endothéliales a entraîné moins boucles par rapport aux réseaux non traités (p ≤0.01) du réseau. Cette quantification identifie un type de cellule qui a un effet nettement positif sur le développement du réseau endothéliales (FTM HUCPVC) et un type de cellule qui risqueraient même de réseaux endothéliales. Il est à noter que le développement du réseau une augmentation significative a été observé en corrélation avec la couverture MSC sur les réseaux endothéliales. Il suggère que les interactions directes sont déterminantes pour les MSCs exécuter leur fonction de soutien.
Les écueils possibles des établissements co-culture anneau aortique sont représentées dans la Figure 6. Polymérisation inadéquate ou irrégulière de BME est un problème qui peut interférer avec le développement du réseau endothéliales réussie. Chronométrer la polymérisation de BME pendant exactement 30 minutes et le transfert des médias sans perturber le polymère assurera une phase BME intacte et fonctionnelle (Figure 6 a). Coloration les MSCs pour temps d’incubation prolongée et permettant les MSCs granuler pendant des périodes prolongées peuvent interférer avec la morphologie cellulaire et phénotype sur co-cultures. Figure 5 b montre FTM HUCPVCs colorés pendant 1 h et a permispour granulés pour 1 h avant la co-culture, les deux étant sous-optimale timings. HUCPVCs FTM ne montrent pas de préférence aux sites de réseaux endothéliales et sont dispersées à travers le réseau. Comparer correctement traitée de cellules (Figure 3) à mal FTM HUCPVCs, les cellules mal affichent la morphologie des cellules arrondies et les interactions cellule-cellule limitées avec les cellules endothéliales (Figure 6 b). Enfin, si l’essai de l’anneau aortique ne peut être établi le jour de la dissection, les aortes peuvent être stockées à-80 ° C en milieu EGM-C additionné de 10 % le diméthylsulfoxyde (DMSO) et 10 % FBS. Le développement du réseau endothéliales peut prendre 1-3 d plus longtemps lors de l’application des anneaux aortiques décongelés par rapport au tissu frais, mais les réseaux endothéliales suffira pour création de co-culture MSC (Figure 6).
Comme une procédure alternative de l’évaluation de co-culture anneau aortique, la fraction cellulaire des anneaux aortiques BME incorporé peut être extrait et analysée par cytométrie en flux (supplémentaire Figure 1). Le marqueur spécifique humain TRA-1-85 (complémentaire de la Figure 1 a, B, axe des y) population de cellules positives de FTM HUCPVC contenant des co-cultures a été identifié comme humains MSCs. L’étiquetage Co a montré faible expression du marqueur endothélial CD31 (complémentaire de la Figure 1 a) et forte expression du marqueur pericyte CD146 (complémentaire Figure 1 b) au sein de la population de cellules positives humaines marqueur spécifique. Cette évaluation peut déchiffrer immunophénotypiques éventuelle et changements engagement lineage des MSCs induites par les interactions avec les cellules endothéliales et fournissent également des informations précieuses sur le type de cellule testé. Afin d’obtenir un nombre suffisant de cellules pour l’analyse des FC, les cellules extraites du puits parallèles du même groupe expérimental peuvent être combinés. Il est important d’envisager l’utilisation non pré-teinté MSC contenant les anneaux aortiques pour analyse en cytométrie en flux, afin que la fluorescence qui rappelle le colorant viable n’interfère pas avec le signal de l’anticorps-connexe fluorophores. Dans le cas contraire le déclenchement négatif devrait prendre la fluorescence cellulaire pré colorés en considération.
Nous avons trié MSCs extrait forme anneau aortique co cultures humaines (jour 7 de co-culture) à l’aide de l’anticorps spécifique de la surface de marqueur de cellules humaines (TRA-1-85). HUCPVCs FTM et BMSC extraite de l’essai de l’anneau aortique ont été traités pour l’analyse de qPCR tester l’expression des gènes angiogénique. À l’aide d’un tableau de qPCR disponibles dans le commerce, trois cultures co de l’anneau aortique a fourni une quantité suffisante de matériel génétique pour quantifier l’expression des gènes de facteur de croissance humain 84 (complémentaire Figure 2 a). Les résultats préliminaires indiquent que les FTM HUCPVCs et BMSC exprime des facteurs angiogéniques sécrétées clés à des niveaux comparables (complémentaire Figure 2 b). En plus de comparer les niveaux d’expression des différents types de cellules dans le dosage, l’effet de transfert de cellules à EBM base dosage médias de leur milieux de culture d’expansion sont à considérer. Lors de l’utilisation de cellules de la plasticité phénotypique ou génétique plus élevée, un groupe de contrôle de comparaison de MSCs humaines dans les médias EBM - sans le tissu aortique - devrait figurer dans l’évaluation.
Les similitudes dans l’expression du facteur angiogénique de MSCs suggère que la différence significative de leur augmentation de réseau n’est pas un résultat des activités différentes paracrine. C’est en concordance avec l’observation antérieure qui interaction intercellulaire directe accrue semble favoriser le développement du réseau endothéliale.

Figure 1 : Schéma d’une nouvelle Application de la configuration de test anneau aortique.
Les principales étapes de l’installation et l’analyse des co-cultures MSC avec le test de l’anneau aortique sont exposées dans des boîtes solides et notes additionnelles sont décrites dans des boîtes en pointillés. Echelle = 1 000 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Image de représentant de l’analyse de réseau anneau aortique.
Réseaux endothéliales sont divisés en trois régions concentriques issues des différences structurelles : secteur non structuré à proximité immédiate de l’anneau aortique tissu (A), développé ou structuré des réseaux endothéliales (B) et développement des réseaux situé dans la périphérie de la culture de tissus ex vivo (C). Croissance du réseau radial et quadrant uniforme pour le nombre de boucles sont définis au sein du réseau avancé endothélial (B). x: fermée boucle endothélial comptés dans quadrant uniforme. Echelle = 250 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
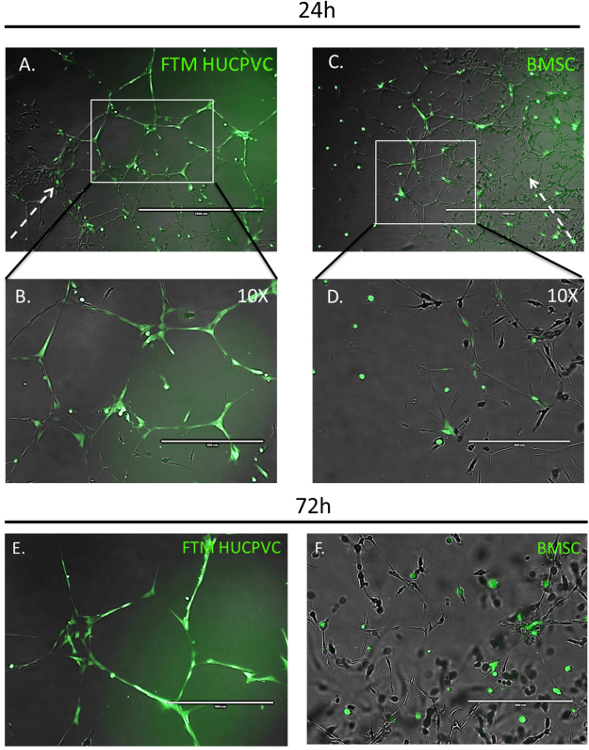
Figure 3 : Fluorescent région dépendante du réseau d’imagerie intégration de humaine MSCs dans le test d’anneau aortique suite 24 & 72 h.
Marqueur (vert) FTM HUCPVCs et BMSC ont été ajoutés pour les développement des réseaux de tube endothéliales anneau aortique. Images de microscopie de fluorescence prises 24h après avoir établi la MSC co-cultures affichent HUCPVCs FTM qui migrent dans l’ECM et la maison aux périphériques réseaux endothéliales en développement (A). Images de grandissement supérieurs afficheront morphologies allongées de FTM HUCPVCs alors qu’il est en contact étroit avec les réseaux endothéliales (B). BMSC moins traite l’ECM et la maison aux réseaux endothéliales avec aucune préférence observable pour le développement de périphériques réseaux (C). BMSC affiche morphologies cellule sphérique (D).
Images de microscopie de fluorescence fort grossissement de marqueur MSCs dans test anneau aortique de rat après 72 h de co-culture (E, F). FTM HUCPVCS présentent des morphologies allongées tout en affichant endothéliale couverture grâce à des interactions directes de cellule à cellule avec des cellules endothéliales (flèches blanches solides) aussi bien dans les noeuds du réseau et les tubules (E). BMSC maintenir morphologies de cellules sphériques regroupées dans les nœuds de réseau endothéliales (F). Broken arrow représente le sens de la croissance du réseau endothéliales dans les tissus de l’anneau aortique. A, C: Echelle = 1 000 µm B, D: échellebar = 400 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
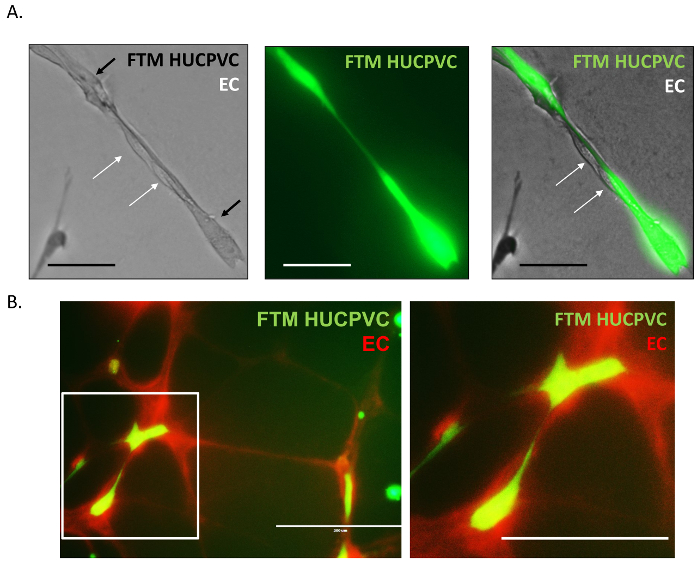
Figure 4 : Fort grossissement les Images de microscopie par Fluorescence des Interactions physiques Pericyte-endothélial.
Les cellules endothéliales non colorés trouvées associées à des protubérances continus reliant préalablement teinté FTM HUCPVCs dans le réseau tubulaire (A). Images fluorescentes des réseaux endothéliales préalablement teinté (EC, rouge) avec pré teinté FTM HUCPVCs (FTM, vert) démontrent récapitulant les cellules endothéliales, les interactions des interactions pericyte (B). A: section Echelle = 100 µm B: section Echelle = 200 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Quantification de la croissance du réseau dans le traitement de MSC regroupe 5 D après établissement de co-culture.
Faible grossissement phase contraste microscopie images ont été prises par les groupes de traitement anneau aortique pour évaluer la croissance et le développement (A). Épars flèche indique le sens de la croissance du réseau. Echelle = 250 µm. microscopie images ont été utilisées pour quantifier les propriétés du réseau, y compris la croissance moyenne réseau et signifie la formation de boucle de réseau dans le quadrant d’un dosage. HUCPVCs FTM ont contribué à une plus grande croissance de réseau par rapport aux cultures co BMSC et réseaux non traités (p 0,001) (B). La valeur de p a été calculée à l’aide d’une ANOVA à être p <0,0001 à l’aide de Tukey Post test (N = 3). Boucles de réseau au moins quatre côtés fermés ont été quantifiés (C). FTM HUCPVC cultures conjointement développés boucles de réseau supérieures par rapport aux cultures co BMSC (p 0,001) et réseaux non traités (p ≤0.01). La valeur de p a été calculée à l’aide d’une ANOVA à être p < 0.0001 à l’aide du test de Post de Tukey (N = 3). La moyenne des 4 domaines de réseaux endothéliales ont été quantifiées. Echelle = 250 µm. Pour la comparaison par paire, * = p ≤ 0,05, ** = p ≤0.01, *** = 0,001 p. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : Les erreurs possibles dans l’établissement de dosage anneau aortique.
Des anneaux aortiques incorporés dans la polymérisation incomplète BME peuvent conduire à réseaux endothéliales incompatibles et cassés (A). FTM HUCPVCs colorées pendant de longues périodes avec des écarts de temps importante entre la coloration et l’établissement des co-cultures, rendement minimal homing et interactions entre les cellules endothéliales (B). Le réseau endothélial de l’aorte de rat stockées à-80 ° C et décongelé pour l’analyse de l’anneau aortique (C). A: section Echelle = 250 µm B, C: échelle = 400 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Supplémentaire Figure 1 : Analyse d’écoulement Cytometry de FTM humaine HUCPVCs extraits des co-cultures anneau aortique.
Des fractions cellulaires des cultures de l’anneau aortique ont été isolées et travaillées pour analyse en cytométrie en flux. Fluorophore conjugués anticorps contre marqueur de surface spécifiques de cellules humaines (TRA-1-85, APC) a été appliqué en combinaison avec le marqueur endothélial (CD31, FITC, (A)) ou des anticorps spécifiques de la pericyte marqueur (CD146, FITC, (B)). La population de cellules positive pour le marqueur humain (axe y) testé faible positivité pour marqueur endothélial CD31 (A, T2) et fortement positif pour le marqueur de pericyte CD146 (B, Q6). Ceci suggère que les FTM HUCPVCs maintenu leurs propriétés de cellule périvasculaire dans les cultures co de l’anneau aortique et n’ont pas développé un phénotype endothélial. Les quadrants sur parcelles ont été définies en utilisant isotype contrôles correspondant à l’anticorps primaires appliquées. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplémentaires Figure 2 : Analyse PCR Quantitative des gènes clés angiogénique.
L’expression des gènes similaires de gènes clés angiogéniques par FTM HUCPVCs et BMSC après 1 semaine culture mixte dans l’essai de l’anneau aortique (A). Les valeurs de CT représentatives figurent au tableau (B). S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Il y a plusieurs étapes essentielles à mettre en place un test réussie anneau aortique expérience de co-culture MSC. Tout d’abord, les étapes les plus importantes lorsque l’isolant et en sectionnant l’aorte sont : 1) obtenir exclusivement le segment thoracique de l’aorte ; 2) soigneusement enlever les vaisseaux sanguins ramifiés, conjonctif et le tissu adipeux et ; 3) coupe même des sections de l’aorte (~ 1 mm) pour limiter la variabilité entre chaque essai. Deuxièmement, l’intégration réussie des anneaux aortiques dans BME est essentiel pour ce dosage. Si les Afro-Caribéens n’est pas complètement polymérisés ou polymérisés inégalement, les anneaux aortiques incorporés dans le BME ne sera pas en mesure d’ouvrir la germination endothéliale ou ils peuvent développer des réseaux endothélium discontinus. Si la polymérisation de BME est insuffisante, dosages ne sont pas fiables pour la quantification. En troisième lieu, complète enrichie en facteur endothélial médias sont nécessaire pour trouver de la nourriture pour les anneaux aortiques à amorcer la germination. Une fois que les anneaux de l’anneau aortique ont initié navire de germination, les prochaines étapes à venir critiques impliquent le type de cellule à tester. À cette fin, MSCs doivent être correctement pré-teint et administré aux germination des anneaux aortiques. Il existe deux procédures critiques pour cette section. 1) en sélectionnant le jour approprié pour l’amorçage : les réseaux devraient être dans la phase de développement et ne pas parvenir à une couverture élevée de la culture bien. Si les MSCs ne sont pas administrés de manière opportune, il devient difficile de quantifier les effets nets des MSCs sur le développement du réseau. 2) prestaining les MSCs avant addition : si les MSCs sont trop colorés ou restent en granulés pendant une longue période de temps, agglutination se produit qui détériore homing et intégration au sein de réseaux endothéliales. Enfin, quantifier les réseaux peut être facilement réalisée si les contrôles appropriés sont prêts. Anneaux aortiques sans MSCs mettra au point des réseaux endothéliales parce que l’aorte elle-même prend en charge la germination, mais les MSCs peuvent favoriser le développement de réseau plus important avec des structures de réseau différent tel que décrit dans ce manuscrit. La quantification des réseaux endothéliales devrait être effectué au moins 5 d établissant co cultures suivantes. En raison du système fermé, réponse angiogénique est transitoire et endothéliales réseaux commencent à dégénérer après environ 7 jours. Si l’observation vise à évaluer l’effet de type cellule testée sur le développement des réseaux endothéliales, les images doivent être acquis au sein de la première semaine de co-culture.
Une éventuelle modification du dosage actuel peut être l’application de tissus humains primaires. Comme une section de 1 mm de l’aorte de rat fait une unité de culture mixte, aortes humaines peuvent fournir un grand nombre de sections de mesures très cohérentes. Malgré la disponibilité très limitée du tissu principal humain viable, à haut rendement suggère faisabilité potentielle. Lors du développement d’un test pour les évaluations à grande échelle, formant avant l’essai et stocker ses composants jusqu'à ce que les cellules pour les tests deviennent disponibles peuvent être considérés. Le revêtement de BME peut être préparé sur des plaques de culture de tissus et stocké sous forme congelée, déshydratée pour longues périodes de temps. Aussi, que nous avons testé dans notre laboratoire, le tissu aortique de rat peut être congelé et stocké pour application ultérieure, ainsi faisant travailler avec l’élément essentiel de l’essai plus commode.
Malgré les nombreux avantages du test de l’anneau aortique, il y a quelques limitations à énumérer. Tout d’abord, la mise en place des cultures dosage peut être difficile. Dans sa forme actuelle, l’application systématique nécessite suffisamment de compétences manuelles. Erreurs d’opérateur peuvent introduire de la variabilité. Il peut être reflété dans la croissance du réseau et peut rendre difficile d’évaluer avec fiabilité l’effet des cellules administrées et, par conséquent, les propriétés angiogénique important. Toutefois, ces défis sont semblables si pas inférieurs par rapport à celles des autres méthodes disponibles, et la période de formation requis peut être facilement courtes et économiques plutôt que des expériences in vivo . Ensuite, une période de latence entre l’incorporation de l’ex vivo le tissu aortique et le développement du réseau initial qui marque le moment de l’administration de la cellule doit être pris en compte par l’utilisateur. Troisièmement, la quantification des propriétés réseau endothéliales peut prendre du temps mais peut être résolue en assignant des paramètres de hallmark, y compris la croissance radiale, tube dimensions de maille de longueur et réseau. Cela peut être effectuée en utilisant l’analyse assistée par ordinateur d’images (Image J), qui peut diminuer considérablement le temps requis pour la quantification fiable et constante. Quatrièmement, la variabilité entre chaque essai peut survenir à la suite de légères incohérences dans la source de tissus d’origine animale et de la manipulation par l’opérateur. Nous avons constaté que ce défi peut être surmonter efficacement et la quantification devient statistiquement fiable en mettant en place réanalysés pour chaque groupe de traitement. Enfin, extraire et de trier les cellules de l’homme et l’origine de rat pour dosage après analyse peuvent être difficiles. Cependant, les protéinases spécifiques, y compris a et solution de récupération de cellules peuvent être appliquées pour récupérer des cellules pour l’analyse de l’expression immunophénotypiques ou gène.
Par rapport aux méthodes existantes qui soit à la culture de cellules endothéliales du même type ou vivent les systèmes animaux, ceci présenté test utilise la combinaison de ex vivo tissu aortique et afro-Caribéennes. Cette configuration permet à l’utilisateur d’obtenir des données qualitatives et quantitatives élucider les propriétés angiogéniques des candidats de la thérapie cellulaire. Combinant des afro-caribéens et multicellulaire ex vivo des tissus fournit des propriétés étroitement imitant le microenvironnement que le type de cellules thérapeutiques peut-être rencontrer après administration locale. En raison de la possibilité d’un nombre élevé de parallels et le contrôle étroit des conditions de culture, l’opérateur est pourvu d’un système qui contient les éléments nécessaires à l’évaluation fiable, tout en éliminant des variables et des incohérences trouvées dans modèles animaux. En outre, les évaluations sont plus réalisables parce qu’elle réduit les coûts et la nécessité de procédures répétées d’animaux. Essais sur des cellules simples et des modèles animaux plus n’ont pas les facteurs et les variables introduites par des réponses immunitaires qui se produirait autrement dans l’application clinique des candidats de la thérapie cellulaire. La réponse inflammatoire altère l’angiogenèse et par conséquent, l’effet thérapeutique de substances implantés ou cellules ne peuvent être quantifiées avec précision. L’essai de l’anneau aortique exclut de nombreux composants inflammatoires qui perturbent le dosage des mesures. Cependant, il contient des macrophages résidents qui sont des acteurs importants dans le développement de système microvasculaire32. Avec l’identification facile du réseau endothéliale et marqueur de cellules humaines, l’effet des cytokines inflammatoires MSC sécrétée et éléments même cellulaires du système immunitaire, on peuvent facilement observer à l’aide de ce test.
Haut contrôle par l’utilisateur sur les conditions de test et le caractère reproductible d’expérimental permet l’introduction de nouveaux éléments du système. Tout d’abord, l’essai de l’anneau aortique peut servir comme un modèle de blessures. Suite à l’incorporation des anneaux aortiques et germination endothéliale, dosages peuvent être introduits à une lésion ischémique, facteurs inflammatoires (TNF-α) ou bactérien lipopolysaccharides (LPS), suivi par addition de MSC pour déterminer possible sauvetage d’angiogénique réponse à la suite de blessures. Deuxièmement, pour élucider les mécanismes possibles de comment les MSCs contribuent à la réponse angiogénique, zationZing anticorps peuvent être utilisés pour faire taire les critiques concernant les interactions cellule-cellule les récepteurs potentiels. Enfin, afin d’étudier les propriétés paracrine de MSCs, l’essai de l’anneau aortique peut être configuré dans un système de transwell à exclure l’effet des interactions cellule-cellule de la réponse angiogénique, mais se concentrer sur les propriétés paracrine.
En résumé, le test de l’anneau aortique peut évaluer la capacité et la puissance des candidats de thérapie cellulaire de médiation ECM traitement, migrer vers des régions de l’angiogenèse et contribuer au développement de navire par contact physique. L’anneau aortique ex vivo angiogenèse dosage pourrait être développé comme un outil de présélection précieux, quantitatif pour les lignées cellulaires candidat pour thérapie régénérative.
Déclarations de divulgation
Dr. Clifford L. Librach est cotitulaire du brevet : méthodes d’isolement et d’utilisation de cellules provenant de tissus de cordon ombilical premier trimestre. Accordée au Canada et en Australie.
Remerciements
Les auteurs remercie les membres du personnel suivants et personnel de recherche : Andrée Gauthier-Fisher, Matthew Librach, Tanya Barretto, Tharsan Velauthapillai et Sarah Laronde.
matériels
| Name | Company | Catalog Number | Comments |
| Alpha-MEM | Gibco | 12571071 | For FTM HUCPVC and BMSC culture media. |
| APC-conjugated anti human TRA-1-85 | R&D Systems | FAB3195A | Human-specific cell marker for flow cytometry and cell sorting |
| Basal membrane extract (BME) (Matrigel) | Corning | 354234 | For aorta embedding |
| Bullet-kit | Lonza | CC-3162 | Includes: Gentamicin/Amphotericin-B (GA)human Epidermal Growth Factor (hEGF); Vascular Endothelial Growth Factor (VEGF); R3- Insulin-like Growth Factor-1 (R3-IGF-1); Ascorbic Acid; Hydrocortisone; human Fibroblast Growth Factor-Beta (hFGF-β); Heparin; Fetal Bovine Serum (FBS). Required to prepare EGM |
| CellTracker Green CMFDA Dye | Thermo-fisher | C2925 | For staining MSCs, green is picked up optimally by MSCs |
| CKX53 Culture Microscope | Olympus | For bright-field imaging of endothelial network development | |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting for MSC culture, flow cytometry and qPCR |
| Dispase | StemCell technologies | 7923 | For dissociating aortic ring-MSC co-cultures (pre-warm at 37 °C) |
| Disposable sterile scalpels | VWR | 21909-654 | For sectioning aorta |
| Dulbecco's phosphate buffered saline | Sigma-Aldrich | D8537 | PBS. 1X, Without calcium chloride and magnesium chloride |
| Endothelial basal media (EBM) | Lonza | CC-3156 | Basal media required for culturing aortic ring assay-MSC co-cultures (warm at 37 °C before use). Required for EGM and EBM-FBS |
| Ethanol, 70%, Biotechnology Grade | VWR | 97064-768 | To sterilize surfaces |
| EVOS | Life Technologies | In-house fluorescent microscope to track MSC migration and integration | |
| Fetal bovine serum (FBS) (Hyclone) | GE Healthcare | SH3039603 | Serum component of cell culture medium |
| FITC-conjugated anti-CD31 antibody | BD | 558068 | Human endothelial marker for flow cytometry |
| FITC-conjugated anti-CD146antibody | BD | 560846 | Human pericyte marker for flow cytometry |
| Forceps | Almedic | 7727-A10-704 | For handing rat tissue. Can use any similar forceps |
| Hank's Balanced Salt Solution (HBSS) | Life Technologies | 14175-094 | 1X Without calcium chloride and magnesium chloride |
| HERAcell 150i CO2 Incubator | Thermo Fisher Scientific | 51026410 | For incubating cells |
| Human Angiogenesis RT2 profiler PCR array | Qiagen | PAHS-024Z | Human specific and includes primers for 84 genes involved in angiogenesis. Each well is 1 primer reaction |
| ImageJ | Open source image processing software. Require Angiogenesis analyzer plugin | ||
| LSR II | BD | UHN SickKids FC Facility. For flow cytometry. | |
| MoFlo Astrios | Beckman Coulter | UHN SickKids FC Facility. For cell sorting. | |
| Penicillin/streptomycin | Gibco | 15140122 | Antibiotic component to buffers and cell culture medium |
| RNeasy Mini Kit | Qiagen | 74104 | For RNA purification. Includes cell lysis buffer |
| RT2Easy First Strand Kit | Qiagen | 330421 | For preparation of cDNA for qPCR |
| RT2PreAMP cDNA Synthesis Kit | Qiagen | 330451 | Pre-amplification of cDNA if low-yield RNA |
| Surgical scissors | Fine Science Tools | 14059-11 | For cutting skin, muscle and aorta |
| Sterile gauze | VWR | 3084 | To dampen and sterilize chest fur |
| TrypleE | Thermo Fisher Scientific | 12605036 | MSC dissociation enzyme pre-warm at 37 °C |
| 0.2 μm pore filtration unit | Thermo Fisher Scientific | 566-0020 | To sterilize tissue culture media |
| 0.25% Trypsin/EDTA | Gibco | 25200056 | For cell dissociation, pre-warm at 37 °C |
| 10 cm tissue culture dishes | Corning | 25382-428 | For cleaning and sectioning aorta and MSC cell culture |
| 12 well-cell culture plates | Corning-Sigma Aldrich | CLS3513 | For setting up aortic ring assay-MSC co-cultures |
| 15 mL tube | BD Falcon | 352096 | For general tissue culture procedures |
| 70 μm cell strainer | Fisherbrand | 22363548 | To ensure a single cell suspension before flow cytometry or sorting |
Références
- Potente, M., Gerhardt, H., Carmeliet, P. Basic and therapeutic aspects of angiogenesis. Cell. 146 (6), 873-887 (2011).
- Hoeben, A., Landuyt, B., Highley, M. S., Wildiers, H., Van Oosterom, A. T., De Bruijn, E. A. Vascular endothelial growth factor and angiogenesis. Pharmacol Rev. 56 (4), 549-580 (2004).
- Khan, T. A., Sellke, F. W., Laham, R. J. Gene therapy progress and prospects: therapeutic angiogenesis for limb and myocardial ischemia. Gene Ther. 10 (4), 285-291 (2003).
- Gupta, R., Tongers, J., Losordo, D. W. Human studies of angiogenic gene therapy. Circ Res. 105 (8), 724-736 (2009).
- Chu, H., Wang, Y. Therapeutic angiogenesis: controlled delivery of angiogenic factors. Ther Deliv. 3 (6), 693-714 (2012).
- Cao, Y. Therapeutic angiogenesis for ischemic disorders: what is missing for clinical benefits?. Discov Med. 9 (46), 179-184 (2010).
- Said, S. S., Pickering, J. G., Mequanint, K. Advances in growth factor delivery for therapeutic angiogenesis. J Vasc Res. 50 (1), 35-35 (2013).
- Bergers, G., Song, S. The role of pericytes in blood-vessel formation and maintenance. Neuro Oncol. 7 (4), 452-464 (2005).
- Leeper, N. J., Hunter, A. L., Cooke, J. P. Stem cell therapy for vascular regeneration: adult, embryonic, and induced pluripotent stem cells. Circulation. 122 (5), 517-526 (2010).
- Sieveking, D. P., Ng, M. K. Cell therapies for therapeutic angiogenesis: back to the bench. Vasc Med. 14 (2), 153-166 (2009).
- Staton, C. A., Reed, M. W., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Auerbach, R., Lewis, R., Shinners, B., Kubai, L., Akhtar, N. Angiogenesis assays: a critical overview. Clin Chem. 49 (1), 32-40 (2003).
- Tahergorabi, Z., Khazaei, M. A review on angiogenesis and its assays. Iran J Basic Med Sci. 15 (6), 1110-1126 (2012).
- Arnaoutova, I., George, J., Kleinman, H. K., Benton, G. The endothelial cell tube formation assay on basement membrane turns 20: state of the science and the art. Angiogenesis. 12 (3), 267-274 (2009).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat Protoc. 5 (4), 628-635 (2010).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10 (3), 588-612 (2006).
- Nicosia, R. F. The aortic ring model of angiogenesis: a quarter century of search and discovery. J Cell Mol Med. 13 (10), 4113-4136 (2009).
- Baker, M., et al. Use of the mouse aortic ring assay to study angiogenesis. Nat Protoc. 7 (1), 89-104 (2011).
- Guo, J., et al. A secreted protein (Canopy 2, CNPY2) enhances angiogenesis and promotes smooth muscle cell migration and proliferation. Cardiovasc Res. 105 (3), 383-393 (2015).
- Wittig, C., Scheuer, C., Parakenings, J., Menger, M. D., Laschke, M. W. Geraniol Suppresses Angiogenesis by Downregulating Vascular Endothelial Growth Factor (VEGF)/VEGFR-2 Signaling. PLoS One. 10 (7), e0131946 (2015).
- Masson, V. V., et al. Mouse Aortic Ring Assay: A New Approach of the Molecular Genetics of Angiogenesis. Biol Proced Online. 4, 24-31 (2002).
- Caplan, A. I. Adult mesenchymal stem cells for tissue engineering versus regenerative medicine. J Cell Physiol. 213 (2), 341-347 (2007).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Keating, A. Mesenchymal stromal cells: new directions. Cell Stem Cell. 10 (6), 709-716 (2012).
- Kilroy, G. E., et al. Cytokine profile of human adipose-derived stem cells: expression of angiogenic, hematopoietic, and pro-inflammatory factors. J Cell Physiol. 212 (3), 702-709 (2007).
- Tang, Y. L., et al. Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction. Ann Thorac Surg. 80 (1), 229-236 (2005).
- Caplan, A. I. All MSCs are pericytes?. Cell Stem Cell. 3 (3), 229-230 (2008).
- Hong, S. H., et al. Ontogeny of human umbilical cord perivascular cells: molecular and fate potential changes during gestation. Stem Cells Dev. 22 (17), 2425-2439 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: The ARRIVE guidelines for reporting animal research. J Pharmacol Pharmacother. 1 (2), 94-99 (2010).
- Sarugaser, R., Ennis, J., Stanford, W. L., Davies, J. E. Isolation, propagation, and characterization of human umbilical cord perivascular cells (HUCPVCs). Methods Mol Biol. 482, 269-279 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Gelati, M., Aplin, A. C., Fogel, E., Smith, K. D., Nicosia, R. F. The angiogenic response of the aorta to injury and inflammatory cytokines requires macrophages. J Immunol. 181 (8), 5711-5719 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon