Method Article
大動脈リング共培養アッセイ:体外間葉系間質細胞の血管新生の可能性を評価するために便利なツール
要約
ここでは、prelabelled の間葉系細胞がラット大動脈由来血管内皮ネットワークとの共培養して大動脈リング測定の新たな応用を提示します。この手法では、間葉系間質細胞 (MSCs) ホーミングと内皮細胞ネットワークとの統合の可視化、ネットワークのプロパティの定量化と MSC immunophenotypes と遺伝子発現の評価をことができます。
要約
血管新生は複雑で規制の厳しいプロセスを提供し、適切な組織灌流を維持する役割を担います。十分な血管のメンテナンスおよび病理学的奇形は、過度に豊富な血管新生は癌や炎症性疾患に関連付けられている重篤な虚血性疾患の起因できます。プロ血管新生療法の有望なフォームは、血管を新しく開発するため規制の要因だけでなく、物理的なサポートを提供することができます血管新生細胞源の使用です。
間葉系間質細胞 (MSCs) は、虚血や炎症を起こしている組織に家を検出してそのパラクライン効果と自分の能力のための血管再生のため広範囲調査候補です。特に、最初の学期はひと臍帯血管周囲細胞 (FTM HUCPVCs) の周皮細胞のような性質、高い増殖能とポテンシャル、免疫特権プロパティ、および堅牢なパラクリンのための非常に有望な候補者プロファイル。潜在的血管新生細胞を効果的に評価、信頼性の高いにそれらと「翻訳」の前臨床アッセイをテストする前提条件です。大動脈リング アッセイは管状の内皮構造の簡単な定量化を可能、ホストからアクセサリー支持細胞と細胞外マトリックス (ECM) を提供します、炎症性成分を除外、 ex vivo血管新生モデル高速かつ安価で設定します。これは生体内でモデル (例えば、角膜の試金、マトリゲル プラグ法) と比較されたとき有利です。大動脈リング アッセイは、投与細胞を追跡し、異種免疫拒絶反応を回避しながら細胞間の相互作用を観察できます。
応用発展途上ラット大動脈内皮細胞ネットワークとの共培養でヒト MSCs を含む大動脈リングの試金のためのプロトコルを提案します。この試金は、チューブの形成と物理的周皮細胞のような相互作用を開発する MSC の貢献とその効力積極的に血管新生のサイトに移行するため、実行して仲介する能力を評価するための分析ECM の処理。このプロトコルは、次の共培養 MSC の表現型と遺伝子発現の変化に関するさらに詳しい情報を提供します。
概要
血管新生の複雑なプロセスを向上させるし、既存の血管1から新しい血容器開発を促進することによって組織の灌流を維持します。それプロ血管新生と血管新生因子によって厳しく規制された、バランスの取れたプロセスです。このシステムの不備不足容器メンテナンスや成長、心筋疾患、脳卒中、神経変性疾患など重篤な虚血性疾患を引き起こす可能性があります。しかし、誇張された血管の開発は、がんや炎症性疾患2などの条件のための特徴です。
有利な組織の再生を達成するために血管新生を制御することを目指す治療法の開発は、重要です。広汎な前臨床および臨床調査にもかかわらずプロ血管新生因子とマイクロ Rna を用いた血管新生を刺激する試みは、望ましい結果3,4,5を達成するために失敗しました。一時的な効果のある可能性があります: 血管新生タンパク質と核酸、有限数の限られた寿命は成長因子6,7を対象とします。可溶性血管新生因子が血管新生を開始するために不可欠であるメンテナンスや血管の機能サポートするペリサイトおよび平滑筋細胞8を含むセルの種類に依存します。プロ血管新生療法の分野は、血管、さらに差別化の自己更新または物理的に新しくサポート開発中血管新生因子、ローカルを提供可能性があります潜在的な幹細胞と前駆細胞源を模索しています。血管内皮細胞 -9,10。これらの機能の要件を満たすために機能を備えた携帯型最適な血管新生を見つける虚血組織再生のための大きい約束を保持します。
潜在的な細胞ベースの治療法を臨床試験に正常に訳し、前臨床試験の有効性を実証し、血管新生機構の解明を強調表示する必要があります。確立された血管新生アッセイの数が多いにもかかわらず、フィールドは確実に潜在的な候補のセル型11,12,の有効性を評価できる「ゴールド スタンダード」の in vitroアッセイを欠いている13. ほとんどの in vitro血管新生アッセイ (内皮細胞の増殖, 移行および管の形成アッセイを含む) 通常内皮細胞表現型変化や分化細胞や化合物の効果の評価鋼管およびネットワーク構造14,15。これらの機能は血管新生に重要な「翻訳」アッセイも評価: 1) 豊胸術や血管や平滑筋細胞、2) ECM や基底膜の処理を含むサポートのセル型の交換と 3)。機能的な血管の形成を促進する効率。角膜アッセイ、マトリゲル プラグ アッセイを含む血管新生モデル生体内でユニークな生体内の微小環境を再現が追跡管理セルの難易度物理的な相互作用の観察に挑戦しています。さらに、生体内でモデル、潜在的な同種細胞療法の候補者16のテスト中 xeno 免疫拒絶反応が行われます。特に大動脈リング分析を提供できる血管新生モデル前のヴィヴォ: 1) 簡単に観察、3) ECM ホストや人工の電源で 4) 炎症性の排除 2) アクセサリー支持細胞管状構造の定量化コンポーネント、および 5) 迅速かつ安価なセットアップ17,18。通常、大動脈リング アッセイは、小さな分泌蛋白質、薬理学的エージェント、およびトランスジェニック齧歯類モデル19,20,21の血管新生可能性をテストできます。
MSCs は、その傍分泌を介する効果22,23,24を通じて主に血管再生医療の有望な候補です。MSCs は、血管内皮増殖因子 (VEGF)、肝細胞増殖因子 (HGF) を含む主要血管新生因子を分泌する示されているインスリン様成長因子 1 (IGF-1)、基本的な線維芽細胞成長因子 (bFGF) と angiopoeitin-1 (Ang-1)25 ,26。また、MSCs を検出することができ、虚血性または炎症に家組織、ただし、厳密なメカニズムはまだ調査中では。ますます、文献はほとんど MSCs 血管周囲細胞から生じるし、共同周皮細胞マーカーを表現し、ペリサイト27のように振る舞うことができる仮説をサポートします。HUCPVCs は、若いひと臍帯の血管領域から派生した MSCs の源です。彼らは、周皮細胞のような性質を持つ MSCs の人口を表し、FTM と用語のへその緒から特徴づけられています。FTM の HUCPVCs は CD146 と NG2、高い増殖能とポテンシャルの免疫特権プロパティを含む周皮細胞マーカーの高発現を示す、堅牢なパラクリン プロファイル28を表示します。FTM の HUCPVCs は、新しい血管周皮細胞のようなプロパティを介しての推進により負傷した組織の再生を促進するための理想的な候補者セル型です。
血管新生の可能性と人間の MSCs の周皮細胞のような性質をテストするのには血管新生アッセイの非常に限られた数が肯定的な利用可能な angiotropic 移行 (以下「ホーミング」という)、ECM 処理、および物理的な開発細胞のタイプ間の相互作用は、血管の開発に関する定量的データを取得しながら調べることができます。
ここ大動脈リング試金の新規アプリケーションを記述するプロトコルを提案する.人間の MSCs は発展途上ラット由来大動脈内皮細胞ネットワークとチューブの形成、成熟および恒常性への貢献を評価するために共培養.このバージョン大動脈リング アッセイの評価能力とホーム新生のサイトに実行し ECM 処理を仲介し、周皮細胞のような物理の確立を通じて内皮の管状の発展に貢献する細胞療法候補者の効能相互作用。培養内皮細胞ネットワーク形成の MSCs の純効果の定量化、細胞間の相互作用を観察することに加え、我々 はまた MSCs を共培養から分離するためのプロトコルを最適化されています。フローサイトメトリーと qPCR を実行、次の共培養 MSC の表現型と遺伝子発現の変化を特徴づけることが可能です。モデル セル型として発生初期と比較した (胎児期) と人間の MSCs の後半 (大人) ソース: FTM HUCPVCs とひと骨髄由来 MSCs (ボーマン)、大動脈リング アッセイで、それぞれ。とき血管再生への応用の検討の下で任意の物理的にサポートのセル型の血管新生の可能性を研究する大動脈リング試金を使用することができることを提案します。
プロトコル
動物を含むすべての研究が行われ、到着のガイドライン 29 によると報告します。制度上の研究倫理委員会の承認 (南軍兵数 4276) とすべての研究を行った。プロシージャは大学健康ネットワーク (トロント、カナダ)、動物の世話委員会によって承認されたすべての動物、すべての動物を受け取った ケアおよび実験動物の使用のためのガイド、8 th 版 (に準拠して人道的なケア国立衛生研究所健康 2011年).
1。 大動脈リング アッセイ セットアップ
- 分離ラット大動脈。
- 安楽死 8 - 10 週齢ラット CO 2 窒息を使用して: 20% にセット CO 2 室ガス交換 (流量商工会議所ボリューム/分 × 0.2 =)。胸の触診でピンチの反射と心ビートの有無によって確認します 。
- には、70% エタノールで滅菌ガーゼを使用して胸の部分の毛が濡れています。胸部正中に切開を行いますし、皮膚や筋肉層を切って滅菌ピンセットとハサミを使用します 。
- 胸郭を公開すると、一度は両側に胸郭をカット、それぞれの側に胸骨から上方約 5 mm を折る。新鮮な死体の肋間動脈からいくつかの出血が予想される 。
- は、大動脈を公開する解剖学的右サイドに肺と心臓をプッシュします。大動脈は、ホワイト色に位置する容器の脊柱に隣接して 。
- (後に大動脈アーチ) 大動脈をピンチし、大動脈を鉗子で保持しながら最初の切開する外科はさみを使用する鉗子を使用します。大動脈を切断時に胸腔内がすぐに血でいっぱい、その血液凝固する前に大動脈を取得するすぐに動作するが重要です 。
- 大動脈を保持し、脊柱から大動脈から下を優しく皮使用鉗子。プルはさらに切開することがなく肋間動脈を断ちます。大動脈腹腔内に 2 つの枝に分かれるし、死体から大動脈を切断する前に、および/または組織の約 10 cm を取得します。尾側方向に下大動脈のセクションへのアクセスを得るために必要な場合は、ダイヤフラムをプッシュします
。 注: は、強烈な力を引き裂くことを引き起こすので、大動脈を優しくはがします。大動脈涙が、数秒間の血液凝固を許可する、ペーパー タオルを使用して凝固血液を削除する残りの大動脈の可視性を許可します 。
- 大動脈が冷たいハンクの 10 mL と 15 mL チューブ、' s 1% ペニシリン/ストレプトマイシン (P/S) を添加したバランスの取れた塩ソリューション (HBSS)。氷のチューブを維持
注: 大動脈組織が氷の上の 1-2 時間続くことができますが、それをできるだけ早く処理することをお勧めします 。
- 滅菌バイオ キャビネット (BSC) の大動脈リング アッセイ培地を準備します。
- 血管内皮成長培地 (EGM) 2% 胎仔ウシ血清 (FBS) があり、1% ゲンタマイシンと成長要因 (材料の表 を参照) を添加した内皮細胞基本培地 (EBM) の 500 mL をフィルターろ過装置を使用しての準備。37 でビードまたは水浴にフィルター選択されたメディアの 50 mL を配置 ° C
- 100 mL をフィルター処理する別のろ過装置を使用して 2 %fbs と 1% を添加した EBM の P/S を準備、EBM 2 %fbs (EBM FBS) し、4 で保存 ° C
- コート 12 ウェル培養プレート底面の膜抽出 (BME) との氷の上の作業中。
- (大きな氷のパックやトレイ) 冷たい表面上 12 ウェル プレートの場所。200 μ L/ウェルたて解凍 BME を使用してのピペット チップを冷蔵し、均一なコーティングをように BME を渦を追加します。すぐに、BME の不均一な重合を避けるため作業
。 注: 一般的な大動脈切除 20 大動脈リングが得られます。大動脈リング アッセイ間の可変性を考慮するには、治療グループごとの少なくとも 3 つの大動脈リング アッセイをセットアップし、コントロールが含まれます。治療グループごと 6 リングお勧めソースを許可する場合 。
- 加湿インキュベーター (95% 相対湿度、37 ° C、5% CO 2; 以下加湿インキュベーターのすべてのステップに適用されますこれらの条件) にコーティング プレートを配置 30 分場所 1,000 μ L ピペット チップは-20 ° C、1.5.3 のステップにします
。 注意: 基底膜抽出ストック濃度で使用されますが、その一貫性と剛性厳密にによって制御されます重合時間。すべての緯線と独立した実験の正確な同じ重合時間を維持することを確認します 。
- (大きな氷のパックやトレイ) 冷たい表面上 12 ウェル プレートの場所。200 μ L/ウェルたて解凍 BME を使用してのピペット チップを冷蔵し、均一なコーティングをように BME を渦を追加します。すぐに、BME の不均一な重合を避けるため作業
- 均一リングに大動脈をセクションします。
- 15 mL チューブから大動脈を取るし、10 ml の 1% を添加した新鮮な HBSS の 10 cm 皿に配置 P/s.
- は、慎重に別の余分な結合組織、脂肪組織、肋間動脈の残りの枝のメスが大動脈に接続して使用するのに鉗子の 2 つのセットを使用します。これは、残存組織の異なるレベルに基づくリング ユニット間の可変性を軽減されます。任意の残留凝固中に大動脈から血液削除します 。
- は、正確に 1-2 mm 滅菌メスや鉗子を用いた大動脈の広いセクションをカット 10 cm 皿 [ルーラーまたはグリッドを配置します。ユニット間の可変性を減らすためにできるだけ正確なセクションをカットします 。
- BME に大動脈リングを埋め込む
。 注: BME 重合孵化前に大動脈リングの断面を完了していない場合、加湿インキュベーターからコーティング プレートを削除し、重合を終了する各ウェルに 100 μ L の EBM を追加します。正確なタイミングは、BME の過剰の重合が内皮細胞ネットワークの開発と細胞の移行を妨げる可能性がある重要です。大動脈リングの準備が、井戸から EBM を削除し、1.5.2 のステップから続行します。- 加湿インキュベーターからコーティング BME 井戸を外し、BSC に戻ります 。
- は慎重に鉗子で大動脈の個々 のリングをピックアップし、各 BME コーティングも真ん中に 1 つを置きます。残り大動脈リングの繰り返し
。 注意: 大動脈リングと共に転送メディア保管すべき重合の不規則性を避けるために最小限 。
- 使用冷却 (-20 ° C) 1,000 μ L ピペット チップ各大動脈リング上に BME の 300 μ L を追加し、よく周りの BME を均等に分散します 。
- 30 分の加湿のインキュベーターに埋め込まれた大動脈リングを返す
- 加湿インキュベーターから埋め込まれた大動脈リング プレートを削除し、徐々 にピペットを配置することによって EGM (準備で暖められたステップ 1.2.1) の 1,000 μ L はよく文化の壁にヒントを追加します
。 注: BME にメディアを直接ピペッティング重合 BME を中断でき連続内皮細胞ネットワークの開発を妨げます。可能な場合は、適切なマルチ チャンネル ピペットを使用します 。
- 次の 24 h、EGM の 1,000 μ L を削除し、EBM FBS も文化の側に対してゆっくりとピペッティングで再度 1.2.2 の手順で準備の 1,000 μ L で置き換えます 。
- 500 μ L 新鮮な EBM FBS (37 ° C) のすべての 48 h. EBM FBS の 500 μ L を置き換えることによって大動脈リング アッセイを維持
注: 参照秒ション 2 大動脈リング アッセイ確立として同じ日に MSC 文化の展開を開始します。これが準備を整える MSCs 培養内皮細胞のネットワークが準備ができているとき 。
- 大動脈リング アッセイ内皮細胞ネットワークの開発を追跡する明視野顕微鏡を使用して (ネットワークの最適な開発のための参照として 図 1 を参照)。内皮細胞ネットワークの側面は 図 2 に示すように、大動脈リング アッセイ MSC 共培養 (セクション 3) の設定に進みます。手順 4.1 内皮細胞ネットワークをイメージングの詳細についてを参照してください 。
2。組織培養
- 組織培養メディアの貯蔵液を準備します。
- 文化 FTM HUCPVCs (以前に確立された、n ≥ 各 3 系統独立) 30 と 10 %fbs と 1% を添加したアルファ MEM で市販 BMSCs P/s.
- 0.2 μ m 孔サイズ フィルター ボトルを使用してメディアを滅菌します 。
- までの 3 週間の 4 ° C で準備されたメディア ソリューションを格納します 。
- 加湿インキュベーターと位相差顕微鏡による決定 70-80% の confluency に通路で FTM HUCPVC の維持とボーマンの文化。細胞培養用ディッシュのサイズのためのメディアの使用適切なボリュームを (すなわち 10 cm 皿に 10 mL) 使用。これらの培養条件を維持すると、MSCs を継を使用します 。
- 分離継の MSC 単分子膜または大動脈リング アッセイ MSC 解離酵素液 (4 mL/10 cm 皿) を使用して共培養し 3 分明視野顕微鏡を用いた細胞の確認剥離加湿インキュベーターで孵化させなさい; インキュベートさらに 1-2 分必要な場合に 。
- 15 mL チューブと 400 x g で 5 分間遠心分離に解離細胞を転送
- 細胞ペレットを乱すことがなく、上清を吸引し、細胞カウンターを使用してカウントするため適切な培養基 (アルファ MEM 大動脈リング分析/MSC 共培養の細胞または EBM FBS を継の完全なメディア) の 1 mL の細胞を再懸濁します 。
3。大動脈リング分析/MSC 共培養の準備
- シード 10 4 MSCs それぞれに埋め込まれた大動脈リング (9,000 のセル/cm 2/12 ウェル プレート)。実行可能で、譲渡の蛍光色素を MSCs を染色前大動脈リング試金の数に基づいて。コントロール グループの MSCs なし大動脈リングの少なくとも 3 つの井戸の維持管理します。
- 10 5/mL の MSCs EBM FBS メディアの汚れは、実行可能な 2.5 μ L を追加、非譲渡蛍光染料/mL メディア (5 μ M) 15 mL チューブと 30 分の加湿器の中の場所には優しく孵化の途中の管をミックスします 。
- 次の 30 分培養陽性細胞に新鮮な EBM FBS の 1 ボリュームを追加し、400 x g で 5 分間で回転
- は、上澄みを除去し、再 EBM FBS メディアの 1 mL の細胞ペレットを中断します。蛍光顕微鏡を用いた MSCs の成功した染色確認します 。
- 加湿インキュベーターから大動脈リング含むプレートを外し、各ウェルから EBM FBS の 500 μ L を削除します 。
- は、内皮細胞のネットワークの周りに均等にピペッティングして 500 μ L EBM FBS の各埋め込み大動脈リングの上の 10 の 4 MSCs を慎重にシードします。培養プレートを優しく揺することによって均一な配分を確認します。
- 大動脈リング分析/MSC 共培養上のメディアの容量が 1,000 μ L であることを確認する追加 EBM FBS を追加します 。
- 大動脈リング試金の蛍光標識 MSCs を可視化する蛍光顕微鏡を使用します
4 顕微鏡
- 大動脈リング分析/MSC 前にラットの血管内皮ネットワークのイメージを使用して明視野顕微鏡共同培養内皮細胞ネットワークのプロパティ (たとえば、ネットワークのベースライン (0 日) 測定。ネットワーク ループ長さ)。4 象限領域内の内皮細胞ネットワークの最も遠いセクションに大動脈リングからウェルあたりをイメージします。
次の大動脈リング
- イメージ、大動脈リング ネットワーク分析/MSC は 3、5、7 日間で共培養します。内皮細胞ネットワークにおける MSC の効果を定量化するこれらのイメージを使用します 。
- 大動脈リング分析済みラベル MSCs をイメージさせる蛍光顕微鏡を使用します。
- 次 24 h 大動脈リング分析/MSC の共培養では、蛍光顕微鏡を使用して、MSC ホーミング, 伸び, 内皮細胞のネットワークとの統合を視覚化します。両方の細胞の種類の共局在を観察する内皮細胞の明視野画像で MSCs の蛍光画像を重複します 。
- 画像近位大動脈リング組織開発の内皮ネットワーク内でローカライズ MSCs と遠位大動脈リング組織 ( 図 2) のネットワークを新しく開発内でローカライズ MSCs 。
5。流れの Cytometry と qPCR
- リング大動脈内皮細胞ネットワークを分離する前に 1 日解凍冷凍当期 4 ° c O/N. セクション 5.3 はフローサイトメトリーと qPCR のどちらでも同じです 。
- 50 mL 37 ° C のビーズや水のお風呂で 0.5% トリプシンの当期の 50 mL をウォームします 。
- は、大動脈リング分析/MSC 共培養から解析のためのセルを取得します。
- 後 1 週、大動脈リング分析/MSC の共同文化の文化メディアを削除し、1 mL の Phosphate-Buffered 生理食塩水 (PBS) を外し、3 分もそれぞれにゆっくりとを追加。この洗浄をさらに 2 回繰り返します 。
- 追加 800 μ L の各ウェルに当期で加温し、15 分の加湿のインキュベーターで孵化させなさい
- 加湿インキュベーターからプレートを削除し BME で分割する (5-10 x) をピペッティングによる当期を中断し、別の 15 mL の管に各ウェルの内容を転送します 。 ない残留まで新鮮に予め温めておいた当期で再び
- 繰り返しステップ 5.3.3 BME も文化で観察されます。3% を添加した PBS の 1 ボリュームを追加残高当期細胞懸濁液、当期を不活化します。ピペット チップを用いた細胞懸濁液に浮かぶ大動脈リングを削除します 。
- (400 g) x 細胞懸濁液をスピンは、5 分削除上清、慎重に 15 mL チューブに細胞懸濁液 3 mL を残しています
。 注: 明らかに、固体ペレットが表示されないが、セルと BME がある 。
- は、細胞懸濁液と積極的に (5-10 x ピペッティングで) を再停止しなさい細胞に prewarmed 0.5% トリプシンの 3 mL を追加します。10 分間の加湿のインキュベーターでトリプシンの携帯ソリューションを孵化させなさい
- 加湿インキュベーターからトリプシン細胞懸濁液を削除し、3 %fbs と再懸濁します補われる PBS の 6 mL を追加いくつかのティムes。400 x g で 5 分間で細胞懸濁液をスピン
- 慎重にチューブに細胞ペレットを残してすべての上澄みを除去し、1 ml の PBS の 3% を添加した細胞を再懸濁します各管内 FBS 。
- は、70 μ m の細胞のストレーナーを使用して細胞懸濁液から集計されたセルと残留 BME を削除する 1 mL 細胞の懸濁液をフィルター処理します。細胞カウンターを使用して細胞懸濁液の 1 mL のセルをカウントします 。
- フローサイトメトリー用セルを準備します。
- 加温、細胞懸濁液 (3% を添加した 200 μ L の PBS で 10 の 5 セル FBS) fluorophore 共役 (FITC または APC) 一次抗体と (TRA-1 - 85 - CD146、CD31) 濃度 = 1:40) 4 ° c で 30 分間、光から保護します
。 注: MSCs のフローサイトメトリー香港 ら、2013年 28 によって最適化を行った。10,000 のセルの最小測定値を正確に必要です 。
- 2 mL の PBS 3 %fbs と遠心分離機 (400 × g、5 分) を添加した細胞を再懸濁します次の 30 分インキュベーションします 。
- 4 ° c 1 時間以内フローサイトメトリー (少なくとも 1 x 10 の 4 イベント) による分析までの光から保護維持セル。ゲーティング戦略 補足図 1 を参照してください。アンチ-トラ-1-85 (APC) を使用して人間の MSCs を並べ替える (濃度: 1:40 0.5 %fbs/PBS) qPCR 解析のためのセル換散バッファーの 350 μ L にセルを並べ替えると
。 メモ: 分離細胞保存できる-80 ° C で将来 qPCR 解析まで 3 カ月 。
- 加温、細胞懸濁液 (3% を添加した 200 μ L の PBS で 10 の 5 セル FBS) fluorophore 共役 (FITC または APC) 一次抗体と (TRA-1 - 85 - CD146、CD31) 濃度 = 1:40) 4 ° c で 30 分間、光から保護します
- QPCR 分析用セルを準備します。
- 列に基づく RNA 分離キットを使用して分離細胞からの RNA を隔離し、RNA 濃度と品質を決定します 。
- RNA の 100 あたり最大 5 μ g から準備 cDNA μ L 逆転写酵素反応。RNA の収穫が少ない場合、中古増幅は手順 (< 10 ng/μ L)。100 未満の使用 ng の RNA の偽陰性率が高いことになります
。 注: cDNA テンプレート保存できるさらなる分析のための-20 ° C で 4 ヶ月 。
- は、遺伝子発現の変化を検出する血管新生式プロファイラー アレイを用いた qPCR を実行します。反応 (40 サイクル、60 ° C 温度の熱処理/拡張) あたり cDNA の 5 ng。未分化の MSC 由来 cDNA サンプルと比べた式のフォールドの変更を表現します。適切なネガティブ コントロール (大動脈リング無し人間 MSCs) を実行します 。
6。ネットワーク定量化次大動脈リング分析/MSC 共培養
- 血管新生アナライザー プラグイン 31 と共に ImageJ などイメージング ソフトウェアをダウンロードします 。
- 撮影内皮ネットワーク画像をインポートし、ソフトウェアを使用してを開きます 。
- 使用される顕微鏡の仕様に基づくイメージ スケールを変換します 。
- 放射状ネットワークの成長を測定する直線ツールを使用します 。
- 細胞カウンター ツールを使用して内皮細胞ネットワーク ループをカウント (少なくとも 4 つの側面のループを定量化する必要があります).
- ネットワーク プロパティの追加数量マスターのセグメントを分析する血管新生 Analyzer プラグインまたは他の同様のプラグインを使用して合計セグメントの長さは、合計ネットワーク エリア、ジャンクションの数。大動脈リング組織と偽肯定的な計算を避けるために空のスペースをあいまいにぼかしたマスク ツールを使用します 。
- 大動脈リング分析/MSC 共培養を次統計プログラムとグラフ内皮ネットワーク プロパティに値をコピーします 。
結果
大動脈リング/MSC 共培養法を確立するための作業フローの図は、図 1に示されています。主な手順を含める: ラット大動脈隔離区分し大動脈リングの埋め込み、監視内皮発芽およびネットワークの開発と最後にラベリング、MSCs を管理します。内皮細胞ネットワーク解析のタイムライン共培養期間ごとに実行可能な解析のウィンドウの概要: 日 1、5 & 7。追記は、点線のボックスで強調表示されます。
大動脈リング培養内皮細胞の構造的に異なる領域の同定は、明るいフィールド顕微鏡検査、大動脈リングは ECM (図 2) に埋め込まれた後の 3-5 d によって実行されます。非構造化領域 (図 2 a) は、高い細胞増殖が大動脈組織の直接の近傍で低構造組織の地域として特徴付けられます。開発した内皮細胞ネットワーク (図 2 b) は高い構造組織、ネットワークを完全に確立や MSCs の追加前に、閉じたループの主にで構成される地域を参照してください。開発ネットワーク (図 2) は、内皮の文化部の遠位にあります。これらは、血管内皮細胞の遊走と新しいネットワーク構造形式として伸びのサイトです。上記 3 地域特定されやすい実験を通して、MSCs が共同の文化に家を参照するときに使用されます。Prelabelled MSCs は、すべての 3 つのネットワーク セグメントを開発しているとき大動脈リング アッセイとの共培養する必要があります。次の MSC 共培養内皮細胞ネットワークの定量化は、先進および発展途上のネットワーク (図 2、白枠) の地域を含めます。
蛍光顕微鏡は、MSC の移行、統合、大動脈リング MSC の培養分析 (図 3) で内皮細胞ネットワークの開発と共に形態の定性的な測定が可能です。MSCs が実行可能で、細胞質の蛍光で標識は、共培養への投与後 24 h をイメージしました。FTM HUCPVCs 開発内皮細胞ネットワークの周辺で発見された、細長い細胞の形態を表示され、内皮細胞ネットワーク (図 3 a, B) の一層の発展に貢献しました。比較のため BMSCs は内皮細胞 (図 3D) のより少ない相互作用を表示しながら発展途上のネットワークに所属。72 h で高倍率画像 FTM HUCPVCs に高いカバレッジと共培養内皮細胞ネットワーク (図 3E 限られた統合を球状の形態を呈した BMSCs 中内皮細胞ネットワークの安定化が維持されることを示した , F)。観測の違いが人間 MSC タイプの定性的な機能的な違いを明確に示します。重要なホーミングと内皮統合プロパティを持つ治療候補細胞型 (図 3 a、B & E) 限られた内皮細胞ネットワークの統合と豊胸とセル型に比較して際立って機能 (図 3、D & F)。
さらに鋼管における内皮細胞と FTM HUCPVCs の物理的な相互作用を分析する高倍率蛍光顕微鏡画像に買収されました。無染色の内皮細胞と付着済みラベルの FTM HUCPVCs (図 4 a緑) が表示されます (図 4 a白矢印)。FTM の HUCPVCs は、ノード間の軸と添付ファイル表面として血管内皮細胞に構造サポートを提供するために発見されました。大動脈リング内皮細胞ネットワークは、あらかじめラベル (図 4 b赤) を染色 MSC と同様に実行可能な蛍光体を使用しても可能です。二重染色共培養、蛍光顕微鏡に協力と支持細胞の挙動の観測を強化 2 つのセル型の間の細長い癒着が明らかにしました。
内皮細胞ネットワーク構造特性の定量化は、MSC 共培養 (図 5) の 5 日間で行われました。制服の象限は、全体の大動脈リング内皮ネットワーク (図 2、白枠) 内での測定に定義されました。遠い遠位閉じたループ (半径) に大動脈リングによって最初の近位の閉じたネットワーク ループからの距離として平均ネットワークの成長を求めた (図 5 a)。大動脈リング MSC 共培養の平均ネットワークの成長は次のとおり: FTM HUCPVCs (2.98 ± 0.3 mm) と BMSCs (1.5 デジタルフラットネス mm)。未処理の内皮細胞ネットワークは、平均半径 1.9 ± 0.1 mm を開発しました。MSC 治療群の統計の比較は、FTM HUCPVCs が BMSCs と未処理のネットワーク (p ≤0.001) と比較して有意のネットワークの拡大に寄与していることを示した。BMSC 共同文化 (p ≤0.01) を含んでいるよりもっと大きな発展を未処理の内皮細胞ネットワーク (図 5 b)。
ループ数の合計は、各象限儀の計算され、平均合計ループ形成 (図 5) で表されます。閉じたループが合計の平均数は次のとおり: FTM HUCPVC 処理共培養 (81 ± 7) BMSCs (26 ± 3) リング (55 ± 7) を放置し、。FTM HUCPVCs BMSCs (p ≤0.01) と未処理のネットワーク (p ≤0.01) と比較して有意の内皮ループ形成に貢献しました。ボーマン共培養結果少ない内皮ループ未処理ネットワーク (p ≤0.01) と比較した場合のネットワークします。この数量は、内皮細胞ネットワークの開発 (FTM HUCPVC) に有意な正の効果を持つセルの種類および内皮細胞ネットワークを損なう可能性がありますもするセル型を識別します。大幅に増加したネットワークの開発が内皮のネットワーク上で MSC のカバレッジとの相関が観察された注意されるべきです。それは、直接的な相互作用が MSCs の支持機能を実行するための重要なことを示唆します。
大動脈リング共培養施設の可能な落とし穴は、図 6で表されます。BME の不十分または不均一な重合は、成功した内皮細胞ネットワークの開発を妨げることが問題です。正確に 30 分の BME 重合をタイミングとポリマーを中断させることがなくメディアを転送するそのままで機能的な BME 相 (図 6 a) が保証されます。長時間インキュベーション時間の MSCs を染色し、長時間用ペレットに MSCs を許可する細胞の形態と共培養の表現型があります。図 5Bに示します FTM HUCPVCs 1 h のステンド グラスし、許可1 共培養前に h 用ペレット、両方は最適タイミングをされています。FTM HUCPVCs 内皮細胞ネットワークのサイトへの好みを表示しないと、ネットワーク全体に散らばっています。不適切 FTM HUCPVCs する細胞 (図 3) を処理正しく比較する、丸みを帯びた細胞の形態と限られた細胞間相互作用血管内皮細胞 (図 6 b) 不適切セルに表示。最後に、解剖の日に大動脈リング アッセイを確立できない場合、大動脈格納できる-80 ° c 10% ジメチルスルホキシド (DMSO) と 10% を添加した EGM C メディアで政府短期証券。新鮮な組織と比較して解凍大動脈リングを適用するとき、内皮細胞ネットワークの開発は長い 1-3 d をかかることがありますが、内皮細胞のネットワークは MSC の培養の確立 (図 6) のために十分になります。
大動脈リング共培養評価の代替手続として埋め込まれて BME 大動脈リングの細胞分画を抽出、フローサイトメトリー (補足図 1)。人間の特定のマーカー共同文化を含んでいる FTM HUCPVC からトラ-1-85 (補足図 1 a B、y 軸) 肯定的な細胞集団は人間の MSCs として同定されました。血管内皮細胞マーカー CD31 (補足図 1 a) の低発現と (補足図 1 b) の周皮細胞マーカー CD146 のひと特異的マーカー陽性細胞集団内に、高発現を示した共同ラベリングします。このような評価することができます最終的な肺浸潤と血管内皮細胞との相互作用による MSCs の血統で、方針の変更を解読し、詳細テスト細胞型について貴重な情報を提供します。FC の分析のための細胞の十分な番号を取得するために同じ実験群の並列井戸から抽出したセルを結合できます。それは実行可能な染料を連想させる蛍光抗体関連 fluorophores の信号と干渉しないようにフローサイトメトリー解析のため大動脈リングを含む非プレ ステンド MSC の使用を検討することが重要です。それ以外の場合否定的なゲートは考慮済み染色細胞蛍光を取る必要があります。
人間 MSCs 抽出されたフォーム大動脈リング共培養 (培養 7 日目) の並べ替え我々 人間の細胞表面マーカー抗体 (トラ-1-85) を使用します。FTM HUCPVCs および BMSCs 大動脈リング アッセイから回復が血管新生遺伝子の発現をテストする qPCR 解析処理されました。市販 qPCR アレイを使用する 3 つの大動脈リング共培養は 84 ひと成長因子遺伝子 (補足図 2 a) の発現を定量化する遺伝物質の十分な量を用意されています。予備的な結果は、FTM HUCPVCs、BMSCs 表現同等レベル (補足図 2 b) キー分泌される血管新生因子であることを示します。アッセイの異なったセルタイプ発現量を比較すると、ほか拡張文化メディアからメディアを考慮すべき分析に基づく EBM にセルを転送する効果。高い表現型または遺伝的可塑性の細胞を使用している場合、EBM メディア--- 大動脈組織なしで人間の MSCs の比較する制御グループは評価に含める必要があります。
MSCs の血管新生因子の発現の類似性は、彼らのネットワークの増強に差は異なる傍分泌活動の結果ではない示唆しています。これは、内皮細胞のネットワークの開発を促進するために増加した直接細胞間相互作用が表示されます以前の観測と一致。

図 1: 大動脈リング測定セットアップの新たな応用の模式図。
セットアップの主な手順と大動脈リング アッセイと MSC 共培養解析はソリッド ボックスに記載されてし、追記、点線のボックスで説明されています。スケール バー = 1,000 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 2: 大動脈リング ネットワーク分析の代表イメージです。
内皮細胞ネットワークは構造の違いに基づいて 3 つの同心円状の領域に分けられる: 大動脈リング組織 (A)、内皮細胞ネットワークの開発/構造 (B)、および開発ネットワークに近接非構造化領域前のヴィヴォの組織文化 (C) の周辺に位置しています。放射状ネットワーク成長とループ カウントの制服四半円点は、(B) 開発した内皮細胞ネットワーク内で定義されます。x: 制服の腹部に血管内皮の閉じたループがカウントされます。スケール バー = 250 μ m.この図の拡大版を表示するのにはここをクリックしてください。
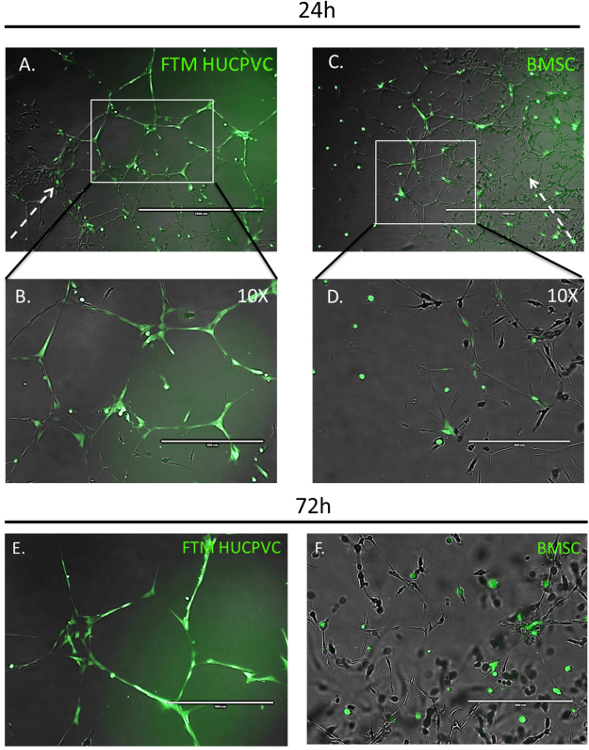
図 3: 蛍光イメージングのネットワーク地域に依存した統合の人間 MSCs、大動脈リング分析では次の 24 & 72 h。
Prestained (緑) FTM HUCPVCs と BMSCs 発展途上の大動脈リング内皮の管ネットワークに追加されました。MSC 共培養表示 ECM と周辺開発内皮ネットワーク (A) に家を通って移行 FTM HUCPVCs 確立した後 24 h を撮影した蛍光顕微鏡画像。高倍率の図 (B) の内皮のネットワークと緊密に連絡中の FTM HUCPVCs の細長い形態を表示します。少ない BMSCs 周辺開発ネットワーク (C) にオブザーバブルを優先しない ECM と内皮細胞ネットワークにホームを処理します。BMSCs 球状細胞の形態 (D) を表示します。
次の 72 時間培養 (E, F) のラット大動脈リング アッセイ prestained MSCs の高倍率蛍光顕微鏡画像。FTM の HUCPVCS は、両方のネットワーク ・ ノードと尿細管 (E) 血管内皮細胞 (固体白い矢印) との直接の細胞間相互作用を介して内皮カバレッジを表示しながら細長い形態を提供します。BMSCs 内皮ネットワーク ノード (F) にクラスター化された球状細胞の形態を維持します。ブロークン アローは、大動脈リング組織から血管内皮ネットワーク成長の方向を表します。C: スケール バー = 1,000 μ m B、d: スケールバー = 400 μ m.この図の拡大版を表示するのにはここをクリックしてください。
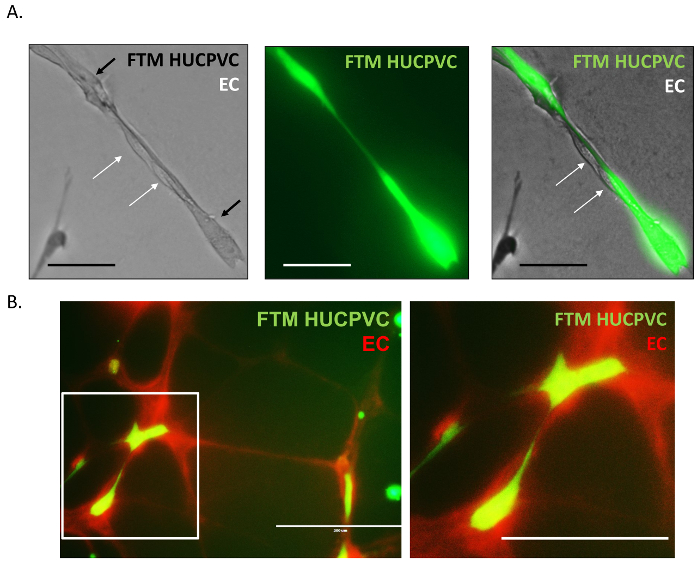
図 4: 周皮細胞内皮細胞の物理的相互作用の蛍光顕微鏡像を高倍率。
無染色の内皮細胞は、管状ネットワーク (A) で染色済みの FTM HUCPVCs を接続する連続的な突起に関連付けられていました。染色済みの FTM HUCPVCs (FTM、緑) と事前にステンド グラス内皮ネットワーク (EC、赤) の蛍光画像を示す相互作用さた内皮細胞、周皮細胞の相互作用 (B)。A: スケールバー = 100 μ m b: スケール バー = 200 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 5: 共培養の確立の後の MSC 治療ネットワーク成長の定量化のグループの 5 D。
低倍率位相コントラスト顕微鏡画像は、大動脈リング治療グループからメジャー ネットワーク成長と発展 (A) に運ばれました。散乱の矢印は、ネットワークの成長方向を示しています。スケール バー = 250 μ m. 顕微鏡画像を用いて平均ネットワークの拡大を含む、ネットワーク プロパティを定量化し、ネットワーク ループ形成 1 つ分析作業領域を意味します。BMSC 共培養と未処理のネットワーク (p ≤0.001) と比較して大きいネットワーク成長に貢献した FTM HUCPVCs (B)。一方通行 ANOVA を使用してp値の計算p <0.0001 テューキーを使用して投稿テスト (N = 3)。少なくとも 4 つの閉じた辺ネットワーク ループを定量した (C)。FTM HUCPVC 共同開発の大きいネットワーク ループ BMSC 共培養 (p ≤0.001) と未処理のネットワーク (p ≤0.01) と比較した場合の文化します。P値は p であるため一方通行 ANOVA を使用して求めた < 0.0001 テューキー Post テストを使用して (N = 3)。内皮細胞ネットワークの 4 つのフィールドの平均値を定量化されました。スケール バー = 250 μ m。一対比較 * p 0.05 = * * = p ≤0.01 * * * p ≤0.001 を =。この図の拡大版を表示するのにはここをクリックしてください。

図 6: 大動脈リング アッセイの確立でエラーが発生します。
一貫性のない、壊れた血管内皮ネットワーク (A) 大動脈リング不完全な BME 重合に埋め込まれている可能性があります。FTM HUCPVCs 染色と共培養、収量最小限ホーミングと血管内皮細胞の相互作用 (B) を確立する間の時間ギャップを長時間染色します。ラット大動脈内皮細胞ネットワークは-80 ° C に格納され、大動脈リング試金 (C) のため解凍。A: スケール バー = 250 μ m B、c: スケール バー = 400 μ m.この図の拡大版を表示するのにはここをクリックしてください。
補足図 1: フロー大動脈リング共培養から抽出した人間 FTM HUCPVCs のフローサイトメトリー解析です。
大動脈リング文化の細胞の一部分が分離・ フローサイトメトリー解析のための処理します。Fluorophore 共役人間の特定の細胞表面マーカー (トラ-1-85、APC) 抗体は、内皮マーカー (CD31、FITC、(A)) または周皮細胞マーカー (CD146、FITC、(B)) の特異抗体との組み合わせで適用されました。低陽性血管内皮マーカー CD31 (A ・第 2 四半期) と (B, Q6) 高正周皮細胞マーカー CD146 の人間のマーカー (y 軸) の肯定的な細胞集団をテストしました。これは FTM HUCPVCs 大動脈リング共培養で血管周囲のセル プロパティを維持し、内皮細胞の表現型を開発していないことを示唆しています。プロット上の象限は、マッチング応用の一次抗体アイソタイプ コントロールを使用して定義されています。このファイルをダウンロードするここをクリックしてください。
主要血管新生遺伝子の補足図 2: 量的な PCR 解析。
FTM HUCPVCs と次の大動脈リング試金 (A) で 1 週間培養 BMSCs による主要血管新生遺伝子と同様の遺伝子発現。代表の CT 値は、表 (B) に示します。このファイルをダウンロードするここをクリックしてください。
ディスカッション
成功した大動脈リング アッセイ MSC の培養実験を設定するのにはいくつかの重要な段階があります。まず、最も重要なステップを分離し、大動脈を切断するときは、: 1) 大動脈; の胸部のセグメントのみを取得2) 慎重に分岐血管、結合および脂肪組織を削除して。3) 切削各測定間変動を制限する大動脈 (~ 1 mm) のセクションでさえ。第二に、大動脈リングの BME へ埋め込み成功は、この試金のため重要です。BME が完全に重合または均等に重合した場合、BME に埋め込まれた大動脈リングは内皮の発芽を開始することはできませんまたは不連続な内皮細胞ネットワークを開発可能性があります。BME 重合が十分ではない場合、アッセイは、定量化の信頼性がありません。第三に、完全な内皮因子濃縮のメディアが発芽を開始する大動脈のリングのための栄養を提供するために必要です。大動脈リング リングは、容器が発芽を開始した後、次の重要な今後のステップはテストするセルの種類を含みます。このため、MSCs は正常に事前に染色されたおよび発芽の大動脈リングを管理すること必要があります。このセクションの 2 つの重要な手順があります。1) 播種のための適切な日付を選択する: ネットワーク発展途上の段階にあるべきし、も、文化の高いカバレッジが届かない。MSCs はタイムリーに管理されていない、ネットワークの開発に、MSCs の純効果を定量化するは困難になります。2) 添加する前に MSCs を予加工: 凝集、MSCs が過剰染色時間の広範な期間のペレットに残るとホーミングと内皮のネットワーク内での統合を損なうが発生します。最後に、ネットワークを定量化できる容易に達成する場合は適切なコントロールを用意しています。大動脈自体は、発芽、サポートしますが、MSCs が本稿で説明したようにさまざまなネットワーク構造のより大きいネットワークの開発を促進するため、MSCs なし大動脈リングは内皮のネットワークを開発します。内皮細胞ネットワークの定量化は、実行される少なくとも 5 d 以下確立する共培養をする必要があります。クローズド システムによる血管新生の応答は一時的なものと内皮ネットワーク開始約 7 d に続く変性します。観察の目的が内皮細胞ネットワークの開発のテスト細胞型効果を評価する場合、共培養の最初の週内に画像を取得する必要があります。
現在試金の可能な変更は、プライマリ ヒト組織を利用をすることができます。ラット大動脈の 1 mm セクション共培養のための 1 つのユニットとして、ひと大動脈は非常に一貫した測定部の数が多いを提供できます。にもかかわらず、実行可能な人間の主要な組織の非常に制限された可用性、高出力は、潜在的な可能性を示唆しています。大規模な評価の分析を開発するとき事前分析を形成、テスト用電池が使用可能になるまでのコンポーネントを格納する考えられます。BME コーティングは組織培養プレート上に作製したし、長期間の冷凍、乾燥形式で格納できます。また、我々 は、私たちの研究室でテストした、ラット大動脈組織を冷凍し、こうして作る作業より便利なアッセイの最も重要な要素とそれ以降のアプリケーションに格納できます。
大動脈リング試金の多くの利点にもかかわらず、表示されるいくつかの制限があります。まず、試金文化の確立は挑戦することができます。現在の形で日常的アプリケーション マニュアルの十分なスキルが必要です。オペレーターのエラーは、可変性を導入できます。それはネットワークの成長でミラーリングできるし、投与細胞の影響とその結果重要な血管新生プロパティを確実に評価する困難にすることができます。しかし、これらの課題は、他の方法のそれらと比較されたときより小さくない場合と同様、短期および生体内の実験ではなく経済必要な研修期間が便利にすることができます。第二に、埋め込み前のヴィヴォ大動脈組織および細胞の投与の時間をマーク初期ネットワークの開発の間のラグ期間はユーザーが考慮する必要があります。第三に、内皮細胞のネットワークのプロパティの定量化が肥大成長を含む特徴パラメーターを割り当てることで解決することができます、チューブの長さとネットワークのメッシュ寸法に時間がかかることができます。これは、一貫性と信頼性の定量化に必要な時間を減らすことができるイメージ (イメージ J) のコンピューター支援分析を使用して実行できます。第四に、各測定間変動は、動物組織ソースとオペレーターによる処理でわずかな矛盾の結果として発生します。我々 は、この課題を効果的に克服することができることが分かったトリプリケート各治療群の設定によって定量化なる統計的信頼性の高い。最後を抽出し、人間の細胞と後の試金の分析のためのラットの起源の並べ替えは挑戦することができます。ただし、当期、細胞回復ソリューションなど特定の蛋白分解酵素は、肺浸潤や遺伝子発現解析のための細胞を回復に適用できます。
この単一内皮細胞型の文化または動物システムをライブする既存のメソッドと比較して、アッセイを使用して前のヴィヴォ大動脈組織と BME の組み合わせを提示しました。このセットアップは、細胞療法の候補者の血管新生特性の解明質的および量的なデータを得るためにユーザーをできます。BME と前のヴィヴォ多細胞組織を組み合わせた治療細胞型はローカル管理後発生可能性のある微小環境を密接に模倣のプロパティを提供します。大量の平行線や培養条件を閉じる制御の可能性があるため、オペレーターは変数と矛盾を排除する中、信頼性の高い評価のために必要な要素が含まれているシステムで提供されます。動物モデル。さらに、評価がより実現可能なコストと繰り返し動物の手続きの必要性が減るためです。単一セルの試金およびほとんどの動物モデルの要因と免疫細胞療法の候補者の臨床応用に陥ることによって導入される変数を欠いています。炎症性応答を変更したがって、注入された物質の治療効果と血管新生や細胞を正確に定量化することはできません。大動脈リング アッセイは、アッセイの測定を妨げる多くの炎症性成分を除外します。しかし、血管の開発32の重要なプレーヤーは、マクロファージが含まれています。内皮細胞ネットワークと prestained のひと細胞の両方を容易に識別で MSC 分泌される炎症性サイトカインの効果と免疫システムの細胞も要素簡単に観察できるこのアッセイを用いたします。
アッセイ条件と再現性実験のセットアップをユーザーが高い制御システムにさらに要素を導入できます。まず、大動脈リング アッセイは、損傷モデルとして使用できます。大動脈リングおよび内皮発芽の埋め込み、次の試金は、虚血性損傷、炎症性因子 (TNF α) や細菌リポポリサッカライド (LPS)、後で血管新生の可能な救済を決定する MSC 加算に導入されること次の傷害応答。第二の可能なメカニズムを解明するため、MSCs に貢献する方法新生応答、neutraliジング抗体を活用して、細胞間相互作用の重要な潜在的な受容体を沈黙させることできます。最後に、MSCs のパラクリン プロパティを調べるためには、大動脈リング アッセイはパラクリン特性に血管新生応答がフォーカスの細胞間相互作用の影響を除外する transwell システムでセットアップをすることができます。
要約すると、大動脈リング アッセイは、能力を評価することが、処理、ECM を仲介する細胞療法の候補者の効力、血管新生における地域への移行し物理的な接触を通して容器開発に貢献。血管新生アッセイ前のヴィヴォ大動脈リングは、候補細胞再生療法のための貴重な定量的なプレ ・ スクリーニング ツールとして開発される可能性があります。
開示事項
博士クリフォード ・ l ・ Librach は、特許の共同保有者:最初の学期臍帯組織由来細胞の分離とファージのメソッド。カナダとオーストラリアで与えられます。
謝辞
著者らは次のスタッフ メンバーに感謝し、研究の人員: Andrée ゴーティエ ・ フィッシャー、マシュー Librach、ターニャ · バレット、Tharsan Velauthapillai、サラ Laronde。
資料
| Name | Company | Catalog Number | Comments |
| Alpha-MEM | Gibco | 12571071 | For FTM HUCPVC and BMSC culture media. |
| APC-conjugated anti human TRA-1-85 | R&D Systems | FAB3195A | Human-specific cell marker for flow cytometry and cell sorting |
| Basal membrane extract (BME) (Matrigel) | Corning | 354234 | For aorta embedding |
| Bullet-kit | Lonza | CC-3162 | Includes: Gentamicin/Amphotericin-B (GA)human Epidermal Growth Factor (hEGF); Vascular Endothelial Growth Factor (VEGF); R3- Insulin-like Growth Factor-1 (R3-IGF-1); Ascorbic Acid; Hydrocortisone; human Fibroblast Growth Factor-Beta (hFGF-β); Heparin; Fetal Bovine Serum (FBS). Required to prepare EGM |
| CellTracker Green CMFDA Dye | Thermo-fisher | C2925 | For staining MSCs, green is picked up optimally by MSCs |
| CKX53 Culture Microscope | Olympus | For bright-field imaging of endothelial network development | |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting for MSC culture, flow cytometry and qPCR |
| Dispase | StemCell technologies | 7923 | For dissociating aortic ring-MSC co-cultures (pre-warm at 37 °C) |
| Disposable sterile scalpels | VWR | 21909-654 | For sectioning aorta |
| Dulbecco's phosphate buffered saline | Sigma-Aldrich | D8537 | PBS. 1X, Without calcium chloride and magnesium chloride |
| Endothelial basal media (EBM) | Lonza | CC-3156 | Basal media required for culturing aortic ring assay-MSC co-cultures (warm at 37 °C before use). Required for EGM and EBM-FBS |
| Ethanol, 70%, Biotechnology Grade | VWR | 97064-768 | To sterilize surfaces |
| EVOS | Life Technologies | In-house fluorescent microscope to track MSC migration and integration | |
| Fetal bovine serum (FBS) (Hyclone) | GE Healthcare | SH3039603 | Serum component of cell culture medium |
| FITC-conjugated anti-CD31 antibody | BD | 558068 | Human endothelial marker for flow cytometry |
| FITC-conjugated anti-CD146antibody | BD | 560846 | Human pericyte marker for flow cytometry |
| Forceps | Almedic | 7727-A10-704 | For handing rat tissue. Can use any similar forceps |
| Hank's Balanced Salt Solution (HBSS) | Life Technologies | 14175-094 | 1X Without calcium chloride and magnesium chloride |
| HERAcell 150i CO2 Incubator | Thermo Fisher Scientific | 51026410 | For incubating cells |
| Human Angiogenesis RT2 profiler PCR array | Qiagen | PAHS-024Z | Human specific and includes primers for 84 genes involved in angiogenesis. Each well is 1 primer reaction |
| ImageJ | Open source image processing software. Require Angiogenesis analyzer plugin | ||
| LSR II | BD | UHN SickKids FC Facility. For flow cytometry. | |
| MoFlo Astrios | Beckman Coulter | UHN SickKids FC Facility. For cell sorting. | |
| Penicillin/streptomycin | Gibco | 15140122 | Antibiotic component to buffers and cell culture medium |
| RNeasy Mini Kit | Qiagen | 74104 | For RNA purification. Includes cell lysis buffer |
| RT2Easy First Strand Kit | Qiagen | 330421 | For preparation of cDNA for qPCR |
| RT2PreAMP cDNA Synthesis Kit | Qiagen | 330451 | Pre-amplification of cDNA if low-yield RNA |
| Surgical scissors | Fine Science Tools | 14059-11 | For cutting skin, muscle and aorta |
| Sterile gauze | VWR | 3084 | To dampen and sterilize chest fur |
| TrypleE | Thermo Fisher Scientific | 12605036 | MSC dissociation enzyme pre-warm at 37 °C |
| 0.2 μm pore filtration unit | Thermo Fisher Scientific | 566-0020 | To sterilize tissue culture media |
| 0.25% Trypsin/EDTA | Gibco | 25200056 | For cell dissociation, pre-warm at 37 °C |
| 10 cm tissue culture dishes | Corning | 25382-428 | For cleaning and sectioning aorta and MSC cell culture |
| 12 well-cell culture plates | Corning-Sigma Aldrich | CLS3513 | For setting up aortic ring assay-MSC co-cultures |
| 15 mL tube | BD Falcon | 352096 | For general tissue culture procedures |
| 70 μm cell strainer | Fisherbrand | 22363548 | To ensure a single cell suspension before flow cytometry or sorting |
参考文献
- Potente, M., Gerhardt, H., Carmeliet, P. Basic and therapeutic aspects of angiogenesis. Cell. 146 (6), 873-887 (2011).
- Hoeben, A., Landuyt, B., Highley, M. S., Wildiers, H., Van Oosterom, A. T., De Bruijn, E. A. Vascular endothelial growth factor and angiogenesis. Pharmacol Rev. 56 (4), 549-580 (2004).
- Khan, T. A., Sellke, F. W., Laham, R. J. Gene therapy progress and prospects: therapeutic angiogenesis for limb and myocardial ischemia. Gene Ther. 10 (4), 285-291 (2003).
- Gupta, R., Tongers, J., Losordo, D. W. Human studies of angiogenic gene therapy. Circ Res. 105 (8), 724-736 (2009).
- Chu, H., Wang, Y. Therapeutic angiogenesis: controlled delivery of angiogenic factors. Ther Deliv. 3 (6), 693-714 (2012).
- Cao, Y. Therapeutic angiogenesis for ischemic disorders: what is missing for clinical benefits?. Discov Med. 9 (46), 179-184 (2010).
- Said, S. S., Pickering, J. G., Mequanint, K. Advances in growth factor delivery for therapeutic angiogenesis. J Vasc Res. 50 (1), 35-35 (2013).
- Bergers, G., Song, S. The role of pericytes in blood-vessel formation and maintenance. Neuro Oncol. 7 (4), 452-464 (2005).
- Leeper, N. J., Hunter, A. L., Cooke, J. P. Stem cell therapy for vascular regeneration: adult, embryonic, and induced pluripotent stem cells. Circulation. 122 (5), 517-526 (2010).
- Sieveking, D. P., Ng, M. K. Cell therapies for therapeutic angiogenesis: back to the bench. Vasc Med. 14 (2), 153-166 (2009).
- Staton, C. A., Reed, M. W., Brown, N. J. A critical analysis of current in vitro and in vivo angiogenesis assays. Int J Exp Pathol. 90 (3), 195-221 (2009).
- Auerbach, R., Lewis, R., Shinners, B., Kubai, L., Akhtar, N. Angiogenesis assays: a critical overview. Clin Chem. 49 (1), 32-40 (2003).
- Tahergorabi, Z., Khazaei, M. A review on angiogenesis and its assays. Iran J Basic Med Sci. 15 (6), 1110-1126 (2012).
- Arnaoutova, I., George, J., Kleinman, H. K., Benton, G. The endothelial cell tube formation assay on basement membrane turns 20: state of the science and the art. Angiogenesis. 12 (3), 267-274 (2009).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat Protoc. 5 (4), 628-635 (2010).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10 (3), 588-612 (2006).
- Nicosia, R. F. The aortic ring model of angiogenesis: a quarter century of search and discovery. J Cell Mol Med. 13 (10), 4113-4136 (2009).
- Baker, M., et al. Use of the mouse aortic ring assay to study angiogenesis. Nat Protoc. 7 (1), 89-104 (2011).
- Guo, J., et al. A secreted protein (Canopy 2, CNPY2) enhances angiogenesis and promotes smooth muscle cell migration and proliferation. Cardiovasc Res. 105 (3), 383-393 (2015).
- Wittig, C., Scheuer, C., Parakenings, J., Menger, M. D., Laschke, M. W. Geraniol Suppresses Angiogenesis by Downregulating Vascular Endothelial Growth Factor (VEGF)/VEGFR-2 Signaling. PLoS One. 10 (7), e0131946 (2015).
- Masson, V. V., et al. Mouse Aortic Ring Assay: A New Approach of the Molecular Genetics of Angiogenesis. Biol Proced Online. 4, 24-31 (2002).
- Caplan, A. I. Adult mesenchymal stem cells for tissue engineering versus regenerative medicine. J Cell Physiol. 213 (2), 341-347 (2007).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Keating, A. Mesenchymal stromal cells: new directions. Cell Stem Cell. 10 (6), 709-716 (2012).
- Kilroy, G. E., et al. Cytokine profile of human adipose-derived stem cells: expression of angiogenic, hematopoietic, and pro-inflammatory factors. J Cell Physiol. 212 (3), 702-709 (2007).
- Tang, Y. L., et al. Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction. Ann Thorac Surg. 80 (1), 229-236 (2005).
- Caplan, A. I. All MSCs are pericytes?. Cell Stem Cell. 3 (3), 229-230 (2008).
- Hong, S. H., et al. Ontogeny of human umbilical cord perivascular cells: molecular and fate potential changes during gestation. Stem Cells Dev. 22 (17), 2425-2439 (2013).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: The ARRIVE guidelines for reporting animal research. J Pharmacol Pharmacother. 1 (2), 94-99 (2010).
- Sarugaser, R., Ennis, J., Stanford, W. L., Davies, J. E. Isolation, propagation, and characterization of human umbilical cord perivascular cells (HUCPVCs). Methods Mol Biol. 482, 269-279 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Gelati, M., Aplin, A. C., Fogel, E., Smith, K. D., Nicosia, R. F. The angiogenic response of the aorta to injury and inflammatory cytokines requires macrophages. J Immunol. 181 (8), 5711-5719 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved