Method Article
Fare Malı İnsani Kemik İliği Mikro Çevrelerinin Biyomühendisliği ve Canlı Görüntüleme ile Görselleştirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Farelerde farklı insanlaştırılmış kemik iliği nişleri oluşturmak ve canlı görüntü oluşturmak için bir yöntem sunulmuştur. İnsan mezenşimal hücreleri tarafından oluşturulan destekleyici niş dayanarak, insan endotel hücrelerinin eklenmesi, insan damarlarının oluşumunu indüklerken rhBMP-2 ilavesi, insan-fare kimerik olgun kemik dokusunun oluşumunu indükler.
Özet
İnsan hematopoietik kök hücreleri (HSC), sitokinler, büyüme faktörleri ve hücre dışı matris üreten karmaşık, çok faktörlü bir ağ bileşeni olan kemik iliği (BM) nişinde bulunur. HSC'lerin sessiz kalması, kendiliğinden yenilenmesi veya farklılaşması ve mutasyonlar kazanması ve malign olma kabiliyeti, farklı stromal bileşenlerle oluşturduğu karmaşık etkileşimlere bağlıdır. İnsan HSC'leri ile fizyolojik ve patolojik koşullardaki insan BM niş arasındaki çapraz akışı gözlemek için, immün yetmezlikli farelerde bir hümanize BM nişinin ektopik olarak modellenmesi ve görüntülenmesi için bir protokol tasarladık. Farklı hücresel bileşenlerin kullanımının insanlaştırılmış yapıların oluşumuna ve uzun vadeli insan hematopoietik yaşantısını sürdürme fırsatı sağladığını gösteriyoruz. İki fotonlu mikroskopi kullanarak, bu yapıları tek hücreli çözünürlükte in situ olarak canlı görüntüleyebilir, insan BM m'nin fonksiyonel karakterizasyonu için güçlü yeni bir araç temin edebilirizMikro çevre ve normal ve malign hematopoezin düzenlenmesindeki rolü.
Giriş
Kök hücre bölmelerinde gözlenen hücre akıbeti kararları iç ve dış faktörler tarafından sıkı bir şekilde düzenlenir. Özellikle, şu anda yaygın olarak bilinmektedir ki, BM mikro ortamının, HSC'lerin anahtarını durgun durumdan aktif duruma kontrol etmenin yanı sıra kendi kendini yenileme veya farklılaşma kaderi kararında kontrol etmede temel bir rol oynamaktadır 1 . Dahası, son bulgular hematolojik malignitelerin BM mikro ortamının işlevini etkilediğini ve iki bölme arasında aktif karışma varlığına işaret ettiğini göstermektedir 2 , 3 , 4 , 5 , 6 . Son gelişmelere rağmen, spesifik BM-niş bileşenlerin aktivitesinin HSC davranışına ve habis transformasyona nasıl katkıda bulunduğu konusunda birçok kilit soru kalır.
BM mikro ortamı oldukça heterog bir yapıdadır Zengin ve karmaşık bir çok farklı hücre tipinin karışımı, her biri özel fonksiyonlara sahiptir. Bol miktarda endotel (EC) ve vasküler bileşen, besleyici ve metabolit döngüsünü, BM'ye gelen ve bu hücrelere ait farklı hücrelerin girişi ve çıkışını ve çeşitli HSC fonksiyonlarını 7 , 8 regüle eder. Farklılaşmamış kök hücrelerin heterojen bir popülasyonu olan mezenkimal stromal hücreler (MSC'ler) ve üç farklı soyla ( yani, osteojenik, kondrojenik, adipogenik) işleyen öncüler, BM nişinin bir diğer temel bileşenidir. Bu MSC'ler hem BM'nin merkez bölgelerinde hem de endosteal bölgeye yakın bir yerde lokalize olur. Vasküler yapılarla ilişkili olabilirler ve HSC işlevinin düzenlenmesinde rol oynarlar 9 , 10 , 11 , 12 , 13 ,"> 14 , 15 .
Birçok rapor, HSC'lerin kemik iliğinde çeşitli tanımlanmış bölgelerde olduğunu ve işlevlerinin konumlarının kesin lokalizasyonuna bağlı olduğunu düşündürmektedir. HSC'ler ve bunların BM mikro ortamıyla etkileşimi hakkında mevcut bilgilerin çoğu murin çalışmalarından kaynaklanmaktadır 1 . Xenograft modellerinin kullanılması, bu bilgiyi immün yetmezlikli farelerin 16 , 17 , 18 , 19 , 20 nolu sıçangil BM'sine yerleşen insan normal ve malign HSC'lerine genişletmiştir. Bu geçerli bir modeli temsil etmesine rağmen, alıcı fare ile çoğu durumda insan HSC homing ve engraftment veya çapraz tür bariyeri ve hücre-hücre etkileşimleri üzerinde kötü anlaşılan etkileşim için izin verilmesi gibi birçok zorluk ortaya koymaktadır ve ve fonksiyonlar.
Nötralize edici antikorların ve genetik olarak değiştirilmiş farelerin, xenotransplantasyon ile birlikte kullanılması, insan HSC'lerinin mikro ortamlarıyla oluşturduğu karmaşık diyaloğu vurgulamada aracı olmuştur. İntravital iki foton konfokal mikroskobunun tanıtılması ve geliştirilmesi, bu çalışmaları bir adım ileriye taşıdı ve kemik iliğinin 19 , 20 , 21 , 22 nolu doğrudan, yüksek çözünürlüklü ve dinamik görüntüsünü elde etmeye ve işlevsel BM mikro ortamının karakterizasyonu ve HSC fonksiyonunun düzenlenmesindeki rolü. Klasik xenotransplantasyon modellerinde ortaya çıkan bazı problemleri ortadan kaldırmak için insancıllaştırılmış BM yapısının mühendisliği kavramı ön plana çıkarılmıştır. Biyomalzemelerin ve hücre implantasyonu kavramlarının bir araya getirilmesi, raporlarda insan kemik taklidinin fizibilitesini gösterdi.Arrow heterotopik bölgelerdeki mikro çevre 23 , 24 , 25 , 26 , 27 . Bu hematopoez 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, tümör oluşumu ve metastaz, 40, 41, 42, insan normal ve habis çalışma fare modellerinde biyoteknik kullanma imkanı açar , 43, 44.
Kemik dokusu mühendisliği ve canlı doku görüntüleme 19 , 22 , 45 , 46 , 47 , 48 , 49 , 50 , 51 , 52'deki daha önceki deneyime dayanarak biyomühendislik ve canlı görüntü organotipik insan BM dokuları için bir protokolü açıkladık. Bu yapılar insan BM kaynaklı stromal hücrelerin immün yetersiz farelerde subkutan yoldan aşılanmış kolajen temelli iskele içine implantasyonundan kaynaklanmaktadır. Önceki bir raporda, insan MSC'lerinin insan hematopoietik hücrelerinin 45 engraftatı için yeterli bir insan mikrobölgelimi oluştuğunu gösterdik. Ayrıca, burada, diğer insan BM hücresel bileşenininKemik oluşumu için önemli sitokinler ( örneğin, hBMP2), hMSC'ler ile birlikte çalışarak, in situ canlı görüntüleme yapılabilen farklı hümanize mikro ortamlar üretir.
Protokol
Tüm hayvan deneyleri İngiltere Ev Ofisi tarafından onaylanmış ve Cancer Research UK kılavuzlarına uygun olarak PPL 70/8904 kapsamında gerçekleştirildi. İnsan göbek kordonu kanı (UCB) ve birincil insan akut miyeloid lösemi (AML) örneklerinin kullanımı, Doğu Londra Etik Kurulu tarafından onay aldıktan sonra onaylandı ve Helsinki Deklarasyonu'na uygun olarak gerçekleştirildi.
1. İnsan Hematopoietik ve Stromal Hücrelerle Kollajen Tabanlı İskele Biyomühendisliği
NOT: Tüm protokol steril koşullarda ve steril malzeme ile gerçekleştirilmelidir. Hücre kültür ortamı 1, hMSC ortamına (MEM-a, P / S ve% 10 hMSC-FBS'ye karşılık gelir); Hücre kültür ortamı 2, EC ortamına (M199,% 20 FBS, P / S, 10mM HEPES, 50 ug / mL heparin, 2 mM glutamin ve 50 ug / mL EKG) tekabül eder ve hücre kültürü ortamı 3, hematopoietik hücre ortamına (H5100 Ve P / S).
- Göbek kordonu kanını hazırlayın mhücrelerin köklü protokollere 53 e göre, bir Ficoll-Paque yoğunluk gradyan kullanılarak (CB-MNC) ya da primer AML (kemik iliği ya da periferal kan MNC), ononuclear.
- AML için, OKT.3 antikoru kullanarak T hücrelerini tüketin. PBS içinde hücreleri yıkamadan önce oda sıcaklığında 30 dakika 1 x 10 6 AML ÇUŞ başına 4 μg OKT.3 inkübe edin. Gerekirse, mL başına 2 x 10 8 hücre,% 10 DMSO ile FBS ÇUŞ'larına dondurarak.
- HMSC (kültür ortamı 1) ve EC (kültür ortamı 2) hücre kültürleri hazırlayın. HMSC ortamında düzenli hücre kültürü şişeleri üzerinde plaka hMSC hücreleri ( Malzeme Tablosuna bakınız). EC ortamında kollajen 1 kaplamalı yüzeyler üzerinde Plaka EC'ler ( Malzeme Tablosuna bakınız).
- % 85-90 oranında hücre konfluansı ortamı çıkarın, iki kez PBS ile yıkayın ve tripsin-EDTA çözeltisi (cm 2 başına 20 mcL) ilave edin.
- 5 dakika sonra hücrelerin ayrıldığını kontrol edin. 1 seyrelterek hücreleri kurtarın:3 hücre kültür ortamı ile. 5 dakika süreyle 300 xg'de santrifüjleyin ve her hücre tipi için ilgili ortamı tekrar askıya alın ve bir Neubauer odası kullanarak hücreleri sayın.
- ML başına 2 x 10 6 - 10 7 hücre hücre kullanın. Her iki hücre tipinin birlikte kullanılması gerekiyorsa, hMSC ve EC süspansiyonlarını 1: 1 oranında karıştırın.
- Hücre süspansiyonunu bir insülin şırıngaya aktarın.
- Bir bisturi kullanarak, sterilize edilmiş jelatin süngerini ( örneğin gelfoam) başlangıç iskelesini (20 mm x 60 mm x 7 mm) 24 adet benzer boyuta (6.6 mm x 7.5 mm x 7 mm; Şekil 1A ve B ) kesti .
- Jelatin iskeletlerini PBS'ye batırarak (5 dakika) yeniden yapılandırın.
- Aşırı PBS'yi uzaklaştırmak için iskeletleri birer birer steril bir dokuya birer birer yerleştirin. İskeleleri bir 24 oyuklu plakanın (ultra-düşük bağlanma yüzeyi) bir oyuğa aktarın ve 10 5 - 10 6 hücre içeren 50 uL enjekte etmek için şırınga kullanın (hMSC alBir veya HEC ile kombinasyon halinde; Şekil 1C ).
- Gerekli iskelelere stromal hücreler ekilecek olana kadar her iskele ile adım 1.7 tekrarlayın.
- Bir hücre kültür inkübatör (37 ° C ve CO 2 % 5) içinde 1 saat inkübe edin.
- Her kuyu hücre kültürü ortamı 1 ( Şekil 1D ) 3 mL ile doldurun ve bir gece boyunca inkübasyon için bir hücre kültürü inkübatörüne (37 ° C ve CO 2 5%) iskele gönderin. İskelelerde EC'ler kullanılıyorsa, hücre kültürü ortamı 2'yi kullanın.
- CB-MNC'leri çözün ve uygun bir CD34 + kesit kiti protokolünü takiben CD34 + hücrelerini onlardan izole edin. Seçilen CD34 + hücrelerini ortam 3'de askıya alın ve bir Neubauer odasında sayın.
Not: Burada, hücreler mL başına 2 x 10 6 hücre bir konsantrasyonda kullanıldı.- AML hastasından türetilen primer numuneler kullanılıyorsa, hücreleri çözündürün, FBS'de 1:10 oranında seyreltin, onları 300'de 5 dakika santrifüjleyinXg, hücreleri PBS-2% FBS içinde tekrar süspansiyon haline getirin, anti-insan CD3 antikoru (10 6 hücre başına 2-4 μg ekleyin) ve 30 dakika boyunca oda sıcaklığında inkübe edin. 5 dakika boyunca 300 x g'de santrifüjleyin ve sitokinler (20 ng / mL granülosit-koloni uyarıcı faktör (G-CSF), 20 ng / mL IL-3 ve 20 ng / mL trombopoietin (TPO) ile desteklenmiş hematopoietik hücre ortamında tekrar süspanse edin) .
- 1.7 - 1.9 arasındaki adımları tekrarlayın, ancak bu durumda yukarıda belirtildiği gibi stromal bileşenler yerine 1 x 10 5 insan hematopoietik hücresi tohumlayın.
- 3 mL hücre kültürü ortamı 3 ( Şekil 1D ) ile iyice doldurun ve gece boyunca inkübasyon için bir hücre kültürü inkübatörüne (37 ° C ve CO 2 5%) iskele gönderin. İskele içinde EC'ler kullanılıyorsa hücre kültürü ortamı 2 ve 3'ün 1: 1'lik bir karışımı kullanın.
- Sadece rekombinant insan kemik morfogenetik protein-2 (rhBMP-2) taşıyıcı iskele için, artçı P'yi uzaklaştırmak için iskeletleri birer steril dokuya yavaş yavaş koyunBS. İskeletlerini bir u-altı, 96 oyuklu plakanın ( Şekil 1E ) bir oyuğa aktarın ve skafoldu iyice örten 5 uL rhBMP-2 ekleyin.
- Her zaman iskeleyi iyice örten 20 mcL trombin, ardından 20 mcL fibrinojen ekleyin ( Şekil 1F ). Tüm iskeleleri tedavi edilene kadar her iskele için prosedürü tekrarlayın ve daha sonra 37 ° C'de 5 - 10 dakika inkübe edin. Koagülasyonun başarıyla oluşturulup oluşturulmadığını kontrol edin.
2. Biyomühendisli İskele Modellerinin Cerrahi İmplantasyonu
NOT: Burada, 6 ila 12 haftalık NSG fareleri ya erkek ya da dişi kullanıldı. Hayvanlar immün yetersiz olduğundan, tüm işlemler steril koşullarda yapılmalıdır. Adımlar 2.10 - 2.13, sağkalım stratejileri ve cerrahi sonrası bakım ile ilgilidir.
- Ameliyattan 60 - 120 dakika önce ağrı kesici ilaçlar (karprofen, 5 mg / kg vücut ağırlığı / fare) subkütan yoldan uygulayın.
- % 0.5 izofluran ve 2 L / dak O2 ile bir bölme içinde anestezi neden. Prosedür sırasında fareler sürekli takip edilmelidir. Sırttan kolaylıkla geçebilmek için hayvanı cerrahi bölgeye eğilimli konuma getirin. Hayvan,% 1.5 izofluran ve 2 L / dak O 2 sağlayan bir burun konisi kullanarak anestezi altında tutun. Cerrahi işlem sırasında fare anestezi altında tutun ve sık sık hayvan durumunu kontrol edin.
- Anestezi altında iken, kuruluğu önlemek için göz fare gözleri kullanın ve farenizi 37 ° C'de tutun.
- Bir elektrikli düzeltici kullanarak fare arkasındaki cerrahi alanı tıraş edin. Cildinizi sterilize etmek için, pamuk ucunu sulandırılmış kloreksidin (PBS'de 1:10 oranında sulandırılmış) içine daldırın ve cilt yüzeyini temizlemek için bu ucunu kullanın. Bu işlemi iki kez tekrarlayın.
- Steril forseps ve bir bisturi (veya makas) kullanarak cildin 0,5 ila 0,7 cm ön-arka tüm kesisini yapın. Takılan forsepsleri kullanınCebini yapmak için cilt altı doku altında.
- Skafoldu cebe yerleştirin, cebin içine derin yerleştirildiğinden emin olun ( Şekil 1G ve H ). İnsizyonu ameliyat yapıştırıcısı ile kapatın ( Şekil 1I ve J ).
- Cerrahi sonrası ağrı tedavisinde, buprenorfin (0.1 mg / kg vücut ağırlığı) subkutan olarak uygulayın.
- İyileşme sırasında, hayvanı önceden ısıtılmış kafesin yanına koyun ve normal davranış gözlenene kadar iyileşmeyi izleyin.
- Ağrı kesiciyi suda inceltin (karprofen, 0,1 mg / mL su) ve hayvanlara ameliyattan 4 gün sonra içme suyu olarak sağlayın.
- Olası advers etki için 48 saatlik ameliyat sonrası hayvanı ve yarayı sık sık kontrol edin.
3. Fare Tedavileri, Ötanazi ve Görüntüleme için Örnek Alma
NOT: İskele analizleri,İmplantasyondan 8 ve 24 hafta sonra.
- Görüntülemeden 60 dakika önce, yerleştirilen fareyi 37 ° C'deki bir ısıtma kutusunda sıcak tutun ve spesifik olmayan bölgeleri bloke etmek için 100 uL'lik insan immünoglobülini intravenöz uygulayın.
- Görüntülemeden 30 dakika önce, ilgilenilen hücreleri etiketlemek için 10 ng (fare başına) spesifik antikorları intravenöz olarak uygulayın.
- Görüntülemeden 5 dakika önce, vasküler yapıları görselleştirmek için 655 nm fluorofor etiketli, damar-birleştirme ajanı (655-VPA) içinden damardan 15 μL (100 μL PBS'de seyreltilmiş) uygulayın.
- Fare servikal çıkık vasıtasıyla euthanize edilir.
- Keskin bir makas kullanarak, orijinal implantasyon alanının yakınında fare arkasında uzunlamasına bir cilt insizyonu yapın.
- Cımbız ve makas yardımıyla, iskele implante edilen cilt altı cebinden cildi dikkatlice ayırın.
- İskele cımbız ile tutun ve kalıntı membran a keserek cildinden yavaşça eksplant çıkarın a.İskele etrafında makas kullanarak doku. Şekil 2'de bulunması gereken iskele örneklerine bakın.
- Bir iskelet görüntüsü plakası (35 mm x 10 mm Petri kabı) hızlı etkili yapışkan yapıştırıcı ile İskele güvenliğini ve oda sıcaklığında tuzlu su çözeltisi (PBS) ile doldurun.
- BMP iskeleleri için, plakayı PBS ile doldurmadan önce, mikrocerrahi mikroskop altında kemik yüzeyini inceltmek için bir cerrahi mikrodillen kullanın; Bu, fluorophore görselleştirme ve yüksek çözünürlüklü görüntü yakalama sağlar. İskelet büyüklüğüne bağlı olarak 1.2 veya 1.6 mm çapaklarını kullanın.
NOT: Kullanıcı, kemiğin kalınlığına bağlı olarak ne kadar delinmesi gerektiğini anlayacaktır. Genel olarak, BMP iskeleleri vaskülarize edildiğinde, görüntüleme için doğru kalınlığa yaklaşıldığında kemik rengi biraz değişir ve daha fazla kırmızı olur. - Plakayı konfokal mikroskop sahnesine yerleştirin.
4. İki fotonlu Mikroskobu Kullanarak Canlı Görüntülemeopyala
NOT: Türetilmemiş dedektörleri (NDD) kullanırken, floresanı NDD'ye yönlendirmek için görüntüleme için her zaman NDD kaydırıcısını kullanın. Mikroskop konfigürasyonu Şekil 3'te verilmektedir .
- Mikroskopu ve bilgisayarı açın, "Start System" i (Başlat Sistemi) tıklayarak yazılımı başlatın ve "Edinme" moduna geçin.
- "Manuel araçları göster" kutusunu işaretleyin. "Lazer" menüsünde, iki fotonlu lazer "açık" konuma getirilir ve ısınmasına ve sabit kalmasına izin verir.
- "Görüntüleme Ayarı" menüsünde, aynı anda "Kanal Modu" ve "Her Çerçeve İzle değiştir" i etkinleştirin. "Işık Yolu" menüsünde "Non Descended" ve "Main Beam Splitter MBS 760+" seçeneğini seçin. Dört NDD'yi etkinleştirmek için işaretleyin ve yapılandırmayı Şekil 3'te gösterildiği gibi ayarlayın.
NOT: Bu konfigürasyon ile, kemik yapılarından gelen kollajen sinyali (saniyeSHG), 380 - 485 nm, FITC - hCD31 + insan endotel hücreleri ve 500-550 nm'de AF488 - hCD45 + insan hematopoietik hücrelerinde ve 640 - 690 nm'de 655 - VPA'da toplanır. - "Kanallar" menüsünde "lazer dalga boyu" nu 890 nm ve gücü% 50 olarak ayarlayın. Her bir kanal için "Kazanç (Master)" değerini 500-600, "Dijital Ofset" i 0'a, "Dijital Kazanç" ı 15'e ayarlayın. Satın alma işlemi başladıktan sonra bu değerleri ayarlayın.
- "Edinme Modu" nda dokuya zarar vermeden ve flüoroforları ağartmadan yüksek çözünürlüklü görüntüler elde etmek için gerekli parametreleri ayarlayın. "Tarama Modu" nu "Çerçeve", "Çerçeve Boyutu" nı "x512 y512", "Hat Adımı" nı 1'e, "Hız" ı 9 "averaj numarası" nı 8'e, "Bit Derinliği" ni "8 Bit" "Yön" den "satır", "Yön" den "çift yönlü" ve "Yöntem" den "ortalama" anlamına gelir.
- "Zo ayarla"Om "değerini 1'e getirin ve belirli alanlara odaklanmak için gerekirse artırın.
- İskele içeren plakayı, 20X, 1.0 NA suya daldırma lensinin altındaki mikroskop aşamasına yerleştirin ve salin solüsyonuna dokunana kadar lensi indirin. Işık kaynağı olarak bir lamba kullanarak, mikroskop göz mercekleri kullanarak objektifin odak noktasını iskelet üzerine ayarlayın.
- "Z-yığını" menüsünü etkinleştirin, "İlk / Son" işlevini seçin ve iki alt ardışık dilim arasındaki gerekli aralığı ayarlayın ( örn., 2-μm Z-yığını). Aralıkları Z yığını içinde sabit tutun.
- Canlı bir örneği taramak için "Canlı" seçeneğini seçin ve en iyi pozlama için "Dijital Kazanç" ve "Dijital Ofset" i ayarlayın. Birden çok kanalı aynı anda görselleştirmek için "Böl" işlevini seçin.
- "Sahne" menüsünde, "Canlı" moddayken görüntünün taranması ve aralarındaki "İşaretle" bölgeleri(ROI), insan hematopoietik hücrelerinin ve vasküler yapıların yeri gibi. Numunenin taraması tamamlandığında, görüntülemeyi başlatmak için ilk YG'ye gidin.
- "Canlı" modda, "Önce ayarla" ve "Sonu ayarla" işlevlerini kullanarak ilgi alanını çevreleyen 3D Z yığınının üstünü ve altını ayarlayın. İşiniz bittiğinde, merkezini "C" ye getirin. "Denemeyi başlat" düğmesiyle ROI'yı satın almaya başlayın. Şekil 4 , Şekil 5 ve Şekil 6'daki görüntü örneklerine bakın.
- Toplama işlemi tamamlandıktan sonra, resmi belirlenen klasöre kaydedin. Bir sonraki ROI'ye geçin ve adım 4.10'u tekrarlayın. Deney tamamlandıktan sonra, mikroskoptan görüntüleme plakasını çıkarın, numuneyi plakadan dikkatle ayırın ve kalıntı tutkalları temizleyin.
- Numuneyi bir sonraki analiz tekniği için hazırlayın.
5. Örnek İşlemciHistoloji ve İmmünosistem için g
NOT: Numuneler, örnek sabitleme, katıştırma ve kesitlendirme işlemlerini açıklayan JoVE genel laboratuvar teknikleri 54'te açıklanan protokole göre işlenir. Kemik oluşturucu numuneler, fiksasyon ve katıştırma işlemleri arasında bir EDTA esaslı dekalsifikasyon ajanı içinde 7 gün süreyle muamele edilmelidir. Bloke edici / permeabilizasyon çözeltisi,% 1 Triton X-100,% 1 sığır serumu albumin (BSA) ve% 10 normal keçi serumu (NGS) içeren 10 mM PBS pH 7.4 tamponudur.
- 5 dakika sonra, 5 dakika süre ile,% 50 etanol, ve 5 dakika için H2O için 5 dakika% 70 etanol için 5 dakika% 100 etanol için), 10 dakika boyunca ksilen içinde ksilen dilimleri koyun.
- Dilimleri çalışma çözümünü açığa çıkaran bir sitrat bazlı antijene aktarın.
- Dilimleri 15 dakika kaynatın ve oda sıcaklığına soğumalarını bekleyin.
- Dilimleri 10 mM PBS pH 7.4 solüsyonunda% 1 Triton X-100 (5 dak, 3 kere) ile yıkayın.
- Sam'i transfer etBloke edici / permeabilizasyon çözeltisiyle 30 dakika inkübe edin.
- Bloke edici / permeabilizasyon çözeltisinde seyreltilmiş birincil antikor ekleyin ve gece boyunca 4 ° C'de inkübe edin.
- Dilimleri 10 mM PBS pH 7.4 solüsyonunda% 1 Triton X-100 (5 dak, 3 kere) ile yıkayın.
- Oda sıcaklığında karanlıkta 1 saat bloke edici / permeabilizasyon çözeltisinde seyreltilmiş sekonder antikor ekleyin.
- H2, O (5 dakika, 3 kez) ile yıkanır.
- Arka plan floresanını azaltmak için, karanlıkta ve oda sıcaklığında 10 dk Sudan Siyah çalışma solüsyonuna dilimleri daldırın.
- H2O (5 dakika, 3 kez) dilimleri yıkayın.
- Dilimleri, DAPI (0.5 μg / mL) ile flüoresan montaj ortamı kullanarak monte edin.
- Dilimleri 4 ° C'de saklayın ve floresan görüntülemeden önce montaj maddesinin kuru olup olmadığını kontrol edin. Şekil 7'deki örnek görüntülere bakın.
Sonuçlar
Şekil 1'de , iskele hücre tohumlamasının ve implantasyon işlemlerinin temsili görüntüleri gösterilmektedir. Şekil 1C'de hücrelerin doğrudan iskele içine enjekte edildiğine dikkat edin. Şekil 1G'de fare arka tarafında, cilt altı cebin yaratıldığı ve iskele implante edildiği bir kesinin yapıldığını unutmayın. Şekil 2 , NSG farelerine yerleştirilen ve 8 hafta sonra alınmış farklı iskeletlerin brüt morfolojisini göstermektedir. HMSC tohumlanmış iskele ( Şekil 2A ) hafif vaskülarizasyon unutmayın. İskele içindeki hMSC'ler ile insan EC'lerin birlikte tohumlanması, iskeletlerde daha ilgili vaskülatürün oluşmasına olanak tanır ( Şekil 2B ). Son olarak, rhBMP-2'nin varlığı, kemik oluşumunu indükler. Elde edilen iskeleler bu davada daha büyüktür veKemiğe benzeyen sert dokuyu andırıyor.
Şekil 3 , NDD ile canlı görüntüleme için mikroskopta kanal yapılandırma ayarını göstermektedir (şekil şekilinde detay). Şekil 4 ve Video 1 , hMSC kaplı iskele içindeki insan hematopoietik hücrelerini göstermektedir. İskele implantasyonundan 8 hafta sonra ve AF488-hCD45 antikoru ve 655-VPA'nın intravenöz inokülasyonundan sonra eksplane edildi. Bu prosedür, implante edilen insan hematopoietik hücrelerinin ve vasküler yapının iki fotonlu konfokal mikroskop ile görselleştirilmesine izin verir. Bu durumda görüntüler, iskele içindeki kan damarlarını (655-VPA) ve iskelet parankiminde insan hematopoietik hücrelerinin (AF488-hCD45) uzun süre engraftmanını göstermektedir. Şekil 5 ve Video 2 , hEC'ler ve hMSC'lere ekilen insan iskele takımlarına karşılık gelir. Ameliyattan 8 hafta sonra, iskeleler intraven sonrası eksplante edildiFITC-hCD31 antikorunun ve 655-VPA'nın inoküle edilmesi ve daha önce belirtildiği gibi görüntüler iki foton konfokal mikroskop ile elde edildi. Görüntüler iskele içindeki damar oluşumunda YK'ların katılımını göstermektedir ve bu da bir fare benzeri kimerik vaskülatür oluşturmaktadır.
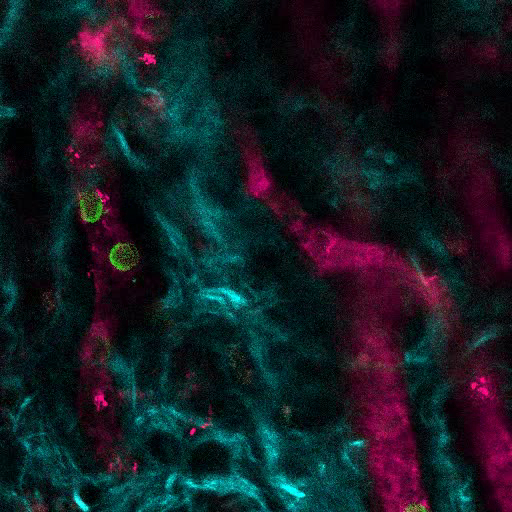
Şekil 6A , MSC iskelelerinde kemik oluşumunu uyarmak için kullanılan yaklaşımın temsili verilerini göstermektedir. İmplantasyondan 8 hafta sonra önceki şekillere benzer şekilde, 655-VPA'nın intravenöz aşılaması gerçekleştirildi, iskeleler alındı ve görüntüler, iki fotonlu konfokal mikroskop ile elde edildi. RhBMP-2 ile uyarılan iskeleler, kemik içindeki kalsiyum tarafından sağlanan SHG (görüntülerdeki mavi renk) nedeniyle görülebilen kemik dokusunun oluşumuna neden olur. Verilen görüntüler ayrıca, BM endosteal dokuya çok benzer boşlukların ve vasküler endosteal dokunun oluşumunu göstermektedir. Şekil 6B'de ve Video 3 , hEC'ler hMSC'ler ile birlikte yerleştirildi. İskele, FITC-hCD31 antikoru ve 655-VPA'nın intravenöz inokülasyonundan sonra alındı ve iki fotonlu konfokal mikroskopi görüntüleri, kemik yapıcı bir iskele içinde neovaskülarizasyona HEKlerin katılımını göstermektedir.
Şekil 7 , histolojinin temsili görüntülerini göstermektedir ve daha önce tarif edilen sonuçları desteklemek için gerçekleştirilen bir prosedür. İmmunofloresan görüntüler, iskele yapılarında fare vaskülatürü, hEC'ler, hMSC'ler ve uzun süreli engraftlanmış insan hematopoietik hücreleri gösterir. Farelerden alınan iskeleler sabitlenmiş ve immünofloresan için kullanılmıştır. RhBMP-2 taşıyıcı kemik yapıcı iskele içinde ( Şekil 7D- F ), adipoz doku ile olgun kemik iliğini andıran dokunun morfolojisine dikkat edin. Bu kemik oluşturan iskele içinde, hMSC'lerin fibroblastlar olduğunu gösteririz, ki bu tŞapka, yeni oluşan dokuya stromal hücreler olarak katkıda bulunurlar. Ayrıca hMSC'lerin yağ dokusu oluşumuna katkıda bulunduğunu gösteren insan adiposit marker ekspresyonunu da gösteririz.
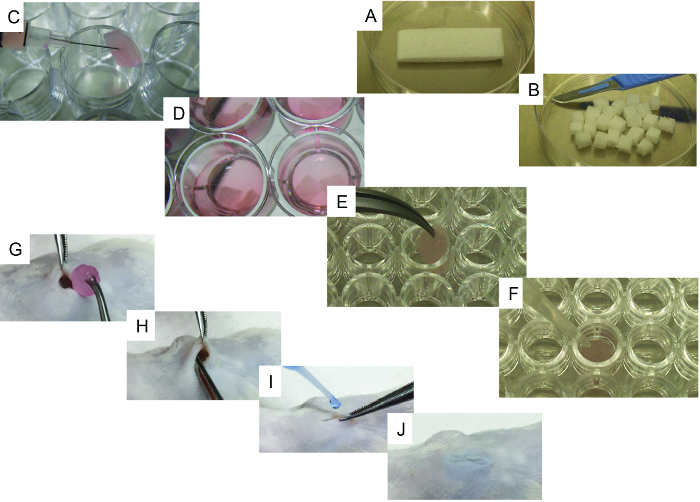
Şekil 1. Hücre tohumlama ve İmplantasyon İşlemlerinin Temsili Görüntüleri. A) İlk iskele ve bir bistül kullanarak kesme yöntemi. B) İlk iskele tarafından elde edilen 24 parça. C) Bir şırınga kullanarak iskele hücre tohumlama yöntemi. D) İmplante edilmeye hazır, kültür ortamı ile hücre-tohumlanmış iskele. EF) Kemik oluşturan iskele için spesifik basamaklar: E) iskelet, 96-kuyu, u-alt plakaya aktarılır ve F) iskeleye rhBMP2, trombin ve fibrinojenin eklenmesinde kullanılan yöntemin temsili görüntüsü. GJ) Surgi Genel anestezi altındaki kalp nakil prosedürü: G) cerrahi yapıştırıcı kullanılarak yarada ciltte yaranın oluşturulması ve iskele implantasyonu, H implantasyon yöntemi ve IJ) yara kapatma prosedürü. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
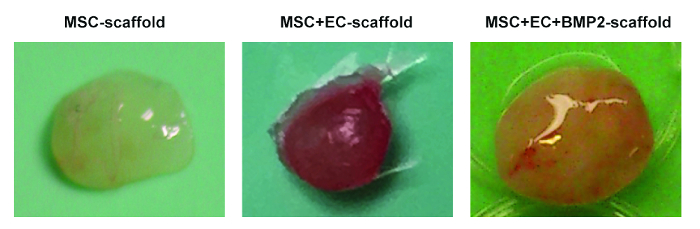
Şekil 2. Farelerden Elde Edilen Farklı İskele Şekilleri. MSC iskele (solda), MSC + EC iskele (orta) ve MSC + EC + BMP iskele (sağda) temsilcisi görüntüleri. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
4 / 55914fig3.jpg "/>
Şekil 3. Kanal Yapılandırması. Mikroskop filtresi kurulumu gösterilir. A) Dört adet NDD dedektör modülü vardır: Birinci modülde iki filtre küpü vardır; Ikinci ve üçüncü modüllerin her biri bir filtre küpüne sahiptir; Ve son modülün küpü yok (kullanılmıyor). İlk fotomültiför tüpü (PMT), daha düşük dalga boylarını yansıtan uzak kırmızı kanal (640 - 690 nm) içindir; Aşağıdaki olanlar 380 - 485 nm, 500 - 550 nm ve 555 - 625 nm'dir (sıra her zaman daha düşük dalgaboylarından daha yüksek dalga boylarına). B) Yukarıdaki konfigürasyonlarla tespit edilebilir florofor emisyonları (renk kodlu). Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
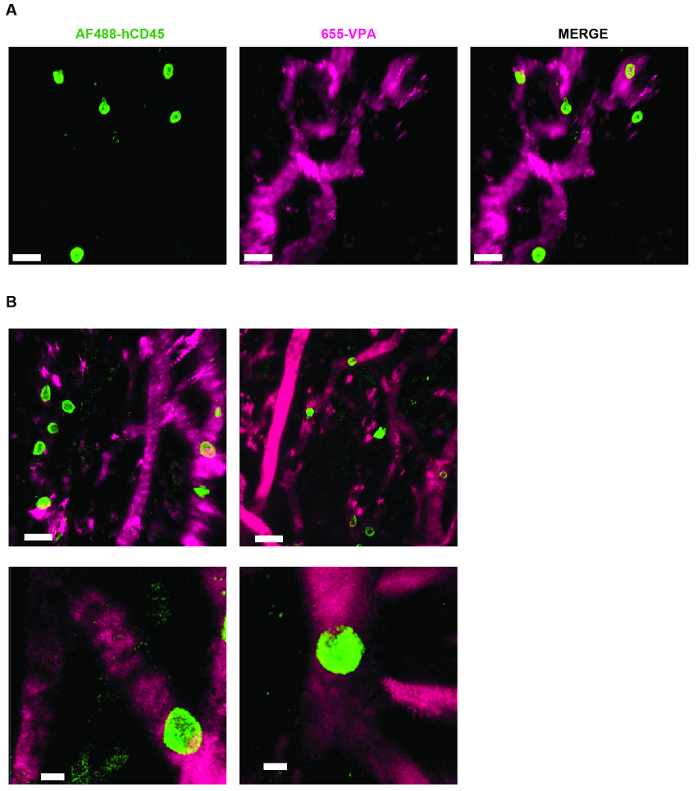
Şekil 4. MSC İskele İnsan Hematopoietik Hücreler için Bir Niş Oluşumuna İzin Verin. AF488-hCD45 (yeşil) ile intravenöz inokülasyondan sonra, insan hematopoietik hücrelerini ve vaskülatürü etiketlemek için 655-VPA (macenta) m'yi etiketleyecek şekilde, eksplant sonrasında alınan Z-yığınlarının A) ve B) 3D rekonstrüksiyonu. Ölçek çubukları A ve B (üst paneller) ve B'de 5 μm (alt paneller) 20 μm'yi temsil etmektedir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Video 1. MSC İskele Şekilleri İnsan Hematopoietik Hücreleri için Bir Niche Oluşumuna İzin Verin . MSC iskelesinde (kolajen yapıları: SHG, camgöbeği) vaskülatür (655-VPA) ile ilişkili insan hematopoietik hücrelerinin 3D rekonstrüksiyonu (AF488-hCD45). Her yığın 140 x 140 μm ölçülür.Ef = "https://ecsource-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/55914/55914video1.mov" target = "_ blank"> Bu videoyu görmek için lütfen tıklayınız. (İndirmek için sağ tıklayın.)
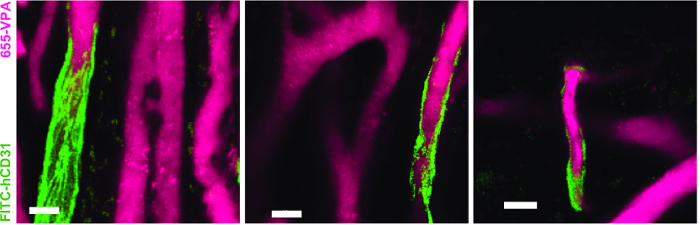
Şekil 5. İnsan ES'leri, MSC İskelelerindeki İnsancıllaştırılmış Gemilerin Oluşumuna Katılmaktadır. İnsan kaynaklı EC'ler (FITC-hCD31) ile sıralanmış damar sisteminin üç boyutlu yeniden yapılandırılması (655-VPA) MSC + EC iskelelerinde. Ölçek çubukları 20 μm'yu temsil eder. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.

Video 2. İnsan EC'leri MSC İskelelerindeki İnsancıl Olmayan Gemilerin Oluşumuna Katılın. Insan EC'lerin 3D rekonstrüksiyonu (FITC-hCD31) Sculature (655-VPA) MSC + EC iskelelerinde. Her bir yığın 240 x 240 μm ölçülür. Bu videoyu izlemek için lütfen tıklayınız. (İndirmek için sağ tıklayın.)
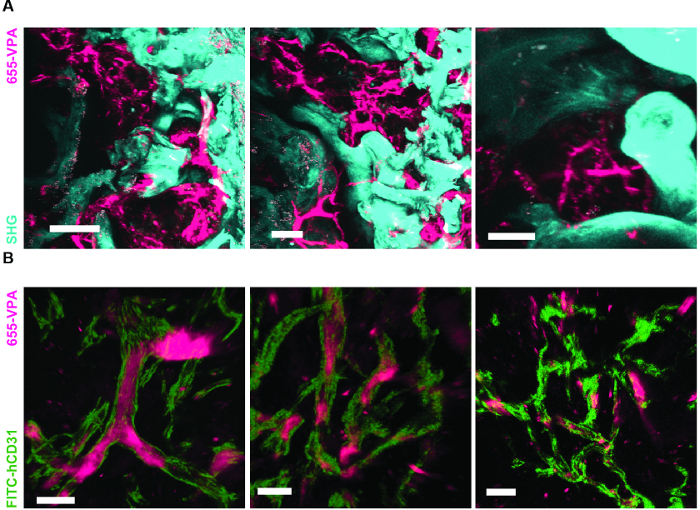
Şekil 6. rhBMP-2 Taşıyıcı İskele Şekillerinde Kemik İliği ve Kemik İliği Benzeri İnsanlaştırılmış Vaskülatür bulunur. A) Kemik yapılarının (SHG-camgöbeği) ve damar yapısının (655-VPA) oluşumunu gösteren MSC + BMP iskeletlerinin 3D rekonstrüksiyonu. Ölçek çubukları 100 μm (sol), 70 μm (orta) ve 50 μm (sağ) temsil eder. B) İnsan EC'leri (FITC-hCD31) ile kaplı olan hümanize damarları (655-VPA) gösteren MSC + EC + BMP iskeletlerinin 3D rekonstrüksiyonu. Ölçek çubukları 50 μm (sol) ve 30 μm (orta ve sağ) temsil eder.14 / 55914fig6large.jpg "target =" _ blank "> Bu figürde daha büyük bir versiyon görmek için lütfen tıklayınız.

Video 3. rhBMP-2 Taşıyıcı İskele Modelleri, Kemik İliği'ne benzer Kemik Yüzeyleri ve İnsanlaştırılmış Vaskülatüre sahiptir. MSC + VERA + BMP iskeletinin (kemik: SHG; damarlar: 655-VPA; insan EC'leri: FITC-hCD31) 3D rekonstrüksiyonu. Her bir yığın 600 x 600 μm ölçülür. Bu videoyu izlemek için lütfen tıklayınız. (İndirmek için sağ tıklayın.)
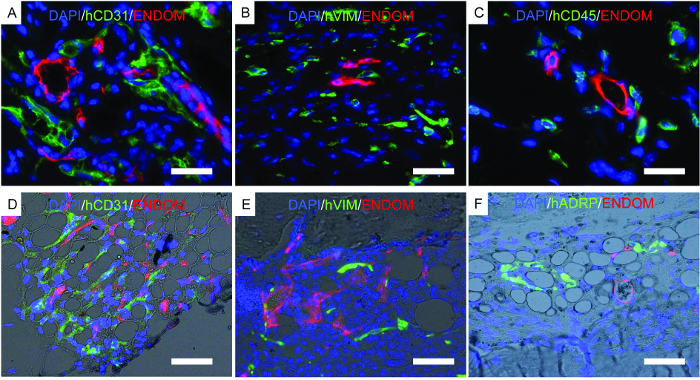
Şekil 7. Sabit İskele üzerinde gerçekleştirilen İmmünofloresansın Temsilci Görüntüleri. AF) İmplante edilen insan hücrelerini bulmak için yapılan immünofloresans çalışmalarıİskele. AC) HEC'ler, hMSC'ler ve hHSC'ler implante edilmiş iskeleler. DF) HEC'ler, hMSC'ler ve hHSC'ler implante edilen kemik oluşturucu iskeleler. Renk kanalları şu şekildedir: AD) insan EC (hCD31) ve fare vasküler yapısı (endomüsin, ENDOM), BE) hMSC'ler (hVimentin, hVIM) ve fare vasküler hücreleri (endomüsin, ENDOM), C) insan hematopoietik hücreleri (hCD45) Ve fare vaskülatürü (endomüsin, ENDOM) ve F) insan adipoz diferansiyasyona bağlı protein (hADRP) ve fare vaskülatürü (endomüsin, ENDOM). Ölçek çubukları 10 μm (A ve C), 20 μm (B ve E) ve 40 (D ve F) μm'dir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Tartışmalar
Mevcut Metotlara İlişkin Önem:
Bu protokolde, farelerde farklı hümanize mikro ortamlar üretmek ve iki foton mikroskopi ve histoloji yoluyla mimarilerini görselleştirmek için bir yöntem tarif ettik. Sağlanan temsili veriler, farklılaşan stromal hücreleri kullanarak insanlaştırılmış dokuları mühendisleştirmek için yaklaşımın fizibilitesini göstermektedir. Protokol, normal ve patolojik koşullardaki insan hematopoietik hücreleri ve kemik iliği niş kaynaklı hücrelerin incelenmesine spesifik uygulamalar içerir. Bu uygulamalar, klonal evrim, uyuşturucu tarama ve insan HSC'leri ile stromal bileşenler arasındaki çapraz geçiş çalışmasını içerir. Ortaya çıkan doku mühendisliği alanında birkaç alternatif yaklaşım önerilmiştir. Notların yaklaşımları 3D insanlaştırılmış BM yapılarının in vitro 55 , 56 , 57 ,S = "xref"> 58 , 59 , 60 , 61 , 62 , 63 ve farelerde 64 insanlaştırılmış BM iskeletlerinin ortotopik grefti. Yaklaşımımız in vivo sistemin hem karmaşıklığını hem insanlaştırılmış doku greftinin kolay anatomik erişilebilirliğiyle birleştirmenin avantajına sahiptir.
Değişiklikler ve Sorun Giderme:
Bu protokoldeki değişkenlik kaynağı, iskele tohumlamada kullanılan hücrelerin seçiminde bulunabilir. Çalışmamızda, BM kaynaklı hMSC kullandık. Bununla birlikte, mezenkimal hücreler, çeşitli dokulardan elde edilebilir, bu da orijine bağlı olarak ayırıcı özellikleri gösterebilir. Bu nedenle, farklı organlardan türetilen hMSC'lerin kullanımı düşünülebilir. Bununla birlikte, in vivo kemik dokusu oluşturma kabiliyeti, bu p'de kullanılmadan önce test edilmelidirBu protokol, piyasada bulunan bir insan endotel hücre kaynağı ( yani, E4ORF1 ile iletilen HUVEC) kullanır. Son zamanlarda, organa spesifik endotel hücrelerinin farklı amaçlarla kullanımı 65 , 66 bildirilmiştir. Dahası, BM'den türetilen birincil hEC'lerin kullanımı, protokolde ilginç bir gelişme sağlayabilir. Bu nedenle, endotel hücrelerinin farklı kaynaklarının kullanılması, in vivo sonuçların farklı olmasını sağlayabilir.
İnsancıllaştırılmış iskele implantasyonunu lehine ve doku reddetmesini önlemek için NSG bağışıklığı baskılanmış alıcı fareler kullandık. Bu protokolün, diğer fare türlerinde ektopik kemik iliği dokularına müdahale etme ihtimalini hariç tutmuyoruz. Nitekim, rhBMP-2, farklı memeli modellerinde 47 , 48 , 49 , 50'de kemik oluşumunu indükleyebilir , 52 . Bununla birlikte, hücre yaşayabilirliği ve uzun vadeli transplantasyonda farklılıklar muhtemelen farklı suşlar / modeller kullanılarak gözlemlenecektir.
İskele geri kazanımı zamanlaması, deneyin nihai amacına bağlı olarak da esnek olabilir. Sunulan protokolde, uzun vadeli hematopoietik engraftmanı değerlendirmek için implantasyondan 8 ila 12 hafta sonra örnekleri toparladık. İnsan BM niş oluşumunun erken aşamalarını ( örneğin osteokondral doku oluşumu 47 veya vasküler gelişim) incelemek için farklı zaman noktaları seçilebilir.
Bu protokolde tanımladığımız canlı görüntüleme tekniği, eksplantların kısa vadeli görüntülemesi için endikedir. Fizyolojik sıcaklık, oksijen basıncı ve CO 2 konsantrasyonunu muhafaza etmek için dengelenmiş bir odanın kullanılması motilite davranışlarını incelemek gibi uzun vadeli görüntülemelerde dikkate alınmalıdır.
Kritik StProtokol dahilinde eps:
Protokolle ilgili zorluklar arasında bazı adımlar için gerekli teknik becerileri vurguluyoruz. Mezenkimal ve endotel hücreleri, düşük hücre geçiş sayılarında kullanılmalıdır; aksi halde in vivo insan hematopoetik hücre engrafmanını desteklemek veya de novo damar sistemi ve in vivo kemik oluşumuna katılmak mümkün olmayacaktır. 1-3 arasındaki pasajlardaki hMSC'lerin ve hEC'lerin kullanılmasını öneriyoruz. İskele hazırlığı ve hücre ekimi adımları, temel hücre kültürü becerileri ve prosedürde kullanılan spesifik hücrelerin özelliklerini bilmeyi gerektirir. Ameliyat protokolü oldukça basittir fakat bazı uygulamalara ihtiyaç duyar. İmmün yetmez farelerde implante edilmiş iskele bulaşmalarını önlemek için bir aseptik ortamın bakımı, deneyin başarısını sağlamak için çok önemlidir. Eksplant ve canlı görüntüleme örnekleri (özellikle mikrodillinin kullanımı için) cerrahi uygulama gerektirir veMikroskop sistemi. Son olarak, numune işleme ve histoloji, kullanılacak teknikler hakkında temel bilgi gerektirir.
Tekniğin Sınırlamaları:
Tarif ettiğimiz yaklaşım, insana ait bir kemik iliği mikro çevresini tohumlayan canlı insan hematopoietik hücrelerinin, insan endotel hücrelerinin vasküler yapılar ve mezenkimal hücreler oluşturan kemik / kemik iliği alanı ile birlikte görselleştirilmesine izin verir. Doku in vivo olarak oluştuğundan, son mühendislik iskelesi hala kimerik (insan ve fare) olacaktır. Kimerik doku, insan kemik iliği karmaşıklığını ve ortamını tam olarak taklit edemediği için, bu husus dikkate alınmalıdır.
İmplante edilen iskele sınırlı bir boyuta sahiptir (maksimum 6.6 x 7.5 x 7 mm denedik) ve bu nedenle, xenotransplantasyon için sınırlı sayıda hücre barındırabilmektedir. Geri kazanılan hücrelerin mutlak sayısı da sınırlı olacaktır; Bu nedenle, yerleştirilen iskeletlerin sayısıDeney için gerekli hücre sayısının bir fonksiyonu olarak hesaplanmalıdır.
Tanımladığımız görüntüleme uygulaması, mimari bozulmadan ve hücrelere zarar vermeden yüzeyden 150-200 μm'lik derinliklerde canlı dokuların geniş alanlarını gözlemlemede özellikle yararlıdır. Bu nedenle, tüm iskele görselleştirme için izin vermiyor. Dokunun tam taranması gerekiyorsa, standart immünofloresans yaklaşımları daha uygun olurdu.
Gelecekteki Uygulamalar:
Bu biyomühendislik modelinin gelecekteki yönü, dokudaki insan bileşenlerinin karmaşıklığını arttırmak olacaktır. İnsan BM nişinin bilgi ve karakterizasyonu son yıllarda ilerlemiş 67 ve tarif edilen protokol, bu yeni hücresel bileşenlerin ve çözünür faktörlerin fonksiyonunu ve normal / malign destek rollerini incelemek için ilginç bir platform olabilirAnt HSC'leri.
Ayrıca, görüntüleme tekniği, uzunlamasına çalışmalarda iskeletlerin intravital görüntüleme potansiyeline sahiptir ve bu da ameliyat sonrası kurtarma ile canlı, anestezi uygulanmış farelerde iskele görüntülemede teknik iyileştirmeler gerektirecektir. Bu yaklaşım, ilave adımlar gerektirir ve şu anda laboratuarda soruşturma altındadır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Francis Crick Enstitüsünün (Biyolojik Araştırma tesisi, In Vivo Görüntüleme ve Deneysel Histopatoloji) çekirdek tesislerindeki personele ve Crick ve LRI'daki veterinerler olan Yolanda Saavedra-Torres ve Mercedes Sanchez-Garzon'a değerli yardımlarından dolayı teşekkür ediyoruz. El Yazması'nı eleştiren okumak için Dr. W. Grey'e minnettarız. DP, EHA'nın klinik dışı bir araştırma fakültesi tarafından desteklendi. Bu çalışma, temel finansmanını Cancer Research UK (FC001045), İngiltere Tıbbi Araştırma Konseyi (FC001045) ve Hoş Geldiniz Güven (FC001045) alan Francis Crick Enstitüsü tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ficoll-Paque | Ge Healthcare | 17-1440-03 | |
| Cd34 positive selection Kit | Stemcell | 18056 | Store a 4°C. |
| Magnet | Stemcell | 18000 | |
| Anti-human CD3 antibody, clone OKT-3 | Bioxcell | BE0001-2 | Store at 4°C. Used for T cell depletion in primary AML samples. |
| Cytokines (IL3, G-CSF, and TPO) | PeproTech | 200-03, 300-23 and 300-18 | For doing the stock: Dilute each one of the cytokines in 100 μL of water and mix them. Add 200 μL, do alicuots of 45 μL and Store at -20 °C. |
| DMSO | Sigma | D4540 | |
| FBS | Life technologies | 10270106 | Heat-inactivate at 56 °C during 30 min, do aliquots and freeze down. Warm in 37 °C water bath before use. |
| MEM-α | Invitrogen | 32571-028 | Store at 4 °C. Warm in 37 °C water bath before use. |
| Myelocult H5100 | corning | 5100 | Store at 4 °C. Warm in 37 °C water bath before use. |
| 199 | Gibco | 41150-020 | Store at 4 °C. Warm in 37 °C water bath before use. |
| hMSC-FBS, Heat-inactivated | Gibco | 12662-029 | Store at -20 °C. Warm in 37 °C water bath before use. |
| P/S | Sigma-Aldrich | P0781 | Store at -20 °C. Warm in 37 °C water bath before use. |
| ECGS | Millipore | 02-102 | Dilute in culture media and use 0.22 mm filter. |
| HEPES | Sigma-Aldrich | S1558-50ML | Store at 4 °C. |
| Heparin | Sigma-Aldrich | H3149 | Store at 4 °C. |
| Glutamine | Gibco | 25030 | Store at -20 °C. |
| Collagen 1 coated cell culture plate | corning | 354505 | |
| Trypsin-EDTA solution | Thermo-Fisher | 25200056 | Store at -20 °C. Warm in 37 °C water bath before use. |
| hMSC | Lonza | PT-2501 | Alternatively, hMSCs we also kindly provided by Dr. Dosquet (University Paris Diderot, Paris) from human bone marrow obtained during orthopaedic surgery under ethical approval 10-038 from IRB00006477. |
| VeraVec HUVEC endothelial cells | Angiocrine bioscience | hVera101 | Alternatively, other human endothelial cell source may be used. |
| Human hematopoietic cells | Umbilical Cord blood or primary Acute Myeloid Leukemia (AML) samples were obtained from the Royal London Hospital (London, UK) after informed consent and protocol of use was approved by the East London Ethical Committee and carried out in accordance with the Declaration of Helsinki. | ||
| Gelfoam, Size 12 - 7mm | Pfizer | 00009-0315-08 | Alternative supplier: Febelco |
| PBS | Thermo-Fisher | 10010023 | |
| Surgical material | Multiple | Sterile forceps, tweezers and sharp scissors. | |
| Sterile tissues | Heat-sterilize paper tissues. | ||
| 1 mL Syringe with needle of 25G | Terumo | SS+01H25161 | |
| Ultra Low Attachment Multiple Well Plates | Corning | 3473 or 3471 | |
| BMP2 | Noricum | rhBMP-2 | Dilute at 5 mg/mL in acetic acid 50 mM and store at 4 °C. |
| Thrombin | Sigma | T8885 | Dilute in CaCl2 2%, 500 mL per vial, and store at 4 °C. |
| Fibrinogen | Sigma | F3879 | Dilute at 4 mg/100 mL in PBS. Store at -20 °C. Warm before use. |
| Tissue-culture dishes 35 mm x 10 mm | Falcon | 353001 | |
| U-Botton 96 well plate | Falcon | 353077 | |
| NSG mice | The Jackson Laboratory | 5557 | NSG mice were a kind gift from Dr Leonard Shultz (The Jackson Laboratory). |
| Chlorhexidine | G9 | Dilute 1:10 before use | |
| Carprofen | Pfizer | Rimadyl | 5 mg/kg of mouse |
| Buprenorphine | Alstoe | Vetergesic | 0.1 mg/kg of mouse body weight |
| Isoflurane | Abbott | B506 | Induction of anaesthesia 2%, maintenance 1% |
| Trimmer | Wella | Contura HS61 | |
| Surgical glue | 3M | Vetbond | |
| carbomer (polyacrylic acid) as Ophthalmic gel | Novartis | Viscotears Liquid Gel | |
| Human Normal Immunoglobulin | Gammaplex | 10g vial | 100 mL/mouse intravenously, 30 min before infusion of specific antibody. |
| NT-QTracker | Invitrogen | Q21021MP | Vessel-pooling agent. Administrate 15 mL/mouse intravenously 5 min before imaging. |
| AF488-hCD45 | Biolegend | 304017 | 100 mL/mouse intravenously, 30 min before imaging. |
| FITC-hCD31 | BD Pharmigen | 555445 | 100 mL/mouse intravenously, 30 min before imaging. |
| Super glue | Loctite | Super Glue | |
| Micro-Drill Kit | IDEAL - Fisher Scientific | NC9010016 | |
| Microsurgical microscope | No specific brand/company is adviced. | ||
| LSM 710 NLO | Zeiss | Upright confocal microscope with motorized stage, two-photon laser and 20X 1.0 NA water immersion lens. Alternatively, a microscope with similar specifications could be used. | |
| MaiTai “High Performance” fully automated 1-box 517 mode-locked Ti:Sapphire laser with DeepSee dispersion compensation | Spectra-Physics | ||
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | |
| Ethanol | Sigma-Aldrich | 32294 | |
| Osteosoft | Millipore | 1.01728.1000 | |
| Polysine slices | Thermo scientific | J2800AMNZ | |
| Antigen unmasking solution | Vector | H-3300 | Store at 4 °C. Dilute 1:100 in H2O for working solution. |
| Triton 100x | Sigma-Aldrich | T9284 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A96470 | Store at 4 °C. |
| Normal Goat serum (NGS) | Sigma-Aldrich | G9023 | Store at 4 °C. |
| Endomucin Antibody | Santa Cruz | sc-65495 | Store at 4 °C. |
| hVimentin antibody | Santa Cruz | sc-6260 | Store at 4 °C. |
| hCD31 antibody | DAKO | M0823 | Store at 4 °C. |
| hCD45 antibody | DAKO | M0701 | Store at 4 °C. |
| ADRP (Perilipin2) | antibodies-online | ABIN283918 | Store at 4 °C. |
| Goat anti mouse secondary antibodies | Invitrogen | A11029 or A11005 | Store at 4 °C. |
| Goat anti Rabbit secondary antibodies | Invitrogen | A11037 or A11008 | Store at 4 °C. |
| Goat anti Rat secondary antibodies | Invitrogen | A11007 or A21247 | Store at 4 °C. |
| Sudan Black | Sigma | S2380 | Prepare a stock of 1% sudan black in ethanol 70%. Store at RT. Prepare working solution of 0.1% sudan black in ethanol 70% and filter using filter-paper before use. |
| DAPI | Sigma | D8417 | Prepare stock in H20 at 100 mg/mg. Store at 4 °C. |
| Fluorescent mounting media | Dako | S3023 | Add DAPI before use (1:400 from DAPI stock). |
| Cover glass | VWR | 631-0147 |
Referanslar
- Hoggatt, J., Kfoury, Y., Scadden, D. T. Hematopoietic Stem Cell Niche in Health and Disease. Annu Rev Pathol. 11, 555-581 (2016).
- Hanoun, M., et al. Acute myelogenous leukemia-induced sympathetic neuropathy promotes malignancy in an altered hematopoietic stem cell niche. Cell Stem Cell. 15 (3), 365-375 (2014).
- Frisch, B. J., et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 119 (2), 540-550 (2012).
- Zhang, B., et al. Altered microenvironmental regulation of leukemic and normal stem cells in chronic myelogenous leukemia. Cancer Cell. 21 (4), 577-592 (2012).
- Schepers, K., et al. Myeloproliferative neoplasia remodels the endosteal bone marrow niche into a self-reinforcing leukemic niche. Cell Stem Cell. 13 (3), 285-299 (2013).
- Krause, D. S., et al. Differential regulation of myeloid leukemias by the bone marrow microenvironment. Nat Med. 19 (11), 1513-1517 (2013).
- Mendez-Ferrer, S., Scadden, D. T., Sanchez-Aguilera, A. Bone marrow stem cells: current and emerging concepts. Ann N Y Acad Sci. 1335, 32-44 (2015).
- Boulais, P. E., Frenette, P. S. Making sense of hematopoietic stem cell niches. Blood. 125 (17), 2621-2629 (2015).
- Ding, L., Morrison, S. J. Haematopoietic stem cells and early lymphoid progenitors occupy distinct bone marrow niches. Nature. 495 (7440), 231-235 (2013).
- Kunisaki, Y., et al. Arteriolar niches maintain haematopoietic stem cell quiescence. Nature. 502 (7473), 637-643 (2013).
- Pinho, S., et al. PDGFRalpha and CD51 mark human nestin+ sphere-forming mesenchymal stem cells capable of hematopoietic progenitor cell expansion. J Exp Med. 210 (7), 1351-1367 (2013).
- Mizoguchi, T., et al. Osterix marks distinct waves of primitive and definitive stromal progenitors during bone marrow development. Dev Cell. 29 (3), 340-349 (2014).
- Zhou, P., Wang, Y., Li, D., Hu, S. Y., Chen, G. H. Therapeutic efficacy of mixed hematopoietic stem cell transplantation for pediatric hematologic diseases. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 22 (2), 434-439 (2014).
- Sugiyama, T., Kohara, H., Noda, M., Nagasawa, T. Maintenance of the hematopoietic stem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niches. Immunity. 25 (6), 977-988 (2006).
- Tzeng, Y. S., et al. Loss of Cxcl12/Sdf-1 in adult mice decreases the quiescent state of hematopoietic stem/progenitor cells and alters the pattern of hematopoietic regeneration after myelosuppression. Blood. 117 (2), 429-439 (2011).
- Pearce, D. J., et al. AML engraftment in the NOD/SCID assay reflects the outcome of AML: implications for our understanding of the heterogeneity of AML. Blood. 107 (3), 1166-1173 (2006).
- Sanchez, P. V., et al. A robust xenotransplantation model for acute myeloid leukemia. Leukemia. 23 (11), 2109-2117 (2009).
- Uzan, B., et al. Interleukin-18 produced by bone marrow-derived stromal cells supports T-cell acute leukaemia progression. EMBO Mol Med. 6 (6), 821-834 (2014).
- Foster, K., et al. Different Motile Behaviors of Human Hematopoietic Stem versus Progenitor Cells at the Osteoblastic Niche. Stem Cell Reports. 5 (5), 690-701 (2015).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Holzapfel, B. M., Wagner, F., Thibaudeau, L., Levesque, J. P., Hutmacher, D. W. Concise review: humanized models of tumor immunology in the 21st century: convergence of cancer research and tissue engineering. Stem Cells. 33 (6), 1696-1704 (2015).
- Scotti, C., et al. Engineering of a functional bone organ through endochondral ossification. Proc Natl Acad Sci USA. 110 (10), 3997-4002 (2013).
- Scotti, C., et al. Recapitulation of endochondral bone formation using human adult mesenchymal stem cells as a paradigm for developmental engineering. Proc Natl Acad Sci USA. 107 (16), 7251-7256 (2010).
- Kuznetsov, S. A., et al. Single-colony derived strains of human marrow stromal fibroblasts form bone after transplantation in vivo. J Bone Miner Res. 12 (9), 1335-1347 (1997).
- Bianco, P., Robey, P. G. Skeletal stem cells. Development. 142 (6), 1023-1027 (2015).
- Vaiselbuh, S. R., Edelman, M., Lipton, J. M., Liu, J. M. Ectopic human mesenchymal stem cell-coated scaffolds in NOD/SCID mice: an in vivo model of the leukemia niche. Tissue Eng Part C Methods. 16 (6), 1523-1531 (2010).
- Groen, R. W., et al. Reconstructing the human hematopoietic niche in immunodeficient mice: opportunities for studying primary multiple myeloma. Blood. 120 (3), e9-e16 (2012).
- Chen, Y., et al. Human extramedullary bone marrow in mice: a novel in vivo model of genetically controlled hematopoietic microenvironment. Blood. 119 (21), 4971-4980 (2012).
- Reinisch, A., et al. A humanized bone marrow ossicle xenotransplantation model enables improved engraftment of healthy and leukemic human hematopoietic cells. Nat Med. 22 (7), 812-821 (2016).
- Sontakke, P., et al. Modeling BCR-ABL and MLL-AF9 leukemia in a human bone marrow-like scaffold-based xenograft model. Leukemia. 30 (10), 2064-2073 (2016).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Antonelli, A., et al. Establishing human leukemia xenograft mouse models by implanting human bone marrow-like scaffold-based niches. Blood. 128 (25), 2949-2959 (2016).
- Holzapfel, B. M., et al. Tissue engineered humanized bone supports human hematopoiesis in vivo. Biomaterials. 61, 103-114 (2015).
- Reinisch, A., et al. Epigenetic and in vivo comparison of diverse MSC sources reveals an endochondral signature for human hematopoietic niche formation. Blood. 125 (2), 249-260 (2015).
- Lee, J., et al. Implantable microenvironments to attract hematopoietic stem/cancer cells. Proc Natl Acad Sci USA. 109 (48), 19638-19643 (2012).
- Lee, J., Heckl, D., Parekkadan, B. Multiple genetically engineered humanized microenvironments in a single mouse. Biomater Res. 20 (19), 1-13 (2016).
- Ho, M. S., Medcalf, R. L., Livesey, S. A., Traianedes, K. The dynamics of adult haematopoiesis in the bone and bone marrow environment. Br J Haematol. 170 (4), 472-486 (2015).
- Bersani, F., et al. Bioengineered implantable scaffolds as a tool to study stromal-derived factors in metastatic cancer models. Cancer Res. 74 (24), 7229-7238 (2014).
- Thibaudeau, L., et al. Mimicking breast cancer-induced bone metastasis in vivo: current transplantation models and advanced humanized strategies. Cancer Metastasis Rev. 33 (2-3), 721-735 (2014).
- Holzapfel, B. M., et al. Species-specific homing mechanisms of human prostate cancer metastasis in tissue engineered bone. Biomaterials. 35 (13), 4108-4115 (2014).
- Thibaudeau, L., Holzapfel, B. M., Hutmacher, D. W. Humanized mice models for primary bone tumor and bone metastasis research. Cell Cycle. 14 (14), 2191-2192 (2015).
- Thibaudeau, L., et al. A tissue-engineered humanized xenograft model of human breast cancer metastasis to bone. Dis Model Mech. 7 (2), 299-309 (2014).
- Abarrategi, A., Foster, K., Hamilton, A., Mian, S., Passaro, D., Gribben, J., Mufti, G., Bonnet, D. Versatile humanized niche model enables study of normal and malignant human hematopoiesis. J Clin Invest. 127 (2), (2017).
- Abarrategi, A., et al. In vivo ectopic implantation model to assess human mesenchymal progenitor cell potential. Stem Cell Rev. 9 (6), 833-846 (2013).
- Rubio, R., et al. Bone environment is essential for osteosarcoma development from transformed mesenchymal stem cells. Stem Cells. 32 (5), 1136-1148 (2014).
- Abarrategi, A., et al. Multiwall carbon nanotube scaffolds for tissue engineering purposes. Biomaterials. 29 (1), 94-102 (2008).
- Abarrategi, A., et al. Gene expression profile on chitosan/rhBMP-2 films: A novel osteoinductive coating for implantable materials. Acta Biomater. 5 (7), 2633-2646 (2009).
- Abarrategi, A., et al. Biological properties of solid free form designed ceramic scaffolds with BMP-2: in vitro and in vivo evaluation. PLoS One. 7 (3), e34117 (2012).
- Abarrategi, A., et al. Chitosan scaffolds for osteochondral tissue regeneration. J Biomed Mater Res A. 95 (4), 1132-1141 (2010).
- Abarrategi, A., et al. Improvement of porous beta-TCP scaffolds with rhBMP-2 chitosan carrier film for bone tissue application. Tissue Eng Part A. 14 (8), 1305-1319 (2008).
- Prasain, N., Meador, J. L., Yoder, M. C. Phenotypic and functional characterization of endothelial colony forming cells derived from human umbilical cord blood. J Vis Exp. (62), (2012).
- JoVE Science Education Database. General Laboratory Techniques. Histological Sample Preparation for Light Microscopy. J Vis Exp. , (2016).
- Hong, J. K., Yun, J., Kim, H., Kwon, S. Three-dimensional culture of mesenchymal stem cells. Tissue Eng Regen Med. 12 (4), 211-221 (2015).
- Bara, J. J., et al. Three-dimensional culture and characterization of mononuclear cells from human bone marrow. Cytotherapy. 17 (4), 458-472 (2015).
- Dong, H. W., Qin, S., Rafailovich, M., Ma, Y. Developing an Optimal Biofunctional Scaffold for Hematopoietic Stem Cell Quiescent Maintenance and Expansion. N Am J Med Sci. 8 (2), (2015).
- Raic, A., Rodling, L., Kalbacher, H., Lee-Thedieck, C. Biomimetic macroporous PEG hydrogels as 3D scaffolds for the multiplication of human hematopoietic stem and progenitor cells. Biomaterials. 35 (3), 929-940 (2014).
- Miyoshi, H., Morita, M., Ohshima, N., Sato, C. Expansion of mouse hematopoietic progenitor cells in three-dimensional cocultures on frozen-thawed stromal cell layers formed within porous scaffolds. Exp Hematol. 43 (2), 115-124 (2015).
- Cuddihy, M. J., Wang, Y., Machi, C., Bahng, J. H., Kotov, N. A. Replication of bone marrow differentiation niche: comparative evaluation of different three-dimensional matrices. Small. 9 (7), 1008-1015 (2013).
- Sharma, M. B., Limaye, L. S., Kale, V. P. Mimicking the functional hematopoietic stem cell niche in vitro: recapitulation of marrow physiology by hydrogel-based three-dimensional cultures of mesenchymal stromal cells. Haematologica. 97 (5), 651-660 (2012).
- Leisten, I., et al. 3D co-culture of hematopoietic stem and progenitor cells and mesenchymal stem cells in collagen scaffolds as a model of the hematopoietic niche. Biomaterials. 33 (6), 1736-1747 (2012).
- Ferreira, M. S., et al. Cord blood-hematopoietic stem cell expansion in 3D fibrin scaffolds with stromal support. Biomaterials. 33 (29), 6987-6997 (2012).
- Baldwin, J. G., et al. Periosteum tissue engineering in an orthotopic in vivo platform. Biomaterials. 121, 193-204 (2017).
- Rafii, S., Butler, J. M., Ding, B. S. Angiocrine functions of organ-specific endothelial cells. Nature. 529 (7586), 316-325 (2016).
- Seandel, M., et al. Generation of a functional and durable vascular niche by the adenoviral E4ORF1 gene. Proc Natl Acad Sci USA. 105 (49), 19288-19293 (2008).
- Medyouf, H. The microenvironment in human myeloid malignancies: emerging concepts and therapeutic implications. Blood. 129 (12), 1617-1626 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır